Меню сайта | Шиманович И.Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И.Л. Шиманович. – 3-е изд., испр. – М.: Высш. шк., 2003. – 128 с.
Задачи 161-180 161. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296 °С. Температура кристаллизации бензола 5,5 °С. Криоскопическая константа 5,1. Вычислите мольную массу растворенного вещества. Решение 162. Вычислите процентную концентрацию водного раствора сахара С12Н22О11, зная, что температура кристаллизации раствора -0,93 °С. Криоскопическая константа воды 1,86. Решение с ключом 163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. 164. Раствор, содержащий 3,04 г камфоры C10H16O в 100 г бензола, кипит при 80,714 °С. Температура кипения бензола 80,2 °С. Вычислите эбуллиоскопическую константу бензола. Решение с ключом 165. Вычислите процентную концентрацию водного раствора глицерина C3H5(ОН)3, зная, что этот раствор кипит при 100,39 °С. Эбуллиоскопическая константа воды 0,52. Решение с ключом 166. Вычислите мольную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,279 °С. Криоскопическая константа воды 1,86. Решение 167. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2 °С. Эбуллиоскопическая константа его 2,57. Решение с ключом 168. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при –0,465 °С. Вычислите мольную массу растворенного вещества. 169. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718 °С. Температура кристаллизации уксусной кислоты 16,65 °С. Решение с ключом 170. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81°. Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая константа бензола 2,57. Решение с ключом 171. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна –0,558 °С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86. Решение с ключом 172. Какую массу анилина C6H5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°. Эбуллиоскопическая константа этилового эфира 2,12. 173. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта C2H5OH. Криоскопическая константа воды 1,86. Решение с ключом 174. Сколько граммов мочевины (NH2)2СО следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465°? Криоскопическая константа воды 1,86. Решение 175. Вычислите процентную концентрацию водного раствора глюкозы C6H12O6, зная, что этот раствор кипит при 100,26 °С. Эбуллиоскопическая константа воды 0,52. Решение с ключом 176. Сколько граммов фенола C6H5OH следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7°? Криоскопическая константа бензола 5,1. Решение 177. Сколько граммов мочевины (NН2)2СО следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26°? Эбуллиоскопическая константа воды 0,52. 178. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372°. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86. Решение 179. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбуллиоскопическая константа воды 0,52. Решение с ключом 180. Вычислите процентную концентрацию водного раствора метанола СН3ОН, температура кристаллизации которого –2,79 °С. Криоскопическая константа воды 1,86. Решение с ключом | Новые файлы Статистика Онлайн всего: 2 Гостей: 2 Пользователей: 0 |
Тема №10. Коллигативные свойства растворов. Основные понятия и определения
1-й | — рА= |
2-й | — Ткип= КэСm |
Уравнение | — = |
Изотонический | — |
Так, в соответствии
со вторым законом Рауля: повышение
температуры кипения или понижение
температуры замерзания разбавленных
растворов неэлектролитов пропорционально
числу частиц растворенного вещества и
не зависит от его природы:
Δtзам. =
=
К·Сm, Δtкип.
= Е·Сm,
где Δt– понижение температуры замерзания
или повышение температуры кипения
раствора, ˚С;
К и Е – криоскопическая
и эбулиоскопическая константы
соответственно;
Сm– моляльная концентрация растворенного
вещества, моль/кг.
Таким образом,
указанные формулы позволяют определить
температуры кипения и замерзания
растворов неэлектролитов по их
концентрации, а также находить мольную
массу растворенного вещества по понижению
температуры кипения или замерзания
растворов.
Пример 1. Определите температуру замерзания раствора, содержащего 54 г глюкозы с6н12о6 в 250 г воды. Криоскопическая константа воды равна 1,86.
Решение.
В 250 г воды содержится 54 г глюкозы,
следовательно, в 1000 г ее содержание
составит: 54·1000/250=216 г, что составляет
216/180, или 1,2 моля, так как мольная масса
глюкозы равна 180 г/моль. Вычислим понижение
Вычислим понижение
температуры замерзания:
Δtзам.
= К·Сm= 1,86·1,2 =
2,23.
Таким образом,
раствор будет замерзать при температуре
–2,23 С.
Контрольные задания.
2-й закон Рауля
На сколько градусов
повысится температура кипения воды,
если в 100 г воды растворить 9 г глюкозы
С6Н12О6?8 г глюкозы
растворили в 180 мл воды. При какой
температуре замерзнет такой раствор?При растворении
0,4 г некоторого вещества в 10 г воды
температура кристаллизации раствора
понижается на 1,240.
Вычислить молекулярную массу растворенного
вещества.В каком количестве
воды следует растворить 0,5 кг глицерина
С3Н8О3
для получения раствора с температурой
кристаллизации – 30С?Вычислите
процентную концентрацию водного
раствора метанола СН3ОН,
температура кристаллизации которого
-2,79 °С. Криоскопическая константа воды
Криоскопическая константа воды
1,86°.При
какой приблизительно температуре будет
кипеть 50 %-ный водный раствор С12Н22О11,
если эбуллиоскопическая константа
воды равна 0,52°?Раствор,
содержащий 3,04 г камфары С10Н16О
в 100 г бензола, кипит при +80,714 °С.
Температура кипения бензола +80,2 °С.
Вычислите эбуллиоскопическую константу
бензола.Температура
кристаллизации раствора, содержащего
66,3 г некоторого электролита в 500 мл
воды, равна -0,558°С. Вычислите мольную
массу растворенного вещества, если
криоскопическая константа воды равна
1,86°.Вычислите
криоскопическую константу уксусной
кислоты, зная, что раствор, содержащий
4,25 г антрацена С4Н10
в 100 г уксусной кислоты, кристаллизуется
при температуре -15,718 °С. Температура
кристаллизации уксусной кислоты + 0,65
°С.
Раствор,
содержащий 2,7 г фенола С6Н5ОН
в 75 г бензола, замерзает при +3,5°, тогда
как чистый бензол замерзает при 5,5°.
Вычислите криоскопическую константу
бензола.В
каком количестве воды (эбуллиоскопическая
константа Н2О
равна 0,52°) следует растворить 23 г
глицерина С3Н8О3,
чтобы получить раствор с температурой
кипения 100,104°?При
какой приблизительно температуре будет
кристаллизоваться 40 %-ный раствор
этилового спирта С2Н5ОН,
если криоскопическая константа воды
равна 1,86°?Сколько
граммов сахарозы C12H22O11
надо растворить в 100 г воды, чтобы:
а)
понизить ее температуру замерзания на
1°; б) повысить температуру кипения на
1°?
Вычислите
мольную массу неэлектролита, зная, что
раствор, содержащий 2,25 г этого вещества
в 250 г Н2О,
кристаллизуется при температуре -0,279
°С. Криоскопическая константа воды
Криоскопическая константа воды
равна 1,86°.Вычислите
температуру кипения 15%-го водного
раствора пропилового спирта С3Н7ОН.
Эбуллиоскопическая константа воды
равна 0,52º.Температура
кипения ацетона 56,1ºС, а его эбуллиоскопическая
константа равна 1,73. Вычислить температуру
кипения 8%-го раствора глицерина С3Н6О3
в ацетоне.Вычислите
температуру кристаллизации 2%-го раствора
этилового спирта С2Н5ОН.
Криоскопическая константа воды 1,86º.При
растворении 4,86г серы в 60г бензола
температура кипения его повысилась на
0,81º. Сколько атомов содержит молекула
серы в этом растворе? Эбуллиоскопическая
константа бензола равна 2,57º.Определите
температуру замерзания раствора,
содержащего мочевину (NН2)2СО
массой 0,625г в воде массой 50г. Криоскопическая
Криоскопическая
константа воды равна 1,86ºСколько
граммов мочевины (NН2)2СО
следует растворить в 75г воды, чтобы
температура кристаллизации получилась
0,456? Криоскопическая константа воды
1,86º
1- й Закон Рауля.
Уравнение Вант – Гоффа.
При 200
С осмотическом давление
осм
водного раствора некоторого электролита
равно 4,38*105Па.
Чему равноосм
если раствор разбавить в три раза, а
температуру повысить до 400С?Осмотическое
давление раствора, в 250 мл которого
содержится 2,3 г растворенного
неэлектролита, при 270С
равно 249 кПа. Вычислите молярную массу
растворенного вещества.Чему равна масса
этилового спирта, содержащегося в 1 л
раствора, если этот раствор при 200
С изотоничен раствору анилинаC6H5NH2
, в 4 л которого содержится 18,6 г анилина?Как изменится
осмотическое давление раствора
неэлектрлита концентрации 0,5 моль/л
при его нагревании от 250С
до 750С?Будет ли изотоничены
водные растворы глюкозы и этилового
спирта, если их массовые доли составляют
15% для глюкозы и 5 для спирта?Какова масса
растворенного в 1,5 л раствора анилина
C6H5NH2
, если осматическое давление такого
раствора при 170С
равно 193кПа?Рассчитайте
осм
при 200С:
а) сахарозы С12Н22О11;
б) глюкозы в С6Н12О6
; в)этилового
спирта С2Н5ОН,
содержащих по 72 г соответствующего
вещества в 1 л раствора. В каком случае
В каком случае
осмотическое давление будет наибольшим?Найдите молярную
массу неэлектролита, если при растворении
28 г вещества при 270С
осмотическое давление составило 700
кПа.При 315 К давлении
насыщенного пара над водой равно 82
кПа. Насколько понизится давление
насыщенного водяного пара при указанной
температуре, если в 540 г воды растворить
36 г глюкозы С6Н12О6
?Чему равно
осмотическое давление такого раствора,
если р=1,01 г/см3?Рассчитайте
давление насыщенного пара бензолом
над раствором нафталинаС10Н8
в бензоле при 400С,
если в 400 г раствора содержится 128 г
нафталина, а давление насыщенного пара
чистого бензола при указанной температуре
равно 24144,6 Па.Определите
осмотическое давление раствора сахарозы
при 00С,
если при 200С
осмотическое давление этого раствора
равно 1,066*105Па.
Химия зимой | Мнение
Грузовики, разбрасывающие соль и песок или песок для увеличения трения, были обычным явлением в Великобритании этой зимой. Для понижения точки замерзания воды разбрасывают соль в концентрации 10-15 г·м -2 на сухой дороге, а на мокрой или покрытой снегом дороге чаще 20-40 г·м — 2 . Так зачем же соль и есть ли альтернативы?
Криоскопические константы
Раствор замерзает при более низкой температуре, чем чистый растворитель, фактическая температура зависит от количества растворенного вещества. Криоскопическая постоянная воды равна 1,86 К моль 9.0003 -1 кг -1 , т.е. один моль любого вещества, растворенного в 1 кг воды, понизит температуру замерзания на 1,86°C. Строго говоря, это верно только для разбавленных растворов, но в качестве приближения один моль мочевины, CO(NH 2 ) 2 , 60 г, в одном кг воды понизит температуру замерзания воды на 1,86°C.
Однако почти такая же масса (58,5 г) хлорида натрия, NaCl, дает почти двойное снижение температуры замерзания, потому что 58,5 г дают два моля ионов, по одному на каждый из Na + и кл — . Соединения, которые содержат еще больше ионов на моль, , например, CaCl 2 или Na 2 SO 4 , дадут больший эффект, но вам придется использовать большую массу этих соединений, чтобы получить один моль каждого из из них — 111 г для первого и 142 г для второго.
Назад на дорогу
Поверхность дороги, покрытая 10-процентным раствором хлорида натрия, не замерзнет до тех пор, пока температура не достигнет -6°C, но для того, чтобы быть эффективной, соль должна раствориться. Это нормально, если дорога мокрая — из-за соли будет труднее замерзнуть, — но если поверхность уже замерзла? Часто поверхностной воды на льду мало, а хлорид натрия гигроскопичен — поглощает воду из атмосферы. Хлорид кальция настолько гигроскопичен, что образует раствор с поглощаемой им водой (расплывается). В результате хлорид кальция является более быстродействующим и довольно часто используется в США, иногда в смеси трех частей NaCl на одну часть CaCl9.0017 2 . Однако хлорид кальция неэффективен в очень холодных условиях, потому что недостаточно поверхностной воды для растворения соли. В таких случаях в США часто используют хлорид магния.
В результате хлорид кальция является более быстродействующим и довольно часто используется в США, иногда в смеси трех частей NaCl на одну часть CaCl9.0017 2 . Однако хлорид кальция неэффективен в очень холодных условиях, потому что недостаточно поверхностной воды для растворения соли. В таких случаях в США часто используют хлорид магния.
Другим важным фактором при разбрасывании соли на дороге является размер частиц. Маленькие крупинки соли имеют большую площадь поверхности и быстро растворяются, но могут быть унесены ветром или движущимися транспортными средствами. Чтобы противодействовать этому, некоторые местные власти в Великобритании экспериментировали, добавляя патоку в соль. Предполагая, что патока представляет собой нечистую сахарозу, C 12 H 22 O 11 , 10-процентный (по весу) раствор окажет незначительное влияние на температуру замерзания, но теория состоит в том, что многие группы -ОН образуют водородные связи с водой на соли. или дорожных покрытий и предотвратить сдувание соли.
или дорожных покрытий и предотвратить сдувание соли.
Однако соль на дорогах приносит свои проблемы. Например, ионы хлора разъедают транспортные средства и мосты. В США этого избегают, используя как мочевину, так и двойную соль, этаноат магния кальция (ацетат), Ca 3 — 4Mg 7-6 (CH 3 CO 2 ) 20 . Относительная молярная масса равна 1478, но на моль соединения приходится 30 молей ионов, поэтому 10-процентный (весовой) раствор замерзнет при -4°C, тогда как 10-процентный (весовой) раствор только мочевина замерзнет при температуре около -3°C.
Простой эксперимент
Чтобы исследовать соль и ее альтернативы, поместите воронки поверх двух мерных цилиндров. Наполните каждую воронку кусочками льда. Добавьте соль в одну из воронок. Мерный цилиндр под соленым льдом заполняется гораздо быстрее, чем другой. Вы также можете поместить термометры (или датчики температуры) в лед и собранную воду и исследовать влияние изменения количества используемой соли или альтернативных растворов, таких как ионный хлорид кальция или сульфат натрия и молекулярный сахар или мочевина.
16.13: Депрессия точки замерзания — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53861
Коллигативные свойства имеют практическое применение, например, для засолки дорог в холодном климате. Посыпая обледенелую дорогу солью, можно снизить температуру плавления льда, и лед будет таять быстрее, что сделает вождение более безопасным. Хлорид натрия \(\left( \ce{NaCl} \right)\) и либо хлорид кальция \(\left( \ce{CaCl_2} \right)\), либо хлорид магния \(\left( \ce{MgCl_2} \право)\) используются чаще всего по отдельности или в смеси. Хлорид натрия является наименее дорогим вариантом, но он менее эффективен, поскольку диссоциирует только на два иона вместо трех.
Понижение точки замерзания
На рисунке ниже показана фазовая диаграмма чистого растворителя и ее изменение при добавлении к нему растворенного вещества. Растворенное вещество снижает давление паров растворителя, что приводит к снижению точки замерзания раствора по сравнению с растворителем. Понижение точки замерзания представляет собой разницу температур между температурой замерзания чистого растворителя и температуры замерзания раствора. На графике депрессия точки замерзания представлена \(\Delta T_f\).
Рисунок \(\PageIndex{1}\): Давление паров раствора (синее) ниже, чем давление паров чистого растворителя (розовое). В результате температура замерзания растворителя ниже, когда в нем растворено любое растворенное вещество.
Когда чистый растворитель замерзает, его частицы становятся более упорядоченными, так как межмолекулярные силы, действующие между молекулами, становятся постоянными. В случае воды водородные связи образуют сеть молекул гексагональной формы, которая характеризует структуру льда. \text{o} \text{C} \right)\) 9\text{o} \text{C}/\textit{m} \right)\)
\text{o} \text{C} \right)\) 9\text{o} \text{C}/\textit{m} \right)\)
Пример \(\PageIndex{1}\)
Этиленгликоль \(\left( \ce{C_2H_6O_2} \right)\) — это молекулярное соединение, которое используется во многих коммерческих антифризах. Водный раствор этиленгликоля используется в автомобильных радиаторах для снижения температуры замерзания и, таким образом, предотвращения замерзания воды в радиаторе. Рассчитайте температуру замерзания раствора \(400 \: \text{г}\) этиленгликоля в \(500 \: \text{г}\) воды. 9\text{o} \text{C}/\textit{m}\)
Водный раствор этиленгликоля используется в автомобильных радиаторах для снижения температуры замерзания и, таким образом, предотвращения замерзания воды в радиаторе. Рассчитайте температуру замерзания раствора \(400 \: \text{г}\) этиленгликоля в \(500 \: \text{г}\) воды. 9\text{o} \text{C}/\textit{m}\)
Неизвестно
Это трехшаговая задача. Сначала рассчитайте количество молей этиленгликоля. Затем рассчитайте моляльность раствора. Наконец, рассчитайте депрессию точки замерзания.
Шаг 2: Решить.
\[\begin{align*} 400. \: \text{g} \: \ce{C_2H_6O_2} \times \frac{1 \: \text{mol} \: \ce{C_2H_6O_2}}{62.08 \: \text{g} \: \ce{C_2H_6O_2}} &= 6,44 \: \text{моль} \: \ce{C_2H_6O_2} \\ \frac{6,44 \: \text{моль} \: \ce{ C_2H_6O_2}}{0,500 \: \text{кг} \: \ce{H_2O}} &= 12,9\text{o} \text{C}\).
Шаг 3: Подумайте о своем результате.
Точка замерзания воды значительно снижается, защищая радиатор от повреждений из-за расширения воды при замерзании.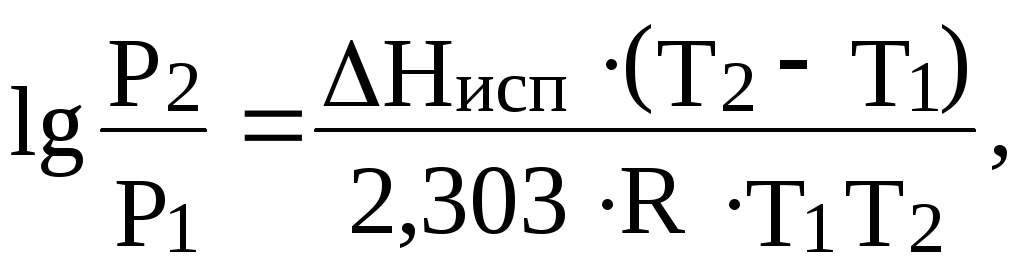

 Криоскопическая константа воды 1,86. Решение
Криоскопическая константа воды 1,86. Решение Криоскопическая константа воды 1,86. Решение с ключом
Криоскопическая константа воды 1,86. Решение с ключом Решение
Решение Решение
Решение
 Криоскопическая константа воды
Криоскопическая константа воды
 Криоскопическая константа воды
Криоскопическая константа воды Криоскопическая
Криоскопическая В каком случае
В каком случае