Содержание
14.Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
Автопротолиз
– обратимый процесс образования равного
числа катионов и анионов из незаряженных
молекул жидкого индивидуального вещества
за счет передачи протона от одной
молекулы к другой.
h3O
+ h3O= h4O+
+ OH–
Это
равновесие называется равновесием
автопротолиза воды.
Константа
автопротолиза
для воды обычно называется ионным
произведением воды и обозначается как
Kw. Ионное произведение численно равно
произведению равновесных концентраций
ионов гидроксония и гидроксид-анионов.
Обычно используется упрощенная запись:
При
стандартных условиях ионное произведение
воды равно 10-14.
Оно является постоянной не только для
чистой воды, но также и для разбавленных
водных растворов веществ. Автопротолиз
воды объясняет, почему чистая вода, хоть
и плохо, но всё же проводит электрический
ток.
pH
— это водородный показатель—
мера активности (в случае разбавленных
растворов отражает концентрацию) ионов
водорода в растворе, количественно
выражающая его кислотность, вычисляется
как отрицательный (взятый с обратным
знаком) десятичный логарифм концентрации
водородных ионов, выраженной в молях
на литр:
pH
= -log[H+].
Т.е.
рН определяется количественным
соотношением в воде ионов Н+ и ОН-,
образующихся при диссоциации воды.
(Моль — единица измерения количества
вещества.)
Если
в воде пониженное содержание свободных
ионов водорода [H+] (рН > 7) по сравнению
с ионами гидроксида [ОН-], то вода будет
иметь щелочную реакцию, а при повышенном
содержании ионов Н+ (рН < 7) — кислую. В
идеально чистой дистиллированной воде
эти ионы будут уравновешивать друг
друга и в нейтральной воде рН=7. При
растворении в воде различных химических
веществ этот баланс может быть нарушен,
что приводит к изменению значения рН.
Когда
концентрации обоих видов ионов в растворе
одинаковы, говорят, что раствор имеет
нейтральную реакцию.
для
сильной кислоты:
pH
= -log[H+]
для
слабой кислоты:
pH
= ½ (рКа –
lgСкисл)
или
pH
= ½ (-lgKкисл
– lgСкисл)
для
сильного основания:
pH
= 14- pOH;
(pOH=-lg[OH];
[OH]=Cоснования;
C=
m
/ MV)
или
если дано Kb,тогда
pOH=
½ (pKb
— Cоснования)
(pKb=-lgKb;
pOH=
½ (-lgKb
— Cоснования;
pH=14-pOH)
для
слабого основания
:
pH
= 14 — ½pKb
+ ½ lgC
15.
 Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия.
Типы протолитических реакций. Понятие о гидролизе. Роль гидролиза в биохимических процессах. Ацидиметрия и алкалиметрия.
К
протолитическим реакциям относят
кислотно−основные реакции и реакции
нейтрализации и гидролиза.
В
соответствии с протолитической теорией
кислот и оснований кислоты представляют
собой атомно−молекулярные частицы,
способные в обычных условиях к
внутримолекулярной или межмолекулярной,
полной или неполной передаче протона,
а основания − частицы, способные в этих
же условиях к присоединению протона,
например:
Nh4(осн.1)
+ h3O(кисл.2) = Nh5+ (кисл.2)+ OH−(осн.2)
Сродство
к протону ‒
энергия, высвобождающаяся в газофазной
реакции между протоном и молекулой с
образованием соответствующей сопряженной
кислоты
Реакция
гидролиза — необратимая химическая
реакция взаимодействие ионов соли с
водой с образованием малодиссоциирующих
частиц (относится к протолитическим
реакциям). Реакции гидролиза записывают
в виде:
а)
молекулярного уравнения: KNO2 + h3O ↔ KOH +
HNO2
б)
ионного уравнения:
NO2−
+ h3O ↔ HNO2 + OH−
Nh5+
+ h3O = Nh5ОН + Н+ [образующийся ион водорода
обусловливает кислотную среду раствора,
т. е. (рН) < 7].
е. (рН) < 7].
Уравнение
реакции гидролиза соли (гидролиз иона)
на примере FeCl3 выглядит как (FeCl3 = Fe3+ +
3Cl−)
Гидролиз
солей это реакции между составными
частями воды и солей, сопровождающиеся
образованием малодиссоциированных
соединений. Гидролизу могут подвергаться
не только соли, но и другие растворенные
вещества (углеводы, белки, жиры, эфиры
и т.д.). Реакция гидролиза часто
сопровождается изменением рН раствора.
Если вместо воды используется иной
растворитель, то процесс носит название
сольволиз.
Гидролизу
подвергаются соли, являющиеся производными
слабых кислот или оснований. Соли,
образованные сильными кислотами и
основаниями, гидролизу не подвергаются.
1)Гидролиз
солей, образованных сильной кислотой
и слабым основанием (гидролиз по катиону).
Для характеристики полноты протекания
реакции используют понятие степень
гидролиза (β) – отношение концентрации
молекул, подвергшихся гидролизу (сгидр)
к исходной концентрации растворенной
соли (сисх):
(7. 37)
37)
Степень
гидролиза зависит от: 1)химической
природы ионов, составляющих соль;
2)концентрации соли; 3)температуры.
Степень гидролиза увеличивается с
уменьшением константы диссоциации
слабой кислоты или основания, уменьшением
концентрации соли и повышением
температуры.
Гидролиз
протекает в заметной степени только в
разбавленных растворах,
тогда следовательно,Это
произведение называется константой
гидролиза (Кг):
Из
выражения (7.42) следует, что уменьшение
силы основания ведет к увеличению
константы гидролиза, а следовательно,
и степени гидролиза.
Степень
гидролиза увеличивается с уменьшением
силы основания и концентрации соли.
Повышение температуры сопровождается
увеличением КW, что также ведет к росту
β.
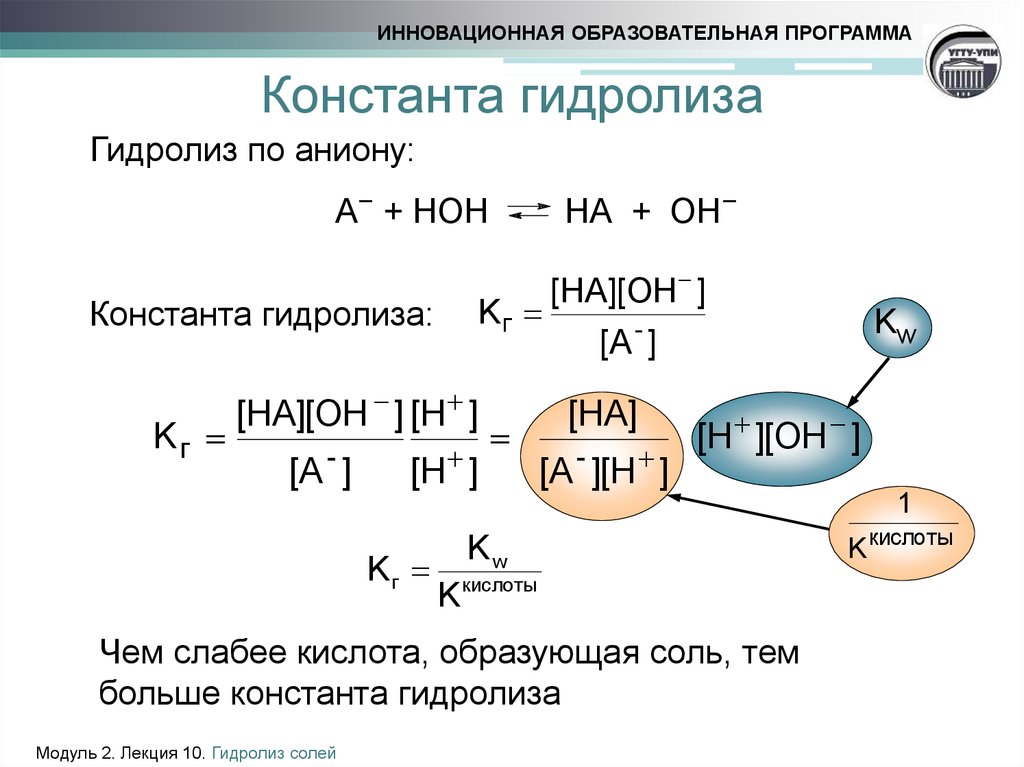
2)Гидролиз
солей, образованных слабой кислотой и
сильным основанием (гидролиз по аниону).
где
Ккислота – константа диссоциации слабой
кислоты.
3)Гидролиз
солей, образованных слабой кислотой и
слабым основанием (гидролиз по аниону
и катиону)
Константа
гидролиза в этом случае определяется
константой диссоциации слабой кислоты
и слабого основания:
Реакции
гидролиза играют важную роль в природных
и производственных процессах. В
В
водоочистке для удаления грубодисперсных
и коллоидных примесей используют осадки
гидроксидов алюминия и железа, получаемые
гидролизом сульфатов железа (FeSO4.7h3O;
Fe2(SO4)3.9h3O), алюминия Al2(SO4)3.18h3O), или хлорида
железа (FeCl3.6h3O). Для обеспечения полноты
протекания гидролиза растворы
подщелачивают. Важной стадией процесса
пищеварения является гидролиз пищи в
желудочно-кишечном тракте. Энергия в
живых организмах запасается, в основном,
в виде АТФ (аденозинтрифосфорная кислота)
и выделяется при ее гидролизе.
Алкалиметрия
и ацидиметрия — важнейшие титриметрические
методы определения кислот или же
оснований, основанные на реакции
нейтрализации:
Н+
+ ОН− = Н2О
Титрование
раствором щелочи называется алкалиметрией,
а титрование раствором кислоты —
ацидиметрией.
Константа — автопротолиз — Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
Каждый растворитель характеризуется определенной величиной константы автопротолиза ( Ks), которая определяет шкалу кислотности растворителя ( p / Cs) — Чем больше шкала кислотности, тем больше наблюдаемые при титровании в среде такого растворителя скачки титрования и тем больше возможность дифференцированного титрования смесей электролитов.
[31]
Ясно, что вклад определяется константой автопротолиза, которая для серной кислоты относительно велика.
[32]
Избираемый растворитель должен обеспечивать наилучшие соотношения констант автопротолиза и констант диссоциации титруемых электролитов.
[33]
Избираемый растворитель должен обеспечивать наилучшие соотношения констант автопротолиза и констант диссоциации титруемых электролитов.
[34]
Но затруднение, связанное с различием констант автопротолиза растворителей, не единственное.
[35]
Чем сильнее ионизирован растворитель, тем больше константа автопротолиза, тем большей сольватирующей способностью в отношении растворенных веществ обладает данный растворитель, а следовательно, тем сильнее диссоциированы в его ореде электролиты. Это означает, что чем больше константа автопротолиза, тем слабее его дифференцирующее действие при прочих равных условиях. С уменьшением константы автопротолиза возрастает его дифференцирующий эффект.
С уменьшением константы автопротолиза возрастает его дифференцирующий эффект.
[36]
В табл. 12 — 1 приведены значения констант автопротолиза нескольких наиболее известных растворителей.
[37]
Под влиянием неводных растворителей с различной величиной констант автопротолиза сила кислот, оснований и степень диссоциации солей изменяется в неодинаковой степени. Это дифференцирующее действие неводных растворителей используется для титрования смесей, раздельное определение компонентов которых в водной среде невозможно из-за гидролиза продуктов реакций.
[38]
На основании критической оценки опубликованных данных о константе автопротолиза уксусной кислоты следует считать, что она выше, чем константа самодиссоциации воды.
[39]
Величина Kw называется ионным произведением воды ( константой автопротолиза воды) и является величиной постоянной в воде, разбавленных водных растворах кислот, щелочей, солей и других соединений при постоянной температуре.
[40]
| Моляльные концентрации частиц, т, образующихся при самодиссоциации h3SO4 и 62804.
[41] |
Следует отметить, что значения константы автодейтролиза меньше константы автопротолиза. В табл. 22 приведены моляльные концентрации продуктов самодиссоциации кислот h3SO4 и D2S04 при температуре замерзания соответствующих кислот.
[42]
ОН ] — молярные концентрации; Л авТо константа автопротолиза воды, равная 1 00 — 10 14 молъ / л при 25 С.
[43]
Очевидно, чем сильнее собственная диссоциация растворителя — больше константа автопротолиза, — тем в большей степени происходит сольволиз.
[44]
При этом скачки титрования увеличиваются особенно сильно, если константы автопротолиза уменьшаются в большей степени, чем константы диссоциации кислот. Следует также иметь в виду, что соотношение констант ионного произведения растворителя и диссоциации кислоты уменьшается по мере уменьшения кислотности или увеличения основности растворителя.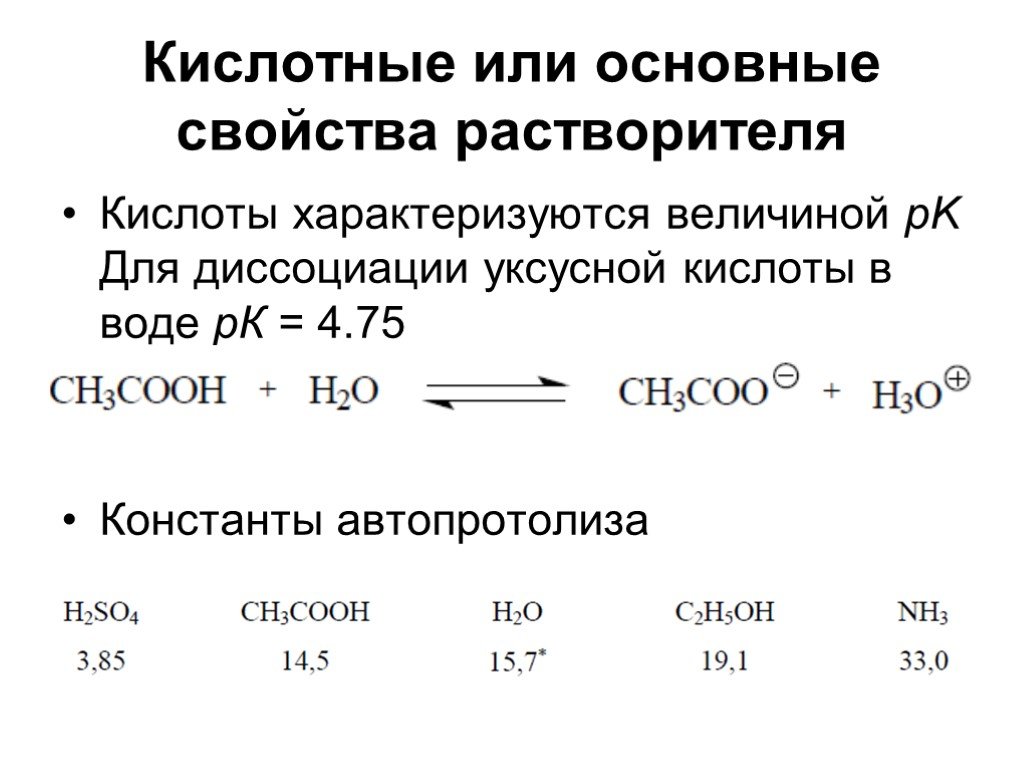 С уменьшением диэлектрической проницаемости среды условия титрования ухудшаются вследствие усиления степени ассоциации ионов. Немаловажную роль играет также изменение кислотности самой титруемой кислоты, наблюдаемое при переходе к растворителям, не содержащим гидроксильных групп.
С уменьшением диэлектрической проницаемости среды условия титрования ухудшаются вследствие усиления степени ассоциации ионов. Немаловажную роль играет также изменение кислотности самой титруемой кислоты, наблюдаемое при переходе к растворителям, не содержащим гидроксильных групп.
[45]
Страницы:
1
2
3
4
ChemTeam: Kw: константа ионизации воды
ChemTeam: Kw: константа ионизации воды
K
w : Константа ионизации воды
Вернуться в меню «Кислотно-основное»
Важное примечание: все константы, относящиеся к: K c , K w , K a и K b , зависят от температуры. Предполагается, что все обсуждения ведутся при 25 °C, т. е. при стандартной температуре.
Следующее уравнение описывает реакцию воды с самой собой (называемую аутопротолизом):
H 2 O + H 2 O ⇌ H 3 O + + OH¯
Константа равновесия этой реакции записывается следующим образом:
[Н 3 О + ] [ОН¯] К с = ––––––––––– [Н 2 О] [Н 2 О]
Однако в чистой жидкой воде [H 2 O] само по себе является постоянной величиной.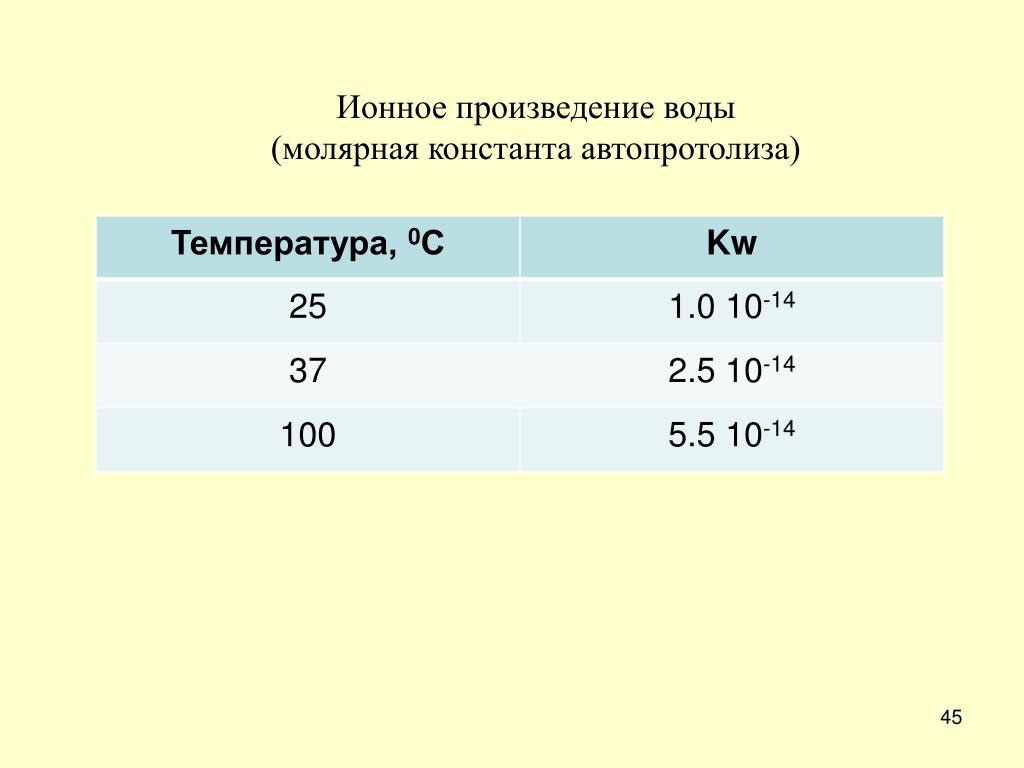 Чтобы продемонстрировать это, рассмотрим 1000 мл воды с плотностью 1,00 г/мл. Этот 1,00 литр (1000 мл) будет весить 1000 граммов. Эта масса, деленная на молекулярную массу воды (18,0152 г/моль), дает 55,5 молей. Тогда «молярность» этой воды будет 55,5 моль/1,00 литр или 55,5 М.
Чтобы продемонстрировать это, рассмотрим 1000 мл воды с плотностью 1,00 г/мл. Этот 1,00 литр (1000 мл) будет весить 1000 граммов. Эта масса, деленная на молекулярную массу воды (18,0152 г/моль), дает 55,5 молей. Тогда «молярность» этой воды будет 55,5 моль/1,00 литр или 55,5 М.
Растворы, изучаемые во вводной химии, настолько разбавлены, что на «концентрацию» воды это не влияет. Таким образом, 55,5 молярных можно считать константой, если раствор достаточно разбавлен.
Перемножение приведенного выше уравнения дает:
K c [H 2 O] [H 2 O] = [H 3 O + ] [OH¯]
Поскольку терм K c [H 2 O] [H 2 O] является константой, пусть он будет обозначен как K w , что дает:
K w = [H 3 O + ] [OH¯]
Эта константа, K w , называется константой автопротолиза воды или константой автоионизации воды. (Иногда префикс auto опускается, как это было сделано в заголовке этого раздела.) Он может быть определен экспериментально и имеет значение 1,011 x 10¯9.0028 14 при 25 °C. Обычно используется значение 1,00 x 10¯ 14 .
(Иногда префикс auto опускается, как это было сделано в заголовке этого раздела.) Он может быть определен экспериментально и имеет значение 1,011 x 10¯9.0028 14 при 25 °C. Обычно используется значение 1,00 x 10¯ 14 .
Из приведенного выше химического уравнения видно, что на каждый произведенный H 3 O + также производится один OH¯. Другой способ сказать, что молярное отношение H 3 O + к OH¯ в воде составляет 1 к 1. Это означает, что одинаковое количество каждого иона присутствует в чистой воде. Другими словами, в чистой воде [H 3 O + ] = [OH¯].
Следовательно, значения [H 3 O + ] и [OH¯] можно определить, взяв квадратный корень из K w . Следовательно, и [H 3 O + ], и [OH¯] равны 1,00 x 10¯ 7 М в чистой воде. Это приводит к нескольким важным результатам в кислотно-щелочном мире.
Результат №1: pH чистой воды равен 7
По определению pH = -log [H 3 O + ]
pH чистой воды тогда равен −log 10¯ 7 , то есть 7.
Результат #2: Если pH или pOH известны, можно найти другие значения.
Возьмите отрицательный логарифм каждой части уравнения K w следующим образом:
-log K w = -log [H 3 O + ] + -log [OH¯]
−log 1,00 x 10¯ 14 = −log [H 3 O + ] + −log [OH¯]
Обратите внимание на знак добавления в правой части уравнения. Результат обычно записывается как:
pK w = pH + pOH = 14
Это чрезвычайно важное уравнение. Изучите это хорошо.
Результат #3: Если известен [H 3 O + ] или [OH¯], можно найти другой.
Просто разделите K w на известное значение, чтобы получить другое.
Предположим, [H 3 O + ] известно, тогда:
[OH¯] = K w / [H 3 O + ]
Предположим, [OH¯] известно, тогда:
[H 3 O + ] = K w / [OH¯]
Результат №4: В решении, если одна переменная ( [H 3 O + ] или [OH¯] ) изменяет значение (в большую или меньшую сторону), другая переменная будет изменяться в противоположном направлении.
Изменение значений все равно сохранит это фундаментальное равенство:
K w = [H 3 O + ] [OH¯]
Предположим, что [H 3 O + ] стало больше, поэтому [OH¯] стало меньше.
Предположим, что [OH¯] стало больше, поэтому [H 3 O + ] стало меньше.
Это изменение происходит автоматически и не может быть остановлено.
Вернуться в меню Acid Base
водный раствор — Константа автопротолиза воды
спросил
Изменено
6 лет, 8 месяцев назад
Просмотрено
1к раз
$\begingroup$
В моем учебнике по химии указано, что $[\ce{h4O+}][\ce{OH-}] = K_w$ во всех водных растворах, которые мы знаем как $K_w$. Однако мне было интересно, почему это было правдой. В учебнике утверждается, что это так, потому что $K_w$ является константой равновесия, но почему мы можем предположить, что другие ионы не принимают участия в этой реакции?
Однако мне было интересно, почему это было правдой. В учебнике утверждается, что это так, потому что $K_w$ является константой равновесия, но почему мы можем предположить, что другие ионы не принимают участия в этой реакции?
Для дальнейшего уточнения рассмотрим следующую реакцию
$$\ce{HCl + h3O (ж) <=> h4O+ + OH- + Cl- }$$
Конечно, это не сбалансировано, но почему ион водорода слева не влияет на константу равновесия? 9{-7}$ Это действительно очень маленькая сумма, настолько маленькая, что ее можно игнорировать.
Однако во многих реакциях (особенно в органической химии) вы увидите отрицательный ион, например, $\ce{Cl-}$, вытягивающий $\ce{H+}$ из воды. Поэтому, когда необходимы $[\ce{OH-}]$ или $[\ce{h4O+}]$, для их получения можно разорвать воду.
$\endgroup$
3
$\begingroup$
!!Бинг!! !!Бинг!! !!Бинг!! Поздравляю — Вы думаете как химик!! 9-}$.
