Содержание
Количество теплоты. Удельная теплоёмкость – FIZI4KA
ОГЭ 2018 по физике ›
1. Изменение внутренней энергии путём совершения работы характеризуется величиной работы, т.е. работа является мерой изменения внутренней энергии в данном процессе. Изменение внутренней энергии тела при теплопередаче характеризуется величиной, называемой количеством теплоты.
Количеством теплоты называется изменение внутренней энергии тела в процессе теплопередачи без совершения работы.
Количество теплоты обозначают буквой \( Q \). Так как количество теплоты является мерой изменения внутренней энергии, то его единицей является джоуль (1 Дж).
При передаче телу некоторого количества теплоты без совершения работы его внутренняя энергия увеличивается, если тело отдаёт какое-то количество теплоты, то его внутренняя энергия уменьшается.
2. Если в два одинаковых сосуда налить в один 100 г воды, а в другой 400 г при одной и той же температуре и поставить их на одинаковые горелки, то раньше закипит вода в первом сосуде. \circ C) \) температур: \( Q\sim(t_2-t_1) \).
\circ C) \) температур: \( Q\sim(t_2-t_1) \).
4. Если теперь в один сосуд налить 100 г воды, а в другой такой же сосуд налить немного воды и положить в неё такое металлическое тело, чтобы его масса и масса воды составляли 100 г, и нагревать сосуды на одинаковых плитках, то можно заметить, что в сосуде, в котором находится только вода, температура будет ниже, чем в том, в котором находятся вода и металлическое тело. Следовательно, чтобы температура содержимого в обоих сосудах была одинаковой нужно воде передать большее количество теплоты, чем воде и металлическому телу. Таким образом, количество теплоты, необходимое для нагревания тела зависит от рода вещества, из которого это тело сделано.
5. Зависимость количества теплоты, необходимого для нагревания тела, от рода вещества характеризуется физической величиной, называемой удельной теплоёмкостью вещества.
Физическая величина, равная количеству теплоты, которое необходимо сообщить 1 кг вещества для нагревания его на 1 °С (или на 1 К), называется удельной теплоёмкостью вещества.
Такое же количество теплоты 1 кг вещества отдаёт при охлаждении на 1 °С.
Удельная теплоёмкость обозначается буквой \( c \). Единицей удельной теплоёмкости является 1 Дж/кг °С или 1 Дж/кг К.
Значения удельной теплоёмкости веществ определяют экспериментально. Жидкости имеют большую удельную теплоёмкость, чем металлы; самую большую удельную теплоёмкость имеет вода, очень маленькую удельную теплоёмкость имеет золото.
Удельная теплоёмкость свинца 140 Дж/кг °С. Это значит, что для нагревания 1 кг свинца на 1 °С необходимо затратить количество теплоты 140 Дж. Такое же количество теплоты выделится при остывании 1 кг воды на 1 °С.
Поскольку количество теплоты равно изменению внутренней энергии тела, то можно сказать, что удельная теплоёмкость показывает, на сколько изменяется внутренняя энергия 1 кг вещества при изменении его температуры на 1 °С. В частности, внутренняя энергия 1 кг свинца при его нагревании на 1 °С увеличивается на 140 Дж, а при охлаждении уменьшается на 140 Дж.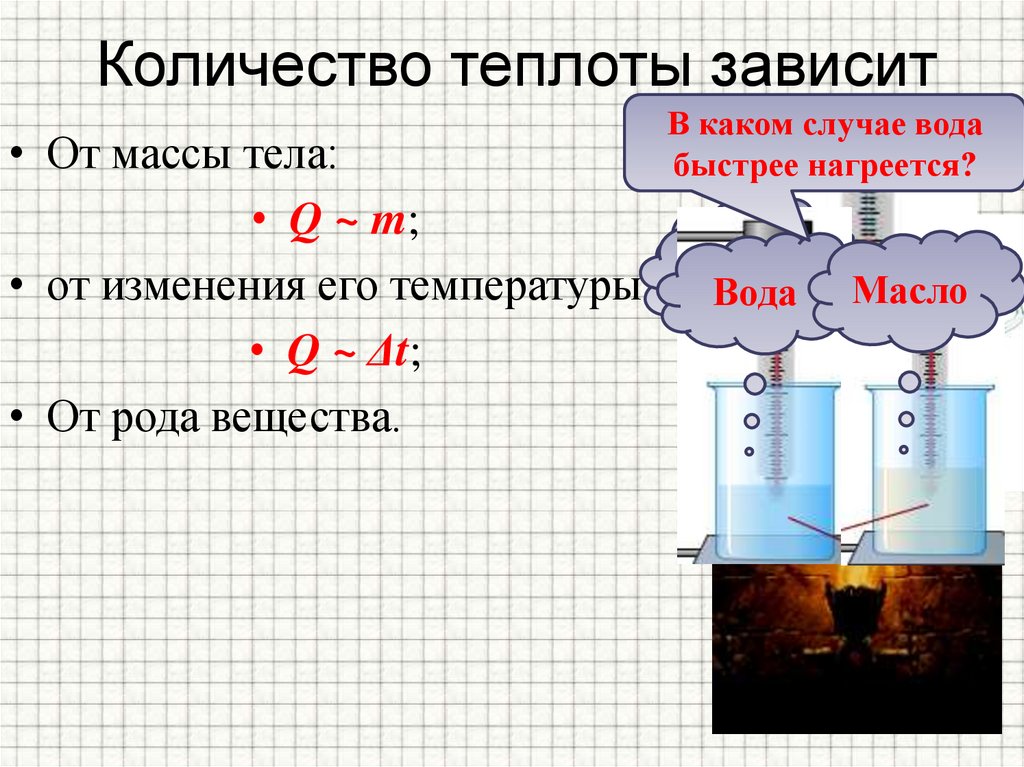 \circ) \]
\circ) \]
По этой же формуле вычисляется и количество теплоты, которое тело отдаёт при охлаждении. Только в этом случае от начальной температуры следует отнять конечную, т.е. от большего значения температуры отнять меньшее.
6. Пример решения задачи. В стакан, содержащий 200 г воды при температуре 80 °С, налили 100 г воды при температуре 20 °С. После чего в сосуде установилась температура 60 °С. Какое количество теплоты получила холодная вода и отдала горячая вода?
При решении задачи необходимо выполнять следующую последовательность действий:
- записать кратко условие задачи;
- перевести значения величин в СИ;
- проанализировать задачу, установить, какие тела участвуют в теплообмене, какие тела отдают энергию, а какие получают;
- решить задачу в общем виде;
- выполнить вычисления;
- проанализировать полученный ответ.
1. Условие задачи.
Дано:
\( m_1 \) = 200 г
\( m_2 \) = 100 г
\( t_1 \) = 80 °С
\( t_2 \) = 20 °С
\( t \) = 60 °С
______________
\( Q_1 \) — ? \( Q_2 \) — ?
\( c_1 \) = 4200 Дж/кг · °С
2. СИ: \( m_1 \) = 0,2 кг; \( m_2 \) = 0,1 кг.
СИ: \( m_1 \) = 0,2 кг; \( m_2 \) = 0,1 кг.
3. Анализ задачи. В задаче описан процесс теплообмена между горячей и холодной водой. Горячая вода отдаёт количество теплоты \( Q_1 \) и охлаждается от температуры \( t_1 \) до температуры \( t \). Холодная вода получает количество теплоты \( Q_2 \) и нагревается от температуры \( t_2 \) до температуры \( t \).
4. Решение задачи в общем виде. Количество теплоты, отданное горячей водой, вычисляется по формуле: \( Q_1=c_1m_1(t_1-t) \).
Количество теплоты, полученное холодной водой, вычисляется по формуле: \( Q_2=c_2m_2(t-t_2) \).
5. Вычисления.
\( Q_1 \) = 4200 Дж/кг · °С · 0,2 кг · 20 °С = 16800 Дж
\( Q_2 \) = 4200 Дж/кг · °С · 0,1 кг · 40 °С = 16800 Дж
6. В ответе получено, что количество теплоты, отданное горячей водой, равно количеству теплоты, полученному холодной водой. При этом рассматривалась идеализированная ситуация и не учитывалось, что некоторое количество теплоты пошло на нагревание стакана, в котором находилась вода, и окружающего воздуха. В действительности же количество теплоты, отданное горячей водой, больше, чем количество теплоты, полученное холодной водой.
В действительности же количество теплоты, отданное горячей водой, больше, чем количество теплоты, полученное холодной водой.
Содержание
- ПРИМЕРЫ ЗАДАНИЙ
- Часть 1
- Часть 2
- Ответы
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. Удельная теплоёмкость серебра 250 Дж/(кг · °С). Что это означает?
1) при остывании 1 кг серебра на 250 °С выделяется количество теплоты 1 Дж
2) при остывании 250 кг серебра на 1 °С выделяется количество теплоты 1 Дж
3) при остывании 250 кг серебра на 1 °С поглощается количество теплоты 1 Дж
4) при остывании 1 кг серебра на 1 °С выделяется количество теплоты 250 Дж
2. Удельная теплоёмкость цинка 400 Дж/(кг · °С). Это означает, что
1) при нагревании 1 кг цинка на 400 °С его внутренняя энергия увеличивается на 1 Дж
2) при нагревании 400 кг цинка на 1 °С его внутренняя энергия увеличивается на 1 Дж
3) для нагревания 400 кг цинка на 1 °С его необходимо затратить 1 Дж энергии
4) при нагревании 1 кг цинка на 1 °С его внутренняя энергия увеличивается на 400 Дж
3. \circ \)
\circ \)
4. На рисунке приведён график зависимости количества теплоты, необходимого для нагревания двух тел (1 и 2) одинаковой массы, от температуры. Сравните значения удельной теплоёмкости (\( c_1 \) и \( c_2 \)) веществ, из которых сделаны эти тела.
1) \( c_1=c_2 \)
2) \( c_1>c_2 \)
3) \( c_1<c_2 \)
4) ответ зависит от значения массы тел
5. На диаграмме представлены значения количества теплоты, переданного двум телам равной массы при изменении их температуры на одно и то же число градусов. Какое соотношение для удельных теплоёмкостей веществ, из которых изготовлены тела, является верным?
1) \( c_1=c_2 \)
2) \( c_1=3c_2 \)
3) \( c_2=3c_1 \)
4) \( c_2=2c_1 \)
6. На рисунке представлен график зависимости температуры твёрдого тела от отданного им количества теплоты. Масса тела 4 кг. Чему равна удельная теплоёмкость вещества этого тела?
1) 500 Дж/(кг · °С)
2) 250 Дж/(кг · °С)
3) 125 Дж/(кг · °С)
4) 100 Дж/(кг · °С)
7. При нагревании кристаллического вещества массой 100 г измеряли температуру вещества и количество теплоты, сообщённое веществу. Данные измерений представили в виде таблицы. Считая, что потерями энергии можно пренебречь, определите удельную теплоёмкость вещества в твёрдом состоянии.
При нагревании кристаллического вещества массой 100 г измеряли температуру вещества и количество теплоты, сообщённое веществу. Данные измерений представили в виде таблицы. Считая, что потерями энергии можно пренебречь, определите удельную теплоёмкость вещества в твёрдом состоянии.
1) 192 Дж/(кг · °С)
2) 240 Дж/(кг · °С)
3) 576 Дж/(кг · °С)
4) 480 Дж/(кг · °С)
8. Чтобы нагреть 192 г молибдена на 1 К, нужно передать ему количество теплоты 48 Дж. Чему равна удельная теплоёмкость этого вещества?
1) 250 Дж/(кг · К)
2) 24 Дж/(кг · К)
3) 4·10-3 Дж/(кг · К)
4) 0,92 Дж/(кг · К)
9. Какое количество теплоты необходимо для нагревания 100 г свинца от 27 до 47 °С?
1) 390 Дж
2) 26 кДж
3) 260 Дж
4) 390 кДж
10. На нагревание кирпича от 20 до 85 °С затрачено такое же количество теплоты, как для нагревания воды такой же массы на 13 °С. Удельная теплоёмкость кирпича равна
1) 840 Дж/(кг · К)
2) 21000 Дж/(кг · К)
3) 2100 Дж/(кг · К)
4) 1680 Дж/(кг · К)
11. Из перечня приведённых ниже высказываний выберите два правильных и запишите их номера в таблицу.
Из перечня приведённых ниже высказываний выберите два правильных и запишите их номера в таблицу.
1) Количество теплоты, которое тело получает при повышении его температуры на некоторое число градусов, равно количеству теплоты, которое это тело отдаёт при понижении его температуры на такое же число градусов.
2) При охлаждении вещества его внутренняя энергия увеличивается.
3) Количество теплоты, которое вещество получает при нагревании, идёт главным образом на увеличение кинетической энергии его молекул.
4) Количество теплоты, которое вещество получает при нагревании, идёт главным образом на увеличение потенциальной энергии взаимодействия его молекул
5) Внутреннюю энергию тела можно изменить, только сообщив ему некоторое количество теплоты
12. В таблице представлены результаты измерений массы \( m \), изменения температуры \( \Delta t \) и количества теплоты \( Q \), выделяющегося при охлаждении цилиндров, изготовленных из меди или алюминия.
Какие утверждения соответствуют результатам проведённого эксперимента? Из предложенного перечня выберите два правильных. Укажите их номера. На основании проведенных измерений можно утверждать, что количество теплоты, выделяющееся при охлаждении,
1) зависит от вещества, из которого изготовлен цилиндр.
2) не зависит от вещества, из которого изготовлен цилиндр.
3) увеличивается при увеличении массы цилиндра.
4) увеличивается при увеличении разности температур.
5) удельная теплоёмкость алюминия в 4 раза больше, чем удельная теплоёмкость олова.
Часть 2
C1.Твёрдое тело массой 2 кг помещают в печь мощностью 2 кВт и начинают нагревать. На рисунке изображена зависимость температуры \( t \) этого тела от времени нагревания \( \tau \). Чему равна удельная теплоёмкость вещества?
1) 400 Дж/(кг · °С)
2) 200 Дж/(кг · °С)
3) 40 Дж/(кг · °С)
4) 20 Дж/(кг · °С)
Ответы
Закон сохранения энергии в тепловых процессах. Преобразование энергии в тепловых машинах →
Преобразование энергии в тепловых машинах →
← Виды теплопередачи: теплопроводность, конвекция, излучение
Расчет количества теплоты, сообщенного телу при его нагревании или выделяемого при его охлаждении
Мы узнали, от каких величин зависит количество теплоты и какими единицами его измеряют.
Для подсчета количества теплоты нужно знать удельную теплоемкость вещества, из которого изготовлено тело, массу этого тела и разность между его начальной и конечной температурой.
Например, нужно подсчитать, какое количество теплоты получила железная деталь массой 5 кг при нагревании на 600 °С.
Удельная теплоемкость железа равна 460 Дж/кг*°С, это означает, что для нагревания железа массой 1 кг на 1 °С требуется 460 Дж.
Для нагревания железа массой 5 кг на 1°С потребуется в 5 раз большее количество теплоты, т. е. 460 Дж X 5 =2300 Дж; для нагревания железа массой 5 кг на 600 °С потребуется еще в 600 раз большее количество теплоты, т. е. 2300 Дж X 600 = 1380 000 Дж.
е. 2300 Дж X 600 = 1380 000 Дж.
Итак, чтобы подсчитать количество теплоты, необходимое для нагревания тела, нужно удельную теплоемкость умножить на массу тела и на разность между конечной и начальной температурой его.
Указанное правило можно записать в виде формулы, введя следующие обозначения: Q—количество теплоты, c – кудельная теплоемкость вещества, m — масса тела, t1 —начальная и t2 – конечная температура тела. Тогда
Q = cm (t2 — t1).
Пример 1. В железный котел массой 10 кг налито 20 кг воды. Какое количество теплоты нужно передать котлу, чтобы нагреть его вместе с налитой в него водой от 10 до 100 °С?
Оба тела — и котел, и вода — будут нагреваться вместе. Между ними происходит теплообмен, и их температуры можно считать одинаковыми. Поэтому и котел, и вода нагреваются на одно и то же число градусов: 100 °С — 10 °С = 90 °С. Но количества теплоты, полученные котлом и водой, не будут одинаковыми, ведь их массы и удельные теплоемкости различны.
Количество теплоты, полученное котлом, равно:
Q1=c1m1(t2 – t1),
Q1 =460 Дж/кг*°С • 10 кг • 90°С=414 000 Дж ≈ 400 кДж.
Количество теплоты, полученное водой, равно:
Q2 = c2m2(t2 – t1),
Q2 = 4200 Дж/кг*°С • 20 кг • 90°С = 7560000 Дж≈7600 кДж.
На нагревание и котла, и воды израсходовано количество теплоты:
Q=Q1 + Q2,
Q = 400 кДж+7 600 кДж = 8 000 кДж
Пример 2. Смешали 0,8 кг воды, имеющей температуру 25°С, и 0,2 кг кипятка. Температуру полученной смеси измерили, и она оказалась равной 40 °С. Вычислить, какое количество теплоты отдал при остывании кипяток и какое количество теплоты получила, при нагревании более холодная вода. Сравнить эти количества теплоты.
Кипяток остыл от 100 до 40 °С, при этом он отдал количество теплоты:
Q1 = c1m1(t2 — t1),
Q1 = 4 200 Дж/кг*°С • 0,2 кг • (100° С – 40° С) = 50 400 Дж.
Вода, в которую был влит кипяток, нагрелась от 25 до 40 °С и получила количество теплоты:
Q2 = c2m2(t – t1),
Q2 = 4 200 Дж/кг*°С • 0,8 кг • (40° С – 25° С) = 50 400 Дж.
Мы видим, что количество теплоты, отданное горячей водой, и количество теплоты, полученное холодной водой, равны между собой. Это не случайный результат. Опыт показывает, что если между телами происходит теплообмен, то внутренняя энергия всех нагревающихся тел увеличивается настолько, насколько уменьшается внутренняя энергия остывающих тел.
Однако если провести более точные измерения в опытах по смешиванию горячей и холодной воды, то точного равенства отданной и полученной энергии не получится. Отданная энергия будет больше полученной. Объясняется это тем, что часть энергии во время опыта передается воздуху и сосуду. Разница в отданном и полученном количестве теплоты будет тем меньше, чем меньше потерь энергии допускается в опыте.
Вопросы. 1. Что нужно знать, чтобы подсчитать количество теплоты, полученное телом при нагревании? 2. Объясните на примере, как подсчитывают количество теплоты, сообщенное телу при его нагревании или выделяющееся при его охлаждении. 3. Как записывают формулу для подсчета количества теплоты? 4. Какой вывод можно сделать из опыта по смешиванию холодной и горячей воды?
3. Как записывают формулу для подсчета количества теплоты? 4. Какой вывод можно сделать из опыта по смешиванию холодной и горячей воды?
Упражнения.
- Удельная теплоемкость алюминия равна 920 Дж/кг • ° С. Что это означает?
- Какая из указанных в таблице 6 жидкостей быстрее нагревается при одинаковых условиях нагревания? Почему?
- Почему в качестве охладителя (например, при охлаждении двигателя внутреннего сгорания) из всех жидкостей выгоднее всего применять воду?
- Рассчитайте количество теплоты, необходимое для нагревания: а) чугунного утюга массой 1,5 кг на 200° С, б) алюминиевой ложки массой 50 г от 20 до 90° С, в) кирпичной печи массой 2 т от 10 до 60°С,
Метки: внутренняя энергияДжоульединицы теплаколичество теплотынагреваниерасчет количества теплотытелотеплотеплоемкостьТеплопередачаУдельная теплоемкостьэнергия
Тепло
Тепло
| Тепло | Теплоемкость | Удельная теплоемкость |
| Скрытая теплота | Кинетический Молекулярная теория | |
Тепло
Тепло способ передачи энергии между системами
и его окружение, которое часто, но не всегда, меняет
температура системы. Тепло не сохраняется, его можно
Тепло не сохраняется, его можно
либо созданы, либо уничтожены. В метрической системе теплота
измеряется в единицах калорий , которые определяются как
количество теплоты, необходимое для нагревания одного грамма
вода от 14,5 o C до 15,5 o C.
В системе СИ единицей теплоты является джоуль .
Теплоемкость
Теплоемкость вещества есть количество теплоты
требуется для повышения температуры определенного количества чистого
веществ на один градус (по Цельсию или Кельвину). Калорийность была
определяли так, чтобы теплоемкость воды была равна единице.
Удельная теплоемкость
калорий, необходимых для повышения температуры на один грамм на 1 o °С.
Поскольку один градус по шкале Цельсия равен одному Кельвину,
удельная теплоемкость в метрической системе может быть выражена в единицах
либо кал/г- o C, либо кал/г-K. Единицы удельной теплоемкости
Единицы удельной теплоемкости
в системе СИ – Дж/г-К. Поскольку 4,184 Дж в
калория, удельная теплоемкость воды 4,184 Дж/г-К.
Легкость, с которой вещество приобретает или
потери тепла также можно описать с помощью его молярной теплоты.
мощность , это тепло, необходимое для повышения температуры
одного моля вещества на 1 o C или 1
K. В метрической системе единицами молярных теплоемкостей являются
поэтому либо кал/моль- o °С, либо кал/моль-К. В СИ
единицами молярной теплоемкости являются Дж/моль-К.
| Практическая задача 1: Использование 1 кал = 4,184 Дж Нажмите Нажмите |
Скрытая теплота
При нагревании льда тепло, первоначально поступающее в систему
используется для растапливания льда. Когда лед тает, температура остается
Когда лед тает, температура остается
постоянная при 0 o C. Количество тепла, необходимое для плавления
лед исторически назывался скрытой теплотой плавления .
После того, как лед растает, температура воды медленно
увеличивается с 0 o C до 100 o C. Но как только
вода начинает кипеть, тепло, попадающее в образец, используется для
преобразование жидкости в газ и температуру образца
остается постоянной до тех пор, пока жидкость не испарится. Количество тепла
для кипячения или испарения жидкость исторически была
называется скрытой теплотой парообразования .
Более 200 лет назад Джозеф Блэк различал разумных
тепло и скрытая теплота . Тепло, которое поднимает
можно измерить температуру системы, но тепло, которое приводит к
изменение состояния системы из твердого в жидкое или
из жидкости в газ скрыто. Как скрытое изображение на
фотопленка, которая не была проявлена или со скрытыми отпечатками пальцев
невидимое невооруженным глазом, скрытое тепло
тепло, поступающее в систему без изменения температуры
система.
Тепло и кинетика
Молекулярная теория
Система — это небольшая часть Вселенной в
которые нас интересуют, например вода в стакане или газ
в поршне и цилиндре, как показано на рисунках ниже.
окружения — это все остальное в
Другими словами, остальная часть Вселенной.
Система и ее окружение разделены границей .
Тепло передается через границу между системой и ее
окрестности.
Одним из фундаментальных принципов кинетической теории является
предположение, что средняя кинетическая энергия газового скопления
частиц зависит от температуры газа и больше ни от чего.
Газ становится теплее тогда и только тогда, когда средняя кинетическая энергия
частиц газа увеличивается. Тепло, когда оно повышает температуру
системы, приводит к увеличению скорости, с которой
частицы системы движутся, как показано на рисунке ниже.
Что такое удельная теплоемкость? (Видео)
TranscriptFAQs
Привет и добро пожаловать в это видео Mometrix об удельной теплоемкости — константе, которая связывает теплопередачу с изменениями температуры .
Температура напрямую связана со средней поступательной кинетической энергией атомов или молекул в системе. По сути, чем быстрее и тяжелее частицы, тем выше температура. Единицами температуры являются градусы Цельсия и Кельвина (помните, 0 градусов Цельсия = 273 Кельвина, но 1 градус Цельсия имеет ту же величину, что и 1 Кельвин).
И наоборот, теплота измеряется в джоулях и представляет собой энергию, передаваемую между контактирующими системами при разных температурах. Поскольку теплота является передачей энергии, она известна как величина процесса.
Поскольку теплота является передачей энергии, она известна как величина процесса.
Когда тепло поглощается или выделяется системой, температура изменяется. Степень изменения температуры зависит от вещества и, в частности, от удельной теплоемкости этого вещества.
Давайте рассмотрим пример.
Допустим, у нас есть 47,8 грамма воды температурой 35ºC, и мы ставим ее на плиту. Включаем плиту и передаем 1000 джоулей тепла нашим вода и температура поднимается до 40ºC. Другими словами, чтобы поднять 47,8 грамма воды на 5ºC, потребовалось 1000 Дж тепла.
Это своего рода глоток и кажется странно специфичным с точки зрения количества. Здесь в игру вступает удельная теплоемкость, обозначаемая как \(c\). Это стандартное количество тепла, необходимое для нагревания 1 грамма вещества на 1 градус Цельсия.
С помощью некоторого простого деления мы можем получить удельную теплоемкость воды из нашего гипотетического стакана с водой.
\(\text{Удельная теплоемкость (}c\text{)} =\) \(qmass \times ΔT= \frac{1000\text{ джоулей}}{47,8\text{ г} \times 5\ text{ K}}\)\(=4,184\text{ J/gK}\)
Теперь мы знаем, что требуется 4,184 Дж, чтобы поднять температуру 1 грамма воды на 1 градус Цельсия— это удельная теплоемкость воды.
Это действительно полезно для ученых, потому что однажды определенная удельная теплоемкость может использоваться для расчета тепла, поглощаемого или выделяемого системой, просто путем измерения изменения температуры и массы. Давайте попробуем это.
Давайте посмотрим на новую чашку с кипящей водой, скажем, на 350-граммовую кружку. Вода начинается при 100ºC и остывает до 90ºC. Мы хотим знать, сколько тепла было выделено из воды в окружающую среду. Поскольку мы знаем, что удельная теплоемкость воды составляет 4,184 Дж на грамм Кельвина, нам просто нужно изменить наше предыдущее уравнение, чтобы найти \(q\) (выделившееся тепло).
\(q=c \times \text{масса} \times ∆T\)\(=4,184 \text{ Дж/гK} \times 350 \text{g} \times -10 \text{K}\ )\(=-14 644 \text{J}\)
Поскольку мы знали удельную теплоемкость воды, рассчитать тепло, выделяемое системой, было легко!
Обратите внимание, что отрицательный знак просто говорит нам о том, что система (кружка с водой) отдавала тепло окружающей системе, а не поглощала его.
Теперь, когда мы определили удельную теплоемкость и продемонстрировали, как ее можно использовать для расчета теплоты, передаваемой от системы или к ней, давайте посмотрим, почему удельная теплоемкость изменяется между веществами.
Например, удельная теплоемкость этанола составляет 2,18 Дж на грамм Кельвина, что почти вдвое меньше, чем у воды. Если у нас есть один грамм воды и один грамм этанола при 0ºC, потребуется 4,18 Дж тепла, чтобы поднять температуру воды до 1ºC, и только 2,18 Дж для этанола. Жидкости достигают одинаковой температуры, но требуют разного количества тепла. Почему?
Помните, чтобы повысить температуру, нам нужно увеличить среднюю поступательную кинетическую энергию молекул (заставить молекулы двигаться быстрее). Но внутренняя энергия вещества — это больше, чем просто поступательная кинетическая энергия, она также включает в себя потенциальную энергию межмолекулярных взаимодействий. Когда тепло передается системе, оно распределяется между кинетической и потенциальной энергиями.
Таким образом, если система имеет большую потенциальную энергию, меньшая часть переданного тепла распределяется на кинетическую энергию, что приводит к меньшему увеличению температуры. Чтобы лучше понять эту концепцию, давайте снова посмотрим на воду и этанол.
В воде существует сложная сеть водородных связей между молекулами. Эти взаимодействия являются частью потенциальной энергии, и их необходимо преодолеть или прервать, чтобы увеличить среднюю поступательную кинетическую энергию. Итак, когда мы нагреваем воду, часть этой энергии используется для разрушения сети водородных связей вместо увеличения кинетической энергии, что приводит к большой удельной теплоемкости. И наоборот, в этаноле меньше водородных связей на молекулу или меньше потенциальной энергии, и поэтому большая часть переданного тепла используется для увеличения средней кинетической энергии, что приводит к меньшей удельной теплоемкости.
Обзор
Хорошо, давайте завершим обзор. Во-первых, мы рассмотрели научные определения температуры и тепла и связали их с помощью удельной теплоемкости.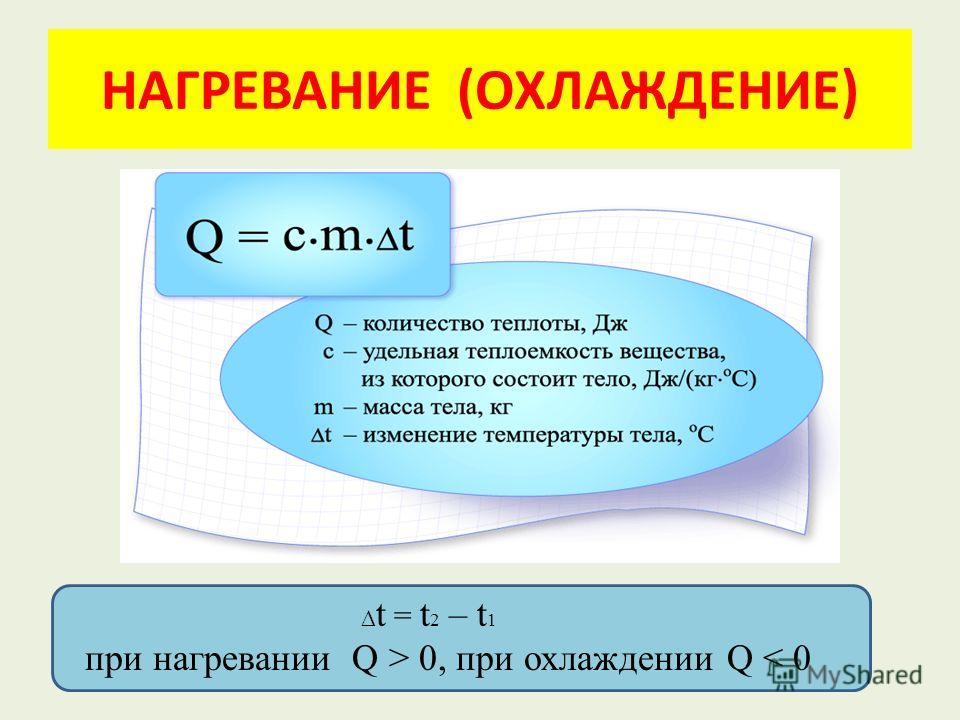 На примере воды мы показали, как, зная ее удельную теплоемкость, довольно легко определить количество теплоты, передаваемое от системы или к системе. И, наконец, мы рассмотрели с микроскопической точки зрения, почему вещества имеют разную удельную теплоемкость.
На примере воды мы показали, как, зная ее удельную теплоемкость, довольно легко определить количество теплоты, передаваемое от системы или к системе. И, наконец, мы рассмотрели с микроскопической точки зрения, почему вещества имеют разную удельную теплоемкость.
Спасибо за просмотр и удачной учебы!
Часто задаваемые вопросы
Q
Что такое удельная теплоемкость?
A
Удельная теплоемкость относится к количеству энергии или тепла, необходимому для повышения температуры 1 грамма вещества на один градус Цельсия.
Q
Какова удельная теплоемкость воды?
A
Ключевой характеристикой воды является ее высокая удельная теплоемкость. Вода должна поглотить 4184 Дж тепла, или 1 калорию, чтобы повысить температуру 1 кг воды на 1 градус Цельсия.
Q
В каких единицах выражается удельная теплоемкость?
A
Единицами, часто выражаемыми для удельной теплоемкости, являются Дж/(г×C) или Дж/(кг×C).
