5). Химические свойства основных оксидов:. Кислотный оксид вода
5). Химические свойства основных оксидов:
а) взаимодействие с водой. Правило: оксид взаимодействует с водой, если продукт реакции растворим в воде (и наоборот). Примеры:
Na2O + h3O 2NaOH
FeO + h3O реакция не идет, т.к. Fe(OH)2 нерастворим в воде.
б) взаимодействие с кислотами. При взаимодействии основных оксидов с кислотами образуется соль и вода.
Примеры:
CuO + h3SO4 CuSO4 + h3O (требуется нагревание)
Обратить внимание на следующее:
кремниевая кислота не реагирует с основными оксидами («твердое» не реагирует с «твердым»)
если в оксиде с.о. металла не максимальная, то в реакциях с кислотой азотной любой концентрации и с концентрированной серной кислотой помимо обменного взаимодействия возможно окислительно-восстановительное:
* FeO + 4HNO3(конц) Fe(NO3)3 + NO2 + 2h3O
* 2FeO + 4h3SO4 (конц) Fe2(SO4)3 + SO2+ 4h3O
*CaO + 2h4PO4 Ca(h3PO4)2 + h3O
в) взаимодействие с кислотными оксидами. Эти реакции протекают при нагревании, в ходе реакции образуется соль:
CaO + CO2 = CaCO3
Примечание: уравнения реакций в пунктах 6б и 6в являются доказательством основных свойств оксидов
г) взаимодействие с амфотерными оксидами.
Na2O + Al2O3 2NaAlO2 (при нагревании)
Na2O + ZnONa2ZnO2 (при нагревании)
6). Химические свойства кислотных оксидов:
а) взаимодействие с водой. Правило: оксид взаимодействует с водой, если продукт реакции растворим в воде (оксид не взаимодействует с водой, если продукт реакции нерастворим в воде)
ВСЕ КИСЛОТНЫЕ ОКСИДЫ, КРОМЕ SiO2, РЕАГИРУЮТ С ВОДОЙ.
Примеры:
P2O5 + 3h3O 2h4PO4 (при нагревании)
*P2O5 + h3O HPO3 (на холоду)
SiO2 + h3O реакция не идет, т.к. h3SiO3 нерастворима в воде
б) взаимодействие с основными и амфотерными оксидами (см. пункт 6.в)
г) взаимодействие с основаниями. Правило: кислотные оксиды взаимодействуют со щелочами, при этом образуется соль и вода. Пример:
2NaOH + CO2 Na2CO3 + h3O (в избытке NaOH)
NaOH + CO2 NaHCO3 (в избытке CO2)
д) взаимодействие с солями. Правило:
– при нагревании менее летучий оксид вытесняет из соли более летучий оксид.
Пример: Na2CO3 + SiO2 Na2SiO3 + CO2 (при нагревании)
– в растворе оксид, соответствующий более сильной кислоте, вытесняет из соли оксид, соответствующий более слабой кислоте.
– оксиды могут взаимодействовать с солями, содержащими остаток кислоты, которой этот оксид соответствует:
Na2CO3 +CO2 + h3O 2NaHCO3
Na2SO3 +SO2 + h3O 2NaHSO3
Пример: Na2SiO3 + CO2 Na2CO3 + SiO2 (в растворе)
8). Химические свойства амфотерных оксидов.
а) амфотерные оксиды не реагируют с водой
б) амфотерные оксиды в реакциях с кислотами проявляют основные свойства, т.е. реакции протекают так же, как с основными оксидами
Пример: Al2O3 + 6HCl 2AlCl3 + 3h3O
в) взаимодействие со щелочами. В зависимости от условий реакции протекают по-разному:
Al2O3 + 2NaOH + 3h3O 2Na[Al(OH)4] (в растворе)
Al2O3 + 2NaOH 2NaAlO2 + h3O(при нагревании)
г) взаимодействие с основными оксидами (см №6г)
д) при взаимодействии с кислотными оксидами амфотерные оксиды проявляют основные свойства.
Пример: Al2O3 + P2O5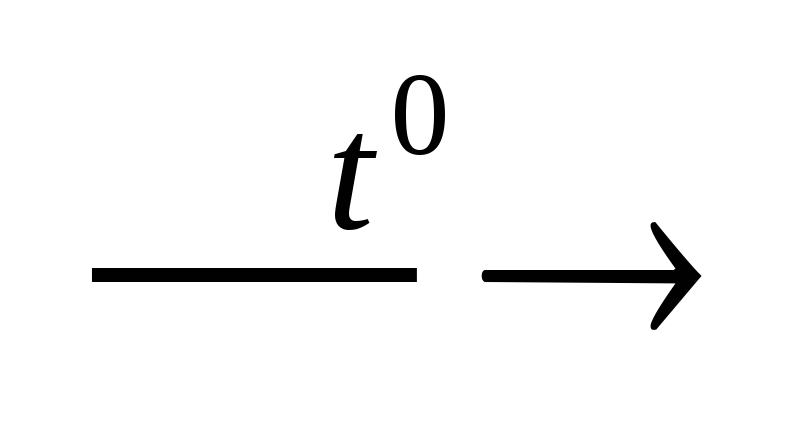 2AlPO4
2AlPO4
е) При взаимодействии с солями амфотерные оксиды, как нелетучие, вытесняют из солей при нагревании более летучие оксиды.
Пример: Na2CO3 + Al2O3 2NaAlO2 + CO2
| оксид | Гидроксид, основная форма | Гидроксид, кислотная форма (при нагревании) | Гидроксид, кислотная форма (в растворе) |
| BeO | Be(OH)2 | h3BeO2 | h3[Be(OH)4] |
| ZnO | Zn(OH)2 | h3ZnO2 | h3[Zn(OH)4] |
| SnO | Sn(OH)2 | h3SnO2 | h3[Sn(OH)4] |
| PbO | Pb(OH)2 | h3PbO2 | h3[Pb(OH)4] |
| Al2O3 | Al(OH)3 | HAlO2 | H[Al(OH)4] |
| Cr2O3 | Cr(OH)3 | HCrO2 | h4[Cr(OH)6] |
| Fe2O3 | Fe(OH)3 | HFeO2 | h4[Fe(OH)6] |
Примечание: кислотная форма амфотерных гидроксидов составлена формально, т.к. в реакциях со щелочами и с основными оксидами могут быть образованы только соли приведенных форм гидроксидов.
9). Зависимость кислотно-основных свойств оксидов от положения элемента в периодической системе и его степени окисления.
Слева направо по периоду по мере ослабления металлических свойств элементов основные свойства оксидов ослабевают, а кислотные возрастают. Сверху вниз по главным подгруппам неметаллические свойства элементов ослабевают, а металлические возрастают, при этом: сверху вниз по главной подгруппе возрастают основные свойства оксидов, а кислотные ослабевают. Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства.
Пример: Cr+2O – основный оксид, Cr2+3O3 – амфотерный оксид, Cr+6O3 – кислотный оксид.
Кислоты.
I Определение.
а) кислоты – сложные вещества, состоящие из кислотных остатков и атомов водорода, способных замещаться на атомы металлов
б) кислоты – электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода.
II Классификация
а) по наличию или отсутствию атомов кислорода кислоты делят на бескислородные (h3S, HCl и др.) и кислородосодержащие (h3SO4, HNO3 и др.)
б) по числу атомов водорода, способных замещаться на металлы или по числу ионов H+, образующихся при диссоциации кислоты выделяют кислоты одноосновные (HNO3, HCl), двухосновные (h3S, h3SO4,), трехосновные (h4PO4), четырехосновные (h5P2O7)
в) по способности к диссоциации кислоты разделяют на сильные электролиты (HCl, HNO3, h3SO4 и др.), слабые электролиты (h3S, h3CO3, HF), электролиты средней силы (h4PO4, h3SO3 ).
г) по летучести выделяют нелетучие кислоты (h4PO4, h3SiO3, h3SO4) и летучие (HNO3, HCl, HF, h3S h3CO3, h3SO3)
д) стабильные (h4PO4, h3SO4) и нестабильные (h3SO3, h3CO3) кислоты
III Структурные формулы кислот.
IV Физические свойства кислот. Существуют кислоты твердые (h4PO4, h3SiO3), жидкие кислоты (h3SO4, HNO3)
V Способы получения кислот:
а) бескислородные кислоты получают растворением соответствующего газа в воде
б) кислородосодержащие получают при взаимодействии соответствующего оксида в воде:
P2O5 + 3h3O 2h4PO4
в) нерастворимые кислоты получают косвенным путем:
Na2SiO3 + 2HCl h3SiO3+ 2NaCl
VI Химические свойства кислот.
1). Кислоты реагируют с металлами, стоящими в ряду активности левее водорода; при этом образуется соль и водород. При протекании таких процессов металл растворяется в кислоте (в ходе реакции не должна образовываться нерастворимая соль: h3SO4 + Mg MgSO4 + h3
Примечание: при взаимодействии металлов со слабыми кислотами образуются кислые соли:
Fe + 2h4PO4 → Fe(h3PO4)2 + 3h3
Ca + 2h3CO3 → Ca(HCO3)2 + h3
2). Кислоты реагируют с основными оксидами
Примечание: некоторые реакции требуют нагревания:
CuO + h3SO4 CuSO4 + h3O (требуется нагревание)
MgO + h3SO4 MgSO4 + h3O (эта реакция протекает при комнатной температуре)
3). Кислоты реагируют с основаниями.
Примечание: слабые нерастворимые основания не реагируют со слабыми кислотами.
2Al(OH)3 + 3h3SO4 Al2(SO4)3 + 6h3O
Al(OH)3 + h3CO3 – реакция не идет.
4). Кислоты реагируют с солями при выполнении условий:
а) в ходе реакции выпадает осадок
BaCl2 + h3SO4 BaSO4 + 2HCl
Примечание: с помощью сероводорода можно осадить из солей в виде сульфидов металлы, стоящие в ряду активности правее железа:
CuSO4 + h3S CuS+ h3SO4
Т.к. сульфиды железа, цинка, магния и т.д. растворимы в разбавленных кислотах, то
FeSO4 + h3S реакция не идет
б) в ходе реакции выделяется газ
K2CO3 + 2HCl 2KCl + h3O + CO2
в) нелетучие кислоты могут вытеснять летучие из их солей:
NaCl(тв.) + h3SO4(конц.)HCl + NaHSO4 (при слабом нагревании)
2NaCl(тв.) + h3SO4(конц.)2HCl + Na2SO4 (при сильном нагревании)
KNO3(тв.) + h3SO4(конц.) HNO3 + KHSO4
5). Растворы кислот изменяют окраску индикаторов:
лакмус и метилоранж – в красный.
Мнемотаблица для запоминания окраски индикаторов в зависимости от реакции среды:
| Кислая | нейтральная | щелочная | |
| Лакмус | 4 Красный | 8 Фиолетовый | 3 Синий |
| Метиловый оранжевый | 6 Красный | 2 Оранжевый | 7 Желтый |
| фенолфталеин | 1 Бесцветный | 9 Бесцветный | 5 Малиновый |
Таблица заполняется только первыми буквами приведенных в них слов (см. ниже). Заполнение происходит следующим образом: а) по горизонтали верхняя строка по алфавиту;
б) по вертикали левая строка также по алфавиту; в) далее из букв по порядку складываем мнемофразу (как «Каждый охотник желает знать…») «Бос и Ком крыжовником играют в футбол» (жирным подчеркнутым шрифтом выделены буквы из таблицы)
| К | Н | Щ | |
| Л | 4 К | 8 Ф | 3 С |
| М | 6 Кр | 2 О | 7 Ж |
| Ф | 1 Б | 9 Б | 5 М |
Дополнение. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | Щелочные, щелочноземельные металлы, Mg, Zn | Fe, Cr, Al | Другие металлы | Au, Pt |
| Концентрированная (>50%) | N2O | Пассивация, при нагревании - NO2 | NO2 | Нет реакции |
| Разбавленная (10 –50%) | N2 | NO, металлы, стоящие в ряду напряжений до водорода могут также давать N2O, N2 | ||
| Очень разбавленная (<10%) | Металлы, стоящие в ряду напряжений до водорода - Nh5NO3 | |||
Взаимодействие концентрированной серной кислоты с металлами:
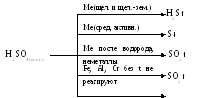
Основания. 1). Определение
а) основания – сложные вещества, состоящие из металлов (иона аммония) и одной или нескольких гидроксогрупп NaOH, Fe(OH)2
б) основания – электролиты, при диссоциации которых в качестве анионов образуются гидроксид-анионы NaOHNa++OH-
в) основания – вещества, в ходе реакций присоединяющие протоны Nh4 + H+Nh5+
2). Классификация.
По количеству гидроксогрупп основания делят на однокислотные - NaOH, двухкислотные - Fe(OH)2, трехкислотные - Fe(OH)3.
По способности к диссоциации основания разделяют на сильные и слабые электролиты.
Сильные электролиты - гидроксиды щелочных и щелочноземельных металлов (раствор Ag2O дает сильно щелочную среду, TlOH – сильный электролит). Все остальные основания – слабые электролиты.
3). Физические свойства.
Все основания, кроме гидроксида аммония, твердые вещества, имеющие различную растворимость в воде. Гидроксиды щелочных и щелочноземельных металлов хорошо растворимы в воде (кроме Ca(OH)2), большинство оснований в воде нерастворимо.
4). Способы получения.
Гидроксиды щелочных и щелочноземельных металлов получают при взаимодействии соответствующего металла или оксида с водой:
Ca + 2h3O Ca(OH)2 + h3
CaO + h3O Ca(OH)2
В промышленности щелочи получают электролизом растворов солей:
2NaCl + 2h3O h3+ 2NaOH + Cl2
Нерастворимые основания получают из солей:
ZnCl2 + 2NaOH(недостаток) Zn(OH)2 + 2NaCl
studfiles.net
Химический сайт - Общие схемы реакций
Что такое Химия? На древнеегипетском слово chemi означало темный, таинственный. И действительно, в те времена химия являлась чем-то таинственным, необъяснимым. Все реакции, которые удавалось воспроизвести алхимикам приписывали к действию темных сил.
В настоящее время химия разделилась на несколько поднаук: неорганическая химия, органическая, биохимия, физическая химия, коллоидная химия, квантовая химия.
Из них выделяют два важнейшие раздела – органическую и неорганическую химию. Неорганическая химия (если выразиться по-простому) – химия неживой природы. Изучает минеральные вещества, созданные неживой природой. Выделяют несколько классов веществ в неорганической химии: Кислоты (минеральные), основания, соли, оксиды, пероксиды, металлы и неметаллы. Все эти классы между собой вступают в реакции, которые можно отобразить в следующих схемах:
Кислота + основание = соль + вода (Реакция нейтрализации)
HCl + NaOH = NaCl + h3O
Причем кислоты реагируют как и с растворимыми основаниями (щелочами), так и с нерастворимыми, при условии, что образуется растворимая соль
h3SO4 + Cu(OH)2 = CuSO4 + 2h3O
Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + h3O
(В этом правиле существует исключение: плавиковая кислота реагирует с диоксидом кремния (кислотным оксидом))6HF + SiO2 = h3[SiF6]+2h3O
Кислота + металл = соль + водород
2HCl + Zn = ZnCl2 + h3 (газ)
На это правило распространяется ограничение:
1) Кислоты реагируют с металлами, стоящими в ряду напряжений металлов до водорода (Исключение составляют концентрированная серная и азотная кислота любой концентрации)
2) При реакции метала с кислотой должна получиться растворимая соль
3) На щелочные металлы правило распространяется частично т.к эта реакция проходит в растворе (щелочные металлы взаимодействуют с водой)
Исключения: Cu + 2h3SO4 (конц.) = CuSO4 + SO2 (газ) + 2h3O
4Zn + 5h3SO4 (конц.) = 4ZnSO4 + h3S(газ) + 4h3O
8HNO3 (разб) + 3Cu = 3Cu(NO3)2 + 2NO (газ) + 4h3O
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 (газ) + 2h3O
Zn + 4HNO3(конц.) =(t) Zn(NO3)2 + 2NO2 (газ) + 2h3O4Zn + 10HNO3 (разб.) =(t) 4Zn(NO3)2 + N2O (газ) + 5h3O
4Zn + 10HNO3 (сильно разб) =(t) 4Zn(NO3)2 + Nh5NO3 + 3h3O
12HNO3(сильно разб) + 5Fe = 5Fe(NO3)2 + N2 (газ) + 6h3O
Кислота + соль = новая кислота + новая сольh3SO4 + BaCl2 = BaSO4 (осадок) + 2HCl
Для осуществления этой реакции необходимо, чтобы кислота, получающаяся в итоге, была либо летуча (или нерастворима например кремниевая). Или соль, получающаяся в итоге выпадала в осадок
Соль1 + Соль2 = Соль3 + Соль4
Na2CO3 + Ca(NO3)2 = 2NaNO3 + CaCO3
(Следует напомнить, что при составлении таких реакций следует руководствоваться правилом протекания реакций. В данном случае исходные соли должны быть хорошо растворимы, а одна из образующихся должна выпадать в осадок)
Основание + кислота = соль + вода (см. выше)
Основание + кислотный оксид = соль + вода
2NaOH + CO2 = Na 2CO3 +h3O
В эту реакцию вступают только растворимые основания
Основание + соль = новое основание + новая соль
KOH + CuSO4 = K2SO 4 + Cu(OH)2 (осадок)
Правило распространяется только на реакцию с растворимыми основаниями
Кислотный оксид + вода = кислота
SO3 + h3O = h3SO4
На диоксид кремния (SiO2 ) правило не распространяется т.к. этот оксид водой не гидратируется
Кислотный оксид + основный оксид = соль
SO2 + Li2O = Li2SO3
Кислотный оксид + основание = соль + вода (см. выше)
Основный оксид + вода = основание
K2O + h3O = 2KOH
Правило распространяется только на те реакции, в результате которых получается растворимое основание (т.е щелочь)
Основный оксид + кислота = соль + вода (см. выше)
Основный оксид + кислотный оксид = соль (см. выше)
Металл + кислота = соль + водород (см. выше)
Металл + неметалл = соединение ( соль, оксид, пероксид)
2Na + Cl2 = 2NaCl (соль)
2Mg + O2 = 2MgO (оксид)
2Na + O2 = Na2O2 (пероксид)
При составлении некоторых уравнений химических реакций следует руководствоваться следующим правилом: Реакция практически осуществима, если в результате реакции образуется газ, осадок или вода (малодиссоциирующее соединение)
xumich.ucoz.ru
Оксиды, их классификация, взаимодействие с водой, кислотами и щелочами. Взаимодействие между
Оксиды -это сложные вещества, состоящие из кислорода и какого нибудь другого элемента. Название оксидов образуется от названия элемента, входящего в состав оксида. Например, BaO - оксид бария. Если образующий оксид элемент имеет переменную валентность, то после названия элемента в скобках указывается его валентность римской цифрой. Например, FeO - оксид железа (I), Fe₂О₃ - оксид железа (III). Общая формула оксидов: ЭхОу. Оксиды классифицируют: несолеобразующие, основные, амфотерные и кислотные.1. Не солеобразующие оксиды:оксиды CO, NO,N2O, SiO, S₂O не соответствуют никаким кислотным гидроксидам и они не образуют солей, в состав которых входили бы C⁺², N⁺², N⁺¹,Si⁺², Si⁺¹. Поэтому оксиды CO, NO, N₂O, SiO, S₂O называют несолеобразующими. Но совсем безразличными нельзя назвать оксид азота(lV) и оксид углерода(ll):Не существует кислот или солей, в которых бы содержался N⁺⁴ диоксид азота N⁺⁴O₂, но он реагируя со щелочами , образует сразу две соли, содержащие N⁺³ и N⁺⁵:2N⁺⁴O₂ + 2NaOH = NaN⁺³O₂ + NaN⁺⁵O₃ + H₂OОксид углерода(ll)СО не совсем относится к несооеобразующим оксидам ,так как он взаимодействует с щелочами с образованием формиата .NaOH+CO⇒HCONaНа солнечном свету или в присутствии активного угля соединяется с хлором, образуя ядовитый газ фосгенСО + Сl2 = COCl2Соедединяется. со многими металлами, образуя карбонилы Fe(CO)₅, Ni(CO)₄CO хороший восстановитель, ядовит. Соединяется с гемоглобином крови делает его неспособным переносить кислород от легких к тканям. Человек от этого погибает.Остальные оксиды можно назвать безразличные или индиферрентными оксидами: N₂O, SiO, S₂O
2. Основные оксиды, состоят из металла и кислорода. Общая формула основных оксидов MexOу. Например, Na₂O MgO CaO BaO FeO. Основным оксидам соответствуют основания: NaOH Mg(OH)₂ Ca(OH₂) Ba(OH)₂ Fe(OH)₂ Основные оксиды щелочных и щелочноземельных металлов растворимы в воде: Na₂O + H₂O= 2NaOH +2H₂ Основные оксиды взаимодействуют: с кислотами с образованиям соли и воды: MgO +2HCI= MaCI₂ +H₂O с кислотными оксидами с образованием соли: CaO+CO₂=CaCO₃3. Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. Соединения этих оксидов с водой могут иметь кислотные и основные свойства одновременно, например - Al₂O₃, Cr₂O₃, MnO₂; Fe₂O₃ ZnO. К примеру, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом натрия:ZnO + 2HCl = ZnCl₂ + H₂O ZnO + 2NaOH = Na₂ZnO₂ + H₂OУ различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) - Fe₂O₃ - обладает преимущественно основными свойствами.4. Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Кислотные оксиды также называются ангидридами кислот. Кислотными являются оксиды типичных неметаллов, а также оксиды ряда металлов в высших степенях окисления (B₂O₃; N₂O₅).Многие кислотные оксиды соединяются с водой, образуя кислоты:N₂O₃+ H₂O = 2HNO₂SO₃ + H₂O = H₂SO₄Не все ангидриды реагируют с водой, в этом случае соответствующие им кислоты добываются косвенным путем.Кислотные оксиды реагируют с основными оксидами с образованием соли:CO₂ + CaO = CaCO₃Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду:CO₂ + Ba(ОН)₂= BaCO₃ + H₂O5.Способы получения оксидов из простых веществ - это либо прямая реакция элемента с кислородом:2Ca + O₂ = 2CaO S+ O₂=SO₂4AI + 3O₂= 2AI₂O₃либо разложение сложных веществ:а) оксидов4CrO₃ = 2Cr₂O₃ + 3O₂б) гидроксидовCa(OH)₂ = CaO + H₂Oв) кислотH₂CO₃ = H₂O + CO₂г) солейCaCO₃ = CaO +CO₂А также взаимодействие кислот - окислителей с металлами и неметаллами:
Cu + 4HNO3(конц) = Cu(NO₃) ₂ + 2NO₂ + 2H₂Oznanija.com





















