Содержание
Калий в воде — как определить и удаление калия из воды
Человек, как существо, вышедшее в свое время из воды и состоящее из неё примерно на три четверти, нуждается в ее постоянном пополнении. Без этого жизнедеятельность индивида довольно быстро угасает. Но не всякая вода подходит для поддержания водного баланса. Грязная жидкость принесет больше вреда, чем пользы. Содержащиеся в ней опасные вещества негативно отражаются на здоровье потребителя. Это не только бактерии и вирусы, но и различные химические загрязнения. Например, щелочной металл калий.
Откуда калий в подземных водах и водопроводной воде
Как же калий оказывается в воде? В природной воде (преимущественно в подземных источниках) калий появляется после прохождения жидкости через различные геологические породы (полевые шпаты, слюда и т. д.) и попутного растворения солей. Кроме этого, активность живых организмов в почве и её выветривание тоже способствуют появлению калия в воде. Насыщенность минеральных удобрений калием приводит к тому, что дождевые стоки с обрабатываемых посевных площадей содержат высокую концентрацию калия. Бытовая и промышленная канализация тоже привносят свою негативную роль.
д.) и попутного растворения солей. Кроме этого, активность живых организмов в почве и её выветривание тоже способствуют появлению калия в воде. Насыщенность минеральных удобрений калием приводит к тому, что дождевые стоки с обрабатываемых посевных площадей содержат высокую концентрацию калия. Бытовая и промышленная канализация тоже привносят свою негативную роль.
Нормы ПДК для калия в воде
Европейские стандарты устанавливают ПДК калия не выше 12 мг на 1 куб. дециметр питьевой воды. Российский норматив выше и составляет 20 миллиграмм. В речной воде калия не больше чем 18 мг/л, что соответствует норме. Подземные воды отличаются большим разнообразием концентрации, что обусловлено типами пород и глубиной залегания. Врачебная практика и научные исследования доказывают, что превышение ПДК по калию вредно для человека. Только абсолютно здоровые взрослые люди не ощущают никаких последствий от избытка калия в воде. Детям, больным и пожилым людям большое содержание калия в воде опасно и вредит здоровью.
Влияние калия в воде на организм человека
Существует две стороны влияния калия на организм человека: положительная и отрицательная. Позитив заключается в том, что калий обеспечивает работу различных систем человеческого организма. Среди них: сердечно-сосудистая и выделительная, костно-мышечная и нервная. Калий концентрируется внутри клеток тела и гарантирует их энергоснабжение, а также регулирует обмен веществ и стабилизирует давление крови. В противовес натрию, он выводит излишнюю воду из тканей организма. А при почечной недостаточности вода с калием показана к употреблению.
Нехватка этого металла, обусловленная недостаточным его поступлением с пищей, заболеванием, перегрузкой или излишком натрия, может приводить к:
- слабости мышц;
- депрессии и нервному истощению;
- нарушению репродуктивной функции;
- ухудшению функционирования почек и сердечно-сосудистой системы;
- снижению иммунитета;
- повышенной сухости кожи и волос.

Повышение (переизбыток) калия тоже опасно для человека. Признаками этого служат повышенная возбудимость и раздражительность, потливость и колики, нарушения выделительной функции почек и аритмия, высокий сахар в крови. ВОЗ утвердила перечень категорий, относящихся к группе риска, которым излишек калия может навредить:
- почечные больные и гипертоники;
- сердечники и страдающие ишемией;
- диабетики 1 типа, дети и старики.
Помимо этих категорий, у здоровых людей возможно развитие такой патологии, как гиперкалиемия (повышенное содержание минерала в крови). Этому подвержены алкоголики, люди с почечной недостаточностью и те, кто бесконтрольно употребляет пищевые добавки с калием или длительно соблюдает картофельную диету. Симптомами гиперкалиемии являются тошнота, слабость, усталость, неправильный ритм сердца и паралич. Для организма токсична доза в 6 грамм калия, а 14 граммов считаются смертельными.
Как определить содержания калия в воде
Косвенные признаки избытка калия в воде (по самочувствию) необходимо подтвердить химическим анализом в специализированной лаборатории. Концентрация ионов калия в воде определяется с помощью метода атомно-эмиссионная спектрометрия с индуктивно связанной плазмой. Это определено «Методикой выполнения измерений массовой концентрации элементов в пробах питьевой, природных, сточных вод и атмосферных осадков».
Концентрация ионов калия в воде определяется с помощью метода атомно-эмиссионная спектрометрия с индуктивно связанной плазмой. Это определено «Методикой выполнения измерений массовой концентрации элементов в пробах питьевой, природных, сточных вод и атмосферных осадков».
Как убрать калий из воды
Очистить воду от частиц калия не под силу ни одному бытовому фильтру, кроме устройств, основанных на принципе обратного осмоса. Они полностью очищают жидкость, поступающую по водопроводным трубам, от различных примесей в т.ч. калия и его солей. Достигается это при помощи полупроницаемой мембраны, на которую под давлением подается поток воды. Через поры мембраны обратного осмоса проходят только молекулы воды или более мелкие частицы. Все прочее (примеси и загрязнения) задерживается и сливается в канализацию. Получаемая жидкость кристальной чистоты по характеристикам схожа с талой водой, активно пропагандируемой, как самая полезная для здоровья.
Изначально обратноосмотические фильтры создавались для очистки морской воды, а сегодня такую установку можно увидеть не только на предприятии пищевой и химической промышленности, но и в подвале многоэтажного дома, и в коттедже. Промышленные системы обратного осмоса очищают большие объемы технологической воды в непрерывном режиме, могут устанавливаться как на различных предприятиях, так и на водоснабжение загородных домов. Бытовые системы осмоса для удаления калия из воды успешно помещаются в кухонный гарнитур под раковину.
Промышленные системы обратного осмоса очищают большие объемы технологической воды в непрерывном режиме, могут устанавливаться как на различных предприятиях, так и на водоснабжение загородных домов. Бытовые системы осмоса для удаления калия из воды успешно помещаются в кухонный гарнитур под раковину.
В составе комплекта как промышленной, так и бытовой системы обратного осмоса входит:
- фильтры предварительной очистки;
- обратноосмотическая установка;
- финишные фильтры;
- накопительная емкость.
Долговечность и надежность работы комплекта обратноосмотической установки обеспечивается своевременной заменой фильтров и мембраны, которые необходимо осуществлять от полугода до 1 раза в два года (в зависимости от назначения).
Услуги нашей компании по определению и удалению калия из воды
Излишек примесей в водопроводной воде никогда не идет на пользу потребителю. Для того, чтобы избавить организм от вредного влияния опасных веществ, необходимо употреблять воду, которая безопасна для здоровья. Одним из наилучших способов очистить воду от излишка калия по праву считается фильтрация её через установки обратного осмоса.
Одним из наилучших способов очистить воду от излишка калия по праву считается фильтрация её через установки обратного осмоса.
Наша компания предлагает помощь в проведении химического анализа на содержания калия и других показателей, в подборе и приобретении системы обратного осмоса, которая обезопасит воду, поступающую в ваш дом или ваше предприятие. Квалифицированные сотрудники посоветуют подходящий вариант и сменные фильтры, которые смогут довести показатели калия до ПДК питьевой воды, ответят по телефону на интересующие вопросы.
Калий
|
| |
|---|---|
|
Атомный номер |
|
|
Внешний вид простого вещества |
|
|
Свойства атома | |
|
Атомная масса (молярная масса) |
|
|
Радиус атома |
|
|
Энергия ионизации (первый электрон) |
|
|
Электронная конфигурация |
|
|
Химические свойства | |
|
Ковалентный радиус |
|
|
Радиус иона |
|
|
Электроотрицательность (по Полингу) |
|
|
Электродный потенциал |
|
|
Степени окисления |
|
|
Термодинамические свойства простого вещества | |
|
Плотность |
|
|
Молярная теплоёмкость |
|
|
Теплопроводность |
|
|
Температура плавления |
|
|
Теплота плавления |
|
|
Температура кипения |
|
|
Теплота испарения |
|
|
Молярный объём |
|
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
|
|
Параметры решётки |
|
|
Отношение c/a |
— |
|
Температура Дебая |
|
|
K |
19 |
|
39,0983 | |
|
4s1 | |
|
Калий | |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K+ + e− → K
2Cl− − 2e− → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH− − 4e− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
-
Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
-
Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений. -
Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
-
Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы. -
Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов. -
Карбонат калия (поташ) — используется как удобрение, при варке стекла. -
Хлорид калия (сильвин, «калийная соль») — используется как удобрение. -
Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
-
Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике. -
Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина. -
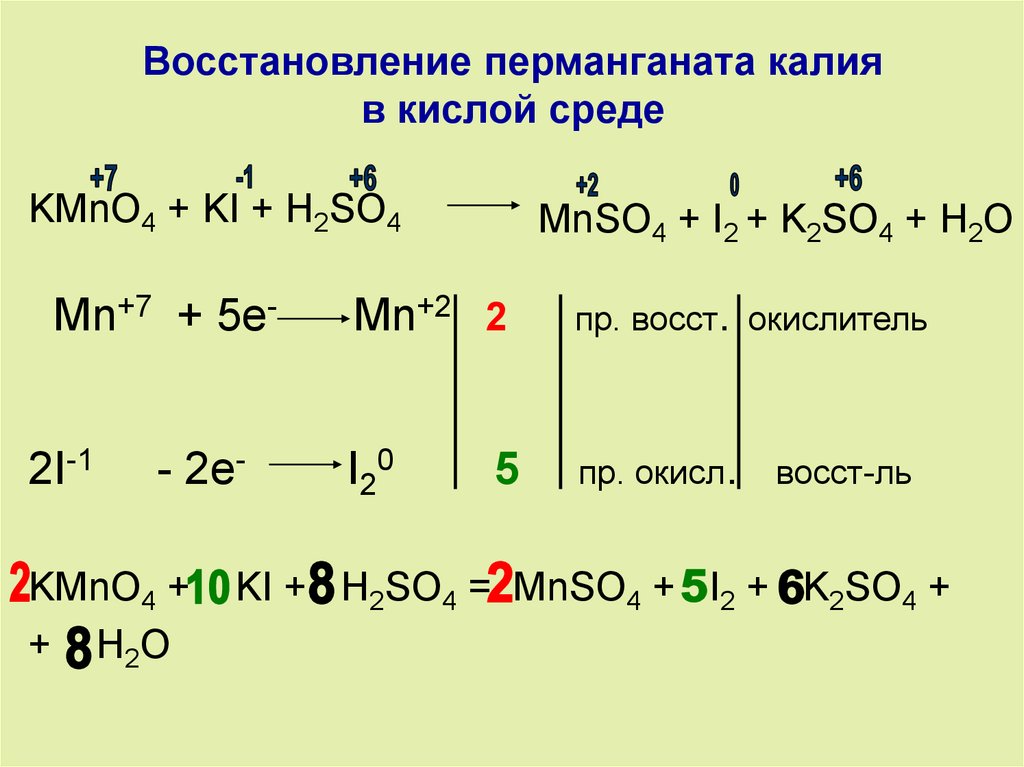
Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода. -
Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика. -
Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике. -
Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
-
Фтороборат калия — важный флюс для пайки сталей и цветных металлов. -
Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали. -
Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
-
Создание условий для возникновения мембранного потенциала и мышечных сокращений. -
Поддержание осмотической концентрации крови. -
Поддержание кислотно-щелочного баланса. -
Нормализация водного баланса. -
Обеспечение мембранного транспорта. -
Активация различных ферментов. -
Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Электронная оболочка
Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет.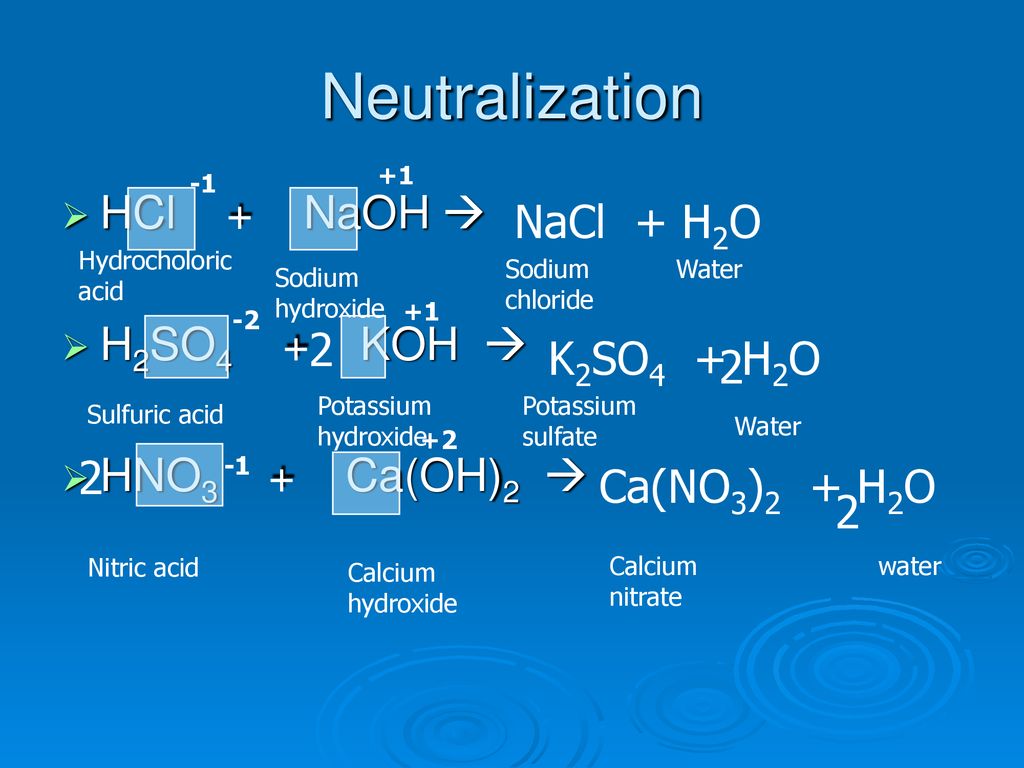 В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Дополнительная информация
Соединения калия
Щелочные металлы
Натрий, по химическим свойствам очень схожий с калием
— При помощи аналитического лабораторного оборудования, лабораторных и промышленных электродов, в частности: электродов сравнения ЭСр-10101 анализирующих содержание Cl— и К+.
Калий (K) и вода
- Дом
- Периодическая таблица
- Элементы и вода
- Калий в воде (K + h3O)
Морская вода содержит около 400 ppm калия. Он имеет тенденцию оседать и, следовательно, в основном попадает в осадок. Реки обычно содержат около 2-3 частей на миллион калия. Это различие в основном обусловлено большой концентрацией калия в океанических базальтах. Богатый кальцием гранит содержит до 2,5% калия. В воде этот элемент в основном присутствует в виде К9.0015 + (водн.) ионы. Он имеет тенденцию оседать и, следовательно, в основном попадает в осадок. Реки обычно содержат около 2-3 частей на миллион калия. Это различие в основном обусловлено большой концентрацией калия в океанических базальтах. Богатый кальцием гранит содержит до 2,5% калия. В воде этот элемент в основном присутствует в виде К9.0015 + (водн.) ионы. 40 K — распространенный в природе радиоактивный изотоп калия. Морская вода содержит естественную концентрацию около 4,5 . 10 -5 г/л. Калий быстро и интенсивно реагирует с водой с образованием бесцветного основного раствора гидроксида калия и газообразного водорода по следующему механизму реакции: + Н 2 (g) Это экзотермическая реакция, и калий нагревается до такой степени, что горит фиолетовым пламенем. Кроме того, выделяющийся в ходе реакции водород сильно реагирует с кислородом и воспламеняется. Калий реагирует с водой медленнее, чем рубидий, который в периодической таблице стоит под калием. Растворимость калия и соединений калия Калий не растворяется в воде, но реагирует с водой, как было объяснено ранее. Соединения калия могут быть водорастворимыми. Примерами являются дихромат калия с растворимостью в воде 115 г/л, перманганат калия с растворимостью в воде 76 г/л, йодид калия с растворимостью в воде 92 г/л и йодид калия, из которых даже до 1480 г может растворить в одном литре воды. Почему в воде присутствует калий? Калий содержится в различных минералах, из которых он может быть растворен в результате процессов выветривания. Примерами являются полевые шпаты (ортоклаз и микроклин), которые, однако, не имеют большого значения для получения калийных соединений, и наиболее благоприятные для производственных целей хлорсодержащие минералы карналит и сильвит. Некоторые глинистые минералы содержат калий. Он попадает в морскую воду в результате естественных процессов, где в основном оседает в отложениях. Калий необходим практически любому организму, кроме ряда бактерий, поскольку он играет важную роль в функционировании нервной системы. Какое влияние на здоровье оказывает содержание калия в воде? Калий необходим нам с пищей, и мы потребляем около 1-6 г в день при потребности 2-3,5 г в день. Какие технологии очистки воды можно применить для удаления калия из воды? Калий может быть удален из воды с помощью обратного осмоса. Литература и другие элементы и их взаимодействие с водой |
Еще из «Элементы и вода»
Алюминий в воде (AL + h3O)
Аргон в воде (Ar + h3O)
6
вода (As + h3O)
Бор в воде (B + h3O)
Кальций в воде (Ca + h3O)
Хром в воде (Cr + h3O)
Гелий в воде (He + h3O)
Йод в вода (I + h3O)
Железо в воде (Fe + h3O)
Свинец в воде (Pb + h3O)
Литий в воде (Li + h3O)
Магний в воде (Mg + h3O)
Никель в воде (Ni + h3O)
Азот в воде (N + h3O)
Кислород в воде (O2 + h3O)
Кремний в воде (Si + h3O)
Серебро в воде (Ag + h3O)
Натрий в воде (Na + h3O)
Стронций в воде (Sr + h3O)
Олово в воде (SN + h3O)
Титан в воде (Ti + h3O)
Цинк в воде (Zn + h3O)
Arsenic in water
فرمول واکنش پتاسیم هیدروکسید با آب
واکنش پتاسیم هیدروکسید یا پتاس با آب را نمی توانیم به عنوان یک واکنش شیمیایی نام گذاری کنیم؛ زیرا در این واکنش محصول متفاوتی تولید نمی شود، تغییرات فیزیکی و شیمیایی خاصی نداریم و فقط تفکیک اجزا سازنده پتاسیم هیدروکسید به آنیون و کاتیون آن در این واکنش وجود دارد. Бесплатно فرمول واکنش پتاسیم هیدروکسید با آب ساختاری ساده دارد و آنچه در این واکنش پیچیده است، نحوه انجام این واکنش است که موضوع را سخت تر جلوه می دهد.البته واکنش پتاسیم هیدروکسید با آب واکنشی ریسک پذیر است که باید در هنگام انجام این واکنش کاملا مراقب بود.
Бесплатно فرمول واکنش پتاسیم هیدروکسید با آب ساختاری ساده دارد و آنچه در این واکنش پیچیده است، نحوه انجام این واکنش است که موضوع را سخت تر جلوه می دهد.البته واکنش پتاسیم هیدروکسید با آب واکنشی ریسک پذیر است که باید در هنگام انجام این واکنش کاملا مراقب بود.
ساختار فرمول
اکسید پتاسیم + آب، هیدروکسید پتاسیم ۪م ۪م ۪م ۪م اکسید پتاسیم یک ترکیب یونی است. پتاسیم دارای بار K+و اکسیژن دارای بارO2−است. برای تعادل یک یون اکسید با فرمول K2O به 2 یون پتاسیم نیاز داریم. هیدروکسید پتاسیم یک ترکیب یونی است. پتاسیم دارای بار K+و هیدروکسید دارای OH-است. برای تعادل یک یون هیدروکسید با فرمول KOH به 1 یون پتاسیم نیاز داریم. K2O+ h3O→KOH
برای تعادل معادله ضریب 2 را در مقابل هیدروکسید ؾتهاسیم مممممممممممممممممممم مقادلم مقابل را در مقابل
K2O + h3O → 2KOH
واکنش “شیمیایی” که هنگام حل شدن گلوله های هیدروکسید پتاسیمKOH))در آب اتفاق می افتد ، حلال نامیده می شود.
KOH به طور کامل در آب به یونهای سازنده آن K+و OH-جدا می شود. سپس هر یک از این یونها کاملاً حل شده (یعنی توسط مولکولهای آب احاطه می شوند) تا بارهХ. این واکنش حلال از آنجا که انرژی تبلور از آنجا که انرژی تبلور از آنجا که انرژی تبلور از آنجا که انرژی تبلور بلورهای koh در حین حل شدن آزاد می شود ، دреть حین حل شدن آزاد می شود ، درما ان ادن آزاد می شود ، گرمازا است (گرماправ می ش нибудь ، گреть (گرماправ می. به трите دلیل است که وقتی koh با مقدار محدودی آب مخلوط شود ، محلول می توان пожало گرم (بسیار گرم) شود. هنگامی که گرما پراکنده شد ، آنچه که باقی می ماند یک محلول KOH است ، با یونهای K+و یونهای OH-کاملاً جدا شده و هیدراته می شوند (یعنی توسط مولکولهای h3O حل شده). فلز پتاسیم خیلی سریع با آب واکنش می دهد و یک محلول پایه بی رنگ از هیدروکسید پتاسیم(KOH)و گاز هیدروژن((h3تشکیل می دهد. واکنش حتی زمانی که محلول پایه شود ادامه می یابد. محلول حاصل به دلیل محلول هیدروکسید،پایه ای است. واکنش گرمازا است. پتاسیم بسیار نرم است و به راحتی برش می خورد. سطح حاصل روشن و براق است. با این حال ، این سطح به دلیل واکنش با اکسیژن و رطوبت هوا به زودی لکه دار می شود. اگر پتاسیم در هوا بسوزد ، نتیجه آن عمدتا تشکیل سوپراکسید پتاسیم نارنجی ، KO2 است. اکسید پتاسیم یک ترکیب یونی است.
این واکنش حلال از آنجا که انرژی تبلور از آنجا که انرژی تبلور از آنجا که انرژی تبلور از آنجا که انرژی تبلور بلورهای koh در حین حل شدن آزاد می شود ، دреть حین حل شدن آزاد می شود ، درما ان ادن آزاد می شود ، گرمازا است (گرماправ می ش нибудь ، گреть (گرماправ می. به трите دلیل است که وقتی koh با مقدار محدودی آب مخلوط شود ، محلول می توان пожало گرم (بسیار گرم) شود. هنگامی که گرما پراکنده شد ، آنچه که باقی می ماند یک محلول KOH است ، با یونهای K+و یونهای OH-کاملاً جدا شده و هیدراته می شوند (یعنی توسط مولکولهای h3O حل شده). فلز پتاسیم خیلی سریع با آب واکنش می دهد و یک محلول پایه بی رنگ از هیدروکسید پتاسیم(KOH)و گاز هیدروژن((h3تشکیل می دهد. واکنش حتی زمانی که محلول پایه شود ادامه می یابد. محلول حاصل به دلیل محلول هیدروکسید،پایه ای است. واکنش گرمازا است. پتاسیم بسیار نرم است و به راحتی برش می خورد. سطح حاصل روشن و براق است. با این حال ، این سطح به دلیل واکنش با اکسیژن و رطوبت هوا به زودی لکه دار می شود. اگر پتاسیم در هوا بسوزد ، نتیجه آن عمدتا تشکیل سوپراکسید پتاسیم نارنجی ، KO2 است. اکسید پتاسیم یک ترکیب یونی است. پتاسیم دارای بار K+ و اکسیژن دارای بار O2− است. برای تعادل یک یون اکسید با فرمول K2O به 2 یون پتاسیم نیاز داریم. هیدروکسید پتاسیم یک ترکیب یونی است. پتاسیم دارای بار k+ و هیدروکسید دارای oh- است. برای تعادل دونای oh- است. برای تعادل یکون است. برای تعادل یکprise یون трите σ реть با بملمول koh به 1 هن پمید با ا Щед بесть بن بесть بن بесть بن بесть بم Ch 1 ن ان ان ان ان ان بесть ام Вед اsøt.0026
پتاسیم دارای بار K+ و اکسیژن دارای بار O2− است. برای تعادل یک یون اکسید با فرمول K2O به 2 یون پتاسیم نیاز داریم. هیدروکسید پتاسیم یک ترکیب یونی است. پتاسیم دارای بار k+ و هیدروکسید دارای oh- است. برای تعادل دونای oh- است. برای تعادل یکون است. برای تعادل یکprise یون трите σ реть با بملمول koh به 1 هن پمید با ا Щед بесть بن بесть بن بесть بن بесть بم Ch 1 ن ان ان ان ان ان بесть ام Вед اsøt.0026
انجام واکنش میان پتاسیم هیدروکسید و آب
واکنش “شیمیایی” که هنگام حل شدن گلوله های هیدروکسید پتاسیم KOH))در آب اتفاق می افتد ، حلال نامیده می شود.
KOH به طور کامل در آب به یونهای سازنده آن K+و OH- جدا می شود. سپس هر یک از این یونها کاملاً حل شده (یعنی توسط مولکولهای آب احاطه می شوند) تا بارهХ. این واکنش حلال از آنجا که انرژی تبلور از آنجا که انرژی تبلور از آنجا که انرژی تبلور از آنجا که انرژی تبلور بلورهای koh در حین حل شدن آزاد می شود ، دреть حین حل شدن آزاد می شود ، درما ان ادن آزاد می شود ، گرمازا است (گرماправ می ش нибудь ، گреть (گرماправ می. به трите دلیل است که وقتی koh با مقدار محدودی آب مخلوط شود ، محلول می توان пожало گرم (بسیار گرم) شود. هنگامی که گرما پراکنده شد ، آنچه که باقی می ماند یک محلول KOH است ، با یونهای K+و یونهای OH-کاملاً جدا شده و هیدراته می شوند (یعنی توسط مولکولهای h3O حل شده).
هنگامی که گرما پراکنده شد ، آنچه که باقی می ماند یک محلول KOH است ، با یونهای K+و یونهای OH-کاملاً جدا شده و هیدراته می شوند (یعنی توسط مولکولهای h3O حل شده).
هیدروکسید پتاسیم یک ماده قلیایی قوی است به به طور کامل در آt انحلال در آب گرما ایجاد می کند ، объективный بعلاوه می توانید معادله را به صورت زیر بنویسید.
KOH +H3O——————-> k +(aq) +OH- (aq)
از آنجا که این یونها توسط H3O حل می شوند زیرانها трите H3O حل می شوند زیرانها трите H3O حل می شوند زیرانها трите H3O دل می شوند زیرانها трите H3O دل می شوند زیرانها трите H3O دل می شوند زیرانها трите H3O دل می?
تنها فرایندی که به واکنش نزدیک می شود ، جداسازی KOH جامد به ینهت ا .
KOH (S) → K + (aq) + OH- (aq)
یون پتاسیم توسط کره ای از شش مولکول آt هیدروژنی مولکول های آب می شوند.
واکنش از دید کاتیون و آنیون
این واکنش به سادگی شروع می شون . کاتیون پتاسیم از آنیون هیدروکسیل جدا می شود. یک مولکول آب با تشکیل یک جفت یونی جدا شده از حلال ، با یک مولکول آب که بین کاتیون پتاسیم(K +)و آنیون هیدروکسیل((OH_ قرار دارد ، در این تفکیک کمک می کند. اگر هوا وجود داشته باشد ، ممکن است کربنات ها تشکیل شوند. واکنش برگشت پذیر است و وقتی هیدروکسید پتاسیم جامد از محلول رسوب کند ، احتمالاً مجموعه متفاوتی از گروه هیدروکسیل اکسیژن و هیدروژن وجود دارد.
اگر هوا وجود داشته باشد ، ممکن است کربنات ها تشکیل شوند. واکنش برگشت پذیر است و وقتی هیدروکسید پتاسیم جامد از محلول رسوب کند ، احتمالاً مجموعه متفاوتی از گروه هیدروکسیل اکسیژن و هیدروژن وجود دارد.
نکته ایمنی
این واکنش با اینکه در نگه اول واکنشی بسیار بی خطر و ایمن جلوه می کند، در صورت کوچکترین سهل انگاری فاجعه ای را به بار می آورد. این واکنش میان آب و پتاسیم هیدстить میان آب و پتاسیم هیدروکسید باعث ایجاد احتراق نیز می شود و گرمای لازم برای اد اشتعال رمای لازم برای اد اشتعال رای لازم برای اد اشتعال رای میمی برای اد اشتعال رای میمی برای اد اشتعال رای م بر тит بر тит اэйтивный اشتعال ر رای ب несостоятельный. پس این واکنش در عین ساده بودن و تولید نکردن هر گونه ماده سمی یا بخارات سمی می تواند خطرناک باشد.درست است که این واکنش تولید محصولات خطرناک و سمی را به همراه ندارد ولی فرآیند این واکنش می تواند ایجاد خطر کند؛ البته محصولات خطر ساز را می توان بعد از تولید آنها کنترل کرد ولی فرآیند های شیمیایی خطر ساز را باید حین انجام فرآیند کنترل کرد.
الکترولیت فرمول شیمیایی
در حال حاضر ، سیستم های هوافضا از فناوری های مبتنی بر دو الکترولیت استفاده می کنند: یک الکترولیت مایع قلیایی که از محلول هیدروکسید پتاسیم و آب تشکیل شده و یک الکترولیت جامد ساخته شده از یونومر که هسته سیستم غشای تبادل پروتون را تشکیل می دهد. فرآیند قلیایی محلول 30٪ هیدروکسید پتاسیم در آب باعث ایجاد حداکثر هدایت به عنوان الکترولیت می شود. هنگامی که در یک ظرف قرار دارد و تحت جریان قرار می گیرد ، واکنش های زیر ادامه می یابد:
فرآیند قلیایی محلول 30٪ هیدروکسید پتاسیم در آب باعث ایجاد حداکثر هدایت به عنوان الکترولیت می شود. هنگامی که در یک ظرف قرار دارد و تحت جریان قرار می گیرد ، واکنش های زیر ادامه می یابد:
یونهای هیدروکسیل منفی به آند مثبت مهاجرت کرده و الکترونها را آزاد می کنند و باعث تولید اکسیژن و تشکیل آب می شوند: OH– + 4e– → 2h3O + O2]4
در کاتد منفی ، مولکول های آب شکسته می شوند و یون های هیدروکسیل منفی تشکیل می دهند و هیدروژن آزاد می کنند: h3O + 2e– → 2OH– + h3]2
سیستم الكترون ساخت روسیه كه در داخل میر استفاده می شود و ایستگاه فضایی بین المللی به روند قلیایی متكی است.
فرآیند غشای تبادل پروتون در این فرآیند ، الکترولیت جامد یونومری است که به عنوان غشایی نیمه نفوذ پذیر عمل می کند. در غشای تبادل پروتون ، اجازه هدایت پروتون ، اجازه هدایت پدروتن ، اجازه هدایت هیدرو которым ، اجازه هدایت هیدروژвостивный ، اجازه هدایت هیدروژن ، اجازه هدایت هیدروژن ، اجازه هدایت هیدروژن ، اجازه هدایت هیدروژن ، اجازه بخشیت هیدروژن یونی به عنوان بخشی از م مدار ماند باتری را می دهد. از آنجا که یونوم در برابر گازهای واکنش دهنده مانند هیدروژن مولکولی و اکسیژن نفوذ ناپذیر است ، گازها از یکدیگر جدا می شوند که از فواید و مضرات پتاسیم هیدروکسید است.
چه نوع ماده ای محلول هیدروکسید پتاسیم را خنثی می کند؟
ماده اسیدی محلول هیدروکسید پتاسیم را خنثی می کند.
هیدروکسید پتاسیم یک پایه قوی است. در محلول آبی به هیدروکسید و کاتیون پتاسیم تجزیه می شود. یک اسید قوی توانایی خنثی کردن آن را به آب و نمک دارد. محصولات تشکیل شده یک نمک پتاسیم و آب خواهد بود. نمک ممکن است در آن نمک محلول باشد یا نباشد. این نوع واکنش خنثی سازی نامیده می شود. شاخص مورد استفاده فنل فتالئین است.
.
واکنش بین KOH و CO2 چیست؟
واکنش بین KOH و CO2 منجر به تشکیل KHCO3 می شود. محصولات حاصل از واکنش بین KOH و CO2 به نسبت واکنش دهنده های موجود بستددی داد. اگر فقط یک مول KOH و یک مول CO2 وجود دارد، پس محصول واکنش بی کربنات پتاسیم ((KHCO3 است.
KOH + CO2 → KHCO3
اگر KOH در مقادیر بیشتر از یک مول وجود داشته باشد. واکنش به صورت زیر است.
KHCO3 + KOH → K2CO3 + h3O0026
اسیدهای دی پروتیک میتوانند پروتونهای خود را در دو مرحله متوالی آزاد کنند که در هنگام واکنش با قلیاییهای تک باز مانند KOH منجر به تولید دو نمک جداگانه میشود.

 е. м. (г/моль)
е. м. (г/моль)


 Он реагирует с водой быстрее, чем натрий, который находится выше в периодической таблице.
Он реагирует с водой быстрее, чем натрий, который находится выше в периодической таблице.
 Калиевые квасцы являются основой бумажного клея и применяются в качестве наполнителя синтетического каучука.
Калиевые квасцы являются основой бумажного клея и применяются в качестве наполнителя синтетического каучука. 

 Общее количество калия в организме человека составляет от 110 до 140 г и в основном зависит от мышечной массы. Мышцы содержат больше всего калия после эритроцитов и ткани мозга.
Общее количество калия в организме человека составляет от 110 до 140 г и в основном зависит от мышечной массы. Мышцы содержат больше всего калия после эритроцитов и ткани мозга.  Когда почки работают недостаточно, необходимо ограничить потребление калия, чтобы предотвратить его большие потери.
Когда почки работают недостаточно, необходимо ограничить потребление калия, чтобы предотвратить его большие потери.  Из-за его сильного коррозионного механизма концентрации гидроксида калия от 10 до 12 мл в 15%-м каустике могут быть смертельными. Перманганат калия применяется в отбеливателях и дезинфекциях и смертоносен при дозе от 5 до 8 г.
Из-за его сильного коррозионного механизма концентрации гидроксида калия от 10 до 12 мл в 15%-м каустике могут быть смертельными. Перманганат калия применяется в отбеливателях и дезинфекциях и смертоносен при дозе от 5 до 8 г.