Содержание
Изотопный состав воды | это… Что такое Изотопный состав воды?
Изотопный состав воды — процент содержание молекул с различной изотопной массой (изотопологов) в воде. Содержание воды, состоящей из лёгких стабильных изотопов 1H216O («лёгкой воды», в отличие от содержащей повышенное количество тяжелого изотопа водорода 2H «тяжёлой воды») в природной воде составляет 99.73 — 99.76 мол.%. [1][2]
Содержание
|
Изотопика воды
Изотопы — разновидности атомов одного и того же химического элемента, имеющие одинаковые заряд ядра и строение электронных оболочек, различающиеся по массе ядер. Разница масс обусловлена тем, что ядра изотопов содержат одинаковое число протонов p и различное число нейтронов n. Комбинации различных атомов-изотопов дают набор молекул-изотопологов.
Комбинации различных атомов-изотопов дают набор молекул-изотопологов.
Изотопологи — молекулы, различающиеся только по изотопному составу атомов, из которых они состоят. Изотополог имеет в своём составе, по крайней мере, один атом определенного химического элемента, отличающийся по количеству нейтронов от остальных.
Молекула воды состоит из двух атомов водорода и одного атома кислорода.
Водород имеет два стабильных изотопа — протий (Н) — 1H и дейтерий (D) — 2H.
У кислорода три устойчивых изотопа: 16O, 17O и 18O (табл.1).
Таблица 1. Изотопы воды
| Элемент | Водород | Кислород | |||
|---|---|---|---|---|---|
| Изотоп | Н | D | 16O | 17O | 18O |
| Количество протонов в ядре | 1 | 1 | 8 | 8 | 8 |
| Количество нейтронов в ядре | 0 | 1 | 8 | 9 | 10 |
| Атомная масса | 1 | 2 | 16 | 17 | 18 |
Комбинации 5 стабильных изотопов водорода и кислорода дают набор 9 молекул-изотопологов воды (табл. 2).
2).
Таблица 2. Изотопологи воды
| Изотополог | 1H216O | 1HD16O | D216O | 1H217O | 1HD17O | D217O | 1H218O | 1HD18O | D218O |
|---|---|---|---|---|---|---|---|---|---|
| Изотопы водорода | 1H | 1H, D | D | 1H | 1H, D | D | 1H | 1H, D | D |
| Изотопы кислорода | 16O | 16O | 16O | 17O | 17O | 17O | 18O | 18O | 18O |
| Молекулярная масса | 18 | 19 | 20 | 19 | 20 | 21 | 20 | 21 | 22 |
Молекула 1H216O является самой лёгкой из совокупности всех изотопологов воды. Именно воду 1H216O следует считать классической или лёгкой водой.
Именно воду 1H216O следует считать классической или лёгкой водой.
Лёгкая вода как моноизотопная композиция 1H216O является предельным случаем изотопной чистоты. В естественных условиях такой чистой лёгкой воды не существует. Для получения изотополога 1H216O ведут тонкую многостадийную очистку природных вод или синтезируют из исходных элементов 1H2 и 16O2. Природная вода представляет собой многокомпонентную смесь изотопологов. Содержание самого лёгкого изотополога в ней значительно превосходит концентрацию всех остальных вместе взятых. В природных водах в 1000000 молекул в среднем содержится 997284 молекул 1H216O, 311 молекул 1HD16O, 390 молекул 1H217O, и около 2005 молекул 1H218O. Концентрация молекул воды, содержащих тяжёлые изотопы D, 17O, 18O, в природной воде колеблется в пределах, зафиксированных в основных стандартах изотопного состава гидросферы SMOW и SLAP (табл. 3). Весовые количества изотопологов в природной воде рассчитаны на основании данных прямого определения их содержания методом молекулярной спектроскопии [3].
3). Весовые количества изотопологов в природной воде рассчитаны на основании данных прямого определения их содержания методом молекулярной спектроскопии [3].
Таблица 3. Рассчитанные весовые количества изотопологов в природной воде, соответствующие международным стандартам SMOW (средняя молекулярная масса = 18,01528873) и SLAP (средняя молекулярная масса = 18,01491202), [4].
| Изотополог воды | Молекулярная масса | Содержание, г/кг | |
|---|---|---|---|
| SMOW | SLAP | ||
| 1H216O | 18,01056470 | 997,032536356 | 997,317982662 |
| 1HD16O | 19,01684144 | 0,328000097 | 0,187668379 |
| D216O | 20,02311819 | 0,000026900 | 0,000008804 |
| 1H217O | 19,01478127 | 0,411509070 | 0,388988825 |
| 1HD17O | 20,02105801 | 0,000134998 | 0,000072993 |
| D217O | 21,02733476 | 0,000000011 | 0,000000003 |
| 1H218O | 20,01481037 | 2,227063738 | 2,104884332 |
| 1HD18O | 21,02108711 | 0,000728769 | 0,000393984 |
| D218O | 22,02736386 | 0,000000059 | 0,000000018 |
Как видно из таблицы 3, в природной воде весовая концентрация тяжёлых изотопологов может достигать 2,97 г/кг, что является значимой величиной, сопоставимой, например, с содержанием минеральных солей.
Природная вода, близкая по содержанию изотополога 1H216O к стандарту SLAP, а также специально очищенная с существенно увеличенной долей этого изотополога по сравнению со стандартом SLAP, определяется как особо чистая лёгкая вода (менее строгое определение, которое применимо в реальной жизни).
В лёгкой воде доля самого лёгкого изотополога составляет (мол.%): 99.76 < 1H216O ≤ 100.
Если из воды, отвечающей стандарту SMOW, удалить все тяжёлые молекулы, массовое содержание которых составляет 2,97 г/кг и заменить их на 1H216O, то масса 1 л такой лёгкой и изотопно чистой воды уменьшится на 250 мг. Таким образом, параметры лёгкой воды, в первую очередь, её «лёгкость» и изотопный состав поддаются измерению с помощью таких методов, как масс-спектрометрия, гравиметрия, лазерная абсорбционная спектроскопия[5], ЯМР.
Международные стандарты на природные воды различного изотопного состава
Содержание тяжёлых изотопов водорода и кислорода в природных водах определяется двумя международными стандартами, введенными Международным агентством по атомной энергии (МАГАТЭ)[6][7]:
- Стандарт VSMOW (Vienna Standard Mean Ocean Water) определяет изотопный состав глубинной воды Мирового океана.

- Стандарт SLAP (Standard Light Antarctic Precipitation) определяет изотопный состав природной воды из Антарктики.
По международному стандарту VSMOW абсолютное содержание дейтерия и кислорода-18 в океанической воде составляет[8] : D VSMOW /1H VSMOW=(155,76±0,05)·10−6, или 155,76 ppm 18O VSMOW/16O VSMOW =(2005,20±0,45)·10−6, или 2005 ppm. Для стандарта SLAP концентрации в воде составляют[9]: дейтерия D/H=89·10−6 или 89 ppm, кислорода-18 18O/16O=1894·10−6 или 1894 ppm.
Содержание лёгкого изотополога 1H216O в воде, соответствующей по изотопному составу VSMOW, составляет 997,0325 г/кг (99,73 мол. %). Доля самого лёгкого изотополога в воде, соответствующей по изотопному составу SLAP, составляет 997,3179 г/кг (99,76 мол. %).
Стандарт SLAP характеризует самую лёгкую природную воду на Земле. Вода в различных точках земного шара неодинакова по своей лёгкости.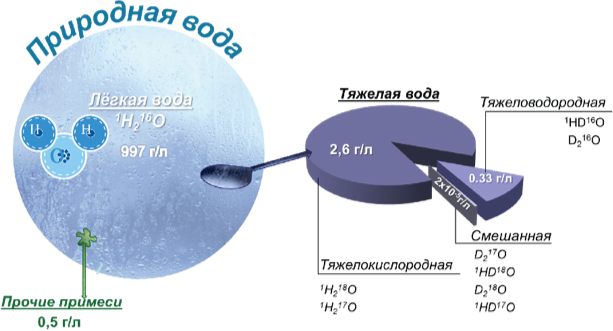
Свойства и эффекты лёгкой воды
Изотопологи отличаются друг от друга по физическим, химическим и биологическим свойствам (табл.4).
Таблица 4. Изменение физических свойств воды при изотопном замещении
| Физические свойства | 1H216O | D216O | 1H218O |
|---|---|---|---|
| Плотность при 20 °C, г/см3 | 0.9970 | 1.1051 | 1.1106 |
| Температура максимальной плотности, °C | 3.98 | 11.24 | 4.30 |
| Температура плавления при 1 атм, °C | 0 | 3.81 | 0.28 |
| Температура кипения при 1 атм, °C | 100 | 101,42 | 100,14 |
| Давление пара при 100 °C, Торр | 760,00 | 721,60 | 758,10 |
| Вязкость при 20 °C, сантипуаз | 1,002 | 1,247 | 1,056 |
Равновесное давление паров у изотопологов воды различается, и весьма существенно.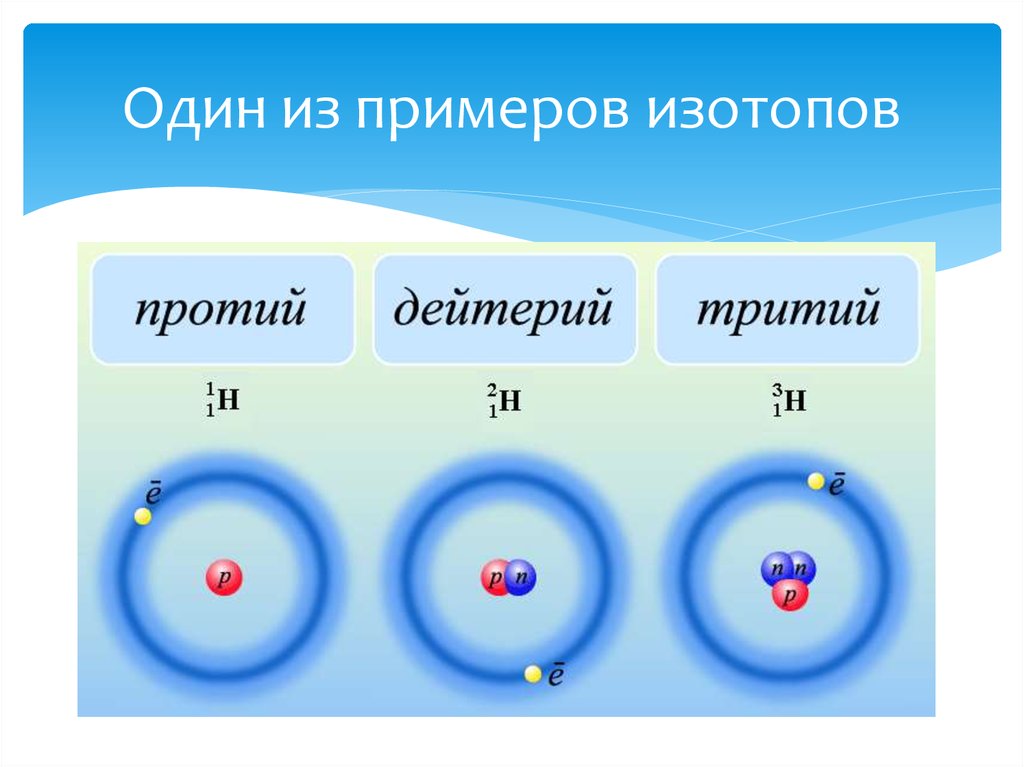 Чем меньше масса молекулы воды, тем выше давление пара, а это означает, что пар, равновесный с водой, всегда обогащён лёгкими изотопами кислорода и водорода. Относительно малой массы элементов разница масс изотопов велика, поэтому они способны сильно фракционировать в природных процессах: D/H → 100 %, 18O/16O →12,5 %. Изотопы водорода и кислорода наиболее эффективно фракционируют в процессах испарения-конденсации и кристаллизации воды.
Чем меньше масса молекулы воды, тем выше давление пара, а это означает, что пар, равновесный с водой, всегда обогащён лёгкими изотопами кислорода и водорода. Относительно малой массы элементов разница масс изотопов велика, поэтому они способны сильно фракционировать в природных процессах: D/H → 100 %, 18O/16O →12,5 %. Изотопы водорода и кислорода наиболее эффективно фракционируют в процессах испарения-конденсации и кристаллизации воды.
Результаты экспериментальных исследований свидетельствуют о различии физико-химических свойств легкой воды и деионизированной воды природного изотопного состава[10].
Тяжёлые изотопологи в природной воде являются примесями по отношению к 1H216O, которые по некоторым исследованиям можно рассматривать как дефекты структуры [11].
Устранение гетерогенности воды по изотопному составу приводит к увеличению её гомогенности. Лёгкая вода является более однородной жидкостью. Тяжелоизотопные молекулы, содержащиеся в воде в природных концентрациях, практически не оказывают заметного влияния на неживые системы. В наибольшей степени эффекты лёгкой воды проявляются на биологических объектах, для которых характерны каскадные реакции.
Тяжелоизотопные молекулы, содержащиеся в воде в природных концентрациях, практически не оказывают заметного влияния на неживые системы. В наибольшей степени эффекты лёгкой воды проявляются на биологических объектах, для которых характерны каскадные реакции.
Реакция биосистем при воздействии на них воды может изменяться в зависимости от количественных и качественных изменений её изотопного состава. В ходе эволюции живых организмов произошёл отбор биохимических процессов с настройкой их только на один изотоп, как правило, лёгкий [12]. В организме человека происходит «фракционирование изотопов, сопровождающееся удалением тяжёлых стабильных изотопов водорода и кислорода воды»[13]. Применение воды с повышенной концентрацией тяжёлых изотопов, в частности, дейтерия, вызывает выраженные токсические эффекты на уровне организма [14][15]. В то же время на разных объектах зарегистрирована положительная биологическая активность вод с пониженным, относительно природного, содержанием тяжелых изотопологов, в частности дейтерия и кислорода 18[16][17]. Проводимые в ГНЦ РФ «Институт медико-биологических проблем» РАН систематические исследования по созданию среды обитания космонавтов с оптимальным изотопным составом биогенных химических элементов показали, что вода с пониженным по сравнению с природным содержанием тяжелоизотопных молекул является необходимым компонентом системы жизнеобеспечения космонавтов во время длительных полётов [18]
Проводимые в ГНЦ РФ «Институт медико-биологических проблем» РАН систематические исследования по созданию среды обитания космонавтов с оптимальным изотопным составом биогенных химических элементов показали, что вода с пониженным по сравнению с природным содержанием тяжелоизотопных молекул является необходимым компонентом системы жизнеобеспечения космонавтов во время длительных полётов [18]
Биологические свойства
В качестве универсальной среды, в которой идут все биологические реакции, лёгкая вода увеличивает скорость этих реакций по сравнению с водой природного изотопного состава. Этот эффект известен под названием кинетический изотопный эффект растворителя [19].
Транспортные свойства легкой воды доказаны при изучении влияния тяжелых изотопологов в составе природной воды на динамику выведения красителя метиленового синего из обонятельной системы шпорцевых лягушек [20].
Наиболее сильное влияние очистка воды от тяжёлых изотопологов оказывает на энергетический аппарат живой клетки. Дыхательную цепь митохондрий отличают каскадные реакции. Тяжёлые изотопологи замедляют скорость реакций дыхательной цепи. На примере реакции генерации перекиси водорода митохондриями с янтарной кислотой в качестве субстрата экспериментально доказан общий ингибирующий эффект тяжёлых изотопологов воды. Снижение их содержания в воде до уровня ниже природных концентраций деингибирует и достоверно ускоряет исследованную реакцию [21].
Дыхательную цепь митохондрий отличают каскадные реакции. Тяжёлые изотопологи замедляют скорость реакций дыхательной цепи. На примере реакции генерации перекиси водорода митохондриями с янтарной кислотой в качестве субстрата экспериментально доказан общий ингибирующий эффект тяжёлых изотопологов воды. Снижение их содержания в воде до уровня ниже природных концентраций деингибирует и достоверно ускоряет исследованную реакцию [21].
Лёгкая вода проявляет противоопухолевую активность, что показано в работах учёных, проводимых в исследовательских центрах разных стран [22][23][24][25]. По данным Г.Шомлаи, результаты клинических испытаний, проведённых в 1994—2001 гг. в Венгрии, показали, что уровень выживаемости больных, употреблявших лёгкую воду в сочетании с традиционными методами лечения или после них выше, чем у больных, использовавших только химио- или лучевую терапию [26].
Токсикопротекторные свойства легкой воды подтверждены экспериментальными исследованиями [27] , из которых следует, что легкая вода, очищенная от тяжелых изотопологов, за счет своих транспортных свойств эффективно выводит токсины и продукты метаболизма из организма.
См. также
- Вода
- Тяжёлая вода
Примечания
- ↑ Кульский Л. А., Даль В. В., Ленчина Л. Вода знакомая и загадочная.- Киев: «Радянська школа», 1982.- 120 с.
- ↑ Петрянов-Соколов И. В. Самое необычное вещество в мире.// Химия и жизнь. 2007. № 1. с.26.
- ↑ Rothman et al., J. Quant. Spectrosc. Radiat. Transfer, 1998, 60, 665. Rothman et al., J. Quant. Spectrosc. Radiat. Transfer, 2003, 82, p.9.
- ↑ Патент RU 2295493. «Способ и установка для производства лёгкой воды». Соловьев С. П.
- ↑ Lis G., Wassenaar L. I., Hendry M. J. High-Precision Laser Spectroscopy D/H and 18O/16O Measurements of Microliter Natural Water Samples.// Anal. Chem. 2008. V. 80 (1). P. 287—293
- ↑ Ферронский В. И., Поляков В. А. Изотопия гидросферы. М.: Наука, 1983 г.
- ↑ Craig, H. Standard for Reporting Concentrations of Deuterium and Oxygen-18 in Natural Waters.
 // Science. 1961. V. 133. PP. 1833−1834.
// Science. 1961. V. 133. PP. 1833−1834. - ↑ Hagemann R., Niff G., Roth E. Absolute isotopic scale for deuterium analysis of natural waters. Absolute D/H ratio for SMOW. // Tellus. 1970. V.22. N6. PP.712-715.
- ↑ De Wit J.C., van der Straaten C.M.; Mook W.G. Determination of the Absolute Hydrogen Isotopic Ratio of VSMOW and SLAP. // Geostandards Newsletter. 1980. V. 4. N. 1. PP. 33−36.
- ↑ V.V. Goncharuk, V.B. Lapshin, T.N. Burdeinaya, T.V. Pleteneva, A.S. Chernopyatko et al. Physicochemical Properties and Biological Activity of the Water Depleted of Heavy Isotopes // 2011, published in Khimiya i Tekhnologiya Vody, 2011, Vol. 33, No. 1, pp. 15–25. Journal of Water Chemistry and Technology, 2011, Vol. 33, No. 1, pp. 8–13.
- ↑ Смирнов А. Н., Лапшин В. Б., Балышев А. В., Лебедев И. М., Гончарук В. В., Сыроешкин А. В. Структура воды: гигантские гетерофазные кластеры воды. // Химия и технология воды. — 2005.- № 2. — C. 11-37; Смирнов А.
 Н., Сыроешкин А. В. Супранадмолекулярные комплексы воды. // Рос. хим. ж. — 2004.- Т.48 — № 2. — C. 125—135
Н., Сыроешкин А. В. Супранадмолекулярные комплексы воды. // Рос. хим. ж. — 2004.- Т.48 — № 2. — C. 125—135 - ↑ Синяк Ю. Е.., Григорьев А. И. Оптимальный изотопный состав биогенных химических элементов на борту пилотируемых космических аппаратов. // Авиакосмическая и экологическая медицина. 1996. Т. 30, № 4, С. 26.
- ↑ Синяк Ю. Е., Скуратов В. М., Гайдадымов В. Б., Иванова С. М., Покровский Б. Г. Григорьев А. И. Исследование фракционирования стабильных изотопов водорода и кислорода на международной космической станции. // Авиакосмическая и экологическая медицина. 2005. Т. 39, № 6, С. 43.
- ↑ Денько Е. И. Действие тяжёлой воды (D2O) на клетки животных, растений и микроорганизмы. // Усп. совр. биол.. 1970. Т. 70, № 4, С. 41.
- ↑ Лобышев В. И. Механизмы термодинамических и кинетических изотопных эффектов D2O в биологических системах Автореф. докт. диссертации. Москва, — 1987 (биофак МГУ)
- ↑ GLEASON J.D., FRIEDMAN I. Oats may grow better in water depleted in oxygen 18 and deuterium.
 NATURE 256, 305 (24 July 1975)
NATURE 256, 305 (24 July 1975) - ↑ Bild W, Năstasă V, Haulică I. In vivo and in vitro research on the biological effects of deuterium-depleted water: 1. Influence of deuterium-depleted water on cultured cell growth. // Rom J. Physiol. 2004. V.41. N 1-2. P:53-67.
- ↑ Sinyak Y., Grigoriev A., Gaydadimov V., Gurieva T., Levinskih M., Pokrovskii B. Deuterium-free water (1h3O) in complex life-support systems of long-tern space missions. // Acta Astronautica. 2003. V. 52, P. 575.
- ↑ Райхардт К. «Растворители и эффекты среды в органической химии». -М.: «Мир», 1991. — 763 с.
- ↑ Т.Н. Бурдейная, В.А. Поплинская, А.С. Чернопятко, Э.Н. Григорян. Влияние легкой воды на динамику выведения красителя из обонятельной системы личинок Xenopus laevis // Вода: химия и экология 2011.-№9 — C. 86-91
- ↑ Pomytkin I.A., Kolesova O.E. //Bulletin of Experimental Biology and Medicine. 2006. V.142. N 5.
- ↑ Gyöngyi Z, Somlyai G. Deuterium depletion can decrease the expression of C-myc Ha-ras and p53 gene in carcinogen-treated mice.
 // In Vivo. 2000. V.14. N.3. P. 437.
// In Vivo. 2000. V.14. N.3. P. 437. - ↑ Berdea P., Cuna S., Cazacu M., Tudose M. Deuterium variation of human blood serum. // Studia Universitatis Babeş-Bolyai, Physica. 2001. Special issue
- ↑ Krempels K., Somlyai I., Somlyai G. A Retrospective Evaluation of the Effects of Deuterium Depleted Water Consumption on 4 Patients with Brain Metastases from Lung Cancer. // Integrative Cancer Therapies. 2008. V.7. N.3. P. 172—181.
- ↑ Cong F.-S., Zhang Y.-R., Sheng H.-C., Ao Z.-H., Zhang S.-Y., Wang J.-Y. Deuterium-depleted water inhibits human lung carcinoma cell growth by apoptosis. // Experimental and Therapeutic Medicine. 2010. V.1. N.2. P.277-283
- ↑ Somlyai G. «Let’s Defeat Cancer!». Akadémiai Kiadó, Budapest, 2001.
- ↑ Doina P.M. et al., Bulletin UASVM, Veterinary Medicine. 2008. V.65(1). P.1843
Ссылки
- SMOW (англ.)
- Isotopologue (англ.)
- БСЭ. Изотопные методы в геологии
Изотопный состав воды | это.
 .. Что такое Изотопный состав воды?
.. Что такое Изотопный состав воды?
Изотопный состав воды — процент содержание молекул с различной изотопной массой (изотопологов) в воде. Содержание воды, состоящей из лёгких стабильных изотопов 1H216O («лёгкой воды», в отличие от содержащей повышенное количество тяжелого изотопа водорода 2H «тяжёлой воды») в природной воде составляет 99.73 — 99.76 мол.%. [1][2]
Содержание
|
Изотопика воды
Изотопы — разновидности атомов одного и того же химического элемента, имеющие одинаковые заряд ядра и строение электронных оболочек, различающиеся по массе ядер. Разница масс обусловлена тем, что ядра изотопов содержат одинаковое число протонов p и различное число нейтронов n.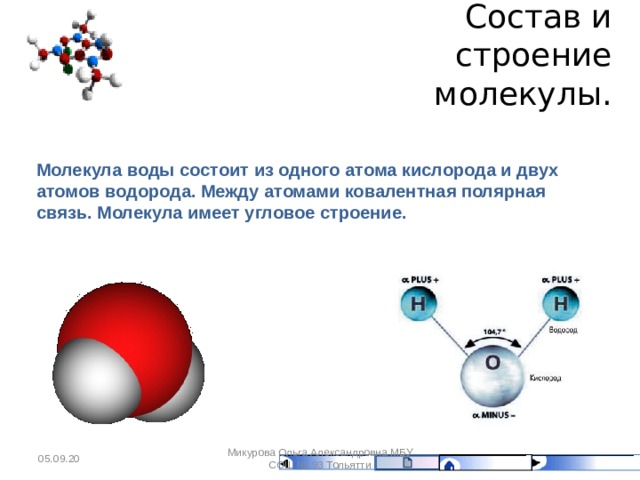 Комбинации различных атомов-изотопов дают набор молекул-изотопологов.
Комбинации различных атомов-изотопов дают набор молекул-изотопологов.
Изотопологи — молекулы, различающиеся только по изотопному составу атомов, из которых они состоят. Изотополог имеет в своём составе, по крайней мере, один атом определенного химического элемента, отличающийся по количеству нейтронов от остальных.
Молекула воды состоит из двух атомов водорода и одного атома кислорода.
Водород имеет два стабильных изотопа — протий (Н) — 1H и дейтерий (D) — 2H.
У кислорода три устойчивых изотопа: 16O, 17O и 18O (табл.1).
Таблица 1. Изотопы воды
| Элемент | Водород | Кислород | |||
|---|---|---|---|---|---|
| Изотоп | Н | D | 16O | 17O | 18O |
| Количество протонов в ядре | 1 | 1 | 8 | 8 | 8 |
| Количество нейтронов в ядре | 0 | 1 | 8 | 9 | 10 |
| Атомная масса | 1 | 2 | 16 | 17 | 18 |
Комбинации 5 стабильных изотопов водорода и кислорода дают набор 9 молекул-изотопологов воды (табл. 2).
2).
Таблица 2. Изотопологи воды
| Изотополог | 1H216O | 1HD16O | D216O | 1H217O | 1HD17O | D217O | 1H218O | 1HD18O | D218O |
|---|---|---|---|---|---|---|---|---|---|
| Изотопы водорода | 1H | 1H, D | D | 1H | 1H, D | D | 1H | 1H, D | D |
| Изотопы кислорода | 16O | 16O | 16O | 17O | 17O | 17O | 18O | 18O | 18O |
| Молекулярная масса | 18 | 19 | 20 | 19 | 20 | 21 | 20 | 21 | 22 |
Молекула 1H216O является самой лёгкой из совокупности всех изотопологов воды. Именно воду 1H216O следует считать классической или лёгкой водой.
Именно воду 1H216O следует считать классической или лёгкой водой.
Лёгкая вода как моноизотопная композиция 1H216O является предельным случаем изотопной чистоты. В естественных условиях такой чистой лёгкой воды не существует. Для получения изотополога 1H216O ведут тонкую многостадийную очистку природных вод или синтезируют из исходных элементов 1H2 и 16O2. Природная вода представляет собой многокомпонентную смесь изотопологов. Содержание самого лёгкого изотополога в ней значительно превосходит концентрацию всех остальных вместе взятых. В природных водах в 1000000 молекул в среднем содержится 997284 молекул 1H216O, 311 молекул 1HD16O, 390 молекул 1H217O, и около 2005 молекул 1H218O. Концентрация молекул воды, содержащих тяжёлые изотопы D, 17O, 18O, в природной воде колеблется в пределах, зафиксированных в основных стандартах изотопного состава гидросферы SMOW и SLAP (табл. 3). Весовые количества изотопологов в природной воде рассчитаны на основании данных прямого определения их содержания методом молекулярной спектроскопии [3].
3). Весовые количества изотопологов в природной воде рассчитаны на основании данных прямого определения их содержания методом молекулярной спектроскопии [3].
Таблица 3. Рассчитанные весовые количества изотопологов в природной воде, соответствующие международным стандартам SMOW (средняя молекулярная масса = 18,01528873) и SLAP (средняя молекулярная масса = 18,01491202), [4].
| Изотополог воды | Молекулярная масса | Содержание, г/кг | |
|---|---|---|---|
| SMOW | SLAP | ||
| 1H216O | 18,01056470 | 997,032536356 | 997,317982662 |
| 1HD16O | 19,01684144 | 0,328000097 | 0,187668379 |
| D216O | 20,02311819 | 0,000026900 | 0,000008804 |
| 1H217O | 19,01478127 | 0,411509070 | 0,388988825 |
| 1HD17O | 20,02105801 | 0,000134998 | 0,000072993 |
| D217O | 21,02733476 | 0,000000011 | 0,000000003 |
| 1H218O | 20,01481037 | 2,227063738 | 2,104884332 |
| 1HD18O | 21,02108711 | 0,000728769 | 0,000393984 |
| D218O | 22,02736386 | 0,000000059 | 0,000000018 |
Как видно из таблицы 3, в природной воде весовая концентрация тяжёлых изотопологов может достигать 2,97 г/кг, что является значимой величиной, сопоставимой, например, с содержанием минеральных солей.
Природная вода, близкая по содержанию изотополога 1H216O к стандарту SLAP, а также специально очищенная с существенно увеличенной долей этого изотополога по сравнению со стандартом SLAP, определяется как особо чистая лёгкая вода (менее строгое определение, которое применимо в реальной жизни).
В лёгкой воде доля самого лёгкого изотополога составляет (мол.%): 99.76 < 1H216O ≤ 100.
Если из воды, отвечающей стандарту SMOW, удалить все тяжёлые молекулы, массовое содержание которых составляет 2,97 г/кг и заменить их на 1H216O, то масса 1 л такой лёгкой и изотопно чистой воды уменьшится на 250 мг. Таким образом, параметры лёгкой воды, в первую очередь, её «лёгкость» и изотопный состав поддаются измерению с помощью таких методов, как масс-спектрометрия, гравиметрия, лазерная абсорбционная спектроскопия[5], ЯМР.
Международные стандарты на природные воды различного изотопного состава
Содержание тяжёлых изотопов водорода и кислорода в природных водах определяется двумя международными стандартами, введенными Международным агентством по атомной энергии (МАГАТЭ)[6][7]:
- Стандарт VSMOW (Vienna Standard Mean Ocean Water) определяет изотопный состав глубинной воды Мирового океана.

- Стандарт SLAP (Standard Light Antarctic Precipitation) определяет изотопный состав природной воды из Антарктики.
По международному стандарту VSMOW абсолютное содержание дейтерия и кислорода-18 в океанической воде составляет[8] : D VSMOW /1H VSMOW=(155,76±0,05)·10−6, или 155,76 ppm 18O VSMOW/16O VSMOW =(2005,20±0,45)·10−6, или 2005 ppm. Для стандарта SLAP концентрации в воде составляют[9]: дейтерия D/H=89·10−6 или 89 ppm, кислорода-18 18O/16O=1894·10−6 или 1894 ppm.
Содержание лёгкого изотополога 1H216O в воде, соответствующей по изотопному составу VSMOW, составляет 997,0325 г/кг (99,73 мол. %). Доля самого лёгкого изотополога в воде, соответствующей по изотопному составу SLAP, составляет 997,3179 г/кг (99,76 мол. %).
Стандарт SLAP характеризует самую лёгкую природную воду на Земле. Вода в различных точках земного шара неодинакова по своей лёгкости.
Свойства и эффекты лёгкой воды
Изотопологи отличаются друг от друга по физическим, химическим и биологическим свойствам (табл.4).
Таблица 4. Изменение физических свойств воды при изотопном замещении
| Физические свойства | 1H216O | D216O | 1H218O |
|---|---|---|---|
| Плотность при 20 °C, г/см3 | 0.9970 | 1.1051 | 1.1106 |
| Температура максимальной плотности, °C | 3.98 | 11.24 | 4.30 |
| Температура плавления при 1 атм, °C | 0 | 3.81 | 0.28 |
| Температура кипения при 1 атм, °C | 100 | 101,42 | 100,14 |
| Давление пара при 100 °C, Торр | 760,00 | 721,60 | 758,10 |
| Вязкость при 20 °C, сантипуаз | 1,002 | 1,247 | 1,056 |
Равновесное давление паров у изотопологов воды различается, и весьма существенно. Чем меньше масса молекулы воды, тем выше давление пара, а это означает, что пар, равновесный с водой, всегда обогащён лёгкими изотопами кислорода и водорода. Относительно малой массы элементов разница масс изотопов велика, поэтому они способны сильно фракционировать в природных процессах: D/H → 100 %, 18O/16O →12,5 %. Изотопы водорода и кислорода наиболее эффективно фракционируют в процессах испарения-конденсации и кристаллизации воды.
Чем меньше масса молекулы воды, тем выше давление пара, а это означает, что пар, равновесный с водой, всегда обогащён лёгкими изотопами кислорода и водорода. Относительно малой массы элементов разница масс изотопов велика, поэтому они способны сильно фракционировать в природных процессах: D/H → 100 %, 18O/16O →12,5 %. Изотопы водорода и кислорода наиболее эффективно фракционируют в процессах испарения-конденсации и кристаллизации воды.
Результаты экспериментальных исследований свидетельствуют о различии физико-химических свойств легкой воды и деионизированной воды природного изотопного состава[10].
Тяжёлые изотопологи в природной воде являются примесями по отношению к 1H216O, которые по некоторым исследованиям можно рассматривать как дефекты структуры [11].
Устранение гетерогенности воды по изотопному составу приводит к увеличению её гомогенности. Лёгкая вода является более однородной жидкостью. Тяжелоизотопные молекулы, содержащиеся в воде в природных концентрациях, практически не оказывают заметного влияния на неживые системы. В наибольшей степени эффекты лёгкой воды проявляются на биологических объектах, для которых характерны каскадные реакции.
Тяжелоизотопные молекулы, содержащиеся в воде в природных концентрациях, практически не оказывают заметного влияния на неживые системы. В наибольшей степени эффекты лёгкой воды проявляются на биологических объектах, для которых характерны каскадные реакции.
Реакция биосистем при воздействии на них воды может изменяться в зависимости от количественных и качественных изменений её изотопного состава. В ходе эволюции живых организмов произошёл отбор биохимических процессов с настройкой их только на один изотоп, как правило, лёгкий [12]. В организме человека происходит «фракционирование изотопов, сопровождающееся удалением тяжёлых стабильных изотопов водорода и кислорода воды»[13]. Применение воды с повышенной концентрацией тяжёлых изотопов, в частности, дейтерия, вызывает выраженные токсические эффекты на уровне организма [14][15]. В то же время на разных объектах зарегистрирована положительная биологическая активность вод с пониженным, относительно природного, содержанием тяжелых изотопологов, в частности дейтерия и кислорода 18[16][17]. Проводимые в ГНЦ РФ «Институт медико-биологических проблем» РАН систематические исследования по созданию среды обитания космонавтов с оптимальным изотопным составом биогенных химических элементов показали, что вода с пониженным по сравнению с природным содержанием тяжелоизотопных молекул является необходимым компонентом системы жизнеобеспечения космонавтов во время длительных полётов [18]
Проводимые в ГНЦ РФ «Институт медико-биологических проблем» РАН систематические исследования по созданию среды обитания космонавтов с оптимальным изотопным составом биогенных химических элементов показали, что вода с пониженным по сравнению с природным содержанием тяжелоизотопных молекул является необходимым компонентом системы жизнеобеспечения космонавтов во время длительных полётов [18]
Биологические свойства
В качестве универсальной среды, в которой идут все биологические реакции, лёгкая вода увеличивает скорость этих реакций по сравнению с водой природного изотопного состава. Этот эффект известен под названием кинетический изотопный эффект растворителя [19].
Транспортные свойства легкой воды доказаны при изучении влияния тяжелых изотопологов в составе природной воды на динамику выведения красителя метиленового синего из обонятельной системы шпорцевых лягушек [20].
Наиболее сильное влияние очистка воды от тяжёлых изотопологов оказывает на энергетический аппарат живой клетки. Дыхательную цепь митохондрий отличают каскадные реакции. Тяжёлые изотопологи замедляют скорость реакций дыхательной цепи. На примере реакции генерации перекиси водорода митохондриями с янтарной кислотой в качестве субстрата экспериментально доказан общий ингибирующий эффект тяжёлых изотопологов воды. Снижение их содержания в воде до уровня ниже природных концентраций деингибирует и достоверно ускоряет исследованную реакцию [21].
Дыхательную цепь митохондрий отличают каскадные реакции. Тяжёлые изотопологи замедляют скорость реакций дыхательной цепи. На примере реакции генерации перекиси водорода митохондриями с янтарной кислотой в качестве субстрата экспериментально доказан общий ингибирующий эффект тяжёлых изотопологов воды. Снижение их содержания в воде до уровня ниже природных концентраций деингибирует и достоверно ускоряет исследованную реакцию [21].
Лёгкая вода проявляет противоопухолевую активность, что показано в работах учёных, проводимых в исследовательских центрах разных стран [22][23][24][25]. По данным Г.Шомлаи, результаты клинических испытаний, проведённых в 1994—2001 гг. в Венгрии, показали, что уровень выживаемости больных, употреблявших лёгкую воду в сочетании с традиционными методами лечения или после них выше, чем у больных, использовавших только химио- или лучевую терапию [26].
Токсикопротекторные свойства легкой воды подтверждены экспериментальными исследованиями [27] , из которых следует, что легкая вода, очищенная от тяжелых изотопологов, за счет своих транспортных свойств эффективно выводит токсины и продукты метаболизма из организма.
См. также
- Вода
- Тяжёлая вода
Примечания
- ↑ Кульский Л. А., Даль В. В., Ленчина Л. Вода знакомая и загадочная.- Киев: «Радянська школа», 1982.- 120 с.
- ↑ Петрянов-Соколов И. В. Самое необычное вещество в мире.// Химия и жизнь. 2007. № 1. с.26.
- ↑ Rothman et al., J. Quant. Spectrosc. Radiat. Transfer, 1998, 60, 665. Rothman et al., J. Quant. Spectrosc. Radiat. Transfer, 2003, 82, p.9.
- ↑ Патент RU 2295493. «Способ и установка для производства лёгкой воды». Соловьев С. П.
- ↑ Lis G., Wassenaar L. I., Hendry M. J. High-Precision Laser Spectroscopy D/H and 18O/16O Measurements of Microliter Natural Water Samples.// Anal. Chem. 2008. V. 80 (1). P. 287—293
- ↑ Ферронский В. И., Поляков В. А. Изотопия гидросферы. М.: Наука, 1983 г.
- ↑ Craig, H. Standard for Reporting Concentrations of Deuterium and Oxygen-18 in Natural Waters.
 // Science. 1961. V. 133. PP. 1833−1834.
// Science. 1961. V. 133. PP. 1833−1834. - ↑ Hagemann R., Niff G., Roth E. Absolute isotopic scale for deuterium analysis of natural waters. Absolute D/H ratio for SMOW. // Tellus. 1970. V.22. N6. PP.712-715.
- ↑ De Wit J.C., van der Straaten C.M.; Mook W.G. Determination of the Absolute Hydrogen Isotopic Ratio of VSMOW and SLAP. // Geostandards Newsletter. 1980. V. 4. N. 1. PP. 33−36.
- ↑ V.V. Goncharuk, V.B. Lapshin, T.N. Burdeinaya, T.V. Pleteneva, A.S. Chernopyatko et al. Physicochemical Properties and Biological Activity of the Water Depleted of Heavy Isotopes // 2011, published in Khimiya i Tekhnologiya Vody, 2011, Vol. 33, No. 1, pp. 15–25. Journal of Water Chemistry and Technology, 2011, Vol. 33, No. 1, pp. 8–13.
- ↑ Смирнов А. Н., Лапшин В. Б., Балышев А. В., Лебедев И. М., Гончарук В. В., Сыроешкин А. В. Структура воды: гигантские гетерофазные кластеры воды. // Химия и технология воды. — 2005.- № 2. — C. 11-37; Смирнов А.
 Н., Сыроешкин А. В. Супранадмолекулярные комплексы воды. // Рос. хим. ж. — 2004.- Т.48 — № 2. — C. 125—135
Н., Сыроешкин А. В. Супранадмолекулярные комплексы воды. // Рос. хим. ж. — 2004.- Т.48 — № 2. — C. 125—135 - ↑ Синяк Ю. Е.., Григорьев А. И. Оптимальный изотопный состав биогенных химических элементов на борту пилотируемых космических аппаратов. // Авиакосмическая и экологическая медицина. 1996. Т. 30, № 4, С. 26.
- ↑ Синяк Ю. Е., Скуратов В. М., Гайдадымов В. Б., Иванова С. М., Покровский Б. Г. Григорьев А. И. Исследование фракционирования стабильных изотопов водорода и кислорода на международной космической станции. // Авиакосмическая и экологическая медицина. 2005. Т. 39, № 6, С. 43.
- ↑ Денько Е. И. Действие тяжёлой воды (D2O) на клетки животных, растений и микроорганизмы. // Усп. совр. биол.. 1970. Т. 70, № 4, С. 41.
- ↑ Лобышев В. И. Механизмы термодинамических и кинетических изотопных эффектов D2O в биологических системах Автореф. докт. диссертации. Москва, — 1987 (биофак МГУ)
- ↑ GLEASON J.D., FRIEDMAN I. Oats may grow better in water depleted in oxygen 18 and deuterium.
 NATURE 256, 305 (24 July 1975)
NATURE 256, 305 (24 July 1975) - ↑ Bild W, Năstasă V, Haulică I. In vivo and in vitro research on the biological effects of deuterium-depleted water: 1. Influence of deuterium-depleted water on cultured cell growth. // Rom J. Physiol. 2004. V.41. N 1-2. P:53-67.
- ↑ Sinyak Y., Grigoriev A., Gaydadimov V., Gurieva T., Levinskih M., Pokrovskii B. Deuterium-free water (1h3O) in complex life-support systems of long-tern space missions. // Acta Astronautica. 2003. V. 52, P. 575.
- ↑ Райхардт К. «Растворители и эффекты среды в органической химии». -М.: «Мир», 1991. — 763 с.
- ↑ Т.Н. Бурдейная, В.А. Поплинская, А.С. Чернопятко, Э.Н. Григорян. Влияние легкой воды на динамику выведения красителя из обонятельной системы личинок Xenopus laevis // Вода: химия и экология 2011.-№9 — C. 86-91
- ↑ Pomytkin I.A., Kolesova O.E. //Bulletin of Experimental Biology and Medicine. 2006. V.142. N 5.
- ↑ Gyöngyi Z, Somlyai G. Deuterium depletion can decrease the expression of C-myc Ha-ras and p53 gene in carcinogen-treated mice.
 // In Vivo. 2000. V.14. N.3. P. 437.
// In Vivo. 2000. V.14. N.3. P. 437. - ↑ Berdea P., Cuna S., Cazacu M., Tudose M. Deuterium variation of human blood serum. // Studia Universitatis Babeş-Bolyai, Physica. 2001. Special issue
- ↑ Krempels K., Somlyai I., Somlyai G. A Retrospective Evaluation of the Effects of Deuterium Depleted Water Consumption on 4 Patients with Brain Metastases from Lung Cancer. // Integrative Cancer Therapies. 2008. V.7. N.3. P. 172—181.
- ↑ Cong F.-S., Zhang Y.-R., Sheng H.-C., Ao Z.-H., Zhang S.-Y., Wang J.-Y. Deuterium-depleted water inhibits human lung carcinoma cell growth by apoptosis. // Experimental and Therapeutic Medicine. 2010. V.1. N.2. P.277-283
- ↑ Somlyai G. «Let’s Defeat Cancer!». Akadémiai Kiadó, Budapest, 2001.
- ↑ Doina P.M. et al., Bulletin UASVM, Veterinary Medicine. 2008. V.65(1). P.1843
Ссылки
- SMOW (англ.)
- Isotopologue (англ.)
- БСЭ. Изотопные методы в геологии
WaterIsotopes.
 org
org
(гаитянский креольский перевод этой страницы в Web Geek Science)
Стабильные изотопы водорода и кислорода имеют долгую историю использования в гидрологии и палеоклиматологии. Два стабильных изотопа водорода ( 1 H и 2 H) и три изотопа кислорода ( 16 O, 17 O и 18 O) встречаются в природе в водах, биологических и геологических материалах. Из них 1 Н, 2 H, 16 O и 18 O широко распространены и могут быть легко измерены с помощью масс-спектрометрии.
Распределение изотопов воды в большинстве гидрологических процессов регулируется простым правилом: тяжелые изотопы преимущественно встречаются в жидкой (или твердой) фазе, а легкие изотопы — в газовой фазе. Это разделение между фазами лежит в основе большинства приложений, связанных с изотопами воды, поскольку оно приводит к прогрессивной эволюции изотопного состава воды климатологических воздушных масс по мере их движения по поверхности земли, приобретая и теряя влагу. Самый фундаментальный пример этого процесса включает постепенное высыхание воздушной массы, которая насыщается водой над океанами, а затем перемещается над сушей. Поскольку воздушная масса теряет тяжелые изотопы ( 2 H и 18 O) быстрее легких изотопов тяжелый изотоп отгоняется из воздушной массы. Таким образом, соотношение тяжелых и легких изотопов в осадках, выпадающих из воздушной массы, со временем уменьшается по мере того, как с осадками теряется все больше и больше воды.
Самый фундаментальный пример этого процесса включает постепенное высыхание воздушной массы, которая насыщается водой над океанами, а затем перемещается над сушей. Поскольку воздушная масса теряет тяжелые изотопы ( 2 H и 18 O) быстрее легких изотопов тяжелый изотоп отгоняется из воздушной массы. Таким образом, соотношение тяжелых и легких изотопов в осадках, выпадающих из воздушной массы, со временем уменьшается по мере того, как с осадками теряется все больше и больше воды.
Временное разделение изотопов, описанное выше, также приводит к сильному, предсказуемому пространственному разделению изотопов по ландшафтам. В основе этих закономерностей лежит сочетание описанного выше процесса дистилляции и метеорологии. Мы видели, как изменяются соотношения изотопов воды по мере движения воздушных масс по поверхности земли, и чтобы понять, как это создает пространственные закономерности, нам нужно только учесть, что климатические процессы управляют движением воздушных масс более или менее предсказуемо. Соотношение изотопов воды в осадках обычно снижается вдоль этих «путей» циркуляции, создавая геопространственные градиенты соотношения изотопов воды, поступающей на поверхность Земли. Наклон этих пространственных градиентов изотопов воды в конечном счете зависит от скорости потери воды при движении воздушных масс по путям, что связано с большим количеством климатологических факторов, но в конечном итоге сводится к тому, насколько быстро воздух охлаждается и/или подняли по дорожке.
Соотношение изотопов воды в осадках обычно снижается вдоль этих «путей» циркуляции, создавая геопространственные градиенты соотношения изотопов воды, поступающей на поверхность Земли. Наклон этих пространственных градиентов изотопов воды в конечном счете зависит от скорости потери воды при движении воздушных масс по путям, что связано с большим количеством климатологических факторов, но в конечном итоге сводится к тому, насколько быстро воздух охлаждается и/или подняли по дорожке.
Это понятие применимо к отдельным воздушным массам, но может рассматриваться и на уровне средних климатических закономерностей, характеризующих сезонный или среднегодовой перенос влаги над различными районами земного шара. Например, штат Миннесота получает влагу из различных источников в течение года, в том числе относительно небольшой вклад от зимних штормов, источником которых является северная часть Тихого океана и Гудзонов залив, и больший вклад от летних штормов, приносящих влагу из Мексиканского залива. Таким образом, можно ожидать, что среднее соотношение изотопов воды, попадающей в Миннесоту, будет отражать этот баланс источников влаги и связанную с этим дистилляционную характеристику этих путей циркуляции. На самом общем уровне эти закономерности стабильны в течение многих лет или десятилетий, но на более тонком уровне они подвержены изменчивости от года к году (например, ежегодные изменения средней зимней траектории струйного течения над рекой). США и Канаде или интенсивность зимних штормов в Калифорнии, связанная с циклами ЭНЮК). Таким образом, долгосрочное среднее геопространственное распределение соотношений изотопов воды в осадках должно отражать среднюю климатологию региона, а более краткосрочные средние значения могут нести информацию о климатических закономерностях в более коротких временных масштабах.
Таким образом, можно ожидать, что среднее соотношение изотопов воды, попадающей в Миннесоту, будет отражать этот баланс источников влаги и связанную с этим дистилляционную характеристику этих путей циркуляции. На самом общем уровне эти закономерности стабильны в течение многих лет или десятилетий, но на более тонком уровне они подвержены изменчивости от года к году (например, ежегодные изменения средней зимней траектории струйного течения над рекой). США и Канаде или интенсивность зимних штормов в Калифорнии, связанная с циклами ЭНЮК). Таким образом, долгосрочное среднее геопространственное распределение соотношений изотопов воды в осадках должно отражать среднюю климатологию региона, а более краткосрочные средние значения могут нести информацию о климатических закономерностях в более коротких временных масштабах.
Осознавая потенциал применения соотношений стабильных изотопов воды в ряде научных дисциплин, Всемирная метеорологическая организация и Международное агентство по атомной энергии в начале 1960-х годов создали Глобальную сеть по изотопам в осадках (GNIP). Эта всемирная сеть станций мониторинга осадков существует и продолжает развиваться сегодня. Он собрал данные о стабильных изотопах воды с месячным временным разрешением почти на 400 станциях, предоставив невероятный ресурс для изучения соотношения изотопов воды в осадках во временном, климатическом и геопространственном контекстах. Большая база данных измерений отношения изотопов, составленная как часть этой программы, обеспечивает основу для работы, представленной на этом веб-сайте, и мы в долгу перед теми, кто координировал и вносил свой вклад в работу GNIP. Однако работа с данными GNIP в геопространственном контексте сопряжена с уникальным набором проблем. В первую очередь, измерения GNIP распределены очень неравномерно во времени и в пространстве. Например, набор данных включает очень хорошее географическое покрытие Китая, но почти ни одна из китайских станций не работала до 19 века.80-е годы. Это контрастирует с такими регионами, как Соединенные Штаты и Африка, где сбор данных начался намного раньше, но многие станции мониторинга прекратили работу к тому времени, когда китайские станции подключились к сети.
Эта всемирная сеть станций мониторинга осадков существует и продолжает развиваться сегодня. Он собрал данные о стабильных изотопах воды с месячным временным разрешением почти на 400 станциях, предоставив невероятный ресурс для изучения соотношения изотопов воды в осадках во временном, климатическом и геопространственном контекстах. Большая база данных измерений отношения изотопов, составленная как часть этой программы, обеспечивает основу для работы, представленной на этом веб-сайте, и мы в долгу перед теми, кто координировал и вносил свой вклад в работу GNIP. Однако работа с данными GNIP в геопространственном контексте сопряжена с уникальным набором проблем. В первую очередь, измерения GNIP распределены очень неравномерно во времени и в пространстве. Например, набор данных включает очень хорошее географическое покрытие Китая, но почти ни одна из китайских станций не работала до 19 века.80-е годы. Это контрастирует с такими регионами, как Соединенные Штаты и Африка, где сбор данных начался намного раньше, но многие станции мониторинга прекратили работу к тому времени, когда китайские станции подключились к сети. Эта пространственная и временная неравномерность вызывает беспокойство при сравнении данных из разных регионов, и в разных местах на этом сайте мы описываем попытки, которые мы предприняли, чтобы минимизировать влияние артефактов выборки на наши анализы.
Эта пространственная и временная неравномерность вызывает беспокойство при сравнении данных из разных регионов, и в разных местах на этом сайте мы описываем попытки, которые мы предприняли, чтобы минимизировать влияние артефактов выборки на наши анализы.
Часто задаваемые вопросы: Изотопный состав воды
Каков изотопный состав обычной воды?
Вода состоит из водорода и кислорода, но оба эти элемента имеют
более одного стабильного природного изотопа. Самый обильный
изотоп водорода имеет атомное массовое число 1, но массовое число
из 2 (называемый дейтерием и часто обозначаемый символом D)
присутствуют в небольшом количестве. Тритий (массовое число 3, часто представляемое
символом Т) радиоактивен и почти полностью отсутствует в природе.
Самый распространенный изотоп кислорода имеет массовое число 16, но 18-O
изотоп присутствует в количестве около 0,2%, а также имеется небольшое количество 17-O.
Изотопный состав воды (как и других химических соединений)
не однородный. Это связано с тем, что некоторые химические реакции различают
Это связано с тем, что некоторые химические реакции различают
между изотопами и из-за различий в летучести между
соединения, образованные различными изотопами. Это последний эффект
это наиболее заметно для воды. При испарении воды пар
немного обеднен тяжелыми изотопами. Противоположное происходит, когда
вода конденсируется из атмосферы; дождя или снега больше
тяжелых изотопов, оставляя более легкие водяные пары в
атмосфера. Эти явления важны для тех, кто изучает
климат, потому что можно использовать изотопные составы
проследить глобальные потоки воды и других соединений.
Из-за этих эффектов пресные воды на Земле различаются относительно
широко распространены по своему изотопному составу. В умеренном климате,
пресная вода обеднена дейтерием примерно на 4% по сравнению с океаном
вода. В полярных районах это истощение может достигать 40%.
Несмотря на эту вариацию, важно иметь «стандарт»
вода, которая легко воспроизводима и против которой другие воды
можно сравнить. К счастью, морская вода может обеспечить такое
стандарт.


 // Science. 1961. V. 133. PP. 1833−1834.
// Science. 1961. V. 133. PP. 1833−1834. Н., Сыроешкин А. В. Супранадмолекулярные комплексы воды. // Рос. хим. ж. — 2004.- Т.48 — № 2. — C. 125—135
Н., Сыроешкин А. В. Супранадмолекулярные комплексы воды. // Рос. хим. ж. — 2004.- Т.48 — № 2. — C. 125—135 NATURE 256, 305 (24 July 1975)
NATURE 256, 305 (24 July 1975) // In Vivo. 2000. V.14. N.3. P. 437.
// In Vivo. 2000. V.14. N.3. P. 437.
 // Science. 1961. V. 133. PP. 1833−1834.
// Science. 1961. V. 133. PP. 1833−1834. Н., Сыроешкин А. В. Супранадмолекулярные комплексы воды. // Рос. хим. ж. — 2004.- Т.48 — № 2. — C. 125—135
Н., Сыроешкин А. В. Супранадмолекулярные комплексы воды. // Рос. хим. ж. — 2004.- Т.48 — № 2. — C. 125—135 NATURE 256, 305 (24 July 1975)
NATURE 256, 305 (24 July 1975) // In Vivo. 2000. V.14. N.3. P. 437.
// In Vivo. 2000. V.14. N.3. P. 437.