Содержание
Насыщение воды газом продлило жизнь супергидрофобности
Время жизни супергидрофобного состояния на шероховатой поверхности можно увеличить при насыщении воды газом. Ученые из Китая показали, что если поддерживать уровень насыщения близким к максимальному, то супергидрофобность может существовать бесконечно долго в рамках эксперимента. Работа опубликована в Physical Review Letters.
Известно, что при смачивании водой плоской поверхности краевой угол может быть меньше 90 градусов (для гидрофильных поверхностей) или больше 90 градусов (для гидрофобных поверхностей). Но если сохранять поверхность идеально плоской, то даже для самых гидрофобных поверхностей краевой угол не может превышать примерно 120 градусов. Однако если добавить к гидрофобности еще и микрорельеф, краевой угол можно значительно увеличить за счет возникновения воздушного слоя между жидкостью и твердой поверхностью. Такой эффект наблюдается, например, на поверхности листа лотоса, а также используется для создания противосмачивающихся поверхностей. Тем не менее, для большинства таких поверхностей супергидрофобное состояние не является термодинамически устойчивым. Со временем газ покидает полости на шероховатой поверхности, и их заполняет жидкость. Для того, чтобы продлить время жизни супергидрофобного состояния, ученые обычно предлагают изменять геометрию поверхности или наносят на нее наночастицы, создавая иерархическую шероховатую структуру.
Тем не менее, для большинства таких поверхностей супергидрофобное состояние не является термодинамически устойчивым. Со временем газ покидает полости на шероховатой поверхности, и их заполняет жидкость. Для того, чтобы продлить время жизни супергидрофобного состояния, ученые обычно предлагают изменять геометрию поверхности или наносят на нее наночастицы, создавая иерархическую шероховатую структуру.
В своем новом исследовании ученые из Китая предложили повысить устойчивость супергидрофобности, не изменяя свойства поверхности, а просто поддерживая постоянный уровень растворенного в жидкости воздуха. Чтобы показать, что такой механизм работает, они провели следующий эксперимент. Супергидрофобный лист лотоса поместили в водный поток скоростью до 30 миллилитров в минуту и следили за состоянием газа на поверхности. Вода вытекала из резервуара, который был помещен на подвижную платформу и через который продувался воздух, так что можно было контролировать гидростатическое давление и степень насыщенности воды воздухом.
Оказалось, что вне зависимости от гидростатического давления, поддерживая максимально возможную концентрацию растворенного в воде газа (то есть насыщенность в 100 процентов), можно сохранять супргидрофобное состояние на поверхности листа лотоса достаточно долгое время. Эксперимент проводился в течение нескольких часов, и никаких изменений за это время ученые не обнаружили. При этом в случае насыщенности, например, в 67 процентов, уже через две минуты все полости поверхности оказывались заполнены водой.
Ученые не уточняют, как такой метод можно применить при использовании супергидрофобных поверхностей в естественных водоемах, но для лабораторных условий такой способ является весьма перспективным.
Недавно мы писали о еще одном интересном свойстве супергидрофобных поверхностей: они могут сильно снижать сопротивление жидкости. А если супергидрофобный шарик бросить в жидкость с нужной скоростью, то сопротивление может снизиться сразу в 10 раз.
Александр Дубов
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Прорыв газовой скважины за полвека не перестал портить воду
Нидерландские геологи обнаружили, что грунтовые воды вблизи места прорыва газовой скважины, произошедшего в 1965 году, по-прежнему содержат повышенное количество метана, опасное для здоровья. По данным изотопного анализа углерода, источником метана в воде служит все тот же газовый резервуар, сообщают ученые в Proceedings of the National Academy of Sciences.
В связи с активным увеличением масштабов добычи сланцевого газа в настоящее время большое внимание уделяется возможным негативным последствиям этого процесса. Одним из них является загрязнение грунтовых вод, которое может происходить в результате неконтролируемых утечек или из-за аварий, при которых происходит прорыв газовых скважин. Увеличение концентрации углеводородов в грунтовых водах приводит к изменению кислотности и окислительно-восстановительных свойств среды, что может представлять опасность для здоровья человека. Несмотря на то, что прорывы скважин происходят довольно редко (примерно один прорыв на тысячу просверленных скважин), их последствия для окружающей среды довольно значительны.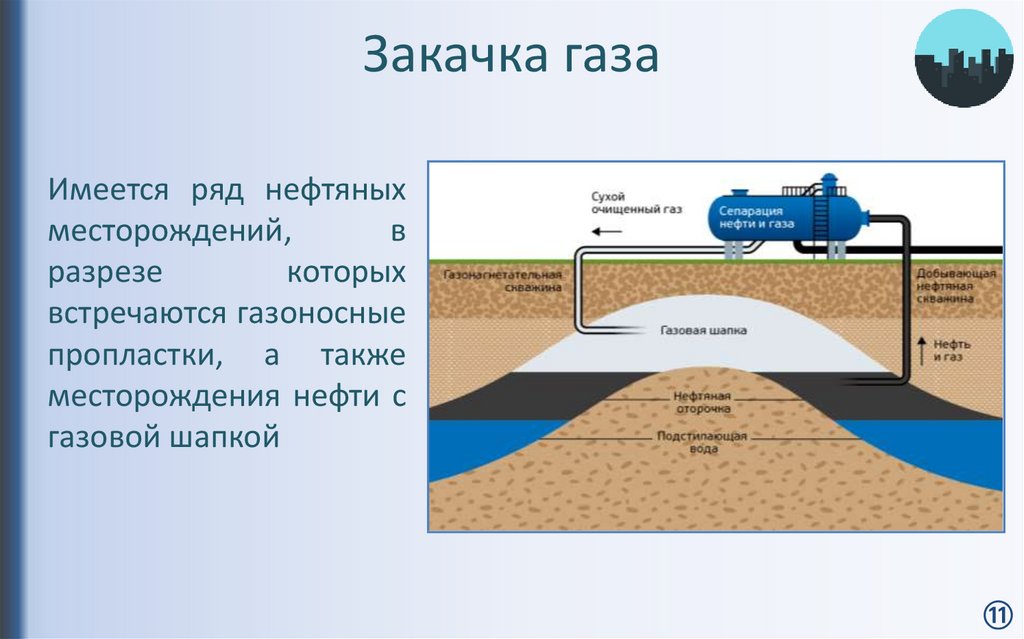 При этом влияние газовых прорывов на состав почвы и грунтовых вод может быть достаточно долгим и продолжаться несколько лет или десятилетий.
При этом влияние газовых прорывов на состав почвы и грунтовых вод может быть достаточно долгим и продолжаться несколько лет или десятилетий.
Для того, чтобы оценить, как утечки природного газа из газовых резервуаров загрязняют воду спустя длительное время после прорыва скважины, нидерландские геологи под руководством Гилиана Схаута (Gilian Schout) из Утрехтского университета исследовали содержание метана и изотопный состав углерода в грунтовых водах, протекающих вблизи места мощного прорыва газовой скважины. Прорыв скважины произошел в 1965 году вблизи деревни Слеен в провинции Дренте на глубине около двух тысяч метров, в результате чего образовался кратер радиусом несколько сот метров. В своей работе ученые проанализировали состав воды непосредственно в области кратера а также образцов, забранных на глубине от 6 до 120 метров в радиусе около трех километров от точки прорыва.
Оказалось, что содержание метана в различных образцах воды в зависимости от удаления от кратера и глубины варьируется от 0,1 до 43,8 миллиграмма на литр. Максимальная концентрация была измерена непосредственно вблизи зоны газового прорыва, при этом в 12 из 27 исследованных образцов уровень метана оказался выше порога в 10 миллиграммов на литр, а в 7 — выше порога в 28 миллиграммов на литр (содержание, которое представляет опасность для здоровья).
Максимальная концентрация была измерена непосредственно вблизи зоны газового прорыва, при этом в 12 из 27 исследованных образцов уровень метана оказался выше порога в 10 миллиграммов на литр, а в 7 — выше порога в 28 миллиграммов на литр (содержание, которое представляет опасность для здоровья).
Однако для воды в некоторых регионах Голландии характерно естественное высокое содержание метана, поэтому, чтобы точно определить источник его происхождения, авторы работы дополнительно изучили изотопный состав углерода в воде. С помощью изотопного анализа удалось показать, что во всех образцах воды с высоким содержанием углеводородов метан имеет термогенное происхождение и его источником является газовый резервуар на глубине около 2 тысяч метров.
Поэтому несмотря на то, что после прорыва газовой скважины в 1965 году никаких видимых утечек газа на поверхности не наблюдалось, внутри грунта они, очевидно, все еще происходят. При этом ученые отмечают, что для более надежного изучения возможных последствий загрязнения воды метаном в результате его окисления, необходимо провести измерения образцов воды вблизи других источников метана.
К загрязнению питьевой воды может приводить большое количество других антропогенных факторов. Например, недавно ученые обнаружили, что 83 процента водопроводной воды содержат микрочастицы пластика, источниками которых являются синтетическая одежда, автомобильные шины, краска и вторичные отходы.
Александр Дубов
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Как вода превращается в газ? | Физика Фургон
Категория
Выберите категориюО фургоне физикиЭлектричество и магнитыВсе остальноеСвет и звукДвижение вещейНовая и захватывающая физикаСостояния материи и энергииКосмосПод водой и в воздухе
Подкатегория
Поиск
Задайте вопрос
Последний ответ: 22.10.2007
В:
как вода превращается в газ?
— Аноним
Массачусетс, США
Ответ:
Отличный вопрос!
Если бы вы взяли воду (как и многие другие материалы) и разбили ее почти на мельчайшие частицы, вы бы получили молекулы. Если молекулы очень плотно склеены в правильном порядке, то они называются твердыми телами. Твердая форма воды – лед. Это на самом деле имеет большой смысл, потому что кажется, что все маленькие части твердого тела (например, льда) очень плотно слиплись.
Если молекулы очень плотно склеены в правильном порядке, то они называются твердыми телами. Твердая форма воды – лед. Это на самом деле имеет большой смысл, потому что кажется, что все маленькие части твердого тела (например, льда) очень плотно слиплись.
Когда вы что-то нагреваете, молекулы начинают двигаться быстрее. Если вы нагреете типичное твердое тело, оно расплавится и станет жидкостью. В жидкости (например, в воде) молекулы все еще слипаются, но они могут двигаться. На самом деле происходит то, что молекулы все еще как бы держатся вместе, но они постоянно распадаются и прилипают к другим молекулам. Это также имеет смысл, когда вы думаете о воде. Вода как бы слипается, но легко распадается /действительно/.
Если еще больше нагреть жидкость, например воду (например, поставить ее в кастрюлю на плиту), то молекулы будут двигаться так быстро, что вообще не смогут держаться друг за друга. Когда это происходит, все молекулы разлетаются и превращаются в газ (например, когда вы кипятите воду, чтобы получить пар). Процесс перехода молекул газа из жидкости в газ называется «испарением». Противоположный процесс называется «конденсацией».
Процесс перехода молекул газа из жидкости в газ называется «испарением». Противоположный процесс называется «конденсацией».
Надеюсь, это ответ на ваш вопрос!
-Тамара (маленькие модификации от mbw)
(опубликовано 22.10.2007)
Продолжение #1: машина на газу?
Q:
как я могу превратить воду в газ, чтобы я мог использовать его в качестве топлива для моей машины, пожалуйста.
— Эрик Кинг (54 года)
Корнуолл, Англия
Ответ:
Упс, газ, в который превращается вода при кипении, это не бензин, это пар. Вы не можете сжечь его.
Вы можете использовать электрический ток, чтобы превращать воду в водород и кислород, а также приводить в действие двигатели, сжигая водород. Проблема в том, что на разложение воды всегда уходит больше энергии, чем вы получаете от сжигания водорода. Это не инженерный предел, это закон природы.
Mike W.
(опубликовано 26.05.2008)
Дополнение #2: Афера с водой в водород
Q:
Можно ли сделать устройство для установки под капот автомобиля, превратит воду в газообразный водород и смешает его с обычным бензином и запустит двигатель вашего автомобиля, чтобы увеличить расход бензина? Посетите веб-сайт halfwaterhalfgas.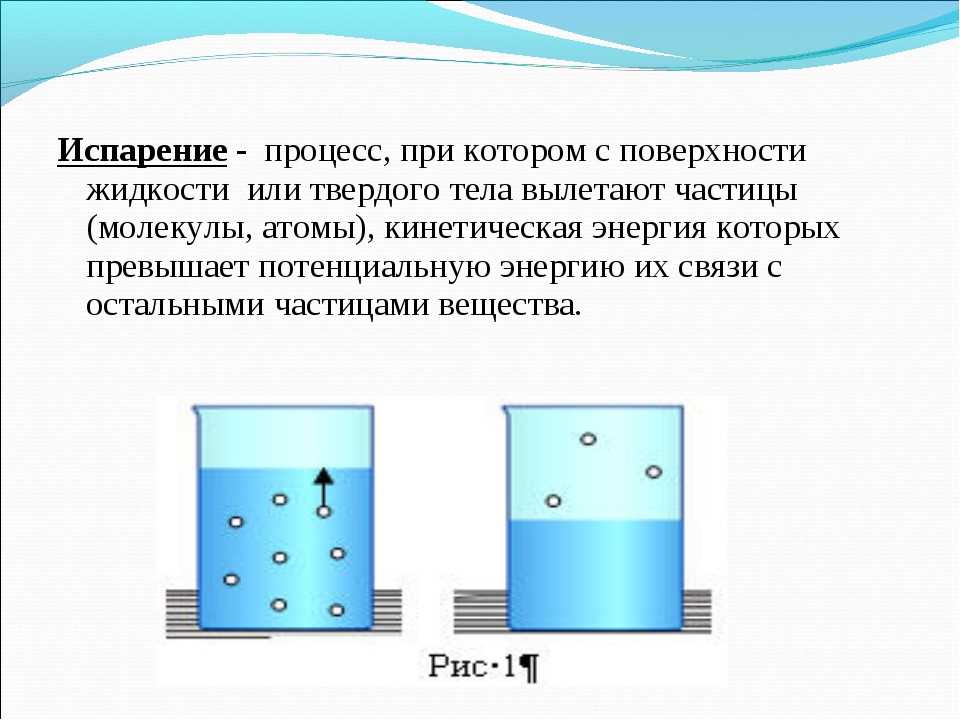 com и посмотрите на устройство, которое должно преобразовывать воду в водород и смешивать его с бензином для питания автомобиля. Это ДЕЙСТВИТЕЛЬНО работает или это мошенничество?
com и посмотрите на устройство, которое должно преобразовывать воду в водород и смешивать его с бензином для питания автомобиля. Это ДЕЙСТВИТЕЛЬНО работает или это мошенничество?
– Кайла Фишер (56 лет)
Хартсхорн, Оклахома США
A:
Это мошенничество. Эти мошенничества были вокруг в течение многих лет.
Хотя можно разложить воду на составляющие ее газы, водород и кислород, количество энергии, которое требуется для этого, больше, чем количество энергии, которое вы получаете обратно при сжигании водорода. Всегда есть чистый убыток. Не покупайте один.
п.с. Если вы опустите «g» и добавите «s» к имени URL, вы получите мое мнение…
LeeH
(published on 08/01/2008)
Follow-up on this answer
Related Questions
expanding piston with water
hot fumes rise
water and fires
Джин проясняет запотевшее стекло
Конденсация воды под чашкой горячего чая
Слишком странно, чтобы поверить
Испарение
Чай и кипящее молоко в молоке0003
сжатие газа
температура кипения растворов
Все еще любопытно?
Вопросы и ответы по Expore в смежных категориях
- Кипение, испарение и конденсация
Дальтон
Дальтон
Об абсорбции газов водой и другими жидкостями
Мемуары литературно-философского общества Манчестера , вторая серия, 1 , 271–87 (1805). См. изображения страниц оригинала
См. изображения страниц оригинала
Прочитайте 21 октября 1803 г. [из репринта Alembic Club # 2]
1. Если некоторое количество чистой воды быстро вскипятить в течение короткого времени в сосуде с узким отверстием или подвергнуть его воздушному насосу, то воздух выпустить из приемника, содержащего воду, а затем быстро взбалтывать в течение через какое-то время почти весь газ, который может содержаться в воде, будет извлечен из нее.
2. Если количество воды, освобожденной таким образом от воздуха, взболтать в каком-нибудь газе, не соединившись химически с водой, то она поглотит большую часть газа или, иначе, часть его, равную какой-либо из следующих фракций, а именно: , 1/8, 1/27, 1/64, 1/125 и т. д. это кубы обратных натуральных чисел 1, 2, 3 и т. д. или 1/1, 1/2 3 , 1/3 3 , 1/4 3 и т.д. один и тот же газ всегда поглощается в одной и той же пропорции, как показано в следующей таблице: — Следует понимать, что количество газа должно быть измерено при давлении и температуре, при которых осуществляется пропитка .
| Поглощенная масса, основная масса воды равна единице. | |
|---|---|
| 1/1 3 = 1 | Углекислый газ, сероводород, закись азота[1]. |
| 1/2 3 = 1/8 | Олефиантовый газ голландских химиков. |
| 1/3 3 = 1/27 | Кислородный газ, азотистый газ, [2] карбюраторный водородный газ из стоячей воды. |
| 1/4 3 = 1/64 | Азотный газ, водородсодержащий газ, окись углерода. |
| 1/5 3 = 1/125 | Не обнаружено. |
3. Поглощенный таким образом газ может быть извлечен из воды в том же количестве и качестве, в каком он поступил, способами, указанными в 1-й статье.
4. Если количество воды, свободной от воздуха, смешать со смесью двух или более газов (например, с атмосферным воздухом), вода будет поглощать порции каждого газа так же, как если бы они были представлены ей по отдельности в их надлежащей плотности.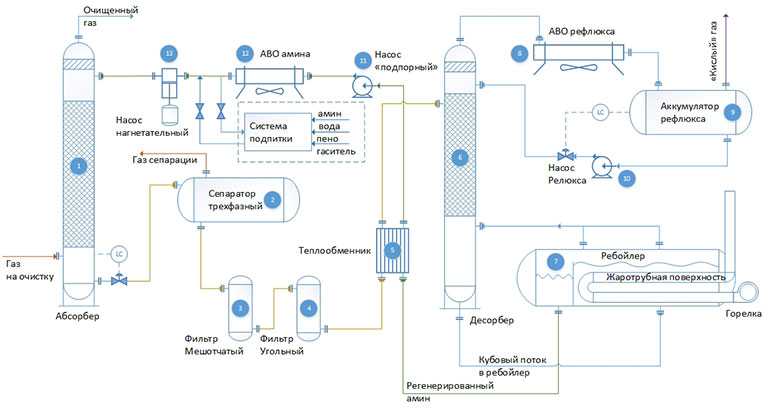
пр. гр. Атмосферный воздух, состоящий из 79 частей азотистого газа и 21 части кислородсодержащего газа, %.
| Поглощает воду | 1/64 от 79/100, | азотный газ = | 1,234 |
| ————— | 1/27 от 21/100, | кислородный газ = | .778 |
| 2.012 |
5. Если воду, пропитанную каким-либо одним газом (как водородосодержащим), смешать с другим газом, столь же поглощаемым (как азотным), то очевидно не будет поглощения последнего газа; после взбалтывания обнаруживается столько же газа, сколько было введено в воду; но при осмотре остаточный газ будет найден a смесь из двух, и части каждого в воде будут точно пропорциональны частям вне воды.
6. Если вода, пропитанная каким-либо одним газом, взбалтывается с другим газом, менее или более абсорбирующим; будет очевидно увеличение или уменьшение последнего; но при осмотре остаточный газ будет найден смесью из двух, и пропорции соответствуют статье 4.
7. Если количество воды в сосуде с притертой пробкой очень точно подобрано, встряхните его с любым газом или смесью газов до тех пор, пока в воду не попадет необходимая часть; затем, если пробка закрыта, пузырек может подвергаться воздействию любых вариаций температуры , не нарушая равновесия: То есть, количество газа в воде останется тем же самым независимо от того, подвергнута она воздействию тепла или холода, если пробка будет воздухонепроницаемой.
Н.Б. Флакон не должен быть почти полным воды, а температура должна быть между 32° и 212°.
8. Если вода будет пропитана одним газом (как кислородосодержащим), а другой газ, имеющий сродство к первому (как азотистый), будет взволнован вместе с ним; поглощение последнего газа будет больше на количество, необходимое для насыщения первого, чем это было бы, если бы вода была свободна от газа.
9. Большинство жидкостей без вязкости, таких как кислоты, спирт, жидкие сернистые соединения и солевые растворы в воде, поглощают такое же количество газов, как и чистая вода; за исключением того, что они имеют сродство к газу, как сероводороды к кислороду и т.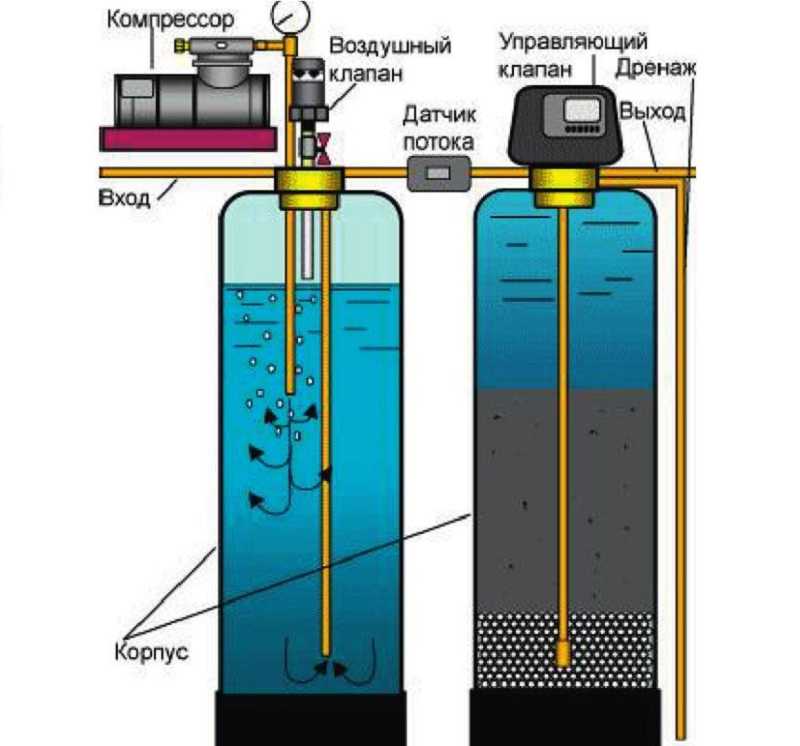 д.
д.
Предыдущие статьи содержат основные факты, необходимые для обоснования теории поглощения. Те, что следуют, имеют второстепенный характер и частично выводятся как их следствие.
10. Чистая дистиллированная вода, дождевая и родниковая вода обычно содержат почти свою долю атмосферного воздуха; если нет, то они быстро приобретают эту долю при взбалтывании в нем и теряют всякий другой газ, которым они могут быть пропитаны. Примечательно, однако, что вода в результате застоя при определенных обстоятельствах теряет часть или весь свой кислород, несмотря на ее постоянное воздействие атмосферы. Я постоянно обнаруживал, что это имеет место в моем большом деревянном пневматическом корыте, содержащем около 8 галлонов или 1-1/3 кубического фута воды. Всякий раз, когда он пополняется относительно чистой дождевой водой, он содержит свою долю атмосферного воздуха; но с течением времени ей становится не хватать кислорода: за три месяца вся поверхность покрылась пленкой, и в воде не было обнаружено никакого кислородосодержащего газа.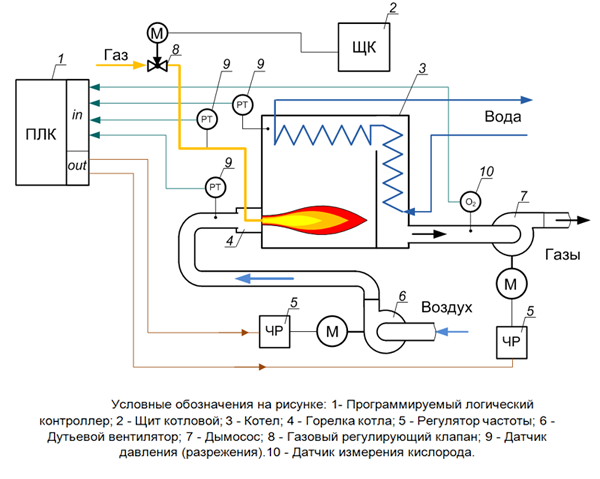 Оно стало оскорбительным, но не очень; он не был загрязнен какой-либо материальной частью металлических или сернистых смесей или каким-либо другим предметом, которому можно было бы приписать эффект. Количество азотного газа существенно не уменьшается из-за застоя, если вообще уменьшается. Эти обстоятельства, не замеченные должным образом, послужили источником большого разнообразия результатов различных философов о количестве и качестве атмосферного воздуха в воде. По статье 4 выясняется, что атмосферный воздух, вытесняемый из воды, должен иметь 38 процентов. кислород; тогда как по этой статье воздух может быть удален из воды, которая должна содержать от 38 до 0 процентов. кислорода. Я полагаю, что исчезновение кислородсодержащего газа в воде должно происходить из-за некоторых примесей в воде, которые соединяются с кислородом. Чистая дождевая вода, простоявшая больше года в глиняной бутылке, не потеряла ни капли кислорода.
Оно стало оскорбительным, но не очень; он не был загрязнен какой-либо материальной частью металлических или сернистых смесей или каким-либо другим предметом, которому можно было бы приписать эффект. Количество азотного газа существенно не уменьшается из-за застоя, если вообще уменьшается. Эти обстоятельства, не замеченные должным образом, послужили источником большого разнообразия результатов различных философов о количестве и качестве атмосферного воздуха в воде. По статье 4 выясняется, что атмосферный воздух, вытесняемый из воды, должен иметь 38 процентов. кислород; тогда как по этой статье воздух может быть удален из воды, которая должна содержать от 38 до 0 процентов. кислорода. Я полагаю, что исчезновение кислородсодержащего газа в воде должно происходить из-за некоторых примесей в воде, которые соединяются с кислородом. Чистая дождевая вода, простоявшая больше года в глиняной бутылке, не потеряла ни капли кислорода.
11. Если воду, свободную от воздуха, взбалтывать с небольшой порцией атмосферного воздуха (как 1/15 ее объема), то в остатке такого воздуха будет пропорционально меньше кислорода, чем в исходном: Если взять 1/15, как указано выше, то остаток будет иметь только 17 процентов.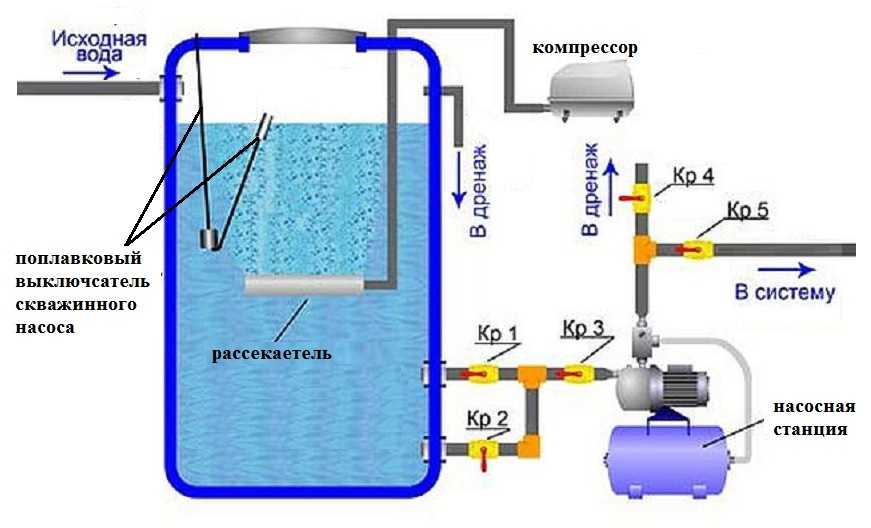 кислород; согласуется с принципом, установленным в статье 4. Это обстоятельство объясняет наблюдения, сделанные д-ром Пристли и г-ном Уильямом Генри, что вода поглощает кислород, а не азот.
кислород; согласуется с принципом, установленным в статье 4. Это обстоятельство объясняет наблюдения, сделанные д-ром Пристли и г-ном Уильямом Генри, что вода поглощает кислород, а не азот.
12. Если высокий стеклянный сосуд, содержащий небольшое количество газа, опрокинуть в глубокую ванну с водой и таким образом заключить газ в стекло, а воду быстро взбалтывать, то он постепенно исчезнет.
Удивительно, что д-р Пристли, который, по-видимому, первым обратил внимание на этот факт, усложнил его; потеря газов, очевидно, имеет механическую причину; волнение делит воздух на бесконечное число мельчайших пузырьков, которые, как можно видеть, пронизывают всю воду; они последовательно выталкиваются из-под края стекла в желоб и таким образом ускользают.
13. Если в последнем опыте в желобе будет старая стоячая вода, а объектом будет атмосферный воздух, кислородсодержащий газ будет очень скоро почти полностью извлечен и оставит остаток азотного газа; но если вода будет полностью пропитана атмосферным воздухом в начале, то остаточный газ, исследуемый в любое время, будет чистым атмосферным воздухом.
14. Если какой-либо газ, не содержащий ни азотистого, ни кислородсодержащего газа, взболтать над водой, содержащей атмосферный воздух, то обнаружится, что остаток содержит и азотистый, и кислородсодержащий газ.
15. Пусть количество воды содержит равные части любых двух или более неодинаково поглощаемых газов: например, азотного газа, кислородсодержащего газа и углекислого газа; затем пусть вода вскипятится или подвергнется воздушному насосу, и обнаружится, что будут вытеснены неравные части газов. Азотная часть будет наибольшей, затем кислородсодержащей, а угольная кислота будет наименьшей. Ибо предыдущая пропитка такова, что она обусловлена атмосферой следующих относительных сил;
| Азотик | 21 дюйм. ртути. |
| Кислородный | 9 |
| Углекислый | 1/3 |
Следовательно, при устранении этих сил наибольшая упругость углекислого газа и наименьшая из азотных газов; последняя будет даже настолько мала, что не сможет преодолеть сцепление воды без сильного волнения.
Замечания по авторитетности предыдущих фактов.
Чтобы представить цепь фактов как можно отчетливее, я до сих пор не упоминал, кем и каким образом они были установлены.
Факт, упомянутый в первой статье, давно известен; однако оставалось сомнение относительно количества воздуха, оставшегося в воде после вскипания и работы воздушного насоса. Я полагаю, что в последующих статьях это будет более ясно изложено.
При определении количества поглощенных газов я опирался на опыт мистера Уильяма Генри по этому вопросу, опубликованный в Philosophical Transactions за 1803 год. Благодаря взаимным сообщениям с тех пор мы смогли привести результаты наших экспериментов к близкому согласию; поскольку количества, которые он дал в своем приложении к этой статье, почти совпадают с теми, которые я указал во второй статье. В своих экспериментах с менее поглощаемыми газами или газами 2-го, 3-го и 4-го классов я использовал склянку, вмещающую 2700 гран воды, с очень точно притертой пробкой; в тех, у кого более всасываемая способность первого класса, я использовал трубку эвдиометра, должным образом градуированную и с таким отверстием, чтобы его можно было закрыть кончиком пальца. Его наполняли газом, а небольшую часть выбрасывали, помещая твердое тело под воду; количество было замечено по количеству воды, которая вошла при извлечении твердого тела, палец был приложен к концу, и вода внутри взбалтывалась; затем, убирая палец на мгновение под воду, вливали дополнительное количество воды, и перемешивание повторяли до тех пор, пока вода не переставала поступать, после чего проверяли количество и качество остаточного газа. На самом деле с помощью этой процедуры воду никогда нельзя было заставить поглотить большую часть газа; но если это заняло 9/10 или любой другой части, а остаточный газ имел чистоту 9/10, тогда предполагалось, что вода займет большую часть этого газа. Тот же принцип был и при использовании склянки; впускалось лишь небольшое количество газа, и перемешивание было более длительным.
Его наполняли газом, а небольшую часть выбрасывали, помещая твердое тело под воду; количество было замечено по количеству воды, которая вошла при извлечении твердого тела, палец был приложен к концу, и вода внутри взбалтывалась; затем, убирая палец на мгновение под воду, вливали дополнительное количество воды, и перемешивание повторяли до тех пор, пока вода не переставала поступать, после чего проверяли количество и качество остаточного газа. На самом деле с помощью этой процедуры воду никогда нельзя было заставить поглотить большую часть газа; но если это заняло 9/10 или любой другой части, а остаточный газ имел чистоту 9/10, тогда предполагалось, что вода займет большую часть этого газа. Тот же принцип был и при использовании склянки; впускалось лишь небольшое количество газа, и перемешивание было более длительным.
Во второй статье содержатся два очень важных факта. Во-первых, количество поглощенного газа равно плотности или давлению. Это было открыто м-ром Умом. Генри, прежде чем он или я сформировали какую-либо теорию по этому вопросу.
Другое состоит в том, что плотность газа в воде находится в особом отношении к плотности газа вне воды, причем расстояние между частицами внутри всегда несколько кратнее расстояния вне воды: Так, в случае угольной кислоты и т. д. расстояние внутри и снаружи одинаково, или газ внутри воды имеет ту же плотность, что и снаружи; в маслянистом газе расстояние частиц в воде вдвое больше, чем вне воды; в кислородсодержащем газе и т. д. расстояние внутри всего в три раза больше, чем снаружи; и в азотной, &c. это в четыре раза. Этот факт стал результатом моего собственного расследования. Первый из них, я думаю, определяет действие как механическое; и последний, по-видимому, указывает на принцип, по которому устанавливается равновесие.
Факты, отмеченные в 4-й, 5-й и 6-й статьях, были исследованы a priori на основе механической гипотезы и представления о различных действиях упругих жидкостей при их смешении. Было обнаружено, что результаты полностью согласуются с обоими или настолько близко, насколько это можно было ожидать от экспериментов такого рода.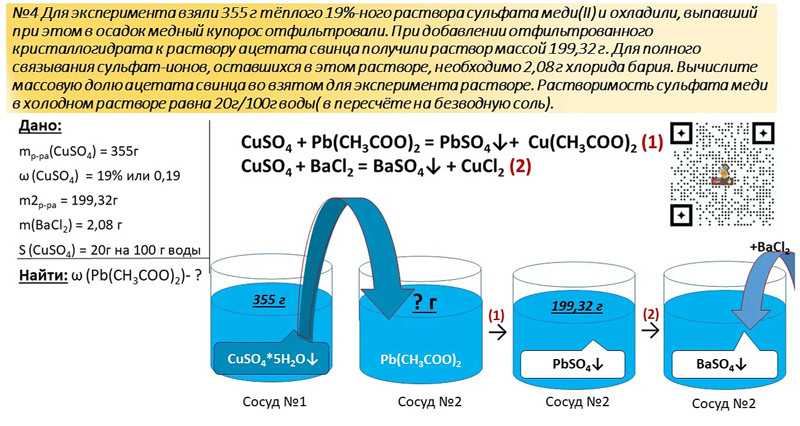
Факты, упомянутые в 7-й статье, имеют большое значение в теоретическом плане; ибо, если количество поглощенного газа зависит от механических принципов, на него не может повлиять температура содержащегося в нем воздуха, так как механическое действие внешнего и внутреннего воздуха одинаково увеличивается при нагревании, а плотность при этих обстоятельствах совершенно не изменяется. Я пробовал эксперименты при значительном разнообразии температур, не замечая никаких отклонений от принципа. Он заслуживает дальнейшего внимания.
Если вода, как указано в этом эссе, является простым вместилищем газов, она не может повлиять на их сродство: следовательно, то, что наблюдается в 8-м артикуле, слишком очевидно, чтобы нуждаться в объяснении. не по химической, а по механической причине можно ожидать, что все жидкости, имеющие одинаковую с водой текучесть, будут поглощать одинаковые порции газа. В нескольких испробованных мною жидкостях не было обнаружено заметной разницы; но это заслуживает дальнейшего изучения.
После того, что было замечено, кажется излишним добавлять какие-либо пояснения к 10-й и последующим статьям.
Теория поглощения газов водой и т.д.
Из фактов, изложенных в предыдущих статьях, кажется выводимой следующая теория поглощения газов водой.
1. Все газы, которые входят в воду и другие жидкости под действием давления и снова полностью высвобождаются при устранении этого давления, являются механически 9.0148 смешивается с жидкостью, а не химически соединяется с ней.
2. Газы, смешанные таким образом с водой и т. д. сохраняют свою эластичность или силу отталкивания среди своих собственных частиц точно так же в воде, как и вне ее, причем промежуточная вода не имеет в этом отношении никакого другого влияния, кроме простого вакуума.
3. Каждый газ удерживается в воде благодаря давлению газа своего рода, находящегося на его абстрактно рассматриваемой поверхности, и никакой другой газ, с которым он может быть смешан, не имеет в этом отношении никакого постоянного влияния.
4. Когда вода поглотила свою основную часть углекислого газа и т. д., газ вообще не давит на воду, а давит на сосуд, содержащий его, как если бы в нем не было воды. Когда вода поглотила свое надлежащее количество кислородсодержащего газа и т. д. то есть 1/27 своего объема, внешний газ давит на поверхность воды с 26/27 своей силы, а на внутренний газ с 1/27 своей силы, которая давит на сосуд, а не на воде. Для азотного и водородсодержащего газа пропорции составляют 63/64 и 1/64 соответственно. Когда вода не содержит газа, ее поверхность должна выдерживать все давление любого поступающего в нее газа до тех пор, пока газ частично не проникнет в воду.
5. Давление частицы газа на поверхность воды аналогично одиночному выстрелу, давящему на вершину квадратной их кучи. Как дробь распределяет свое давление поровну между всеми особями, образующими самый нижний слой кучи, так и частица газа распределяет свое давление поровну между каждым последующим горизонтальным слоем частиц воды вниз, пока не достигнет сферы влияния другой частицы газа. . Например; пусть любой газ давит с данной силой на поверхность воды, и пусть расстояние частиц газа друг от друга будет как 10 к 1; тогда каждая частица газа должна разделить свою силу поровну между 100 частицами воды следующим образом: — она действует непосредственно на 4 частицы воды; те 4 давят на 9, 9 на 16 и так далее в соответствии с порядком квадратных чисел, пока между 10 частицами воды не будет распределяться сила; и в том же самом слое каждый квадрат 100, имеющий лежащую на нем частицу газа, вода под этим слоем равномерно сжимается газом и, следовательно, ее равновесие не нарушается этим давлением.
. Например; пусть любой газ давит с данной силой на поверхность воды, и пусть расстояние частиц газа друг от друга будет как 10 к 1; тогда каждая частица газа должна разделить свою силу поровну между 100 частицами воды следующим образом: — она действует непосредственно на 4 частицы воды; те 4 давят на 9, 9 на 16 и так далее в соответствии с порядком квадратных чисел, пока между 10 частицами воды не будет распределяться сила; и в том же самом слое каждый квадрат 100, имеющий лежащую на нем частицу газа, вода под этим слоем равномерно сжимается газом и, следовательно, ее равновесие не нарушается этим давлением.
6. Когда вода поглотила 1/27 своей массы любого газа, слой газа на поверхности воды давит на воду с 26/27 своей силы, как указано в последней статье, и с силой 1/27 его силы на самый верхний слой газа в воде: расстояние между двумя слоями газа должно быть почти в 27 раз больше расстояния между частицами в окружающей атмосфере и в 9умноженное на расстояние частиц в воде. это сравнительно большое расстояние между внутренней и внешней атмосферой возникает из-за большой силы отталкивания последней из-за ее превосходящей плотности или из-за того, что она представляет 9 частиц поверхности другой 1. Когда 1/64 поглощается, расстояние атмосфер становится в 64 раза больше расстояния между двумя внешними частицами или в 16 раз больше внутреннего.
это сравнительно большое расстояние между внутренней и внешней атмосферой возникает из-за большой силы отталкивания последней из-за ее превосходящей плотности или из-за того, что она представляет 9 частиц поверхности другой 1. Когда 1/64 поглощается, расстояние атмосфер становится в 64 раза больше расстояния между двумя внешними частицами или в 16 раз больше внутреннего.
7. Равновесие между внешней и внутренней атмосферами не может быть установлено ни при каких других обстоятельствах, кроме как при условии, что расстояние между частицами одной атмосферы равно или несколько кратно расстоянию между частицами другой атмосферы; и, вероятно, кратное не может быть больше 4. Ибо в этом случае расстояние между внутренней и внешней атмосферой таково, что перпендикулярная сила каждой частицы первой действует на те частицы последней, которые непосредственно подвергаются ее воздействию. влияние, физически говоря, равное; и то же самое можно наблюдать относительно малой боковой силы.
8. Наибольшая трудность, сопровождающая механическую гипотезу, возникает из-за того, что разные газы подчиняются разным законам. Почему вода не допускает в своей массе в равной степени всех видов газа? Этот вопрос я должным образом обдумал, и хотя я еще не в состоянии полностью удовлетворить себя, я почти убежден, что это обстоятельство зависит от веса и количества газов. конечные частицы нескольких газов: те, частицы которых самые легкие и одиночные, наименее поглощаемы, а другие в большей степени соответствуют тому, как они увеличиваются в весе и сложности. Насколько мне известно, исследование относительных весов первичных частиц тел является совершенно новым предметом: в последнее время я занимаюсь этим исследованием с замечательным успехом. Принцип не может быть затронут в этой статье; но я просто присоединю результаты, насколько они кажутся подтвержденными моими экспериментами.
Наибольшая трудность, сопровождающая механическую гипотезу, возникает из-за того, что разные газы подчиняются разным законам. Почему вода не допускает в своей массе в равной степени всех видов газа? Этот вопрос я должным образом обдумал, и хотя я еще не в состоянии полностью удовлетворить себя, я почти убежден, что это обстоятельство зависит от веса и количества газов. конечные частицы нескольких газов: те, частицы которых самые легкие и одиночные, наименее поглощаемы, а другие в большей степени соответствуют тому, как они увеличиваются в весе и сложности. Насколько мне известно, исследование относительных весов первичных частиц тел является совершенно новым предметом: в последнее время я занимаюсь этим исследованием с замечательным успехом. Принцип не может быть затронут в этой статье; но я просто присоединю результаты, насколько они кажутся подтвержденными моими экспериментами.
Таблица относительных масс элементарных частиц газообразных и других тел.
| Водород | 1 |
| Азот | 4. 2 2 |
| Карбон | 4.3 |
| Аммиак | 5.2 |
| Кислород | 5,5 |
| Вода | 6,5 |
| Фосфор | 7,2 |
| Водород фосфористый | 8.2 |
| Азотистый газ | 9.3 [sic, а не 9.7—CJG] |
| Эфир | 9,6 |
| Газообразный оксид углерода | 9,8 |
| Закись азота | 13,7 [sic, а не 13,9—CJG] |
| Сера | 14,4 |
| Азотная кислота | 15,2 |
| Сероводород | 15,4 |
| Углекислота | 15,3 |
| Алкоголь | 15.1 |
| Сернистая кислота | 19,9 |
| Серная кислота | 25,4 |
| Карбюраторный водород из стоячей воды | 6,3 |
| Олефиантовый газ | 5.
|
