Содержание
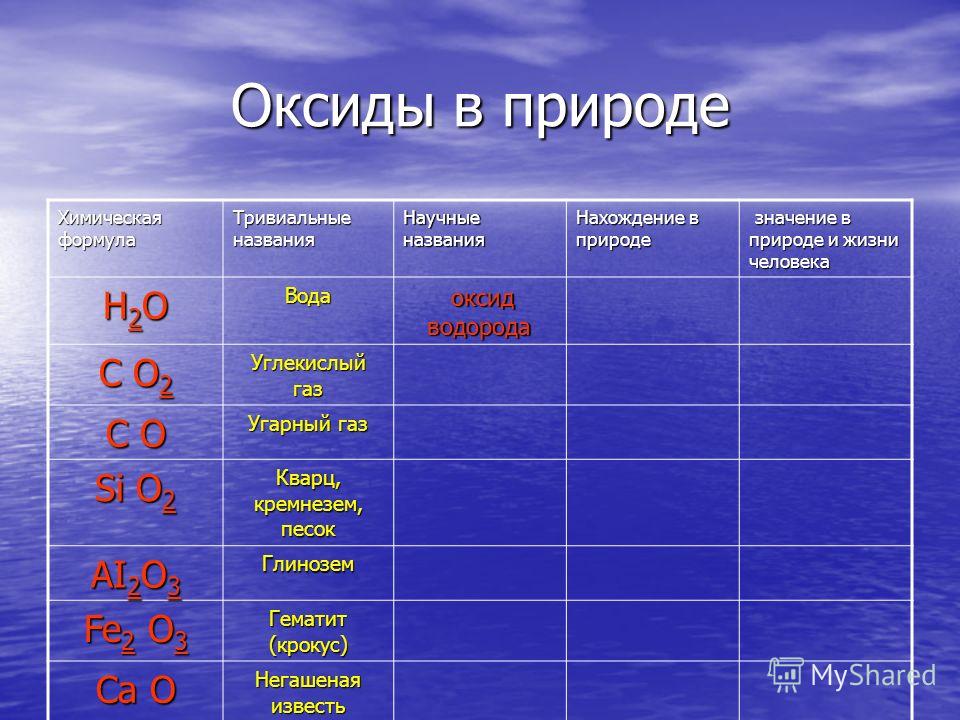
Дигидрогена монооксид
Дигидрогена монооксид — это научная шутка, очень удачная мистификация, где использовалось «химическое» название воды, неизвестное широкой публике, а также описание ее вещества, всячекси воздействующего на человека. Это была попытка убедить массы в тщательном регулировании или даже полном запрете на применение данного вещества. Главное предназначение шутки – показать, каким образом может создать панику отсутствие каких-либо научных знаний.
История шутки началась в 1990 году. Ее инициировала небольшая группа студентов Калифорнийского университета в Санта-Крусе в лице Мэтью Кауфмана, Эрика Лехнера и Ларса Норпченера. Они распространили в кампусе листовки, в которых содержалось предупреждение о том, что вода загрязнена опасным веществом под названием монооксид дигидроген. Дело в том, что перед этим в мичиганской газете «Дюранд экспресс» было опубликовано предупреждение о «гидроксиде водорода». После прочтения заметки Мэтью пришла аналогичная мысль, и трое приятелей решили придумать еще более опасный по звучанию термин. В результате предупреждение было напечатано Эриком на компьютере и размножено на копировальном аппарате.
В результате предупреждение было напечатано Эриком на компьютере и размножено на копировальном аппарате.
Ниже приведен текст листовки:
Недавно исследователи открыли факт загрязнения наших водопроводных систем опасным химикатом. Этот химикат бесцветный, безвкусный и не имеет запаха. Он убивает бесчисленное множество людей каждый год. Правительство не предприняло никаких попыток регулирования этого опасного заражения. Данный химикат называется «дигидрогена монооксид» (Dihydrogen monoxide).
Химикат используется для следующих целей:
В производстве как растворитель и охладитель
В ядерных реакторах
В производстве пенопласта
В огнетушителях
В химических и биологических лабораториях
В производстве пестицидов
В искусственных пищевых добавках
Химикат является основной составляющей кислотных дождей, способствует эрозии почвы, ускоряет коррозию и вредит большинству электроприборов.
Длительный контакт с химикатом в его твёрдой форме приводит к серьёзным повреждениям кожи человека, контакт с газообразной формой химиката приводит к сильным ожогам, вдыхание даже небольшого количества химиката грозит смертельным исходом. Химикат обнаружен в злокачественных опухолях, нарывах, язвах и прочих болезненных изменениях тела. Химикат развивает наркозависимость, жертвам при воздержании от потребления химиката грозит смерть в течение 168 часов.
Ни один известный очиститель не способен полностью очистить воду от этого химиката.
Несмотря на эти опасности, химикат активно и безнаказанно используется в индустрии. Многие корпорации ежедневно получают тонны химиката через специально проложенные подземные трубопроводы. Люди, работающие с химикатом, как правило, не получают спецодежды и инструктажа. Отработанный химикат тоннами выливается в реки и моря.
Мы призываем население проявить сознательность и протестовать против дальнейшего использования этого опасного химиката.
В 1994 году Крейгом Джексоном была создана веб-страница «Объединения за запрещение DHMO».
В 1997 году 14-летний Натан Зонер, ученик школы Игл-Рок (город Айдахо-Фолс, штат Айдахо), опросил 50 учащихся. Итогом стали 43 голоса за запрещение опасного химиката. Исследование, проведенное Зонером, получило название «Насколько мы легковерны?». Автор был удостоен первой премии на научной ярмарке Айдахо-Фолс. Журналист Джеймс К. Глассман придумал термин «зонеризм», в знак признания эксперимента молодого человека. Данное понятие означает применение факта, приводящего публику, не сведущую в математике и науке, к ложным выводам.
Кампания по запрещению дигидрогена монооксида на международном уровне была объявлена 1 апреля 1998 года членом австралийского парламента.
Номенклатура ИЮПАК была пересмотрена в 2005 году, после чего для неорганической химии единственно правильного названия какого-либо соединения не существует. Главная задача номенклатуры состоит в обеспечении отсутствия двусмысленности в отношении химических соединений. Другими словами, каждое название обозначает одно и то же вещество. Считается не столь важным для каждого из элементов обеспечить единое название, хотя количество допустимых имен ограничено. В данном случае, вполне приемлемым для воды считается название дигидрогена монооксид.
Другими словами, каждое название обозначает одно и то же вещество. Считается не столь важным для каждого из элементов обеспечить единое название, хотя количество допустимых имен ограничено. В данном случае, вполне приемлемым для воды считается название дигидрогена монооксид.
Эта история прекрасно демонстрирует то, что большинство людей слепо верит красивым терминам и всему научному.
Нам следует сделать важные выводы:
В демагогии термины помогут завоевать расположение толпы.
В троллинге термины помогут подорвать аргументы оппонента, вывести его из равновесия.
В дискуссии честные термины помогут наладить доверительные отношения. (Тут важно соблюдать меру, ведь избыток терминов оттолкнёт собеседника от дискуссии).
Водород (Hydrogene, H) — Актуальные публикации на сайте компании «НИИ КМ»
В периодической системе водород располагается в двух абсолютно противоположных по своим свойствам группах элементов. Данная особенность делают его совершенно уникальным. Водород не просто представляет собой элемент или вещество, но также является составной частью многих сложных соединений, органогенным и биогенным элементом. Поэтому рассмотрим его свойства и характеристики более подробно.
Водород не просто представляет собой элемент или вещество, но также является составной частью многих сложных соединений, органогенным и биогенным элементом. Поэтому рассмотрим его свойства и характеристики более подробно.
История открытия водорода
Выделение горючего газа в процессе взаимодействия металлов и кислот наблюдали еще в XVI веке, то есть во время становления химии как науки. Известный английский ученый Генри Кавендиш исследовал вещество, начиная с 1766 года, и дал ему название «горючий воздух». При сжигании этот газ давал воду. К сожалению, приверженность ученого теории флогистона (гипотетической «сверхтонкой материи») помешала ему прийти к правильным выводам.
Французский химик и естествоиспытатель А. Лавуазье вместе с инженером Ж. Менье и при помощи специальных газометров в 1783 г. провел синтез воды, а после и ее анализ посредством разложения водяного пара раскаленным железом. Таким образом, ученые смогли прийти к правильным выводам. Они установили, что «горючий воздух» не только входит в состав воды, но и может быть получен из нее.
В 1787 году Лавуазье выдвинул предположение, что исследуемый газ является простым веществом и, соответственно, относится к числу первичных химических элементов. Он назвал его hydrogene (от греческих слов hydor — вода + gennao — рождаю), т. е. «рождающий воду».
Русское название «водород» в 1824 году предложил химик М. Соловьев. Определение состава воды ознаменовало конец «теории флогистона». На стыке XVIII и XIX веков было установлено, что атом водорода очень легкий (по сравнению с атомами прочих элементов) и его масса была принята за основную единицу сравнения атомных масс, получив значение, равное 1.
Физические свойства
Водород является легчайшим из всех известных науке веществ (он в 14,4 раз легче воздуха), его плотность составляет 0,0899 г/л (1 атм, 0 °С). Данный материал плавится (затвердевает) и кипит (сжижается), соответственно, при -259,1 °С и -252,8 °С (только гелий обладает более низкими t° кипения и плавления).
Критическая температура водорода крайне низка (-240 °С). По этой причине его сжижение — довольно сложный и затратный процесс. Критическое давление вещества — 12,8 кгс/см², а критическая плотность составляет 0,0312 г/см³. Среди всех газов водород имеет наибольшую теплопроводность: при 1 атм и 0 °С она равняется 0,174 вт/(мхК).
По этой причине его сжижение — довольно сложный и затратный процесс. Критическое давление вещества — 12,8 кгс/см², а критическая плотность составляет 0,0312 г/см³. Среди всех газов водород имеет наибольшую теплопроводность: при 1 атм и 0 °С она равняется 0,174 вт/(мхК).
Удельная теплоемкость вещества в тех же условиях — 14,208 кДж/(кгхК) или 3,394 кал/(гх°С). Данный элемент слабо растворим в воде (около 0,0182 мл/г при 1 атм и 20 °С), но хорошо — в большинстве металлов (Ni, Pt, Pa и прочих), особенно в палладии (примерно 850 объемов на один объем Pd).
С последним свойством связана его способность диффундирования, при этом диффузия через углеродистый сплав (к примеру, сталь) может сопровождаться разрушением сплава из-за взаимодействия водорода с углеродом (этот процесс называется декарбонизация). В жидком состоянии вещество очень легкое (плотность — 0,0708 г/см³ при t° = -253 °С) и текучее (вязкость — 13,8 спуаз в тех же условиях).
Химические свойства водорода
Во многих соединениях этот элемент проявляет валентность +1 (степень окисления), подобно натрию и прочим щелочным металлам. Обычно он рассматривается в качестве аналога этих металлов. Соответственно он возглавляет I группу системы Менделеева. В гидридах металлов ион водорода проявляет отрицательный заряд (степень окисления при этом -1), то есть Na+H- имеет структуру, подобную хлориду Na+Cl-. В соответствии с этим и некоторыми другими фактами (близость физических свойств элемента «H» и галогенов, способность его замещения галогенами в органических соединениях) Hydrogene относят к VII группе системы Менделеева.
Обычно он рассматривается в качестве аналога этих металлов. Соответственно он возглавляет I группу системы Менделеева. В гидридах металлов ион водорода проявляет отрицательный заряд (степень окисления при этом -1), то есть Na+H- имеет структуру, подобную хлориду Na+Cl-. В соответствии с этим и некоторыми другими фактами (близость физических свойств элемента «H» и галогенов, способность его замещения галогенами в органических соединениях) Hydrogene относят к VII группе системы Менделеева.
В обычных условиях молекулярный водород имеет низкую активность, непосредственно соединяясь только с самыми активными из неметаллов (с фтором и хлором, с последним — на свету). В свою очередь, при нагревании он взаимодействует со многими химическими элементами.
Атомарный водород имеет повышенную химическую активность (если сравнивать с молекулярным). С кислородом он образует воду по формуле:
Н₂ + ½О₂ = Н₂О,
выделяя 285,937 кДж/моль тепла или 68,3174 ккал/моль (25 °С, 1 атм). В обычных температурных условиях реакция протекает довольно медленно, а при t° >= 550 °С — неконтролируемо. Пределы взрывоопасности смеси водород + кислород по объему составляют 4–94 % Н₂, а смеси водород + воздух — 4–74 % Н₂ (смесь из двух объемов Н₂ и одного объема О₂ называют гремучим газом).
Пределы взрывоопасности смеси водород + кислород по объему составляют 4–94 % Н₂, а смеси водород + воздух — 4–74 % Н₂ (смесь из двух объемов Н₂ и одного объема О₂ называют гремучим газом).
Данный элемент используют для восстановления большинства металлов, так как он отнимает кислород у оксидов:
Fe₃O₄ + 4H₂ = 3Fe + 4Н₂О,
CuO + H₂ = Cu + H₂O и т. д.
С разными галогенами водород образует галогеноводороды, к примеру:
Н₂ + Cl₂ = 2НСl.
Однако при реакции с фтором водород взрывается (это происходит и в темноте, при -252 °С), с бромом и хлором реагирует только при нагревании или освещении, а с йодом — исключительно при нагревании. При взаимодействии с азотом образуется аммиак, но лишь на катализаторе, при повышенных давлениях и температуре:
ЗН₂ + N₂ = 2NН₃.
При нагревании водород активно реагирует с серой:
Н₂ + S = H₂S (сероводород),
и значительно труднее — с теллуром или селеном. С чистым углеродом водород реагирует без катализатора, но при высоких температурах:
2Н₂ + С (аморфный) = СН₄ (метан).
Данное вещество непосредственно реагирует с некоторыми из металлов (щелочными, щелочноземельными и прочими), образуя гидриды, например:
Н₂ + 2Li = 2LiH.
Немаловажное практическое значение имеют взаимодействия водорода и оксида углерода (II). При этом в зависимости от давления, температуры и катализатора образуются разные органические соединения: НСНО, СН₃ОН и пр. Ненасыщенные углеводороды в процессе реакции переходят в насыщенные, к примеру:
СnН₂n + Н₂ = СnН₂n₊₂.
Водород и его соединения играют в химии исключительную роль. Он обусловливает кислотные свойства т. н. протонных кислот, склонен образовывать с разными элементами водородную связь, оказывающую значительное влияние на свойства многих неорганических и органических соединений.
Получение водорода
Основными видами сырья для промышленного производства этого элемента являются газы нефтепереработки, природные горючие и коксовые газы. Его также получают из воды посредством электролиза (в местах с доступной электроэнергией). Одним из важнейших методов производства материала из природного газа считается каталитическое взаимодействие углеводородов, в основном метана, с водяным паром (т. н. конверсия). Например:
Одним из важнейших методов производства материала из природного газа считается каталитическое взаимодействие углеводородов, в основном метана, с водяным паром (т. н. конверсия). Например:
СН₄ + H₂О = СО + ЗН₂.
Неполное окисление углеводородов кислородом:
СН₄ + ½О₂ = СО + 2Н₂.
Синтезированный оксид углерода (II) подвергается конверсии:
СО + Н₂О = СО₂ + Н₂.
Водород, производимый из природного газа, является самым дешевым.
Для электролиза воды применяется постоянный ток, который пропускается через раствор NaOH или КОН (кислоты не используют во избежание коррозии аппаратуры). В лабораторных условиях материал получают электролизом воды или в результате реакции между соляной кислотой и цинком. Однако чаще применяют готовый заводской материал в баллонах.
Из газов нефтепереработки и коксового газа данный элемент выделяют путем удаления всех остальных компонентов газовой смеси, так как они легче сжижаются при глубоком охлаждении.
Применение водорода
Промышленным образом этот материал стали получать еще в конце XVIII века. Тогда его использовали для наполнения воздушных шаров. На данный момент водород широко применяют в промышленности, главным образом — в химической, для производства аммиака.
Тогда его использовали для наполнения воздушных шаров. На данный момент водород широко применяют в промышленности, главным образом — в химической, для производства аммиака.
Массовые потребители вещества — производители метилового и прочих спиртов, синтетического бензина и многих других продуктов. Их получают синтезом из оксида углерода (II) и водорода. Hydrogene используют для гидрогенизации тяжелого и твердого жидкого топлива, жиров и пр., для синтеза HCl, гидроочистки нефтепродуктов, а также в резке/сварке металлов. Важнейшими элементами для атомной энергетики являются его изотопы — тритий и дейтерий.
Биологическая роль водорода
Около 10 % массы живых организмов (в среднем) приходится на этот элемент. Он входит в состав воды и важнейших групп природных соединений, включая белки, нуклеиновые кислоты, липиды, углеводы. Для чего он служит?
Этот материал играет решающую роль: при поддержании пространственной структуры белков (четвертичной), в осуществлении принципа комплиментарности нуклеиновых кислот (т. е. в реализации и хранении генетической информации), вообще в «узнавании» на молекулярном уровне.
е. в реализации и хранении генетической информации), вообще в «узнавании» на молекулярном уровне.
Ион водорода Н+ принимает участие в важных динамических реакциях/процессах в организме. В том числе: в биологическом окислении, которое обеспечивает живые клетки энергией, в реакциях биосинтеза, в фотосинтезе у растений, в бактериальном фотосинтезе и азотфиксации, в поддержании кислотно-щелочного баланса и гомеостаза, в мембранных процессах транспорта. Наряду с углеродом и кислородом он образует функциональную и структурную основы явлений жизни.
терминология — Относят ли химики воду к «моноксиду дигидрогена»?
спросил
Изменено
8 месяцев назад
Просмотрено
23 тысячи раз
$\begingroup$
Является ли название «моноокись дигидрогена» тем, что химики использовали бы для обозначения $\ce{h3O}$ (при условии, что общепринятого названия «вода» не существовало)?
Конечно, это по всему Интернету. Я настроен немного скептически, потому что подобное химическое вещество $\ce{h3S}$ называется «сероводородом», а не «моносульфидом дигидрогена».
Я настроен немного скептически, потому что подобное химическое вещество $\ce{h3S}$ называется «сероводородом», а не «моносульфидом дигидрогена».
- вода
- терминология
$\endgroup$
$\begingroup$
Нет, это не так. Название «моноксид дигидрогена» используется как часть розыгрыша. В научном сообществе есть химические названия воды, и какое из них используется в литературе, как правило, зависит от того, как она взаимодействует с чем-то другим (гидроксикислота и гидроксид водорода — два, которые я чаще всего слышал в кислотно-щелочных реакциях).
IUPAC, комитет по стандартам, который устанавливает стандартные названия для химических структур, предлагает «оксидан» в качестве отправной точки для создания других названий для химических веществ, полученных из воды. Однако они не предлагают использовать сам термин «оксидан» для обозначения простой воды.
Большинство химиков используют слово «вода» даже при написании научных статей.
$\endgroup$
0
$\begingroup$
Как и большинство других специалистов, отвечающих здесь, я выступил с несколькими докладами на международных конференциях и опубликовал несколько статей в рецензируемых журналах.
Я никогда не использовал термины монооксид дигидрогена или оксидан и не собираюсь делать это в серьезном научном контексте.
Как правило, говорят и пишут о воде , водных растворах и даже используют (традиционный) термин, например, рассол , когда речь идет о водном, насыщенном растворе хлорида натрия.
$\endgroup$
$\begingroup$
Я согласен с другими ответами. Ни один серьезный химик не использует ни одного слова, кроме «вода», на каком бы языке он ни говорил.
Однако это название соответствует установленным правилам систематического наименования бинарных ковалентных соединений основной группы.
Возьмем, к примеру, $\ce{N2O5}$:
- Перечислим элементы в порядке возрастания электроотрицательности: азот кислород
- Преобразуем названия второго элемента в «-ide»: оксид азота.
- Мы используем префиксы для обозначения номера каждого элемента. Обратите внимание, что «-a-» в «пента-» исчезает, чтобы пентоксид было легче произносить: пятиокись азота.
Нам нужна такая система, чтобы давать однозначные названия бинарным соединениям, особенно, когда, например, есть несколько оксидов азота: $\ce{N2O}$, $\ce{NO}$, $\ce{ N2O3}$, $\ce{NO2}$, $\ce{N2O4}$ и $\ce{N2O5}$.
Обратите внимание, что мы редко используем приставку «моно-»: $\ce{NO2}$ — двуокись азота.
И мы никогда не используем префиксы с бинарными гидридами. Все кислотные соединения называются так же, как ионные соединения, как и гидриды металлов, а некислотные все имеют общие названия, которые используются так часто, что глупо использовать более сложные названия:
- $\ce{NaH}$ гидрид натрия
- $\ce{Bh4}$ боран
- $\ce{Ch5}$ метан
- $\ce{Nh4}$ аммиак
- $\ce{h3O}$ вода
- $\ce{HF}$ фтороводород
- $\ce{Ph4}$ фосфин
- $\ce{h3S}$ сероводород
- $\ce{HN3}$ азид водорода
Таким образом,
Вода будет оксидом водорода , если угодно.
Хотя возможны и другие оксиды водорода (или гидриды кислорода), они имеют разные названия в зависимости от анионов:
- $\ce{h3O}$ — вода (оксид водорода)
- $\ce{HO2}$ — супероксид водорода
- $\ce{h3O2}$ — перекись водорода
- $\ce{h3O_n}$ — триоксидан (n=3), тетраоксидан (n=4), пентаоксидан (n=5)
$\endgroup$
2
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Обязательно, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
Каково химическое название воды? Химия, стоящая за водой
Первый квартал был сложным для химического сектора с многочисленными встречными ветрами, включая инфляцию RM, рост стоимости энергии/электроэнергии, повышенные затраты на логистику и уменьшение товарных запасов у клиентов. Тем не менее, конъюнктура спроса оставалась хорошей во всех химических сегментах, за исключением отечественных агрохимикатов, где сокращение запасов и отложенные дожди повлияли на продажи в первом квартале. На фоне европейских проблем, инфляции в США, российско-украинской войны, экспортного спроса не наблюдалось вялости, и руководство не сообщило ни о сокращении спроса, ни об отмене заказов ни в первом квартале, ни в начале второго квартала. Положительным моментом является то, что в целом цены на химические вещества снижались за последние пару месяцев, что должно отразиться на показателях за второй квартал. За исключением каких-либо непредвиденных событий, химический сектор, как ожидается, будет работать лучше в квартальном исчислении, и даже местная агрохимия, вероятно, преуспеет благодаря хорошему сезону дождей.
Тем не менее, конъюнктура спроса оставалась хорошей во всех химических сегментах, за исключением отечественных агрохимикатов, где сокращение запасов и отложенные дожди повлияли на продажи в первом квартале. На фоне европейских проблем, инфляции в США, российско-украинской войны, экспортного спроса не наблюдалось вялости, и руководство не сообщило ни о сокращении спроса, ни об отмене заказов ни в первом квартале, ни в начале второго квартала. Положительным моментом является то, что в целом цены на химические вещества снижались за последние пару месяцев, что должно отразиться на показателях за второй квартал. За исключением каких-либо непредвиденных событий, химический сектор, как ожидается, будет работать лучше в квартальном исчислении, и даже местная агрохимия, вероятно, преуспеет благодаря хорошему сезону дождей.
Комментарии руководства по операционной среде
— Инфляция в Молдавии – В первом квартале инфляция в Молдове повлияла на валовую прибыль, однако цены начали снижаться. Компании смогли пойти на повышение цен, чтобы преодолеть инфляцию в РМ
Компании смогли пойти на повышение цен, чтобы преодолеть инфляцию в РМ
— Затраты на электроэнергию/электроэнергию/уголь – Повышение затрат на энергию повлияло на операционные расходы, цены на уголь выросли в 2-3 раза в годовом исчислении, что не было полностью преодолено
— Логистика – Расширение логистики также повлияло на операционные расходы, однако в последние несколько недель фрахтовые ставки начали снижаться, что должно пойти на пользу компаниям
— Экспорт – Спрос остался/остается хорошим, несмотря на европейские проблемы, инфляцию в США и т.д. Компании не сталкивались с какими-либо проблемами со стороны спроса сокращение складских запасов, продажи Q1 были затронуты. Тем не менее, руководство указало, что в июле продажи вернулись на прежний уровень, что должно помочь во втором квартале
Операционные показатели в первом квартале 23 финансового года
— Всего 46 (исключая Tata Chem. и UPL) — валовая прибыль сократилась больше по сравнению с предыдущим кварталом.