Содержание
Состав воды и ее особенности
- Главная
- /
- Состав и технологии
- /
- Состав воды и ее особенности
Химический состав воды, мг/л:
Калий 2–20
Фтор 0,6–1,2
Кальций 25–80
Йод 0,06
Магний 5–50
HCO330–400
Общая минерализация 200–500 мг./л
Общая жесткость 1,5–7 мг-экв./л
Минерализация
Минерализация воды это суммарный количественный показатель содержания растворенных в ней веществ, среди которых наиболее распространены неорганические соли (минералы), в состав которых могут входить анионы и карбонаты, хлориды, сульфаты и др. катионы кальций, магний, натрий, калий, железо и др. Единица измерения минерализации миллиграммы на 1 дмі (мг/дм3 или мг/л). Практически этот показатель указывается на всех питьевых бутылированных водах.
Уровень минерализации природных вод может колебаться в широких границах. Но, с точки зрения ежедневного потребления воды человеком, оптимальным можно считать уровень 200–600 мг/л.
Но, с точки зрения ежедневного потребления воды человеком, оптимальным можно считать уровень 200–600 мг/л.
Калий (K)
Калий в организме необходим для нормального функционирования нервных клеток мозга и всего организма, деятельности мышц сердца, а также для вывода излишков воды и натрия.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1800 до 5000 миллиграммов. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания.
Фтор (F)
Фтор в организме на ряду с кальцием и фосфором принимает участие в построении костей и зубов, обеспечивает их твердость и крепость, стимулирует кроветворную систему и иммунитет, принимает участие в развитии скелета. Стимулирует репаративные процессы при переломах костей, а также предупреждает развитие сенильного остеопороза. Недостаток фтора в воде и пищевых продуктах способствует развитию кариеса зубов, а также снижает прочность костей.
Кальций (Са)
Особое значение для организма человека имеют ионы кальция, как основной структурный компонент в формировании опорных тканей. Недостаток в организме кальция ведет к остеопорозу, а недостаток его в водном обмене ведет к отекам.
Наличие в необходимых количествах ионов кальция питьевой воде стимулирует кроветворение, поддерживает высокий уровень обмена веществ, усиливает защитные реакции организма, способствует деятельности нервной системы, сокращению мышц, свертываемости крови и нормальной работе сердца.
Йод (I)
Основная биологическая функция йода состоит в поддержании функции щитовидной железы и построении ею гормона — тироксина. Йод пока является единственным известным микроэлементом, участвующим в образовании гормона. Недостаток йода в питьевой воде — это не только путь формирования патологии щитовидной железы, но и риск низкого уровня или неполного развития интеллектуальных возможностей человека. О необходимости йодирования питьевой воды говорится в постановлении Главного государственного санитарного врача РФ Г. Г. Онищенко «О коррекции качества питьевой воды по содержанию биогенных элементов».
Г. Онищенко «О коррекции качества питьевой воды по содержанию биогенных элементов».
Магний (Mg)
Работа всех других основных минералов в организме зависит от наличия магния. Например, магний активирует фермент, находящийся во всех оболочках клеток (мембранах). Этот фермент контролирует баланс натрия и калия, удерживая натрий вне клетки, а калий внутри клетки. Это необходимо для поддержания внутриклеточного водного баланса, активности нервных клеток и производства клеточной энергии. При дефиците магния в клетке калий быстро выводится из нее, вследствие чего создается внутри-клеточный дефицит калия, и этот дефицит, в свою очередь, приводит к быстрой утомляемости, упадку сил и слабости при жаре.
Химический состав водопроводной воды
Здоровье человека напрямую зависит от химического состава воды, которую он постоянно употребляет для питья и приготовления пищи. Большинство жилищ в нашей стране подключено к системам централизованного водоснабжения, поэтому важно знать, какие химические вещества содержатся в жидкости, текущей из крана на кухне и в ванной комнате.
Виды и количество химических веществ и соединений может отличаться в различных городах. Это связано с разными источниками водозабора, различной степенью изношенности трубопроводных коммуникаций, используемыми технологиями очистки.
Наиболее распространенные вещества
В воде чаще всего встречаются такие химические элементы и соединения:
- Кальций и магний в виде солей. Попадают в воду при ее прохождении через различные слои грунта. Они делают воду более жесткой, что приводит к появлению накипи на нагревательных элементах бытовых приборов, минеральным отложениям на сантехнике. Постоянное употребление воды с высокой жесткостью приводит к появлению камней в почках и печени. Для умягчения воды используются специализированные фильтры с загрузками из ионообменной смолы.
- Фтор. Этот элемент полезен для здоровья человека, из-за чего минеральную воду иногда искусственно фторируют. При недостаточном потреблении фтора у человека может появиться кариес и различные патологии внутренних органов.
 Рекомендуемое количество фтора в питьевой воде составляет 1,2 мг на литр.
Рекомендуемое количество фтора в питьевой воде составляет 1,2 мг на литр. - Марганец. Чаще всего присутствуют в воде из скважин вместе с растворенным двухвалентным железом. В централизованные водопроводные системы попадает как продукт жизнедеятельности марганцевых бактерий. В большинстве случаев его концентрация в воде не более 2 мг на литр, но для человеческого организма безопасной является норма в 0,5 мг. В противном случае возможны патологии печени и расстройства центральной нервной системы.
- Селен. Несмотря на некоторые исследования, которые говорят о пользе селена, постоянное употребление этого вещества с водой приводит к отравлениям организма, неправильной работе желудочно-кишечного тракта. Количество селена в водопроводной питьевой воде, согласно действующим нормам, не должно превышать 0,1 мг на литр.
- Молибден. Превышение количества этого химического элемента возможно только в населенных пунктах, где залегают молибденовые руды.
 В этом случае его количество в воде может достигать 200 мг на литр. Из-за этого вода становится немного терпкой. При постоянном употреблении такой воды появляется боль в суставах, нарушается работа почек и желудочно-кишечного тракта.
В этом случае его количество в воде может достигать 200 мг на литр. Из-за этого вода становится немного терпкой. При постоянном употреблении такой воды появляется боль в суставах, нарушается работа почек и желудочно-кишечного тракта. - Нитраты. Представляют собой соли азотной кислоты. Чаще всего обнаруживаются в природных водоемах и подповерхностных грунтовых водах. Попадают туда в результате нарушения технологии выращивания растений с использованием азотных удобрений. Наличие нитратов в воде становится причиной заболеваний крови и нарушений работы сердечно-сосудистой системы.
- Сероводород. Растворенный в воде газ придает ей характерный гнилостный запах, что делает ее употребление неприятным. Дополнительный минус в том, что этот газ при окислении приводит к появлению сульфидов, которые могут привести к отравлению человека.
Вещества, которые появляются после обработки
Помимо химических элементов, которые находятся в воде по естественным причинам, вода в водопроводе может быть загрязнена дополнительными соединениями, которые применяются при ее очистке.
- Коагулянты. Это вещества, которые используются для удаления микроскопических и коллоидных частиц путем их объединения в большие группы. Чаще всего в виде коагулянта используется алюминий. При нарушении технологии концентрация сульфата алюминия превышает норму, что приводит к повреждению нервной системы человека. Слишком большое потребление может вызвать остановку дыхания и сердца.
- Остаточный хлор. Этот газ и его соединения используются на станциях очистки для обеззараживания воды. Он добавляется также в воду перед транспортировкой по трубам для защиты от повторного заражения. Если на станции очистки будет нарушена технология, в воду попадет избыточный хлор, который не окислится. Он оказывает токсичное воздействие на организм и приводит к появлению множества заболеваний. Крайне рекомендуется очищать воду от хлора с помощью специальных фильтров с загрузками адсорбентами.
Кроме того, в воде могут содержаться медь и железо, пестициды, тяжелые металлы. При превышении предельно допустимых концентраций они оказывают отрицательное влияние на организм человека, вредят трубопроводам, бытовой технике, сантехническим приборам.
При превышении предельно допустимых концентраций они оказывают отрицательное влияние на организм человека, вредят трубопроводам, бытовой технике, сантехническим приборам.
Куда обратиться
Хотите обеспечить себя и своих близких чистой водой в квартире? Привести ее в точное соответствие с санитарными правилами и сделать более мягкой помогут фильтры для воды. Наша компания возьмет на себя выбор модулей системы водоподготовки, их установку в квартире и запуск в эксплуатацию. Для оформления заказа обратитесь к менеджерам отдела продаж.
Читайте также:
- Поможет ли хлорирование в проблеме очистки воды?
- Зачем нужно смягчать жесткую воду
Перейти в каталог
Свойства материи | manoa.hawaii.edu/ExploringOurFluidEarth
Вода повсюду
Люди ежедневно используют воду для питья, для очистки себя и своей одежды и для приготовления пищи. Поскольку люди так часто используют воду, легко забыть, насколько она важна и уникальна. Вода настолько распространена, что является отличным примером для изучения свойств материи.
Вода настолько распространена, что является отличным примером для изучения свойств материи.
Определение воды
Вода представляет собой соединение, состоящее из атомов двух элементов, водорода и кислорода, связанных вместе. Молекула воды состоит из двух атомов водорода (Н) и одного атома кислорода (О). Эта взаимосвязь выражается в химической формуле воды H 2 О (рис. 1.4). Химическая формула показывает количество атомов каждого элемента, которые объединяются в молекулу этого соединения. Сама по себе вода считается чистым веществом. Однако морская вода представляет собой смесь многих веществ, наиболее распространенным из которых является вода.
Деятельность
Вода является наиболее распространенным веществом на Земле и необходима для жизни. Определите, где находится вода, проверив ее наличие.
Состояние вещества
Существует четыре основных состояния материи: твердое, жидкое, газообразное и плазменное. На Земле наиболее распространены твердые, жидкие и газообразные состояния вещества. Вода является не только самым распространенным веществом на Земле, но и единственным веществом, которое обычно встречается в твердом, жидком и газообразном состояниях в пределах нормального диапазона земных температур. Это делает воду хорошей моделью для обсуждения твердого, жидкого и газообразного состояний материи.
На Земле наиболее распространены твердые, жидкие и газообразные состояния вещества. Вода является не только самым распространенным веществом на Земле, но и единственным веществом, которое обычно встречается в твердом, жидком и газообразном состояниях в пределах нормального диапазона земных температур. Это делает воду хорошей моделью для обсуждения твердого, жидкого и газообразного состояний материи.
На Земле вода существует в трех состояниях:
- Как жидкость , вода течет и принимает форму океана, озер и речных бассейнов. В жидкости молекулы воды расположены относительно близко друг к другу и могут свободно перемещаться друг вокруг друга (рис. 1.5 А).
Как твердое тело , вода принимает определенную форму, например, снежинка, кубик льда или ледник. В твердом теле молекулы воды расположены относительно близко друг к другу, но имеют различную форму. Вода — уникальное вещество, потому что ее молекулы
на самом деле дальше друг от друга в твердом состоянии, чем в жидком состоянии.
 В большинстве других веществ молекулы твердого тела расположены ближе друг к другу, чем молекулы жидкости (рис. 1.5 Б).
В большинстве других веществ молекулы твердого тела расположены ближе друг к другу, чем молекулы жидкости (рис. 1.5 Б).- Как газ , водяной пар может свободно перемещаться в атмосфере на большие расстояния. В газе молекулы воды относительно далеко друг от друга и могут свободно двигаться с высокой скоростью. Трудно сфотографировать воду в газообразном состоянии. Многие люди думают, что пар или облака — это водяной пар, но на самом деле это крошечные капельки жидкой воды, а не газообразной воды.
Плазма представляет собой газ, обладающий электрическим зарядом. Плазма очень распространена во Вселенной, из нее состоят звезды и пространство между планетами в нашей Солнечной системе. Плазму также можно найти на Земле в таких вещах, как флуоресцентные лампы и молнии. Однако плазма не является состоянием материи, которое является обычным или постоянным в естественном мире на Земле.
Физические и химические изменения
Изменения между состояниями вещества могут быть физическими или химическими изменениями. физическое изменение , химическая формула вещества остается прежней, хотя физические свойства могут измениться. Физические свойства включают вкус, запах, текстуру и цвет. Физические изменения обычно можно обратить вспять. Лед может таять, превращаясь в жидкость, которая может снова замерзнуть до твердого состояния. В каждом из состояний химическая формула воды H 2 O остается неизменной. Другими примерами физических изменений являются фильтрация, резка, плавление и окрашивание поверхности чего-либо краской, мелками или фломастерами. Примеры физического изменения показаны на рис. 1.6 А и Б.
физическое изменение , химическая формула вещества остается прежней, хотя физические свойства могут измениться. Физические свойства включают вкус, запах, текстуру и цвет. Физические изменения обычно можно обратить вспять. Лед может таять, превращаясь в жидкость, которая может снова замерзнуть до твердого состояния. В каждом из состояний химическая формула воды H 2 O остается неизменной. Другими примерами физических изменений являются фильтрация, резка, плавление и окрашивание поверхности чего-либо краской, мелками или фломастерами. Примеры физического изменения показаны на рис. 1.6 А и Б.
При химическом изменении конечный продукт химически отличается от исходного вещества, и химическая формула изменяется. Когда растение сахарного тростника биологически преобразует углекислый газ (CO 2 ), воду (H 2 O) и газообразный кислород (O 2 ) в глюкозу (C 6 H 12 O 6 ) , это химическое изменение.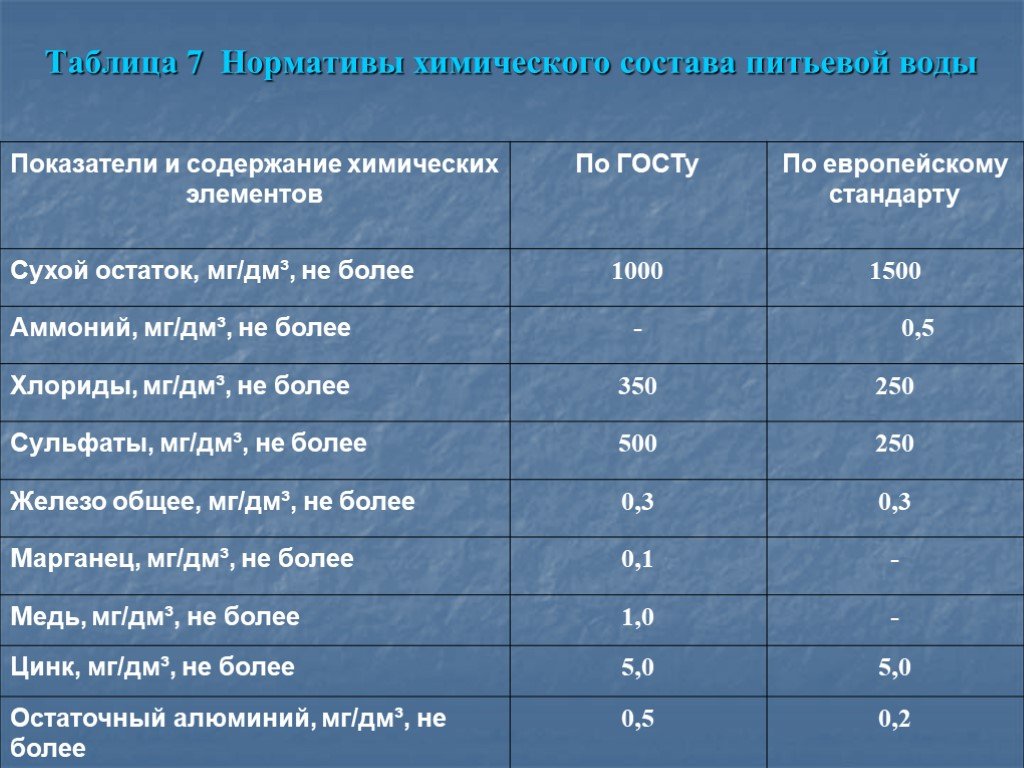 Поскольку химические изменения производят новые вещества, их нельзя легко обратить вспять. Глюкоза может быть снова расщеплена на компоненты только в результате другого химического превращения, такого как сжигание. Другими распространенными типами химических изменений являются приготовление пищи, ржавление и созревание. Примеры химических изменений показаны на рис. 1.6 С и Г.
Поскольку химические изменения производят новые вещества, их нельзя легко обратить вспять. Глюкоза может быть снова расщеплена на компоненты только в результате другого химического превращения, такого как сжигание. Другими распространенными типами химических изменений являются приготовление пищи, ржавление и созревание. Примеры химических изменений показаны на рис. 1.6 С и Г.
Химические изменения часто сопровождаются физическими изменениями, такими как изменение цвета. Это может затруднить различие между физическим изменением, которое является чисто физическим, и физическим изменением, вызванным химическим изменением. При чисто физическом изменении субстанции после изменения остаются теми же субстанциями, которыми они были до изменения. При раскрашивании листа бумаги карандашом мелок был нанесен поверх бумаги, но субстанциями по-прежнему являются воск для карандашей и бумага. Вещества можно разделить, соскребая воск с бумаги. При химическом изменении, таком как ржавление, вещества после изменения химически отличаются от веществ, существовавших до изменения. Когда кусок металла ржавеет, его цвет меняется, потому что железо химически соединяется с кислородом воздуха, образуя новое вещество — ржавчину. Не существует физического способа разделить ржавчину обратно на железо и газообразный кислород.
Когда кусок металла ржавеет, его цвет меняется, потому что железо химически соединяется с кислородом воздуха, образуя новое вещество — ржавчину. Не существует физического способа разделить ржавчину обратно на железо и газообразный кислород.
Понятия физических и химических изменений можно использовать для понимания различий между смесями и соединениями. В смеси два или более вещества, элемента или соединения физически соединяются. Свойства смеси обычно отражают свойства отдельных веществ. Например, если смешать соль с водой, получится соленая вода. Много раз смесь можно разделить на отдельные вещества путем физического превращения. Например, смесь помидоров, листьев салата, сухариков, моркови и изюма в салате можно разделить на отдельные составляющие.
В соединении два или более элемента соединены химически. Свойства соединения часто сильно отличаются от свойств отдельных элементов. Например, сахар в злаках, скорее всего, представляет собой глюкозу, C 6 H 12 O 6 . Глюкоза — сладкий белый кристалл (рис. 1.7 А), сильно отличающийся от углерода, водорода или кислорода, составляющих его элементов. Углерод (C) существует в природе либо в виде хрупкого черного твердого вещества (уголь), либо в виде мягкого серого твердого вещества (графит), либо в виде твердого прозрачного твердого вещества (алмаз), как показано на рис. 1.7 B, C и D. Водород (H 2 ) и кислород (O 2 ) существуют в природе в виде бесцветных газов без запаха. Невозможно разделить соединение физическими методами. Соединения могут быть разложены на составляющие их элементы только в процессе химического превращения.
Глюкоза — сладкий белый кристалл (рис. 1.7 А), сильно отличающийся от углерода, водорода или кислорода, составляющих его элементов. Углерод (C) существует в природе либо в виде хрупкого черного твердого вещества (уголь), либо в виде мягкого серого твердого вещества (графит), либо в виде твердого прозрачного твердого вещества (алмаз), как показано на рис. 1.7 B, C и D. Водород (H 2 ) и кислород (O 2 ) существуют в природе в виде бесцветных газов без запаха. Невозможно разделить соединение физическими методами. Соединения могут быть разложены на составляющие их элементы только в процессе химического превращения.
В таблице 1.3 показано, чем отличаются свойства элементов, входящих в состав соединений сульфата меди, хлорида натрия и сахарозы, от свойств образующихся соединений и смесей. Вы заполните столбец «Категория вопроса» в наборе вопросов «Свойства вопроса».
Набор вопросов
Часто задаваемые вопросы о химии воды
Что такое вода?
Вода является очень важным веществом, так как составляет большую часть тела организма. Но что такое вода? Внутри тела человека есть скелет, который делает ваше тело прочным и гарантирует, что вы сможете встать, не развалившись. Вода тоже своего рода скелет. Он состоит из мельчайших частиц, атомов, как и любое другое вещество на Земле. Один из этих атомов называется водородом, а другой кислородом. Как вы, наверное, знаете, воздух, которым мы дышим, также содержит кислород. Одна частица воды называется молекулой. Когда много молекул воды сливаются вместе, мы можем видеть воду и пить ее или использовать ее, например, чтобы смыть унитаз.
Но что такое вода? Внутри тела человека есть скелет, который делает ваше тело прочным и гарантирует, что вы сможете встать, не развалившись. Вода тоже своего рода скелет. Он состоит из мельчайших частиц, атомов, как и любое другое вещество на Земле. Один из этих атомов называется водородом, а другой кислородом. Как вы, наверное, знаете, воздух, которым мы дышим, также содержит кислород. Одна частица воды называется молекулой. Когда много молекул воды сливаются вместе, мы можем видеть воду и пить ее или использовать ее, например, чтобы смыть унитаз.
Как устроена молекула воды?
| Молекула воды состоит из трех атомов; атом кислорода и два атома водорода, которые связаны друг с другом, как маленькие магниты. Атомы состоят из вещества, которое имеет ядро в центре. Разница между атомами выражается атомными номерами. Атомный номер атома зависит от числа протонов в ядре атома. Протоны – это небольшие положительно заряженные частицы.  У водорода один протон в ядре, а у кислорода восемь. В ядре также есть незаряженные частицы, называемые нейтронами. У водорода один протон в ядре, а у кислорода восемь. В ядре также есть незаряженные частицы, называемые нейтронами. Помимо протонов и нейтронов, атомы также состоят из отрицательно заряженных электронов, которые можно найти в электронном облаке вокруг ядра. Количество электронов в атоме равно количеству протонов в ядре. Притяжение между протонами и электронами — это то, что удерживает атом вместе. |
Сколько весит молекула воды?
Вес молекулы определяется атомной массой атомов, из которых она состоит. Атомная масса атома определяется сложением количества протонов и нейтронов в ядре, потому что электроны почти ничего не весят. Когда известны атомные массы отдельных атомов, их нужно просто сложить, чтобы найти общую атомную массу молекулы, выраженную в граммах на моль. Моль — это выражение молярной массы молекулы, полученное из массы молекулы водорода, равной 1 моль.
Водород имеет относительную атомную массу 1 г/моль, а кислород имеет относительную атомную массу 16 г/моль. Вода состоит из одного атома кислорода и двух атомов водорода. Это означает, что масса молекулы воды равна 1 г + 1 г + 16 г = 18 г/моль.
Вода состоит из одного атома кислорода и двух атомов водорода. Это означает, что масса молекулы воды равна 1 г + 1 г + 16 г = 18 г/моль.
Когда число молей воды известно, можно рассчитать, сколько это граммов веса, используя молярную массу воды.
Молярный вес отдельных атомов можно найти в периодической таблице Менделеева.
В каких состояниях (фазах) может находиться вода?
Вода существует в трех состояниях: твердом, жидком и газообразном. При нормальной температуре около 25 o С он жидкий, но ниже 0 o С он замерзнет и превратится в лед. Воду можно найти в газообразном состоянии выше 100 o С, это называется точкой кипения воды, при которой вода начинает испаряться. Вода превращается в газ и становится бесцветной и без запаха.
Скорость испарения воды зависит от температуры; если температура высокая, вода испарится быстрее.
Что произойдет, если вода изменит фазу?
Фазовые превращения воды |
Переходы из жидкости в твердое или газообразное состояние называются фазовыми переходами. Когда такое вещество, как вода, меняет фазу, меняется его внешний вид, но не химические свойства. Это связано с тем, что химическая структура остается прежней, но молекулы, из которых она состоит, будут плавать немного дальше друг от друга. В твердом состоянии молекулы воды расположены довольно близко друг к другу, а в жидком — немного дальше друг от друга. Вода становится жидкой в результате расщепления молекул. Когда вода переходит из жидкого состояния в газообразное, молекулы расходятся еще дальше, поэтому мы не можем этого обнаружить.
Когда такое вещество, как вода, меняет фазу, меняется его внешний вид, но не химические свойства. Это связано с тем, что химическая структура остается прежней, но молекулы, из которых она состоит, будут плавать немного дальше друг от друга. В твердом состоянии молекулы воды расположены довольно близко друг к другу, а в жидком — немного дальше друг от друга. Вода становится жидкой в результате расщепления молекул. Когда вода переходит из жидкого состояния в газообразное, молекулы расходятся еще дальше, поэтому мы не можем этого обнаружить.
Почему лед плавает на воде?
Когда вещества замерзают, молекулы обычно сближаются. Вода там имеет аномалию: ниже 0 o С она замерзает, но при температуре ниже 4 o С вода снова начинает расширяться и в результате плотность становится меньше. Плотность вещества означает вес в килограммах кубического метра вещества. Когда два вещества смешиваются, но не растворяются друг в друге, вещество с наименьшей плотностью всплывает на другое вещество. В данном случае этим веществом является лед из-за пониженной плотности воды.
В данном случае этим веществом является лед из-за пониженной плотности воды.
Почему не все вещества растворимы в воде?
Полярность определяет, растворимо ли вещество в воде. Полярное вещество — это вещество, имеющее два вида «полюсов», как в магните. Когда другое вещество также полярно, полюса веществ притягиваются друг к другу, и в результате вещества смешиваются. Затем вещество растворяется в воде.
Вещества, не содержащие «полюсов», называются аполярными веществами. Нефть, например, является аполярным веществом, поэтому масло не растворяется в воде. На самом деле он плавает на воде, как лед, из-за меньшей плотности.
Что такое жесткая вода?
Когда воду называют «жесткой», это просто означает, что она содержит больше минералов, чем обычная вода. Это прежде всего минералы кальций и магний. Степень жесткости воды увеличивается, когда растворяется больше кальция и магния.
Магний и кальций являются положительно заряженными ионами. Из-за их присутствия другие положительно заряженные вещества будут хуже растворяться в жесткой воде, чем в воде, не содержащей кальция и магния. Это является причиной того, что мыло практически не растворяется в жесткой воде.
Из-за их присутствия другие положительно заряженные вещества будут хуже растворяться в жесткой воде, чем в воде, не содержащей кальция и магния. Это является причиной того, что мыло практически не растворяется в жесткой воде.
Для получения дополнительной информации о жесткой воде см. Часто задаваемые вопросы по умягчителю воды
Каковы физические и химические свойства?
Физические свойства вещества — это свойства, имеющие прямое отношение к внешнему виду вещества. Химические свойства — это свойства, которые часто используются в химии для определения состояния вещества. Физические и химические свойства могут рассказать нам кое-что о поведении вещества в определенных обстоятельствах.
Какими физическими и химическими свойствами обладает вода?
Существует несколько различных физических и химических свойств, которые часто используются попеременно. Мы можем назвать следующее:
— Плотность. Плотность воды означает вес определенного количества воды.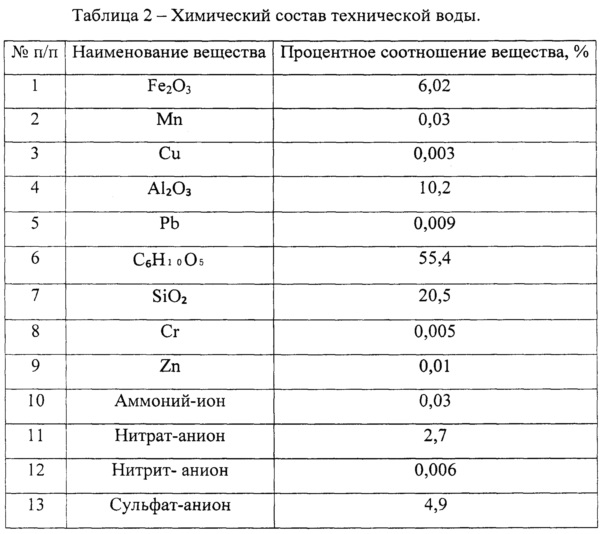 Обычно выражается в килограммах на кубический метр. (физический)
Обычно выражается в килограммах на кубический метр. (физический)
— Термические свойства. Это относится к тому, что происходит с водой при нагревании; при какой температуре он становится газообразным и тому подобное. (физический)
— Проводимость. Это означает количество электричества, которое может проводить вода. Он выражается в химической величине. (физический)
— Поглощение света. Это количество света, которое определенное количество воды может поглотить с течением времени. (химический)
— Вязкость. Это означает сгущенность воды и определяет подвижность воды. При повышении температуры вязкость ухудшается; это означает, что вода будет более подвижной при более высоких температурах. (физический)
— рН. pH имеет собственную шкалу от 1 до 14. pH показывает, является ли вещество кислым (pH 1-6), нейтральным (pH 7) или щелочным (pH 8-14). Количество атомов водорода в веществе определяет рН. Чем больше атомов водорода содержит вещество, тем ниже будет рН. Вещество, содержащее много атомов водорода, называется кислотой.

 Рекомендуемое количество фтора в питьевой воде составляет 1,2 мг на литр.
Рекомендуемое количество фтора в питьевой воде составляет 1,2 мг на литр. 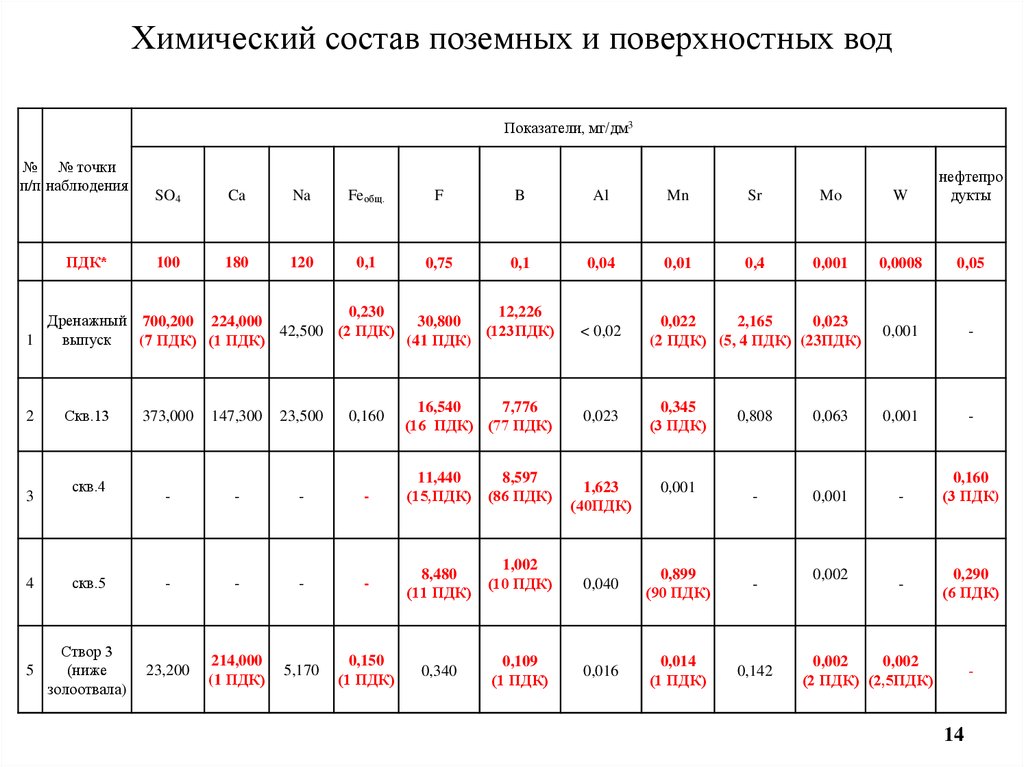 В этом случае его количество в воде может достигать 200 мг на литр. Из-за этого вода становится немного терпкой. При постоянном употреблении такой воды появляется боль в суставах, нарушается работа почек и желудочно-кишечного тракта.
В этом случае его количество в воде может достигать 200 мг на литр. Из-за этого вода становится немного терпкой. При постоянном употреблении такой воды появляется боль в суставах, нарушается работа почек и желудочно-кишечного тракта. 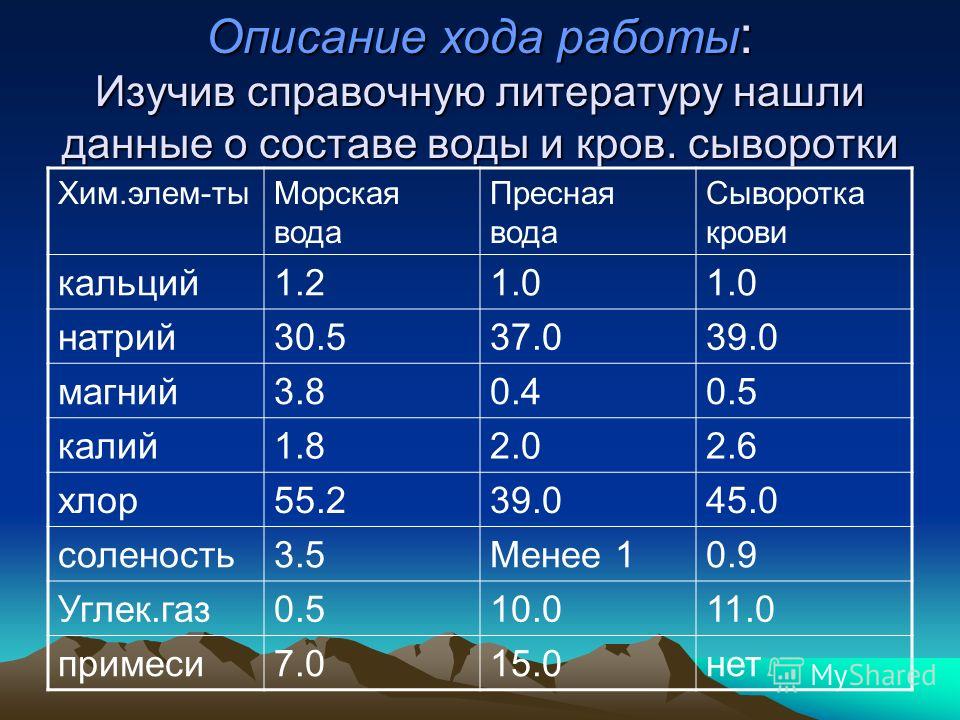 В большинстве других веществ молекулы твердого тела расположены ближе друг к другу, чем молекулы жидкости (рис. 1.5 Б).
В большинстве других веществ молекулы твердого тела расположены ближе друг к другу, чем молекулы жидкости (рис. 1.5 Б).