Содержание
Вопреки законам физики. Почему вода — это уникальное химическое соединение? | Наука | Общество
Дмитрий Писаренко
Примерное время чтения: 5 минут
14738
Shutterstock.com
9 августа 1776 года родился итальянский химик Амедео Авогадро, впервые записавший химическую формулу воды как Н2O. Учёные и раньше знали о том, что это не химический элемент, а соединение водорода с кислородом в определённой пропорции, а слово «водород», собственно, и означало «порождающий воду». Но дальнейшие исследования показали, что за незатейливой формулой Н2О и структурой молекулы, имеющей симметричную V-образную форму, скрываются уникальные свойства вещества, без которого, как мы знаем, жизнь на Земле была бы невозможной.
АиФ.ru популярно объясняет, в чём же заключаются необычные свойства воды и почему они не подчиняются логике законов физики.
Амедео Авогадро, с рисунка К. Сентье, 1856 год. Фото: Public Domain
Природный аккумулятор тепла
Молекула Н2O — это два небольших атома водорода, присоединённые к крупному атому кислорода и образующие угол 104,45°. Такая структура отличает её от других трёхатомных молекул, где все атомы располагаются цепочкой. Это нестандартное расположение атомов и наделяет воду необычными свойствами, хотя дело не только в нём.
Во-первых, вода имеет аномально высокую теплоёмкость. Скажем, удельная теплоёмкость железа составляет 460, бетона — 880, керосина — 2140, а воды — аж 4200 Дж/(кг·°С)! Это значит, что, если вы захотите нагреть 1 килограмм воды на 1°С, вам придётся затратить значительно больше энергии, чем при аналогичном нагревании других жидкостей, да и не только их. Благодаря этому физическому свойству вода способна аккумулировать, т. е. надолго сохранять, тепло. А поскольку наше тело на две трети состоит из неё, это даёт ему возможность поддерживать температуру на одном уровне всегда — и жарким днём, и прохладной ночью. Высокая теплоёмкость воды защищает организм как от перегрева, так и от быстрого охлаждения. Будь иначе, любая тренировка и нагрузка на мышцы приводили бы к интенсивному разогреву тела и тепловому удару изнутри.
Высокая теплоёмкость воды защищает организм как от перегрева, так и от быстрого охлаждения. Будь иначе, любая тренировка и нагрузка на мышцы приводили бы к интенсивному разогреву тела и тепловому удару изнутри.
Более того, удельная теплоёмкость воды зависит от температуры, и эта зависимость имеет свой минимум. Он приходится на 37°С. Именно в районе этой отметки внутренние жидкости человека наилучшим образом регулируют процессы теплообмена и позволяют поддерживать комфортное состояние при минимуме энергетических затрат. Иначе говоря, организм находится в оптимальном энергетическом состоянии. Вот почему нормальная температура тела — это 37°С (мы привыкли к 36,6°С, но мы держим градусник под мышкой, а наши внутренние органы всегда имеют более высокую температуру).
Аномально большая теплоёмкость воды полезна не только человеку и животным, но и окружающей среде в целом. Земные водоёмы, в первую очередь Мировой океан, являясь гигантскими аккумуляторами тепла, выступают в роли природных термостатов. То есть поддерживают температуру атмосферы в удобном для нас диапазоне. Летом они защищают планету от перегрева, зимой — от переохлаждения. Именно поэтому климат в прибрежных странах мягче: близость воды предохраняет его от резких перепадов температуры, чего не скажешь о территориях, расположенных в глубине континентов.
То есть поддерживают температуру атмосферы в удобном для нас диапазоне. Летом они защищают планету от перегрева, зимой — от переохлаждения. Именно поэтому климат в прибрежных странах мягче: близость воды предохраняет его от резких перепадов температуры, чего не скажешь о территориях, расположенных в глубине континентов.
Второе тепловое свойство воды — её высокая удельная теплота плавления. Говоря простым языком, чтобы растопить лёд, нужно затратить много энергии. По этой причине снег весной тает медленно — почва успевает впитать в себя влагу и отправить её в реки. Конечно, без паводков не обходится, но если бы снег и лёд таяли быстрее, было бы гораздо хуже. С другой стороны, заморозить воду тоже трудно. Это её качество делает климат на планете в целом достаточно стабильным, хотя в последние десятилетия он и стал более капризным.
«Плавучее одеяло» для подводного мира
О том, что вода при замерзании расширяется, мы знаем с детства. Оставьте на морозе бутылку с водой — она лопнет. Но мало кто задумывается, что благодаря этому свойству воды на Земле и зародилась жизнь.
Но мало кто задумывается, что благодаря этому свойству воды на Земле и зародилась жизнь.
Большинство веществ при охлаждении и замерзании уменьшаются в объёме, что приводит к увеличению их плотности. А вот вода ведёт себя иначе. Охлаждаясь, она сначала тоже становится плотнее и сжимается, но, достигнув максимальной плотности при 4°С, затем начинает расширяться. В момент замерзания она и вовсе увеличивает объём скачкообразно — более чем на 8%.
Таким образом, замёрзшая вода становится легче жидкой, поэтому лёд держится на поверхности водоёмов, а не опускается на дно. Будь иначе, реки, озёра и моря в зимние месяцы промерзали бы целиком, превращаясь в гигантские глыбы льда. А оставаясь на поверхности, лёд препятствует дальнейшему замерзанию водоёмов, играет роль «плавучего одеяла» и выполняет полезную функцию — защищает от гибели весь подводный мир, всех обитающих в нём существ. Если бы не аномальная способность воды расширяться при замерзании, возникшая на Земле жизнь, скорее всего, погибла бы при первом похолодании.
Ещё вода — хороший растворитель, и за это чудесное свойство мы ей тоже должны сказать спасибо. Ведь благодаря ему в нашем организме протекают жизненно важные процессы: вода с растворёнными в ней компонентами твёрдых веществ становится поставщиком всех необходимых нам микроэлементов. Содержась в нашей крови и лимфе, она разносит питательные вещества по всем тканям и их клеткам.
Вода на Земле постоянно очищает саму себя: замерзая, она вытесняет из кристаллической решётки льда всё лишнее. Поэтому даже на поверхности грязной лужи будут плавать практически прозрачные льдинки. А растаяв, вода вновь начинает растворять в себе почти все твёрдые вещества, с которыми встречается и соприкасается. И это такой же циклический процесс, как её круговорот в природе.
водахимияученый Амедео Авогадрополезные свойства
Следующий материал
Новости СМИ2
Физические и химические свойства воды.
В течение многих веков люди представить себе не могли, чем на самом деле является вода и как она образовалась на планете. Вплоть до 19 столетия люди не знали, что на самом деле вода является химическим элементом. Считалось, что она – обычный химический элемент. Сравнительно недавно было открыто, что вода – это химический элемент, формула которого – Н2О.
Вплоть до 19 столетия люди не знали, что на самом деле вода является химическим элементом. Считалось, что она – обычный химический элемент. Сравнительно недавно было открыто, что вода – это химический элемент, формула которого – Н2О.
Химические свойства воды зависят от физической природы ее атомов, а также способов их объединения в молекулу и последующей группировки образовавшихся молекул. Так как она постоянно контактирует с различными веществами, вода является раствором с очень сложным составом. Более того, она проявляется себя как прекрасный растворитель, так как она способна растворить и жидкости, и твердые тела, и газы.
Особенно хорошо свойства такого растворителя проявляют себя в морской воде, так как она может растворить практически все вещества. Примерно семьдесят элементов периодической системы можно обнаружить в ее составе. В морской и океанской воде можно обнаружить даже редкие радиоактивные элементы. Наиболее часто встречаемые вещества в составе воды – это хлор, натрий, сера, калий, магний, кальций, стронций, бром, углерод и бор.
На сегодняшний день исследователи раскрывают все более сложные и тонкие механизмы организации водной массы. Ее считают наиболее трудным соединением из всех веществ, известных физикам и химикам. По химическому составу вода может и не различаться, но при этом она будет иметь различное влияние на организм человека, так как формировалась она в определенных условиях.
Химические свойства воды также зависят о ее молекулярной структуры. В частности, молекула воды состоит из трех атомов, которые сформированы в виде равнобедренного треугольника. В его вершине находится атом кислорода, тогда как в основании лежат два атома водорода. При этом валентный угол соединения НОН равняется 104,31°.
Есть также некоторые физические и химические свойства воды, которые идут вразрез с принципами таблицы Менделеева. В частности, наиболее высокими характеристиками у воды являются те, которые по сути своей должны быть гораздо ниже. Это касается температуры замерзания и кипения, теплоты плавления и парообразования.
Температура замерзания и кипения у гидридных элементов кислородной подгруппы по мере облегчения соединения снижается. Если бы такая закономерность действовала на воду, то она закипала бы при глубоко отрицательном температурном значении, при -70°С, а замерзала бы при -90°С. Это, в свою очередь, спровоцировало бы отсутствие воды на Земле, так как она не смогла бы содержаться ни в жидком, ни в твердом состоянии. Единственно возможный вариант – это газообразное состояние.
Касательно теплоты парообразования можно сказать, что для испарения воды, нагретой до 100°С, необходимо в 6 раз больше тепла, чем для нагрева аналогичной массы воды до 80°С.
С каждой минутой миллион тонн воды в гидросфере испаряется от солнечного тепла. В результате такого воздействия в атмосфере постоянно содержится огромное количество теплоты, которое эквивалентно тому, что выработали бы 40 тысяч мощнейших электростанций.
Такие уникальные физические и химические свойства воды позволяют широко использовать ее в производственной деятельности. В частности, на металлургических производствах в большинстве своем используется кипяток для охлаждения. Такой, казалось бы, парадоксальный поступок объясняется тем, что охлаждение происходит за счет теплоты парообразования. При этом отпадает необходимость в сооружении лишних градирен.
В частности, на металлургических производствах в большинстве своем используется кипяток для охлаждения. Такой, казалось бы, парадоксальный поступок объясняется тем, что охлаждение происходит за счет теплоты парообразования. При этом отпадает необходимость в сооружении лишних градирен.
Конечно, кипяток в качестве охладителя можно использовать только на тех объектах, где температура нагрева превышает показатель в 100°С.
Уникальные физико-химические свойства воды позволяют использовать ее в сельском хозяйстве, и не только для полива растений. К примеру, когда поздней весной случаются внезапные заморозки, угрожающие цветущим деревьям, садоводы проводят так называемое дождевание сада. Пелена мелких брызг окутывает собой мерзнущие деревья. Также капли воды покрывают сами цветы. Затем она быстро превращается в лед и укрывает собой цветы, отдавая им свое тепло.
Как видим, вода, химические свойства которой еще не изучены в полной мере, – это уникальнейшее соединение, которое поддерживает все живое на планете и является неотъемлемой частью человеческого быта.
3.1 Химические элементы и вода
Предыдущий
Следующий
Список
3.1.1 Укажите, что наиболее часто встречающимися химическими элементами в живых существах являются углерод, водород, кислород и азот
Приблизительные пропорции четырех основных элементы в живых существах:
• Углерод (19%) • Водород (10%) • Кислород (65%) • Азот (3%)
0009 3.1.2 Укажите, что живым организмам необходимы различные другие элементы, включая серу, кальций, фосфор, железо и натрий
Помимо четырех основных элементов, живые существа могут содержать следовые количества примерно 20 других элементов, включая:
• Сера (0,25%) • Кальций (1,5%) • Фосфор (1%) • железо (0,7%) • натрия (0,15%)
3,1,3. Обратите внимание по одной роли для каждого из упомянутых в элементах. 3.1.2
Сера (S): Содержится в некоторых аминокислотах (цистеине и метионине), позволяя белкам образовывать дисульфидные связи
Кальций (Ca): Содержится в костях и зубах, также участвует в высвобождении нейротрансмиттеров в синапсах
Фосфор (P): Компонент нуклеиновых кислот и клеточных мембран
Железо (Fe): Содержится в гемоглобине (животных), обеспечивая транспорт кислорода импульсы в нейронах
3. Водородная связь между молекулами воды Структура и связывание молекул воды 3.1.5 Опишите термические, когезионные и растворяющие свойства воды Термические свойства Когезионные свойства Свойства растворителя Другие свойства 3. Хладагент Среда для метаболических реакций Транспортная среда Поверхностное натяжение Питер С. Информация об элементах На данный момент идентифицировано более 120 элементов. В Периодической таблице (см. выпуск WC&P за июль 2009 г.) перечислено 118. Недавние открытия — это элементы, которые существуют в течение наносекунд, прежде чем разрушиться. Понимание периодической таблицы зависит от знания важности и обозначений перечисленных чисел. Атомный номер — это количество протонов в атоме, а атомный вес — это количество протонов плюс количество нейтронов в атомном элементе. Атом На орбите вокруг ядра находятся электроны, равные протонам и отрицательные. Эти электроны очень малы, и их масса считается незначительной, они весят в 2000 раз меньше, чем протон или нейтрон (график 3). По самой своей природе химические реакции включают взаимодействие/обмен электронами внутри орбитальной структуры или оболочки. Ядро не меняется. Атомные номера Водород является ключом к созданию молекулы воды (график 4). Два или более атома в определенном расположении и удерживаемые вместе химическими связями определяются как молекула. В редких случаях количество нейтронов в конкретном элементе может варьироваться. Такой элемент затем классифицируется как изотоп. Второй наименьший элемент — гелий (атомный номер 2) с двумя протонами, двумя нейтронами и двумя электронами (график 5). Углерод, немного более крупный элемент (атомный номер 6), имеет шесть протонов, шесть нейтронов и шесть электронов. Он также имеет две орбитальные оболочки. (Рисунок 6). Азот (атомный номер 7) и кислород (атомный номер 8) являются дополнительными примерами элементов, которые имеют две орбитальные оболочки (график 7). Натрий, магний и хлор имеют три орбитальные оболочки (рис. 8). Орбитальные оболочки В следующем месяце мы займемся молекулами и соединениями. Об авторе Питер С. Картрайт, CWS-VI, президент Cartwright Consulting Company, Миннеаполис, является зарегистрированным профессиональным инженером в Миннесоте. Он работает в сфере очистки воды с 1974 года, является автором более 125 статей, выступил с более чем 125 лекциями на конференциях по всему миру и получил три патента. Картрайт возглавлял несколько комитетов и целевых групп WQA и получил награду за заслуги перед организацией. Член Комитета по технической оценке WC&P с 19 лет.96, его опыт включает в себя такие высокотехнологичные процессы разделения, как RO, UF, MF, UF электродиализ, деионизация, адсорбция углерода, озонирование и дистилляция. Картрайт также является техническим консультантом Канадской ассоциации качества воды. С ним можно связаться по телефону (952) 854-4911; факс (952)854-6964; по электронной почте [email protected] или на его веб-сайте www. 1.4 Нарисуйте и подпишите схему, показывающую структуру молекул воды, чтобы показать их полярность и образование водородных связей. двух атомов водорода, ковалентно связанных с атомом кислорода
1.4 Нарисуйте и подпишите схему, показывающую структуру молекул воды, чтобы показать их полярность и образование водородных связей. двух атомов водорода, ковалентно связанных с атомом кислорода 1.6 Объясните взаимосвязь между свойствами воды и ее использованием в живых организмах в качестве хладагента, среда для метаболических реакций и транспортная среда
1.6 Объясните взаимосвязь между свойствами воды и ее использованием в живых организмах в качестве хладагента, среда для метаболических реакций и транспортная среда Основы химии воды: элементы, атомы и молекулы – WCP Online
 Картрайт, PE, CWS-VI курс химии, а базовое обучение химии в отношении воды и очистки воды . Мы надеемся, что ваш интерес пробудится и вы захотите узнать больше. Желаемый результат заключается в том, что это поможет вам стать более эффективным и ценным специалистом по очистке воды. Пожалуйста, свяжитесь с нами с любыми вопросами или проблемами; мы приветствуем ваш вклад!
Картрайт, PE, CWS-VI курс химии, а базовое обучение химии в отношении воды и очистки воды . Мы надеемся, что ваш интерес пробудится и вы захотите узнать больше. Желаемый результат заключается в том, что это поможет вам стать более эффективным и ценным специалистом по очистке воды. Пожалуйста, свяжитесь с нами с любыми вопросами или проблемами; мы приветствуем ваш вклад!
Простейшие вещества, содержащие атомы одного типа, называются элементами. Элементы обладают уникальными физическими и химическими свойствами. Масса электрона пренебрежимо мала (график 1).
Масса электрона пренебрежимо мала (график 1).
Наименьшая часть элемента, которая может существовать, — это атом (рис. 2). Ядро или центр атома содержит протоны, имеющие положительный заряд, а также нейтроны, не имеющие заряда. Протоны и нейтроны имеют массу.
В качестве примера для лучшего понимания атомных номеров мы проанализируем атом водорода (атомный номер 1), первый и самый маленький из элементов. Он имеет один протон и один электрон.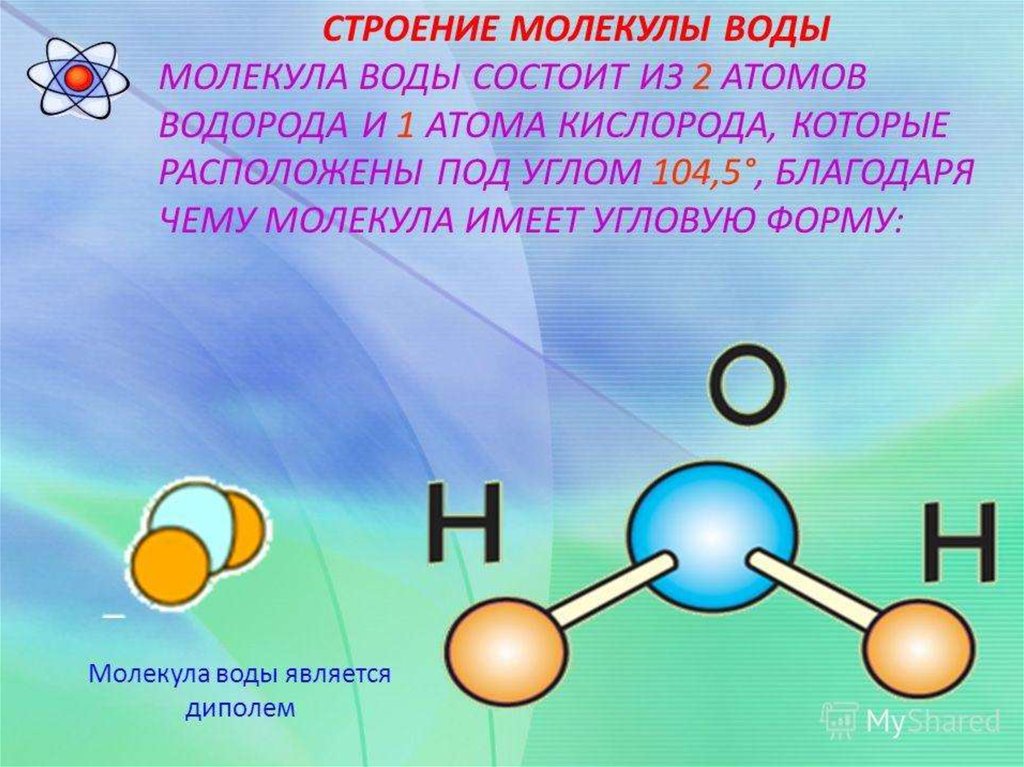
Эти орбитальные оболочки определяют стабильность элемента и его способность объединяться с другими элементами в соединения. Максимальное количество электронов на орбите в два раза больше квадрата количества орбитальных оболочек, от одного до пяти (график 9).

