Содержание
Вода: физические и химические свойства
Не обращали ли вы внимание на то, что все или почти все происходящее в мире вокруг нас, так или иначе связано с водой? Вода — это гидросфера Земли: ее океаны, реки, озера. Три процента всей массы воды на планете содержится в атмосфере. При извержениях из земных глубин вырываются водяные пары…
Вода есть не только на Земле. Недавно в нашей галактике обнаружили огромные скопления водяных паров — настоящие космические облака, размеры которых достигают сотен миллионов километров. Вода входит в состав комет. Следы ее найдены в атмосфере Марса и некоторых звезд…
Однако самое главное — это то, что вода связана с существованием жизни. Колыбелью жизни, ее первичных форм, по-видимому, был океан. Дальнейший ход биологической эволюции тесно связан с превращениями, идущими в водной среде. Удаление воды означает гибель либо прекращение процессов обмена. Высушенные семена растений могут сохраняться тысячелетиями, но в таком состоянии они не проявляют признаков жизни. Но стоит их смочить, и огонек жизни делается заметным — начинается прорастание, и жизненные процессы возобновляются.
Но стоит их смочить, и огонек жизни делается заметным — начинается прорастание, и жизненные процессы возобновляются.
Планеты, где, по всем данным, нет воды,— безжизненны. Если можно говорить о каких-то формах жизни на других космических телах, то лишь в том случае, если там будет обнаружена вода, именно вода, а не кислород, так как нам известны формы жизни, не требующие кислорода, но не известны ее «сухие» формы. Чем замечательна вода? Почему она играет такую важную роль во всем на нашей планете? (А еще вода обладает целительными свойствами для человеческого организма, такая к примеру минеральная вода, имеющая в своем составе некоторые полезные минералы).
Химические свойства воды
После, того, как Менделеев сформулировал свой периодический закон, стало невозможным порознь рассматривать свойства простых веществ. Таблица Менделеева связала различные вещества одной общей закономерностью. Эта закономерность проявляет себя во множестве частных связей. Например, свойства водородных соединений ряда металлоидных элементов, образующих вертикальные столбцы, в таблице Менделеева, изменяются с ростом массы атома. Можно четко проследить эти изменения: прочность соединений убывает, плотность увеличивается, повышается температура кипения и плавления и т. д.
Можно четко проследить эти изменения: прочность соединений убывает, плотность увеличивается, повышается температура кипения и плавления и т. д.
Вода — это водородное соединение кислорода. Кислород — элемент шестой группы таблицы Менделеева. В той же группе (и подгруппе) находятся сера, селен, теллур. Если сравнить свойства их соединений с водородом (гидридов), то увидим, что температура кипения понижается при переходе от теллура к сере. Сероводород кипит уже при минус 60 градусах. Значит, соединение кислорода с водородом при нормальных условиях — при нуле градусов — должно быть газом. Вода — газ! Это и было бы нормой, но, к счастью для нас, вода почему-то отклоняется от правила.
Такая странность воды не единственна. Вода необычна и в других отношениях. У нее очень велика теплота испарения, теплоемкость, водяной пар при быстром расширении конденсируется, вместо того чтобы переходить в состояние ненасыщенного пара, плотность воды увеличивается при изменении температуры от 0° до +4°С, а затем снова падает; затвердевая, вода расширяется.
Перечень странностей воды не исчерпан, но для нас достаточно и этого. Подумаем о том, что значат для жизни удивительные ее свойства. Попробуем представить себе Землю и жизнь на ней при условии, что вода — вещество «нормальное».
Нет морей и океанов, нет рек и озер, все растения и животные обезвожены, а атмосфера насыщена газом Н20.
Предположим, что ненормально высокая теплоемкость воды тоже понизилась — например, в 20—30 раз. Тогда воды океанов и морей уже не смогут накапливать достаточное количество теплоты — они станут быстро нагреваться летом и сильно охлаждаться зимой. Резкие колебания температуры вызовут растрескивание горных пород, изменят рельеф земной поверхности. Но растрескивание пород — результат расширения воды при замерзании, это ведь тоже аномалия! Допустим, что нет и ее, — горным породам от этого, конечно, будет легче, но лед начнет образовываться на дне водоемов, и они станут промерзать полностью. Следствием окажется гибель и рыбы, и всей жизни в реках и озерах.
Невеселая получается картина, не правда ли? Но и это не все. Есть у воды еще одно удивительное качество: в ней резко ослабляется сила взаимодействия между электрическими зарядами. Например, если заряженные тела перенести из воздуха в воду, эта сила упадет в 80 раз!
А результат! Какие грандиозные последствия имеет такое, казалось бы, сугубо специальное обстоятельство.
Ослабляя взаимодействие электрических зарядов, вода поддерживает растворенные в ней соли, кислоты и основания в ионизированном состоянии. А быстро протекающие химические реакции чаще всего совершаются как раз между ионами.
Вот мы и добрались до самых глубин жизни; ведь ионы — это одна из главных сил в жизненных процессах. Ионы регулируют действие множества биологических катализаторов — ферментов, без которых немыслима жизнь; перемещение ионов через биологические мембраны обуславливает передачу нервного возбуждения; концентрация ионов в почве дает возможность нормального роста растений и т. д. Вывод: вода не могла бы стать средой для жизни, если бы она не вызывала образования ионов.
Жизнь зародилась в воде; вполне естественно, что вся химия жизни неразрывно связана с маленькими молекулами Н20; все формы, все типы реакций, направление развития и формирование функций живых систем так же, как и величественные картины неживой природы, несут на себе отпечаток свойств и деятельности молекул воды!
Молекула воды
Странности воды, сейчас изучены достаточно основательно. Главный секрет таится в конструкции молекулы воды. В этой молекуле атом кислорода двумя отдельными связями сцеплен с двумя атомами водорода. Связи мы можем изобразить в виде палочек, и можно представить себе много способов их взаимного расположения.
На самом же деле в молекуле воды реализован только один — палочки расположены в одной плоскости с углом между ними примерно в 105°. На скрещении палочек-связей находится атом кислорода, на противоположных концах палочек помещаются атомы водорода. Но палочки, хоть они и разведены друг от друга, все-таки направлены в одну сторону. И, значит, у молекулы воды одна сторона — кислородная, а другая — водородная. В этом все дело.
И, значит, у молекулы воды одна сторона — кислородная, а другая — водородная. В этом все дело.
Но расскажем сначала о некоторых тонкостях в том, как возникает эта конструкция. Читатель, которого отпугивают сложности атомной физики, может пропустить следующую главу.
Электронные тонкости
Образуя молекулу воды, атомы кислорода и водорода схватываются, сцепляются своими электронными оболочками. У атома кислорода есть так называемые р-электроны — их четыре и распределение их плотности можно представить себе в виде фигур (объемных тел), напоминающих гантели. Кроме того, у кислорода есть еще два электрона, расположенных так, что распределение их заряда имеет сферическую симметрию (электроны э-типа).
Атомы водорода имеют электроны, плотность которых тоже распределена сферически. Для образования связи нужно, чтобы электронные облака атомов кислорода и водорода перекрылись, то есть их электроны стали общими, как на этом рисунке.
Перекрытие и происходит между гантелеобразными облаками р-электронов кислорода и сферическими облаками атомов водорода. На образование связи нужно два электрона — по одному, от каждого атома; эта пара электронов и образует общее зарядовое облако. После образования связей у кислорода остается два электрона р-типа и два э-типа, которые не были использованы. Какова роль этих неиспользованных электронов?
На образование связи нужно два электрона — по одному, от каждого атома; эта пара электронов и образует общее зарядовое облако. После образования связей у кислорода остается два электрона р-типа и два э-типа, которые не были использованы. Какова роль этих неиспользованных электронов?
Две связи в молекуле воды, две палочки Н = 0 имеют на одном конце положительный, а на другом — кислородном конце — отрицательный заряд. Такая конструкция называется диполем. Если бы палочки-диполи были расположены на одной прямой — как продолжение друг друга с атомом кислорода посредине, они взаимно компенсировались бы, и общий дипольный момент молекулы был бы равен нулю.
Однако этого нет. Палочки-связи разведены на угол в 105°, и такая конструкция молекулы электрически активна. Два электрона в-типа влияют на величину угла между связями. Но дипольный момент молекулы воды очень велик и, чтобы создать его, одной изогнутости молекулы мало. В дело вступают два других неиспользованных для связей р-электрона атома кислорода.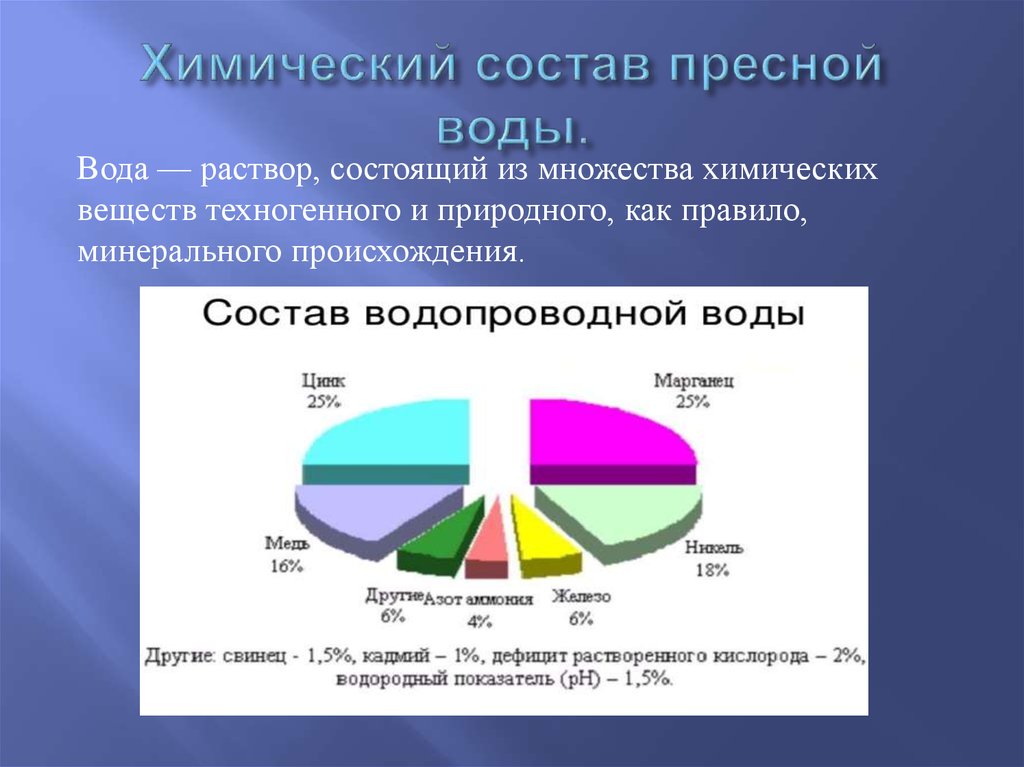 Вращаясь вокруг своего ядра, они на кислородном, «боку» молекулы создают дополнительный отрицательный заряд.
Вращаясь вокруг своего ядра, они на кислородном, «боку» молекулы создают дополнительный отрицательный заряд.
Физические свойства воды
Итак, природа «согнула» молекулу воды и сделала ее активным диполем. Диполи же, как известно, энергично притягиваются друг к другу. Но чем отличается жидкость от газа? Прежде всего, именно силой взаимодействия между молекулами. Чем сильнее сцепляются друг с другом диполи-молекулы, тем большую надо затратить работу, чтобы их разделить,— тем выше теплота испарения…
При испарении вода должна поглощать огромную энергию. При испарении! А значит, в обычных условиях она должна быть именно жидкостью: ведь дополнительная гигантская энергия в обычных условиях отсутствует.
А у молекул сероводорода — для сравнения — дипольный момент вдвое меньше, сила притяжения между ними слабее, и в обычных условиях сероводород — газ.
Но дело не только в величине дипольного момента. Молекулы воды соединяются друг с другом еще и так называемыми водородными связями. Что это такое? Ядра водорода в молекуле воды «тянутся» не только к «своему» кислороду, но и к электронам кислорода у соседей. Конечно, к своему «хозяину» — кислороду протон притягивается сильнее, чем к «чужаку». Поэтому водородные связи не строго симметричны.
Что это такое? Ядра водорода в молекуле воды «тянутся» не только к «своему» кислороду, но и к электронам кислорода у соседей. Конечно, к своему «хозяину» — кислороду протон притягивается сильнее, чем к «чужаку». Поэтому водородные связи не строго симметричны.
У других гидридов они тоже есть. Но они слабы, так как расстояния между молекулами, например, сероводорода больше (связи длиннее), чем у воды. Большое число электронных оболочек не позволяет молекулам других гидридов сблизиться, а значит, не позволяет водородным связям проявить себя. А в молекулах воды электронных оболочек немного, и водородные связи очень энергичны в своей совокупности.
Молекулы воды крепко сцеплены друг с другом; так крепко, что в ней рождается огромное внутреннее давление: приблизительно 20 000 атмосфер. С такой силой слои молекул воды прижаты друг к другу; не удивительно, что это практически несжимаемая жидкость.
Вода: порядок или хаос? Структура воды.
Но если диполи так крепко сцепляются друг с другом, то как же выглядит структура воды, да и можно ли вообще говорить о ней? Расположены ли диполи в воде беспорядочно или в их пространственном размещении есть какая-то правильность? На первый взгляд, ответ очевиден.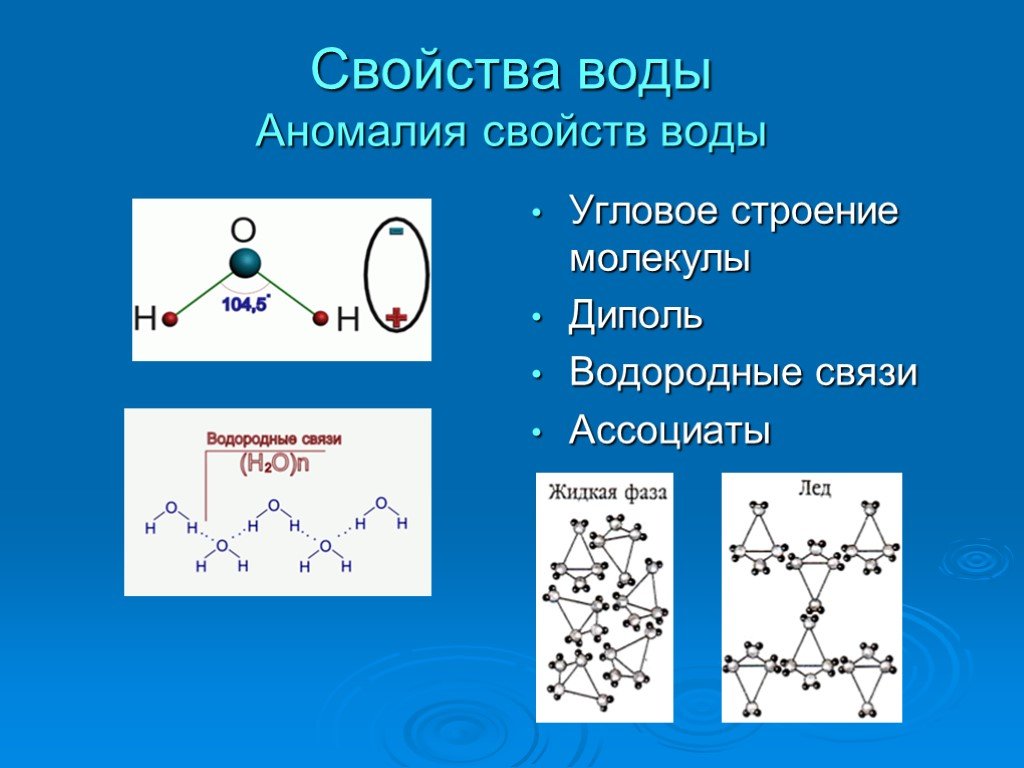 Ведь молекулы движутся и притом хаотически, о каком же регулярном расположении вообще идет речь? Однако данные, полученные с помощью рентгенографического анализа, говорят о другом: в воде есть явные признаки упорядоченной структуры.
Ведь молекулы движутся и притом хаотически, о каком же регулярном расположении вообще идет речь? Однако данные, полученные с помощью рентгенографического анализа, говорят о другом: в воде есть явные признаки упорядоченной структуры.
Предположим, что все движения молекул воды на мгновение прекратились, и допустим, что мы в состоянии видеть каждую молекулу. Тогда, взглянув на воду, мы обнаружим в ней так называемый ближний порядок. В непосредственной близости от выбранной нами молекулы воды другие молекулы расположены по определенному закону.
Особенность жидкостей не в том, что в них нет упорядоченности, а в том, что этот порядок не выдерживается строго во времени и в пространстве. Если отодвинуться подальше от избранной молекулы, то мы попадем в область, где порядок уже нарушен. А если подождать некоторое время, то окажется, что и ближние молекулы обмениваются местами. В воде нет хаоса, но порядок вновь и вновь нарушается, а затем восстанавливается. Огромные силы внутреннего давления, сжимающие воду, ограничивают возможности быстрых перемещений — одна молекула «топчется» около другой, пока ей удастся покинуть свое место и сделать более или менее значительный скачок в сторону. Правда, продолжительность «топтания» велика лишь по молекулярным масштабам.
Правда, продолжительность «топтания» велика лишь по молекулярным масштабам.
Значит, и у воды есть внутренняя структура. Самое же поразительное в ней то, что она очень похожа на структуру льда. Лед построен так. Каждая молекула воды в нем окружена четырьмя соседними.
Молекула льда.
В этой кристаллической решетке есть полости — пустоты. Такие же пустоты сохраняются и в структуре воды. Как мы увидим далее, они играют важную роль — это молекулярные «ловушки», куда попадают молекулы различных веществ, ионы, а иногда и молекулы самой воды. В кристалле льда такая структура распространяется на весь кристалл. В жидкой воде, охлажденной до температуры, близкой к нулю, тоже есть подобие правильного расположения молекул, но уже с некоторыми нарушениями порядка, или, как говорят, с «дефектами»: то одна молекула попадет в полость, то обнаружится недостача молекулы в окружении этой полости и т. д.
Значит, чем больше порядка в расположении молекул воды, тем больше «пустот» и меньше плотность. Когда же молекулы расположены беспорядочно, плотность увеличивается — ведь все большее число молекул попадает в «пустоты». Понятно, почему при плавлении льда наблюдается сжатие, а замерзание жидкой воды, наоборот, сопровождается расширением.
Когда же молекулы расположены беспорядочно, плотность увеличивается — ведь все большее число молекул попадает в «пустоты». Понятно, почему при плавлении льда наблюдается сжатие, а замерзание жидкой воды, наоборот, сопровождается расширением.
Сокращается объем воды и при нагревании ее от 0° до +4°: в этом температурном интервале молекулы воды интенсивнее всего внедряются в пустоты решетки, и плотность возрастает.
Чем выше температура воды, тем, конечно, меньше порядка в расположении молекул, и тем менее структура жидкой воды похожа на структуру льда. Но есть условия, в которых жидкая вода особенно похожа на лед, — условия, когда молекулы воды снова приобретают упорядоченное расположение. Как ни странно, но, по-видимому, этот эффект вполне четко выражен в биологических системах — около белковых молекул, на поверхности клеточных мембран и т. д.
Наше тело на 70 процентов состоит из воды; неужели мы на 70 процентов состоим изо льда? Не совсем так, но все-таки очень похоже на это…
Чисто физические исследования показали: тонкие слои воды, зажатые между двумя пластинками из слюды, проявляют свойства, характерные не для жидкой воды, а для льда! На поверхности различных твердых тел вода, по последним данным, тоже структурно упорядочена и имеет сходство со льдом.
Во-вторых. Активность молекул воды и их стремление «организоваться» находит своеобразное выражение во взаимодействиях между водой и различными веществами. Когда в воду попадает кристалл соли, молекулы воды немедленно притягиваются к ионам на поверхности кристалла. Энергия их взаимодействия так велика, что ионы покидают свои места в кристаллической решетке и уходят в водную среду, окруженные оболочками из молекул воды: соль начинает растворяться.
Водяная «шуба» состоит не из одного слоя, но чем дальше от иона, тем слабее связь, и ее границы довольно «пушисты» и расплывчаты — по-видимому, лишь 4—6 молекул воды вполне связаны с ионом.
Так же, как и вокруг ионов, молекулы воды могут ориентироваться, например, около молекулы метана — тогда возникает гидрат этого газа. Грозди молекул воды в гидрате получили название «айсбергов» — состояние воды в них напоминает строение кристаллов льда.
В трубопроводах газовых сетей не раз находили скопления снега и льда, причем они оставались твердыми и при температуре +20°. Это и были «айсберги», выросшие вокруг молекул метана.
Это и были «айсберги», выросшие вокруг молекул метана.
Затравкой для таких соединений может быть не только метан: этан, этилен, хлор, двуокись серы и даже инертные газы (аргон, криптон) образуют подобные гидраты. Загадка «айсбергов» разъясняется неожиданно просто. Молекулы газов попадают в пустоты между молекулами воды. Застряв в них, они упорядочивают окружающие молекулы воды. Предполагают, что в гидратах молекулы воды расположены по углам пятиугольников, а из пятиугольников строятся сложные многогранники — пространство внутри них заполнено газом. Если газ удалить, устойчивость всего каркаса уменьшается, и он начинает разрушаться и перестраиваться. Некоторые исследователи считают, что точно так же, окружая углеводородные группы, входящие в состав белков, вода стабилизует молекулы белка. А это означает, что формы, в которых белковые молекулы находятся и действуют в организмах, в значительной степени связаны с влиянием воды.
Вода в тканях животных и растений не представляет собой хаоса; молекулы ее расположены относительно упорядоченно, и действительно можно сказать, что у воды в нашем организме есть определенное сходство со льдом.
Активность и холод
Оледенение, замерзание, застывание — слова, с которыми у нас прочно связано представление о понижении активности; жизнь замирает при понижении температуры, скорость химических реакций как будто тоже уменьшается. Но дело не так просто. Вода и лед и здесь обнаруживают своеобразие.
Вода, как известно из школьного курса химии, плохой электролит. Лишь небольшая доля ее молекул диссоциирует на ионы Н+ и ОН-. Лед диссоциирован еще менее, и, если литр воды замерзнет, в нем останется только тысячная доля от того количества ионов, которое было в жидкой воде.
Но поразительно: резкое уменьшение концентрации ионов очень слабо отражается на электропроводности. У льда она всего в три раза меньше, чем у воды, — в три, а не в тысячу! Между тем электрические заряды переносятся именно ионами Н+ и ОН-, и следовало бы ожидать, что уменьшение их числа скажется на способности проводить ток.
Однако электропроводность зависит не только от числа ионов, но и от их подвижности. В кристаллической решетке льда ионы становятся «стремительными» — и эта стремительность возмещает резкое падение их числа.
В кристаллической решетке льда ионы становятся «стремительными» — и эта стремительность возмещает резкое падение их числа.
Впрочем, «стремительность» — это грубо метафорическое выражение. Дело не только в том, что ионы ускоряют свой бег — дело в том, что во льду возникает особый механизм, который организует движение ионов. Механизм этот называют цепным, или эстафетным. Вот как он действует. Ион водорода приближается к молекуле воды, возникает водородная связь. Затем эта связь переходит в обычную химическую, а другой ион водорода, ранее принадлежавший молекуле, отщепляется. Он присоединяется к следующей молекуле, от которой так же одновременно отделится новый ион водорода, и, двигаясь по цепи, процесс будет продолжаться.
Быстрота, с которой он совершится, зависит не от индивидуальной скорости ионов, а от быстроты обмена ими между молекулами воды. В кристалле льда царит внутренний порядок, и обмен идет легко. А в жидкой воде, то и дело, натыкаясь на зоны нарушений или на пустоты, ионы будут терять скорость своего бега вдоль по цепочке молекул. Итак, во льду на самом деле, оказывается, «двигаться» легче, чем в воде, поэтому лед и ускоряет многие реакции. Лед — настоящий катализатор!
Итак, во льду на самом деле, оказывается, «двигаться» легче, чем в воде, поэтому лед и ускоряет многие реакции. Лед — настоящий катализатор!
Но ведь похожие на лед «айсберги» есть и в организмах, и в них, значит, тоже легче протекают различные реакции. Перенос ионов играет важную роль в действии ферментов и в работе белковых мембран различного типа — и в оболочке клетки, и в оболочке ее ядра, и в митохондриях (энергетических станциях клетки), и в рибосомах, где строятся новые молекулы белков, словом, повсюду. Поэтому вода не просто среда, это, по Сьент- Дьерди, — неотъемлемая часть живой машины.
Мы подошли к концу рассказа… Каков итог? Что же, вода и впрямь какое-то «ненормальное» вещество, на «ненормальных» свойствах которого (как физических, так и химических) держится привычная картина природы?
Нет, конечно. «Необычность» воды более чем обычна, она естественна. Она — свидетельство того, что при переходе от одного атома к другому в подгруппе периодической системы происходят изменения. Накапливаясь, эти изменения становятся все более ощутимыми, и вдруг резкий скачок.
Накапливаясь, эти изменения становятся все более ощутимыми, и вдруг резкий скачок.
Вернемся снова к диполям воды. Их тесно сцепляют друг с другом мощная электрическая активность и действие водородной связи.
У других элементов шестой группы очень велико экранирующее действие электронных облаков — водородная связь не может «пробиться» сквозь них. У теллура, и у селена, серы слишком много свободных, незанятых электронов. Окутанные ими, тяжелые молекулы гидридов слабо связаны друг с другом. И все они при нормальных условиях — газы.
Однако при движении от одного элемента группы к другому электронов в атомах становится все меньше, и у кислорода их уже так мало, что водородная связь начинает пробиваться, активно проявляя себя.
Так, порой медленно и постепенно, рассеиваются тучи, пока не разорвется серый пласт. И тут же блеснет луч солнца. И неожиданный скачок — из пасмурной погода стала ясной, все засияло другими красками.
Электронное «небо» при переходе к кислороду на самом деле проясняется, и в мире гидридов неожиданно наступает другая погода.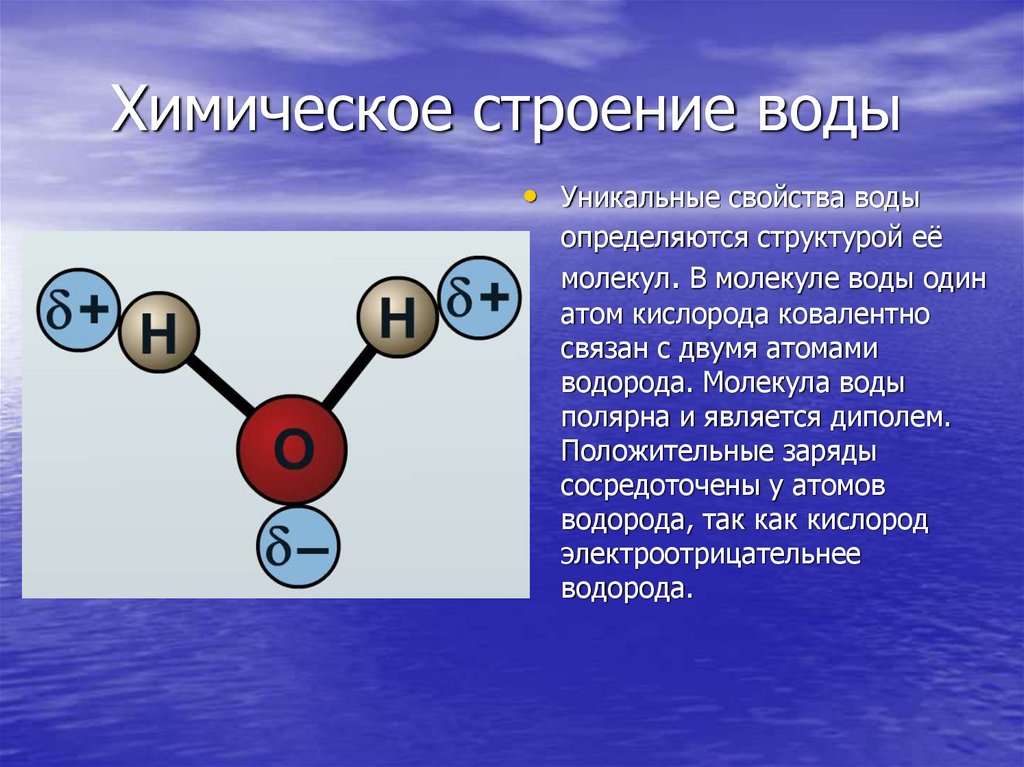 Во всем блеске своих необычных свойств на сцене мира появляется Вода.
Во всем блеске своих необычных свойств на сцене мира появляется Вода.
Автор: Л. Николаев.
Влияние электрохимической обработки на физико-химические свойства воды | Некрасова
1. Рахманин Ю.А., Михайлова Р.Н. Состояние и тенденции развития технологий обеззараживания воды для питьевых целей. Актуальные вопросы транспортной медицины. 2009; (1): 86-8.
2. Прилуцкий В.И., Бахир В.М. Электрохимически активированная вода: аномальные свойства, механизм биологического действия. М.: Экран; 1997.
3. Леонов Б.И., Прилуцкий В.И., Бахир В.М. Физико-химические аспекты биологического действия электрохимически активированной воды. М.; 1999.
4. Бахир В.М. Электрохимическая активация. Изобретения, техника, технология. М.: Дельфин Аква; 2014.
5. Погорелов А.Г., Бахир В.М., Ипатова Л.Г., Погорелова М.А., Левачева М.А. Прогрессивная электрохимия и функциональная микроскопия биоструктур в агропищевых и биотехнологиях. М.: Франтера; 2018.
6. Кирпичников П.А., Бахир В. М., Гамер П.У., Добреньков Г.А., Лиакумович А.Г., Фридман Б.С. и соавт. О природе электрохимической активации сред. Доклады Академии наук СССР. 1986; 286(3): 66-7.
М., Гамер П.У., Добреньков Г.А., Лиакумович А.Г., Фридман Б.С. и соавт. О природе электрохимической активации сред. Доклады Академии наук СССР. 1986; 286(3): 66-7.
7. Томилов А.П. Электрохимическая активация — новое направление прикладной электрохимии. Жизнь и безопасность. 2002; (3): 302-7.
8. Petrushanko I.Yu., Lobyshev V.I. Physicochemical properties of aqueous solutions obtained in a membrane electrolyzer. Biophysics. 2004; 49(1): 22-31
9. Некрасова Л.П. Необычные свойства некоторых бесконтактно активированных растворов. Успехи современного естествознания. 2013; (4): 87-92.
10. Некрасова Л.П., Михайлова Р.И., Рыжова И.Н. Определение антиоксидантной активности электрохимически активированной воды потенциометрическим и спектрофотометрическим методами. Международный журнал прикладных и фундаментальных исследований. 2016; (5): 559-63.
11. Hamasaki T., Harada G., Nakamichi N., Kabayama S., Teruya K., Fugetsu B., et al. Electrochemically reduced water exerts superior reactive oxygen species scavenging activity in HT1080 cells than the equivalent level of hydrogen-dissolved water. PloS One. 2017; 12(2): e0171192. https://doi.org/10.1371/journal.pone.0171192
PloS One. 2017; 12(2): e0171192. https://doi.org/10.1371/journal.pone.0171192
12. Cloete T.E., Thantsha M.S., Maluleke M.R., Kirkpatrick R. The antimicrobial mechanism of electrochemically activated water against Pseudomonas aeruginosa and Escherichia coli as determined by SDS-PAGE analysis. J. Appl. Microbiol. 2009; 107(2): 379-84. https://doi.org/10.1111/j.1365-2672.2009.04233.x
13. Погорелов А.Г., Кузнецов А.Л., Погорелова В.Н., Суворов О.А., Панаит А.И., Погорелова М.А. Разрушение бактериальной плёнки электрохимически активированным водным раствором. Биофизика. 2019; 64(4): 583-7
14. Huang K.C., Hsu S.P., Yang C.C., Ou-Yang P., Lee K.T., Morisawa S., et al. Electrolysed-reduced water dialysate improves T-cell damage in end-stage renal disease patients with chronic haemodialysis. Nephrol. Dial. Transplant. 2010; 25(8): 2730-7. https://doi.org/10.1093/ndt/gfq082.
15. Kim M.J., Kim H.K. Anti-diabetic effects of electrolysed reduced water in streptococci-induced and genetic diabetic mice. Life Sci. 2006; 79(24): 2288-92. https://doi.org/10.1016/j.lfs.2006.07.027
Life Sci. 2006; 79(24): 2288-92. https://doi.org/10.1016/j.lfs.2006.07.027
16. Abo-Enein H., Gheith O.A., Barakat N., Nour E., Sharaf A.E. Ionized alkaline water: new strategy for management of metabolic acidosis in exeperimental animals. Ther. Apher. Dial. 2009; 13(3): 220-4. https://doi.org/10.1111/j.1744-9987.2009.00659
17. Yan H., Kashiwaki T., Hamasaki T., Kinjo T., Teruya K., Kabayama S., et al. The neuroprotective effects of electrolyzed reduced water and its model water containing molecular hydrogen and Pt nanoparticles. BMC Proc. 2011; 5(Suppl. 8): 69. https://doi.org/10.1186/1753-6561-5-S8-P69
18. Watanabe T., Shirai W., Pan I., Fukuda Y., Murasugi E., Sato T., et al. Histopathological influence of alkaline ionized water on myocardial muscle of mother rats. J. Toxicol. Sci. 1998; 23(5): 411-7. https://doi.org/10.2131/jts.23.5_411
19. Беляева Н.Н., Рахманин Ю.А., Михайлова Р.И., Савостикова О.Н., Гасимова З.М., Каменецкая Д.Б. и соавт. Воздействие 12-месячного потребления вод, полученных с использованием неконтактной активации после электрохимической обработки, на морфофункциональные показатели печени, почки и толстой кишки крыс. Гигиена и санитария. 2015; 94(6): 26-9.
Гигиена и санитария. 2015; 94(6): 26-9.
20. Зацепина О.Н., Ингель Ф.И. Индукция эффектов нестабильности генома человека под действием неконтактно (электрохимически) активированных вод in vitro. Гигиена и санитария. 2016; 95(3): 233-41. https://doi.org/10.18821/0016-9900-2016-95-3-233-241
21. Бондаренко Н.Ф., Гак Е.З., Шапкин М.П. Некоторые особенности свойств водных растворов при обработке их методом электрохимической активации. Электронная обработка материалов. 2001; (6): 50-60.
22. Некрасова Л.П. Проблемы измерения и интерпретации окислительно-восстановительного потенциала активированных вод. Международный журнал прикладных и фундаментальных исследований. 2013; 11(2): 13-8.
23. Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии. Киев: Наукова думка; 1974.
24. Некрасова Л.П. Физико-химические свойства воды, активированной в электролизере бездиафрагменного типа. Сознание и физическая реальность. 2012; 17(8): 7-14.
25. Petrushanko I. Yu., Lobyshev V.I. Nonequilibrum state of electrochemically activated water and its biological activity. Biophysics. 2001; 46(3): 389-401
Yu., Lobyshev V.I. Nonequilibrum state of electrochemically activated water and its biological activity. Biophysics. 2001; 46(3): 389-401
26. Сычева Л.П., Савостикова О.Н., Михайлова Р.И., Юрченко В.В., Кривцова Е.К., Алексеева А.В. и соавт. Изучение шестимесячного воздействия на крыс неконтактно электрохимически активированных вод с использованием полиорганного кариологического теста. Гигиена и санитария. 2015; 94(6): 87-91.
27. Клосс А.И. Электрон-радикальная диссоциация и механизм активации воды. Доклады Академии наук СССР. 1988; 303(6): 1403-7.
28. Miroshnikov A.I., Bruskov V.I., Masalimov Zh.K. Concentration of hydrogen peroxide in electrochemically activated solutions and study of its effect on Escherichia coli growth. Biophysics. 2004; 49(1): 32-7
29. Мирошников А.И. Причина активности растворов после электрохимической обработки. Роль хлоридов и окислительно-восстановительного потенциала. Вода: химия и экология. 2012; (12): 104-10.
30. Некрасова Л.П. , Ершова М.Л. Влияние бесконтактной электрохимической активации на водные растворы некоторых белков. Международный журнал прикладных и фундаментальных исследований. 2015; (5): 452-6.
, Ершова М.Л. Влияние бесконтактной электрохимической активации на водные растворы некоторых белков. Международный журнал прикладных и фундаментальных исследований. 2015; (5): 452-6.
31. Маргулис М.А., Пильгунов В.Н. Свечение и электризация при течении диэлектрических жидкостей в узком канале. Журнал физической химии. 2009; 83(8): 1414-8.
Химические характеристики и функции воды в физиологии
Если бы кто-то спросил, какая молекула самая важная в вашем теле, большинство из нас ответило бы, что это вода. Он составляет примерно 2/3 веса нашего тела! Вот почему борец, пытающийся «набрать вес» для матча, может сбросить несколько фунтов, просто потея от воды (кстати, не очень хорошая идея). Всякий раз, когда возникают предположения о жизни на других планетах, всегда возникает вопрос, есть ли на планете вода? Что такого особенного в воде, что делает ее незаменимой для жизни? Не подойдет ли и другая жидкость? Вот некоторые из вопросов, на которые мы попытаемся ответить в этом блоке.
Химические характеристики воды
Напомним, что молекула воды H 2 O удерживается вместе полярными ковалентными связями . Поскольку кислород притягивает электроны в ковалентных связях сильнее, чем водород, кислородный конец молекулы имеет небольшой отрицательный заряд, а водородный конец молекулы имеет небольшой положительный заряд. Также вспомните, что молекулы, состоящие из полярных ковалентных связей, могут участвовать в слабых взаимодействиях с другими полярными молекулами, называемых водородными связями. На рисунке ниже показано, как молекулы воды образуют водородные связи друг с другом. Каждая молекула воды может образовать максимум 4 водородные связи с другими молекулами воды. Большинство характеристик воды, о которых мы будем говорить, являются результатом полярной природы молекулы воды и ее способности образовывать водородные связи с собой и другими полярными молекулами. Помните, что водородные связи являются очень слабыми взаимодействиями и могут образовываться и разрываться относительно легко. Однако, как и в случае со всеми связями, для их разрыва требуется энергия, а энергия высвобождается при образовании новых связей. Именно количество этих связей определяет физическое состояние воды. Например, в твердом состоянии каждая молекула воды образует водородные связи с четырьмя другими молекулами, что приводит к образованию стабильной кристаллической структуры, известной как лед. В жидком состоянии каждая молекула воды образует менее четырех связей (в среднем 3,4), которые постоянно перестраиваются. Вода становится паром, когда энергии достаточно, чтобы разорвать все водородные связи между молекулами воды, и они могут выйти в виде газа.
Однако, как и в случае со всеми связями, для их разрыва требуется энергия, а энергия высвобождается при образовании новых связей. Именно количество этих связей определяет физическое состояние воды. Например, в твердом состоянии каждая молекула воды образует водородные связи с четырьмя другими молекулами, что приводит к образованию стабильной кристаллической структуры, известной как лед. В жидком состоянии каждая молекула воды образует менее четырех связей (в среднем 3,4), которые постоянно перестраиваются. Вода становится паром, когда энергии достаточно, чтобы разорвать все водородные связи между молекулами воды, и они могут выйти в виде газа.
изображение создано студенткой BYU-I Ханной Краудер, осень 2013 г.
На изображении выше показаны водородные связи между молекулами воды.
Стабилизация температуры тела
Количество энергии в виде тепла, которое необходимо добавить к веществу или отнять от него, чтобы изменить его температуру, называется теплоемкостью вещества. Вода обладает очень высокой теплоемкостью. Для повышения температуры одного грамма воды на один градус Цельсия требуется одна калория энергии. На самом деле, мы определяем калорию на основе теплоемкости воды (Одна калория — это количество тепловой энергии, необходимое для повышения температуры 1 грамма воды на 1° Цельсия. Примечание: при указании калорийности пищи калорией является пишется с большой буквы. Эти «большие» калории на самом деле составляют килокалории или 1000 калорий). Точно так же 1 калория энергии должна быть изъята из воды, чтобы понизить температуру 1 грамма воды на 1 градус Цельсия. Сравните это с теплоемкостью воздуха, которая составляет 0,24 калории на грамм. Высокая теплоемкость обусловлена водородными связями между молекулами воды. Температура является мерой полной кинетической энергии (движения) материала. Прежде чем молекулы воды смогут начать двигаться быстрее, водородные связи между молекулами должны быть разрушены, что требует затрат энергии. Следовательно, большая часть энергии (тепла) используется для разрыва связей, а не для повышения температуры (движения) молекул воды.
Вода обладает очень высокой теплоемкостью. Для повышения температуры одного грамма воды на один градус Цельсия требуется одна калория энергии. На самом деле, мы определяем калорию на основе теплоемкости воды (Одна калория — это количество тепловой энергии, необходимое для повышения температуры 1 грамма воды на 1° Цельсия. Примечание: при указании калорийности пищи калорией является пишется с большой буквы. Эти «большие» калории на самом деле составляют килокалории или 1000 калорий). Точно так же 1 калория энергии должна быть изъята из воды, чтобы понизить температуру 1 грамма воды на 1 градус Цельсия. Сравните это с теплоемкостью воздуха, которая составляет 0,24 калории на грамм. Высокая теплоемкость обусловлена водородными связями между молекулами воды. Температура является мерой полной кинетической энергии (движения) материала. Прежде чем молекулы воды смогут начать двигаться быстрее, водородные связи между молекулами должны быть разрушены, что требует затрат энергии. Следовательно, большая часть энергии (тепла) используется для разрыва связей, а не для повышения температуры (движения) молекул воды. Точно так же, когда тепло отводится и молекулы воды начинают замедляться, образуются новые водородные связи, высвобождая энергию, что помогает предотвратить сильное падение температуры. Поскольку тело человека примерно на 2/3 состоит из воды, это помогает предотвратить резкие изменения температуры тела.
Точно так же, когда тепло отводится и молекулы воды начинают замедляться, образуются новые водородные связи, высвобождая энергию, что помогает предотвратить сильное падение температуры. Поскольку тело человека примерно на 2/3 состоит из воды, это помогает предотвратить резкие изменения температуры тела.
Еще одним свойством воды, помогающим стабилизировать температуру тела, является ее высокая теплота парообразования . Это означает, что для превращения воды из жидкости в газ требуется затратить относительно большое количество энергии, чтобы увеличить движение молекул воды, достаточное для того, чтобы они освободились от молекул воды вокруг них. Поскольку эти молекулы воды движутся все быстрее и быстрее, у них в конечном итоге будет достаточно энергии, чтобы полностью отделиться от жидкости и превратиться в газ (водяной пар). Когда самые быстро движущиеся молекулы вырываются на свободу, их кинетическая энергия уходит вместе с ними, отводя тепло. На этом основан охлаждающий эффект испарения пота с нашей кожи.
Адгезия, когезия и смазка
Вода способна прилипать к другим полярным веществам. Это свойство обозначается как адгезия . Отличным примером важности этого свойства для организма являются легкие. Тонкая прослойка воды между наружной поверхностью легких и стенками грудной полости «приклеивает» легкие к стенкам и препятствует их коллапсу. Когезия — это слипание молекул воды. Это свойство препятствует отделению крови при движении по кровеносным сосудам. Наконец, вода может действовать как смазка и находится в тех частях тела, где структуры должны скользить друг относительно друга. Например, синовиальные суставы (колено, плечо, лодыжка и т. д.) имеют тонкий слой воды (синовиальной жидкости) между противолежащими структурами, что позволяет им легко скользить друг относительно друга при движении сустава.
Химические реакции
Все тысячи химических реакций, протекающих в нашем организме, требуют воды. Это связано с тем, что для реакции химические вещества должны находиться в водном растворе. Также вода принимает непосредственное участие во многих важных реакциях, протекающих в организме.
Также вода принимает непосредственное участие во многих важных реакциях, протекающих в организме.
**Вы можете использовать кнопки ниже, чтобы перейти к следующему или предыдущему чтению в этом модуле**
Химические характеристики воды – Кислотность Щелочность Жесткость Мутность
Химические характеристики воды
Химические характеристики природной воды являются отражением почв и горных пород, с которыми вода контактировала. Кроме того, на качество воды влияют сельскохозяйственные и городские стоки, а также муниципальные и промышленные очищенные сточные воды. Микробные и химические превращения также влияют на химические характеристики воды. Химические характеристики воды можно разделить на следующие категории:
- Кислотность
- Щелочность
- Твердость
- Мутность
Кислотность воды:
pH является мерой того, насколько кислой или щелочной (щелочной) является вода. Он определяется как отрицательный логарифм концентрации ионов водорода. Шкала рН является логарифмической и колеблется от 0 (очень кислая) до 14 (очень щелочная). При увеличении каждого целого числа (то есть от 1 до 2) концентрация ионов водорода уменьшается в десять раз, а вода становится менее кислой. Кислотность или щелочность измеряется рН. PH измеряет концентрацию ионов водорода в воде. Ионизация воды
Он определяется как отрицательный логарифм концентрации ионов водорода. Шкала рН является логарифмической и колеблется от 0 (очень кислая) до 14 (очень щелочная). При увеличении каждого целого числа (то есть от 1 до 2) концентрация ионов водорода уменьшается в десять раз, а вода становится менее кислой. Кислотность или щелочность измеряется рН. PH измеряет концентрацию ионов водорода в воде. Ионизация воды
HOH H + + OH —
В нейтральных растворах [OH] = [H], следовательно, pH = 7
[ЧАС]). Значение pH воды важно для многих процессов очистки воды и сточных вод, а также для борьбы с коррозией.
Щелочность воды:
Щелочность природной воды обычно обусловлена присутствием бикарбонатов, образующихся в результате реакций в почвах, через которые вода просачивается. Это мера способности воды нейтрализовать кислоты и отражает ее буферную способность. Это также может быть связано с наличием карбонатов и гидроксидов. Щелочность важна для рыб и водных организмов, потому что она защищает или защищает от быстрых изменений pH. Значения pH выше 7 свидетельствуют о щелочности. Щелочные соединения в воде могут нейтрализовать кислоты. Основными составляющими щелочности (или едкости) являются OH — , CO 3 2- и бикарбонаты HCO 3 ионы. Щелочность в воде обычно вызывается ионами бикарбоната.
Щелочность важна для рыб и водных организмов, потому что она защищает или защищает от быстрых изменений pH. Значения pH выше 7 свидетельствуют о щелочности. Щелочные соединения в воде могут нейтрализовать кислоты. Основными составляющими щелочности (или едкости) являются OH — , CO 3 2- и бикарбонаты HCO 3 ионы. Щелочность в воде обычно вызывается ионами бикарбоната.
Жесткость воды:
Определение жесткости воды
Жесткость воды обусловлена только солями кальция и магния. Временная жесткость обусловлена карбонатами и бикарбонатами кальция и магния, а постоянная жесткость обусловлена хлоридами и сульфатами кальция и магния.
Жесткость – это свойство воды, требующее большего количества мыла для образования пены или пены. Жесткость воды не вредна для здоровья человека, но может быть повышена при нагревании, что может привести к повреждению котлов, горячих труб и т. д. за счет осаждения материала и уменьшения емкости для хранения и транспортировки воды. Абсолютно мягкая вода , с другой стороны, неприемлема для человека, поскольку может вызвать заболевания, особенно у сердечников. Жесткость воды обычно классифицируют по содержанию в ней CaCO 3 (карбонат кальция).
Абсолютно мягкая вода , с другой стороны, неприемлема для человека, поскольку может вызвать заболевания, особенно у сердечников. Жесткость воды обычно классифицируют по содержанию в ней CaCO 3 (карбонат кальция).
| Концентрация CaCO3 | Степень твердости |
0 – 75 мг/л | Мягкий |
75 – 150 мг/л | Умеренно жесткий |
150 – 300 мг/л | Жесткий |
300 мг/л | Очень твердый |
Таблица 1 — Степень жесткости
Низкий уровень жесткости может быть удален простым кипячением, а высокий уровень жесткости может быть удален добавлением извести. Преимущество этого метода заключается также в удалении содержания железа и марганца и уменьшении количества взвешенных частиц, включая микроорганизмы.
Преимущество этого метода заключается также в удалении содержания железа и марганца и уменьшении количества взвешенных частиц, включая микроорганизмы.
См. также: Химические характеристики сточных вод
Жесткая вода не подходит для промышленного использования. Но жесткая вода обычно полезна для питья. Однако жесткость, вызванная MgSO 4 , оказывает серьезное воздействие на здоровье. Так, концентрация Mg++ в питьевой воде не должна превышать 50 мг/л.
Мутность воды:
Мутность является мерой светопроницаемости воды и состоит из взвешенных и коллоидных веществ. Это важно для здоровья и эстетики. На прозрачность природных водоемов влияет деятельность человека, разлагающиеся растительные остатки, цветение водорослей, взвешенные отложения и питательные вещества для растений. Мутность обеспечивает недорогую оценку общей концентрации взвешенных твердых частиц (TSS). Он имеет небольшое значение, за исключением относительно чистой воды, но полезен для определения качества питьевой воды при очистке воды.
