|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
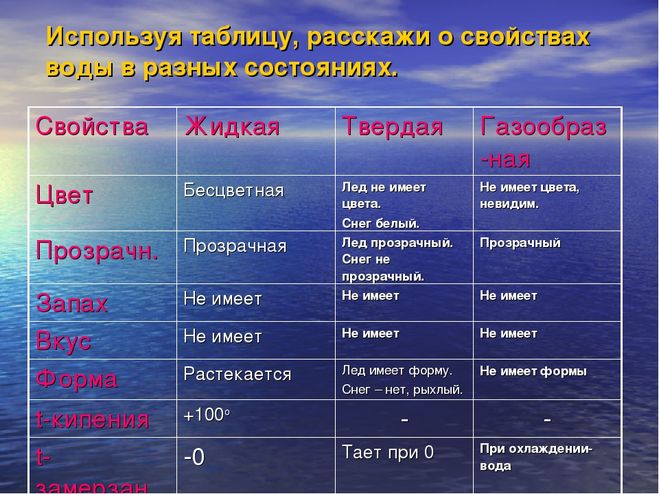
Удивительные свойства воды
Японский исследователь Масару Емото более двадцати лет изучает воду. Вернее, ее кристаллы, которые он получает в своей лаборатории, фотографирует, а затем анализирует снимки под микроскопом с увеличением в несколько сотен раз. Эти многолетние исследования позволили ученому сделать удивительное, поистине сенсационное открытие.
Эти многолетние исследования позволили ученому сделать удивительное, поистине сенсационное открытие.
Суть своих экспериментов и сделанного на их основе открытия японский ученый раскрыл на встрече с польскими исследователями и журналистами, состоявшейся 16 марта 2004 года в конференц-зале Института геологии в Варшаве.
Исследуя обычную дистиллированную воду, Масару Емото обнаружил, что форма образующихся из нее кристаллов может отличаться большим разнообразием, а их внешний вид зависит от характера информационного воздействия, оказанного на воду до начала ее кристаллизации.
Основой структуры кристаллов воды — хорошо известных снежинок — является шестиугольник, именно с его формирования и начинается кристаллизация. А вокруг этого шестиугольника могут возникать украшающие его орнаменты. Вид этих украшений, так же, как и цвет кристалла, определяется информацией, гредварительно воспринятой водой.
Оптимальной для образования кристаллов воды оказалась температура, равная -5шС. Именно такой «легкий морозец» и поддерживает в своей лаборатории японский исследователь, по крайней мepe, в период проведения экспериментов. Отправным моментом для исследований Масару Емото стали работы американского биохимика доктора Ли Лорензена, который в конце 80-х годов XX века впервые в мире доказал, что вода накапливает и сохраняет сообщаемую ей информацию. Емото стал сотрудничать с Лорензеном, но пошел еще дальше и решил попытаться получить визуальное подтверждение неожиданного свойства воды, обнаруженного американским ученым. Его поиски увенчались успехом, а результаты превзошли все ожидания.
Именно такой «легкий морозец» и поддерживает в своей лаборатории японский исследователь, по крайней мepe, в период проведения экспериментов. Отправным моментом для исследований Масару Емото стали работы американского биохимика доктора Ли Лорензена, который в конце 80-х годов XX века впервые в мире доказал, что вода накапливает и сохраняет сообщаемую ей информацию. Емото стал сотрудничать с Лорензеном, но пошел еще дальше и решил попытаться получить визуальное подтверждение неожиданного свойства воды, обнаруженного американским ученым. Его поиски увенчались успехом, а результаты превзошли все ожидания.
Оказалось, что кристаллы воды, к которой до начала кристаллизации «обратились» с такими словами, как «доброта», «любовь», «ангел», «благодарность», имели правильную структуру, симметричную форму и были украшены сложным, красивым орнаментом. Но если воде были сообщенные слова типа «зло», «ненависть», «злоба», «ты дура», то кристаллы получались мелкими, деформированными, уродливыми на вид. При этом не имело значения, произносились ли слова вслух или записывались на бумажку, приклеенную к емкости с водой. Если же воде не сказать ничего, образуются кристаллы правильной формы, но будут они обычными, «серыми», практически без всяких украшений. Причем такая зависимость подтверждена многочисленными экспериментами и тысячами фотоснимков. Воде не важно, на каком языке с ней общаются, она понимает любую речь. Более того, опыты показали, что не играет роли и расстояние. Так, Масару Емото посылал «чистые мысли» воде, находящейся в его лаборатории в Токио, а сам был в это время в Мельбурне. Вода эти мысли восприняла мгновенно и отреагировала Арией великолепных кристаллов. Таким образом, в очередной раз подтвердилась гипотеза о том, что пространство и время не являются преградой для передачи информации. (Не правда ли, все это очень похоже на механизм телепатических контактов?)
При этом не имело значения, произносились ли слова вслух или записывались на бумажку, приклеенную к емкости с водой. Если же воде не сказать ничего, образуются кристаллы правильной формы, но будут они обычными, «серыми», практически без всяких украшений. Причем такая зависимость подтверждена многочисленными экспериментами и тысячами фотоснимков. Воде не важно, на каком языке с ней общаются, она понимает любую речь. Более того, опыты показали, что не играет роли и расстояние. Так, Масару Емото посылал «чистые мысли» воде, находящейся в его лаборатории в Токио, а сам был в это время в Мельбурне. Вода эти мысли восприняла мгновенно и отреагировала Арией великолепных кристаллов. Таким образом, в очередной раз подтвердилась гипотеза о том, что пространство и время не являются преградой для передачи информации. (Не правда ли, все это очень похоже на механизм телепатических контактов?)
В ходе дальнейших экспериментов выяснилось, что вода способна воспринимать и отображать такие человеческие эмоции, как страх, боль, страдание. Об этом убедительно свидетельствуют фотографии кристаллов, сделанные после катастрофического землетрясения 1995 года в городе Кобе. Когда сразу же после этой трагедии сфотографировали кристаллы, образовавшиеся из воды, взятой из местного водопровода, они были деформированными и уродливыми, словно их исказили воспринятые водой страх, паника и страдания, испытываемые людьми сразу после землетрясения. А когда получили кристаллы из воды, взятой из того же водопровода, но три месяца спустя, они уже имели правильную форму и выглядели гораздо привлекательнее. Дело в том, что в течение этого времени в Кобе поступала помощь из многих стран мира, жители ощущали сочувствие и симпатию большинства населения Земли, и их моральное состояние заметно улучшилось.
Об этом убедительно свидетельствуют фотографии кристаллов, сделанные после катастрофического землетрясения 1995 года в городе Кобе. Когда сразу же после этой трагедии сфотографировали кристаллы, образовавшиеся из воды, взятой из местного водопровода, они были деформированными и уродливыми, словно их исказили воспринятые водой страх, паника и страдания, испытываемые людьми сразу после землетрясения. А когда получили кристаллы из воды, взятой из того же водопровода, но три месяца спустя, они уже имели правильную форму и выглядели гораздо привлекательнее. Дело в том, что в течение этого времени в Кобе поступала помощь из многих стран мира, жители ощущали сочувствие и симпатию большинства населения Земли, и их моральное состояние заметно улучшилось.
Подобным же образом кристаллы отображают и качество воды, из которой они образовались. Примечательно, что из проб, которые Масару Емото брал из Темзы в Лондоне и из Сены в Париже, кристаллов не удалось получить вообще, к что и фотографировать было нечего. из воды, взятой в городском водопроводе Лос-Анджелеса, кристаллы получились, но вид их был просто ужасен. Зато кристаллы, образовавшиеся из воды родников Японии, озера Лаго-Маджоре, что лежит в южных отрогах Альп на территорииИталии и Швейцарии, а также ледника Маунт Кук в Новой Зеландии, оказались яркими, красочными и имели великолепную форму. Реагирует вода и на музыку. «Прослушав» сочинения Бетховена, «Аве Марию» Шуберта или «Свадебный марш» Мендельсона, она образует кристаллы фантастической красоты. Kpисталлы воды, которой сыграли «Танец маленьких лебедей» из балета Чайковского «Лебединое озеро», напоминали, пo словам Емото, силуэты этих rpaциозных и величественных птиц. А когда воде сообщили назван я пяти основных мировых религий — христианство, буддизм, индуизм, ислам, и иудаизм, из нее образовался пятиугольны кристалл, и в нем просматривались контуры человеческого лица! Масару Емото имеет все основания утверждать, что его открытие является еще одним доказательством справедливости гипотезы доктора биологии, профессора Руперта Шелдрейка о суцествовании в природе морфогенезных, или формообразующих, полей, содержащих информацию, не передающуюся живым организмам посредством механизма наследственности и доступную им для считывания из этих полей.
из воды, взятой в городском водопроводе Лос-Анджелеса, кристаллы получились, но вид их был просто ужасен. Зато кристаллы, образовавшиеся из воды родников Японии, озера Лаго-Маджоре, что лежит в южных отрогах Альп на территорииИталии и Швейцарии, а также ледника Маунт Кук в Новой Зеландии, оказались яркими, красочными и имели великолепную форму. Реагирует вода и на музыку. «Прослушав» сочинения Бетховена, «Аве Марию» Шуберта или «Свадебный марш» Мендельсона, она образует кристаллы фантастической красоты. Kpисталлы воды, которой сыграли «Танец маленьких лебедей» из балета Чайковского «Лебединое озеро», напоминали, пo словам Емото, силуэты этих rpaциозных и величественных птиц. А когда воде сообщили назван я пяти основных мировых религий — христианство, буддизм, индуизм, ислам, и иудаизм, из нее образовался пятиугольны кристалл, и в нем просматривались контуры человеческого лица! Масару Емото имеет все основания утверждать, что его открытие является еще одним доказательством справедливости гипотезы доктора биологии, профессора Руперта Шелдрейка о суцествовании в природе морфогенезных, или формообразующих, полей, содержащих информацию, не передающуюся живым организмам посредством механизма наследственности и доступную им для считывания из этих полей. Практическое значение открытия японского ученого трудно переоценить, если вспомнить, что человек более чем наполовину состоит из воды. И, следовательно, вода, находящаяся в организме, запоминает все наши повседневные мысли, чувства, эмоции. И если они положительны — мы не болеем, у нас отличное самочувствие, тогда как отрицательные мысли и эмоции, являющиеся, в сущности, вибрациями с определенными параметрами, передаются «нашей» воде и отрицательно влияют на все протекающие в организме процессы. И при этом нарушается гармония. наших вибраций с вибрациями, проявляющимися в природе.
Практическое значение открытия японского ученого трудно переоценить, если вспомнить, что человек более чем наполовину состоит из воды. И, следовательно, вода, находящаяся в организме, запоминает все наши повседневные мысли, чувства, эмоции. И если они положительны — мы не болеем, у нас отличное самочувствие, тогда как отрицательные мысли и эмоции, являющиеся, в сущности, вибрациями с определенными параметрами, передаются «нашей» воде и отрицательно влияют на все протекающие в организме процессы. И при этом нарушается гармония. наших вибраций с вибрациями, проявляющимися в природе.
— Человеческое тело можно уподобить симфонии вибраций наших клеток, а внутри каждого из нас как бы существует своя малая вселенная, — говорит Емото. — Из этого следует, как много в нашей судьбе зависит от нас самих.
Открытие японского исследователя, по мнению многих ученых и специалистов, — одно из самых сенсационных, сделанных на рубеже тысячелетий. Но представителями ортодоксальной науки оно было проигнорировано. И это понятно: для того чтобы его воспринять, необходимо прежде признать, что сама по себе материя — это далеко не главное, что гораздо важнее пронизывающий ее дух, который, как бы это ни показалось невероятным, в определенных случаях способен продемонстрировать свое присутствие поразительным и ярко выраженным способом. Как это и происходит, например, в самом обычном (а может как раз, в самом необычном!) веществе — в воде.
И это понятно: для того чтобы его воспринять, необходимо прежде признать, что сама по себе материя — это далеко не главное, что гораздо важнее пронизывающий ее дух, который, как бы это ни показалось невероятным, в определенных случаях способен продемонстрировать свое присутствие поразительным и ярко выраженным способом. Как это и происходит, например, в самом обычном (а может как раз, в самом необычном!) веществе — в воде.
Результаты своих исследований Масару Емото изложил в книге «Послания, исходящие от воды», опубликованной в 2002 году, которая за прошедшее с тех пор время буквально покорила мир и была переведена на десятки языков.
Почему жизнь зависит от воды
Результаты обучения
- Описать свойства воды, имеющие решающее значение для поддержания жизни
Рисунок 1. Как видно из этого изображения нефти и воды, нефть является неполярным соединением и, следовательно, не растворяется в воде. Масло и вода не смешиваются.
Вы когда-нибудь задумывались, почему ученые тратят время на поиски воды на других планетах? Это потому, что вода необходима для жизни; даже мельчайшие следы его на другой планете могут указывать на то, что жизнь могла существовать или существовала на этой планете. Вода — одна из наиболее распространенных молекул в живых клетках и наиболее важная для жизни, какой мы ее знаем. Примерно 60–70 процентов вашего тела состоит из воды. Без него жизни просто не было бы.
Вода — одна из наиболее распространенных молекул в живых клетках и наиболее важная для жизни, какой мы ее знаем. Примерно 60–70 процентов вашего тела состоит из воды. Без него жизни просто не было бы.
Вода полярна
Атомы водорода и кислорода в молекулах воды образуют полярные ковалентные связи. Общие электроны проводят больше времени, связанного с атомом кислорода, чем с атомами водорода. У молекулы воды нет общего заряда, но есть небольшой положительный заряд на каждом атоме водорода и небольшой отрицательный заряд на атоме кислорода. Из-за этих зарядов слегка положительные атомы водорода отталкиваются друг от друга и образуют уникальную форму, показанную на рисунке 2. Каждая молекула воды притягивает другие молекулы воды из-за положительных и отрицательных зарядов в разных частях молекулы. Вода также притягивает другие полярные молекулы (например, сахара), образуя водородные связи. Когда вещество легко образует водородные связи с водой, оно может растворяться в воде и называется гидрофильным («водолюбивым»). Водородные связи нелегко образуются с неполярными веществами, такими как масла и жиры (рис. 1). Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Водородные связи нелегко образуются с неполярными веществами, такими как масла и жиры (рис. 1). Эти неполярные соединения являются гидрофобными («водобоязненными») и не растворяются в воде.
Рис. 2. Водородные связи образуются между слабо положительными (δ+) и слабоотрицательными (δ–) зарядами полярных ковалентных молекул, таких как вода.
Вода стабилизирует температуру
Водородные связи в воде позволяют ей поглощать и выделять тепловую энергию медленнее, чем многие другие вещества. Температура является мерой движения (кинетической энергии) молекул. Чем больше движение, тем выше энергия и, следовательно, выше температура. Вода поглощает большое количество энергии, прежде чем ее температура повысится. Повышенная энергия разрушает водородные связи между молекулами воды. Поскольку эти связи могут создаваться и разрушаться быстро, вода поглощает увеличение энергии и изменения температуры лишь в минимальной степени. Это означает, что вода смягчает изменения температуры внутри организмов и в окружающей их среде. По мере поступления энергии баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Больше связей разрывается, чем образуется. Этот процесс приводит к высвобождению отдельных молекул воды на поверхность жидкости (например, водоема, листьев растения или кожи организма) в процессе, называемом испарением. Испарение пота, что составляет 90 процентов воды, позволяет охлаждать организм, потому что разрыв водородных связей требует затрат энергии и отбирает тепло у тела.
По мере поступления энергии баланс между образованием и разрушением водородных связей смещается в сторону разрушения. Больше связей разрывается, чем образуется. Этот процесс приводит к высвобождению отдельных молекул воды на поверхность жидкости (например, водоема, листьев растения или кожи организма) в процессе, называемом испарением. Испарение пота, что составляет 90 процентов воды, позволяет охлаждать организм, потому что разрыв водородных связей требует затрат энергии и отбирает тепло у тела.
И наоборот, по мере уменьшения молекулярного движения и снижения температуры выделяется меньше энергии для разрыва водородных связей между молекулами воды. Эти связи остаются неповрежденными и начинают формировать жесткую решетчатую структуру (например, лед) (рис. 3а). В замороженном виде лед менее плотный, чем жидкая вода (молекулы находятся дальше друг от друга). Это означает, что лед плавает на поверхности водоема (рис. 3б). В озерах, прудах и океанах лед образуется на поверхности воды, создавая изолирующий барьер, защищающий животных и растения от замерзания в воде. Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах затруднительной или невозможной.
Если бы этого не произошло, растения и животные, живущие в воде, замерзли бы в глыбе льда и не могли бы свободно передвигаться, что сделало бы жизнь при низких температурах затруднительной или невозможной.
Рис. 3. (a) Решетчатая структура льда делает его менее плотным, чем свободно текущие молекулы жидкой воды. Меньшая плотность льда позволяет ему (б) плавать на воде. (кредит а: модификация работы Джейн Уитни; кредит б: модификация работы Карлоса Понте)
Вода — отличный растворитель
Поскольку вода полярна, имеет небольшие положительные и отрицательные заряды, ионные соединения и полярные молекулы могут легко растворяться в ней. Таким образом, вода — это то, что называют растворителем — вещество, способное растворять другое вещество. Заряженные частицы будут образовывать водородные связи с окружающим слоем молекул воды. Это называется сферой гидратации и служит для разделения или диспергирования частиц в воде. В случае поваренной соли (NaCl), смешанной с водой (рис. 4), ионы натрия и хлорида разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации.
4), ионы натрия и хлорида разделяются или диссоциируют в воде, и вокруг ионов образуются сферы гидратации.
Рисунок 4. При смешивании поваренной соли (NaCl) с водой вокруг ионов образуются сферы гидратации.
Положительно заряженный ион натрия окружен частично отрицательно заряженными атомами кислорода в молекулах воды. Отрицательно заряженный ион хлора окружен частично положительными зарядами атомов водорода в молекулах воды. Эти сферы гидратации также называют гидратными оболочками. Полярность молекулы воды делает ее эффективным растворителем и играет важную роль в ее многочисленных ролях в живых системах.
Вода связывает
Рис. 5. Вес иглы над водой снижает поверхностное натяжение; в то же время поверхностное натяжение воды тянет ее вверх, удерживая иглу на поверхности воды и удерживая ее от погружения. Обратите внимание на углубление в воде вокруг иглы. (кредит: Кори Занкер)
Вы когда-нибудь наполняли стакан воды до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода на самом деле образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Сплоченность порождает поверхностное натяжение, способность вещества выдерживать разрыв при растяжении или напряжении. Когда вы бросаете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли воды, хотя объект плотнее (тяжелее), чем вода. Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения (рис. 5).
Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-воздух (газ), хотя в стекле больше нет места. Сплоченность порождает поверхностное натяжение, способность вещества выдерживать разрыв при растяжении или напряжении. Когда вы бросаете небольшой клочок бумаги на каплю воды, бумага плавает поверх капли воды, хотя объект плотнее (тяжелее), чем вода. Это происходит из-за поверхностного натяжения, создаваемого молекулами воды. Когезия и поверхностное натяжение удерживают молекулы воды неповрежденными, а предмет плавает на поверхности. Можно даже «поплавать» стальной иглой поверх стакана с водой, если поместить ее осторожно, не нарушая поверхностного натяжения (рис. 5).
Эти когезионные силы также связаны со свойством воды прилипать или притяжением между молекулами воды и другими молекулами. Это наблюдается, когда вода «поднимается» по соломинке, помещенной в стакан с водой. Вы заметите, что вода кажется выше по бокам соломинки, чем в середине. Это происходит потому, что молекулы воды притягиваются к соломинке и поэтому прилипают к ней.
Вы заметите, что вода кажется выше по бокам соломинки, чем в середине. Это происходит потому, что молекулы воды притягиваются к соломинке и поэтому прилипают к ней.
Силы сцепления и сцепления важны для поддержания жизни. Например, из-за этих сил вода может течь от корней к верхушкам растений, чтобы питать растение.
Видеообзор
Практический вопрос
Какое из следующих утверждений не верно?
- Вода полярная.
- Вода стабилизирует температуру.
- Вода необходима для жизни.
- Вода — самый распространенный атом в атмосфере Земли.
Показать ответ
Попробуйте
Внесите свой вклад!
У вас есть идеи по улучшению этого контента? Мы будем признательны за ваш вклад.
Улучшить эту страницуПодробнее
Свойства воды: Обзор ускоренного курса биологии AP®
Свойства воды Введение
На экзамене по биологии AP® многие студенты задаются вопросами, касающимися свойств воды. Эта тема обычно раскрывается в начале года, а когда дело доходит до всей информации, за которую учащиеся отвечают в AP® Bio, о ней забывают. Свойства воды необходимы для поддержания гомеостаза, стабильного равновесия в организмах и в мире.
В этом обзоре ускоренного курса биологии AP® мы рассмотрим информацию, необходимую для понимания свойств воды. Мы начнем с разговора о полярности воды и о том, как ее полярность делает воду одним из самых важных химических веществ на Земле. Затем мы поговорим о нескольких важных свойствах воды, которые позволяют организмам выживать. Наконец, мы рассмотрим бесплатный вопрос о свойствах воды, заданный учащимся на экзамене 2009 г.Экзамен AP® по биологии.
Важность полярности и водородных связей
К этому моменту вашей научной карьеры вы, вероятно, узнали о полярности. Полярная молекула — это молекула, которая не распределяет свои электроны поровну между своими атомами. Этот электронный дисбаланс заставляет молекулу иметь положительные и отрицательные диполи; поскольку электроны проводят больше времени на одном конце (из-за неравного распределения), эта часть молекулы будет иметь частичный отрицательный заряд. Конец, который притягивает электрон к себе, будет отрицательным диполем, а конец, оттягивающий электрон от себя, будет положительным диполем.
Полярная молекула — это молекула, которая не распределяет свои электроны поровну между своими атомами. Этот электронный дисбаланс заставляет молекулу иметь положительные и отрицательные диполи; поскольку электроны проводят больше времени на одном конце (из-за неравного распределения), эта часть молекулы будет иметь частичный отрицательный заряд. Конец, который притягивает электрон к себе, будет отрицательным диполем, а конец, оттягивающий электрон от себя, будет положительным диполем.
Величина силы, которую оказывает отрицательный атом, называется электроотрицательностью. Важно понимать, что кислород имеет одно из самых высоких значений электроотрицательности, а это означает, что он будет оттягивать электроны от атома, с которым он связан, превращая его в отрицательный диполь. В случае воды кислород вытянет электрон из водорода. Имейте в виду, что молекулы воды по-прежнему делятся своими электронами, но электроны проводят больше времени с кислородом, чем с водородом.
Почему все это так важно? Диполи в конечном итоге делают атом кислорода отрицательно заряженным, а атомы водорода — положительно заряженными. Вода состоит из миллионов этих молекул, которые заставляют их ориентироваться определенным образом. Отрицательная часть одной молекулы воды захочет оказаться рядом с положительной частью другой. Эта решетчатая связь называется водородной связью.
Вода состоит из миллионов этих молекул, которые заставляют их ориентироваться определенным образом. Отрицательная часть одной молекулы воды захочет оказаться рядом с положительной частью другой. Эта решетчатая связь называется водородной связью.
Водородные связи — одна из самых важных вещей, которые вы должны знать о воде. Водородная связь является причиной свойств воды, которые вы должны знать для экзамена AP® Bio. Для каждого свойства, которое мы обсуждаем, мы рассмотрим, как оно возникает из-за водородных связей и как это влияет на жизнь на Земле.
Источник изображения: Wikimedia Commons.
Адгезия
Первые два свойства, которые мы обсудим в обзоре ускоренного курса биологии AP®, связаны друг с другом: адгезия и адгезия. Адгезия — это свойство воды, которое относится к прилипанию молекул воды к другой поверхности. Когезия — это свойство воды, которое относится к тому, что молекулы воды прилипают друг к другу. Оба этих свойства обусловлены водородными связями и тем, как водородные связи ориентируют молекулы воды.
Оба этих свойства обусловлены водородными связями и тем, как водородные связи ориентируют молекулы воды.
Адгезия является важным свойством. Для демонстрации адгезии наполните пробирку водой. Вы увидите, как вода образует букву U. Эта буква U называется мениском . Мениск образуется из-за прилипания воды к стеклу пробирки. Если у вас будет еще более тонкая пробирка, вы увидите, что мениск станет глубже (вода поползет выше). Если у вас нет пробирки, обратите внимание на рисунок.
Слипание также происходит естественным образом и является причиной того, что деревья могут быть высокими. Деревья получают воду из своих корней. Корни находятся далеко от листьев, которым нужна вода. Ксилема — это часть дерева, по которой вода движется вверх против силы тяжести, чтобы добраться до листьев. Ксилема состоит из мелких капилляров. Когда вода попадает в ксилему, вода прилипает к стенкам капилляра и позволяет ей двигаться к листьям. Этот процесс называется капиллярным действием и жизненно важен для выживания растений.
Когезия
Когезия, как мы уже говорили, — это способность воды связываться сама с собой. Когезия отвечает за поверхностное натяжение, а это означает, что капли воды будут сопротивляться разрыву, когда в систему добавляются напряжение и давление.
Сплоченность возникает, когда вода окружена воздухом. Молекулы, находящиеся на концах капель, имеют меньше возможностей для образования водородных связей. Это приводит к укреплению их водородных связей; поверхность способна выдерживать нагрузки.
Сплоченность – важное свойство воды для многих видов насекомых. Пример можно найти в семействе насекомых Gerridae. Этих насекомых принято называть водомерками. Они могут использовать поверхностное натяжение воды, чтобы стоять на воде. Ареал обитания водомерок – поверхность спокойных вод. Именно здесь они охотятся и размножаются. Без связующих свойств воды эти насекомые не выжили бы так, как сейчас.
Источник изображения: Wikimedia Commons.
Удельная теплоемкость
Благодаря прочности водородных связей вода обладает чрезвычайно высокой удельной теплоемкостью. Удельная теплоемкость относится к количеству тепла, необходимому для перемещения вещества на один градус Цельсия. Высокая удельная теплоемкость означает, что вода способна выдержать большое количество энергии, прежде чем ее температура изменится; это связано с водородными связями воды. Чтобы вода нагрелась, водородные связи должны быть разорваны. Эта дополнительная энергия, необходимая для разрыва связей, дает воде способность противостоять изменениям температуры.
Удельная теплоемкость относится к количеству тепла, необходимому для перемещения вещества на один градус Цельсия. Высокая удельная теплоемкость означает, что вода способна выдержать большое количество энергии, прежде чем ее температура изменится; это связано с водородными связями воды. Чтобы вода нагрелась, водородные связи должны быть разорваны. Эта дополнительная энергия, необходимая для разрыва связей, дает воде способность противостоять изменениям температуры.
Есть две важные температуры, которые часто изучаются в соединениях: теплота парообразования и теплота плавления. Теплота парообразования относится к теплу, необходимому для перехода соединения из жидкого состояния в газообразное. Теплота плавления относится к теплу, необходимому для перевода соединения из твердого состояния в жидкое. Благодаря водородным связям вода имеет как высокую теплоту парообразования, так и высокую теплоту плавления.
Высокая удельная теплоемкость чрезвычайно важна для выживания организмов на Земле.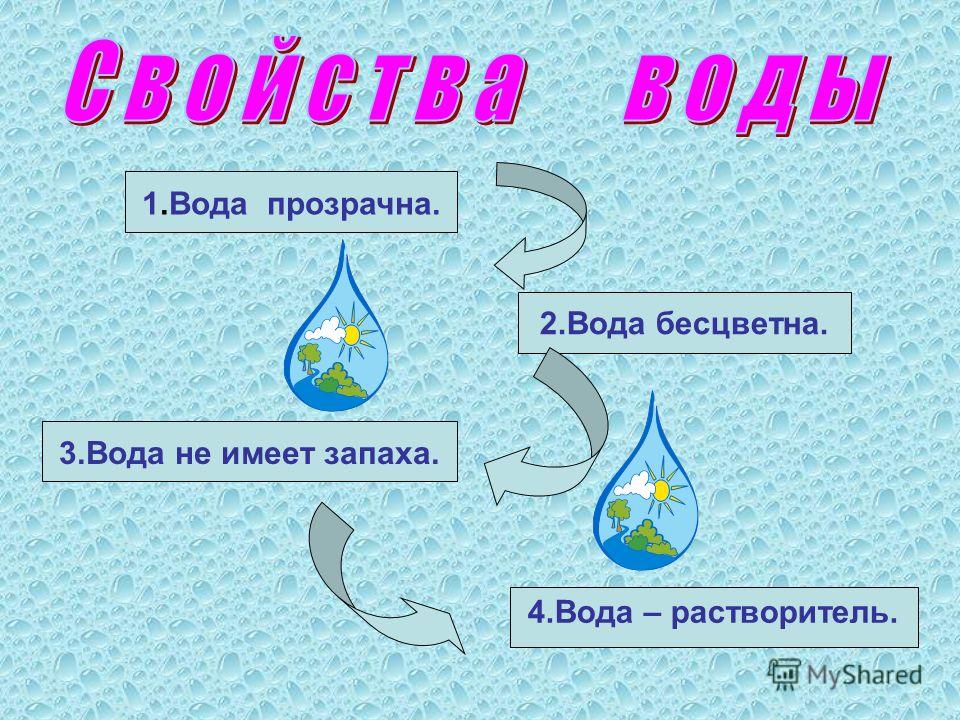 Земля на 70% состоит из воды. Вода на планете препятствует радикальному изменению температуры. Когда температура в атмосфере меняется, вода поглощает изменение температуры, не позволяя организмам выживать в динамичной среде. Кроме того, у людей (как и у большинства организмов) есть тела с очень высоким содержанием воды. По той же причине содержание воды предотвращает колебания температуры тела.
Земля на 70% состоит из воды. Вода на планете препятствует радикальному изменению температуры. Когда температура в атмосфере меняется, вода поглощает изменение температуры, не позволяя организмам выживать в динамичной среде. Кроме того, у людей (как и у большинства организмов) есть тела с очень высоким содержанием воды. По той же причине содержание воды предотвращает колебания температуры тела.
Плотность льда
Это может показаться наиболее очевидным свойством воды; вода в твердом состоянии плавает в жидком. Большинство веществ, обнаруженных на Земле, имеют гораздо более плотную твердую версию, чем жидкая версия, что интуитивно понятно. Когда вещество становится твердым, оно уплотняется, делая связи более тесными и прочными. Почему же тогда вода не подчиняется этому правилу и плавает? Вы, наверное, догадались, водородные связи.
Водородные связи в воде заставляют твердую воду образовывать трехмерную матрицу. Водородные связи удерживают связи растянутыми, не позволяя воде конденсироваться, а скорее заставляя ее растекаться.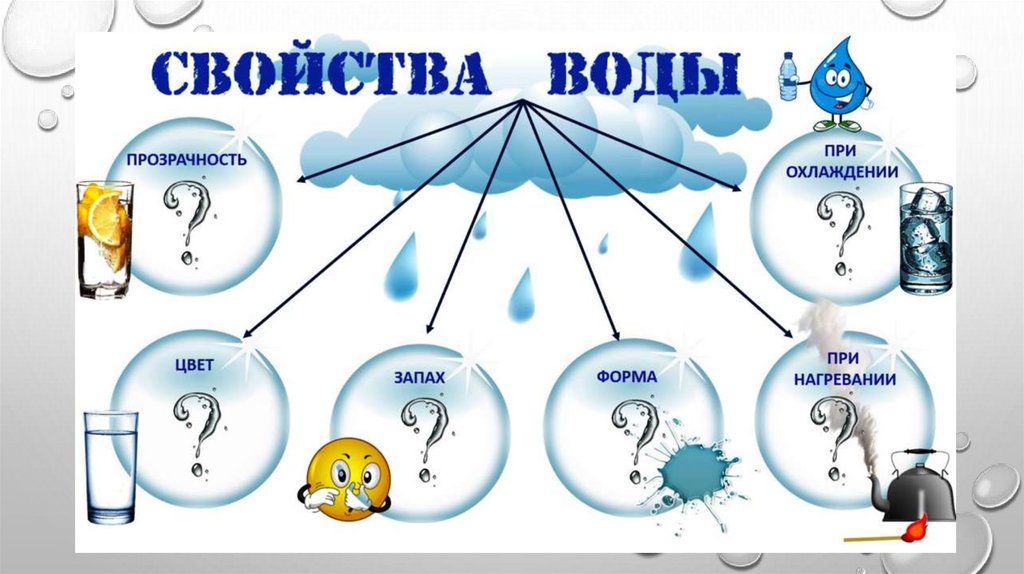 Когда вода находится в жидком состоянии, водородные связи гораздо более гибкие и способны перемещаться. Когда вода становится твердой, связи становятся менее гибкими, что приводит к расширению воды. Расширение связей приводит к уменьшению плотности льда; менее плотные соединения будут плавать в более плотных смесях.
Когда вода находится в жидком состоянии, водородные связи гораздо более гибкие и способны перемещаться. Когда вода становится твердой, связи становятся менее гибкими, что приводит к расширению воды. Расширение связей приводит к уменьшению плотности льда; менее плотные соединения будут плавать в более плотных смесях.
Помимо того, что это интересно, это чрезвычайно важно для нашего выживания на Земле. Если бы вода утонула в твердом состоянии из-за меньшей плотности льда, наша планета была бы заморожена. Если вода тонет, когда она подвергается воздействию низких температур, то следующий слой воды тоже будет тонуть, пока весь океан не замерзнет. Умрут не только морские животные, но и наземные организмы, скорее всего, не выживут.
Универсальный растворитель
Возможно, вы слышали, что вода является универсальным растворителем. Вода считается универсальным растворителем, так как способна очень быстро растворять соединения. Это свойство уникально для воды из-за диполей, которые имеют молекулы воды.
Когда соединение попадает в воду, молекулы воды окружают его, образуя клетку вокруг молекул соединения. Например, когда NaCl (поваренная соль) помещается в воду, Na отделяется от Cl. Молекулы воды разрывают соединение, потому что положительно заряженные молекулы водорода хотят соединиться с отрицательно заряженным ионом хлора. Кроме того, отрицательно заряженный диполь кислорода хочет соединиться с положительно заряженным ионом натрия. Это притяжение раздвигает молекулы и заставляет воду быстро растворять соль.
Существует класс соединений, которые вода не может растворить. Эти соединения являются неполярными соединениями. Неполярные соединения делят свои электроны поровну и не имеют зарядов или диполей. Из-за этой характеристики вода не может разделять разные молекулы. По этой причине масло (неполярное) и вода (полярное) не смешиваются.
Растворители невероятно необходимы по многим причинам. Мы постоянно поглощаем пищу, которая должна быть быстро и эффективно расщеплена. Присутствие воды в нашем организме способствует пищеварению. Растворители играют важную роль почти во всех химических реакциях.
Присутствие воды в нашем организме способствует пищеварению. Растворители играют важную роль почти во всех химических реакциях.
Резюме
В этом обзоре ускоренного курса биологии AP® мы говорили о многих различных свойствах воды, которые позволяют жить на Земле. Мы говорили о сплоченности, которая позволяет таким насекомым, как водомерки, стоять на воде. Мы также рассмотрели адгезию, которая позволяет воде доходить до листьев дерева. Затем мы узнали о высокой удельной теплоемкости воды и о том, как она позволяет температуре на Земле и в организмах, таких как люди, оставаться на уровне гомеостаза. Далее мы говорили о том, как твердая форма воды, лед, плавает, и как это позволило нашим океанам оставаться талыми. Наконец-то мы узнали о том, что вода является универсальным растворителем, способным растворить любое полярное вещество.
В этой статье «Свойства воды: обзор ускоренного курса биологии AP®» содержится много информации для обзора. Чтобы убедиться, что вы чувствуете себя комфортно, мы сейчас рассмотрим вопрос AP® Bio о свойствах воды, который был замечен на экзамене AP® в 2009 году. .
.
а) Обсудите ТРИ свойства воды.
(b) Объясните каждое из следующего с точки зрения свойств воды. Вы не ограничены тремя свойствами, описанными в части (а):
- роль воды как среды для метаболических процессов клеток
- способность воды смягчать температуру внутри живых организмов и в окружающей их среде
- движение воды от корней к корням листья растений
Для части А у вас есть выбор. Вот несколько ответов, за которые Экзамен по биологии AP® принимает полные баллы:
| Свойство | Description |
| Cohesion | Attraction to other water molecules, surface tension |
| Adhesion | Attraction to other surfaces |
| High Specific Heat | Heat absorption without temperature change |
| Состояние вещества | Лед менее плотный, чем вода, расширяется и становится менее плотным |
| Высокая теплота парообразования | Молекулы воды поглощают энергию |
В части B вы должны объяснить три важные составляющие жизни на Земле и то, как вода необходима для их существования. Первый пример относится к способности воды быть универсальным растворителем. Мы рассмотрели, что важно, чтобы вода могла растворять вещества, а в клетке это особенно важно. Присутствие воды также позволяет протекать многим химическим реакциям.
Первый пример относится к способности воды быть универсальным растворителем. Мы рассмотрели, что важно, чтобы вода могла растворять вещества, а в клетке это особенно важно. Присутствие воды также позволяет протекать многим химическим реакциям.
Второй пример, который мы рассмотрели ранее в этой статье. Вода снижает температуру, поглощая тепло и не изменяя температуру. Это позволяет климату оставаться более стабильным. Высокая удельная теплоемкость воды также позволит поддерживать постоянную внутреннюю среду внутри организмов.
Наконец, в третьем примере мы можем использовать капиллярное действие воды. Вода движется вверх по ксилеме дерева, чтобы достичь листьев. Вода движется за счет адгезии и капиллярного действия.
Большое спасибо, что прочитали нашу статью! Дайте нам знать, если у вас есть какие-либо вопросы или вы хотите поделиться своей подготовкой к экзамену AP® Bio ниже. Если вы хотите продолжить обучение, ознакомьтесь с нашей статьей Гомеостаз: обзор ускоренного курса биологии AP® прямо сейчас!
Нужна помощь в подготовке к экзамену AP® по биологии?
У Альберта есть сотни практических вопросов AP® Biology, бесплатные ответы и полные практические тесты, которые можно попробовать.

 Конструирование
Конструирование 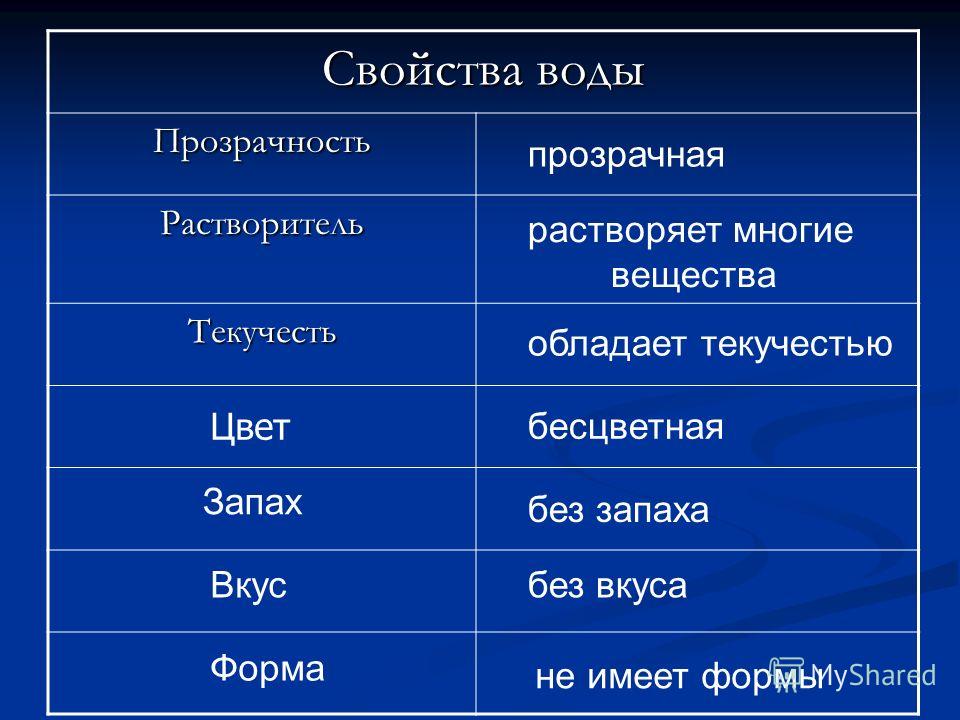
 Так вот не жизнь изумительна, а — вода!
Так вот не жизнь изумительна, а — вода!

 Воннегута
Воннегута