Содержание
Что такое гипс? Формула, виды, состав, применение
Промышленное применение
Weiter
ГИПС: горная порода и строительный материал
Легкий и экономичный в работе гипс применяется человечеством веками. Сегодня гипс – это один из самых распространённых строительных материалов. Он используется для декоративной отделки стен и потолков в современном дизайне интерьера, для производства гипсокартона, штукатурок, наливных полов, клеев и т.д.
Свое название гипс получил от греческого «γύψος» (gypsos). Именно греки одни из первых стали применять гипс в строительстве.
В Древнем Египте гипс использовался как раствор или штукатурка, а алебастр или селенит (разновидности гипса) — для изготовления статуэток, ваз, предметов интерьера и прозрачных пластин, которые устанавливались вместо оконного стекла. Римляне обнаружили, что при сильном нагреве гипса выделяется влага и получается идеальная штукатурка.
ФОРМУЛА И СТРУКТУРА ГИПСА
Гипс — это сульфат кальция (CaSO4), который может присутствовать в разных модификациях с кристаллической водой (Н2О):
Дигидрат (CaSO4*2 Н2О) → Полугидрат (CaSO4*0,5Н2О) → Ангидрит (CaSO4).
Химический состав чистого гипса:
СаО — 32,6 %;
SO3 — 46,5 %;
Н2О — 20,9 %.
Химическая формула для гипсового вяжущего такая же, как и для натурального гипса — CaSO4*2 Н2О. Поэтому, как и натуральный гипс, строительный гипс является биологически качественным, абсолютно безопасным строительным материалом.
Гипс кристаллизуется в моноклинной сингонии. Поэтому кристаллы имеют пластинчатый, а иногда столбчатый или игольчатый (волокнистый) облик.
Мы видим на рисунке, что связанные между собой ионы Са2+ и две анионные группы SO42- формируют двойные слои, окруженные молекулами воды. Таким образом ионы Са окружены двумя молекулами воды и шестью ионами кислорода группы SO4, и образуется спайность по плоскости симметрии, располагаясь как пластинки или столбики в блестящие каскады.
СВОЙСТВА ГИПСА
Согласно генетической классификации горных пород гипс относится к породам осадочного происхождения. Действительно, гипс образовался путем кристаллизации из перенасыщенной сульфатом кальция морской воды или как сульфидный продукт выветривания.
Действительно, гипс образовался путем кристаллизации из перенасыщенной сульфатом кальция морской воды или как сульфидный продукт выветривания.
Волокнистая разновидность гипса называется селенитом, а зернистая — алебастром. В природе встречаются также чешуйчатые породы гипса, самый знаменитый и ценный представитель которых «роза пустыни», стоимость некоторых экземпляров этого камня может достигать на аукционах сотни Евро.
Выдающиеся свойства и особенности гипса делают его важным минеральным строительным материалом, незаменимым для строительства современных зданий и сооружений.
По цвету кристаллы гипса различают от бесцветных и белых, до красноватых, желтоватых, бурых, голубых и серых тонов. Оттенок гипса зависит от примесей и включений, которые в небольшом количестве распределенные в гипсе не ухудшают свойства породы.
Гипсовые кристаллы при изломе характеризуются занозистым эффектом, а сама порода имеет стеклянный блеск.
Плотность гипса — 2300 кг/м3.
Твердость по минералогической шкале Мооса — 1,5 — 2. Согласно данной шкале тальк имеет твердость — 1, алмаз — 10.
ОГНЕЗАЩИТНЫЕ СВОЙСТВА ГИПСА
Помимо химически связанной (кристаллизационной) воды, гипс имеет и химически несвязанную (гигроскопическую) влагу
Она собирается на поверхности и в порах гипсового камня. Это же свойство сохраняется и в строительном гипсе, и в изделиях на его основе.
Как видно в разделе выше, в составе гипса содержится почти 21% воды. Поэтому материалы на основе гипса отличаются повышенными характеристиками в области огнезащиты и пожарной безопасности. Например, при нагревании гипсокартонного листа, толщиной 12 мм с 1 м2 поверхности испаряется 2,5 л кристаллизационной воды. Для подогрева и испарения этого количества воды нужно более 7 000 КДж теплоты. Пока вся вода не испарится, температура изделия не превысит 100-110°C!
СУХИЕ СМЕСИ
3 дня, 20% теории, 80% практики
Знакомство с номенклатурой штукатурок, шпаклевок, готовых составов и прочих материалов.
 Технология применения. Правильный выбор материала.
Технология применения. Правильный выбор материала.
Подробное описание программы
КНАУФ Россия в социальных сетях
Пройти обучение
Реакции обнаружения катионов III аналитической группы Общая характеристика группы
Гидроксиды бария,
кальция, стронция являются сильными
основаниями, и растворимые соли их,
образованные сильными кислотами,
гидролизу не подвергаются.
Хорошо растворимыми
солями этих катионов являются хлориды,
нитраты, ацетаты.
Карбонаты, сульфаты,
хроматы, оксалаты и фосфаты – трудно
растворимые.
Групповым реактивом
на катионы III группы является разбавленная
серная кислота.
Действие
группового реактива H2SO4
Разбавленная
серная кислота с катионами кальция,
бария, стронция образует белые осадки
сульфатов. Эти осадки практически
нерастворимы в воде, в щелочах и кислотах,
но значения их констант растворимости
сильно отличаются. Так, Ks
Так, Ks
(ВaSO4)
= 1·10‾10;
Ks
(CaSO4)
= 2,5·10‾5;
Ks
(SrSO4)
= 2,8·10‾7.
Из этого следует,
что при действии серной кислоты на
разбавленные растворы солей катионов
данной группы, бария сульфат выпадает
мгновенно, стронция сульфат – постепенно,
сульфат же кальция образуется только
при нагревании очень медленно, так как
произведение концентраций ионов кальция
и сульфат-ионов не достигает величины
константы растворимости кальция сульфата
(для понижения растворимости CaSO4
необходимо добавить ацетон или спирт).
BaCl2
+ H2SO4
→ BaSO4↓
+ 2 HCl
Ba2+
+ SO42‾
→ BaSO4↓
мелкокристаллический
SrCl2
+ H2SO4
→ SrSO4↓
+ 2 HCl
Sr2+
+ SO42‾
→ SrSO4↓
аморфный
ацетон
CaCl2
+ H2SO4
CaSO4↓
+ 2 HCl
Ca2+
+ SO42‾
→ CaSO4↓
кристаллический
В отличие от BaSO4
и SrSO4
растворимость кальция сульфата в
значительной степени повышается в
присутствии аммония сульфата. При этом
При этом
образуется очень неустойчивая комплексная
соль состава (NH4)2[Ca(SO4)2]:
CaSO4
+ (NH4)2SO4
→ (NH4)2[Ca(SO4)2]
Отсюда следует,
что если осаждение смеси катионов Ba2+,
Sr2+ и
Ca2+
производить не серной кислотой, а
избытком раствора (NH4)2SO4,
то осаждения ионов кальция не происходит,
однако при нагревании осадок CaSO4
образуется быстро.
Предел обнаружения
бария – 0,08 мкг, кальция – 1 мкг.
Так как сульфаты
бария, стронция не растворяются ни в
кислотах, ни в щелочах, а между тем
открытие (обнаружение) их ионов нужно
проводить из раствора, необходимо уметь
переводить сульфаты бария, стронция в
такие состояния, которые могут быть в
дальнейшем растворимы в кислоте. Этого
можно достигнуть, переводя сульфаты в
карбонаты.
ОПЫТ:
берут три пробирки; в одну из них добавляют
по 5 капель раствора соли бария, в другую
– соли кальция, в третью – соли стронция.
В каждую пробирку добавляют 1-2 капли 2
н. раствора серной кислоты. Наблюдают
образование осадков. Осадок
кальция сульфата выпадает только в
присутствии спирта или ацетона.
Перевод сульфатов
в карбонаты проводят следующим образом:
к осадку, например, бария сульфата
прибавляют насыщенный раствор натрия
карбоната и кипятят, затем центрифугируют
и центрифугат отбрасывают.
Такую обработку
проводят 5-8 раз. После этого осадок
растворяют в уксусной кислоте. Если
осадок растворяется почти полностью,
это говорит о том, что бария сульфат
переведен в карбонат.
t
BaSO4
+ (NH4)2CO3
(насыщ.)
→ BaCO3
↓+ (NH4)2SO4
BaSO4
+ CO32‾
→ BaCO3
+ SO42‾
Превращение BaSO4
в BaCO3
происходит, если выполняется условие:
РЕАКЦИИ катионов
БАРИЯ (Ba2+)
1. Калия дихромат
Калия дихромат
K2Cr2O7
образует с ионами бария осадок – хромат
бария BaCrO4
желтого цвета. Причиной того, что выпадает
не дихромат, а бария хромат, является
следующее: в растворе K2Cr2O7
наряду с ионами Cr2O72‾
образуются и ионы CrO42‾:
Cr2O72‾
+ H2O
↔ 2 HCrO4‾
↔ 2 H+
+ 2 CrO42‾
Концентрация ионов
CrO42‾
достаточна для того, чтобы Ks(BaCrO4)
оказывалась превышенной раньше, чем
достигается Ks(BaCr2O7).
Уравнение данной реакции приведено в
общем виде:
2 BaCl2
+ K2Cr2O7
+ H2O
→ 2 BaCrO4↓
+ 2 KCl + 2 HCl
2 Ba2+
+ Cr2O72‾
+
H2O
→ 2 BaCrO4↓
+ 2 H+
Желтый осадок
бария хромата растворим в минеральных
кислотах (кислотах HCl, HNO3),
но нерастворим в уксусной кислоте. Так
Так
как осадок BaCrO4
растворим в сильных кислотах (кроме
серной), а при образовании осадка
образуется сильная кислота (см. уравнение
реакции), то для полного осаждения нужно
заменить сильную соляную кислоту
уксусной. Для этого добавляют в раствор
ацетат натрия.
HCl +
CH3COONa
→ CH3COOH
+ NaCl
H+
+ CH3COO‾
→
CH3COOH
Уравнение реакции
осаждения калия дихроматом в этом случае
будет следующим:
2 BaCl2
+ K2Cr2O7
+ H2O
+ 2 CH3COONa
→
→ 2
BaCrO4↓
+ 2 KCl + 2 CH3COOH
+ 2 NaCl
2Ba2+
+ Cr2O72‾
+ H2O
+ 2CH3COO‾
→ 2BaCrO4↓
+ 2CH3COOH
Предел обнаружения
бария – 0,15 мг. Мешают открытию Ва2+
ртуть (I,
II),
серебро (I),
свинец (II),
висмут (III)
и железо (III),
т. к. образуют окрашенные хроматы. Ca
к. образуют окрашенные хроматы. Ca
(II)
и Sr
(II)
при рН < 7 не образуют осадков с K2Cr2O7
и не мешают обнаружению бария. Эту
реакцию используют и для отделения
бария от стронция и кальция.
ОпыТ:
К 2-3 каплям раствора соли бария добавляют
3-5 капель натрия ацетата и 1-2 капли калия
дихромата. Наблюдают образование осадка.
Для ускорения образования осадка
пробирку нагревают в водяной бане.
2. Аммония карбонат
(NH4)2CO3
с солями бария образует аморфный белый
осадок BaCO3,
который постепенно переходит в
кристаллический. Осадок бария карбоната
легко растворяется в соляной, азотной
и уксусной кислотах:
BaCl2
+ (NH4)2CO3
→ BaCO3↓
+ 2 NH4Cl
Ba2+
+ CO32‾
→ BaCO3↓
BaCO3
+ 2 CH3COOH
→ (CH3COO)2Ва
+ СО2↑
+ Н2О
BaCO3
+ 2 CH3COOH
→ 2 CH3COO‾
+ Ва2+
+ СО2↑
+ Н2О
BaCO3
+ 2 HCl
→ ВаCl2
+ СО2↑
+ Н2О
BaCO3
+ 2 H+
→ Ва2+
+ СО2
+ Н2О
ОПЫТ: К
2-3 каплям раствора соли бария добавляют
3-4 капли раствора (NH4)2CO3.
Наблюдают образование осадка. Осадок
делят на две пробирки: в одну добавляют
по каплям раствор уксусной кислоты, в
другую по каплям раствор соляной кислоты.
Наблюдают растворение осадка.
3. Аммония
оксалат (NH4)2C2O4
с ионами бария образует белый
кристаллический осадок бария оксалата
ВаC2O4,
растворимый в соляной и азотной и
нерастворимый в уксусной кислотах.
ВaCl2
+ (NH4)2C2O4
→ ВaC2O4↓
+ 2 NH4Cl
Вa2+
+ C2O42‾
→ ВaC2O4↓
BaC2O4
+ 2 HCl
→ ВаCl2
+ Н2С2О4
BaC2O4
+ 2 H+
→ Ва2+
+ Н2С2О4
ОПЫТ: К
2-3 каплям раствора соли бария добавляют
3-4 капли раствора (NH4)2C2O4.
Наблюдают образование осадка. Осадок
делят на две пробирки: в одну добавляют
по каплям раствор уксусной кислоты, в
другую по каплям раствор соляной кислоты.
Наблюдают растворение осадка в НCl.
4. Натрия
гидроортофосфат Na2HPO4
образует
с солями бария белый аморфный осадок
ВаHPO4,
растворимый в минеральных и уксусной
кислотах:
ВaCl2
+ Na2HPO4
→ ВаHPO4↓
+ 2 NаCl
Вa2+
+ HPO42‾
→ ВаHPO4↓
2 ВаHPO4
+ 2 CH3COOH
→ (CH3COO)2Ва
+ Ва(H2PO4)2
ВаHPO4
+ CH3COOH
→ CH3COO‾
+ Ва2+
+ H2PO4‾
ВаHPO4
+ 2 HCl → ВаCl2
+ H3PO4
ВаHPO4
+ 2 H+
→ Ва2+
+ H3PO4
ОПЫТ: К
2-3 каплям раствора соли бария добавляют
3-4 капли раствора Na2HPO4.
Наблюдают образование осадка. Осадок
делят на две пробирки: в одну добавляют
по каплям раствор уксусной кислоты, в
другую по каплям раствор соляной кислоты.
Наблюдают растворение осадка.
5. Насыщенный
раствор гипса CaSO4·2H2O
(гипсовая вода) образует с ионами Ва2+
белый мелкокристаллический осадок
бария сульфата, нерастворимый в
минеральных кислотах:
BaCl2
+ СаSO4
→ BaSO4↓
+ СаCl2
Ba2+
+ SO42‾
→ BaSO4↓
Реакция служит
для обнаружения Ва2+
только в
отсутствии Sr2+,
который с гипсовой водой дает аморфный
осадок стронция сульфата, появляющийся
не сразу, т.к. растворимость SrSO4
больше растворимости BaSO4
(Ks(SrSO4)
= 2,8·10‾7;
Ks(BaSO4)
= 1,1·10‾10).
ОПЫТ: К
2-3 каплям раствора соли бария добавляют
2-3 капли раствора гипсовой воды. Наблюдают
Наблюдают
мгновенное образование осадка.
РЕАКЦИИ КАТИОНОВ
КАЛЬЦИЯ (Cа2+)
1. Аммония карбонат
(NH4)2CO3
с солями кальция образует белый
кристаллический осадок СaCO3,
легко растворяющийся в соляной и уксусной
кислотах:
СaCl2
+ (NH4)2CO3
→ СaCO3↓
+ 2 NH4Cl
Сa2+
+ CO32‾
→ СaCO3↓
СaCO3
+ 2 CH3COOH
→ (CH3COO)2Са
+ СО2↑
+ Н2О
СaCO3
+ 2 CH3COOH
→ 2 CH3COO‾
+ Са2+
+ СО2
+ Н2О
СaCO3
+ 2 HCl
→ СаCl2
+ СО2↑
+ Н2О
СaCO3
+ 2 H+
→ Са2+
+ СО2
+ Н2О
ОПЫТ: К
2-3 каплям раствора соли кальция добавляют
3-4 капли раствора (NH4)2CO3.
Наблюдают образование осадка. Осадок
делят на две пробирки: в одну добавляют
по каплям раствор уксусной кислоты, в
другую по каплям раствор соляной кислоты.
Наблюдают растворение осадка.
2. Аммония оксалат
(NH4)2C2O4
с ионами кальция образует белый
кристаллический осадок кальция оксалата.
CaCl2
+ (NH4)2C2O4
→ CaC2O4↓
+ 2 NH4Cl
Ca2+
+ C2O42‾
→ CaC2O4↓
Осадок не растворяется
в уксусной кислоте, но растворяется в
минеральных кислотах (HCl, HNO3):
СaC2O4
+ 2 HCl
→ СаCl2
+ Н2С2О4
СaC2O4
+ 2 H+
→ Са2+
+ Н2С2О4
Предел обнаружения
кальция этой реакцией 20 мкг.
Ионы бария и
стронция дают с аммония оксалатом тоже
белый кристаллический осадок. Из этого
следует, что обнаружить ион кальция с
помощью оксалат-иона можно лишь в
отсутствии ионов бария и стронция.
Опыт:
К
2-3 каплям раствора соли кальция добавляют
2-3 капли раствора аммония оксалата.
Наблюдают образование осадка. Осадок
делят на две пробирки: в одну добавляют
по каплям раствор уксусной кислоты, в
другую по каплям раствор соляной кислоты.
Наблюдают растворение осадка в HCl.
3. Натрия
гидроортофосфат Na2HPO4
образует
с солями кальция белый аморфный осадок
СаHPO4,
растворимый в минеральных и уксусной
кислотах:
СaCl2
+ Na2HPO4
→ СаHPO4↓
+ 2 NаCl
Сa2+
+ HPO42‾
→ СаHPO4↓
2 СаHPO4
+ 2 CH3COOH
→ (CH3COO)2Са
+ Са(H2PO4)2
СаHPO4
+ CH3COOH
→ CH3COO‾
+ Са2+
+ H2PO4‾
СаHPO4
+ 2 HCl → СаCl2
+ H3PO4
СаHPO4
+ 2 H+
→ Са2+
+ H3PO4
ОПЫТ: К
2-3 каплям раствора соли кальция добавляют
3-4 капли раствора Na2HPO4.
Наблюдают образование осадка. Осадок
делят на две пробирки: в одну добавляют
по каплям раствор уксусной кислоты, в
другую по каплям раствор соляной кислоты.
Наблюдают растворение осадка.
4.
Калия гексацианоферрат (II) K4[Fе(CN)6]
в присутствии катионов аммония образует
при нагревании белый кристаллический
осадок двойной соли кальция-аммония
гексацианоферрата (II).
CaCl2
+ K4[Fe(CN)6]
+ 2 NH4Cl
→ Ca(NH4)2[Fe(CN)6]↓
+ 4 KCl
Ca2+
+ [Fe(CN)6]4‾
+ 2 NH4+
→ Ca(NH4)2[Fe(CN)6]↓
Однако указанная
реакция недостаточно чувствительна,
предел обнаружения кальция 50 мкг. Кроме
того, катионы бария (при их высокой
концентрации) и стронция с калия
гексацианоферратом (II) образуют
аналогичный осадок при условии их
длительного нагревания на кипящей бане.
Все катионы остальных аналитических
групп (за исключением первой) также
образуют осадки с этим реактивом. Поэтому
указанная реакция для обнаружения Ca2+
широкого применения в химическом анализе
не имеет.
Опыт:
К 3-5 каплям раствора соли кальция
добавляют по 3 капли растворов NH4Cl
и NH4OH,
затем приливают 5-6 капель раствора
K4[Fe(CN)6]
и нагревают до кипения. Наблюдают
образование осадка.
РЕАКЦИИ КАТИОНОВ
СТРОНЦИЯ (Sr2+)
1. Карбонат аммония
(NH4)2CO3
при взаимодействии с растворами солей
стронция осаждает карбонат стронция в
виде белого осадка, растворимого в
уксусной, соляной и азотной кислотах:
Sr(NO3)2
+ (NH4)2CO3
→ SrCO3↓
+ 2 NH4NO3
Sr2+
+ CO32‾
→ SrCO3↓
SrCO3
+ 2 CH3COOH
→ (CH3COO)2Sr
+ СО2↑
+ Н2О
SrCO3
+ 2 CH3COOH
→ 2 CH3COO‾
+ Sr2+
+ СО2
+ Н2О
SrCO3
+ 2 HCl
→ SrCl2
+ СО2↑
+ Н2О
SrCO3
+ 2 H+
→ Sr2+
+ СО2
+ Н2О
Опыт:
2-3 капли раствора соли стронция помещают
в пробирку и прибавляют 2-3 капли раствора
(NH4)2CO3.
Наблюдают образование осадка. Осадок
делят на две пробирки: в одну добавляют
по каплям раствор уксусной кислоты, в
другую по каплям раствор соляной кислоты.
Наблюдают растворение осадка.
2. Аммония оксалат
(NH4)2C2O4
с ионами стронция образует белый
мелкокристаллический осадок стронция
оксалата.
Sr(NO3)2
+ (NH4)2C2O4
→ SrC2O4↓
+ 2 NH4NO3
Sr2+
+ C2O42‾
→ SrC2O4↓
Осадок не растворяется
в уксусной кислоте, но растворяется в
минеральных кислотах (HCl, HNO3):
SrC2O4
+ 2 HCl
→ SrCl2
+ Н2С2О4
SrC2O4
+ 2 H+
→ Sr2+
+ Н2С2О4
Опыт:
К
2-3 каплям раствора соли стронция добавляют
2-3 капли раствора аммония оксалата.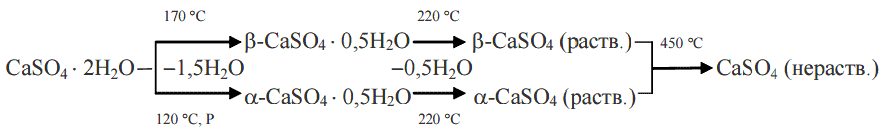
Наблюдают образование осадка. Осадок
делят на две пробирки: в одну добавляют
по каплям раствор уксусной кислоты, в
другую по каплям раствор соляной кислоты.
Наблюдают растворение осадка в HCl.
3. Насыщенный
раствор гипса CaSO4·2H2O
(гипсовая вода) образует с ионами Sr2+
белый осадок стронция сульфата:
Sr(NO3)2
+ СаSO4
→ SrSO4↓
+ Са(NO3)2
Sr2+
+ SO42‾
→ SrSO4↓
Однако при действии
гипсовой воды ион стронция дает не
обильный осадок, а только небольшую
муть, появляющуюся не сразу из-за
образования пересыщенного раствора.
Нагревание раствора ускоряет образование
осадка.
Реакция служит
для обнаружения Sr2+
только в отсутствии Ва2+,
который с гипсовой водой дает осадок
сульфата бария, появляющийся сразу,
т.к. растворимость BaSO4
меньше растворимости SrSO4
(Ks(SrSO4)
= 2,8·10‾7;
Ks(BaSO4)
= 1,1·10‾10).
Гипсовая вода не
образует осадков с растворами солей
кальция ни на холоду, ни при нагревании.
Этим ион Ca2+
отличается от ионов Ва2+
и Sr2+.
Опыт:
К 2-3 каплям раствора соли стронция
добавляют 2-3 капли раствора гипсовой
воды. Раствор нагревают на водяной бане
и наблюдают постепенное образование
осадка.
Химическая формула, свойства, типы, использование и часто задаваемые вопросы
В природе встречается множество минералов, и для студентов, изучающих химию, очень важно узнать об этих минералах, и гипс является одним из таких минералов. Следовательно, студентам-химикам необходимо как можно подробнее узнать о гипсе. Но в то же время учащиеся должны иметь доступ к объяснению темы гипса таким образом, чтобы они могли легко понять, в противном случае это не служит никакой цели, кроме как вызвать беспокойство у учащихся, что в конечном итоге может привести к тому, что учащиеся поверят, что тема гипса сложна для понимания и они не в состоянии это сделать.
Следовательно, чтобы помочь студентам-химикам изучить тему гипса, Vedantu предоставляет полное объяснение указанной темы на языке, который они могут легко понять, потому что это объяснение гипса подготовлено лучшими преподавателями, которые знают как эффективно донести тему до учащихся. Поэтому они подготовили это объяснение на доступном языке, чтобы у студентов не было проблем.
Кроме того, как было сказано, Веданту дает полное объяснение гипса, что означает, что он включает в себя все, что касается указанной темы, то есть значение гипса, его происхождение, места, где его можно найти, химическую формулу для гипс, различные виды гипса и многое другое. И если у студентов все еще есть какие-то сомнения, они могут найти их решение в разделе часто задаваемых вопросов (FAQ). И Vedantu предоставляет этот полный пакет Gypsum бесплатно всем студентам.
Обзор гипса
Гипс — это минерал, который включает в свою структуру ион сульфата, что делает его сульфатным минералом, и из всех сульфатных минералов гипс является наиболее распространенным. Гипс состоит из гидратированного сульфата кальция и имеет химическую формулу CaSO 4 .2H 2 O. Это природный солевой минерал, то есть эвапоритовый минерал, который в основном встречается вместе с галитом, серой, доломит, ангидрит и кальцит. Если мы посмотрим на химическую формулу гипса и ангидрита, мы увидим, что гипс очень похож на ангидрит, потому что, как уже упоминалось, химическая формула гипса CaSO 4 .2H 2 O, в то время как химическая формула ангидрита CaSO 4 , единственная разница между ними состоит в том, что ангидрит не содержит воды, а гипс содержит два стакана воды.
Гипс состоит из гидратированного сульфата кальция и имеет химическую формулу CaSO 4 .2H 2 O. Это природный солевой минерал, то есть эвапоритовый минерал, который в основном встречается вместе с галитом, серой, доломит, ангидрит и кальцит. Если мы посмотрим на химическую формулу гипса и ангидрита, мы увидим, что гипс очень похож на ангидрит, потому что, как уже упоминалось, химическая формула гипса CaSO 4 .2H 2 O, в то время как химическая формула ангидрита CaSO 4 , единственная разница между ними состоит в том, что ангидрит не содержит воды, а гипс содержит два стакана воды.
Гипс представляет собой встречающийся в природе минерал, состоящий из гидратированного сульфата кальция, имеющий мягкий белый или серый цвет. Он образуется в основном в слоистых осадочных отложениях и имеет множество применений во многих отраслях, таких как строительство, скульптура, садоводство и украшения. Это инертный и безопасный минерал, который существует уже миллионы лет, так как вы можете найти его также в египетских пирамидах. Это самый распространенный сульфатный минерал.
Это самый распространенный сульфатный минерал.
Гипс
Как было сказано ранее, гипс встречается вместе с другими минералами, такими как галит и ангидрит. Все это минералы эвапорита и, следовательно, гипс. Это означает, что гипс является осадочным отложением, то есть он откладывается под действием или работой ветра или воды, обычно на дне водоема. В частности, сульфат откладывается из природного рассола, который встречается в океане, за которым затем следуют ангидрит и галит.
В соленых озерах, то есть в соленых озерах и солончаках, что означает область, где вода испарилась, а соли и минералы остались (в этих минералах содержится сульфат). Когда подземные и поверхностные воды гидратируют ангидрит, он образует гипс, по сути, это одно из распространенных проявлений гипса. В широко рассеянном виде гипс может встречаться также в известняках и доломитовых известняках.
Месторождения гипса находятся во многих странах мира, но крупнейшими производителями гипса являются Испания, Соединенные Штаты Америки, Россия, Турция и Таиланд. Поскольку гипс растворяется в воде в течение определенного периода времени, только в редких случаях его можно найти в виде песка, и поэтому чаще всего он находится в кристаллической форме. Кристалл гипса длиной более 3 метров или почти 10 футов и диаметром 0,4 метра или почти 1,5 фута был найден в шахте Браден в Чили. Этот конкретный кристалл гипса является одним из самых больших кристаллов гипса, когда-либо найденных.
Поскольку гипс растворяется в воде в течение определенного периода времени, только в редких случаях его можно найти в виде песка, и поэтому чаще всего он находится в кристаллической форме. Кристалл гипса длиной более 3 метров или почти 10 футов и диаметром 0,4 метра или почти 1,5 фута был найден в шахте Браден в Чили. Этот конкретный кристалл гипса является одним из самых больших кристаллов гипса, когда-либо найденных.
Где добывают гипс?
Гигантские гипсы образуются под слоями осадочных пород вместе с галитом, ангидритом, серой, кальцитом и доломитом. Толстые пласты и слои горных пород являются обычным явлением для обнаружения гипса. Океанская вода богата кальцием и сульфатными минералами, поэтому гипс также встречается в лагунах, поскольку вода в океане может медленно испаряться и пополняться новыми источниками воды. Когда вода испаряется, минерал остается. Доказательства гипсовых дюн были обнаружены и на планете Марс.
Какова химическая формула гипса?
Основными компонентами гипса являются сульфат кальция (CaSO 4 ) и вода (H 2 O). Его химическое название — дигидрат сульфата кальция, а химическая формула гипса представлена как CaSO 4 .2H 2 O. Гипс и ангидрит (CaSO 4 ) очень похожи химически, только гипс имеет 2 молекулы воды, а ангидрит — нет. не содержат молекул воды.
Его химическое название — дигидрат сульфата кальция, а химическая формула гипса представлена как CaSO 4 .2H 2 O. Гипс и ангидрит (CaSO 4 ) очень похожи химически, только гипс имеет 2 молекулы воды, а ангидрит — нет. не содержат молекул воды.
Физические и химические свойства гипсового минерала
Гипс был известен как Камень Копья на древнеанглийском языке, так как он принимает кристаллоподобную форму, выступая из скалы наподобие копья. Вы можете смешать гипс с водой, чтобы получить его первоначальную каменную форму, и его можно затвердеть. Его цикл переработки можно назвать «замкнутым циклом переработки», поскольку вы можете перерабатывать его несколько раз, и он никогда не теряет своего качества. Он умеренно растворим в воде, и его растворимость снижается с повышением температуры, в отличие от поведения других солей. Вот некоторые из его важных химических и физических свойств:
Chemical Classification | Sulfate |
Chemical Composition | Hydrous Calcium Sulfate, CaSO 4 . |
Mohs твердость | 2 |
Удельный вес | 2.2 |
Colourless, red, brown, clear, yellow, white, grey | |
Diaphanous property | Transparent to translucent |
Texture | Silky, Sugary, Vitreous |
расщепление | Perfect |
Кристаллическая система | Моноклиновый |
0002 Диагностические свойства | Удельный вес, спайность, низкая твердость |
Различные виды гипса найденный. Он встречается примерно в 85 странах, а наибольшее количество гипса производится в Северной Америке.
 Гипс нашел свое применение в различных областях, на основании чего его можно разделить на следующие категории:
Гипс нашел свое применение в различных областях, на основании чего его можно разделить на следующие категории:
Камень тусклого цвета
Алебастр, его мелкозернистая разновидность
Гипсобетон или гипсовая корка, образующийся на почве твердый слой шелковистый блеск.
Типы гипсовых изделий:
Тип I – Оттискной гипс
Тип II – Стоматологический гипс, используемый в материале модели
Тип III – Стоматологический гипс, используемый в монтажном материале
Тип IV – Штамповочный гипс или гипс с высоким запасом прочности отливки из сплавов неблагородных металлов
Как перерабатывается гипс
Гипсовая порода сначала добывается или добывается в карьере, затем дробится и измельчается до мелкого порошка. Затем он проходит процесс, называемый прокаливанием, при котором к гипсовому порошку подводится тепло при температуре 350 градусов, что удаляет 3/4 молекул воды. Полугидрат — это название кальцинированного гипса, который затем используется в гипсокартоне, гипсовой штукатурке и других продуктах. Его выбор и подготовка (как и очистка) определяют качество производимой штукатурки. Химическую реакцию этого процесса можно представить в виде:
Затем он проходит процесс, называемый прокаливанием, при котором к гипсовому порошку подводится тепло при температуре 350 градусов, что удаляет 3/4 молекул воды. Полугидрат — это название кальцинированного гипса, который затем используется в гипсокартоне, гипсовой штукатурке и других продуктах. Его выбор и подготовка (как и очистка) определяют качество производимой штукатурки. Химическую реакцию этого процесса можно представить в виде:
(CaSO 4 , 2 H 2 O) + теплота = (CaSO 4 , ? H 2 O) + 1,5 H 2 O
3 Гипсы включают
Гипс используется в течение многих лет, потому что существует так много применений гипса, некоторые из которых приведены ниже: В стоматологических приспособлениях для изготовления слепков и слепков
Производственная штукатурка Парижа
Кондиционирование почвы
Утверждение в Cement
Ингредиент. , в качестве замедлителя твердения в портландцементе.
, в качестве замедлителя твердения в портландцементе.
Алебастр и атласный шпат — тип гипса, используемый в декоративных целях.
В сельском хозяйстве гипс используется в качестве удобрения, а также в качестве флюса, а в производстве бумаги и текстиля он используется в качестве наполнителя.
Гипс широко используется в качестве строительного материала, а фактически около трех четвертей всего производства гипса используется для этих целей.
Сколько воды содержится в обожженном гипсе?
(PhysOrg.com) — Гипс использовался в качестве строительного материала в древности и до сих пор широко используется в качестве связующего вещества для штукатурки, гипсокартона и шпаклевки. Известный в строительной химии как дигидрат, гипс представляет собой водосодержащий сульфат кальция (CaSO 4 • 2 H 2 O). В различных процессах обжига часть кристаллизационной воды удаляется, в результате чего получается обожженный гипс или полугидрат (CaSO 4 • 0,5 H 2 O). Когда этот материал вступает в контакт с водой, он снова впитывает ее и затвердевает. Структура и точное содержание воды в полугидрате остаются предметом предположений.
В различных процессах обжига часть кристаллизационной воды удаляется, в результате чего получается обожженный гипс или полугидрат (CaSO 4 • 0,5 H 2 O). Когда этот материал вступает в контакт с водой, он снова впитывает ее и затвердевает. Структура и точное содержание воды в полугидрате остаются предметом предположений.
Майкл Ф. Брау (BASF Construction Chemicals GmbH) и Хорст Вайс (BASF SE) положили конец этим предположениям: с помощью структурного анализа монокристалла они смогли решить структуру, создать структурную модель и поддержать это с помощью компьютерных расчетов. Как сообщается в журнале Angewandte Chemie, полугидрат действительно содержит ровно половину молекулы воды на структурную единицу, прочно связанную с каркасом из сульфата кальция.
Полугидрат является наиболее активно производимым неорганическим соединением в мире, поэтому его структура и содержание воды представляют большой интерес как с экономической, так и с научной точки зрения. Первая структурная модель этого соединения была предложена в 1933 г. и актуальна до сих пор. С тех пор появилось несколько усовершенствованных моделей, которые хорошо воспроизводят фундаментальный каркас из сульфата кальция. Однако всегда существовали разногласия по поводу того, принимают ли молекулы воды определенное расположение, и если да, то как оно выглядит.
Первая структурная модель этого соединения была предложена в 1933 г. и актуальна до сих пор. С тех пор появилось несколько усовершенствованных моделей, которые хорошо воспроизводят фундаментальный каркас из сульфата кальция. Однако всегда существовали разногласия по поводу того, принимают ли молекулы воды определенное расположение, и если да, то как оно выглядит.
Чтобы ответить на эти вопросы, необходимо провести структурный анализ, основанный на экспериментах по дифракции рентгеновских лучей, проведенных на монокристаллах нужного размера и качества. Атомы кристалла отклоняют входящие рентгеновские лучи; полученная характерная картина дифракции позволяет рассчитать положение отдельных атомов в кристалле. Однако этого было очень трудно достичь в случае кристаллов гипса. Bräu и Weiss добились успеха. Используя различные приемы, они смогли интерпретировать дифракционную картину и использовать свои компьютерные расчеты для объединения данных в правдоподобную структурную модель.
Выравнивание отдельных молекул воды и их расстояния друг от друга доказывают, что между ними нет взаимодействия; они связаны только с каркасом из сульфата кальция.

 2H 2 O
2H 2 O