Содержание
Гидроксид натрия — хим. свойства и получение
Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
1. Гидроксид натрия получают электролизом раствора хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
Na2O2 + H2O → 2NaOH + H2O2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
Качественная реакция на гидроксид натрия — окрашивание фенолфталеина в малиновый цвет.
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3NaOH + H3PO4 → Na3PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
NaOH + H3PO4 → NaH2PO4 + H2O
2. Гидроксид натрия реагирует с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2NaOH(избыток) + CO2 → Na2CO3 + H2O
NaOH + CO2 (избыток) → NaHCO3
3. Гидроксид натрия реагирует с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли:
2NaOH + Al2O3 → 2NaAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
При этом образуются средние соли, или менее кислые соли:
NaOH + NaHCO3 → Na2CO3 + H2O
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
2NaOH + Si + H2O → Na2SiO3 + H2
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
4NaOH + 2F2 → 4NaF + O2 (OF2) + 2H2O
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия:
3NaOH + P4 + 3H2O = 3NaH2PO2 + PH3↑
2NaOH(холодный) + Cl2 = NaClO + NaCl + H2O
6NaOH(горячий) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
Сера взаимодействует с гидроксидом натрия только при нагревании:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6. Гидроксид натрия взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
Гидроксид натрия взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2NaOH + Zn → Na2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксид натрия вступает в обменные реакции с растворимыми солями.
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с гидроксидом натрия взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксид натрия разлагается при нагревании до температуры 600°С:
Гидроксид натрия разлагается при нагревании до температуры 600°С:
2NaOH → Na2O + H2O
9. Гидроксид натрия проявляет свойства сильного основания. В воде практически полностью диссоциирует, образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na+ + OH—
10. Гидроксид натрия в расплаве подвергается электролизу. При этом на катоде восстанавливается натрий, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Понравилось это:
Нравится Загрузка…
Гидроксид натрия, характеристика, свойства и получение, химические реакции
Гидроксид натрия, характеристика, свойства и получение, химические реакции.

Поделиться в:
Гидроксид натрия – неорганическое вещество, имеет химическую формулу NaOH.
Краткая характеристика гидроксида натрия
Модификации гидроксида натрия
Физические свойства гидроксида натрия
Получение гидроксида натрия
Химические свойства гидроксида натрия
Химические реакции гидроксида натрия
Применение и использование гидроксида натрия
Краткая характеристика гидроксида натрия:
Гидроксид натрия – неорганическое вещество белого цвета.
Химическая формула гидроксида натрия NaOН.
Обладает высокой гигроскопичностью. На воздухе «расплывается», активно поглощая пары воды из воздуха.
Хорошо растворяется в воде, при этом выделяя большое количество тепловой энергии. Раствор едкого натра мылок на ощупь.
Гидроксид натрия – самая распространённая щёлочь. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
Гидроксид натрия – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Модификации гидроксида натрия:
До 299 оС гидроксид натрия имеет устойчивую ромбическую модификацию (a = 0,33994 нм, c = 1,1377 нм), выше 299 оС – моноклинную.
Физические свойства гидроксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | NaOН |
| Синонимы и названия иностранном языке | sodium hydroxide (англ.) едкий натр (рус.) натрия гидроокись (рус.) сода каустическая (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные ромбические кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | — |
Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм. ) ) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2130 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,13 |
| Температура кипения, °C | 1403 |
| Температура плавления, °C | 323 |
| Гигроскопичность | высокая гигроскопичность |
| Молярная масса, г/моль | 39,997 |
* Примечание:
— нет данных.
Получение гидроксида натрия:
Гидроксид натрия получается в результате следующих химических реакций:
- 1. из оксида натрия (т.н. пиролитический метод):
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия при температуре 1000 °C либо нагревания до 200 °C гидрокарбоната натрия в целях получения карбоната натрия:
Na2CO3 → Na2O + CO2 (t = 1000 oC),
2NaHCO3 → Na2CO3 + CO2 + H2O (t = 200 oC), после чего проводят первую химическую реакцию.
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
Na2O + H2O → 2NaOH.
- 2. путем взаимодействия раствора соды с гашеной известью (т.н. известковый метод, каустификация соды):
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH (t = 80 oC).
Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH.
- 3. ферритным методом:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2 (t = 1100-1200 oC).
Реакционную смесь спекают.
2NaFeO2 + (n+1)H2O → Fe2O3•nH2O + 2NaOH.
Реакция протекает медленно.
Fe2O3•nH2O выпадает в осадок, который после отделения его от раствора возвращается в процесс в первую реакцию.
- 4. электролизом:
2NaCl + 2H2O → 2Na2O + H2 + Cl2.
Одновременно получаются также водород и хлор.
Гидроксид натрия, водород и хлор вырабатываются тремя электрохимическими методами. Два из них – электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий – электролиз с жидким ртутным катодом (ртутный метод).
Химические свойства гидроксида натрия. Химические реакции гидроксида натрия:
Гидроксид натрия – химически активное вещество, сильное химическое основание.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4).
Химические свойства гидроксида натрия аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида натрия с серой:
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O (t = 50-60 °C).
В результате реакции образуются сульфид натрия, сульфит натрия и вода.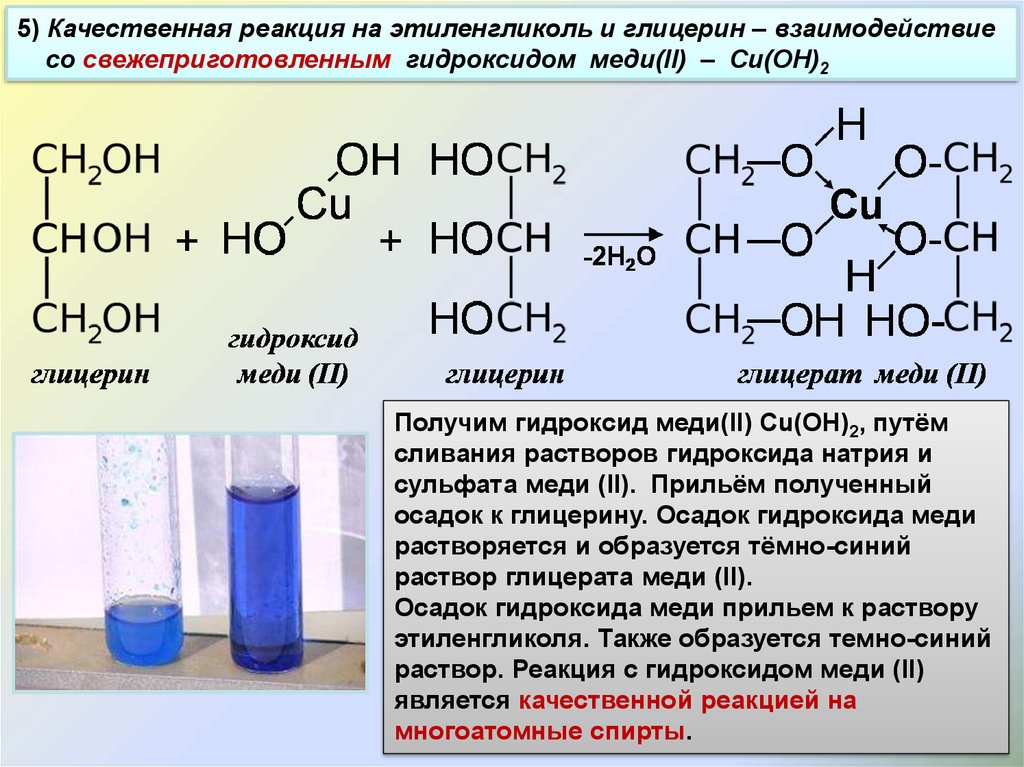 При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
2. реакция гидроксида натрия с хлором:
2NaOH + Cl2 → NaCl + NaClO + H2O.
В результате реакции образуются хлорид натрия, гипохлорит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде холодного разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими галогенами.
3. реакция гидроксида натрия с алюминием:
2Al + 6NaOH → 2NaAlO2 + 3H2 + 2Na2O (t = 450 °C).
В результате реакции образуются алюминат натрия, водород и оксид натрия.
4. реакция гидроксида натрия с алюминием и водой:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2.
В результате реакции образуются тетрагидроксоалюминат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
5. реакция гидроксида натрия с цинком:
Zn + 2NaOH → Na2ZnO2 + H2 (t = 550 °C).
В результате реакции образуются цинкат натрия и водород.
6. реакция гидроксида натрия с цинком и водой:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2.
В результате реакции образуются тетрагидроксоцинкат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
7. реакция гидроксида натрия с ортофосфорной кислотой:
H3PO4 + NaOH → NaH2PO4 + H2O.
В результате реакции образуются дигидроортофосфат натрия и вода.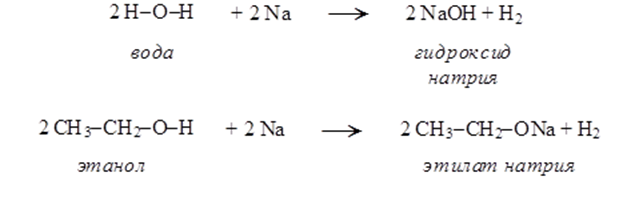 При этом в качестве исходных веществ используются: фосфорная кислота в виде концентрированного раствора, гидроксид натрия в виде разбавленного раствора.
При этом в качестве исходных веществ используются: фосфорная кислота в виде концентрированного раствора, гидроксид натрия в виде разбавленного раствора.
8. реакция гидроксида натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O.
В результате реакции образуются нитрат натрия и вода. При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
9. реакция гидроксида натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O.
В результате реакции образуются нитрат натрия и вода. При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими кислотами.
10. реакция гидроксида натрия с сероводородом:
H2S + 2NaOH → Na2S + 2H2O,
H2S + NaOH → NaHS + H2O.
В результате реакции образуются в первом случае – сульфид натрия и вода, во втором – гидросульфид натрия и вода. При этом гидроксид натрия в первом случае в качестве исходного вещества используется в виде концентрированного раствора, во втором случае – в виде разбавленного раствора.
11. реакция гидроксида натрия с фтороводородом:
HF + NaOH → NaF + H2O,
2HF + NaOH → NaHF2 + H2O.
В результате реакции образуются в первом случае – фторид натрия и вода, во втором – гидрофторид натрия и вода. При этом гидроксид натрия и фтороводород в первом случае в качестве исходного вещества используются в виде разбавленного раствора, во втором случае фтороводород используется в виде в виде концентрированного раствора.
12. реакция гидроксида натрия с бромоводородом:
HBr + NaOH → NaBr + H2O.
В результате реакции образуются бромид натрия и вода. При этом гидроксид натрия и бромоводород в качестве исходного вещества используются в виде разбавленного раствора.
13. реакция гидроксида натрия с йодоводородом:
HI + NaOH → NaI + H2O.
В результате реакции образуются йодид натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
14. реакция гидроксида натрия с оксидом цинка:
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 °C).
Оксид цинка является амфотерным оксидом. В результате реакции образуются цинкат натрия и вода.
15. реакция гидроксида натрия с оксидом цинка и водой:
ZnO + NaOH + H2O → Na[Zn(OH)3] (t = 100 °C),
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (t = 90 °C).
Оксид цинка является амфотерным оксидом. В результате реакции образуется в первом случае – тригидроксоцинкат натрия и вода, во втором случае – тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в первом случае в виде 40 % разбавленного раствора, во втором – в виде 60 % разбавленного раствора.
16. реакция гидроксида натрия с оксидом алюминия:
Al2O3 + 2NaOH → 2NaAlO2 + H2O (t = 900-1100 °C).
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат натрия и вода.
17. реакция гидроксида натрия с оксидом алюминия и водой:
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6],
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4].
Оксид алюминия является амфотерным оксидом. В результате реакции образуется в первом случае – гексагидроксоалюминат натрия, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного горячего раствора.
18. реакция гидроксида натрия с оксидом железа:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O (t = 600 °C, р).
Оксид железа является амфотерным оксидом. В результате реакции образуются феррит натрия и вода. Реакция происходит при сплавлении исходных веществ.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными оксидами.
19. реакция гидроксида натрия с оксидом углерода (углекислым газом):
NaOH + CO2 → NaHCO3.
В результате реакции образуется гидрокарбонат натрия.
20. реакция гидроксида натрия с оксидом серы:
SO2 + NaOH → NaHSO3.
В результате реакции образуется гидросульфит натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
21. реакция гидроксида натрия с оксидом кремния:
2NaOH + SiO2 → Na2SiO3 + H2O (t = 900-1000 °C),
4NaOH + SiO2 → Na4SiO4 + 2H2O.
В результате реакции образуется в первом случае – силикат натрия и вода, во втором случае – ортосиликат натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
22. реакция гидроксида натрия с гидроксидом алюминия:
Al(OH)3 + NaOH → NaAlO2 + 2H2O (t = 1000 °C),
Al(OH)3 + NaOH → Na[Al(OH)4].
Гидроксид алюминия является амфотерным основанием. В результате реакции образуются в первом случае – алюминат натрия и вода, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
23. реакция гидроксида натрия с гидроксидом цинка:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4].
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
24. реакция гидроксида натрия с гидроксидом железа:
Fe(OH)3 + 3NaOH ⇄ Na3[Fe(OH)6].
Гидроксид железа является амфотерным основанием. В результате реакции образуется гексагидроксоферрат натрия.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными гидроксидами.
25. реакция гидроксида натрия с сульфатом железа:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 (kat = N2).
В результате реакции образуются гидроксид железа и сульфат натрия.
26. реакция гидроксида натрия с хлоридом меди:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl.
В результате реакции образуются гидроксид меди и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
27. реакция гидроксида натрия с нитратом свинца:
Pb(NO3)2 + 2NaOH → Pb(OH)2 + 2NaNO3.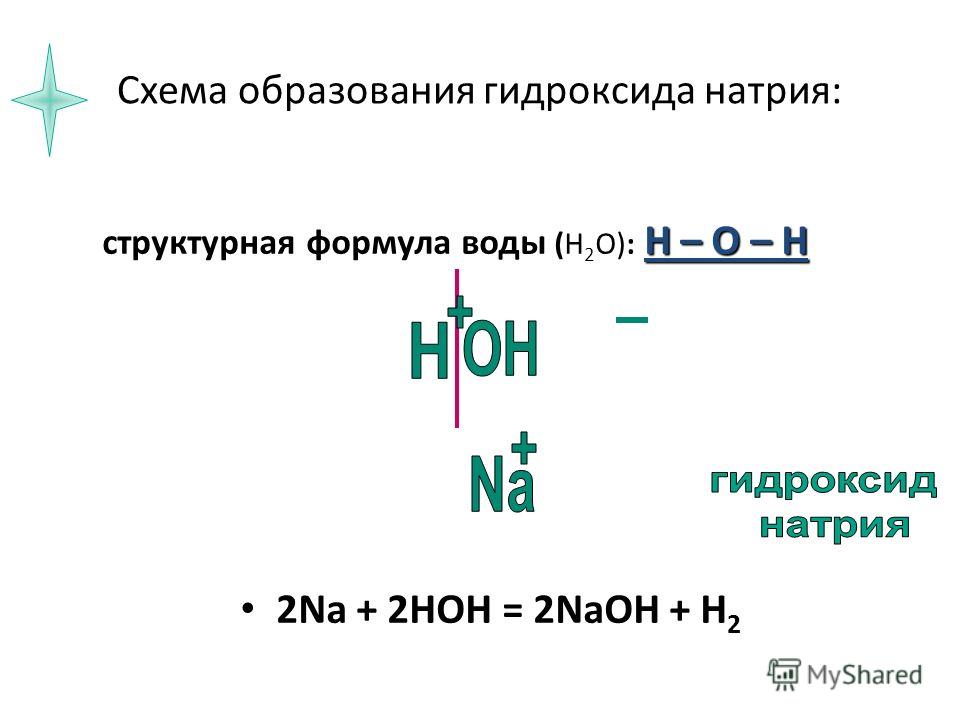
В результате реакции образуются гидроксид свинца и нитрат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
28. реакция гидроксида натрия с хлоридом алюминия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl.
В результате реакции образуются гидроксид алюминия и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими солями.
Применение и использование гидроксида натрия:
Гидроксид натрия используется во множестве отраслей промышленности и для бытовых нужд:
– в целлюлозно-бумажной промышленности для делигнификации(сульфатный процесс) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит;
– для омыления жиров при производстве мыла, шампуня и других моющих средств;
– в химических отраслях промышленности – для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке – для производства масел;
– для изготовления биодизельного топлива – получаемого из растительных масел и используемого для замены обычного дизельного топлива.
Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9:1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число – условная количественная характеристика самовоспламеняемости дизельныхтоплив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьём для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин который используется в пищевой, косметической и бумажной промышленности;
– в качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей. Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе;
Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе;
– в текстильной промышленности – для мерсеризации хлопка и шерсти. При кратковременной обработке едким натром с последующей промывкой волокно приобретает прочность и шелковистый блеск;
– в приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E-524;
– в фотографии – как ускоряющее вещество в проявителях для высокоскоростной обработки фотографических материалов.
Примечание: © Фото //www.pexels.com, //pixabay.com
Коэффициент востребованности
13 766
Эффект концентрации NaOH с помощью h3O
••• Изображение тестового набора Cinneman с сайта Fotolia.com
Обновлено 24 апреля 2017 г.
Автор John Brennan соединения, называемые основаниями. Также известный как щелочь, он находит широкое применение в химических лабораториях, химической промышленности и строительстве, среди прочего. При увеличении концентрации гидроксида натрия в воде могут возникать следующие четыре эффекта.
Также известный как щелочь, он находит широкое применение в химических лабораториях, химической промышленности и строительстве, среди прочего. При увеличении концентрации гидроксида натрия в воде могут возникать следующие четыре эффекта.
Гидроксид-ионы
Когда NaOH растворяется в воде, он диссоциирует на два иона: положительно заряженный ион натрия и отрицательно заряженный гидроксид-ион (ОН-). Увеличение количества гидроксид-ионов в растворе увеличивает концентрацию гидроксид-ионов в воде.
pH
Вода может вступать в реакцию, называемую аутопротолизом, при которой одна молекула воды отдает протон (ион водорода) другой молекуле, что приводит к образованию иона гидроксида (OH-) и иона гидроксония (h4O+). Эта реакция также может быть обращена вспять, поскольку ионы гидроксида принимают атом водорода от ионов гидроксония с образованием молекулы воды. В чистой воде эта двусторонняя реакция находится в равновесии, поэтому концентрации гидроксида и ионов гидроксония в воде равны. Отрицательный логарифм концентрации ионов водорода называется pH; чистая вода имеет рН 7. Ионы гидроксида из растворенного гидроксида натрия нарушают этот баланс; поскольку дополнительные гидроксиды принимают протоны от ионов гидроксония, они снижают концентрацию ионов водорода, тем самым увеличивая рН. Добавление большего количества гидроксида натрия повысит pH воды или сделает ее более щелочной.
Отрицательный логарифм концентрации ионов водорода называется pH; чистая вода имеет рН 7. Ионы гидроксида из растворенного гидроксида натрия нарушают этот баланс; поскольку дополнительные гидроксиды принимают протоны от ионов гидроксония, они снижают концентрацию ионов водорода, тем самым увеличивая рН. Добавление большего количества гидроксида натрия повысит pH воды или сделает ее более щелочной.
Нейтрализация
Основание, такое как гидроксид натрия, может реагировать с кислотой, чтобы нейтрализовать ее. В этом типе реакции ион гидроксида примет протон от кислоты с образованием молекулы воды (h3O). Добавление гидроксида натрия к раствору кислоты может нейтрализовать часть кислоты в воде.
Буферизация
Буфер представляет собой раствор, рН которого мало изменяется при добавлении кислоты или основания. Концентрированный раствор гидроксида натрия действует как буфер (хотя и очень щелочной), так как добавление небольших количеств не приведет к значительному изменению рН — кислота будет реагировать только с гидроксидом натрия, который уже присутствовал в воде, и рН будет меняться. существенно не изменится, так как pH представляет собой логарифмическую шкалу.
существенно не изменится, так как pH представляет собой логарифмическую шкалу.
Связанные статьи
Ссылки
- «Химические принципы, поиск знаний, 4-е издание»; Питер Аткинс и Лоретта Джонс; 2008.
- Химическая оценочная таблица: гидроксид натрия
Об авторе
Джон Бреннан живет в Сан-Диего и пишет о науке и окружающей среде с 2006 года. Его статьи публиковались в журналах Plenty, San Diego Reader, «Санта-Барбара Индепендент» и «East Bay Monthly». Бреннан имеет степень бакалавра биологических наук Калифорнийского университета в Сан-Диего.
Photo Credits
Test Kit image by Cinneman from Fotolia.com
Гидроксид натрия — Sciencemadness Wiki
Гидроксид натрия , иногда называемый едким натром , представляет собой сильноосновное неорганическое соединение с химической формулой 9 004 904 NaOH Это гигроскопичное белое твердое вещество, которое можно использовать в различных целях, например, в реакциях двойного замещения с образованием гидроксидов или оксидов металлов.
Содержание
- 1 Свойства
- 1.1 Физический
- 1.2 Химическая
- 2 Подготовка и приобретение
- 3 варианта использования
- 4 Обращение
- 4.1 Безопасность
- 4.2 Хранение
- 4.3 Утилизация
- 5 Каталожные номера
- 5.1 Соответствующие темы Sciencemadness
Свойства
Физические свойства
Гидроксид натрия представляет собой гигроскопичное белое твердое вещество без запаха. Из-за своей гигроскопической природы гидроксид натрия легко поглощает из воздуха достаточно воды, чтобы раствориться; по этой причине образцы трудно точно взвесить в сухом виде, и для более точного химического анализа часто используются стандартизированные растворы. Растворение гидроксида натрия в воде очень экзотермическое; стеклянная посуда более низкого качества может даже разбиться от термического напряжения, если эта реакция протекает слишком быстро. Гидроксид натрия растворим в воде, метаноле, этаноле, глицерине, но нерастворим в большинстве эфиров. Спиртовые растворы гидроксида натрия окисляются на воздухе, приобретая коричневый цвет.
Гидроксид натрия растворим в воде, метаноле, этаноле, глицерине, но нерастворим в большинстве эфиров. Спиртовые растворы гидроксида натрия окисляются на воздухе, приобретая коричневый цвет.
Химический
Концентрированные растворы гидроксида натрия также обладают уникальным свойством быть одним из немногих веществ, которые могут растворять стекло, и даже разбавленные растворы будут делать это в течение длительного времени. Расплавленный гидроксид натрия гораздо мощнее и быстрее растворяет стекло, образуя силикат натрия.
- 2 NaOH + SiO 2 → Na 2 SiO 3 + H 2 O
По этой причине гидроксид натрия следует хранить только в толстых пластиковых контейнерах.
Гидроксид натрия также уникален среди основных соединений тем, что он энергично реагирует с амфотерными металлами, включая алюминий и некоторые переходные металлы, выделяя при реакции большое количество газообразного водорода и тепла.
- 2 NaOH + 2 Al → 2 NaAlO 2 + H 2
Гидроксид натрия не разрушает магний или другие неблагородные металлы.
Гипохлорит натрия, который недоступен в заметных концентрациях во многих странах, может быть получен путем направления газообразного хлора в водный раствор гидроксида натрия с образованием достаточно сильного и чистого раствора для получения хлороформа или хлората калия.
- 2 NaOH + Cl 2 → 2 NaClO + H 2 O
В процессе, известном как омыление, который используется в мыловарении, гидроксид натрия может гидролизовать органические сложные эфиры, такие как те, которые встречаются в природных растениях или животные жиры с образованием солей жирных кислот и глицерина.
- 3 NaOH + ((CH 2 ) N COO) 3 CH 2 CHCH 2 → 3 (CH 2 ) N COONA + OH-Ch 2 ). ОН)-СН 2 OH
Гидроксид натрия имеет тенденцию поглощать кислые пары и/или углекислый газ из воздуха с образованием соли поглощенной кислоты или, в случае двуокиси углерода, карбоната натрия, если оставить его на некоторое время, особенно в растворе. При хранении с другой кислотой образуется натриевая соль. Хотя бикарбонат натрия обычно рассматривается как основание, если он присутствует в растворе с гидроксидом натрия, он будет действовать как кислота, нейтрализуя ее с образованием карбоната натрия.
При хранении с другой кислотой образуется натриевая соль. Хотя бикарбонат натрия обычно рассматривается как основание, если он присутствует в растворе с гидроксидом натрия, он будет действовать как кислота, нейтрализуя ее с образованием карбоната натрия.
- 2 NaOH + CO 2 → Na 2 CO 3 + H 2 O
При загрязнении воздуха также могут образовываться сульфит/сульфат кальция и нитрат кальция.
Гидроксид натрия и иногда другие сильные основания используются для очистки таких газов, как хлороводород/фторид/бромид, сероводород, диоксид азота (но не оксид азота) или оксиды серы. Это делается путем пропускания этих газов в раствор гидроксида натрия, эффективно нейтрализуя их и позволяя проводить некоторые синтезы в помещении и вне вытяжного шкафа при правильной настройке. При работе с большим количеством вредных газов может потребоваться несколько скрубберов.
Расплавленный гидроксид натрия чрезвычайно агрессивен. Он имеет тенденцию вступать в реакцию почти со всеми металлами, за исключением некоторых, таких как медь, никель и сплавы, такие как нержавеющая сталь, хотя присутствие воздуха и влаги может увеличить скорость коррозии. Оксид магния и диоксид тория — единственные немногие оксиды металлов, на которые не действует расплавленная щелочь. Расплавленный гидроксид натрия окисляет платину и вступает в реакцию с золотом, образуя сплав натрия и золота.
Он имеет тенденцию вступать в реакцию почти со всеми металлами, за исключением некоторых, таких как медь, никель и сплавы, такие как нержавеющая сталь, хотя присутствие воздуха и влаги может увеличить скорость коррозии. Оксид магния и диоксид тория — единственные немногие оксиды металлов, на которые не действует расплавленная щелочь. Расплавленный гидроксид натрия окисляет платину и вступает в реакцию с золотом, образуя сплав натрия и золота.
Расплавленный гидроксид натрия — один из немногих реагентов, быстро растворяющих стекло, образуя силикат натрия. Он также растворяет многие другие оксиды металлов с образованием анионов оксидов металлов, таких как силикаты, ферраты, алюминаты.
Подготовка и приобретение
Гидроксид натрия может быть получен с помощью хлорно-щелочного процесса, электролизной установки, в которой раствор хлорида натрия подвергается электролизу в катодной половине мембранной ячейки с образованием газообразных хлора и водорода, в то время как образуются ионы Na + в растворе, проходящем через мембрану, где они восстанавливаются с образованием гидроксида натрия. Поскольку в этом процессе также образуется хлор, продукт, вероятно, будет загрязнен различными количествами гипохлорита натрия.
Поскольку в этом процессе также образуется хлор, продукт, вероятно, будет загрязнен различными количествами гипохлорита натрия.
В качестве альтернативы, гидроксид натрия часто можно купить в хозяйственных магазинах в виде средства для чистки канализации; однако любые другие агенты часто трудно удалить из средств для чистки канализации, которые не являются на 100% едким щелоком, поскольку они часто предназначены для реакции с гидроксидом натрия в процессе очистки канализации. Однако многие формулы содержат разные реагенты в виде частиц разного размера, например, гидроксид натрия в виде крупных гранул или хлопьев и алюминий в виде мелкого порошка; такие смеси легко отделить с помощью сит. Другие типы каустической соды, как правило, содержат ~ 10% хлорида натрия. Однако самый дешевый доступный гидроксид натрия обычно можно купить в Интернете у таких поставщиков, как Duda Diesel (3 доллара за фунт). В некоторых хозяйственных магазинах продаются очень чистые гранулы или хлопья гидроксида натрия, обычно дешевые. Однако брендовые продукты, содержащие хлопья гидроксида натрия, как правило, дороже по весу, чем каустическая сода, купленная в большинстве хозяйственных магазинов.
Однако брендовые продукты, содержащие хлопья гидроксида натрия, как правило, дороже по весу, чем каустическая сода, купленная в большинстве хозяйственных магазинов.
Из-за типичной высокой стоимости гидроксида натрия в хозяйственных магазинах во многих местах лучше синтезировать его из гидроксида кальция и карбоната натрия, если такие материалы доступны. Этот метод требует получения насыщенного раствора гидроксида кальция и добавления стехиометрического количества карбоната натрия, осаждающего карбонат кальция в процессе.
- Na 2 CO 3 + Ca(OH) 2 → CaCO 3 + 2 NaOH
После кипячения или выпаривания почти до сухого состояния, что нельзя делать в стеклянной посуде из-за разрушительного действия растворов гидроксида натрия, гидроксид натрия можно очистить путем декантации концентрированного раствора в этанол или метанол, осаждая любой оставшийся кальций. гидроксид. Если требуется очень чистый гидроксид натрия, рекомендуется использовать в начальной реакции немного меньшее количество карбоната натрия, чем требуется.
Применение
Одним из наиболее распространенных применений гидроксида натрия во вводной химии является использование сильного основания для кислотно-щелочного титрования; если стандартный раствор готовят из известного количества едкого натра, то для определения концентрации раствора кислоты можно использовать титрование. Гидроксид натрия также является удобной основой для получения других солей натрия из кислот, поскольку при нейтрализации он не выделяет никаких газов. Производство многих оксидов и гидроксидов металлов можно осуществить путем смешивания растворов гидроксида натрия и растворимых солей металлов. Наконец, металлический натрий можно получить из гидроксида натрия двумя способами. В первом горячий расплавленный гидроксид натрия подвергается электролизу, в результате чего на электроды осаждается натрий. Во втором случае смесь мелкодисперсного сухого гидроксида натрия смешивают с порошком магния и поджигают в термитоподобной реакции. Чаще всего гидроксид натрия используется в мыловарении.
Обращение
Безопасность
Гидроксид натрия, как и другие сильные основания, сильно разъедает кожу и плоть. Поэтому с ним следует обращаться осторожно, а меры безопасности следует планировать заранее. Нейтрализация слабой кислотой и упорное умывание горячей водой следует проводить до тех пор, пока кожа не перестанет быть скользкой.
Температура плавления гидроксида натрия (318°C) не так высока, поэтому любое открытое пламя и некоторые горячие плиты способны расплавить твердое вещество. Расплавленный гидроксид натрия чрезвычайно опасен. Он растворяет стекло, бурно реагирует с алюминием, разъедает сталь и с легкостью проедает плоть. Брызги расплавленного гидроксида могут вызвать ужасные раны, поэтому при работе с расплавленным материалом необходимо принять соответствующие меры безопасности, такие как лицевой щиток и лабораторный халат.
Хранение
Гранулы или хлопья гидроксида натрия следует хранить в толстых пластиковых контейнерах или контейнерах из нержавеющей стали, если это возможно, и закрывать, чтобы они не поглощали воду, двуокись углерода и другие газы из окружающего воздуха. НИКОГДА не храните гидроксид натрия в алюминиевых контейнерах, так как он вступает с ним в реакцию, а также в обычных стальных контейнерах, так как они будут ржаветь, и хотя не все сорта подвергаются полной коррозии, он загрязняет гидроксид.
НИКОГДА не храните гидроксид натрия в алюминиевых контейнерах, так как он вступает с ним в реакцию, а также в обычных стальных контейнерах, так как они будут ржаветь, и хотя не все сорта подвергаются полной коррозии, он загрязняет гидроксид.
Растворы гидроксида натрия следует хранить только в стеклянных бутылях в течение определенного периода времени, так как он поглощает углекислый газ или сернистые газы из воздуха и в конечном итоге нейтрализует себя. Они также будут медленно атаковать стекло. Растворы гидроксида натрия будут медленно расползать карбонат натрия из сосуда, если они находятся в контакте с воздухом, а открытые контейнеры могут быть полностью покрыты через несколько месяцев. Даже закрытые бутылки будут образовывать некоторое количество карбоната натрия, так как очень трудно сделать бутылку герметичной. Таким образом, водные растворы NaOH не следует хранить более нескольких месяцев.
Утилизация
Гидроксид натрия можно нейтрализовать любой кислотой, хотя использование слабой кислоты, такой как уксус или лимонная кислота, более экономично.
