Администрация Заринского района Алтайского края
Газированная вода – это вода, насыщенная углекислым газом, в народе ее называют просто газировкой.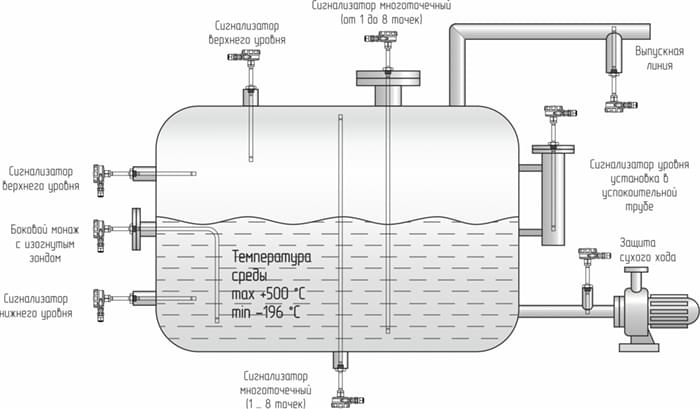 Многие из нас предпочитают именно газировку для утоления жажды, поскольку она обладает приятным вкусом, а также условным прохладительным эффектом. Причем многие предпочитают не минеральную, а сладкую. Не смотря на тот факт, что многочисленные исследования постоянно подтверждают вред, который приносит потребление сладких газированных напитков, взрослые нередко пьют ее сами и еще чаще покупают своим детям. Итак, если вы или ваши дети регулярно употребляют такие напитки, возможно, пришло время остановиться, оценить потенциальные риски и взглянуть, наконец, в глаза суровой правде о сладкой газировке.
Многие из нас предпочитают именно газировку для утоления жажды, поскольку она обладает приятным вкусом, а также условным прохладительным эффектом. Причем многие предпочитают не минеральную, а сладкую. Не смотря на тот факт, что многочисленные исследования постоянно подтверждают вред, который приносит потребление сладких газированных напитков, взрослые нередко пьют ее сами и еще чаще покупают своим детям. Итак, если вы или ваши дети регулярно употребляют такие напитки, возможно, пришло время остановиться, оценить потенциальные риски и взглянуть, наконец, в глаза суровой правде о сладкой газировке.
Что входит в состав газировки?
Состав всех газированных напитков, представленных сегодня в наших супермаркетах и магазинах, примерно одинаковый, и основной их компонент – вода и углекислый газ. Углекислый газ в составе минеральной воды нужен для того, чтобы сохранить ее свойства и придать ей стойкость к бактериям, при этом углекислый газ считается наименее вредным консервантом. Но к сладкой газировке производители в целях экономической выгоды добавляют различные компоненты, которые не утоляют жажду и не восполняют нехватку жидкости в организме, а только усиливают желание попить. К ним относятся: сахар или подсластители; консерванты и пищевые кислоты, которые продлевают срок годности товара; красители, усилители вкуса и ароматизаторы; иногда кофеин.
Но к сладкой газировке производители в целях экономической выгоды добавляют различные компоненты, которые не утоляют жажду и не восполняют нехватку жидкости в организме, а только усиливают желание попить. К ним относятся: сахар или подсластители; консерванты и пищевые кислоты, которые продлевают срок годности товара; красители, усилители вкуса и ароматизаторы; иногда кофеин.
Углекислый газ. В любой газированной воде есть углекислый газ. Газированная вода лучше утоляет жажду, отличается своеобразным приятным вкусом, освежающими свойствами и вызывает приятные ощущения во рту за счет механического воздействия пузырьков. Сам по себе углекислый газ безопасен, но его присутствие в воде возбуждает желудочную секрецию, повышает кислотность желудочного сока и провоцирует метеоризм — обильное выделение газов, может спровоцировать гастрит, гастродуоденит, язвенную болезнь желудка или двенадцатиперстной кишки. Перед употреблением любой газированной воды в том числе и минеральной, газ из бутылки необходимо выпускать путем встряхивания.
Сахар – это легкоусвояемый углевод, опасность которого для здоровья заключается в его количестве – 1 стакан сладкого лимонада содержит до 5 столовых ложек сахара! А если учесть, что в течении дня можно выпить не один литр такой жидкости, то в итоге получается серьезная цифра. Конечно, кто-то может сказать, что сахар – это же глюкоза, которая повышает умственную деятельность, работоспособность и является источником энергии, не понимая, что он быстро превращается в жир и оседает на боках, бедрах и животе. К тому же сахар вызывает кариес, заболевания органов сердечно-сосудистой системы и даже развитие атеросклероза. А большое количество глюкозы в крови приводит к повышенной выработке гормона инсулин, который ответственный за ее переработку, к нарушению функциональности поджелудочной железы и провоцирует развитие сахарного диабета и ожирения.
Подсластители и сахарозаменители: ксилит, сорбитол, сахарин, цикломат, аспартам.
В газированных напитках чаще всего используют аспартам (Е951). Аспартам при температуре выше 30°С распадается на метанол, формальдегид, муравьиную кислоту – сильные канцерогены, которые провоцируют возникновение: злокачественных образований, склероз, эпилепсию, базедову болезнь, «хроническую усталость», диабет, умственную отсталость, туберкулез, потерю зрения. Признаком наличия аспартама является предупреждение: «содержит фенилаланин».
Ксилит, который у всех на слуху благодаря рекламе жевательной резинки, является опасным веществом для образования камней в почках.
Сорбитол Е420 и аспартам Е951 никак не воздействуют на почки или печень. Они просто ослабляют сетчатку глаз и человек постепенно теряет зрение.
Сахарин (из толуола) и цикламат в 40 раз слаще сахара и в 80 раз его опаснее в силу того, что являются канцерогенами. Накопившись в организме, становятся возбудителями раковых опухолей.
Помимо этого у большого процента людей появляется аллергия на эти компоненты – от небольшого зуда на коже до отека Квинке.
Кислоты и консерванты. При производстве лимонадов и сладких напитков принято использовать лимонную и ортофосфорную кислоты (Е330 и Е338 соответственно), которые выступают в качестве консервантов и усилителей вкуса, помогая производителям воссоздавать вкусы, идентичные натуральным. Но Е338 в сладком напитке после употребления вымывает кальций, что вызывает нарушения в здоровье и развитие даже у молодых людей остеопороза. А при регулярном поступлении лимонной кислоты Е330 растворяется эмаль зубов, что приводит к развитию кариеса. Кроме того она вызывает гастрит, мочекаменную болезнь и почечные колики. Внимание! Самым опасным осложнением из-за приема лимонада в больших количествах считается разрушение кальция, что приводит к хрупкости костей и их длительному срастанию. Порой недостача кальция приводит к инвалидности. Для длительного срока годности напитка и сохранения вкуса лимонада используется бензоат натрия (Е211), который превращается в токсичный бензол. Этот элемент приводит к мутациям в клетках и увеличивает риск возникновения онкологического заболевания.
Красители — вещества, придающие напитку новый цвет или скрывающие его природный оттенок, поэтому используют в напитках исключительно в психологических целях. Красители бывают натуральными и искусственными. Наиболее распространенным из натуральных красителей является сахарный колер E-150 (жженый сахар). Но чаще используют синтетические красители: их ассортимент гораздо шире, а себестоимость гораздо ниже. Опасны азотсодержащие, они могут вызывать приступы удушья и крапивницу у больных бронхиальной астмой. Красный краситель (Е128) в организме превращается в анилин. Это вещество может вызывать рак и генетические изменения в клетках организма.
Ароматизаторы. Пищевые ароматизаторы добавляют к пищевым продуктам с целью придания вкуса и аромата безвкусным продуктам. Пищевые ароматизаторы бывают натуральными, идентичными натуральным и искусственными. Использование натуральных ароматизаторов ограничено из-за недостаточности и высокой стоимости природного сырья.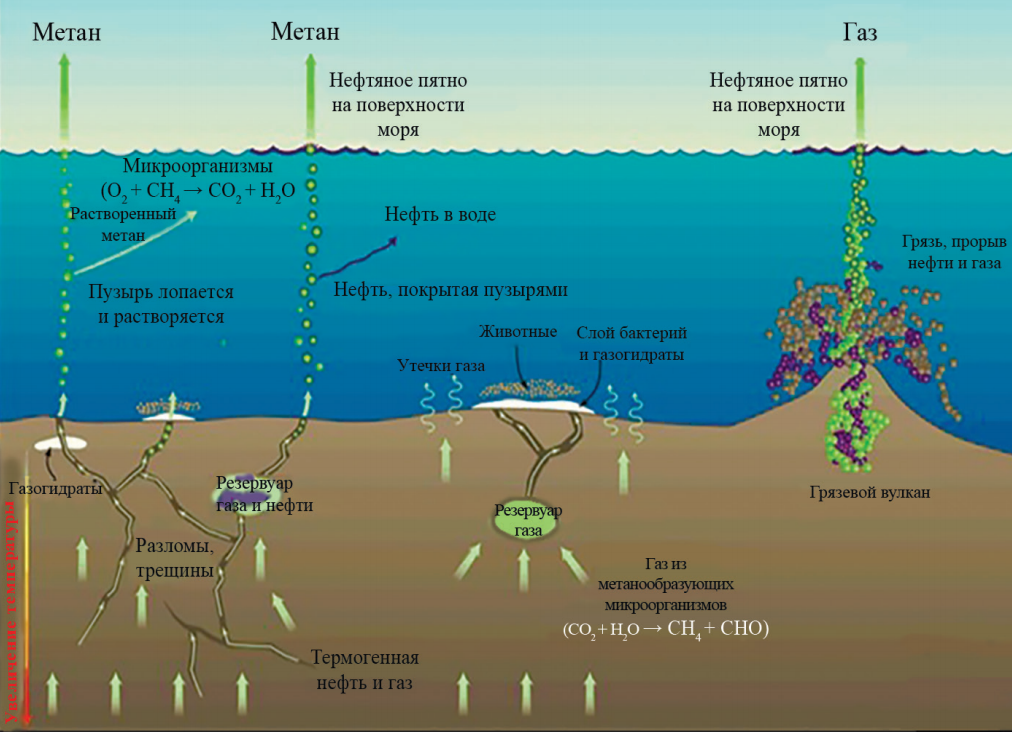 Идентичные натуральным ароматизаторы в настоящее время получили наибольшее распространение. Они получены путем органического синтеза. Такие ароматизаторы наиболее дешевы и стабильны. Если на этикетке в составе газированных напитков не указывается ароматизатор, то можно предположить, что он не натуральный. Главным веществом, из которого можно создать любой аромат путем различных химических соединений, является бензоат натрия. В желудке он соединяется с кислотой, образуя токсичные соединения бензола, а они являются канцерогенами.
Идентичные натуральным ароматизаторы в настоящее время получили наибольшее распространение. Они получены путем органического синтеза. Такие ароматизаторы наиболее дешевы и стабильны. Если на этикетке в составе газированных напитков не указывается ароматизатор, то можно предположить, что он не натуральный. Главным веществом, из которого можно создать любой аромат путем различных химических соединений, является бензоат натрия. В желудке он соединяется с кислотой, образуя токсичные соединения бензола, а они являются канцерогенами.
Кофеин. Во многие сладкие газировки добавляют кофеин – искусственный энергетик, который излишне возбуждает нервную систему и вреден для сердца. Кофеин придает энергию, повышает работоспособность человека, делая его активным и бодрым. Но подвох в том, что бодрость быстро пропадает, а на ее месте появляется раздражение, апатия, заторможенность, сонливость и быстрая утомляемость. Очередная порция способна исправить ситуацию, но ненадолго. И как результат, употребление кофеиносодержащего напитка вызывает не только непоправимый урон для здоровья, но и стойкое привыкание, и превращается в зависимость.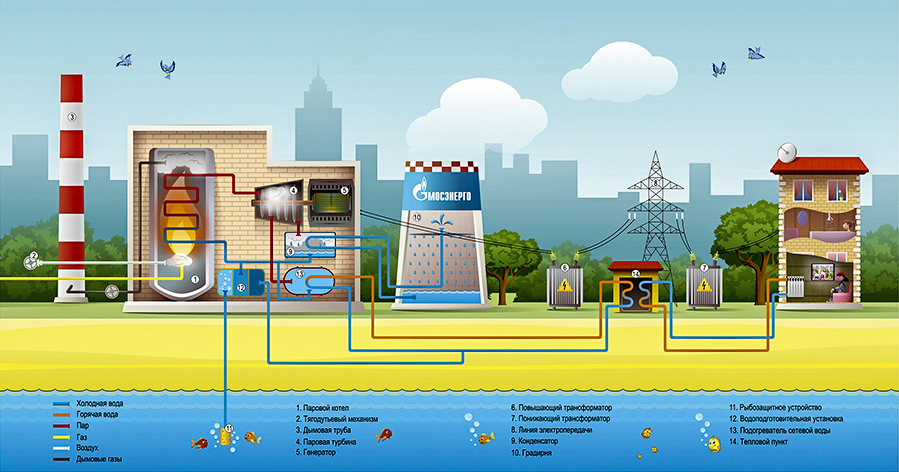
После того как мы определили вред сладкой газировки, давайте разберемся, как уменьшить ее вред на организм, не ограничивать себя и иногда баловать сладкой газировкой без вреда для здоровья.
Для этого достаточно: позволять не больше 0,5 литра газировки в день и не чаще раза в неделю; выбирать газировку в стеклянной таре, а не в алюминиевых банках или пластике; пить напиток через соломинку или предварительно выпустив газ; перейти на простую воду, компоты, морсы или натуральный квас.
Говоря о том, какой вред наносят газированные напитки нашему организму, нельзя забывать, что они, как и любой другой синтетический продукт, при регулярном и чрезмерном употреблении могут повлиять на общее самочувствие человека и заметно снизить его иммунитет. При выборе такого напитка советуем обращать внимание на его происхождение: природное или синтетическое, на количество сахара в нем и срок годности. И, главное, не покупать ежедневно газировку и не употреблять в качестве основного источника питья. Тогда существенного вреда от сладких газированных напитков не будет!
И, главное, не покупать ежедневно газировку и не употреблять в качестве основного источника питья. Тогда существенного вреда от сладких газированных напитков не будет!
Пункт по защите прав потребителей
Филиала ФБУЗ «Центр гигиены и эпидемиологии в Алтайском крае в городе Заринске, Заринском, Залесовском, Кытмановском и Тогульском районах»
Наш адрес:
659100 Алтайский край г.Заринск
ул. 25 Партсъезда д. 14 корп. 2 каб. № 8
Тел.: 8 (38595) 99027
E—mail: zarinsk@altcge.ru
2019 г.
Наличие газа с водой: деятельность в области химии и технических наук
Соберите простое устройство для электролиза, используя 9-вольтовую батарею, обернутую глиной для лепки на масляной основе, улавливайте два образующихся газа и закончите со взрывом, проверив их состав.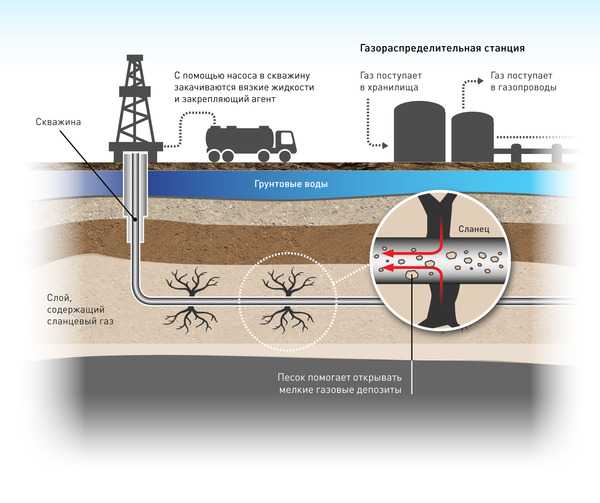
Предмет:
Химия
Материалы и вещества
Комбинирование веществ
Инженерия и технологии
Дизайн и мастерство
Электричество и магнетизм
Электричество и магнетизм0003
Ключевые слова:
Альтернативная энергия
ЭЛЕКТРОЛИЗ
Проводимость
Curance
ION
GAS
WATE
Аккумулятор
Video
NGSS и EP & CS:
NGSS и EP & CS:
NGSS и EP & CS:
NGSS.
ETS
ETS1
CCC
Причина и следствие
Масштаб, доля и количество
Системы и модели систем
Энергия и материя
Стабильность и изменение
Демонстрация видео
Инструменты и материалы
- 9-вольтовая батарея — недорогая углеродно-цинковая батарея, которую часто называют «сверхмощной»: вы можете использовать старые батареи (хотя они могут работать немного дольше), но не используйте литиевые, щелочные или перезаряжаемые батареи.

- Две резинки
- Два винта из нержавеющей стали, каждый длиной не менее 1,5 дюйма (40 мм)
- Один блок глины для лепки на масляной основе, также известной как полимерная глина (торговые марки включают Sculpey, Fimo, Plasticine и Plastilina)
- Прозрачная стеклянная или пластиковая чашка или стакан
- Теплая вода
- английская соль; Предостережение: не заменяйте поваренную соль (NaCl) для этого действия, так как она может выделять газообразный хлор
- Чайная ложка
- Защитные очки
- Две пробирки из лабораторного стекла (рекомендуются пробирки для сжигания с более толстыми стенками)
- Зажигалка или спички
- Деревянная шина или деревянная мешалка для кофе
- Дополнительно: кислотно-щелочной индикатор, такой как феноловый красный, фенолфталеин, бромтимоловый синий или индикатор сока капусты (см. раздел «Советы по обучению» ниже, чтобы узнать, как сделать свой собственный)
Примечание. Убедитесь, что вы знаете, какие цвета обозначают кислоту и/или основание при использовании выбранного вами индикатора, и что вы осведомлены о любых проблемах безопасности, связанных с его использованием
Убедитесь, что вы знаете, какие цвета обозначают кислоту и/или основание при использовании выбранного вами индикатора, и что вы осведомлены о любых проблемах безопасности, связанных с его использованием
Сборка
- Оберните одну резиновую ленту вокруг 9-вольтовой батареи так, чтобы она лежала на обеих клеммах батареи. Оберните другую резинку вокруг батареи так, чтобы она пересекала первую резинку перпендикулярно, проходя между двумя клеммами батареи.
- Вставьте два винта из нержавеющей стали под резинку так, чтобы каждый винт крепился к верхней части каждой клеммы аккумулятора (см. фото ниже). Головки винтов должны указывать в одном направлении, и винты не должны касаться друг друга.
- Поскольку ваша батарея будет погружена в соленую воду, вам необходимо защитить ее, окружив ее глиной для лепки. Прижмите небольшие кусочки глины между электродами и вокруг них (см. левое фото ниже). Во время работы отмечайте, какая клемма является положительной, а какая отрицательной, вырезая метку на окружающей глине, и обязательно держите кончики винтов открытыми (щелкните, чтобы увеличить правую фотографию ниже).
 Продолжайте нажимать и разглаживать глину, пока ваше устройство не будет запечатано со всех сторон. Убедитесь, что метки на клеммах различимы, а кончики винтов чистые. Это ваше устройство для электролиза, а винты — ваши электроды, они будут проводить электричество во время эксперимента.
Продолжайте нажимать и разглаживать глину, пока ваше устройство не будет запечатано со всех сторон. Убедитесь, что метки на клеммах различимы, а кончики винтов чистые. Это ваше устройство для электролиза, а винты — ваши электроды, они будут проводить электричество во время эксперимента. - Наполните стакан примерно на три четверти теплой водой.
- Наденьте защитные очки.
- Насыпьте в воду одну чайную ложку (5 мл) английской соли. Перемешайте раствор, чтобы помочь растворить соль.
- Из стакана с морской водой осторожно наполните каждую пробирку до краев. Отложите их в сторону, но поддержите вертикально, чтобы они не пролились.
- Аккуратно опустите электролизное устройство в раствор электродами (винтами) вверх. Концы винтов должны находиться под поверхностью соленой воды. Если их нет, просто добавьте еще немного воды.
- Как только ваше устройство для электролиза погрузится в соленую воду, вы должны начать видеть крошечные пузырьки, выходящие из электродов.
 Чтобы поймать эти пузырьки, закройте горлышко одной заполненной раствором пробирки большим или указательным пальцем, сильно нажимая, чтобы образовалась водонепроницаемая крышка. Затем осторожно переверните пробирку и погрузите ее горлышко в стакан с соленой водой, следя за тем, чтобы раствор не пролился. Ваш большой или указательный палец намокнет. Наконец, выньте большой или указательный палец из-под перевернутой и погруженной в воду пробирки. Раствор должен оставаться в пробирке.
Чтобы поймать эти пузырьки, закройте горлышко одной заполненной раствором пробирки большим или указательным пальцем, сильно нажимая, чтобы образовалась водонепроницаемая крышка. Затем осторожно переверните пробирку и погрузите ее горлышко в стакан с соленой водой, следя за тем, чтобы раствор не пролился. Ваш большой или указательный палец намокнет. Наконец, выньте большой или указательный палец из-под перевернутой и погруженной в воду пробирки. Раствор должен оставаться в пробирке. - Удерживая горлышко пробирки под поверхностью воды, осторожно переместите горлышко перевернутой пробирки над одним из барботажных электродов. Убедитесь, что пузырьки газа только от одного электрода могут подняться вверх и собраться внутри трубки. Электрод должен поддерживать пробирку в вертикальном положении во время сбора газа.
- Повторите шаги 9 и 10 с другой пробиркой, расположив ее над другим пузырьковым электродом (щелкните, чтобы увеличить фотографии ниже).
Действия и уведомления
Внимательно следите за своим устройством. Сразу же вы, вероятно, заметите образование пузырьков на электродах. Один электрод испускает больше пузырьков, чем другой? Это положительный или отрицательный электрод?
Сразу же вы, вероятно, заметите образование пузырьков на электродах. Один электрод испускает больше пузырьков, чем другой? Это положительный или отрицательный электрод?
Если вы хотите, вы можете добавить в этот момент ваш кислотно-щелочной индикатор в стакан с соленой водой. Замечаете ли вы какие-либо изменения в цвете?
Дайте этой установке постоять и собрать пузырьки в течение нескольких часов или даже на ночь. Через несколько часов вы должны увидеть, что в одной из пробирок собрано намного больше газа, чем в другой.
Вы можете проверить состав газа в пробирках, выполнив «тест на шину». Внимание! Работайте со взрослыми и используйте защитные очки! Вы будете работать с пламенем.
Сначала проверьте газ в пробирке, в которой газа больше. Он должен быть над отрицательным электродом. Если обе трубки полностью заполнены газом, обязательно посмотрите на батарею, чтобы увидеть, какая трубка находится над отрицательным электродом. Наденьте очки. Подожгите деревянную шину (см. левое фото ниже). Затем быстро вытащите пробирку из воды и поднесите пылающую лучину к отверстию (см. правую фотографию ниже). Держись крепко! Вас может напугать громкий хлопок!
Подожгите деревянную шину (см. левое фото ниже). Затем быстро вытащите пробирку из воды и поднесите пылающую лучину к отверстию (см. правую фотографию ниже). Держись крепко! Вас может напугать громкий хлопок!
Теперь проверьте газ в пробирке, которая заполнялась медленнее. Снова подожгите деревянную шину, но на этот раз задуйте пламя, чтобы на конце палки остался только тлеющий уголь.
Быстро вытащите вторую пробирку из воды и вставьте светящуюся шину в открытый конец (см. левое фото ниже). На этот раз вы должны увидеть пересвет шины (см. правую фотографию ниже). Как только шина снова загорится, вытащите ее из трубки, продуйте и снова вставьте. Возможно, вам удастся заставить шину загореться несколько раз.
Что происходит?
Электролиз — это химическое разложение, производимое электричеством — в данном случае химическое вещество, которое вы разлагаете, — это вода.
Молекулярная формула воды: H 2 O, где H обозначает водород, а O обозначает кислород. В стакане воды многие молекулы естественным образом распадаются на положительно заряженные ионы водорода (H + ) и ионы гидроксида (OH — ), которые заряжены отрицательно. Ваше электролизное устройство вызывает реакции, которые еще больше разъединяют воду.
В стакане воды многие молекулы естественным образом распадаются на положительно заряженные ионы водорода (H + ) и ионы гидроксида (OH — ), которые заряжены отрицательно. Ваше электролизное устройство вызывает реакции, которые еще больше разъединяют воду.
Поскольку противоположные заряды притягиваются, ионы гидроксида, содержащие кислород, мигрируют к положительному электроду, а ионы водорода мигрируют к отрицательному электроду.
Элементарно и кислород, и водород предпочитают быть двухатомными или двухатомными молекулами. На положительном электроде атомы кислорода отрываются от ионов гидроксида и затем объединяются, образуя газообразный кислород (O 2 ) пузырьки. Точно так же на отрицательном выводе ионы водорода объединяются, образуя пузырьки газообразного водорода (H 2 ). Ниже приведено химическое уравнение, описывающее происходящее.
2 H 2 O (l) → 2 H 2 (g) + O 2(g)
Газы кислорода и водорода прозрачны и не имеют запаха. Так как же узнать, какая пробирка содержит какой газ? Вот подсказка: один заполняется быстрее, чем другой. Для образования газа доступно в два раза больше атомов водорода, поэтому объем образующегося газообразного водорода должен быть больше, чем объем газообразного кислорода.
Так как же узнать, какая пробирка содержит какой газ? Вот подсказка: один заполняется быстрее, чем другой. Для образования газа доступно в два раза больше атомов водорода, поэтому объем образующегося газообразного водорода должен быть больше, чем объем газообразного кислорода.
Тест с шиной дает еще одну подсказку: газообразный водород очень легко воспламеняется — факт, прославившийся катастрофой с дирижаблем «Гинденбург», — и при горении издает взрывной хлопающий звук. Кислород, с другой стороны, на самом деле не воспламеняется, но он необходим для горения, поэтому ваш расщепленный газ воспламеняется кислородом.
Английская соль, также известная как сульфат магния (MgSO 4 ), растворяется в воде, чтобы помочь вашей батарее более эффективно разлагать воду. Английская соль распадается на заряженные частицы, называемые ионами, которые помогают проводить электрический ток через раствор.
Дальше
Вы добавили кислотно-щелочной индикатор в свой эксперимент? Если вы это сделали, вы, вероятно, заметили изменение цвета вокруг ваших электродов и внутри ваших пробирок. Производство газа на каждом терминале изменяет pH окружающего раствора. Чтобы узнать больше об этом, ознакомьтесь с соответствующей закуской, указывающей на электролиз.
Производство газа на каждом терминале изменяет pH окружающего раствора. Чтобы узнать больше об этом, ознакомьтесь с соответствующей закуской, указывающей на электролиз.
Учебные советы
Простое погружение «голой» 9-вольтовой углеродно-цинковой батареи в раствор соли Эпсома приведет к образованию пузырьков, а также покажет важность защиты батареи в глине для лепки. Аккумулятор быстро выйдет из строя и перестанет работать, а плюсовая клемма сразу же заржавеет от выделяемого там кислорода.
Одним из самых безопасных и дешевых индикаторов кислотно-щелочного состояния является сок краснокочанной капусты, который легко приготовить самостоятельно: нарежьте один небольшой кочан краснокочанной капусты. Нагрейте кастрюлю с водой до кипения, затем выключите огонь и добавьте капусту. Дайте настояться в течение 10 минут, пока жидкость не станет темно-фиолетовой. Процедить и выбросить твердые вещества. Ваш индикатор капустного сока теперь готов к использованию в этом и многих других экспериментах. В кислой среде он становится розовым, в нейтральной — пурпурным, а в щелочной — сине-зеленым или даже желтым.
В кислой среде он становится розовым, в нейтральной — пурпурным, а в щелочной — сине-зеленым или даже желтым.
Похожие закуски
Электролиз
Разбейте воду на водород и кислород с помощью простого устройства.
Кондуктометр
Сделайте измеритель проводимости и пусть ваши электролиты сияют.
Алюминиево-воздушная батарея
Сконструируйте простую батарею, которая может питать свет.
Эта работа находится под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
Атрибуция: Педагогический институт Exploratorium
Получение топлива из воды — особенности
Как электролитический водород может помочь питать наше будущее
Роль водорода
СОКРАЩЕНИЕ выбросов парниковых газов (ПГ) во избежание катастрофических последствий глобального потепления – важнейшая проблема нашего времени. Водород может сыграть ключевую роль в достижении Великобританией целей по сокращению выбросов парниковых газов. Значительное сокращение выбросов было достигнуто в электроэнергетическом секторе за счет увеличения проникновения возобновляемой электроэнергии, а также поэтапного отказа от угольных электростанций, но, наряду с дальнейшим сокращением выбросов от производства электроэнергии, необходимо резко добиться прогресса в секторах отопления и транспорта. улучшенный. Водород может сыграть важную роль в сокращении выбросов в этих секторах и, если он производится электролитическим способом, обеспечивает связь между ними.
Водород может сыграть ключевую роль в достижении Великобританией целей по сокращению выбросов парниковых газов. Значительное сокращение выбросов было достигнуто в электроэнергетическом секторе за счет увеличения проникновения возобновляемой электроэнергии, а также поэтапного отказа от угольных электростанций, но, наряду с дальнейшим сокращением выбросов от производства электроэнергии, необходимо резко добиться прогресса в секторах отопления и транспорта. улучшенный. Водород может сыграть важную роль в сокращении выбросов в этих секторах и, если он производится электролитическим способом, обеспечивает связь между ними.
В настоящее время большая часть водорода производится путем паровой конверсии метана, а затем используется в химической промышленности, например, для производства аммиака. Этот метод не является низкоуглеродным, если только он не используется в сочетании с улавливанием и хранением углерода (CCS). С CCS возможно сокращение выбросов парниковых газов на 60–85% по сравнению с метаном.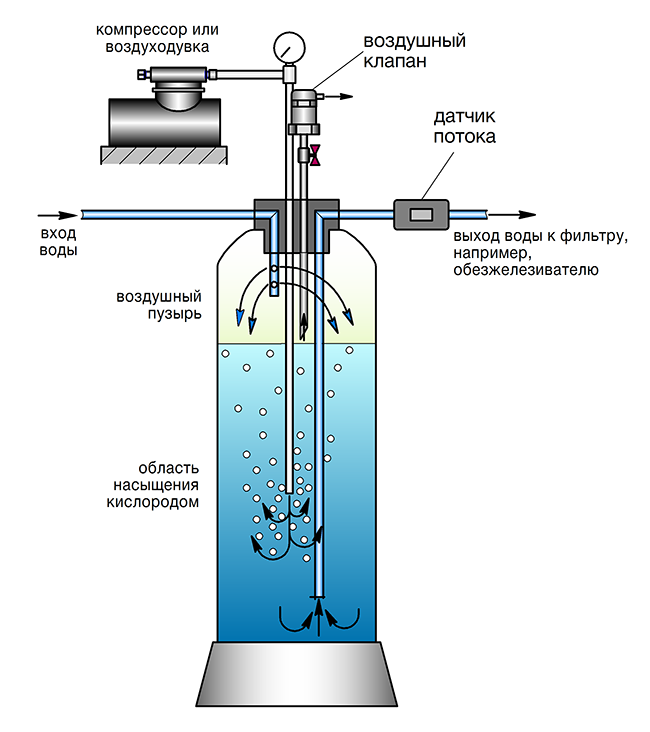 1 Альтернативным методом получения зеленого водорода является электролиз. Электролизер — это тип устройства, которое обычно используется для разложения воды с помощью постоянного электрического тока. Водород и кислород будут производиться из воды в результате окислительно-восстановительных реакций. Общая реакция:
1 Альтернативным методом получения зеленого водорода является электролиз. Электролизер — это тип устройства, которое обычно используется для разложения воды с помощью постоянного электрического тока. Водород и кислород будут производиться из воды в результате окислительно-восстановительных реакций. Общая реакция:
Если в процессе используется электричество из источников с низким содержанием углерода, то водород является топливом с низким содержанием углерода. Точный химический состав реакции зависит от конкретной используемой технологии, причем некоторые технологии больше подходят для определенных применений.
Электролизерные технологии
Открытие электролиза воды оспаривается. Одна точка зрения утверждает, что он был открыт Энтони Карлайлом и Уильямом Николсоном в 1800 году. Другая точка зрения отдает должное Иоганну Риттеру. По оценкам, в 2017 году глобальные продажи электролизеров достигли 100 МВт/год. Это указывает на ежедневное производство водорода 50 000 кг.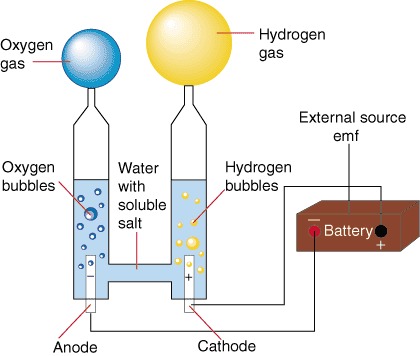 2
2
Существует три различных типа электролита, которые можно использовать в типичном процессе электролиза: жидкий электролит; твердый полимерный электролит в виде протонообменной мембраны; или мембрану, проводящую ионы кислорода. В результате существует три основных типа электролизеров в соответствии с принятой электролитной технологией, а именно щелочные электролизеры, электролизеры с протонообменной мембраной (ПОМ) и электролизеры с твердым оксидом (SO).
Щелочные электролизеры были первой коммерциализированной системой электролиза и остаются наиболее зрелой и широко используемой системой для производства водорода. Два электрода, анод и катод, часто изготовленные из никеля, погружены в проводящий электролит. 30% водный раствор гидроксида калия (КОН) обычно используется в качестве электролита для повышения ионной проводимости. Однако также можно использовать гидроксид натрия (NaOH). Сепаратор используется для обеспечения миграции анионов гидроксида (OH — ) и избегайте смешивания образующихся газообразных водорода и кислорода. Несмотря на то, что это устоявшаяся технология, щелочные электролизеры имеют ряд технических недостатков. Это включает в себя использование агрессивного электролита, низкую плотность тока, ограниченный динамический диапазон и неспособность работать при высоких давлениях. Схема показана на рисунке 1.
Несмотря на то, что это устоявшаяся технология, щелочные электролизеры имеют ряд технических недостатков. Это включает в себя использование агрессивного электролита, низкую плотность тока, ограниченный динамический диапазон и неспособность работать при высоких давлениях. Схема показана на рисунке 1.
Рисунок 1: Принцип работы ячейки для щелочного электролиза
В электролизерах PEM используется протонообменная мембрана. Наиболее часто используемая мембрана Nafion , производства DuPont, толщиной от 25 до 250 мкм. Можно использовать более толстую мембрану, чтобы электролизер мог справляться с работой при низкой нагрузке или частыми пусками и остановками. Эта технология находится на ранней коммерческой стадии. В настоящее время ведутся значительные исследования в области развития этой технологии.
Твердооксидные электролизеры отличаются как от щелочных электролизеров, так и от электролизеров с ПОМ тем, что они работают не при температуре около 80 90 186 o 90 187 C, а в диапазоне высоких температур 800–1000 o C. При такой высокой рабочей температуре в электролизер вместо воды подается пар. Увеличение потребности в тепле компенсируется снижением потребности в электроэнергии. Когда тепловая энергия предоставляется в виде отходов от других высокотемпературных промышленных процессов, стоимость производства водорода может быть дополнительно снижена. Однако установлено, что работа при такой высокой температуре может вызвать ряд недостатков, в том числе плохую долговременную стабильность ячеек, межслойную диффузию, проблемы с изготовлением и материалами. Ведутся исследования по разработке электролизеров, работающих при промежуточных температурах (500–700°С).0186 или С). В настоящее время SOE все еще находится на стадии исследований, разработок и демонстраций.
При такой высокой рабочей температуре в электролизер вместо воды подается пар. Увеличение потребности в тепле компенсируется снижением потребности в электроэнергии. Когда тепловая энергия предоставляется в виде отходов от других высокотемпературных промышленных процессов, стоимость производства водорода может быть дополнительно снижена. Однако установлено, что работа при такой высокой температуре может вызвать ряд недостатков, в том числе плохую долговременную стабильность ячеек, межслойную диффузию, проблемы с изготовлением и материалами. Ведутся исследования по разработке электролизеров, работающих при промежуточных температурах (500–700°С).0186 или С). В настоящее время SOE все еще находится на стадии исследований, разработок и демонстраций.
Вполне вероятно, что разные технологии подходят для разных приложений. Электролизеры на основе PEM способны быстрее регулировать свою производительность и имеют рабочий диапазон от 0 до 100%, поэтому они подходят для таких приложений, как управление спросом и интеграция возобновляемых источников энергии, где ключевым требованием является гибкость работы. Щелочные электролизеры как более устоявшаяся технология, скорее всего, будут продолжать использоваться там, где быстро меняющееся потребление не является ключевым требованием. Твердооксидные электролизеры потенциально могут предложить высокоэффективное производство водорода, если часть используемого тепла обеспечивается потоками отходов.
Щелочные электролизеры как более устоявшаяся технология, скорее всего, будут продолжать использоваться там, где быстро меняющееся потребление не является ключевым требованием. Твердооксидные электролизеры потенциально могут предложить высокоэффективное производство водорода, если часть используемого тепла обеспечивается потоками отходов.
Области применения
Водород может быть получен из различных источников, таких как ископаемое топливо, биомасса, а также электролитически из воды. Его можно хранить в виде сжатого газа, жидкости, в твердотельных структурах или использовать для создания синтетического топлива, такого как аммиак. Водород можно использовать в топливных элементах для выработки электроэнергии и тепла, сжигать или использовать в качестве химического сырья среди других методов. Большая часть водорода, производимого в будущем, вероятно, будет по-прежнему поступать из источников ископаемого топлива в сочетании с CCS из-за прогнозируемых затрат на производство водорода с помощью различных методов. Однако из-за своей способности поддерживать работу возобновляемых источников электроэнергии, обеспечивая топливо с нулевым содержанием углерода, водород, полученный электролитическим путем, может играть ключевую роль в ряде различных секторов. Водород, полученный электролитическим путем, не содержит углеводородных примесей, что снижает потребность в очистке. Это может повысить конкурентоспособность по стоимости водорода, полученного электролитическим путем, особенно в приложениях, требующих водорода высокой чистоты, таких как топливные элементы. На рис. 2 показана схема, демонстрирующая, как водород может обеспечить связь между секторами электроэнергетики, транспорта и газа.
Однако из-за своей способности поддерживать работу возобновляемых источников электроэнергии, обеспечивая топливо с нулевым содержанием углерода, водород, полученный электролитическим путем, может играть ключевую роль в ряде различных секторов. Водород, полученный электролитическим путем, не содержит углеводородных примесей, что снижает потребность в очистке. Это может повысить конкурентоспособность по стоимости водорода, полученного электролитическим путем, особенно в приложениях, требующих водорода высокой чистоты, таких как топливные элементы. На рис. 2 показана схема, демонстрирующая, как водород может обеспечить связь между секторами электроэнергетики, транспорта и газа.
Рисунок 2: Интеграция водородных систем с энергетическими, газовыми и транспортными сетями
Интеграция возобновляемых источников энергии
Увеличение объемов производства электроэнергии из возобновляемых источников потребует использования аккумулирования энергии и управления спросом для смягчения ограничений в электрической сети, а также для обеспечения общесистемная балансировка в разных временных масштабах. Водород особенно подходит для более длительного хранения энергии, такого как сезонное хранение, из-за его низких затрат, связанных с хранением энергии, и может дополнять более краткосрочное хранение, такое как батареи. Водород, полученный электролитическим путем, можно сжимать и хранить либо в газовых баллонах, либо, возможно, в геологических структурах, таких как соляные пещеры. Сохраненный водород позже может быть использован для производства электроэнергии через топливный элемент в качестве хранилища туда и обратно.
Водород особенно подходит для более длительного хранения энергии, такого как сезонное хранение, из-за его низких затрат, связанных с хранением энергии, и может дополнять более краткосрочное хранение, такое как батареи. Водород, полученный электролитическим путем, можно сжимать и хранить либо в газовых баллонах, либо, возможно, в геологических структурах, таких как соляные пещеры. Сохраненный водород позже может быть использован для производства электроэнергии через топливный элемент в качестве хранилища туда и обратно.
Электроэнергия в газ
Помимо накопления энергии в обе стороны, водород может обеспечить связь между секторами электроэнергетики и отопления путем подачи электролитически произведенного водорода в газовую сеть. Текущие правила жестко ограничивают процентное содержание водорода в сети, но исследования показали, что до 8% водорода по энергии технически осуществимо, не вызывая проблем у потребителей. 1 Если водород производится из низкоуглеродистой или возобновляемой электроэнергии, это может способствовать обезуглероживанию отопления. Некоторые схемы в Великобритании предлагают преобразовать целые участки газовой сети для работы на чистом водороде. Затем этот водород можно использовать в переоборудованных газовых котлах и других приборах или в топливных элементах для получения комбинированного тепла и электроэнергии.
Некоторые схемы в Великобритании предлагают преобразовать целые участки газовой сети для работы на чистом водороде. Затем этот водород можно использовать в переоборудованных газовых котлах и других приборах или в топливных элементах для получения комбинированного тепла и электроэнергии.
Заправка транспортных средств (электролиз на АЗС)
Электромобили, работающие на водородных топливных элементах (HFCEV), могут играть ключевую роль в обезуглероживании транспортных выбросов, особенно в более тяжелых условиях эксплуатации, таких как автобусы и грузовые автомобили, в дополнение к большим легковым автомобилям и транспортным средствам. Технологии, связанные с водородом, также могут способствовать обезуглероживанию железнодорожного и судоходного транспорта. Водород можно производить электролитическим путем либо на крупных централизованных предприятиях, либо с использованием электролизеров на АЗС, обеспечивая связь между электроэнергетикой и транспортным сектором.
Промышленность
Промышленные выбросы парниковых газов трудно сократить из-за потребности в высокотемпературном тепле в промышленных процессах, которое часто обеспечивается за счет сжигания ископаемого топлива. Кроме того, водород, используемый для химических реакций, в настоящее время в основном производится путем паровой конверсии метана с последующими выбросами парниковых газов. Производство водорода путем парового риформинга метана с CCS обеспечивает путь к частичной декарбонизации промышленности, которую можно дополнить и расширить за счет использования возобновляемого электролитического водорода.
Кроме того, водород, используемый для химических реакций, в настоящее время в основном производится путем паровой конверсии метана с последующими выбросами парниковых газов. Производство водорода путем парового риформинга метана с CCS обеспечивает путь к частичной декарбонизации промышленности, которую можно дополнить и расширить за счет использования возобновляемого электролитического водорода.
Тематическое исследование – создание электромобилей на водородных топливных элементах
Одной из проблем, связанных с разработкой и внедрением новых технологий, является обеспечение инфраструктуры, позволяющей первым внедрять технологии. В качестве примера можно привести использование электромобилей на водородных топливных элементах (HFCEV), которые требуют разработки инфраструктуры для заправки водородом, предшествующей внедрению транспортных средств.
Раннему внедрению может способствовать коммерческое, общественное и академическое сотрудничество. Примером может служить заправка автомобилей HFCEV, эксплуатируемых местными организациями, такими как Уэльская и Западная пожарная служба, которые используют водородную заправочную установку Университета Южного Уэльса, расположенную в водородном центре Baglan, которая получила поддержку в рамках такого сотрудничества. На рисунке 3 показан HFCEV в водородном центре Baglan Университета Южного Уэльса.
На рисунке 3 показан HFCEV в водородном центре Baglan Университета Южного Уэльса.
Водород, вырабатываемый на объекте в Баглане, частично производится с помощью 20 кВт солнечной фотоэлектрической установки на крыше, подключенной к местному щелочному электролизеру, а остальное подается из электрической сети. Электролизер может производить 10 Нм 3 водорода в час, который сжимается и хранится на месте. Затем водород можно использовать для производства электроэнергии в здании или обратно в электросеть через топливный элемент на месте или использовать для заправки транспортных средств. Транспортные средства могут быть заправлены менее чем за 5 минут из хранилища на территории, что дает потенциальную максимальную дальность 594 км. 3 При таком размере электролизера, установленного в настоящее время в Багланском водородном центре, для пополнения хранилища от одной заправки транспортного средства требуется около 5 часов.
Рис. 3: HFCEV в водородном центре USW Baglan
Резюме
Электролитически полученный водород может быть топливом, не содержащим парниковых газов, которое можно использовать в различных секторах и областях.

 При уровне pH ниже 4.5, из группы компонентов, формирующих карбонатное равновесие, в водоеме можно обнаружить только свободную углекислоту. Гидрокарбонатные ионы доминируют при рН 6-10. В таких условиях они становятся наиболее массовой формой. Своего пика содержание этой производной угольной кислоты достигает в интервале 8.3-8.4. Однако с увеличением рН до 10.5 и выше, на первые позиции выходят ионы карбонатные.
При уровне pH ниже 4.5, из группы компонентов, формирующих карбонатное равновесие, в водоеме можно обнаружить только свободную углекислоту. Гидрокарбонатные ионы доминируют при рН 6-10. В таких условиях они становятся наиболее массовой формой. Своего пика содержание этой производной угольной кислоты достигает в интервале 8.3-8.4. Однако с увеличением рН до 10.5 и выше, на первые позиции выходят ионы карбонатные.
 Убедитесь, что вы знаете, какие цвета обозначают кислоту и/или основание при использовании выбранного вами индикатора, и что вы осведомлены о любых проблемах безопасности, связанных с его использованием
Убедитесь, что вы знаете, какие цвета обозначают кислоту и/или основание при использовании выбранного вами индикатора, и что вы осведомлены о любых проблемах безопасности, связанных с его использованием  Продолжайте нажимать и разглаживать глину, пока ваше устройство не будет запечатано со всех сторон. Убедитесь, что метки на клеммах различимы, а кончики винтов чистые. Это ваше устройство для электролиза, а винты — ваши электроды, они будут проводить электричество во время эксперимента.
Продолжайте нажимать и разглаживать глину, пока ваше устройство не будет запечатано со всех сторон. Убедитесь, что метки на клеммах различимы, а кончики винтов чистые. Это ваше устройство для электролиза, а винты — ваши электроды, они будут проводить электричество во время эксперимента. Чтобы поймать эти пузырьки, закройте горлышко одной заполненной раствором пробирки большим или указательным пальцем, сильно нажимая, чтобы образовалась водонепроницаемая крышка. Затем осторожно переверните пробирку и погрузите ее горлышко в стакан с соленой водой, следя за тем, чтобы раствор не пролился. Ваш большой или указательный палец намокнет. Наконец, выньте большой или указательный палец из-под перевернутой и погруженной в воду пробирки. Раствор должен оставаться в пробирке.
Чтобы поймать эти пузырьки, закройте горлышко одной заполненной раствором пробирки большим или указательным пальцем, сильно нажимая, чтобы образовалась водонепроницаемая крышка. Затем осторожно переверните пробирку и погрузите ее горлышко в стакан с соленой водой, следя за тем, чтобы раствор не пролился. Ваш большой или указательный палец намокнет. Наконец, выньте большой или указательный палец из-под перевернутой и погруженной в воду пробирки. Раствор должен оставаться в пробирке.