Содержание
Морская вода
Морская вода.
Поделиться в:
Морская вода – вода морей и океанов. Ее соленость составляет в среднем 3,47 % (34,7 ‰) и колеблется от 3,4 до 3,6 % (34-36 ‰).
Морская вода и ее свойства: соленость, температура замерзания, pH, плотность, скорость звука, теплопроводность
Сравнение характеристики пресной воды и морской воды
Химический состав морской воды
Морская вода и ее свойства: соленость, температура замерзания, pH, плотность, скорость звука, теплопроводность:
Морская вода – вода морей и океанов.
Солёность морской воды в Мировом океане составляет в среднем 3,47 % (34,7 ‰) и колеблется от 3,4 до 3,6 % (34-36 ‰). Это означает, что в каждом литре морской воды растворено около 35 граммов солей (в основном хлорида натрия NaCl) или 0,6 моль/литр (если предположить, что вся соль представлена NaCl).
В океанах солёность воды почти повсеместно близка к 3,5 %. Однако в морях вода имеет неравномерно распределённую солёность. Наименее солёной является вода Финского залива и северной части Ботнического залива, входящих в акваторию Балтийского моря. Наиболее солёной является вода Красного моря и восточная часть Средиземного моря.
Однако в морях вода имеет неравномерно распределённую солёность. Наименее солёной является вода Финского залива и северной части Ботнического залива, входящих в акваторию Балтийского моря. Наиболее солёной является вода Красного моря и восточная часть Средиземного моря.
В устьях рек, вблизи тающих ледников или вследствие больших количеств осадков (например, муссонов) морская вода может быть существенно менее соленой.
Соленость в изолированных водоемах может быть еще значительно больше – примерно в десять раз выше, как например имеет место в Мертвом море (хотя Метвое море морем в прямом понимании не является, а является бессточным солёным озером). Солёность Мертвого моря составляет 300-310 ‰, а в некоторые годы доходила до 350 ‰.
Морская вода непригодна для питья из-за высокого содержания солей и минеральных веществ, для выведения которых из организма требуется воды больше, чем её выпитое количество. Однако после опреснения такую воду можно пить.
Температура замерзания морской воды уменьшается с увеличением концентрации соли. При обычной солености она замерзает примерно при -2,0 °C. Самая низкая температура, при которой замерзала морская вода составляла -2,0 °C, была зарегистрирована в 2010 году под антарктическим ледником.
При охлаждении морская вода превращается в «морской лёд».
Морская вода слабощелочная. pH варьируется в пределах от 7,5 до 8,4. Однако общепринятой эталонной шкалы рН для морской воды не существует. Наиболее высоко значение pH у поверхности моря, с глубиной оно несколько снижается. В опреснённых участках (у устья рек и пр.) величина pH может снижаться до нейтральной и даже слабокислой.
Плотность морской воды колеблется в пределах от 1020 до 1030 кг/м³ и зависит от ее температуры и солености. При температуре 25 °С, солености 3,5 % и давлении 1 атм плотность морской воды составляет 1023,6 кг/м3. Глубоко в океане под высоким давлением плотность морской воды может достигать 1050 кг/м3 или более. При охлаждении морская вода всегда сжимается, вследствие чего ее плотность растет.
При охлаждении морская вода всегда сжимается, вследствие чего ее плотность растет.
Скорость звука в морской воде составляет около 1500 м/с и изменяется в зависимости от температуры воды, ее солености и давления. Для сравнения: скорость звука обычно составляет около 330 м/с в воздухе при давлении 1 атм.
Теплопроводность морской воды составляет 0,6 Вт/мК при 25 °С и солености 3,5 %. Теплопроводность уменьшается с увеличением солености и увеличивается с увеличением температуры.
Удельная электрическая проводимость морской воды обычно составляет 5 См/м.
Сравнение характеристик пресной (чистой воды) воды и морской воды:
| Наименование показателя | Морская вода с солёностью 35 ‰ | Чистая вода |
| Плотность при 25 °C, г/см3 | 1,02412 | 0,9971 |
| Вязкость при 25 °C, миллипуаз | 9,02 | 8,90 |
Давление пара при 20 °C, мм. рт. ст. рт. ст. | 17,35 | 17,54 |
| Температура максимальной плотности, °C | -3,52 (переохлаждённая жидкость) | +3,98 |
| Точка замерзания, °C | -1,91 | 0,00 |
| Поверхностное натяжение при 25 °C, дин/см | 72,74 | 71,97 |
| Скорость звука при 0 °C, м/с | 1450 | 1407 |
| Удельная теплоёмкость при 7,5 °C, Дж/(г·°C) | 3,898 | 4,182 |
Химический состав морской воды:
В морской воде в виде солей растворены практически все химические элементы из таблицы Д.И. Менделеева. Из 118 известных химических элементов 70 найдено в океанских и морских водах. По сути, морская вода содержит неисчерпаемые запасы нужных и важных для человека химических элементов, правда, в малых концентрациях.
Ниже в таблице № 1 приводится элементный состав морской воды с соленостью 3,5 %. В ней приведены химические элементы, имеющие значительную концентрацию в морской воде. В таблице № 2 приводятся химические элементы, имеющие малые концентрации.
В таблице № 2 приводятся химические элементы, имеющие малые концентрации.
Таблица № 1.
| Химический элемент | %% по массе |
| Кислород | 85,84 |
| Водород | 10,82 |
| Хлор | 1,94 |
| Натрий | 1,08 |
| Магний | 0,1292 |
| Сера | 0,091 |
| Кальций | 0,04 |
| Калий | 0,04 |
| Бром | 0,0067 |
| Углерод | 0,0028 |
Таблица № 2.
| Химический элемент | %% по массе |
| Гелий | 7,2·10-10 |
| Литий | 0,000018 |
| Бериллий | 6,0·10-11 |
| Бор | 0,00044 |
| Азот | 0,00005 |
| Фтор | 0,00013 |
| Неон | 1,2·10-8 |
| Алюминий | 5,0·10-7 |
| Кремний | 0,0001 |
| Фосфор | 7,0·10-6 |
| Аргон | 0,000045 |
| Скандий | 1,5·10-10 |
| Титан | 1,0·10-7 |
| Ванадий | 1,5·10-7 |
| Хром | 6,0·10-8 |
| Марганец | 2,0·10-7 |
| Железо | 3,0·10-7 |
| Кобальт | 8,0·10-9 |
| Никель | 2,0·10-7 |
| Медь | 3,0·10-7 |
| Цинк | 5,0·10-7 |
| Галлий | 3,0·10-9 |
| Германий | 6,0·10-9 |
| Мышьяк | 2,3·10-7 |
| Селен | 4,5·10-8 |
| Криптон | 2,1·10-8 |
| Рубидий | 0,000012 |
| Стронций | 0,00081 |
| Иттрий | 1,3·10-9 |
| Цирконий | 2,6·10-9 |
| Ниобий | 1,0·10-10 |
| Молибден | 1,0·10-6 |
| Технеций | 0 |
| Рутений | 7,0·10-11 |
| Родий | —* |
| Палладий | — |
| Серебро | 1,0·10-8 |
| Кадмий | 5,0·10-9 |
| Индий | 1,0·10-11 |
| Олово | 1,0·10-9 |
| Сурьма | 2,0·10-8 |
| Теллур | — |
| Йод | 6,0·10-6 |
| Ксенон | 5,0·10-10 |
| Цезий | 5,0·10-8 |
| Барий | 3,0·10-6 |
| Лантан | 3,4·10-10 |
| Церий | 1,2·10-10 |
| Празеодим | 6,0·10-11 |
| Неодим | 2,8·10-10 |
| Прометий | 0 |
| Самарий | 4,5·10-11 |
| Европий | 1,3·10-11 |
| Гадолиний | 7,0·10-11 |
| Тербий | 1,4·10-11 |
| Диспрозий | 9,1·10-11 |
| Гольмий | 2,2·10-11 |
| Эрбий | 9,0·10-11 |
| Тулий | 2,0·10-11 |
| Иттербий | 8,0·10-11 |
| Лютеций | 1,5·10-11 |
| Гафний | 8,0·10-10 |
| Тантал | 2,0·10-10 |
| Вольфрам | 1,2·10-8 |
| Рений | 1,0·10-10 |
| Осмий | — |
| Иридий | — |
| Платина | — |
| Золото | 5,0·10-9 |
| Ртуть | 5,0·10-9 |
| Таллий | 1,0·10-10 |
| Свинец | 3,0·10-9 |
| Висмут | 2,0·10-9 |
| Полоний | 2,0·10-18 |
| Астат | 0 |
| Радон | 6,0·10-20 |
| Франций | — |
| Радий | 1,0·10-15 |
| Актиний | — |
| Торий | 4,0·10-12 |
| Протактиний | 2,0·10-23 |
| Уран | 3,3·10-7 |
| Нептуний | 0 |
| Плутоний | 0 |
| Америций | 0 |
| Кюрий | 0 |
| Берклий | 0 |
| Калифорний | 0 |
| Эйнштейний | 0 |
| Фермий | 0 |
| Менделеевий | 0 |
| Нобелий | 0 |
| Лоуренсий | 0 |
| Резерфордий | 0 |
| Дубний | 0 |
| Сиборгий | 0 |
| Борий | 0 |
| Хассий | 0 |
| Мейтнерий | 0 |
| Дармштадтий | 0 |
| Рентгений | 0 |
| Коперниций | 0 |
| Нихоний | 0 |
| Флеровий | 0 |
| Московий | 0 |
| Ливерморий | 0 |
| Теннессин | 0 |
| Оганесон | 0 |
Примечание:
* — – неизвестно.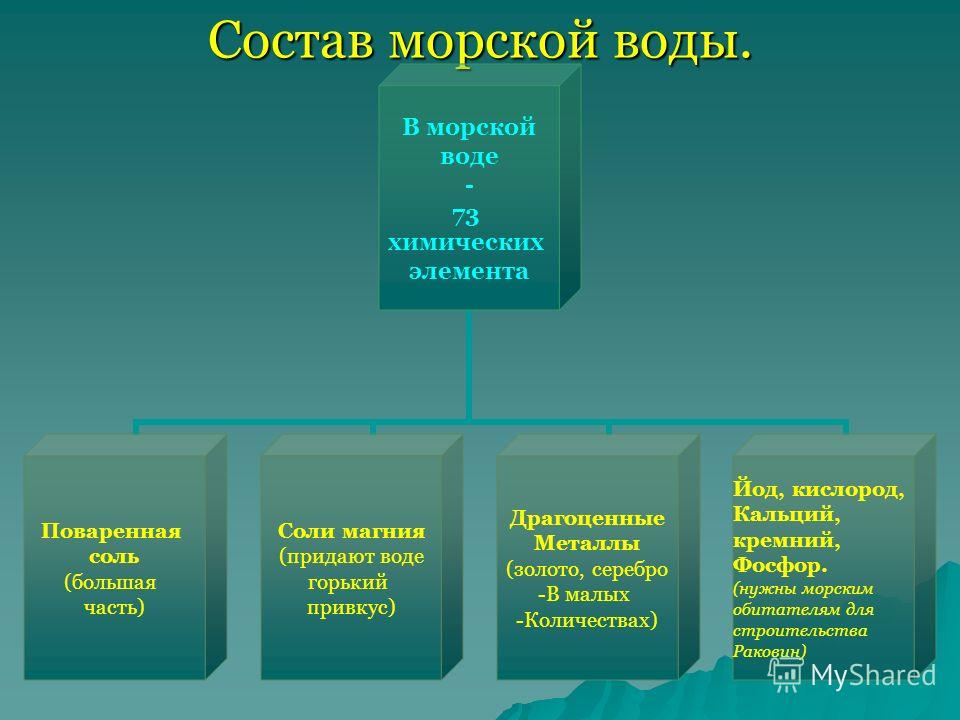
Источник: https://ru.wikipedia.org/wiki/Морская_вода
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
1 238
➜ Опреснение морской воды, методы очистки :: Формула воды
Дефицит пресной воды — феномен, знакомый человечеству издавна Истории известен ни один факт отсутствия питьевой воды, повлекший за собой кризис и социальные беды. По мере развития цивилизации увеличиваются масштабы и вододефицита, и социальных катастроф. Не что иное, как водный дефицит, вызванный последствиями вторичного засоления почвы, является причиной гибели многих цивилизаций. Сегодня же по словам ученных, общество стоит на пороге получения пресной воды из акваторий морей, океанов, заливов и бухт. Многие страны мира уже столкнулись с проблемой нехватки пресной воды. Поэтому, опреснение морской воды – один из шагов решения возникшей задачи.
Опреснение морской воды — удаление из воды растворённых в ней солей, дабы быть пригодной для питья или для использования в технических целях. Содержание солей в морской воде составляет 3,5 %, а в питьевой – 0,05%.
Содержание солей в морской воде составляет 3,5 %, а в питьевой – 0,05%.
Процесс очистки опресненной воды сложный и трудоемкий. Содержание в ней микроорганизмов, концентрированных химических соединений зачастую превышает показатели пресной неочищенной воды, поэтому перед опреснением, морская вода должна пройти предварительную очистку с целью удаления мутности и цветности. Для этого применяются напорные либо безнапорные осветлители, также возможно применение мембранных фильтров. Применение предварительной фильтрации позволяет снизить нагрузку с фильтров «опреснителей», тем самым продлить их срок службы и снизить эксплуатационные показатели.
Отличительно, что морская вода податлива к очистке, благодаря тем методам, которые применяются для ее очистки. Достаточно распространенным является метод дистилляции.
Этот способ основан на закипании и парообразовании. Морскую воду нагревают до образования пара, который изымается и охлаждается, как следствие – вода пригодна к расходованию. Огромным недостаток этого метода является остаточный соляной раствор высокой концентрации Но для того, чтобы он не приводил в непригодность трубопровод и сам дистиллятор, используют многокамерные дистилляторы, и частично опресненную воду с соляным раствором сбрасывают в море. Очень важным моментом является очистка морской воды перед и после метода дистилляции.
Огромным недостаток этого метода является остаточный соляной раствор высокой концентрации Но для того, чтобы он не приводил в непригодность трубопровод и сам дистиллятор, используют многокамерные дистилляторы, и частично опресненную воду с соляным раствором сбрасывают в море. Очень важным моментом является очистка морской воды перед и после метода дистилляции.
Следующим методом опреснения морской воды можно назвать – метод обратного осмоса. Очистка воды и опреснение происходит с помощью мембраны, проницаемой для воды, но непроницаемой для солей и прочих примесей, растворенных в морской воде, при помощи системы водоочистки и водоподготовки. Основной недостаток этого метода – малое количество очищенной опресненной воды. Это объяснимо: на выходе вода получится опресненной в том случае, если морскую подать на мембрану под давлением, при этом соли оставив на инверсионной стороне мембраны. Это давление называется осмотическим, оно не должно превышать допустимые нормы, в противном случае может произойти разрыв мембраны или просачивание солей, растворенных в морской воде.
Наряду с вышеперечисленными методами опреснения морской воды, следует отметить метод заморозки — превращение морской воды в лед, без попадания растворенных в ней солей и метод электродиализа, при котором вода проходит через камеру с электродами, приводя катионы и анионы к распределению на соответствующих электродах. Главное преимущество этого метода заключается в процессе использования химически и термически стойких мембран, тем самым давая возможность проводить опреснение при высоких температурах.
Водоочистка опресненной воды, не отличается от процесса фильтрации и очистки обычной воды, взятой из открытого пресного водоема Не зависимо от метода очистки морской воды, опресненная вода нуждается в применении химических реагентов для хранения подготовленной воды в резервуарах, а так же для транспортировки ее потребителю. В зависимости от технологических процессов и применяемых химических реагентов, дополнительно могут устанавливаться механические либо сорбционные фильтры.
На сегодняшний день, опреснение морской воды – это в одночасье и актуальная проблема, и дорогостоящий метод получения чистой воды, для применения в индустрии и быту.
Плотность морской воды в зависимости от солености (от 5 до 70 г/кг) и температуры (от 273,15 до 363,15 К)
05 мая 2009 г.
05 мая 2009 г.
Ф. Дж. Миллеро и Ф. Хуан
Ф. Дж. Миллеро и Ф. Хуанг
Ф. Дж. Миллеро и Ф. Хуанг
Показать информацию об авторе
- Школа морских и атмосферных исследований им. Розенстила, Университет Майами, Майами, Флорида 33149, США
Получено: 24 октября 2008 г. — Начало обсуждения: 23 января 2009 г.– Опубликовано: 05 мая 2009 г.
Аннотация. Были проведены новые измерения плотности морской воды в зависимости от температуры T = (от 273,15 до 363,15) K и солености (от 5 до 70 г/кг −1 ).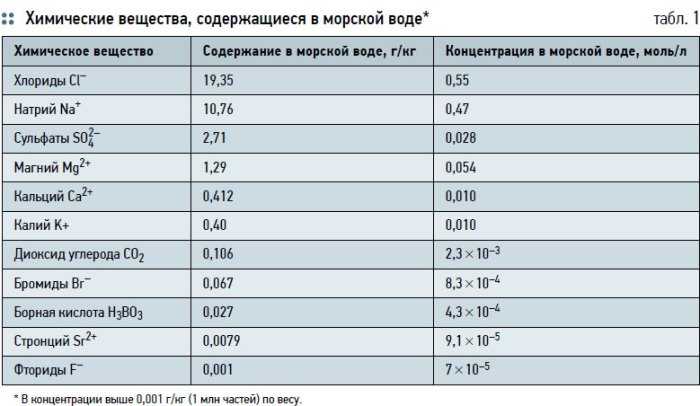 Измерения ( N =230) от T =273,15 до 313,15 K и Практическая соленость ( S ) от 0 до 40 оказались в хорошем согласии (σ=0,0036 кг м −3 ) с уравнение состояния морской воды (Millero and Poisson, 1981) составлено на пробах с известным содержанием хлора (Cl). Эти результаты показывают, что практическая соленость ( S ) согласуются с точностью ±0,003 кг·м −3 со значениями, рассчитанными по хлору, S Cl =1,80655 Cl. Измерения от 298,15 до 363,15 были использованы для распространения уравнения состояния на высокие температуры и соленость. Все плотности относились к чистой воде (ρ−ρ 0 , где ρ 0 — плотность чистой воды) и подгонялись к уравнениям вида
Измерения ( N =230) от T =273,15 до 313,15 K и Практическая соленость ( S ) от 0 до 40 оказались в хорошем согласии (σ=0,0036 кг м −3 ) с уравнение состояния морской воды (Millero and Poisson, 1981) составлено на пробах с известным содержанием хлора (Cl). Эти результаты показывают, что практическая соленость ( S ) согласуются с точностью ±0,003 кг·м −3 со значениями, рассчитанными по хлору, S Cl =1,80655 Cl. Измерения от 298,15 до 363,15 были использованы для распространения уравнения состояния на высокие температуры и соленость. Все плотности относились к чистой воде (ρ−ρ 0 , где ρ 0 — плотность чистой воды) и подгонялись к уравнениям вида
(ρ−ρ 0 )/(кг м −3 )= A S A +B S A 1.5 +C S A 2
where A , B , and C are functions of temperature and S A (g кг −1 ) — абсолютная соленость, S A = (35,16504/35) S г кг −1 . Подогнанные результаты для S A = от 0 до 50 г кг −1 и T = от 273,15 до 313,15 K ( N = 242) дала стандартную ошибку 0,0037 кг м -3 . Подогнанные результаты от 298,15 до 363,15 К ( N = 280) дали стандартные ошибки 0,0063 кг·м −3 , а все результаты ( N =522) от 273,15 до 363,15 К дали стандартные ошибки 0,0063 кг·м . −3 . Более ранние измерения плотности (Millero et al., 1976b; Poisson et al., 1980), использованные для определения уравнения состояния морской воды (Millero and Poisson, 1981), были объединены для получения уравнений, действительных при температурах от 273,15 до 313,15 K и 273,15 до 363,15 К. Стандартные ошибки этих подгонок составляют соответственно 0,0038 кг м −3 ( N =713) и 0,0063 кг·м −3 ( N =962). Эти новые измерения расширяют уравнение состояния морской воды до более широкого диапазона температур (от 273,15 до 363,15) К и абсолютной солености (от 0 до 70 кг·м −3 .
Подогнанные результаты для S A = от 0 до 50 г кг −1 и T = от 273,15 до 313,15 K ( N = 242) дала стандартную ошибку 0,0037 кг м -3 . Подогнанные результаты от 298,15 до 363,15 К ( N = 280) дали стандартные ошибки 0,0063 кг·м −3 , а все результаты ( N =522) от 273,15 до 363,15 К дали стандартные ошибки 0,0063 кг·м . −3 . Более ранние измерения плотности (Millero et al., 1976b; Poisson et al., 1980), использованные для определения уравнения состояния морской воды (Millero and Poisson, 1981), были объединены для получения уравнений, действительных при температурах от 273,15 до 313,15 K и 273,15 до 363,15 К. Стандартные ошибки этих подгонок составляют соответственно 0,0038 кг м −3 ( N =713) и 0,0063 кг·м −3 ( N =962). Эти новые измерения расширяют уравнение состояния морской воды до более широкого диапазона температур (от 273,15 до 363,15) К и абсолютной солености (от 0 до 70 кг·м −3 .
