Содержание
Вода очищенная | Вода дистиллированная
Вода очищенная | Вода дистиллированная | Производство воды очищенной
Системы BWT делают жизнь качественнее, лучше и безопаснее. Откройте для себя системы гомогенизации и комплексные услуги для производства, хранения и распределения воды очищенной
Вода очищенная
Вода очищенная служит для изготовления жидких лекарственных препаратов и является основой, из которой приготовляют воду для инъекций. Фармакопеи разных стран содержат незначительно отличающиеся требования к качеству воды очищенной.
Для проверки качества воды очищенной проводят лабораторные исследования на содержание восстанавливающих веществ, диоксида углерода, хлоридов, сульфатов, аммиака, кальция, нитритов и нитратов, тяжелых металлов; определяют сухой остаток, рН воды и микробные показатели.
Требования к качеству воды очищенной
Основные показатели качества:
- pH от 5,0 до 7,0
- Содержание хлоридов, сульфатов, нитратов, восстанавливающих веществ, кальция, диоксида углерода, тяжелых металлов — отсутствие
- Содержание аммиака — 0,00002% (в препарате) или не более 0,05 мг/л
- Микробиологическая чистота — не более 100 микроорганизмов в 1 мл
- Бесцветность, прозрачность, отсутствие вкуса и запаха
Вода очищенная может быть получена из питьевой воды методами дистилляции (дистиллированная вода), ионного обмена, обратного осмоса или электродеионизации. Предпочтительными и наиболее экономичными методами получения воды очищенной эксперты считают электродеионизациюили обратный осмос.
Предпочтительными и наиболее экономичными методами получения воды очищенной эксперты считают электродеионизациюили обратный осмос.
Вода очищенная должна приготовляться в специальном помещении, в котором запрещены другие виды работ.
Итоговое качество полученного продукта (воды очищенной) складывается из следующих условий:
- химического состава исходной воды;
- совершенства технологического оборудования и соблюдения условий его эксплуатации;
- условий подготовки, сбора и хранения воды очищенной и соблюдения санитарной инструкции.
Зачастую для получения воды очищенной природная или водопроводная вода должна пройти одну или несколько стадий предварительной водоподготовки. Это связано с нестабильностью качества водопроводной или другой исходной воды (колодезной, артезианской, речной).
Требования к воде очищенной
В фармакопеях разных стран четко установлены требования к качеству очищенной воды.
Вода очищенная, также известная как Aqua Purificata, является важным сырьем. Она часто требуется в больших количествах, поэтому её производят в месте использования, непосредственно из доступной питьевой воды. Европейская фармакопея (Евр. Фарм.), а также Фармакопея США (Фарм.США) и Китайская фармакопея (Кит. Фарм.) устанавливают определенные пороговые значения качества очищенной воды в точке использования. В них четко указаны максимальные значения микробиологической нагрузки в виде колониеобразующих единиц, проводимости очищенной воды и количества органического углерода.
Она часто требуется в больших количествах, поэтому её производят в месте использования, непосредственно из доступной питьевой воды. Европейская фармакопея (Евр. Фарм.), а также Фармакопея США (Фарм.США) и Китайская фармакопея (Кит. Фарм.) устанавливают определенные пороговые значения качества очищенной воды в точке использования. В них четко указаны максимальные значения микробиологической нагрузки в виде колониеобразующих единиц, проводимости очищенной воды и количества органического углерода.
Дальновидные клиенты устанавливают ещё более жесткие требования к системам чистых сред для генераторов, чтобы показатели качества готовой продукции существенно превосходили пороговые значения. Это обеспечивает наличие достаточного запаса между системой чистой среды и точкой использования в случае достижения верхних пределов, требующих принятия мер, тем самым исключая потенциальный риск несоответствия. Поскольку проводимость изменяется из-за наличия CO2, также имеет смысл использовать такие меры, как например, CO2 ловушки для вентиляции резервуаров в системе хранения и распределения.
| USP | Ph. Eur. | ChP | ||
|---|---|---|---|---|
| ТОС | ppm C | ≤ 0.50 | ≤ 0.50 | Same as Ph. Eur. |
| Conductivity | µS/cm | ≤ 1.3 (25°C) | ≤ 4.3 (20°C) | Same as Ph. Eur. |
| Nitrate (NO3) | — | ≤ 0.2 ppm | ≤ 0.000006% | |
| Heavy metals | — | ≤ 0.1 ppm Pb | ≤ 0.00001% | |
| Aerobic bacteria | CFU/ml | ≤ 0.50 | ≤ 0.50 | Same as Ph. Eur. Eur. |
Российские стандарты Вода очищенная смотрите в ФС.2.2.0020.15
Продукты для производства воды очищенной, хранение при комнатной температуре и распределение
Компактные стандартизованные системы сочетают в себе все необходимые этапы процесса и технологии производства для надежного обеспечения высочайшего уровня безопасности в процессе эксплуатации. Каждая установка перед доставкой проходит полную проверку и аттестацию на заводе (FAT). Затем она проходит предварительную валидацию и поставляется вместе с полным пакетом документации.
Подробнее
OSMOTRON Pro
Установка самого высокого стандарта.
Подробнее
SEPTRONLine
Компактное и экономичное решение.
Подробнее
OSMOLine
Открытая стандартная компактная установка с автоматизацией высокого уровня.
Первоклассные технологии производства воды очищенной
Эксклюзивные решения BWT для фармацевтической и биотехнологической отрасли
Наша цель: Предоставить нашим клиентам самые лучшие решения. Вот почему мы постоянно работаем над улучшением процессов и технологий. Основное внимание мы уделяем качеству, безопасности, защите окружающей среды и рентабельности.
SEPTRON
Модули SEPTRON способствуют экологически безопасной деминерализации воды с низкой концентрацией ионов (фильтрат обратного осмоса).
- Электродеионизационный модуль предназначен для выработки ВО для фармацевтической промышленности.
- Бесшовная спиральная конструкция
- Корпус из нержавеющей стали 316 L
UV BEWADES
Высокое качество воды очищенной
Озон может применяться для безопасного хранения воды очищенной и ВДИ. Таким образом, емкость с озоном, представляющая микробиологическую опасность, становится полностью безопасной и контролируемой.
- Исключительно чистая вода. Без микробов и озона.
- Эффективная дезинфекция воды очищенной
- Простейшее решение для удаления озона из воды очищенной
AQU@Sense
Будущее мониторинга в микробиологии. Доступно уже сейчас.
Зачем тратить время впустую и 5 дней ждать анализа микробиологического качества очищенной воды, когда вы можете получить результат и отреагировать в течение часа?
- Постоянное наблюдение за микробиологическим качеством чистой воды.
- Подсчет количества клеток в минуту
- Онлайн/оффлайн измерения.
Часто задаваемые вопросы
Нет. Компания BWT активно участвует в EurO3zon в тесном сотрудничестве с участниками рынка.
Опыт, полученный в ходе реализации сотен проектов и тысяч систем, означает, что BWT предлагает широкий спектр стандартизированных устройств для производства ВО и ВДИ. Они отличаются надежностью, и их компоненты настроены надлежащим образом.
Установка разработана с учетом анализа химического состава воды. Основные статьи затрат включают индивидуальные требования клиентов и широкий спектр требований, которые выходят далеко за рамки технической целесообразности. Фармацевтические и биотехнологические отделы BWT также консультируют своих клиентов в этом секторе, с тем чтобы обеспечить наилучшее решение для удовлетворения требований к чистым средам.
В некоторых областях определенно да. Например, OSMOTRON Pro производительностью 3 м³/ч ВО может быть модернизирован при проведении планового технического обслуживания для производства до 6 м³/ч ВО в стандартных диапазонах. Однако физическим препятствием для замкнутых контуров является то, что только максимальное количество воды может проходить через определенный диаметр за определенный период времени. Вместе с BWT проектировщики и руководители проектов могут найти идеальное решение в отношении любых необходимых модификаций вместе со всеми необходимыми контурами.
Разумеется. Это демонстрируют тысячи установок для сотен клиентов. Если бы мы так не думали, мы бы просто не использовали его. Он используется для обработки воды на протяжении десятилетий. Постоянная концентрация озона 20–30 ppb эффективно и непрерывно предотвращает рост любых микробов, особенно в резервуарах ВО, которые без озона являются критически важными с микробиологической точки зрения. Озон подвергается УФ-излучению до тех пор, пока он не опустится ниже обнаруживаемого уровня, прежде чем вода достигнет контура на пути к точке использования. Периодически и автоматически проводится санитарная обработка озоном всей замкнутой системы.
Это демонстрируют тысячи установок для сотен клиентов. Если бы мы так не думали, мы бы просто не использовали его. Он используется для обработки воды на протяжении десятилетий. Постоянная концентрация озона 20–30 ppb эффективно и непрерывно предотвращает рост любых микробов, особенно в резервуарах ВО, которые без озона являются критически важными с микробиологической точки зрения. Озон подвергается УФ-излучению до тех пор, пока он не опустится ниже обнаруживаемого уровня, прежде чем вода достигнет контура на пути к точке использования. Периодически и автоматически проводится санитарная обработка озоном всей замкнутой системы.
Да. Каждая используемая технологическая операция имеет определенные рабочие параметры, которые необходимо соблюдать. Это важно для обеспечения ожидаемого качества продукции, а также для длительного срока службы системы и компонентов. Ожидаются ли колебания уровня подаваемой воды, например, по причине сезонных колебаний или различных источников подачи, или даже комбинации нескольких фактов? В связи с этим каждый проект идеальной системы начинается с тщательного и полного анализа химического состава воды.
Вот почему так важны общее количество и состав различных компонентов. В отдельных случаях они взаимно воздействуют в технологическом процессе. Хлор, кремний, железо, отвердители, взвешенные осадки, микробиология, растворенные газы, индекс плотности взвешенных частиц и температура играют исключительно важную роль.
Вода очищенная, вода для инъекций, чистые среды. Последние изменения в нормативных требованиях. Как успешно пройти инспекцию — ИНЖЕНЕРНАЯ ПРАКТИКА — 6/2021 (86) ноябрь-декабрь — 2021 — Архив
Вода очищенная, вода для инъекций, чистые среды. Последние изменения в нормативных требованиях. Как успешно пройти инспекцию
Последние пять лет на различных уровнях широко обсуждаются вопросы, связанные с чистыми технологическими носителями. В частности, было много дискуссий об условиях допущения холодного метода получения воды для инъекций.
В 2020 году ISPE выпустило документ «Критические утилиты GMP Compliance. Как соответствовать требованиям и быть готовыми это доказать. (Требования GMP к чистым средам. Как соответствовать и как доказать соответствие)». Этот документ подводит промежуточные итоги и обобщает все актуальные аспекты данной проблематики, а также имеет прикладное значение. Из самого названия документа следует, что важно не только соответствовать требованиям GMP, но и уметь доказать инспектору соответствие.
Как соответствовать требованиям и быть готовыми это доказать. (Требования GMP к чистым средам. Как соответствовать и как доказать соответствие)». Этот документ подводит промежуточные итоги и обобщает все актуальные аспекты данной проблематики, а также имеет прикладное значение. Из самого названия документа следует, что важно не только соответствовать требованиям GMP, но и уметь доказать инспектору соответствие.
Давайте посмотрим, с каким опытом мы подошли к новому, самому актуальному на сегодняшний день документу, тем более что он часто применяется наряду с правильными действующими нормативами и рекомендациями.
-
Конечно же сразу следует посмотреть российскую фармакопею. Для нас в первую очередь имеют значение статьи о воде очищенной и воде для инъекций Государственной фармакопеи РФ, во вторую очередь – аналогичные статьи Европейской фармакопеи. Кроме того, конечно, важна американская USP, действующая по меньшей мере в 160 странах мира. Есть и другие стандарты, в том числе международная фармакопея, выпущенная ВОЗ для стран, которые не имеют возможности создать свою фармакопею, но, по всей видимости, влияют минимально на международную фармакопею, несмотря на её впечатляющее название. Все фармакопеи регулярно пересматривают статьи о воде очищенной и воде для инъекций, но кардинальных отличий между этими статьями нет.
Есть и другие стандарты, в том числе международная фармакопея, выпущенная ВОЗ для стран, которые не имеют возможности создать свою фармакопею, но, по всей видимости, влияют минимально на международную фармакопею, несмотря на её впечатляющее название. Все фармакопеи регулярно пересматривают статьи о воде очищенной и воде для инъекций, но кардинальных отличий между этими статьями нет.
После 2019 года уже можно говорить, что промежуточный тип «вода высокоочищенная» уходит в историю и остаётся два основных типа воды: «очищенная» и «для инъекций». Наличие ультрачистой воды в Бразильской фармакопее и градацию воды очищенной на два типа в Фармакопее Мексики следует считать, скорее всего, спецификой, но не общей тенденцией. С удовлетворением можно отметить, что из российской фармакопеи исключены требования к показателю рН, с чем ранее было связано немало недоразумений из-за невозможности на практике измерять рН в среде с низкой электропроводностью. На сегодняшний день требования к рН воды, соответствующей требованиям фармакопеи, сохраняются только в фармакопеях Китая и Мексики (наверное, точнее будет полагать, что они в них пока не отменены).
-
Правила GMP Европейского союза (Приложение 15) содержат основные положения о принципах производства и хранения воды для фармацевтических целей, при этом в этих приложениях мало конкретики. Но, например, в российских правилах GMP определена температура хранения воды для инъекций.
«Руководство о качестве воды для фармацевтических целей» Европейского агентства по лекарственным средствам (-European Medicines Agency — EMA) содержит информацию о технологии получения воды для фармацевтических целей и о том, в каких процессах вода какого качества необходима. Положения данного руководства переплетены с монографией «Вода для инъекций» Европейской фармакопеи (Ph. Eur. Monograph Water for Injections (0169), EMA), которая была пересмотрена в 2017 году в пользу возможности использования холодного метода. Однако допущение холодного метода не следует расценивать как послабление, и этот вывод можно сделать из обсуждения, которое предшествовало изменению монографии («Производство ВДИ холодными методами: вопросы и ответы. Обратный осмос: биопленки и их предотвращение», EMA.) Из данного обсуждения, а также из многих последующих дискуссий о подготовке воды для инъекций холодным методом можно сделать однозначный вывод, что разрешение этого метода вызвано никак не снижением рисков, оно также не является следствием отсутствия прорыва в мембранных технологиях. В качестве обоснований этого решения можно называть дефицит энергоресурсов и достигнутый высокий уровень систем контроля и мониторинга. Поэтому применение холодного метода производства воды для инъекций каждый раз требует детального изучения и разрешения уполномоченных органов. При этом можно сказать, что лидеры рынка придерживаются консервативных позиций и не отказываются от дистилляции.
Обратный осмос: биопленки и их предотвращение», EMA.) Из данного обсуждения, а также из многих последующих дискуссий о подготовке воды для инъекций холодным методом можно сделать однозначный вывод, что разрешение этого метода вызвано никак не снижением рисков, оно также не является следствием отсутствия прорыва в мембранных технологиях. В качестве обоснований этого решения можно называть дефицит энергоресурсов и достигнутый высокий уровень систем контроля и мониторинга. Поэтому применение холодного метода производства воды для инъекций каждый раз требует детального изучения и разрешения уполномоченных органов. При этом можно сказать, что лидеры рынка придерживаются консервативных позиций и не отказываются от дистилляции.
-
По сей день широко используется и цитируется Руководство по испытаниям систем фармакопейной воды (FDA, Guide to Inspections of High Purity Water System, 1993). Формально этот документ предназначен для инспекторов, но он содержит ряд положений по проектированию и эксплуатации систем. Создатели нового документа по чистым средам подчеркивают, что с 1993 года уже накопился колоссальный опыт инспекций, который следует обобщить и проанализировать. Новый документ содержит Приложение 1, в котором приведены актуальные примеры заключений по результатам инспекций с описанием наиболее часто выявляемых несоответствий.
Создатели нового документа по чистым средам подчеркивают, что с 1993 года уже накопился колоссальный опыт инспекций, который следует обобщить и проанализировать. Новый документ содержит Приложение 1, в котором приведены актуальные примеры заключений по результатам инспекций с описанием наиболее часто выявляемых несоответствий.
-
Выход третьей версии Руководства по воде и чистому пару (Baseline Guide Vol 4: Water & Steam Systems 3rd Edition. ISPE, 2019) был ожидаем в свете изменения нормативов. Этот документ достаточно детально рассматривает все аспекты проектирования. В нём приводятся типовые схемы производства и распределения воды фармакопейного качества, общие требования к конструкции различных элементов.
-
Технический доклад ВОЗ «Вода для фармацевтического применения» (WHO Technical Report Series, No. 970, 2012) наиболее часто цитируется, когда говорится о качестве воды, пригодной как сырьё для производства воды фармакопейного качества и, в принципе, о минимальном качестве воды на фармацевтическом производстве.
В «Critical Utilities GMP Compliance. How to be Compliant and Ready to Prove It» (далее – Документ) обзор и классификация чистых технологических носителей начинается именно с питьевой воды.
Чистые носители (по определению) — это среды, которые прямо или опосредованно соприкасаются с продуктом. Питьевую воду не принято относить к чистым средам, но она может применяться в производстве фармацевтических субстанций. Кроме того, именно питьевая вода является сырьём для производства воды, соответствующей требованиям фармакопеи, а значит её качество должно контролироваться. По правилам GMP сертификат соответствия для любого сырья никогда не должен приниматься без проверки. Поэтому фармацевтическому предприятию целесообразно периодически проверять соответствие питьевой воды нормативным требованиям. Это включает в себя отбор проб питьевой воды на производстве в одном или нескольких местах. Количество мест и частота отбора проб должны определяться на основе анализа риска. Если вода не соответствует нормам, должно устанавливаться оборудование для её доочистки с системой контроля. Даже для питьевой воды, соответствующей нормативным требованиям, указывается на необходимость проводить её предочистку перед основными стадиями производства воды фармакопейного качества. Предочистка питьевой воды позволяет также снизить нагрузку на основное оборудование и уменьшить периодичность его сервиса. Правильное техническое обслуживание и надлежащая эксплуатация оборудования для предварительной очистки воды помогают обеспечить оптимальное функционирование всей системы подготовки воды и снизить риски наступления негативных событий.
Если вода не соответствует нормам, должно устанавливаться оборудование для её доочистки с системой контроля. Даже для питьевой воды, соответствующей нормативным требованиям, указывается на необходимость проводить её предочистку перед основными стадиями производства воды фармакопейного качества. Предочистка питьевой воды позволяет также снизить нагрузку на основное оборудование и уменьшить периодичность его сервиса. Правильное техническое обслуживание и надлежащая эксплуатация оборудования для предварительной очистки воды помогают обеспечить оптимальное функционирование всей системы подготовки воды и снизить риски наступления негативных событий.
Вода очищенная используется на финишных стадиях производства парентеральных нестерильных препаратов. Она производится из питьевой воды с применением технологий обратного осмоса и/или электродеионизации. Вода для инъекций применяется там, где есть требования к стерильности и/или апирогенности продукта. Поэтому основным отличием воды для инъекций является наличие требования к апирогенности и низкое содержание в ней микроорганизмов.
Поэтому основным отличием воды для инъекций является наличие требования к апирогенности и низкое содержание в ней микроорганизмов.
Вода для инъекций обычно производится из воды очищенной, но нормативно это закреплено только в фармакопеях Индии и Китая. Наиболее распространённым методом получения воды для инъекций является дистилляция, однако с 2017 года допущен и широко применяется холодный метод – его нет только в Китайской, Бразильской и Международной фармакопеях. Таким образом можно считать, что Китайская фармакопея наиболее консервативна в отношении воды для инъекций.
Чистые среды
Чистым паром (по определению) является пар, конденсат которого соответствует требованиям к воде для инъекций. В Документе отмечено, что в силу нахождения чистого пара в условиях постоянной стерильности допускается отсутствие его контроля по микробиологическим показателям, однако требуется контроль содержания эндотоксинов. Чистый пар применяется для стерилизации продукта и материалов, реакторов и сборников, критичных емкостей. Также в Документе подчеркнуто, что в фармакопеях нет требований к сухости, насыщенности чистого пара и к содержанию в нём неконденсирующихся газов, однако такие требования определены в стандарте EN 285 и в британском стандарте HTM. Эти параметры иногда требуется контролировать на входе в автоклавы, для чего в проект нужно закладывать специальные экзокинетические узлы.
Чистый пар применяется для стерилизации продукта и материалов, реакторов и сборников, критичных емкостей. Также в Документе подчеркнуто, что в фармакопеях нет требований к сухости, насыщенности чистого пара и к содержанию в нём неконденсирующихся газов, однако такие требования определены в стандарте EN 285 и в британском стандарте HTM. Эти параметры иногда требуется контролировать на входе в автоклавы, для чего в проект нужно закладывать специальные экзокинетические узлы.
Сжатый воздух применяется на фармацевтическом производстве для подачи в камеры стерилизаторов, для компенсации давления в ёмкостях и трубопроводах при остывании после стерилизации, для передавливания продукта, для продувки и сушки оборудования после мойки, для подачи воздуха в ферментёры.
Сжатый воздух производится, как правило, на безмасляных компрессорах и классифицируется согласно стандарту ISO 8573 по содержанию масел, частиц и влаги. Класс воздуха определяется в каждом конкретном случае, так же как необходимость установки фильтров и проведения контроля содержания микроорганизмов. Не стоит забывать, что даже если воздух не участвует в процессе и предназначен для подачи на блок управления, то после отработки он может попасть в чистое классифицируемое помещение.
Не стоит забывать, что даже если воздух не участвует в процессе и предназначен для подачи на блок управления, то после отработки он может попасть в чистое классифицируемое помещение.
Технологические газы, такие как кислород, азот, углекислый газ тоже включены в перечень чистых сред. Например, азот может применяться для защиты от окисления в процессе ферментации. Если газы поставляются в баллонах, они должны проверяться столь же тщательно, как и любое другое сырье. В ходе анализа рисков рекомендуется оценить критическое качество газа, места установки и тип фильтров, материал трубопроводов, подлежащие контролю параметры.
В Документе сказано, что воздух системы кондиционирования формально тоже можно отнести к чистым средам, однако традиционно эта система выделена в самостоятельный раздел.
Следующий раздел Документа посвящён вопросам валидации и системе контроля качества. Здесь отмечается необходимость проведения валидации с учётом требований ISPE Baseline® Guide, volume 5 «Commissioning and Qualification» и ISPE Good Practice Guide: Approaches to Commissioning and Qualification of Pharmaceutical Water and Steam Systems (Базовое руководство® ISPE, том 5 «Ввод в эксплуатацию и квалификация» и Руководство ISPE по надлежащей практике: подходы к вводу в эксплуатацию и к квалификации фармацевтических систем воды и пара).
Оценка рисков
Cоздание любой новой установки (или модификация существующей) должно начинаться с плана валидации и заканчиваться подробным сводным отчётом о валидации, сопровождаемым матрицей прослеживаемости требований.
В ходе инспекции важно предъявить: оценку рисков, объём валидации, протоколы квалификации оборудования, доказательство соответствия системы заранее установленным критериям, план отбора проб, СОП, программы обучения и тренингов.
В рамках контроля изменений необходимо контролировать изменения не только в оборудовании и технологическом процессе, но и в документации (например, в СОП).
Оценка риска должна основываться на научных знаниях и в итоге увязываться с защитой пациента. Оценка риска также должна проводиться согласно требованиям соответствующего документа ISPE Baseline® Guide, Volume 7 «Risk-Based Manufacture of Pharmaceutical Products» (Базовое руководство® ISPE, том 7 «Производство фармацевтической продукции с учётом рисков»). В Документе дана оценка каждому потенциальному загрязнению, например: наличие общего органического углерода говорит о присутствии среды для роста и о развитии микроорганизмов; наличие хлора вызывает разрушение мембран; высокая электропроводность свидетельствует о присутствии солей, способных влиять на технологический процесс. Упоминается, конечно, и сезонное изменение состава исходной воды, и риск возникновения роуг-эффекта (rouge effect), вероятность которого следует минимизировать.
В Документе дана оценка каждому потенциальному загрязнению, например: наличие общего органического углерода говорит о присутствии среды для роста и о развитии микроорганизмов; наличие хлора вызывает разрушение мембран; высокая электропроводность свидетельствует о присутствии солей, способных влиять на технологический процесс. Упоминается, конечно, и сезонное изменение состава исходной воды, и риск возникновения роуг-эффекта (rouge effect), вероятность которого следует минимизировать.
Подчёркивается необходимость наличия актуальных чертежей систем. Очень важно представить инспектору как можно более подробную и принципиальную схему. Все компоненты на чертежах должны быть идентифицированы и соответствовать актуальной спецификации. В документации должны присутствовать допустимые значения критических параметров (например, уровень наполнения ёмкостей, скорость потока, температура в разных точках системы и на фильтрах при разных режимах). Также должны отображаться соединения с указанием типа уплотнений.
Изометрические схемы должны подтверждать безопасность санации и стерилизации системы.
Электросхемы запрашиваются инспекторами нечасто, но это не повод не уделять им внимания. Электросхемы важны для эксплуатации и часто требуются для устранения неисправностей.
Документ указывает на необходимость проведения расследования каждого отклонения. К отклонениям относятся как выходы значения параметров за установленные пределы, так и несоответствия в порядке проведения процедур (например, пропущенные калибровки либо ошибочные операции, скажем, неправильная установка уплотнений или шлангов). Необходимо определить, имеет ли отклонение тенденции, и помимо немедленных действий предпринять корректирующие и предупреждающие действия. Например, при разрыве мембраны безопасности ёмкости немедленными действиями являются замена мембраны и санация, а корректирующими – снижение максимальной уставки давления в ёмкости, предупреждающими – применение более плавного режима набора температуры.
В Документе отмечено, что отбор проб является критичным, и при инспекциях ему уделяют внимание. Необходимо определить места отбора проб так, чтобы он был репрезентативным и не добавлял рисков. В точках отбора необходимо реализовать принцип репрезентативности: отбор проб должен производиться в тех же условиях, в которых среда подаётся на производство. Много нюансов возникает при использовании шлангов, и в приложении к Документу описаны конкретные эпизоды, имевшие место при инспектировании. Необходимо понимать разницу между точкой отбора и точкой присоединения к процессу, а зона между этими точками зачастую остаётся без внимания и создаёт много рисков.
Также в Документе уделено внимание новым экспресс-методам микробиологического анализа, при этом указано на сложность валидации этих методов как полноценного микробиологического контроля. Это подтверждается и фармацевтическим рынком, который стоит на консервативных позициях.
Раздел Документа, посвящённый эксплуатации, начинается с вопроса целостности данных. Необходимость соответствия GAMP 5, 21 CFR Part 11 и применение компьютерной валидации в настоящее время является трендом. Необходимы разграничение доступа и отслеживание всех действий с системами автоматизации (при этом права администратора должны быть доступны строго ограниченному кругу пользователей). Предприятие должно иметь политику хранения данных. Ожидается дальнейшее ужесточение требований, поэтому следует ожидать полного отказа от хранения данных на бумаге. Данные по чистым средам рекомендуется хранить 10-30 лет. Аудит системы хранения данных следует проводить раз в 1-3 года.
Необходимость соответствия GAMP 5, 21 CFR Part 11 и применение компьютерной валидации в настоящее время является трендом. Необходимы разграничение доступа и отслеживание всех действий с системами автоматизации (при этом права администратора должны быть доступны строго ограниченному кругу пользователей). Предприятие должно иметь политику хранения данных. Ожидается дальнейшее ужесточение требований, поэтому следует ожидать полного отказа от хранения данных на бумаге. Данные по чистым средам рекомендуется хранить 10-30 лет. Аудит системы хранения данных следует проводить раз в 1-3 года.
Эпиграфом к разделу, посвящённому санации, является цитата из GMP Канады: «Эксплуатируйте систему так, чтобы избежать загрязнения». Можно пойти дальше и добавить: «Проектируйте и стройте систему так, чтобы избежать загрязнения». Если система нуждается в регулярной санации – это плохая система. Хорошая система распределения воды, соответствующей требованиям фармакопеи, должна обладать свойством самоочищения. Но в любом случае следует предусмотреть возможность санации как восстановительную меру. И необходимо предоставлять инспекторам доказательства эффективности процедуры санации (например, записи с температурных датчиков в процессе стерилизации). Если в системе образуется биоплёнка, необходимо не только её удалить, но и разобраться с причинами её образования.
Но в любом случае следует предусмотреть возможность санации как восстановительную меру. И необходимо предоставлять инспекторам доказательства эффективности процедуры санации (например, записи с температурных датчиков в процессе стерилизации). Если в системе образуется биоплёнка, необходимо не только её удалить, но и разобраться с причинами её образования.
Техническое обслуживание должно проводиться согласно утверждённому плану, в установленные сроки и должным образом документироваться. Следует иметь склад запчастей и утвердить процедуру определения необходимости замены (например, модули электродеионизации меняют при падении силы тока либо по истечении определённого времени или при достижении установленного количества часов отработки). Можно также устанавливать минимум по каждому параметру и использовать принцип «что наступит раньше».
При определении периодичности калибровки приборов следует учитывать рекомендации изготовителя прибора и уровень надёжности измерений, основанный на анализе рисков. Результаты калибровки должны быть задокументированы, срок истечения калибровки должен отслеживаться. Датчики электропроводности должны калиброваться без компенсации температуры. На наших фармацевтических предприятиях часто используется периодическая поверка приборов, что, в принципе, не противоречит политике рискориентированного подхода.
Результаты калибровки должны быть задокументированы, срок истечения калибровки должен отслеживаться. Датчики электропроводности должны калиброваться без компенсации температуры. На наших фармацевтических предприятиях часто используется периодическая поверка приборов, что, в принципе, не противоречит политике рискориентированного подхода.
Система обучения подразумевает наличие должностных инструкций, создание учебного плана, проведение и документирование обучения, периодическую актуализацию программы обучения и системы обучения для обеспечения его эффективности.
В заключительной главе Документа речь идёт об устаревших системах чистых сред, требующих доведения до стандартов GMP. Отмечается, что с системами чистых газов проблем меньше, так как за последние 20 лет нормативы для чистых газов претерпели меньше изменений, чем нормативы для воды, соответствующей требованиям фармакопеи. Проблемой в старых системах чаще всего является невозможность поддерживать микробиологическую чистоту и отсутствие должного уровня автоматизации. Старые системы распределения, как правило, выполнены из непригодных материалов и содержат застойные зоны. На старые системы отсутствует какая-либо валидационная документация. Некоторые из них можно исправить, доукомплектовать и провалидировать. Некоторые системы можно эксплуатировать при регулярном выполнении процедур санации и стерилизации. Стоит ли продолжать эксплуатировать такую систему или лучше её заменить? С одной стороны, это вопрос издержек, но, с другой стороны, следуя интересам пациента, всегда предпочтительно переходить на новые системы, соответствующие GMP.
Старые системы распределения, как правило, выполнены из непригодных материалов и содержат застойные зоны. На старые системы отсутствует какая-либо валидационная документация. Некоторые из них можно исправить, доукомплектовать и провалидировать. Некоторые системы можно эксплуатировать при регулярном выполнении процедур санации и стерилизации. Стоит ли продолжать эксплуатировать такую систему или лучше её заменить? С одной стороны, это вопрос издержек, но, с другой стороны, следуя интересам пациента, всегда предпочтительно переходить на новые системы, соответствующие GMP.
Часто задаваемые вопросы: Вода для фармацевтических и аналитических целей
1. Почему в монографиях по очищенной воде и воде для инъекций нет микробиологических требований?
Из-за различного использования этих вод микробиологические требования не включены в эти монографии, так как это излишне обременит некоторых пользователей бессмысленными и/или несущественными или неуместными требованиями, например. вода, используемая для многих лабораторных анализов. Руководства по микробам представлены в информационной главе 9.0005 Вода для фармацевтических целей <1231> , где указано, что пользователь должен установить внутрифирменные спецификации или пригодность для использования микробных уровней, выше которых вода непригодна для использования.
вода, используемая для многих лабораторных анализов. Руководства по микробам представлены в информационной главе 9.0005 Вода для фармацевтических целей <1231> , где указано, что пользователь должен установить внутрифирменные спецификации или пригодность для использования микробных уровней, выше которых вода непригодна для использования.
2. Какова цель микробных уровней предупреждения и действия для очищенной воды и воды для инъекций?
Уровни предупреждения и действия являются терминами управления технологическим процессом и должны быть установлены на уровнях, указывающих на тенденцию водной системы, выходящую за пределы нормального диапазона микробного контроля. Эти уровни должны быть установлены на уровне не выше, а предпочтительно ниже уровней, перечисленных в 9.0005 Вода для фармацевтических целей <1231> на основе нормальных тенденций микробной активности в вашей системе водоснабжения. Уровни оповещения и действия предназначены для запуска дополнительных, нестандартных, а не рутинных мер микробного контроля. Эти дополнительные меры контроля должны предотвращать присутствие в воде нежелательных уровней и типов микроорганизмов в зависимости от использования воды.
Эти дополнительные меры контроля должны предотвращать присутствие в воде нежелательных уровней и типов микроорганизмов в зависимости от использования воды.
3. Для автономного тестирования образцов воды на проводимость воды и общее содержание органического углерода, как долго я могу хранить образцы перед тестированием?
Фармакопея США не дает конкретного ответа на этот вопрос. Понятно, что некоторые производители проводят анализы в сторонних лабораториях, что может занять несколько дней или больше. По этой причине нет ограничения по времени.
В общем, можете ждать сколько хотите — на свой страх и риск. Но рекомендуется проверить как можно скорее по следующим причинам; 1) при хранении чистота воды со временем только ухудшается. Начиная с Очищенная вода , Вода для инъекций или стерильная вода имеет такую высокую чистоту, что с течением времени ничего не происходит, кроме потенциальной деградации образца из-за факторов окружающей среды, окружающей среды или контейнера; и 2) вода обычно не производится партиями, а обычно очищается, производится и потребляется непрерывно. Вода могла иметь прямое воздействие или контакт с продуктом до того, как был проведен какой-либо лабораторный анализ. Задержки в тестировании только увеличивают степень потенциального воздействия продукта — в случае неудачного тестирования.
Вода могла иметь прямое воздействие или контакт с продуктом до того, как был проведен какой-либо лабораторный анализ. Задержки в тестировании только увеличивают степень потенциального воздействия продукта — в случае неудачного тестирования.
4. Как следует хранить образцы для автономного тестирования проб воды для общих глав «Проводимость воды» и «Общий органический углерод»?
Для лабораторных анализов образцы должны храниться в контейнерах, которые не повлияют отрицательно на результаты анализа. Это делается для предотвращения ложных срабатываний и ненужных расследований. Например, хранение воды в стеклянном сосуде в течение нескольких часов, как правило, хорошо, но хранение в течение более длительного времени приведет к незначительному увеличению проводимости образца. Это связано с выщелачиванием силиката натрия из стекла, повышением рН и проводимости воды и угрозой выхода из строя Проводимость воды <645> . Как правило, чистые пластиковые контейнеры являются лучшим выбором для длительного хранения образцов для испытаний на проводимость воды <645> . Для Total Organic Carbon <643> есть аналогичное обоснование — достаточно многих типов нераспадающихся пластиков или стекла. Как правило, для этих химических тестов лучше всего подходит хранение при температуре окружающей среды или в холодильнике, тогда как для образцов, используемых в микробиологических тестах, рекомендуется хранение в холодильнике. Чистота любого контейнера очень важна. Из-за очень высокой чистоты этих вод необходимо избегать отпечатков пальцев, мыла и других остатков. Возможны ложные срабатывания.
Для Total Organic Carbon <643> есть аналогичное обоснование — достаточно многих типов нераспадающихся пластиков или стекла. Как правило, для этих химических тестов лучше всего подходит хранение при температуре окружающей среды или в холодильнике, тогда как для образцов, используемых в микробиологических тестах, рекомендуется хранение в холодильнике. Чистота любого контейнера очень важна. Из-за очень высокой чистоты этих вод необходимо избегать отпечатков пальцев, мыла и других остатков. Возможны ложные срабатывания.
5. Могу ли я провести онлайн-тестирование проводимости воды и общего содержания органического углерода?
В этих двух главах конкретно указано, что эти тесты могут выполняться как в автономном, так и в оперативном режиме. У каждого подхода есть свои преимущества и недостатки, и они более подробно описаны в этих главах и в документе «Вода для фармацевтических целей» <1231> . В целом, онлайн-тестирование позволяет избежать риска загрязнения автономных образцов людьми, контейнерами или окружающей средой и обеспечивает немедленный анализ и прямые возможности для контроля, принятия решений и вмешательства в реальном времени. Например, вы можете постоянно тестировать и принимать воду (для этих химических свойств). И наоборот, вы можете предотвратить распространение воды в случае неудачного теста в режиме реального времени. Однако для объекта с несколькими типами воды и контуров централизованная система лабораторного анализа может оказаться более экономичным выбором. В любом случае проба воды должна быть репрезентативной для воды, используемой в производстве.
Например, вы можете постоянно тестировать и принимать воду (для этих химических свойств). И наоборот, вы можете предотвратить распространение воды в случае неудачного теста в режиме реального времени. Однако для объекта с несколькими типами воды и контуров централизованная система лабораторного анализа может оказаться более экономичным выбором. В любом случае проба воды должна быть репрезентативной для воды, используемой в производстве.
6. Каков предел общего органического углерода (TOC) для очищенной воды и воды для инъекций?
Существует «целевой предел отклика» 500 мкг углерода/л. Истинным пределом является реакция системы измерения TOC на раствор 500 мкг углерода/л (приготовленный из сахарозы), Rs, с поправкой на реакцию на реагентную воду, Rw. Этот предел равен Rs – Rw. Фактическое число будет варьироваться в зависимости от вашего эталонного стандартного раствора, вашего оборудования, фонового углерода и т. д. Для использования требуются эталонные стандарты USP.
7. Как часто я должен проводить тест на пригодность системы в Общей главе по общему органическому углероду?
USP General Chapter <643> преднамеренно ничего не говорит о том, как часто следует проводить тест на пригодность системы (SST). Причина в том, что эта частота зависит от стабильности отклика прибора на общий органический углерод (TOC) и других факторов, связанных с качеством воды и риском. Если ТОС качественной системы водоснабжения очень низкий, скажем, <20 частей на миллиард, то многие предпочитают уменьшить частоту тестирования из-за меньшего риска. Стабильность различных технологий измерения ООУ может изменяться в течение продолжительных периодов времени. Производитель прибора может проконсультировать пользователя по этому вопросу, и опыт пользователя также может быть полезен при определении подходящей частоты. Другим фактором является риск получения несоответствующего результата теста на пригодность системы, поскольку результат Rs-Rw, используемый в этом расчете, является предельным откликом для прибора, решающим значением «годен/не годен» для теста TOC. Если получен несоответствующий тест на пригодность системы, это подразумевает неточность всех результатов теста TOC с момента предыдущего успешного теста на пригодность системы. По этой причине многие пользователи предпочитают выполнять тест на пригодность системы чаще, чем можно предположить по стабильности отклика прибора TOC, просто чтобы свести к минимуму влияние возможного несоответствующего результата. Вот почему водная система с обычно низким содержанием общего органического углерода подвергается меньшему риску, даже при отказе SST. Если SST дает сбой, необходимы некоторые меры по исправлению положения для повторной настройки прибора, замены лампы или других способов улучшения прибора. Но даже 50-процентная ошибка мало повлияет на прошлые показания TOC (поскольку показания, даже с этой ошибкой, очень низкие по сравнению с пределом). В водной системе с высоким содержанием общего органического углерода выход из строя SST, возможно, более критичен. Это зависит от риска, на который готов пойти пользователь, зная историческую стабильность своего инструмента и другие факторы.
Если получен несоответствующий тест на пригодность системы, это подразумевает неточность всех результатов теста TOC с момента предыдущего успешного теста на пригодность системы. По этой причине многие пользователи предпочитают выполнять тест на пригодность системы чаще, чем можно предположить по стабильности отклика прибора TOC, просто чтобы свести к минимуму влияние возможного несоответствующего результата. Вот почему водная система с обычно низким содержанием общего органического углерода подвергается меньшему риску, даже при отказе SST. Если SST дает сбой, необходимы некоторые меры по исправлению положения для повторной настройки прибора, замены лампы или других способов улучшения прибора. Но даже 50-процентная ошибка мало повлияет на прошлые показания TOC (поскольку показания, даже с этой ошибкой, очень низкие по сравнению с пределом). В водной системе с высоким содержанием общего органического углерода выход из строя SST, возможно, более критичен. Это зависит от риска, на который готов пойти пользователь, зная историческую стабильность своего инструмента и другие факторы.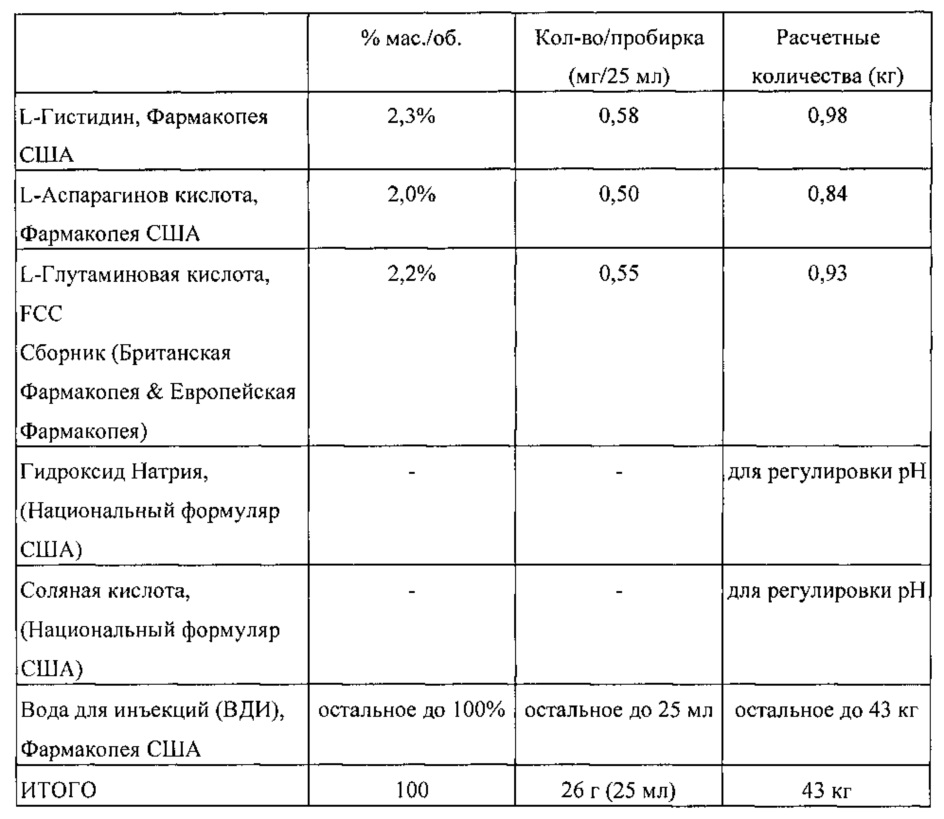 Следовательно, Общий органический углерод <643> ничего не говорит о частоте проведения теста на пригодность системы, поскольку решение о целесообразности остается за пользователем.
Следовательно, Общий органический углерод <643> ничего не говорит о частоте проведения теста на пригодность системы, поскольку решение о целесообразности остается за пользователем.
8. Как долго я могу хранить и повторно использовать эталонные стандартные растворы, приготовленные для проверки пригодности системы Total Organic Carbon?
Если в USP ничего не говорится об условиях хранения и стабильности приготовленных эталонных растворов общего органического углерода (TOC), растворы должны быть 1) приготовлены свежими или 2) использованы в течение истечения срока годности, если они приобретены у стороннего поставщика, или 3) использованы в течение временные рамки, определенные исследованиями стабильности. Во всех случаях указан справочный материал USP. Несколько факторов могут влиять на стабильность эталонных стандартных растворов. К ним относятся температура, свет, кислород, микробное разложение и адсорбция на поверхности контейнера. Помутнение, дополнительная окраска или изменение характеристик по сравнению со свежеприготовленными растворами являются индикаторами нестабильности. Большинство поставщиков решений указывают сроки годности. Но на практике концентрированные эталонные стандартные растворы сахарозы хранятся 3-6 месяцев, а аналогичные растворы 1,4-бензохинона (пБХ) — около 2 месяцев, при условии, что они хранятся при соответствующих температурах в соответствующих контейнерах и защищены от света (для пБК). Рекомендуется использовать охлаждение, так как это замедляет разложение раствора и снижает рост микробов, особенно в растворе сахарозы.
Большинство поставщиков решений указывают сроки годности. Но на практике концентрированные эталонные стандартные растворы сахарозы хранятся 3-6 месяцев, а аналогичные растворы 1,4-бензохинона (пБХ) — около 2 месяцев, при условии, что они хранятся при соответствующих температурах в соответствующих контейнерах и защищены от света (для пБК). Рекомендуется использовать охлаждение, так как это замедляет разложение раствора и снижает рост микробов, особенно в растворе сахарозы.
9. Какова основная причина добавления KCl в тест на проводимость воды для измерения pH?
На этапе 3 добавляется нейтральный электролит (KCl) для увеличения ионной силы и точного измерения pH раствора. Если ионная сила раствора не увеличивается, измерение pH будет очень нестабильным и неточным. Таким образом, KCl добавляется для достоверного измерения pH в рамках теста Water Conductivity <645> — Stage 3. Увеличение ионной силы необходимо для обеспечения минимального градиента концентрации на диафрагме/переходе рН-электрода. Большой градиент концентрации приводит к отсутствию равновесия и нестабильной реакции pH.
Большой градиент концентрации приводит к отсутствию равновесия и нестабильной реакции pH.
10. Могу ли я начать со 2-го этапа для определения проводимости воды или мне нужно начинать со 1-го этапа?
Нет необходимости выполнять этапы 1 и 2 по порядку. Вы можете сразу перейти к этапу 2, если предпочитаете автономное тестирование — вам не нужно сначала проваливать этап 1.
11. Является ли требование к ячейке проводимости постоянным ±2% от номинального значения?
Точность постоянной ячейки должна составлять ±2% от сертифицированного значения, а не от номинального значения.
12. Что такое «подходящий контейнер» для автономного определения электропроводности?
В целом, подходит любой материал, который не оказывает заметного влияния на проводимость. Подходят многие пластиковые контейнеры, включая PTFE, HDPE, LDPE и некоторые поликарбонаты. Подходят стеклянные контейнеры для немедленного тестирования. Независимо от материала, они должны быть чистыми и не содержать чистящих средств, таких как мыло. Мыло очень электропроводно.
Мыло очень электропроводно.
13. Нет тестов на рН, нитраты или тяжелые металлы? Это правильно?
Да, это правильно. Тестов на нитраты для воды USP никогда не проводилось. Тест на тяжелые металлы в водах USP был удален в 1996. Тест pH был исключен в 1998 году. [Примечание. Измерение pH (не тест) проводится как часть этапа 3 теста для Water Conductivity <645> , но это все еще тест на предел проводимости]. Обратите внимание, что вы не можете не соответствовать прежним характеристикам pH воды (pH 5,0–7,0), если вы соответствуете требованиям по проводимости. Вы также не можете пройти тест на тяжелые металлы или тест на нитраты, если вы прошли тест на электропроводность и ваша система водоснабжения запускается с водой, соответствующей требованиям для одной из питьевых вод, указанных в монографиях (для США, ЕС, Японии или ВОЗ). В некоторых случаях эти тесты могут требоваться другой фармакопеей.
14. Могу ли я предоставить воду для использования, проведя микробиологические испытания воды из порта отбора проб?
Вы можете это сделать, но только при определенных обстоятельствах. Микробное качество воды в системе, отражаемое водой из этого отверстия для отбора проб, может быть лучше, чем качество, которое доставляется к месту использования (POU) во время производственного использования. Это происходит из-за микробного загрязнения воды в системе, которое может произойти при ее перемещении из выходов системы в POU. Именно качество воды, ПОСТАВЛЯЕМОЙ из системы в ПОУ, влияет на продукты и другие виды использования.
Микробное качество воды в системе, отражаемое водой из этого отверстия для отбора проб, может быть лучше, чем качество, которое доставляется к месту использования (POU) во время производственного использования. Это происходит из-за микробного загрязнения воды в системе, которое может произойти при ее перемещении из выходов системы в POU. Именно качество воды, ПОСТАВЛЯЕМОЙ из системы в ПОУ, влияет на продукты и другие виды использования.
Если у вас надлежащая практика водопользования, так что количество микробов в порту для отбора проб практически такое же, как и в ПМ при доставке в соответствии с практикой производственного использования, то существует риск того, что подсчет микробов в порту для отбора проб ложно отражает качество доставляемой воды. вода низкая.
Как правило, выпуск воды для использования должен основываться на образце POU, отражающем производственную практику водопользования, а не на данных порта образца.
15. Является ли выход системы распределения воды, иногда называемый выходом точки потребления, точкой потребления?
Нет. Место назначения этой воды, где она будет использоваться для приготовления продукта или очистки, или где она входит в производственный процесс, является истинной точкой использования. Качество воды в точке фактического использования, доставляемой при производстве (или посредством процесса отбора проб, идентичного процессу доставки воды при производстве), должно быть известно во всех точках использования, получающих воду из системы. Качество воды в точке фактического использования — это когда вода должна быть «пригодной для использования», т. е. соответствовать вашим требованиям к воде.
Место назначения этой воды, где она будет использоваться для приготовления продукта или очистки, или где она входит в производственный процесс, является истинной точкой использования. Качество воды в точке фактического использования, доставляемой при производстве (или посредством процесса отбора проб, идентичного процессу доставки воды при производстве), должно быть известно во всех точках использования, получающих воду из системы. Качество воды в точке фактического использования — это когда вода должна быть «пригодной для использования», т. е. соответствовать вашим требованиям к воде.
16. Если у меня нет спецификации микробного состава воды, а есть только уровень предупреждения и действия, считается ли какой-либо микробный уровень непригодным для использования?
Да. Уровни действия в Фармакопее США <1231> (100 КОЕ/мл для очищенной воды и 10 КОЕ/100 мл для воды для инъекций) обычно считаются уровнем, выше которого вода непригодна для использования. Вот почему в случае превышения этих Уровней действий необходимо провести расследование OOS.
Таким образом, независимо от того, объявляете ли вы микробные характеристики или нет, предполагается, что они являются теми значениями «уровня действия справочника», которые содержатся в Общей главе <1231>. Чтобы не допустить превышения технических требований к микробам воды, следует использовать основанные на тенденциях уровни предупреждений и действий для мониторинга и управления системой водоснабжения, чтобы она всегда производила воду, пригодную для использования.
17. Каковы наиболее распространенные проблемы, возникающие в производственных системах WFI, произведенных в соответствии с GMP. Что мы должны искать?
- Одна из распространенных проблем связана с наличием субконтура холодной воды для инъекций вне обогреваемой системы с большими кожухотрубными теплообменниками, используемыми для охлаждения в этом субконтуре. Когда подконтур дезинфицируется горячей водой, охлаждающим теплообменникам (и удерживаемой в них охлажденной воде) не хватает времени контакта, чтобы полностью нагреть и продезинфицировать их.
 При неполной санитарной обработке любая уцелевшая биопленка будет немедленно повторно заселяться в подконтуре холода после возобновления работы в холодном состоянии и будет присутствовать в виде поддающихся обнаружению микроколичеств.
При неполной санитарной обработке любая уцелевшая биопленка будет немедленно повторно заселяться в подконтуре холода после возобновления работы в холодном состоянии и будет присутствовать в виде поддающихся обнаружению микроколичеств. - Другими распространенными проблемами с холодными системами ВДИ являются застойные ветки, иногда временные, которые создаются открытыми жесткими соединениями с оборудованием, которое не используется и не забирает воду. Горячая вода во время дезинфекции плохо смешивается с водой, попавшей в мертвую ногу, поэтому мертвая нога никогда не дезинфицируется. Если в этот боковой отвод попало какое-либо загрязнение во время предыдущего использования, оно будет неуклонно расти в непродезинфицированном мертвом отводе и постоянно загрязнять воду контура.
- Еще одна распространенная проблема заключается в том, что процесс дистилляционной очистки перегружается высоким уровнем эндотоксинов в воде, поступающей в дистиллятор (100+ EU/мл). Это может произойти из-за плохого обслуживания установок предварительной обработки, таких как угольные кровати, а также при совпадении с высоким уровнем эндотоксинов в городской воде, когда они переходят на чистый хлор с хлорамина в течение части года.

18. Получаете ли вы образование нуклеазы из биопленки и больше ли высвобождается во время санитарной обработки?
Было бы неудивительно, если бы из редко используемых химических дезинфицирующих средств могла образовываться значительная биопленка. Однако, если для санитарной обработки используется горячая вода, это приведет к денатурации нуклеазных ферментов, поэтому этого явления может не произойти в системах, дезинфицируемых горячей водой.
19. В новом USP 1231 изменена рекомендуемая температура при горячей дезинфекции. Предыдущая рекомендация не ниже 80°C была снижена до 65-80°C. Теперь температуры, намного превышающие 80°C, явно считаются нецелесообразными. Это правильно?
Да. Температура 80˚C очень «прощает» более прохладные места, которые все еще могут быть продезинфицированы даже при потере температуры на 10-15˚C, поскольку они проникают по всей системе за счет конвекции и проводимости, поэтому они очень эффективны. Можно также использовать более низкие температуры (до 65 °C), но они «не прощают» еще более холодных мест, таких как выпускные клапаны вне основного контура. Таким образом, такие более прохладные места необходимо промывать этой немного более прохладной горячей водой, чтобы гарантировать, что все поверхности достигают температуры дезинфекции выше 60°C. Если системы не предназначены специально для этого, температуры выше 80 °C могут повлиять на долговечность материалов системы (например, прокладок и диафрагм). Температура 80 °C достаточно высока, чтобы убить самые термостойкие биопленочные организмы, которые колонизируют водную систему (значение D около 5 миллисекунд).
Таким образом, такие более прохладные места необходимо промывать этой немного более прохладной горячей водой, чтобы гарантировать, что все поверхности достигают температуры дезинфекции выше 60°C. Если системы не предназначены специально для этого, температуры выше 80 °C могут повлиять на долговечность материалов системы (например, прокладок и диафрагм). Температура 80 °C достаточно высока, чтобы убить самые термостойкие биопленочные организмы, которые колонизируют водную систему (значение D около 5 миллисекунд).
20. При отборе проб воды из портов следует подсоединять технологические шланги? Это требование или рекомендация?
- Если отбор проб предназначен для КК «сброса» воды для производственных нужд, то пробы на выходе, используемом производством, должны быть отобраны ТОЧНО таким же образом, как и на производстве – такая же санитарная обработка на выходе (если есть), то же самое производство шланг (независимо от того, насколько грязный или в плохом состоянии), такая же предварительная промывка (если есть), все то же самое.
 Цель данных о пробах — воспроизвести то же качество воды, которое используется на производстве, поэтому при сборе проб вам необходимо воспроизвести то, как вода забирается из системы для использования. Эти процедуры использования воды могут значительно загрязнить первозданную воду в системе водоснабжения при ее выходе, так что «грязная» вода доставляется на производство. Если вы отберете пробу воды иначе (лучше), чем она используется в производстве, вы получите более низкие (лучшие) микроколичества, которые не отражают качество воды, которая фактически используется. FDA требует, чтобы отбор проб, как и использование производственной воды для контроля качества, был идентичным. Если это не так, это может принести вам наблюдение FDA483 или хуже.
Цель данных о пробах — воспроизвести то же качество воды, которое используется на производстве, поэтому при сборе проб вам необходимо воспроизвести то, как вода забирается из системы для использования. Эти процедуры использования воды могут значительно загрязнить первозданную воду в системе водоснабжения при ее выходе, так что «грязная» вода доставляется на производство. Если вы отберете пробу воды иначе (лучше), чем она используется в производстве, вы получите более низкие (лучшие) микроколичества, которые не отражают качество воды, которая фактически используется. FDA требует, чтобы отбор проб, как и использование производственной воды для контроля качества, был идентичным. Если это не так, это может принести вам наблюдение FDA483 или хуже. - Если пробы воды берутся для контроля процесса (ПК) с целью мониторинга системы водоснабжения и системного микробного контроля, это может осуществляться через порты для отбора проб, которые не используются на производстве. Поскольку мы знаем, что выпускные отверстия сами по себе могут вносить вклад в бионагрузку собранной воды, можно приложить крайние усилия, чтобы гарантировать, что выпускное отверстие не увеличивает микробное содержание воды на выходе из системы (используя экстремальную дезинфекцию выпускного отверстия, очень энергичная и тщательная промывка, стерильные шланги и т.
 д.). Для ПК вас интересует качество воды в системе за клапаном, и вы не хотите, чтобы загрязнение в порту для отбора проб повлияло на интерпретацию данных.
д.). Для ПК вас интересует качество воды в системе за клапаном, и вы не хотите, чтобы загрязнение в порту для отбора проб повлияло на интерпретацию данных. - Однако вода, собранная из портов для отбора проб (а не из выпускных отверстий для производственного использования), обычно не может использоваться для окончательного выпуска (КК) воды, поскольку она собирается не так, как фактически используется. В производстве обычно не используется вода, забираемая из портов для отбора проб.
21. Каков ваш риск повышения уровня эндотоксинов из-за различных методов санитарной обработки?
- Уровни эндотоксина обычно беспокоят только системы WFI. Большинство систем воды для инъекций дезинфицируются при повышенных температурах (горячая вода лучше, чем пар, поскольку для дезинфекции горячей воды не требуется специальных технических средств, и этого достаточно), хотя в ближайшие годы все больше систем может использовать озон, поскольку технологии очистки без дистилляции в окружающей среде становятся все более популярными.
 широкое распространение благодаря смягчению EP методов приготовления WFI в своей монографии по WFI. Поскольку термическая или озоновая дезинфекция систем ВДИ обычно проводится не реже, чем раз в неделю, этого времени недостаточно для образования биопленки (с ее эндотоксином) в системе и ее высвобождения при периодической санации. Если системы дезинфицируются гораздо реже, есть шанс, что развивающаяся биопленка может выделять обнаруживаемый эндотоксин, когда ее убивают периодической санитарной обработкой.
широкое распространение благодаря смягчению EP методов приготовления WFI в своей монографии по WFI. Поскольку термическая или озоновая дезинфекция систем ВДИ обычно проводится не реже, чем раз в неделю, этого времени недостаточно для образования биопленки (с ее эндотоксином) в системе и ее высвобождения при периодической санации. Если системы дезинфицируются гораздо реже, есть шанс, что развивающаяся биопленка может выделять обнаруживаемый эндотоксин, когда ее убивают периодической санитарной обработкой. - Если используются химические дезинфицирующие средства, отличные от озона (это было бы очень нетипично для системы WFI или системы очищенной воды, контролируемой эндотоксинами), дезинфицирующее средство необходимо смывать, что также приведет к вымыванию любого выпущенного эндотоксина.
Вода для фармацевтических целей | FDA
[Предыдущая глава] [Содержание] [Следующая глава]
ОТДЕЛ. ЗДРАВООХРАНЕНИЯ, ОБРАЗОВАНИЯ И
БЛАГОПОЛУЧИЕ ОБЩЕСТВЕННОЕ ЗДРАВООХРАНЕНИЕ
. ТЕМА ITG: ВОДА ДЛЯ ФАРМАЦЕВТИЧЕСКОГО ИСПОЛЬЗОВАНИЯ
ТЕМА ITG: ВОДА ДЛЯ ФАРМАЦЕВТИЧЕСКОГО ИСПОЛЬЗОВАНИЯ
ЦЕЛЬ
В данном ITG рассматриваются различные типы воды, используемые при производстве лекарственных препаратов.
8 ВИДОВ ВОДЫ:
- Непитьевые
- Питьевая (питьевая) вода
- Очищенная вода USP
- USP вода для инъекций (WFI)
- USP стерильная вода для инъекций
- ЛУСП стерильная вода для ингаляций
- USP бактериостатическая вода для инъекций
- USP стерильная вода для орошения
Обозначение USP означает, что вода является предметом официальной монографии в действующей Фармакопее США с различными спецификациями для каждого типа. Последние 4 воды представляют собой «готовые» продукты, которые упакованы и маркированы как таковые, и не должны вызывать беспокойства во время инспекции за пределами заводов, которые фактически производят эти продукты.
Очищенная вода Фармакопеи США и ВДИ Фармакопеи США, с другой стороны, являются компонентами или «ингредиентами», как они называются в Фармакопее США, предназначенными для использования в производстве лекарственных препаратов.
А как насчет питьевой воды как компонента? Требуется ли регулярный отбор проб и тестирование перед использованием в производстве? В соответствии с преамбулой к действующим правилам надлежащей производственной практики (CGMP), приемочные испытания питьевой воды не требуются, если она не получена из источников, которые не контролируют качество воды в соответствии со стандартами Агентства по охране окружающей среды (EPA). Важно знать, что питьевую воду нельзя использовать для приготовления лекарственных форм USP или лабораторных реагентов для тестирования растворов. Однако питьевая вода может использоваться для производства лекарственных веществ (также известных как нерасфасованные лекарства или нерасфасованные фармацевтические химикаты).
Во время осмотра определите источник воды, используемой для влажного гранулирования или любых водных жидких препаратов, а также для лаборатории. Она должна иметь качество очищенной воды USP как химически, так и микробиологически.
Является ли непитьевая вода проблемой при проверке на наркотики? Он может присутствовать на установке в питательной воде для котлов, охлаждающей воде для кондиционирования воздуха или в системах пожаротушения. Внимательно проверьте наличие перекрестных соединений с подачей питьевой воды. Линии подачи непитьевой воды должны быть четко обозначены как таковые, особенно если они примыкают к соединениям подачи питьевой воды.
Внимательно проверьте наличие перекрестных соединений с подачей питьевой воды. Линии подачи непитьевой воды должны быть четко обозначены как таковые, особенно если они примыкают к соединениям подачи питьевой воды.
ИСТОЧНИКИ ПРОИЗВОДСТВА ВОДЫ
Фармакопея США определяет приемлемые способы производства различных типов составных вод. USP WFI может быть получен только путем дистилляции или обратного осмоса.
Питьевая вода добывается в основном из городских систем водоснабжения, но может также браться из колодцев, рек или прудов.
ИСТОЧНИКИ ЗАГРЯЗНЕНИЯ ВОДЫ
Дефекты трубопроводной системы могут привести к загрязнению поступающей чистой воды. Из-за этой возможности указывается отбор проб в месте использования, то есть забор пробы воды после того, как она прошла через систему трубопроводов.
Микробное загрязнение пероральной жидкости и лекарственных препаратов для местного применения продолжает оставаться серьезной проблемой и обычно связано с использованием загрязненной воды. Из-за потенциального риска для здоровья, связанного с использованием загрязненной воды, особое внимание следует уделять системам деионизированной (ДИ) воды, особенно на небольших, менее сложных производственных предприятиях.
Из-за потенциального риска для здоровья, связанного с использованием загрязненной воды, особое внимание следует уделять системам деионизированной (ДИ) воды, особенно на небольших, менее сложных производственных предприятиях.
Чтобы свести к минимуму это загрязнение, USP отмечает, что системы водоснабжения для фармацевтического производства должны иметь «корректирующие средства». Под этим понимают доступ к системе санитарной обработки или подачи пара, хлораторам, хранению при повышенных температурах, фильтрации и т. д. Узнайте об этом во время осмотра.
Сезонные колебания температуры и рост флоры также могут вызывать колебания микробного состава исходной воды. Мониторинг должен быть достаточно частым, чтобы охватить эти изменения.
ВНУТРИЗАВОДСКИЕ СИСТЕМЫ ОЧИСТКИ ВОДЫ
Фильтры с песчаным слоем с оборудованием для хлорирования или без него обычно используются на крупных заводах. Однако они могут быть расположены в центре, а вода может подаваться к месту производства фармацевтической продукции. Работа этих систем должна быть подтверждена вместе с любой последующей обработкой.
Работа этих систем должна быть подтверждена вместе с любой последующей обработкой.
Если используются резервуары для хранения, определите вместимость, норму использования, частоту промывки и дезинфекции внутренних поверхностей.
Несмотря на то, что фильтры глубинного или мембранного типа часто используются в системах водоснабжения, окончательная фильтрация в качестве единственной обработки для очистки воды, как правило, неприемлема. Однако фильтрация может быть приемлемой, например, при использовании для снижения содержания микробов/частиц в питьевой воде, используемой в качестве ингредиента в химическом производстве, где вода не обязательно должна быть стерильной.
Хлорирование питьевой воды является эффективной обработкой, если достигается минимальный уровень свободного хлора 0,2 мг/л. Однако имейте в виду, что любые угольные или угольные фильтры в системе удалят этот защитный хлор и, таким образом, устранят любой ингибирующий эффект на рост микробов после этого момента.
USP WFI обычно производится в системе с непрерывной циркуляцией, поддерживаемой при повышенной температуре. Высокая температура, поддерживаемая равномерно по всей системе за счет постоянной циркуляции, предотвращает значительный рост микробов. Обычно используется температура 80°С, которая является приемлемой. Несколько более низкие температуры также могут быть приемлемыми, при условии, что у фирмы есть достаточные данные, чтобы продемонстрировать, что более низкая температура работает так, как предполагалось. Если вода для инъекций хранится при температуре окружающей среды, а не подвергается рециркуляции при повышенной температуре, она должна быть сброшена или направлена на использование, не связанное с водой для инъекций, через 24 часа после производства.
ОБЩИЕ ЗАМЕЧАНИЯ
Хотя не существует абсолютных микробных стандартов для воды (кроме воды, предназначенной для стерильности), правила CGMP требуют, чтобы были установлены и контролировались соответствующие спецификации. Спецификация должна учитывать предполагаемое использование воды; т. е. вода, используемая для приготовления продукта, не должна содержать организмов, способных расти в продукте. Пределы действий или предупреждений должны основываться на данных проверки и должны быть установлены достаточно низкими, чтобы сигнализировать о значительных изменениях по сравнению с нормальными рабочими условиями.
Спецификация должна учитывать предполагаемое использование воды; т. е. вода, используемая для приготовления продукта, не должна содержать организмов, способных расти в продукте. Пределы действий или предупреждений должны основываться на данных проверки и должны быть установлены достаточно низкими, чтобы сигнализировать о значительных изменениях по сравнению с нормальными рабочими условиями.
ССЫЛКИ
Текущие правила надлежащей производственной практики FDA, Федеральный регистр, том 43, № 190 — 29 сентября 1978 г., I. Общие комментарии и подраздел C, пар. 211.48.
Водные программы, Агентство по охране окружающей среды, Национальные временные правила первичной питьевой воды, 16 декабря 1985 г., 40 Свод федеральных правил, часть 141, параграф. 141.14 и 141.21.
Фармакопея США XXI, Вода для фармацевтических целей, раздел 1231 и Официальные монографии — различные типы воды, 1985.
ПИСЬМО FDA ДЛЯ ФАРМАЦЕВТИЧЕСКОЙ ПРОМЫШЛЕННОСТИ Re: Validation and Control of Deionized Water Systems, — Daniel L.

 Есть и другие стандарты, в том числе международная фармакопея, выпущенная ВОЗ для стран, которые не имеют возможности создать свою фармакопею, но, по всей видимости, влияют минимально на международную фармакопею, несмотря на её впечатляющее название. Все фармакопеи регулярно пересматривают статьи о воде очищенной и воде для инъекций, но кардинальных отличий между этими статьями нет.
Есть и другие стандарты, в том числе международная фармакопея, выпущенная ВОЗ для стран, которые не имеют возможности создать свою фармакопею, но, по всей видимости, влияют минимально на международную фармакопею, несмотря на её впечатляющее название. Все фармакопеи регулярно пересматривают статьи о воде очищенной и воде для инъекций, но кардинальных отличий между этими статьями нет. Создатели нового документа по чистым средам подчеркивают, что с 1993 года уже накопился колоссальный опыт инспекций, который следует обобщить и проанализировать. Новый документ содержит Приложение 1, в котором приведены актуальные примеры заключений по результатам инспекций с описанием наиболее часто выявляемых несоответствий.
Создатели нового документа по чистым средам подчеркивают, что с 1993 года уже накопился колоссальный опыт инспекций, который следует обобщить и проанализировать. Новый документ содержит Приложение 1, в котором приведены актуальные примеры заключений по результатам инспекций с описанием наиболее часто выявляемых несоответствий.
 При неполной санитарной обработке любая уцелевшая биопленка будет немедленно повторно заселяться в подконтуре холода после возобновления работы в холодном состоянии и будет присутствовать в виде поддающихся обнаружению микроколичеств.
При неполной санитарной обработке любая уцелевшая биопленка будет немедленно повторно заселяться в подконтуре холода после возобновления работы в холодном состоянии и будет присутствовать в виде поддающихся обнаружению микроколичеств.
 Цель данных о пробах — воспроизвести то же качество воды, которое используется на производстве, поэтому при сборе проб вам необходимо воспроизвести то, как вода забирается из системы для использования. Эти процедуры использования воды могут значительно загрязнить первозданную воду в системе водоснабжения при ее выходе, так что «грязная» вода доставляется на производство. Если вы отберете пробу воды иначе (лучше), чем она используется в производстве, вы получите более низкие (лучшие) микроколичества, которые не отражают качество воды, которая фактически используется. FDA требует, чтобы отбор проб, как и использование производственной воды для контроля качества, был идентичным. Если это не так, это может принести вам наблюдение FDA483 или хуже.
Цель данных о пробах — воспроизвести то же качество воды, которое используется на производстве, поэтому при сборе проб вам необходимо воспроизвести то, как вода забирается из системы для использования. Эти процедуры использования воды могут значительно загрязнить первозданную воду в системе водоснабжения при ее выходе, так что «грязная» вода доставляется на производство. Если вы отберете пробу воды иначе (лучше), чем она используется в производстве, вы получите более низкие (лучшие) микроколичества, которые не отражают качество воды, которая фактически используется. FDA требует, чтобы отбор проб, как и использование производственной воды для контроля качества, был идентичным. Если это не так, это может принести вам наблюдение FDA483 или хуже. д.). Для ПК вас интересует качество воды в системе за клапаном, и вы не хотите, чтобы загрязнение в порту для отбора проб повлияло на интерпретацию данных.
д.). Для ПК вас интересует качество воды в системе за клапаном, и вы не хотите, чтобы загрязнение в порту для отбора проб повлияло на интерпретацию данных. широкое распространение благодаря смягчению EP методов приготовления WFI в своей монографии по WFI. Поскольку термическая или озоновая дезинфекция систем ВДИ обычно проводится не реже, чем раз в неделю, этого времени недостаточно для образования биопленки (с ее эндотоксином) в системе и ее высвобождения при периодической санации. Если системы дезинфицируются гораздо реже, есть шанс, что развивающаяся биопленка может выделять обнаруживаемый эндотоксин, когда ее убивают периодической санитарной обработкой.
широкое распространение благодаря смягчению EP методов приготовления WFI в своей монографии по WFI. Поскольку термическая или озоновая дезинфекция систем ВДИ обычно проводится не реже, чем раз в неделю, этого времени недостаточно для образования биопленки (с ее эндотоксином) в системе и ее высвобождения при периодической санации. Если системы дезинфицируются гораздо реже, есть шанс, что развивающаяся биопленка может выделять обнаруживаемый эндотоксин, когда ее убивают периодической санитарной обработкой.