Содержание
Вода. Мини-справочник по химическим веществам (3340 веществ)
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Синонимы:
водородагидроокись
оксид водорода
оксид диводорода
Внешний вид:
бесцветн. жидкость
Кристаллические модификации, цвет растворов и паров:
В твердом виде образует несколько модификаций: Ih (гексагональная структура) существует при 0 C, плотность 0,917 г/см3; Ic (кубическая модификация), существует при -133 C, плотность 0,93 г/см3; II (при -33 C и 210 МПа), плотность 1,18 г/см3; III (при -22 C и 200 МПа), плотность 1,15 г/см3; V (при -5 С и 800 МПа), плотность 1,26 г/см3; VI (при +35 С и 800 МПа), плотность 1,34 г/см3; VII (при 25 С и 2500 МПа), плотность 1,65 г/см3.
В толстом слое имеет голубой цвет.
Брутто-формула (система Хилла): H
2O
Формула в виде текста: h3O
Молекулярная масса (в а.е.м.): 18,02
Температура плавления (в °C): 0
Температура кипения (в °C): 100
Температурные константы смесей:
126 °C (температуракипенияазеотропа, давление 1 атм) бромоводород 47,5% вода 52,5%
105 °C (температуракипенияазеотропа, давление 1 атм) бромоводород 10,4% вода 11% хлорбензол 78,6%
64,79 °C (температуракипенияазеотропа, давление 1 атм) бензол 62,4% вода 6,8% гептан 12,1% этиловый спирт 18,7%
108,584 °C (температуракипенияазеотропа, давление 1 атм) вода 79,778% хлороводород 20,222%
203 °C (температуракипенияазеотропа, давление 1 атм) вода 28,4% хлорная кислота 71,6%
111,35 °C (температуракипенияазеотропа, давление 1 атм) вода 64,4% фтороводород 35,6%
127 °C (температуракипенияазеотропа, давление 1 атм) вода 43% иодоводород 57%
120,7 °C (температуракипенияазеотропа, давление 1 атм) азотная кислота 13,4% вода 86,6%
330 °C (температуракипенияазеотропа, давление 1 атм) вода 1,7% серная кислота 98,3%
120 °C (температуракипенияазеотропа, давление 1 атм) вода 32,3% гидразин 67,7%
83,59 °C (температуракипенияазеотропа, давление 1 атм) вода 23,6% нитрометан 76,4%
88,89 °C (температуракипенияазеотропа, давление 1 атм) аллиловый спирт 72,3% вода 27,7%
91,63 °C (температуракипенияазеотропа, давление 1 атм) 1-нитропропан 63,5% вода 36,5%
88,55 °C (температуракипенияазеотропа, давление 1 атм) 2-нитропропан 70,6% вода 29,4%
87,65 °C (температуракипенияазеотропа, давление 1 атм) вода 28,3% н-пропиловый спирт 71,7%
66 °C (температуракипенияазеотропа, давление 1 атм) вода 4,1% тетрахлорметан 95,9%
43,6 °C (температуракипенияазеотропа, давление 1 атм) вода 2% сероуглерод 98%
56,2 °C (температуракипенияазеотропа, давление 1 атм) вода 2,6% хлороформ 97,4%
38,1 °C (температуракипенияазеотропа, давление 1 атм) вода 1,5% дихлорметан 98,5%
107,65 °C (температуракипенияазеотропа, давление 1 атм) вода 25,5% муравьиная кислота 74,5%
87,22 °C (температуракипенияазеотропа, давление 1 атм) вода 28,5% нитроэтан 71,5%
74,35 °C (температуракипенияазеотропа, давление 1 атм) вода 22% этилнитрат 78%
78,174 °C (температуракипенияазеотропа, давление 1 атм) вода 4% этиловый спирт 96%
98,6 °C (температуракипенияазеотропа, давление 1 атм) вода 73% диметилсульфат 27%
119 °C (температуракипенияазеотропа, давление 1 атм) вода 18,4% этилендиамин 81,6%
52,4 °C (температуракипенияазеотропа, давление 1 атм) акролеин 97,4% вода 2,6%
-74,7 °C (температураплавления эвтектической смеси) вода 77% хлороводород 23%
104 °C (температуракипенияазеотропа, давление 1 атм) вода 20% трифторуксусная кислота 80%
98 °C (температуракипенияазеотропа, давление 1 атм) вода 72% перфтормасляная кислота 28%
Растворимость (в г/100 г или характеристика):
1,2-дихлорэтан: 0,187 (25°C)
вода: смешивается
диэтиловый эфир: мало растворим
тетрахлорметан: 0,0116 (25°C)
хлороформ: 0,0932 (25°C)
этанол: смешивается
Вкус, запах, гигроскопичность:
вкус: без вкуса
запах: без запаха
Дополнительное описание:
Криоскопическая константа = 1,86
Способы получения:
1.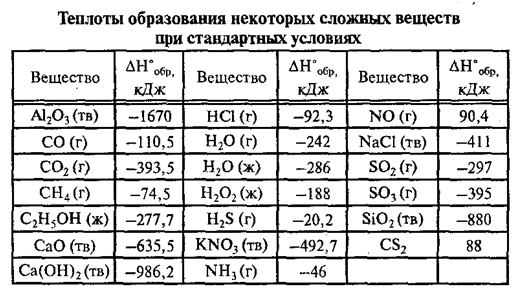 Очистка природной воды.
Очистка природной воды.
2. Сжигание водорода в кислороде или в воздухе.
Природные и антропогенные источники:
Одно из самых распространенных на Земле веществ. Количество воды на поверхности Земли оценивается в 1 390 000 000 000 000 000 т, большая часть из которых находится в морях и океанах. Количество доступной для использования пресной воды в реках, озерах, болотах и водохранилищах составляет 200 000 000 000 000 т. Масса ледников Антпрктики, Антарктиды и высокогорных районов оценивается в 24 000 000 000 000 000 т., примерно столько же имеется подземных вод, причем только небольшая часть из них — пресные. Вода входит в состав многих минералов и горных пород, присутствует в почве, является компонентом всех живых организмов.
Плотность:
1 (4°C, г/см3)
0,9971 (25°C, г/см3)
Показатель преломления (для D-линии натрия):
1,33369 (0°C)
1,33369 (10°C)
1,33299 (20°C)
1,3325 (25°C)
1,33194 (50°C)
1,32725 (60°C)
Давление паров (в мм.
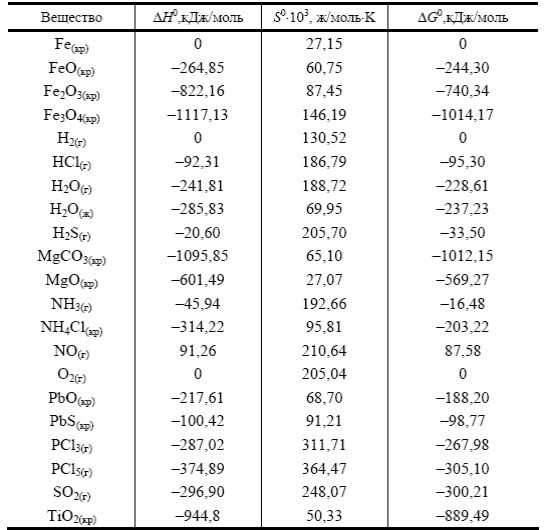 рт.ст.):
рт.ст.):
1 (-17,4°C)
10 (11,2°C)
100 (51,6°C)
Показатель диссоциации:
pKa (1) = 15,7 (20 C, вода)
Диэлектрическая проницаемость:
78,3 (25°C)
Дипольный момент молекулы (в дебаях):
1,84 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
1,792 (0°C)
1,308 (10°C)
1,005 (20°C)
0,894 (25°C)
0,801 (30°C)
0,656 (40°C)
0,549 (50°C)
0,469 (60°C)
0,406 (70°C)
0,3565 (80°C)
0,3165 (90°C)
0,284 (100°C)
0,26 (107°C)
0,22 (127°C)
0,18 (147°C)
0,16 (167°C)
0,14 (187°C)
0,13 (207°C)
0,12 (227°C)
0,11 (247°C)
0,1 (267°C)
0,094 (287°C)
0,086 (307°C)
0,079 (327°C)
0,071 (347°C)
0,042 (374°C)
Поверхностное натяжение (в мН/м):
75,62 (0°C)
74,2 (10°C)
72,75 (20°C)
71,15 (30°C)
69,55 (40°C)
67,9 (50°C)
66,17 (60°C)
64,41 (70°C)
62,6 (80°C)
60,74 (90°C)
58,84 (100°C)
56,97 (110°C)
54,96 (120°C)
52,9 (130°C)
52,79 (140°C)
48,68 (150°C)
46,51 (160°C)
44,38 (170°C)
42,19 (180°C)
40 (190°C)
37,77 (200°C)
35,51 (210°C)
33,21 (220°C)
30,88 (230°C)
28,52 (240°C)
26,13 (250°C)
23,73 (260°C)
21,33 (270°C)
18,94 (280°C)
16,6 (290°C)
14,29 (300°C)
12,04 (310°C)
9,84 (320°C)
7,69 (330°C)
5,61 (340°C)
3,64 (350°C)
2,71 (355°C)
1,85 (360°C)
1,68 (361°C)
1,53 (362°C)
1,07 (365°C)
0,42 (370°C)
0,31 (371°C)
0,2 (372°C)
0,1 (373°C)
0 (374,15°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-285,83 (ж)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-237,24 (ж)
Стандартная энтропия образования S (298 К, Дж/моль·K):
70,08 (ж)
Стандартная мольная теплоемкость C
p (298 К, Дж/моль·K):
75,299 (ж)
Энтальпия плавления ΔH
пл (кДж/моль):
6,009
Энтальпия кипения ΔH
кип (кДж/моль):
40,66
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-241,82 (г)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-228,61 (г)
Стандартная энтропия образования S (298 К, Дж/моль·K):
188,72 (г)
Стандартная мольная теплоемкость C
p (298 К, Дж/моль·K):
33,58 (г)
Критическая температура (в °C):
374,15
Критическое давление (в МПа):
22,12
Критическая плотность (в г/см
3):
0,32
Применение:
Во всех областях человеческой деятельности.
Дополнительная информация:
Длина связи O-H 0,0957 нм, валентный угол H-O-H 104,5 градусов, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. Электрическое сопротивление льда при 0 С = 0,4 мкОм.м, жидкой воды при 0 С = 1,47 мкОм·м, жидкой воды при 50 С = 18,9 мкОм·м. Коэффициент диффузии паров в воздухе = 0,216*(T/273)1,8 см2/с (T=273-1493 К).
- «Справочник химика» т.3, Л.-М.: Химия, 1965 стр. 907
- «Физические величины» под ред. Григорьева И.С., Мейлихова Е.З., М.:Энергоатомиздат 1991 стр. 332, 370
- «Химическая энциклопедия» т.1 М.: Советская энциклопедия, 1988 стр. 394-397
- Гордон А., Форд Р. «Спутник химика» М.: Мир, 1976 стр. 462
- Девяткин В.В., Ляхова Ю.М. «Химия для любознательных, или о чем не узнаешь на уроке» Ярославль:Академия Холдинг, 2000 стр. 46
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 59
Источники информации:
Алф.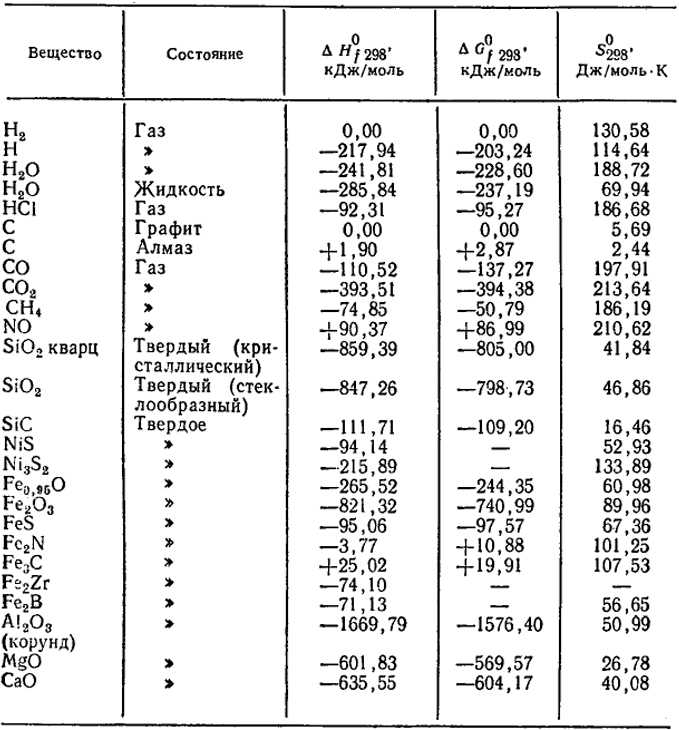 указатель:
указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- ВОДА — химическая энциклопедия
Стандартная молярная энтальпия образования.
Стандартной молярной энтальпией образования вещества ΔH о6р, m (298 К) называется изменение энтальпии при образовании одного моля данного вещества из входящих в него элементов в их стандартных состояниях при температуре 298 К и давлении одна атмосфера.
Сопоставим это определение с приведенными выше примерами. Мы убедились,
что окисление водорода можно представить по меньшей мере тремя различными стехиометрическими уравнениями. Таким образом, нам известны по меньшей мере три разные стандартные молярные энтальпии:
а) ΔН°т {298 К, 2Н20(ж.)} = — 571,6 кДж/моль
б) ΔН°т {298 К, Н20(ж. )} = — 285,8 кДж/моль
)} = — 285,8 кДж/моль
в) ΔН°т{298 К, h3O(T.)} = — 241,8 кДж/моль
Какое же из этих значений соответствует стандартной молярной энтальпии образования воды? Значение (в) не может соответствовать ему, поскольку стандартным состоянием воды при 298 К не является парообразное (газообразное) состояние, соответствующее обозначению Н20(г.). Стандартная молярная энтальпия образования воды может иметь одно из двух оставшихся значений, различие между которыми определяется тем, как записано уравнение реакции. Однако, поскольку в приведенном выше определении стандартной молярной энтальпии образования указано, что оно соответствует изменению энтальпии в расчете на один моль образующегося вещества, следует выбрать вариант (б). Таким образом, стандартная молярная энтальпия образования воды = — 285,8 кДж/моль.
В табл. 5.1 указаны стандартные молярные энтальпии образования некоторых распространенных веществ в их стандартных состояниях. Обратим внимание, что в таблицу включены не только вещества, но и некоторые ионы. Ионы и многие соединения не могут быть получены прямым синтезом из образующих их элементов. Однако их стандартные энтальпии образования можно вычислить с помощью закона Гесса (с которым мы познакомимся в разд. 5.3).
Ионы и многие соединения не могут быть получены прямым синтезом из образующих их элементов. Однако их стандартные энтальпии образования можно вычислить с помощью закона Гесса (с которым мы познакомимся в разд. 5.3).
Большинство соединений характеризуются отрицательными энтальпиями образования. Поэтому их называют экзотермическими соединениями. Лишь немногие соединения имеют положительную энтальпию образования. Они называются эндотермическими соединениями. Примером эндотермического соединения является бензол.
Следует обратить внимание на то обстоятельство, что энтальпии образования твердых соединений, как правило, имеют большие (по абсолютной величине) отрицательные значения, чем энтальпии образования газов. Стандартная молярная энтальпия образования какого-либо вещества или иона является мерой его устойчивости по сравнению с элементами, образующими данное соединение. Чем больше (по абсолютной величине) отрицательное значение энтальпии образования соединения, тем устойчивее это соединение.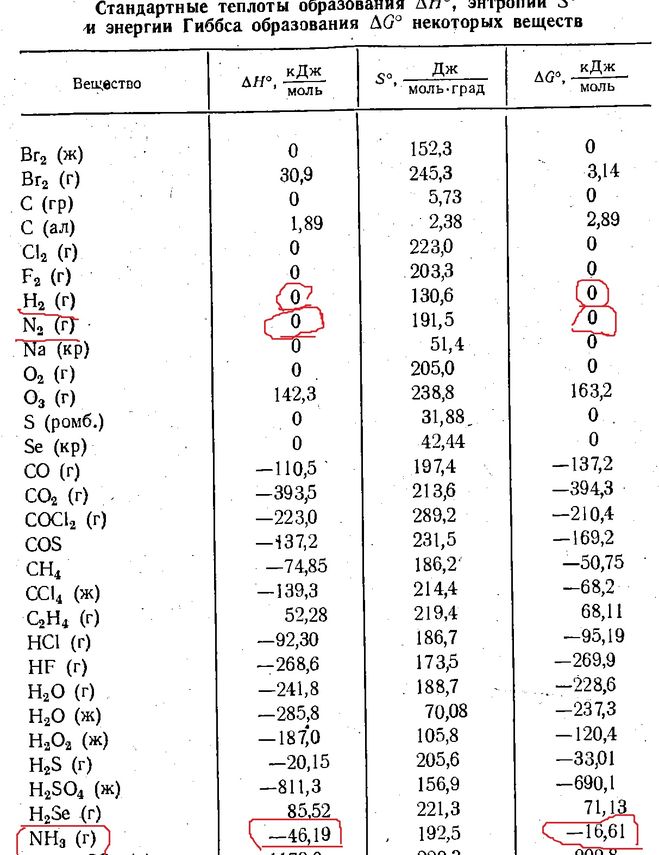
По определению стандартная молярная энтальпия образования любого элемента в его стандартном состоянии при 298 К равна нулю. Например, ΔH {298 К, 02(г.)} = 0.
Таблица 5.1. Стандартные молярные энтальпии образования
Вещество | ΔН(298 К), кДж/моль | Вещество
| Д298 К), кДж/моль |
AgCl (тв.) | -127,1 | Nh4 (г.) | -46,1 |
Al2O3 (тв.) | -1676 | SO2 (г.) | -296,8 |
CaCO3 (тв.) | -1206 | SO4- (водн.) | -909,3 |
CO2 (г.) | -393,5 | Zn2+ (водн.) | -152,4 |
CuSO4 (тв. | -770 | Ch5 (г.) | -74,8 |
-92,3 | C2H6 (г.) | -84,7 | |
HCl (водн.) | -167,2 | CHCl3 (ж.) | -135,4 |
h3O (ж.) | -285,8 | C2H5OH (ж.) | -277,6 |
h3O (г.) | -241,8 | Ch4COOH (ж.) k | -484,2 |
MgO (тв.) Na+ (водн.) | -601,8 | C6h22O6 (тв.) | -1274 |
-240,1 | C12h32O11 (тв.) | -2222 |
Оглавление:
- часть 1 (Cтроение атома, Химическая связь)
- часть 2 (Газы, жидкости и твердые вещества, Стехиометрия, Энергетика)
- часть 3 (Фазовые равновесия, Химическое равновесие, Ионы, Химическая кинетика)
- часть 4 (Электрохимия)
Молярная энтальпия образования различных веществ
Молярная энтальпия образования различных веществ — (Обновлено 18.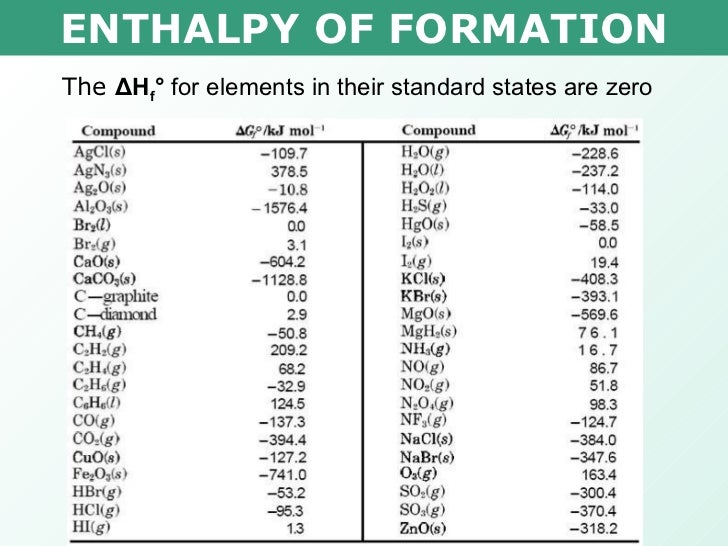 01.09)
01.09)
Вещество | Формула | М [кг/кмоль] | hfo [кДж/кмоль] |
Углерод | С(ы) | 12.001 | 0 |
Водород | Н 2 (г) | 2,016 | 0 |
Азот | Н 2 (г) | 28.012 | 0 |
Кислород | О 2 (г) | 32 | 0 |
Оксид углерода | СО(г) | 28. | -110 530 |
Углекислый газ | СО 2 (г) | 44.001 | -393 520 |
Водяной пар | Н 2 О(г) | 18.016 | -241 820 |
Вода | Н 2 О(л) | 18.016 | -285 820 |
Перекись водорода | Н 2 О 2 (г) | 34.016 | -136 310 |
Аммиак | NH 3 (г) | 17.03 | -46 190 |
Метан | CH 4 (г) | 16. | -74 850 |
Ацетилен | С 2 Н 2 (г) | 26.038 | 226 730 |
Этилен | С 2 Н 4 (г) | 24.034 | 52 280 |
Этан | С 2 Н 6 (г) | 30.07 | -84 680 |
Пропилен | С 3 Н 6 (г) | 42.051 | 20 410 |
Пропан | С 3 Н 8 (г) | 44.097 | -103 850 |
н-бутан | С 4 Н 10 (г) | 58. | -126 150 |
Бензол | С 6 Н 6 (г) | 78.114 | 82 930 |
н-октан | С 8 Н 18 (г) | 114.231 | -208 450 |
н-октан | С 8 Н 18 (л) | 114.231 | -249 950 |
н-додекан | С 12 Н 26 (г) | 170,22 | -291 010 |
Спирт метиловый | CH 3 ОН(г) | 32.043 | -200 670 |
Спирт метиловый | CH 3 ОН(л) | 32. | -238 660 |
Спирт этиловый | C 2 H 5 ОН(г) | 46.069 | -235 310 |
Спирт этиловый | С 2 Н 5 ОХ(л) | 46.069 | -277 690 |
Кислород | О(г) | 16 | 249 190 |
Водород | Н(г) | 1,008 | 218 000 |
Азот | Н(г) | 14.006 | 472 650 |
Гидроксил | ОН(г) | 17. | 39 460 |
Адаптировано из ТЕСТ
( Т он
E эксперт
S система
для T (гермодинамика)
< www.thermofluids.net >
С. Бхаттачарджи, Государственный университет Сан-Диего
Стандартная энтальпия образования h3O (ж) составляет -286 кДж/моль, а стандартная энтальпия сгорания этана -1560 кДж/моль. Учитывая, что изменение энтальпии при изменении одного моля…
Химия Термодинамика
Кулачок Р.
спросил 11.10.20
Стандартная энтальпия образования h3O (ж) составляет -286 кДж/моль, а стандартная энтальпия сгорания этана -1560 кДж/моль. Учитывая, что изменение энтальпии при восстановлении одного моля этилена газообразным водородом до этана составляет -138 кДж/моль, рассчитайте стандартную энтальпию сгорания этилена.
Подписаться
І
1
Подробнее
Отчет
1 ответ эксперта
Лучший
Новейшие
Самый старый
Автор:
ЛучшиеНовыеСамыеСтарые
Дж.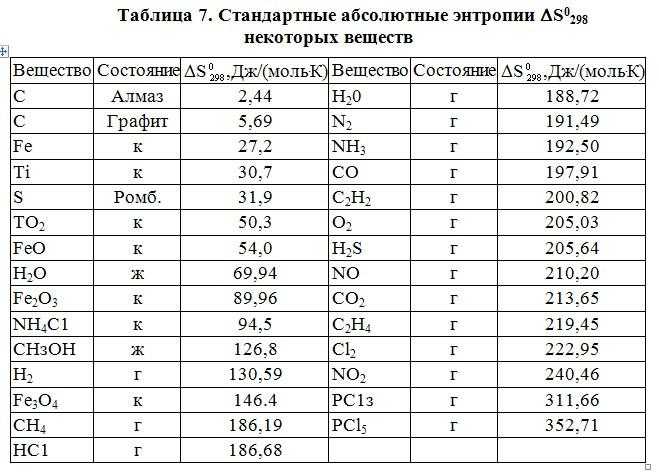 Р. С.
Р. С.
ответил 12.10.20
Репетитор
5,0
(136)
к.т.н. Профессор университета со стажем репетиторства более 10 лет
Об этом репетиторе ›
Об этом репетиторе ›
Это пример использования закона Гесса.
C 2 H 4 + 3O 2 ==> 2CO 2 + 2H 2 o 2 Н 4 + Н 2 ==> С 2 H 6 ∆H = -138 кДж/моль
Уравнение 2C 2C 2 H 6 + 7O 2 ==> 4CO 2 + 6H 2 o ∆H = -15607047 + 6H 2 O /моль
экв.3 2H 2 + O 2 ==> 2H 2 O ∆H = -286 кДж/моль
2 ==> C 2 H 6 ∆H = -138 кДж/моль
Скопируйте уравнение 2 ÷ 2: C 2 H 6 + 7/2O 2 0046 2 + 3H 2 O ∆H = -780 кДж/моль
Обратное уравнение 3 ÷ 2: H 2 O ==> H 2 + 1/2O 2 ∆3 кДж/моль
Складывая уравнения 1, 2 и 3, имеем.

 ) HCl (г.)
) HCl (г.) 013
013 043
043 123
123 043
043 008
008