Готовим электролит для аккумуляторов в домашних условиях самостоятельно. Электролит вода
Питьевые электролиты: особенности применения
Питьевые электролиты – это составы, призванные восполнять потерю природных электролитов (солей) в человеческом организме. Электролиты выпускаются в форме сухих составов (порошка, гранул, шипучих таблеток) для растворения в воде или готовых напитков.
Когда употреблять питьевые электролиты?
Питьевые электролиты иногда считают элементом только спортивного питания. Это логично объясняется интенсивной потерей солей при выделении пота во время интенсивных физических нагрузок. Солевые составы востребованы и необходимы во врачебной практике. Аптечный препарат регидрон, представляющий собой растворимую сухую смесь солей, назначают при диарее. На этот факт обратите внимание. Во время такого заболевания организм теряет соли вместе с выделяющейся жидкостью, но не может восполнить дефицит с помощью натуральных пищевых продуктов из-за назначенной диеты. Здоровый человек получает минеральные вещества с едой. Если занятия спортом ведутся на серьезном уровне, и рацион выбирается продуманно, соли поступают в достаточном количестве. Это не исключает вероятность резкого изменения концентрации электролитов, негативно сказывающегося на состоянии спортсмена. Необходимость употребления и дозировку питьевого электролита определяют с учетом интенсивности потери солей и состава напитка. Главный принцип – восполнять то, что потеряно.


Когда употреблять питьевые электролиты?
Виды питьевых электролитов
Питьевые электролиты в магазинах отличаются по составу и назначению. Базовая характеристика электролитических напитков — осмотическое давление раствора (ОД), указывающее на концентрацию частиц (солей, углеводов, подсластителей, консервантов и пр.).

 Катерина Лобанова:
Катерина Лобанова:Все БАДы, все витамины для семьи, все крема, я раньше покупала в аптеках, но сейчас я нашла более дешевый и качественный источник...
Подробнее>>
- В состав изотонических напитков кроме солей входит 6-8% углеводов. Осмотическое давление – 270-330 мосм/кг. Такие смеси восстанавливают баланс жидкости и подпитывают организм с помощью углеводов. Изотоники рекомендуют легкоатлетам, бегунам, участникам командных спортивных игр.
- Для гипотонических смесей характерно минимальные содержание углеводов и значение ОД. Рекомендуются при необходимости восстановления баланса солей воды и строгом контроле калорий. Гипотонические электролитические напитки подходят для наездников, гимнастов.
- Гипертонические электролиты содержат максимум углеводов в сравнении с другими видами. Используются как источники мышечного гликогена, углеводные добавки. Составы калорийны. Во время тренировок гипертонические электролиты сочетают с изотониками. В чистом виде гипертонические электролиты рекомендуют пить после тренировки. Рекомендованы для занятий спортом, требующих выносливости.
Об изотониках, как их принимать, сколько и зачем. Смотрите.
Вредные вещества в составе электролитических напитков
Обращайте внимание на состав смеси при выборе электролита.
- Сахар. В некоторых электролита содержание сахара достигает 18%. «Сахарные» углеводы не полезны для спортсмена. Эти вещества лучше получать из круп, фруктов и пр. Сладкий вкус напитка мешает утолению жажды.
- Кофеин. Вещество дает мгновенный «вброс» энергии, но может повышать давление и негативно влиять на работу сердца. Кофеин характеризуется мочегонным действием, что снижает результат действия электролита. Обратное действие объясняется увеличением интенсивности выведения солей.
- Лимонная кислота. Не рекомендуется при заболеваниях желудка. Вызывает аллергию. Чтобы не допустить разъедания эмали зубов лимонной или другими кислотами, напитки рекомендуют пить через соломинку.
- Искусственные красители, ароматизаторы. Практической пользы не несут. Опасны канцерогенным действием. Честный производитель делает соответствующую пометку на упаковке. Консерванты добавляют в готовые жидкие смеси, поэтому лучше приобретать сухие составы, приготавливая электролиты порционно.
Дозировка электролитов
Для предотвращения обезвоживания за 20 минут до занятий пьют 250 мл электролитического напитка. Во время занятий практикуется следующий режим: по 120-180 мл один раз в 15-20 мин. В идеале дозировка должна корректироваться спортивным врачом. диетологом, принимающим во внимание нюансы (степень нагрузки, биометрические параметры спортсмена).
Самостоятельное приготовление
Напитки-электролиты готовят самостоятельно. На литр воды добавляют щепотку соли и апельсиновый сквош (концентрированный сок):
- для изотонических смесей – 200 мл,
- для гипотонических электролитов – 100 мл,
- для гипертонических составов – 400 мл.
Даже если такие напитки уступают по моментальному результату покупным электролитам, они безопасны и полезны.
No tags for this post.fitexpert.biz
19.Вода как слабый электролит.Индикаторы.
Вода — один из наиболее слабых электролитов Химически чистая вода (дистиллированная) не проводит электрический ток. Но в ее составе есть небольшое количество заряженных частиц.
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый оранжевый | Красный (рН < 3,1) | Оранжевый (3,1 < рН < 4,4) | Желтый (рН > 4,4) |
| Метиловый красный | Красный (рН < 4,2) | Оранжевый (4,2 < рН < 6,3) | Желтый (рН > 6,3) |
| Фенолфталеин | Бесцветный (рН < 8,0) | Бледно-малинов. (8,0 < рН < 9,8) | Малинов. (рН > 9,8) |
| Лакмус | Красный (рН < 5) | Фиолетовый (5 < рН < 8) | Синий (рН > 8) |
При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно донором и акцептором протонов по отношению к самой себе.
2h3O ↔ h4O+ + OH-
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если h4O+ заменить на H+
h3O ↔ H+ + OH-
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H+]·[OH-]/[h3O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H+]·[OH-]
При температуре 25ºС KН2О = 1·10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H+]·[OH-] = 1·10-14
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H+] = [OH-], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14)
При нейтральном характере раствора, т.е. [H+] = [OH-], получаем следующее:
[H+] = [OH-] = (KН2О)1/2 = (1·10-14)1/2 = 10-7 М
Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняетхарактер среды. Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
водородным показателем pH:
pH = -lg[H+] = lg (1/[H+])
Отметим, что изменению [H+] в 10 раз соответствует изменение pH всего на 1 единицу.
pOH = -lg[OH-] = lg (1/[OH-])
pH и pOH нейтрального раствора равен 7:
pH = -lg[H+] = -lg(1·10-7) = 7
| Нейтральная среда | pH = pOH = 7, pH + pOH = 14 |
| Кислая среда | pH ˂ pOH, pH ˂ 7, pH + pOH = 14 |
| Щелочная среда | pH > pOH, pH > 7, pH + pOH = 14 |
Индикаторы − органические вещества, принимающие характерную окраску в нейтральной, кислотной и щелочной среде, в зависимости отзначения рН.
studfiles.net
Что доливать в аккумулятор: дистиллированную воду или электролит
Аккумулятор – это источник жизненной силы для транспортного средства. С одной стороны, его сложно отнести к важнейшим для машины агрегатам, с другой стороны, без аккумуляторной батареи машина просто не заведётся. Несмотря на распространённое мнение, что в процессе работы аккумуляторная батарея имеет свойство самостоятельно заряжаться, такой процесс не является константным, а срок службы АКБ ограниченный. Всё чаще современные «умельцы» пытаются собственными силами продлить эксплуатационный период автомобильного аккумулятора путём его заправки. На этом этапе у многих автовладельцев, которые сталкиваются с такой проблемой впервые, возникает вопрос, чем заполнить АКБ, что заливать: дистиллированную воду, или необходимо заправлять электролит?

Рекомендации по обслуживанию аккумулятора.
Как изменяются свойства электролита в АКБ транспортного средства
Многие профессионалы вопрос, что залить в АКБ, считают абсолютно некорректным, так как устройство причисляется к неремонтопригодным элементам. Однако хороший аккумулятор – это далеко не дешёвое удовольствие, потому желание продлить его эксплуатационный период автовладельцами вполне объяснимо. Чтобы заправка батареи не повлекла за собой её полного выхода из строя, для начала необходимо разобраться в процессах, которые происходят во время функционирования АКБ при её систематических зарядках и разрядках.
Изначально, с завода, в аккумуляторе находится эмульсия, которая состоит на тридцать пять процентов из серной кислоты, при этом оставшиеся шестьдесят пять процентов объёма составляет дистиллят – очищенная вода, без примесей. В процессе функционирования устройство нагревается, проистекает реакция электролиза, а часть воды под воздействием высокой температуры испаряется, собирается в качестве конденсата на внутренней поверхности агрегата. Если аккумулятор имеет абсолютно герметичную конструкцию, в корпусе отсутствуют механические повреждения, то пар при остывании превращается в воду и стекает по стенкам устройства обратно. Если имеются повреждения корпуса в результате эксплуатации устройства или же вследствие плохого качества изготовления товара, вода испаряется из АКБ безвозвратно. В результате этого процесса жидкость в АКБ становится более концентрированной, плотность кислоты возрастает. Это отражается на критериях выдачи устройством напряжения, его работоспособности.
Кроме природного процесса испарения при рабочих температурах, в батарее происходит так называемая реакция сульфатации – оседание солей кислоты на свинцовых планках батареи. В результате такого процесса концентрация электролита уменьшается. Прецеденты, когда плотность электролита падает, чаще всего провоцируются нерегулярным функционированием батареи в результате продолжительного простоя машины или некорректной эксплуатации АКБ – подача слишком большой силы тока на устройство или серьёзные неисправности в электронике транспортного средства.
Вода или электролит: какой жидкости отдать предпочтение
Первое правило при проведении любых работ по ремонту или обслуживанию функционирующих устройств автомобиля – не навредить. В случае с обслуживанием аккумулятора, доливка «не той» жидкости может полностью вывести его из строя. С вышеописанной информации понятно, что снижение эффективности работы аккумуляторной батареи может стать как результатом сульфатации – понижения коэффициента кислоты в агрегате, так и следствием испарения воды. Прежде чем принять решение, что заливать, воду или электролит, важно сначала разобраться с причинами, которые повлияли на эксплуатационные характеристики батареи.
Если причиной послужило снижение процента кислоты в составе жидкости в АКБ, то заливать в устройство нужно именно электролит. При заправке дистиллята процент кислоты в аккумуляторе снизится ещё больше, что сделает невозможным дальнейшее эксплуатирование зарядного устройства. В ситуации, когда причиной неисправности агрегата послужило испарение дистиллированной воды, заправка щелочной жидкостью батареи спровоцирует пропорциональное возрастание кислоты в устройстве, что повлечёт интенсивную сульфатацию. Кислотные компоненты будут оседать на пластинах, разрушая их, что повлечёт безвозвратную непригодность к эксплуатации зарядного элемента. В этом случае заливается дистиллят – только так можно продлить жизнь батарее.
Чем заправить аккумулятор?
Прежде чем приступать к решению вопроса, что доливать в аккумулятор – воду или электролит, важно определиться, нужна ли дозаправка механизма вообще. С этой целью нужно внимательно осмотреть имеющийся у вас агрегат. Преимущественно корпус всех батарей изготовлен из прозрачного пластика, что позволяет визуально определить количество электролитического раствора внутри. На корпусе АКБ практически всегда имеются пометки, по которым можно определить, нужна доливка эмульсии или нет.
Если корпус изготовлен из непрозрачного материала, осуществить проверку уровня эмульсии можно следующим способом:
- Открутите пробку аккумулятора. Предварительно тщательно очистите фронтальную поверхность агрегата, чтобы при его вскрытии в систему не попали частицы грязи.

- Взять прозрачную трубку диаметром не более пяти миллиметров, опустить её до упора в проём.

- Закрыть плотно пальцем наружный конец трубки и вытянуть из системы приспособление, не отпуская пальца.
- Нормальными считаются критерии, когда высота жидкости в вытянутой трубке составляет примерно полтора сантиметра. При несоответствии параметров нужна доливка или извлечение лишней жидкости.

Если факт необходимости доливки установлен, дальше нужно определиться, что потребуется залить в АКБ. Помочь в этой ситуации сможет специальное приспособление под названием «ареометр», с помощью которого измеряется плотность раствора в батарее. На основании результатов проверки и устанавливается причина неисправности механизма, решается дилемма, что доливать в аккумулятор, воду, или всё-таки электролит. С помощью прибора измерьте плотность аккумуляторной жидкости: в норме она должна быть от 1,27 до 1,29 грамма на сантиметр кубический. Если плотность значительно меньше, тогда добавлять потребуется электролит. Плотность, превышающая показатель 1,29 единицы, говорит о том, что в батарею добавить необходимо воду.
Процедура добавки воды и электролита осуществляется по аналогичной схеме:
- Если корпус прозрачный, осуществите добавку необходимой жидкости до уровня, отмеченного на самом АКБ с помощью груши или шприца. В ином случае добавляйте жидкость порционно, систематически проверяя её уровень с помощью прозрачной трубки по вышеописанному алгоритму.

- После добавки жидкости закрутите пробку и хорошо встряхните аккумулятор, чтобы раствор основательно размешался в системе. Проверьте ещё раз плотность. Если результат не соответствует норме, отберите часть эмульсии с помощью шприца и ещё раз осуществите доливку необходимой жидкости. Осуществите повторный контроль полученного раствора.
- Когда показатели достигли нормальных параметров, оставьте агрегат постоять несколько часов, можно его на это время поставить на щадящую зарядку, чтобы жидкость максимально хорошо перемешалась, приобрела однородную консистенцию. После истечения указанного времени осуществите контрольную проверку плотности раствора в батарее. Нормальные показатели свидетельствуют о правильности выполненных процедур и о возможности дальнейшей эксплуатации АКБ.

При выполнении процедуры «воскрешения» аккумулятора помните, что некорректность выполненной работы сможет не только привести к полной неисправности агрегата, но и повлечь за собой проблемы с автомобильной электроникой. Очень тщательно проверяйте показания одометра – и у вас всё получится. При необходимости залива дистиллята ни в коем случае не заливайте обычную воду из-под крана – в ней имеется масса добавок, которые негативно отразятся на функционировании и эксплуатационном периоде батареи.
Подведём итоги
Продлить срок эксплуатации механизмов и систем, которые непосредственно задействованы в функционировании транспортного средства – желание каждого автовладельца, так как покупка любого механизма или аксессуара является дополнительной финансовой растратой. В случае с аккумулятором специалисты и профессионалы настоятельно рекомендуют не экспериментировать, особенно если имеющееся устройство относится к категории бюджетных товаров, при его выходе из строя советуют купить новую батарею. Попытки восстановления функционирования АКБ с помощью её заправки только на время продлят эксплуатационный срок агрегата, потому покупка нового зарядного устройства неизбежна. Лучше приобретите сразу качественный аккумулятор для своей машины, который при правильной эксплуатации прослужит вам многие годы.
Лучшие цены и условия на покупку новых авто
Кредит 9.9% / Рассрочка / Trade-in / 98% одобрений / Подарки в салоне Мас Моторс
Мас Моторс rating-avto.ru
Приготовление электролита для аккумуляторов своими руками
В настоящее время выбор аккумуляторных батарей огромен — в продаже можно найти уже готовые к использованию источники питания, а также сухозаряженные батареи, которые требуют осуществить приготовление электролита и его заливку до начала эксплуатации. Дальнейшее обслуживание аккумуляторов многие часто осуществляют в сервисах. По разным причинам может возникнуть необходимость самостоятельно приготовить раствор. Чтобы это мероприятие увенчалось успехом, следует знать, как сделать электролит в домашних условиях.
Что такое электролит?

Электролит — электропроводящий раствор, содержащий в своём составе дистиллированную воду и серную кислоту, едкий калий или натрий в зависимости от типа источника питания.
Концентрация серной кислоты в АКБ
Этот показатель кислотности напрямую зависит от необходимой плотности электролита. Изначально средняя концентрация этого раствора в автомобильном аккумуляторе — около 40% в зависимости от температуры и климата, в которых используется источник питания. Во время эксплуатации концентрация кислоты падает до 10–20%, что сказывается на работоспособности АКБ.
Вместе с тем стоит понимать, что аккумуляторная серная составляющая — наичистейшая жидкость, которая на 93% состоит непосредственно из кислоты остальные 7% — примеси. На территории России производство этого химиката строго регламентировано — продукция должна соответствовать требованиям ГОСТ.
Отличия электролитов для разных типов аккумуляторов
Несмотря на то что принцип работы раствора одинаков для разных источников питания, следует знать о некоторых различиях составов. В зависимости от состава принято выделять щелочной и кислотный электролиты.
Щелочные АКБ

Этот вид источников питания характеризуется наличием гидроокиси никеля, окиси бария и графита. Электролит в этом виде аккумуляторов представляет собой 20% раствор едкого калия. Традиционно используется добавка моногидрата лития, которая позволяет продлить срок эксплуатации АКБ.
Щелочные источники питания отличаются отсутствием взаимодействия калийного раствора с веществами, образуемыми во время работы аккумулятора, что способствует аксимальному уменьшению расхода.
Кислотные АКБ

Этот вид источников питания является одним из самых традиционных, поэтому и раствор в них знаком многим — смесь дистиллированной воды и серного раствора. Концентрат электролита для свинцово-кислотных аккумуляторов дешёво стоит и характеризуется способностью проводить ток большой величины. Плотность жидкости должна соответствовать климатическим показателям.

Таблица 1. Рекомендуемая плотность электролита
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?

Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов. Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.

Таблица 2. Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Как правильно приготовить электролит в домашних условиях: техника безопасности
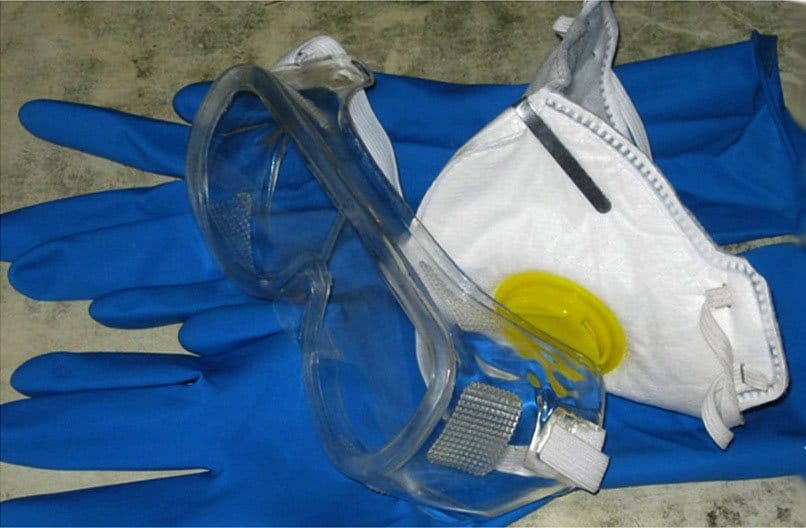
Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
- резиновые перчатки
- одежду и фартук, устойчивый химическим веществам;
- защитные очки;
- нашатырный спирт, кальцинированную соду или борный раствор, чтобы нейтрализовать кислоту и щёлочь.
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
- ёмкость и палочка, устойчивые к воздействию кислот и щелочей;
- дистиллированная вода;
- инструменты для измерения уровня, плотности и температуры раствора;
- аккумуляторная серная жидкость — для кислотной АКБ, твёрдые или жидкие щелочи, литий — для соответствующих видов АКБ, силикагель — для гелевых аккумуляторов.
Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
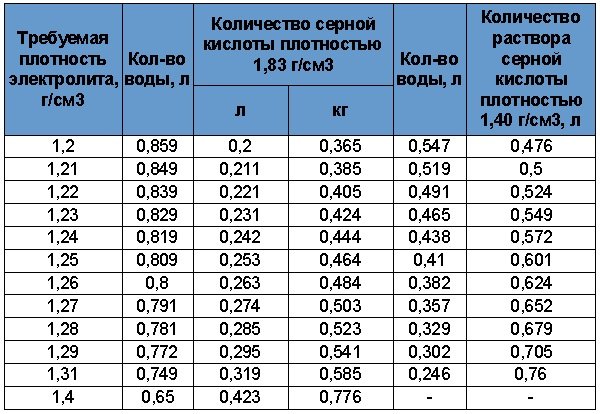
Таблица 3. Пропорции воды и серной кислоты.
- В ёмкость, устойчивую к едким веществам, налейте нужный объем воды.
- Разбавлять воду кислотой следует постепенно.
- По окончании процесса вливания замеряйте плотность получившегося электролита с помощью ареометра.
- Дайте составу отстояться около 12 часов.
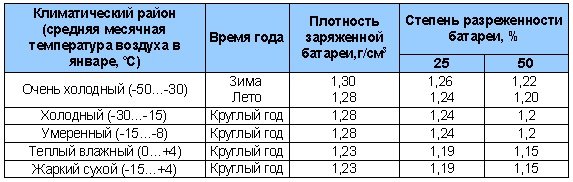
Таблица 4. Плотность электролита для разных климатов.
Концентрация кислотного раствора должна соотноситься с минимальной температурой, при которой эксплуатируется аккумулятор. Если жидкость получилась слишком концентрированной, её необходимо разбавить дистиллированной водой.
Смотрите видео, как измерить плотность электролита.
Внимание! Вливать воду в кислоту нельзя! В результате этой химической реакции может возникнуть закипание состава, что приведёт к его расплескиванию и возможности получить кислотные ожоги!
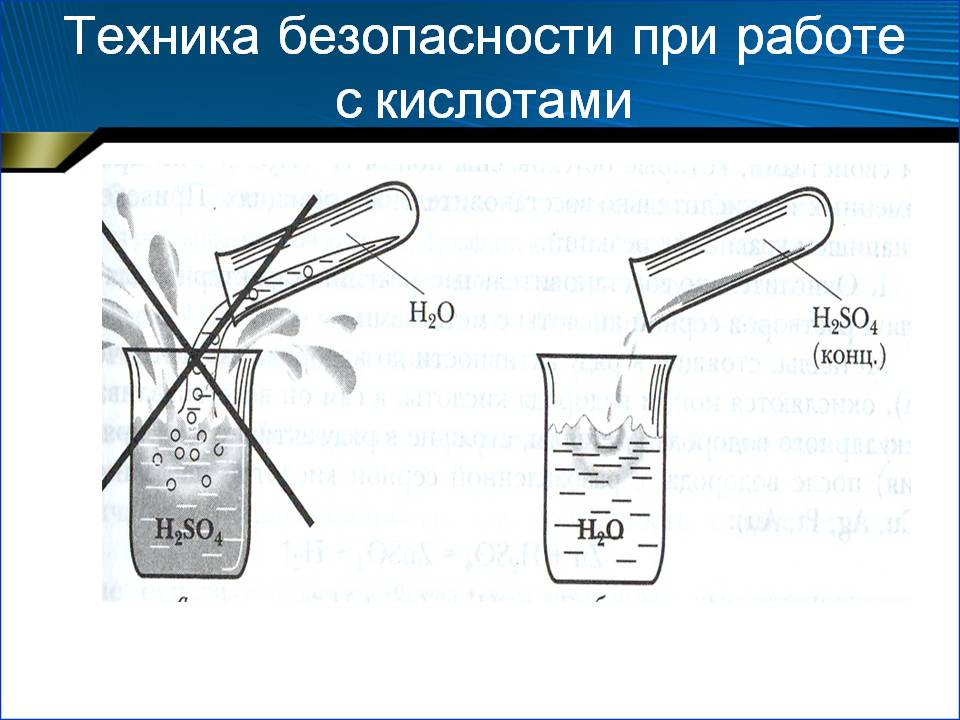
Обращаем ваше внимание, что во время смешивания компонентов выделяется тепло. В подготовленный аккумулятор следует заливать остывший раствор.
Способ развести электролит для щелочного источника питания
Плотность и количество электролита в таких аккумуляторах указана в инструкции по эксплуатации источника питания или на сайте компании-производителя.
| Необходимая плотность раствора | Количество твёрдой щелочи равняется количеству электролита, разделенному на |
| 1,17–1,19 г/см³ | 5 |
| 1,19–1,21 г/см³ | 3 |
| 1,25–1,27 г/см³ | 2 |
- Влейте в посуду дистиллированную воду.
- Добавьте щелочь.
- Смешайте раствор, герметично его закройте и дайте настояться в течение 6 часов.
- По истечении времени слейте образовавшийся светлый раствор — электролит готов.
При появлении осадка следует его перемешивать. Если к концу отстаивания он остаётся, слейте электролит так, чтобы осадок не попал в аккумулятор — это приведёт к уменьшению срока его эксплуатации.
Внимание! Во время работ температура щелочного раствора не должна превышать 25 градусов по Цельсию. Если жидкость чрезмерно нагревается, охладите её.
После приведения раствора к комнатной температуре и его заливке в аккумулятор, источник питания необходимо полностью зарядить током, составляющим 10% от ёмкости АКБ (60Ач — 6А).
Как видите, приготовление раствора электролита не такое сложное дело. Главное, следует чётко определиться с необходимым количеством ингредиентов и помнить о безопасности. Вы пробовали развести электролит своими руками? Поделитесь опытом с нашими читателями в комментариях.
akkumulyatoravto.ru
Что доливать в аккумулятор - воду или электролит? Обслуживание аккумулятора автомобиля. Уровень электролита в аккумуляторе
Любой, даже начинающий автомобилист знает, что своевременное обслуживание автомобиля очень важно для комфортной его эксплуатации. Поэтому проверка основных его основных частей, приборов и датчиков перед поездкой – обязательный ритуал водителя. Также важное условие – периодический осмотр и ремонт ТС квалифицированными мастерами на станциях технического обслуживания автомобилей. Но многие автовладельцы в процессе увеличения своего водительского стажа начинают самостоятельно разбираться в основных частях и механизмах своего транспортного средства. Поэтому в большинстве случаев способны осуществить ремонт и обслуживание его устройств самостоятельно.
К таким основным частям в ТС стоит отнести аккумулятор. При нормальном раскладе такая батарея заряжается во время работы автомобиля. Но нередки случаи, когда при неисправности других устройств в машине его необходимо заряжать при помощи специального устройства. Такие условия эксплуатации влияют на быстрый износ устройства. К тому же время от времени его необходимо заправлять. Многие часто путаются, что доливать в аккумулятор: воду или электролит. Какие функции выполняет это устройство, как определить в нем уровень, как и чем правильно заправить, разберемся в этой статье.
Понятие аккумулятора
Это специальный механизм, который используется в транспортном средстве непосредственно для его запуска и дальнейшей работы. Кроме этого, такое устройство призвано оптимизировать работу пиков напряжения в момент запуска транспортного средства.
Понятие электролита
Для эффективной работоспособности аккумулятора обязательно используется электролит. Он представляет собой раствор соляной кислоты и дистиллированной воды. Здесь не должны использоваться сторонние примеси. В противном случае это изменит его плотность. Для правильной работоспособности важен также и уровень электролита в аккумуляторе. Если он будет ниже положенной нормы, то в дальнейшем это неизбежно приведет к нестабильной работе вспомогательного источника электроэнергии транспортного средства, и владелец не сможет нормально завести машину. При этом высохнут внутренние пластинки, а мощность батареи значительно снизится. Также не стоит превышать достаточный уровень жидкости в системе. В противном случае в дальнейшем это приведет к полной или частичной поломке этого механизма. Батарея станет быстрее разряжаться. Поэтому уровень электролита в аккумуляторе обязательно должен быть стабильным. Это позволит обеспечить нормальную работу транспортного средства.
Когда необходима заправка аккумулятора

Согласно мнению многих специалистов, автомобильная батарея не подлежит техническому обслуживанию. Поэтому вопрос о том, что доливать в аккумулятор: воду или электролит - некоторые мастера считают неактуальным. Но это если он используется в нормальных условиях. Если автовладелец любит путешествовать на своем транспортном средстве на дальние расстояния, то он обязательно должен учесть данный параметр. В составе электролита обязательно используется водная масса. В процессе работы устройства она может испариться. Жидкость может начать активно переходить в парообразное состояние в случае полной и частичной неисправности реле-регулятора. К основным моментам неисправности механизма обязательно надо отнести:
- Появление сильного пара из заливных отверстий.
- Появление капель электролита на корпусе АКБ.
- Большой нагрев аккумулятора в процессе работы транспортного средства.
Также стоит учитывать тип батареи. Они бывают обслуживаемыми и необслуживаемыми. В первом случае испарение будет больше, поэтому именно для них актуален вопрос о том, что доливать в аккумулятор: воду или электролит. В необслуживаемых батареях жидкость находится в герметичном корпусе. Поэтому в процессе эксплуатации жидкость все же поднимается вверх, но не выходит за границы корпуса, и впоследствии снова опускается вниз, выпадая в осадок. В таких устройствах цикл замкнутый. Такие аккумуляторы не требуют проверки в них жидкости. 
Способы проверки уровня электролита
Как отмечено ранее, такой проверки требуют только обслуживаемые аккумуляторы. К первому способу проверки обязательно надо отнести визуальный осмотр. Как правило, корпус батареи устройства делается прозрачным. Здесь ставятся различные отметки. Они указывают на уровень жидкости. Поэтому визуально можно отследить количество электролита в системе.
Но не все модели обслуживаемых аккумуляторов выполняются с прозрачным корпусом. В этом случае автовладелец может воспользоваться специальной прозрачной трубочкой, которая имеет диаметр 5 мм.
Для проведения проверки:
- необходимо открутить крышку батареи;
- отпустить трубку в жидкость до упора;
- пальцем плотно зажать внешнее отверстие;
- достать трубку.
Уровень электролита должен соответствовать уровню его столба в такой трубке.
Что делать при несоответствии уровня электролита
Автовладелец должен знать, что уровень высоты жидкости в трубке должен быть в пределах 15 мм. Если эта норма превышена, то следует убрать лишний раствор. Для этого понадобится резиновая груша или шприц. 
При низком показателе электролита в раствор можно залить воду. Доливают ли электролит в аккумулятор? Ответ на этот вопрос можно получить, проанализировав состав раствора в батарее. Как уже отмечалось, это вода и раствор соляной кислоты. В процессе эксплуатации испаряется только вода, поэтому она и доливается во время обслуживания. Но если плотность раствора слишком мала, то для ее повышения доливается кислота. Поэтому, отвечая на вопрос о том, что доливать в аккумулятор: воду или электролит - необходимо сначала измерить плотность раствора. Сделать это можно самостоятельно.
Проверка плотности электролита
Автовладелец обязан знать и о том, что, кроме уровня электролита, необходимо проверять и его плотность. Поэтому перед тем, как долить дистиллированную воду в аккумулятор, стоит обязательно проверить плотность раствора.
Сделать это можно специальным прибором под названием "ареометр". Он имеет форму поплавка. Он имеет соответствующую шкалу, градуированную в единицах плотности. Сверху расположен баллон. Именно в него поступает раствор. Уровень жидкости должен обеспечивать нормальное передвижение поплавка в вертикальном положении. Показатель плотности электролита в АКБ должен оставаться в пределах 1,25-1,3 г/куб. см. Когда уровень отклоняется в большую сторону, применяется дистиллированная водная масса. Если такой уровень отклонился в меньшую сторону, то используется специальный корректирующий электролит. Он значительно повышает плотность используемой жидкости в системе.
Как долить дистиллированную воду в аккумулятор

Если плотность выше нормы, это свидетельствует об испарении жидкости, которую необходимо добавить. Сколько воды доливать в аккумулятор? Уровень раствора в АКБ необходимо поддерживать на 1-1,5 см выше уровня пластин. Нельзя добавлять дистиллированную воду больше разрешенной нормы. После заправки обязательно следует повторно проверить плотность жидкости, предварительно зарядив батарею.

Заключение
На основании вышеизложенного обязательно надо сделать вывод о том, что для обеспечения нормальной работоспособности транспортного средства владелец обязательно должен отслеживать уровень электролита в аккумуляторе автомобиля. В ином варианте водитель просто не заведет свое транспортное средство. Уровень не должен отклоняться в большую или меньшую сторону. В дальнейшем это обязательно приведет к неисправностям в работе системы. Кроме отслеживания уровня электролита, надо внимательно следить и за его плотностью. Если установленный показатель отклоняется, нужно совершать определенные действия по увеличению или уменьшению уровня плотности в системе. Можно ли доливать воду в аккумулятор? Да, но только в том случае, если плотность раствора в АКБ выше нормы.
fb.ru
Кокосовая вода: оптимальный природный электролит
Кокосовая вода – питательная жидкость, содержащаяся в орехах и представляющая собой питательную среду для развития ростка. В состав входит сбалансированный минеральный комплекс, поэтому кокосовая вода — универсальный природный электролит.
Электролиты в организме
В организме человека электролитами выступают солевые растворы. Внутриклеточная и околоклеточная жидкость содержит анионы и катионы, поэтому состав электронейтрален, но заряженные частицы передают нервно-электрические импульсы в тканях нервов, мышц и даже в миокарде. Поддержание водно-солевого или электролитического баланса важно для организма. При снижении содержания калия почки увеличивают выделение мочи. Изменение баланса влияет на работу организма. При повышении содержания солей (после употребления сильно соленой пищи) возникает жажда. Употребление воды восстанавливает концентрацию. Дефицит электролитов приводит к нарушению нервно-импульсных реакций. При недостатке соли возникают судороги.
Опасность представляет собой изменение содержания калия.

 Катерина Лобанова:
Катерина Лобанова:Все БАДы, все витамины для семьи, все крема, я раньше покупала в аптеках, но сейчас я нашла более дешевый и качественный источник...
Подробнее>>
- Гипокалиемия (недостаток) опасна возникновением мышечных болей и аритмии. При дефиците калия возникают мышечные боли, аритмия, раздражительность, слабость. Критическое состояние – паралич.
- Гиперкалиемия (избыток) приводит к почечной недостаточности, замедлению сердечных ритмов, остановке сердца.
Поскольку опасны и недостаток, и избыточность солей, важно внимательно подходить к выбору средств для восстановления электролитического баланса.
Восстановление электролитного баланса


Кокосовая вода — чудесный напиток.
Физические нагрузки приводят к нарушению электролитического баланса. Потеря солей происходит при выделении пота. Пот соленый на вкус, а на одежде он оставляет характерные белые разводы. Это – удаленные из организма, но необходимые ему вещества. Для восстановления баланса рекомендуют употреблять:
- минеральную воду,
- соки фруктов и овощей (предпочтительно красного, оранжевого или желтого цвета),
- специальные напитки для спортсменов,
- кокосовую воду.
Употребление напитков-электролитов нужно при интенсивных нагрузках, если тренировки длятся от 45 минут. Они рекомендован бегунам-стайерам, приверженцам силовых видов спорта.
Преимущества кокосовой воды
Кокосовая вода лучше других напитков подходит для восстановления электролитического (солевого) баланса. В составе содержатся в достаточном количестве задействованные в механизме электролитических реакций микроэлементы – калий (250 мг на 100 мл) и натрий (105 мг на 100 мл). В состав кокосовой воды входят:
- комплекс витаминов группы B (B1, B6, B12),
- аминокислоты, необходимые для жизнедеятельности,
- кальций,
- фосфор,
- железо,
- магний,
- цинк,
- энзимы и цитокинины, требующиеся для сохранения прочности и функционирования оболочек клеток,
- селен,
- рибофлавин,
- витамин C.
Кокосовая вода в диетическом питании
Кокосовую воду рекомендуют употреблять при необходимости снизить вес или предотвратить набор массы. Нельзя сказать, что этот полезный напиток станет универсальным способом устранить лишние килограммы. Если запивать кокосовой водой калорийные блюда, вес не снизится. В то же время употребление кокосовой воды во время диеты дает преимущества.
- Из-за низкого гликемического индекса напитка, им можно «погасить» острое желание съесть сладкое
- Восстановление солевого баланса устраняет приступы жажды и чрезмерное употребление воды.
- Кокосовая вода выводит токсины и шлаки.
- Собственная калорийность кокосовой воды 17-20 кКал.
Употребление кокосовой воды
- Лучше употреблять натуральную кокосовую воду из плодов пальмы. В этом случае жидкость содержит полный комплекс необходимых веществ. Скорлупа защищает содержимое от воздействия внешних факторов, в том числе, разрушающих некоторые вещества ультрафиолетовых лучей. Кроме того, в орехе кокосовая вода стерильна, скорлупа играет роль природного фильтра.
- Кокосовую воду продают в герметичной таре. При покупке важно выбирать светонепроницаемую упаковку.
- Кокосовая вода в сублимированном виде входит в состав специальных напитков для спортсменов.
fitexpert.biz
Электролит вода - Справочник химика 21
Рассмотренная реакция хлора с водой лежит в основе получения солей хлорноватистой кислоты. Гипохлориты получают пропусканием хлора в охлажденные растворы едких щелочей. Для этого через холодный раствор едкого натра концентрацией до 30% пропускают газообразный хлор. В конце процесса получения гипохлорита температура не должна превышать 35 °С. Вначале хлор гидролизуется водой. В присутствии щелочи гидролиз идет до конца равновесие полностью смещается вправо, так как получается слабый электролит — вода, в результате весь хлор, взаимодействуя с щелочью, превращается в хлорид и гипохлорит натрия, в которых хлор имеет степени окисления —1 и -f-1. [c.253] К обменным ионным процессам относятся также реакции нейтрализации, в результате которых образуется слабый электролит— вода, например [c.262]В опыте Г при смешивании растворов двух сильных электролитов — соляной кислоты и едкой щелочи — происходит уменьшение электропроводности раствора смеси за счет того, что в результате химического взаимодействия помимо сильного электролита хлорида натрия образуется очень слабый электролит — вода, [c.65]
С рассмотренной точки зрения становится ясным различие между реакциями нейтрализации сильной кислоты сильным основанием и случаями нейтрализации, когда хотя бы одно из исходных веществ — слабый электролит. При нейтрализации сильной кислоты сильным основанием в растворе образуется только один слабый электролит — вода. При этом равновесие [c.252]
При смешении двух растворов они будут взаимно способствовать смещению равновесия в обеих реакциях гидролиза в сторону продуктов гидроксид-ионы и ионы водорода связываются в слабый электролит — воду. Окончательное уравнение реакции [c.83]
Здесь направляет реакцию слабый электролит — вода. [c.143]
Следует также иметь в виду экспоненциальную зависимость растворимости газов в воде от значения коэффициента Сеченова. По этой причине погрешность в расчете коэффициента Сеченова при-большой концентрации электролита может приводить к заметному искажению величины, предсказываемой растворимости газа в содержащей электролит воде. [c.107]
Для осуществления катодной защиты необходимо наличие следующих условий вокруг защищаемой поверхности металла необходима токопроводящая среда — электролит, вода, влажный бетон и т. п., обеспечивающая распределение тока по всей поверхности защищаемая конструкция должна иметь возможно более простую конфигурацию сила тока, необходимая для защиты, не должна быть опасной для людей при случайном контакте. [c.377]
При добавлении щелочи к ацетатному буферному раствору ионы ОН будут связываться с ионами водорода, образовавшимися при диссоциации уксусной кислоты, образуя еще более слабый электролит — воду, что вызывает последующую диссоциацию кислоты. В результате концентрация ионов Н+ в буферном растворе изменится незначительно [c.14]
Здесь направляет реакцию слабый электролит—вода. [c.28]
Здесь направляющими реакцию веществами являются слабый электролит—вода (в правую сторону) и слабый электролит—уксусная кислота (в левую сторону). [c.122]
Разбавить электролит водой до нужной концентрации [c.44]
Следовательно, если к буферному раствору, содержащему кислоту, прибавить сильную щелочь, то ионы водорода, образующиеся при электролитической диссоциации кислоты НАп, связываются с ионами гидроксила прибавленной щелочи, образуя слабый электролит—воду. Вместо израсходованных ионов водорода, вследствие последующей диссоциации кислоты НАп, появляются новые ионы водорода. В результате концентрация Н+-ионов в буферном растворе изменится очень незначительно. [c.85]
Разбавить электролит водой и добавить олова [c.149]
Полученный фторборат меди подкисляют раствором HBF4 до требуемого значения pH, добавляют борную кислоту, оказывающую буферное действие, после чего заливают электролит водой до рабочего уровня и приступают к работе без специальной проработки. [c.48]
Разбавить электролит водой и добавить олова до нормы [c.149]
Слить часть электролита и разбавить оставшийся электролит водой [c.136]
Коричневая просвечивающая пленка на деталях или белые полосы Плотность электролита выше, чем 1,77 г/см Разбавить электролит водой до плотности 1,77 г/см и прогреть при 373 К в течение 1 ч [c.193]
Разбавить электролит водой до достижения удельного веса 1,74 Г/сж и прогреть при температуре 90—110° С в течение 1 ч Увеличить время электрополирования до 8—10 мин [c.145]
Разбавить электролит водой до удельного веса 1,6 Псм Проработать электролит [c.152]
Абсолютные значения диффузиониых потенциалов (табл. 6.3) невелики и обычно не превышают нескольких сотых вольта, хотя на границах растворов кислот и щелочей они могут составлять и десятые доли вольта. В технической электрохимии поэтому диффузионные потенциалы, как правило, не учитываются. Правда, иногда, например при промышленном электролите воды, применяются меры для их снижения с целью уменьшения расхода электроэнергии. [c.153]
В данном случае образуются очень слабый электролит (вода) и газ (диоксид серы). Оба продукта смещают равновесие вправо (AG298 = —9,7 ккал/моль). Повышение температуры будет способствовать течению этой реакции (Л5>0). [c.198]
В качестве эмпирического обоснования существующего теоретического подхода служат правила, установленные Кольрау-шем (1893 г.) при исследовании электрической проводимости большого числа двойных систем электролит — вода. [c.450]
Используя 3%-иую амальгаму отрафипироваиного цинка в качестве анода, можно получить с хорошим выходом в зависимости от рода электролита самые разнообразные соединения цинка особой чистоты гидроокись (электролит—вода), карбонат (электролит—вода, насыщаемая углекислым газом), ацетат (электролит —уксусная кислота) и т, д. [104]. При анодном растворении амальомы с получением особо чистых соединений необходим стро[ий контроль поте Щиала анода. Послс перехода металла из амальгамы в растнор наблюдается увеличение потенциала анода до значений, необходимых для окисления ртути. В электролите увеличивается содержание примеси ртути и появляется муть из-за обрачования малорастворимых соединений [85, 05]. [c.393]
Ход определения. Навеску пробы 2 г растворяют в смеси 40 мл серной (1 4) и 2 лл борофтористоводородной кислот, осторожно нагревая раствор для ускорения растворения. Окисляют раствор небольшим избытком концентрированной азотной кислоты, добавляя ее по каплям, затем доливают еш е 5 мл кислоты. Раствор кипятят 2—3 мин для удаления окислов азота, охлаждают и разбавляют водой до объема 300 мл. Высушивают катод (см. примечание 1) 15 мин при 105 С, охлаждают его в эксикаторе и взвешивают. Закрепляют оба электрода (см. примечание 1) в ячейке для электролиза. расположив их как можно ближе к дну стакана с раствором. Если нужно, разбавляют электролит водой так, чтобы сетка и обод катода оказались под слоем электролита, и закрывают стакан стеклянной крышкой с отверстием. Проводят электролиз при напряжении 6—12 в и силе тока 2—3 а до полного выделения меди. [c.46]
Выход диметилсуберината заметно снижается при увеличении содержания в электролите воды и свободной глутаровой кислоты. Выход диметилового эфира пробковой кислоты следующим образом зависит от содержания в электролите воды [c.142]
Поставить электролит иа проработку, а при большом содержании примесей сме нить электролит Слкть часть электролита и разбавить оставшийся электролит водой [c.93]
Это положение объясняет причины коррозии железного предмета, частично погруженного в воду или электролит. Вода около границы вода — воздух содержит больше растворенного кислорода, чем более глубокие ее слои. Вследствие этого железный предмет, погруженный частично в воду, образует гальванический элемент, замкнутый через массу металла, и корродирует. Коррозия такого железного предмета начинается с глубоко лежащих под водой з астков, а не на границе вода — воздух, как этого можно было бы ожидать. Такой ход процесса коррозии объясняется тем, что чем дальше от поверхности находится слой воды, тем меньше в нем растворено воздуха. Поэтому участки железного предмета, находящиеся в более глубоких слоях воды, являются анодами и начинают корродировать, участки же, нахо-дяпшеся очень близко к границе вода — воздух, являются катодами и поэтому не корродируют. [c.22]
Классическим примером в этом направлении является гипотеза Мак-Иннеса [139], согласно которой в водных растворах хлорида калия коэффициент активности иона калия равен коэффициенту активности иона хлора. Гипотеза Мак-Иннеса основана на правиле ионной силы (см. также [140]), поэтому ее применение ограничено разбавленными растворами (бинарных смесях электролит — вода индивидуальные коэффициенты активности ионов равны среднегеометрическому коэффициенту активности электролита. Для многокомпонентных растворов 1,1-электролитов Гуг-генгейм получил следующие уравнения [c.29]
chem21.info
















