Содержание
Глава 4.1. Свойства воды | BookOnLime
Описание свойств воды начинают, обычно, с характеристики аномалий, присущих воде – самому распространенному и, вместе с тем, самому загадочному и необычному веществу на земле. Причем практически каждое из этих аномальных свойств имеет важное значение для обеспечения жизнедеятельности на земле. Необычные свойства воды особенно ярко выделяются на фоне свойств ее гомологов: h3S, h3Se, h3Te. Молекула воды является самым первым и легким представителем этого гомологического ряда, однако гидриды серы, селена и теллура при комнатной температуре, в отличие от воды, находятся в газообразном состоянии (рис. 23).
И вода, если бы она была обычным членом гомологического ряда, должна в соответствии со своей молекулярной массой закипать при температуре –70 оС и превращаться в лед при температуре –90 оС, а значит, не могла бы быть основой жизни на земле.
Рис. 23. Точки плавления и кипения гидридов VI группы Периодической системы элементов
Другая особенность воды – это аномальное изменение плотности в зависимости от температуры (рис. 24). В обычных жидкостях плотность всегда уменьшается с ростом температуры. Для воды характер изменения плотности в зависимости от температуры другой – после таяния льда плотность увеличивается, проходит через максимум при температуре 4 оС, а затем уменьшается с ростом температуры.
24). В обычных жидкостях плотность всегда уменьшается с ростом температуры. Для воды характер изменения плотности в зависимости от температуры другой – после таяния льда плотность увеличивается, проходит через максимум при температуре 4 оС, а затем уменьшается с ростом температуры.
Рис. 24. Зависимость плотности воды от температуры
Жидкая вода имеет максимум плотности не в точке плавления, а при температуре 4 оС и ее плотность уменьшается, как при повышении температуры, так и при ее понижении до температуры возможного переохлаждения, равной – 40 оС (при 1 атмосфере). При этом плотность воды больше плотности льда на 10%, благодаря чему лед плавает на поверхности воды. При температуре 4 оС вода уменьшается в объеме до минимальных значений, а при дальнейшем понижении температуры от 4 оС до 0 оС расширяется (рис. 25).
Рис. 25. Зависимость молярного объема воды и льда от температуры
Минимум объема воды при температуре 4 оС обусловлен, по мнению Зацепиной Г. Н., особенностью межмолекулярного взаимодействия системы Н2О, в которой число межмолекулярных переходов протонов равно числу внутримолекулярных переходов. Вода, превращаясь в лед, благодаря увеличению объема приобретает огромную силу, способность разрушать крепчайшие породы и, вместе с тем это спасает нашу планету от оледенения. Так как максимум плотности при 4 оС предотвращает конвективное перемешивание жидкости и опускание на дно поверхностных слоев воды, остывших до температуры ниже 4 оС, что замедляет дальнейшее охлаждение и промерзание водоемов.
Н., особенностью межмолекулярного взаимодействия системы Н2О, в которой число межмолекулярных переходов протонов равно числу внутримолекулярных переходов. Вода, превращаясь в лед, благодаря увеличению объема приобретает огромную силу, способность разрушать крепчайшие породы и, вместе с тем это спасает нашу планету от оледенения. Так как максимум плотности при 4 оС предотвращает конвективное перемешивание жидкости и опускание на дно поверхностных слоев воды, остывших до температуры ниже 4 оС, что замедляет дальнейшее охлаждение и промерзание водоемов.
Морская вода, в отличие от пресной ведет себя иначе. Наличие различных солей меняет ее физико-химические свойства. Она замерзает при – 1,9 оС (переохлажденная вода) и имеет максимальную плотность при – 3,5 оС, то есть она превращается в лед, не достигая наибольшей плотности. Переохлажденная вода, то есть остающаяся в жидком состоянии ниже точки замерзания 0 оС, ведет себя странно, с одной стороны плотность воды сильно уменьшается по мере переохлаждения, но, с другой стороны она приближается к плотности льда при понижении температуры.
Другая аномалия воды – необычное поведение ее сжимаемости, то есть уменьшение объема при увеличении давления. Для обычных жидкостей сжимаемость растет с температурой – при высоких температурах жидкости более рыхлы, имеют меньшую плотность, их легче сжать. Вода так ведет себя при высоких температурах выше 50 оС. При низких температурах, от 0 оС до 45 оС сжимаемость воды меняется противоположным образом, в результате при температуре 45 оС появляется минимум. Изотермическая сжимаемость воды при температуре 0 оС в четыре раза больше, чем изотермическая сжимаемость льда (рис. 26).
Рис. 26. Зависимость сжимаемости воды от температуры
Максимальное изменение сжимаемость испытывает при плавлении. Сжимаемость воды и льда мала по сравнению со сжимаемостью других веществ (табл.4.1.1).
Таблица 4.1.1. Сжимаемость ряда веществ в интервале температур от 5 оС до 30 оС
Температура, оС | βs ·1012, дин/см2 | ||
Вода | Метанол | Бензин | |
5 | 51,6 | – | 84,2 |
10 | 48,7 | 114,9 | 88,5 |
15 | – | 118,8 | 92,2 |
25 | 46,6 | 122,7 | 95,6 |
30 | 45,8 | 131,0 | 103,1 |
Указание особенности изменения сжимаемости воды и льда объясняют характером водородных связей в них. На этих примерах видно, что необычные свойства воды характеризуются появлением максимумов или минимумов на кривых зависимостей от температуры. Такие зависимости означают, что имеют место два противоположных процесса, которые и определяют эти свойства. Один процесс – это обычное тепловое движение, которое усиливается с ростом температуры и делает воду, как и любую другую жидкость, более разупорядоченной. Другой процесс необычный, присущий только воде, за счет него вода становится более упорядоченной при низких температурах. Разные свойства воды по-разному чувствительны к этим двум процессам, и поэтому положение экстремума наблюдается для каждого свойства при своей температуре.
На этих примерах видно, что необычные свойства воды характеризуются появлением максимумов или минимумов на кривых зависимостей от температуры. Такие зависимости означают, что имеют место два противоположных процесса, которые и определяют эти свойства. Один процесс – это обычное тепловое движение, которое усиливается с ростом температуры и делает воду, как и любую другую жидкость, более разупорядоченной. Другой процесс необычный, присущий только воде, за счет него вода становится более упорядоченной при низких температурах. Разные свойства воды по-разному чувствительны к этим двум процессам, и поэтому положение экстремума наблюдается для каждого свойства при своей температуре.
Самая сильная аномалия воды – это температурная зависимость ее теплоемкости. Величина теплоемкости показывает, сколько нужно затратить тепла, чтобы поднять температуру вещества на один градус. При нагревании вещества теплоемкость, как правило, возрастает для всех веществ, кроме воды. Изменение теплоемкости воды с повышением температуры аномально – от 0 оС до 37 оС она падает и от 37 оС до 100 оС начинает повышаться. Теплоемкость водяного пара приближается к теплоемкости льда. Минимальное значение теплоемкость воды имеет около 37 оС. Это нормальная температура тела человека (36,6–37 оС), именно при этой температуре происходят сложные биохимические процессы в организме человека, значит энергетически это наиболее выгодные условия. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла изменяется незначительно (табл. 4.1.2).
Теплоемкость водяного пара приближается к теплоемкости льда. Минимальное значение теплоемкость воды имеет около 37 оС. Это нормальная температура тела человека (36,6–37 оС), именно при этой температуре происходят сложные биохимические процессы в организме человека, значит энергетически это наиболее выгодные условия. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла изменяется незначительно (табл. 4.1.2).
Таблица 4.1.2. Теплоемкость веществ в трех агрегатных состояниях
Агрегатное состояние | Теплоемкость вещества (СоР, кал/моль) | ||||||
Н2О | Nh4 | Ch5 | HCl | h3 | Hg | Na | |
газообразное | 8,75 | 9,9 | – | 6,7 | 6,9 | – | 5,0 |
жидкое | 18,0 | 12,0 | 11,0 | 12,0 | 11,0 | 6,8 | 7,6 |
твердое | 9,0 | 9,0 | 14,0 | 15,0 | 13,0 | 6,7 | 8,0 |
Вода же при плавлении льда меняет теплоемкость в два раза, такого огромного скачка при плавлении не наблюдается ни у одного вещества. Теплоемкость льда имеет очень низкое значение, она близка к теплоемкости одноатомных кристаллов и равна теплоемкости твердого аммиака. В процессе плавления металлов теплоемкость практически не изменяется, для веществ из многоатомных молекул в процессе плавления она, как правило, уменьшается, что, вероятно, связано с тем, что молекулы могут свободно вращаться в жидкости, и не могут в твердом теле. Для таких соединений как Н2О и Nh4 теплоемкость в жидком состоянии много больше, чем в твердом состоянии. Это означает, что в воде открываются какие-то новые, энергоемкие процессы, на которые тратится подводимое тепло, что и обуславливает появление избыточной теплоемкости, причем это характерно для всего диапазона температур, при которых вода находится в жидком состоянии. Эта аномалия исчезает только в паре, то есть это свойство именно жидкой воды. Для переохлажденной воды теплоемкость еще больше возрастает при сильном переохлаждении, то есть переохлажденная вода еще более аномальна, чем обычная.
Теплоемкость льда имеет очень низкое значение, она близка к теплоемкости одноатомных кристаллов и равна теплоемкости твердого аммиака. В процессе плавления металлов теплоемкость практически не изменяется, для веществ из многоатомных молекул в процессе плавления она, как правило, уменьшается, что, вероятно, связано с тем, что молекулы могут свободно вращаться в жидкости, и не могут в твердом теле. Для таких соединений как Н2О и Nh4 теплоемкость в жидком состоянии много больше, чем в твердом состоянии. Это означает, что в воде открываются какие-то новые, энергоемкие процессы, на которые тратится подводимое тепло, что и обуславливает появление избыточной теплоемкости, причем это характерно для всего диапазона температур, при которых вода находится в жидком состоянии. Эта аномалия исчезает только в паре, то есть это свойство именно жидкой воды. Для переохлажденной воды теплоемкость еще больше возрастает при сильном переохлаждении, то есть переохлажденная вода еще более аномальна, чем обычная.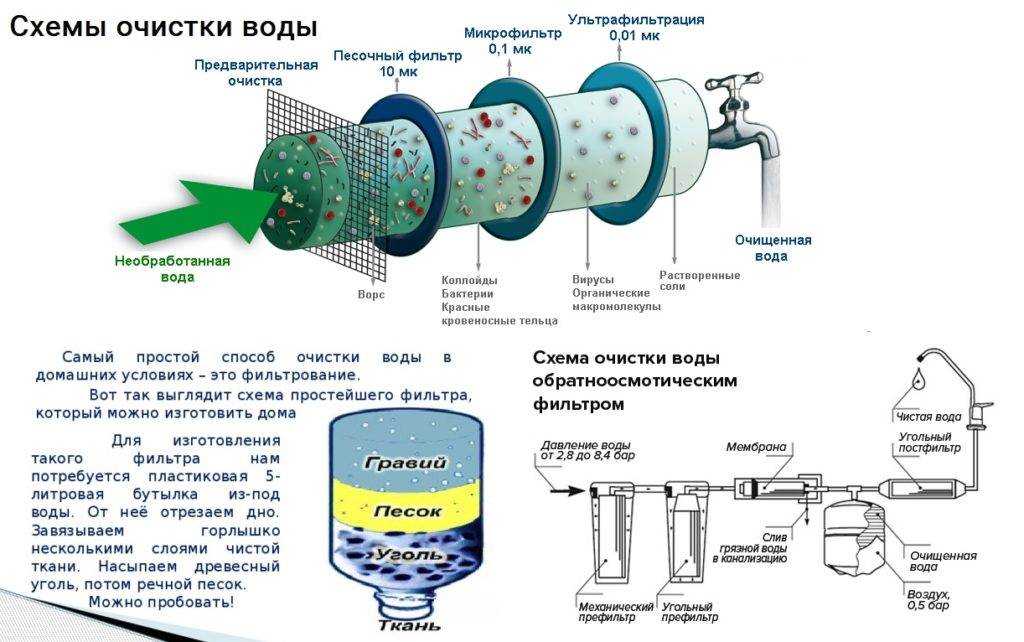 Высокая теплоемкость воды и высокая удельная теплота плавления среди простых веществ (лед трудно растопить, а воду заморозить) способствуют смягчению климата на земле, не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку существует гигантский регулятор, своеобразный термостат – воды Мирового океана.
Высокая теплоемкость воды и высокая удельная теплота плавления среди простых веществ (лед трудно растопить, а воду заморозить) способствуют смягчению климата на земле, не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку существует гигантский регулятор, своеобразный термостат – воды Мирового океана.
Другой величиной, которая определяет характер теплового движения в жидкостях, является теплопроводность. Зависимость изменения теплопроводности воды от температуры приведена на рисунке 26. Для сравнения приведено изменение теплопроводности четыреххлористого углерода, который ведет себя, как обычная жидкость, то есть с ростом температуры уменьшается теплопроводность и растет теплоемкость. Как видно из рисунка 27, теплопроводность при плавлении льда уменьшается приблизительно в четыре раза. Переохлажденная вода имеет тот же характер изменения теплопроводности, что и обычная.
Рис. 27. Зависимость теплопроводности воды и четыреххлористого углерода от температуры
Все нормальные жидкости с ростом давления изменяют знак зависимости теплопроводности от температуры. Теплопроводность воды не изменяет характера температурной зависимости под давлением. Относительная величина увеличения теплопроводности воды при давлении 1200 кг/см2 составляет около 50%, в то время как для нормальных жидкостей это увеличение при том же давлении составляет приблизительно 270%. Теплопроводность воды слабо зависит от давления, что связано с малой сжимаемостью воды по сравнению с другими жидкостями.
Теплопроводность воды не изменяет характера температурной зависимости под давлением. Относительная величина увеличения теплопроводности воды при давлении 1200 кг/см2 составляет около 50%, в то время как для нормальных жидкостей это увеличение при том же давлении составляет приблизительно 270%. Теплопроводность воды слабо зависит от давления, что связано с малой сжимаемостью воды по сравнению с другими жидкостями.
И, наконец, еще одно удивительное свойство воды, связанное с особенностями ее поверхностного натяжения. Вода в свободном состоянии принимает шарообразную форму (капли дождя, росы). На границе двух сред (вода-воздух) силы межмолекулярного притяжения действуют с одной стороны, стягивая поверхность жидкости. На структуру поверхностного слоя воды влияет два фактора – полярность молекул воды и сетка водородных связей. Поверхностное натяжение воды 72 мн/м (миллиньютон/метр). Это поверхностное натяжение настолько велико, что смоченные водой две пластинки из стекла удается разъединить только с помощью огромных усилий. Из всех известных жидкостей силы поверхностного натяжения воды по своей величине уступают только ртути (около 500 мн/м).
Из всех известных жидкостей силы поверхностного натяжения воды по своей величине уступают только ртути (около 500 мн/м).
Рис. 28. Зависимость сдвиговой вязкости от температуры для воды и четыреххлористого углерода
Еще одно аномальное свойство воды – ее вязкость. Обычные жидкости с повышением давления увеличивают вязкость, а с ростом температуры уменьшают. Характер изменения вязкости у воды другой. На рисунке 28 представлена зависимость вязкости от температуры для воды и четыреххлористого углерода. Как видно из рисунка вязкость четыреххлористого углерода до температуры около 23 оС меньше, чем у воды, а для больших температур она больше, чем у воды.
Зависимость вязкости от давления для разных температур приведена на рисунке 29, из которой следует, что для низких температур с ростом давления вплоть до 2000 атм вязкость воды уменьшается, а затем начинает расти и при температуре 100 оС кривая близка по характеру зависимости для обычных жидкостей.
Рис. 29. Зависимость сдвиговой вязкости от давления для ряда температур
Зависимость сдвиговой вязкости от давления для ряда температур
Увеличение вязкости для них с ростом давления связано с уменьшением длины свободного пробега молекул, так как при большем давлении они плотнее упакованы. Как видно из приведенных характеристик, вода действительно является необычной, аномальной жидкостью и природа этих аномалий кроется в особенностях ее структуры.
Типы химических реакций на примере свойств воды.
Тема урока: «Типы химических реакций на примере свойств воды»
Тип урока: Комбинированный (Усвоение новых знаний на основе раннее полученных предметных умений).
Цели урока: |
Задачи урока:
Образовательные: сформировать знания учащихся о составе, строении и свойствах воды, закрепить знания о типах химических реакций, научить комментировать слайды и работать с компьютерными схемами. Продолжить формирование умений работать самостоятельно с учебником, текстом, тестами.
Развивающие: развивать наблюдательность, память при просмотре компьютерной презентации и демонстрационного эксперимента. Развивать умение сравнивать, прогнозировать, обобщать и делать выводы. Развивать информационную культуру учащихся.
Воспитательные: воспитывать бережное и экономное отношение к водным ресурсам, продолжить экологическое просвещение школьников, прививать заботу к окружающей среде и своему здоровью, развивать чувство прекрасного.
Формы организации работы детей: групповая (просмотр презентации, работа с текстом), индивидуальная (беседа, работа с тестом), проблемное обучение (решение проблемных вопросов).
Оборудование:
дидактический материал: Компьютер, презентация, видеоопыты
тексты, тесты, таблица «Изменение окраски индикаторов».
Ход урока:
Мотивационный этап
Учитель: Добрый день, ребята! Наш урок я начинаю гимном химическим элементам.
«Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Все – от песчинок малых до планет-
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий.
Вокруг тебя творится мир живой.
Входи в него, вдыхай, руками трогай».
(Степан Щипачев. «Читая Менделеева»)
Сегодня мы вспомним, какие важнейшие сведения можно почерпнуть из периодической системы.
Внимание. Ящик секретом.
Назовите формулу вещества, которое лежит в этом ящике.
(Оксид этого элемента является самым распространенным веществом на нашей Земле. Про него математик Фалес говорил, что это первое начало и сущность всего. А писатель Антуан де Сент- Экзепюри говорил, что у него нет ни вкуса, ни цвета, ни запаха, и оно является самым удивительным веществом. Единственное вещество, которое встречается на Земле во всех трех агрегатных состояниях).
Итак в ящике – вода
Внимание на экран. (Видеоролик про воду). После просмотра ролика попробуйте сформулировать тему урока, употребляя не менее 4 слов.
Для того чтобы мы сейчас могли озвучить тему точнее, я вам предлагаю воспользоваться опорными словами: слайд «Типы реакции свойства вода».
Тема урока: «Типы химических реакций на примере свойств воды»
Как бы вы сформулировали цели нашего сегодняшнего урока?
1. Повторить типы химических реакций.
2. Изучить химические свойства воды и доказать, что вода может ступать реакции различных типов.
Фронтальная беседа о значении воды в природе, о ее количестве; о значении воды в промышленности и быту.
Вода – единственное вещество, которое в земных условиях встречается во всех агрегатных состояниях.
Около 71% поверхности нашей Земли покрыто Мировым океаном, составляющим около 97(девяносто семи)% всех поверхностных вод и половину литосферных. Водная оболочка Земли составляет 1,5 млрд. км3(кубических км), а остальная вода находится в глубоких слоях земной коры.
Водная оболочка Земли составляет 1,5 млрд. км3(кубических км), а остальная вода находится в глубоких слоях земной коры.
Так много или мало воды на Земле? Очень мало! А ведь, большая часть воды соленая, а пригодной для жизни, пресной, всего около 5 млн. км3. Человеку же с каждым годом требуется все больше пресной, чистой воды. Человечеству угрожает кризис из-за загрязнения воды. Некоторые страны уже испытывают нехватку чистой пресной воды и вынуждены ввозить ее из-за рубежа. По оценкам учёных к 2025 году в странах, испытывающих умеренную или серьёзную нехватку воды, будут жить уже две трети населения планеты. Наша Родина занимает первое место в мире по запасам пресной воды – на территории России сосредоточена 1/5 её мировых запасов. Однако проблема загрязнения водоёмов и нехватки питьевой воды является одной из актуальных.
Каковы же основные причины загрязнения природной воды?
У вас на столах лежат тексты. Прочитайте их внимательно и сформулируйте, что является основными загрязнителями воды.
Прочитайте их внимательно и сформулируйте, что является основными загрязнителями воды.
Работа с текстом.
Вещества, вызывающие нарушения качества воды, называются загрязняющими. Наряду с физическими и химическими загрязнителями существует тепловое и микробное загрязнение вод.
Воды морей и океанов загрязняются в основном сбросом сточных вод, выбросами от двигателей водных транспортных средств и в большей степени нефтью и нефтепродуктами, в частности – при авариях на танкерах.
Следует отметить также загрязнение рек и водоемов суши соединениями тяжелых металлов, преимущественно со сточными водами промышленных предприятий. Свинец, ртуть, кадмий, никель, цинк, марганец, попав в воду, делают ее токсичной, что приводит не только к гибели зоопланктона, но и наносит вред здоровью людей.
Хозяйственно-бытовые стоки приводят к биологическому загрязнению воды, что может вызвать желудочно-кишечные заболевания. Особенно опасны сточные воды пунктов санитарной обработки белья и спецодежды, стоки от больниц, бытовые стоки и т. д. Органические загрязнения часто приводят к непредсказуемым процессам – связыванию кислорода в воде, гибели живых организмов и фитопланктона. Избыток фосфора и азота в воде вызывает ее «цветение» и нарушает биологическое равновесие в водоеме.
д. Органические загрязнения часто приводят к непредсказуемым процессам – связыванию кислорода в воде, гибели живых организмов и фитопланктона. Избыток фосфора и азота в воде вызывает ее «цветение» и нарушает биологическое равновесие в водоеме.
Загрязнители природных вод. Слайд.
1. Бытовые стоки и отходы промышленного производства.
2. Соли тяжёлых металлов.
3. Синтетические моющие средства.
4. Выбросы водного, железнодорожного и автомобильного транспорта
Какой вывод мы сделаем?
Вода – природное богатство. Её нужно беречь и экономно расходовать. Без воды нет жизни.
На основе ваших знаний составим кластер: Все работают вместе с нами и рисуют схему у себя в тетради.
- Физические свойства.
Что вам известно о воде из курса физики?
Формула воды – Н2О, то есть это соединение, состоящее из двух атомов водорода и одного атома кислорода, молекула воды имеет угловое строение. Атомы водорода и кислорода соединены ковалентной полярной связью (Н — О).
Атомы водорода и кислорода соединены ковалентной полярной связью (Н — О).
К какому классу соединений относится вода? (оксиды).
Вы назвали физические свойства воды. Но, если я у вас спрошу: видел ли кто-нибудь воду? Этот вопрос может вам показаться нелепым.
Однако то, что мы по привычке называем водой, на самом деле представляет собой раствор многих веществ в воде. В ней растворены тысячи различных соединений элементов Периодической системы.
Области применения воды:
Помогите мне определить области применения воды.
Сколько и какие типы химических реакций нам известны?
Можете ли вы написать все четыре типа химических реакций, в которые вступает вода?
Обучающиеся готовы записать только реакцию разложения.
Совместными усилиями мы определили следующий этап урока: изучение химических свойств воды, описывать которые мы будем при помощи химических уравнений.
Химические свойства воды.

Вода легко вступает в химические реакции и для нее характерны все 4 типа химических реакций, и сегодня мы поговорим о них.
Реакции разложения.
Посмотрите видеоопыт. (Фрагмент 1.Электролиз)
Что вы наблюдали? Запишем уравнение реакции.
2H2O 2H2+ O2
Что является условием для протекания данной реакции? Укажем это в уравнении. К какому типу относится данная реакция?
Таким образом, вода может разлагаться под действием постоянного электрического тока на водород и кислород. Данная реакция называется электролизом. Запишите определение электролиза.
Кроме того, из курса биологии вам известно, что растения разлагают воду на кислород и водород в процессе фотосинтеза. Эта реакция происходит под действием света и называется фотолизом.
Процесс фотосинтеза можно записать с помощью следующего обобщенного уравнения:
6СО2 +6Н2О=С6Н12О6 +6О2
Реакции соединения. ( Фрагмент 2.Опыт оксид кальция с водой).
( Фрагмент 2.Опыт оксид кальция с водой).
Посмотрите следующий видеоопыт.
После просмотра я хочу чтобы вы ответили на следующие вопросы:
Какие вещества вступили в реакцию? Какое вещество образовалось? Запишем уравнение реакции.
CaO + H2O = Ca(OH)2
К какому типу относится данная реакция?
Реакция оксида металла с водой происходит в том случае, если образуется растворимое основание – щёлочь.
Посмотрим ещё один опыт. Запишем уравнение реакции.
(Фрагмент 3.Взаимодействие Оксида фосфора с водой)
Оксиды неметаллов, взаимодействуя с водой, образуют кислоты, в которых неметалл будет иметь ту же степень окисления, что и в соответствующем оксиде.
P2O5 + 3H2O = 2H3PO4
SiO2 + H2O
Правило: Вода реагирует с оксидами только в том случае, если образуется растворимый гидроксид.
Почему я записала, что оксид кремния и оксид железа (III) не взаимодействуют с водой?
Посмотрим таблицу растворимости. Кремниевая кислота и гидроксид железа нерастворимы.
Кремниевая кислота и гидроксид железа нерастворимы.
Физминутка
Перейдём к следующему опыту. Фрагмент 4. Взаимодействие кальция с водой.
Какие вещества вступили в реакцию? Какие вещества образовались? Запишем уравнение реакции.
Ca + 2HOН = Ca(OH)2 + Н2
К какому типу относится данная реакция?
Щелочные и щелочноземельные металлы с водой могут образовывать щёлочи не только с помощью своих оксидов, но и при непосредственном взаимодействии. Только это будут уже реакции замещения.
Если вы обратите внимание на уже знакомую вам таблицу растворимости гидроксидов и солей в воде, то заметите, что в некоторых клетках этой таблицы стоят прочерки, которые обозначают, что данное вещество в водной среде разлагается, или как говорят, гидролизуется.
Посмотрим последний видеофрагмент. Фрагмент 5.Взаимодействие карбида кальция с водой.
Запишем уравнение реакции.
CaC2 + 2HOH = Ca(OH)2↓ + C2H2↑
Гидролиз может быть обратимым и необратимым. Мы рассмотрели пример необратимого гидролиза.
Мы рассмотрели пример необратимого гидролиза.
Подведём итоги урока.
Какие типы химических реакций характерны для воды?
С какими химическими веществами взаимодействует вода?
Какие продукты реакции могут образовываться при реакциях воды с различными веществами?
Подведём итоги урока.
Какие типы химических реакций характерны для воды?
С какими химическими веществами взаимодействует вода?
Какие продукты реакции могут образовываться при реакциях воды с различными веществами?
Какую роль играет вода в жизни человека?
Домашнее задание § 33, упр 1, стр 172
Составить схемы на отдельных листках по темам:
«Меры защиты природных вод от загрязнения»
«Состояние природных водоёмов Саратовской области»
Характеристики воды — физические, химические и биологические
🕑 Время чтения: 1 минута
Вода имеет три характеристики, то есть физические, химические и биологические характеристики. Необработанную очищенную воду можно проверить и проанализировать, изучив и протестировав следующие характеристики, как описано ниже:
Необработанную очищенную воду можно проверить и проанализировать, изучив и протестировав следующие характеристики, как описано ниже:
Состав:
- Физические характеристики воды
- 1. Мутность воды
- 2. Цвет
- 3. Вкус и запах
- 4. Температура воды
- 5. Удельная электропроводность
- Химические характеристики воды
- 1. Общее содержание твердых и взвешенных веществ
- 2. Значение pH воды
- 3. Жесткость воды
- 9000 Содержание хлоридов
- (5) Содержание азота
- 6. Металлы и другие химические вещества в воде:
- 7. Растворенные газы
- Биологическое потребление кислорода (БПК):
- Бактериальные и микроскопические характеристики воды
- 1. Bacteria
- 2. Protozoa
- 3. Viruses
- 4. Worms
- 5. Fungi
- Classification of bacteria based on oxygen requirement:
Physical Characteristics of Water
1 Мутность воды
Мутность измеряется мутностным стержнем или мутномером с оптическими наблюдениями и выражается в виде количества взвешенных веществ в мг/л или миллионных долей (ppm).
Для воды ppm и мг/л примерно равны.
Стандартная единица – это единица, полученная из одного миллиграмма мелкодисперсного кремнезема (фуллеровой земли) в одном литре дистиллированной воды.
Измеритель мутности
Стержень для измерения мутности:
Мутность можно легко измерить в полевых условиях с помощью стержня мутности. Он состоит из алюминиевого стержня, градуированного для определения мутности непосредственно в единицах диоксида кремния (мг/л) Мутномер:
Мутность можно легко измерить в лаборатории с помощью приборов, называемых мутномером. В общем, мутномер работает по принципу измерения помех, создаваемых пробой воды прохождению световых лучей. Свеча Джексона Турбидиметр:
Следовательно, высота водяного столба будет больше для менее мутной воды и наоборот. Чем длиннее световой путь, тем меньше мутность. Такой мутномер не может измерять мутность ниже 25 JTU.
Его можно использовать только для природных источников и нельзя использовать для измерения мутности очищенных источников воды, для которых используются мутномеры Бейлиса или современные нефелометры . Турбидиметры Бейлиса
Турбидиметры Бейлиса
Одна из двух стеклянных трубок заполнена пробой воды (мутность которой I должна быть измерена), а другая заполнена стандартным водным раствором известной мутности. Электрическая лампочка загорается, и с верхней части прибора наблюдается синий цвет в обеих трубках. Современный нефелометр: для низкой мутности менее 1 единицы.
NTU — нефелометрические единицы мутности
FTU — Единицы измерения мутности формазина
Коэффициент мутности: Речная вода имеет максимальную степень мутности.
2. Цвет
Наличие красителя в воде не является нежелательным с точки зрения здоровья, но может испортить цвет стираемой одежды. Стандартная единица цвета – это единица измерения цвета, которая получается при растворении одного миллиграмма платинового кобальта в одном литре дистиллированной воды.
Для предметов общественного пользования номер цвета по кобальтовой шкале не должен превышать 20 и предпочтительно должен быть меньше 10.
Цвет, определяемый прибором, известен как тонометр.
3. Вкус и запах
Степень вкуса или запаха, присутствующего в конкретном образце воды, измеряется термином, называемым запах интенсивность , который связан с пороговым значением запаха или пороговым числом запаха.
Поэтому испытуемую воду постепенно разбавляют водой, не имеющей запаха, и определяют смесь, в которой просто теряется обнаружение запаха человеческим наблюдением. Количество разбавлений образца представляет собой пороговое значение запаха.
Вода для общественного водоснабжения, как правило, не должна иметь запаха, т. е. пороговое значение должно быть равно 1 и никогда не должно превышать 3.
4. Температура воды
Для питьевой воды желательна температура примерно около C. Она не должна быть больше С.
5. Удельная электропроводность
Общее количество растворенных солей, присутствующих в воде, можно легко оценить, измерив удельную электропроводность воды.
Химические характеристики воды
1. Общее содержание твердых и взвешенных веществ
Общее содержание твердых веществ (взвешенные вещества + растворенные вещества) можно получить путем выпаривания образца воды и взвешивания оставшегося сухого остатка, а также взвешивания остатка, оставшегося на фильтровальной бумаге.
Взвешенное вещество можно обнаружить путем фильтрации пробы воды. Общее допустимое количество твердых веществ в воде обычно ограничивается 500 ppm.
2. Значение pH воды
Если концентрация увеличивается, pH уменьшается, и тогда он будет кислым.
Если концентрация уменьшается, pH увеличивается, и тогда он будет щелочным.
рН + рОН = 14
если pH воды больше 7, она будет щелочной, а если меньше 7 – кислой.
Щелочность обусловлена наличием гидрокарбонатов кальция и магния или карбонатов гидроксидов натрия, калия, кальция и магния.
Некоторые, но не все соединения, вызывающие щелочность, также вызывают жесткость.
Измерение pH:
Значение pH воды может быть измерено быстро и автоматически с помощью потенциометра .
pH также может быть измерен индикаторами, как указано ниже:
| Индикатор | Диапазон рН индикаторного красителя | Исходный цвет | Готовый цвет |
| Метиловый оранжевый | 2,8 – 4,4 | Красный | Желтый |
| Метиловый красный | 4,4 – 6,2 | Красный | Желтый |
| Феноловый красный | 6,8 – 8,4 | Желтый | Красный |
| Фенолфталеин | 8,6 – 10,3 | Желтый | Красный |
Допустимое значение pH для коммунально-бытового водоснабжения может составлять от 6,6 до 8,4.
Более низкое значение pH может вызвать образование накипи, отложений осадка, затруднение хлорирования.
3. Жесткость воды
Жесткая вода нежелательна, так как она может привести к повышенному расходу мыла, образованию накипи в котлах, вызвать коррозию и образование накипи на трубах, сделать пищу безвкусной и т. д.
Временная жесткость : Если в воде присутствуют бикарбонаты и карбонаты кальция и магния, вода временно становится жесткой, так как эту жесткость можно частично устранить простым кипячением или полностью путем добавления в воду извести. Такая жесткость известна как временная жесткость или карбонатная жесткость.
Постоянная жесткость: Если в воде присутствуют сульфаты, хлориды и нитраты кальция или магния, то они вообще не удаляются простым кипячением и поэтому такая вода требует специальной обработки для умягчения. Такая жесткость известна как постоянная жесткость или некарбонатная жесткость.
Его вызывают сульфаты, хлориды, нитраты кальция и магния.
Карбонатная жесткость = Общая жесткость или щелочность (что меньше)
Некарбонатная жесткость = Общая жесткость – Щелочность
- Карбонатная жесткость равна общей жесткости или щелочности в зависимости от того, что меньше
- Некарбонатная жесткость – это общая жесткость, превышающая щелочность. Если щелочность равна или больше общей жесткости, некарбонатной жесткости нет.
- Один французский градус жесткости равен 10 мг/л CaCO3.
- Один британский градус жесткости равен 14,25 мг/л.
- Вода с жесткостью до 75 частей на миллион считается мягкой, выше 200 частей на миллион считается жесткой, а промежуточное значение считается умеренно жесткой.
- Подземные воды обычно тверже поверхностных.
- Предписанный предел жесткости для предметов общественного пользования находится в диапазоне от 75 до 115 частей на миллион.
4. Содержание хлоридов
Содержание хлоридов в очищенной воде, подаваемой населению, не должно превышать значения около 250 частей на миллион.
Содержание хлоридов в воде можно определить путем титрования воды стандартным раствором нитрата серебра с использованием хромата калия в качестве индикатора.
(5) Содержание азота
Присутствие азота в воде может произойти по одной или нескольким из следующих причин:
- Свободный аммиак: Указывает на самую первую стадию разложения органического вещества. Он не должен превышать 0,15 мг/л
- Белковые или органические вещества: Указывает количество азота, присутствующего в воде до начала разложения органического расплава. Он не должен превышать 0,3 мг/л
- Нитриты: Не полностью окисленные органические вещества в воде.
- Нитраты: Указывает на полностью окисленное органическое вещество в воде (представляет собой старое загрязнение).
- Нитриты очень опасны, поэтому допустимое количество нитритов в воде должно быть равно нулю.

- Аммиачный азот + органический азот = азот Кьельдаля
- Нитраты в воде не вредны. Однако присутствие слишком большого количества нитратов в воде может отрицательно сказаться на здоровье младенцев, вызывая заболевание, называемое 9.0065 метгемоглобинемия , обычно называемая болезнью синего ребенка.
- Концентрация нитратов в хозяйственно-питьевой воде ограничена 45 мг/л.
6. Металлы и другие химические вещества в воде:
Железо – 0,3 промилле, избыток вызывает обесцвечивание одежды.
Марганец – 0,05 частей на миллион
Медь – 1,3 части на миллион
Сульфат – 250 частей на миллион
Фтор – 1,5 ppm, избыток этого вещества влияет на легкие человека и другие органы дыхания.
Концентрация фтора менее 0,8 – 1,0 промилле вызывает кариес (кариес). Если концентрация фтора превышает 1,5 ppm, это вызывает появление пятен и обесцвечивание зубов (заболевание, называемое флюорозом).
7. Растворенные газы
Растворенные газы
Газообразный кислород обычно поглощается водой из атмосферы, но потребляется неустойчивыми органическими веществами для их окисления. Следовательно, если содержание кислорода в воде оказывается ниже уровня его насыщения, это указывает на присутствие органических веществ и, следовательно, делает воду подозрительной.
Биологическая потребность в кислороде (БПК):
Количество органического вещества, присутствующего в образце воды, можно оценить, подав кислород в этот образец и найдя кислород, потребляемый органическим веществом, присутствующим в воде. Эта потребность в кислороде известна как биологическая потребность в кислороде (БПК).
Практически невозможно определить конечную потребность в кислороде. Следовательно, БПК воды в течение первых пяти дней при температуре С обычно принимается за стандартную потребность.
= Потеря кислорода в мг/л x коэффициент разбавления.
БПК безопасной питьевой воды должно быть равно нулю.
Бактериальные и микроскопические характеристики воды
Общеизвестно, что пять типов паразитических организмов (т. е. бактерии, простейшие, вирусы, черви и грибы) заразны для человека и находятся в воде.
1. Бактерии
Это мельчайшие одноклеточные организмы, не имеющие определенного ядра и зеленого материала, который помогал бы им производить себе пищу. Они воспроизводятся бинарным слиянием и могут быть различной формы и размеров от 1 до 4 микрон, исследуются под микроскопом.
а) Неболезнетворные бактерии – непатогенные бактерии.
б) Болезнетворные бактерии – Патогенные бактерии.
2. Простейшие
Это одноклеточные животные, представляющие собой низшую и простейшую форму жизни животных. Они пожирают бактерии и таким образом уничтожают патогены. Их подсчитывают под микроскопом.
3. Вирусы
4. Черви
Черви
Это личинки мух.
5. Грибы
Это те растения, которые растут без солнечного света и живут на других растениях или животных, мертвых или живых.
Классификация бактерий на основе потребности в кислороде:
- Аэробные бактерии: Те, которым для выживания требуется кислород.
- Анаэробные бактерии: Те, которые процветают в отсутствие свободного кислорода.
- Факультативные бактерии: Бактерии, способные выживать при наличии или отсутствии свободного кислорода.
Патогенные бактерии
Их можно проверить и подсчитать в лабораториях, но с большим трудом. Поэтому эти тесты, как правило, не проводятся в плановом порядке для проверки качества воды. Обычные рутинные тесты обычно проводятся для обнаружения и подсчета наличия колиформных бактерий, которые сами по себе безвредны, но их присутствие или отсутствие указывает на наличие или отсутствие патогенных бактерий.
Методы определения наличия колиформных бактерий:
- Мембранная фильтрация (современная методика)
- Смешивание различных разбавлений образца воды с лактозной пеной и инкубация их в пробирках в течение 48 часов при температуре С. Наличие кислоты или углекислого газа в пробирках укажет на наличие колиформных бактерий.
Наиболее вероятное число (MPN) представляет плотность бактерий.
Колиформный индекс
Он может быть определен как величина, обратная наименьшему количеству образца, которое может дать положительную долю. БГКП, иногда называемые бактериями coli (B-coli) или Escherichia (E-coli), являются безвредными аэробными микроорганизмами.
Если на 100 мл воды приходится не более 1 колиформы, то говорят, что вода пригодна для питья.
Подробнее: Испытания качества воды для бетонных конструкций и рекомендуемые пределы
Физические и химические свойства воды
Эксперты Element оценивают физические и химические свойства качества воды, чтобы помочь консультантам по вопросам окружающей среды убедиться, что вода соответствует нормативным требованиям, и это безопасно для людей и окружающей среды.
Физические характеристики воды включают температуру, цвет, вкус и запах пробы воды. Химические свойства воды включают такие параметры, как рН и растворенный кислород. Мониторинг этих характеристик помогает определить, соответствует ли вода государственным нормам и безопасна ли она для потребления человеком и окружающей среды.
Физические характеристики качества воды
Необходимо контролировать физические аспекты качества воды, чтобы определить, загрязнена вода или нет. Физические характеристики можно определить по:
- Цвет – чистая вода бесцветна; окрашенная вода может указывать на загрязнение. Цвет также может показывать органические вещества. Максимально допустимый уровень цветности питьевой воды составляет 15 TCU (единица истинного цвета).
- Мутность – чистая вода прозрачна и не поглощает свет. Если в воде появилось помутнение, это может свидетельствовать о загрязнении воды.
- Вкус и запах – чистая вода всегда без вкуса и запаха.
 Если присутствует какой-либо вкус и запах, это может указывать на загрязнение воды.
Если присутствует какой-либо вкус и запах, это может указывать на загрязнение воды. - Температура – температура напрямую не используется для оценки пригодности воды для питья. Однако в естественных водных системах, таких как озера и реки, температура является важным физическим фактором, определяющим качество воды.
- Твердые вещества — если вода фильтруется для удаления взвешенных твердых частиц, оставшееся твердое вещество в воде указывает на общее количество растворенных твердых веществ. Если растворенные в воде твердые вещества превышают 300 мг/л, это оказывает неблагоприятное воздействие на живые организмы, а также на промышленные продукты.
Химические свойства воды
Химические свойства воды включают оценку таких параметров, как pH и растворенный кислород:
- pH – рН воды измеряется в диапазоне от 0 до 14, чтобы определить, насколько она кислая или щелочная. Измерение проводится с использованием логарифмической шкалы.




 Если присутствует какой-либо вкус и запах, это может указывать на загрязнение воды.
Если присутствует какой-либо вкус и запах, это может указывать на загрязнение воды.