Содержание
Диссоциация воды. Водородный показатель
Чистая вода плохо
проводит электрический ток, но всё же
обладает измеримой электропроводностью,
которая объясняется частичной диссоциацией
молекул Н2О на ионы водорода и
гидроксид-ионы:
Н2ОН++ ОН–
По величине
электропроводности чистой воды можно
вычислить концентрацию в ней ионов Н+и ОН–. При 25оС она равна
10–7моль/л.
Константа диссоциации
Н2О рассчитывается следующим
образом:
Перепишем это
уравнение:
Следует подчеркнуть,
что данная формула содержит равновесные
концентрации молекул Н2О, ионов
Н+и ОН–, которые установились
на момент наступления равновесия в
реакции диссоциации Н2О.
Но, поскольку
степень диссоциации Н2О очень
мала, можно считать, что концентрация
недиссоциированных молекул Н2О
в момент наступления равновесия
практически равна общей начальной
концентрации воды, т. е. 55,56 моль/дм3(1 дм3Н2О содержит 1000 г
е. 55,56 моль/дм3(1 дм3Н2О содержит 1000 г
Н2О или 1000 : 18 ≈ 55,56 (молей). В
разбавленных водных растворах можно
считать, что концентрация Н2О
будет такой же. Поэтому, заменив в
уравнении (42) произведение двух постоянных
величинновой константой(илиKW),
будем иметь:
Полученное уравнение
показывает, что для воды и разбавленных
водных растворов при неизменной
температуре произведение молярных
концентраций ионов водорода и
гидроксид-ионов есть величина постоянная.
Она называется иначе ионным
произведением воды.
В чистой воде при
25оС.
Поэтому для указанной температуры:
При увеличении
температуры значении
возрастает. При 100оС оно достигает
5,5 ∙ 10–13(рис. 34).
Рис. 34. Зависимость
константы диссоциации воды Kw
от температурыt
(°С)
Растворы, в
которых концентрации ионов Н+
и ОН– одинаковы, называются
нейтральными растворами. В
В
кислых растворах больше
содержится ионов водорода, а в щелочных
– гидроксид-ионов.Но какова бы ни
была реакция среды в растворе, произведение
молярных концентраций ионов Н+и
ОН–останется постоянным.
Если, например, к
чистой Н2О добавить некоторое
количество кислоты и концентрация ионов
Н+при этом увеличится до 10-4моль/дм3, то концентрация ионов
ОН–, соответственно, понизится
так, что произведениеостанется равным 10-14. Следовательно,
в этом растворе концентрация гидроксид-ионов
будет равна 10-14: 10-4= 10-10моль/дм3. Этот пример показывает,
что если концентрация ионов водорода
в водном растворе известна, то тем самым
определена и концентрация гидроксид-ионов.
Поэтому реакцию раствора можно
количественно охарактеризовать
концентрацией ионов Н+:
нейтральный раствор
кислый раствор
щелочной раствор
На практике для
количественной характеристики кислотности
или щёлочности раствора используют не
молярную концентрацию в нём ионов Н+,
а её отрицательный десятичный логарифм.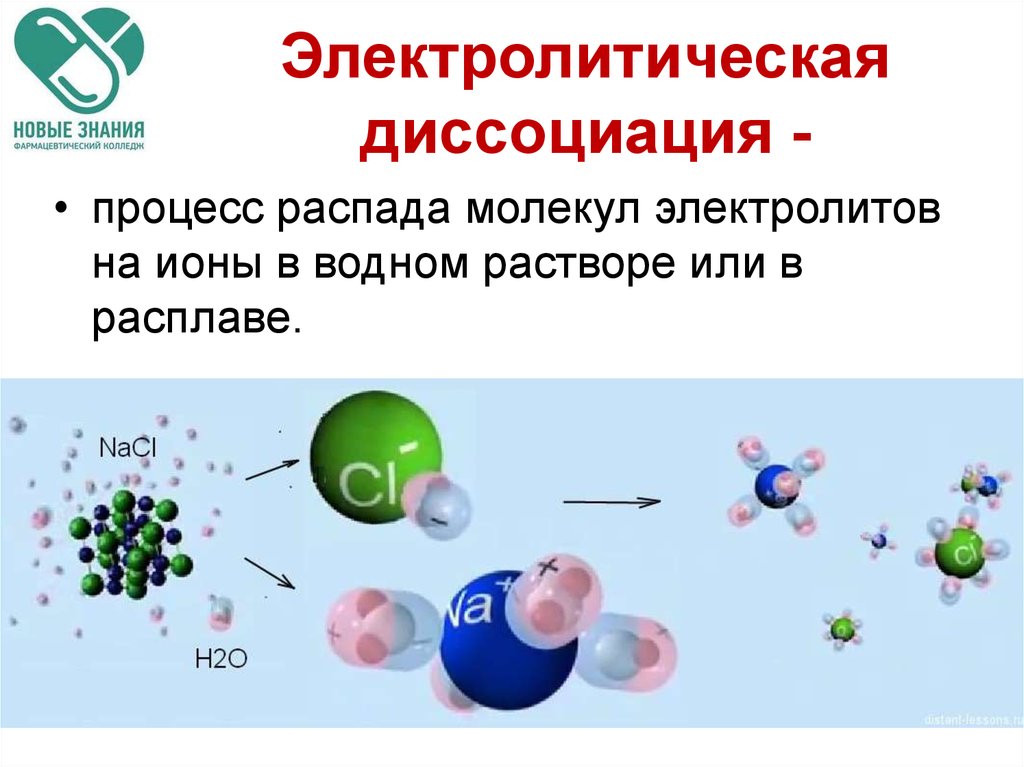
Эта величина называетсяводородным
показателем и обозначается черезрН:
рН = –lg[H+]
Например, если
,
то рН = 2; если,
то рН = 10. В нейтральном растворе рН = 7.
В кислых растворах рН < 7 (и тем меньше,
чем «кислее» раствор, т.е., чем больше в
нём концентрация ионов Н+). В
щёлочных растворах рН > 7 (и тем больше,
чем «щелочнее» раствор, т.е., чем меньше
в нём концентрация ионов Н+).
Для измерения рН
раствора существуют различные методы.
Очень удобно приблизительно оценивать
реакцию раствора с помощью специальных
реактивов, называемых кислотно-основными
индикаторами. Окраска этих веществ
в растворе меняется в зависимости от
концентрации в нём ионов Н+.
Характеристика некоторых наиболее
распространённых индикаторов представлена
в таблице 12.
Таблица
12.Важнейшие кислотно-основные
индикаторы
Название индикатора | Цвет | ||
в | в | в | |
Метиловый | красный | оранжевый | жёлтый |
Фенолфталеин | бесцветный | бесцветный | малиновый |
Лакмус | красный | фиолетовый | синий |
Из таблицы 12
следует, что с помощью индикаторов мы
можем определить не точное значение рН
раствора, а тот интервал, внутри которого
это значение может находиться.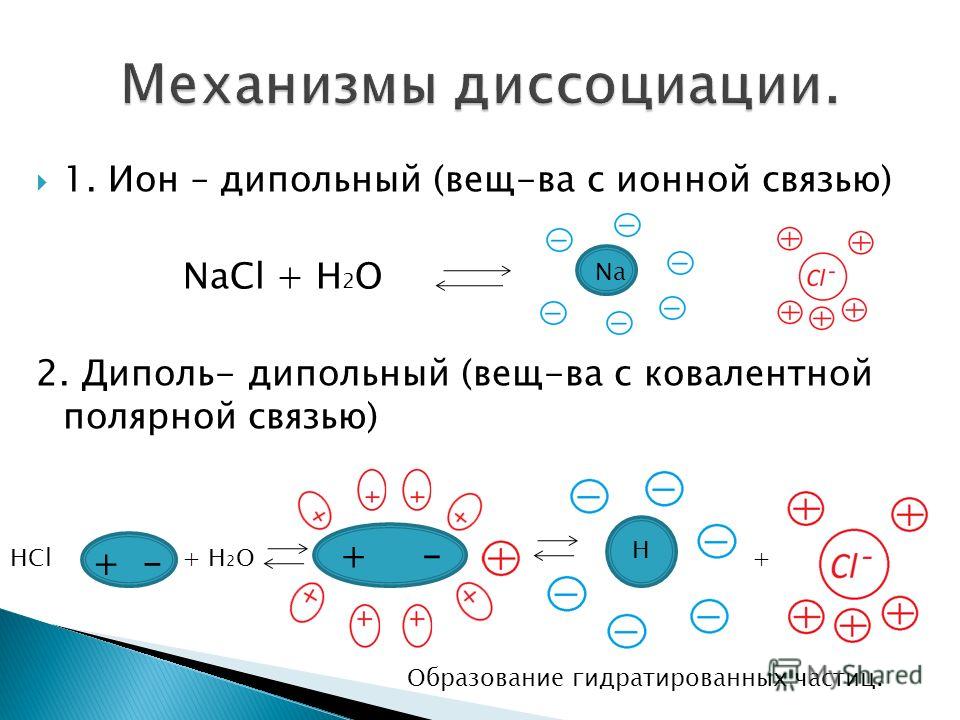
Существует также
универсальный индикатор, с помощью
которого можно определить приблизительное
значение (с точностью до единицы) рН
раствора в широком интервале от 0 до 14.
Для многих химических
и биологических процессов величина рН
раствора имеет большое значение. Так,
рН крови человека имеет строго постоянное
значение 7,36±0,04. Отклонение от него в ту
или иную сторону даже на незначительную
величину приводит к развитию в организме
различных патологических (болезненных)
процессов, которые могут завершиться
летальным исходом. Растения нормально
произрастают, если значение рН почвенного
раствора лежит в определённом интервале,
характерном для данного вида растения.
От величины рН зависят и свойства
природных вод, в частности, их коррозионная
активность.
Диссоциация воды. Среда растворов » HimEge.ru
Общая химия
,
Теория
Добавить комментарий
Мар
24
2014
Сама вода – это
очень слабый
электролит
.
H
2
O ↔ H
+
+ OH
—
Концентрация катиона H
+
и аниона OH
—
в чистой воде весьма малы и составляют 1 10
-7
моль/л при 25 ˚С
Катион водорода H
+
представляет собой простейшее ядро – протон
P
+
(электронная оболочка катиона
H
+
— пустая, 1
S
0
) у свободного протонавелики подвижность и проникающая способность, к окружении полярных молекулH
2
O он не может оставаться свободным.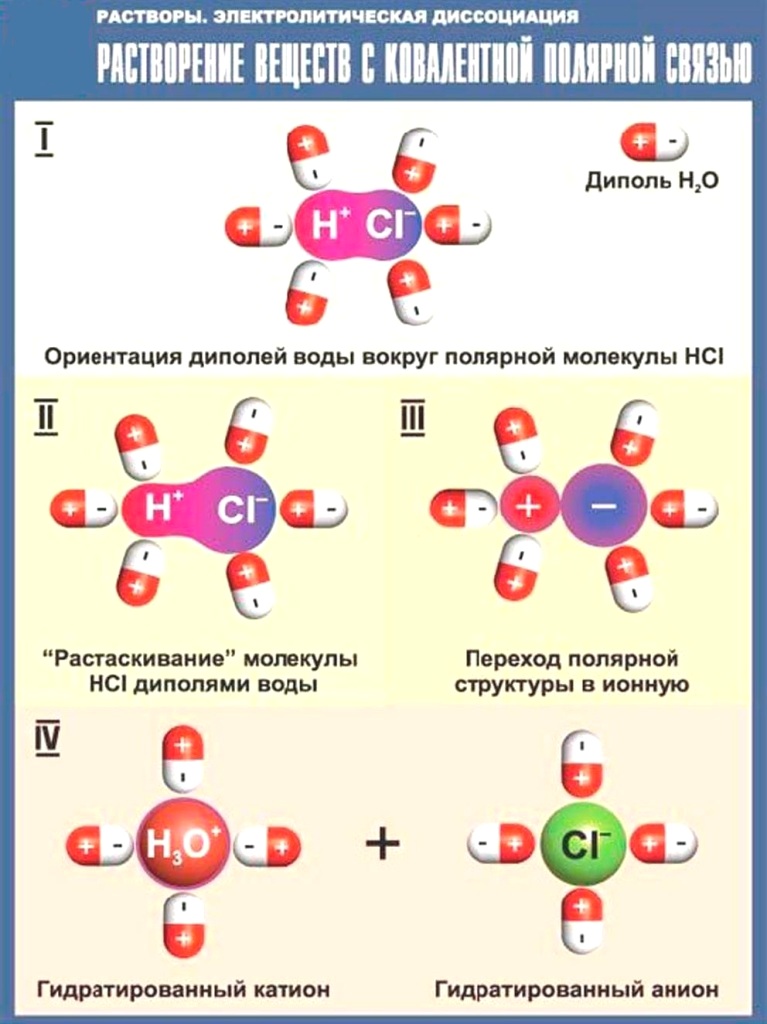 Протон тут же присоединяется к молекуле воды:
Протон тут же присоединяется к молекуле воды:
H
2
O + H
+
= H
3
O (
катион оксония
)
В дальнейшем для простаты оставляется запись H
+
(но подразумевается H
3
O).
В воде содержание ионов H
+
и OH
—
одинаково; в водных растворах кислот появляется избыток ионов H
+
, в водных растворах щелочей – избыток ионов OH (за счет диссоциации кислот и оснований).
Типы
среды водных растворов
:
нейтральная
c
(H
+
) =
c
(OH
—
)
кислотная
c(H
+
) ˃ c(OH
—
)
щелочная
c(H
+
) ˂ c(OH
—
).
Содержание H
+
и OH
—
в водных растворах обычно выражают через
водородный показатель
p
H(читается пэ-аш) и аналогичный ему гидроксильный показатель
p
OH:
p
H = -lg
c
(H
+
)
p
OH= -lg
c
(OH
—
)
Для воды при комнатной температуре имеем:
p
H = -lg
c
(H
+
) = -lg (1*10
-7
)= 7
p
OH= -lg
c
(OH
—
) = -lg (1*10
-7
)= 7
Следовательно, в чистой воде:
p
H +
p
OH = 14
Это равенство справедливо и для водных растворов:
нейтральная
p
H = 7,
p
OH = 14 —
p
H =
кислотная
p
H = 7,
p
OH = 14 —
p
H ˃ 7
щелочная
p
H = 7,
p
OH = 14 —
p
H ˂ 7
Практическая шкала
p
H отвечает интервалу 1-13 (разбавленные растворы кислот и основания):
Кислотная среда
p
H = 1-6,
c
(H
+
) = 1*10
-1
— 1*10
-6
моль/л
Щелочная среда
p
H = 8-13,
c
(OH
—
) = 1*10
-6
— 1*10
-7
моль/л
В практически нейтральной среде
c p
H = 6-7 и
p
H = 7-8 концентрация H
+
и OH
—
очень мала (1 *10
-6
– 1* 10
-7
моль/л) и почти равна концентрации этих ионов в чистой воде. Такие растворы кислот и оснований считаются
Такие растворы кислот и оснований считаются
предельно
разбавленными (содержат очень мало вещества).
Для практического установления типа среды водных растворов служат
индикаторы –
вещества, которые окрашивают в характерный цвет нейтральные, кислые и/или щелочные растворы.
Распространенные в лаборатории индикаторы – это лакмус, метилоранж и фенолфталеин.
Метилоранж (индикаторы на кислую среду) становятся
розовыми
в сильнокислом растворе, фенолфталеин (индикатор на щелочную среду) – малиновым в сильнощелочном растворе, а лакмус используется во всех средах.
Электролитическая диссоциация | Реакции ионного обмена |
Диссоциация | Encyclopedia.
 com
com
Gale
Просмотры Обновлено мая 23 2018
Диссоциация воды
Диссоциация кислоты и основания
Диссоциация солей
Ресурсы
Диссоциация является процессом, посредством которого молекула разделяет на ионы. Его также можно назвать ионизацией, но, поскольку существуют и другие способы образования ионов, предпочтительным является термин диссоциация. Вещества диссоциируют в разной степени: от веществ, диссоциирующих очень слабо, таких как вода, до веществ, диссоциирующих почти полностью, таких как сильные кислоты и основания. Степень диссоциации вещества напрямую связана с его способностью проводить электрический ток. Вещество, которое лишь слегка диссоциирует (как в случае со слабой кислотой, такой как уксус), является слабым электролитом, так как плохо проводит электричество. Почти полностью диссоциированное вещество (например, поваренная соль, NaCl или соляная кислота, HCl) очень хорошо проводит электричество.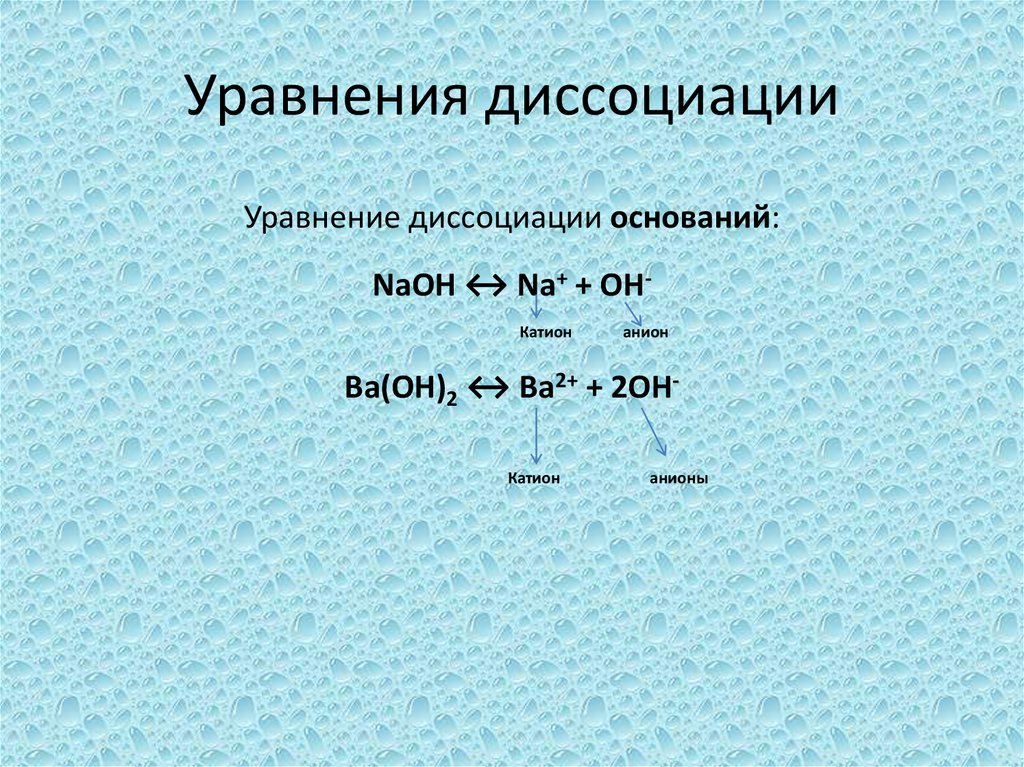 Способность проводить электричество основана на ионном составе вещества. Чем больше ионов содержит вещество, тем лучше оно проводит электричество.
Способность проводить электричество основана на ионном составе вещества. Чем больше ионов содержит вещество, тем лучше оно проводит электричество.
Чистая вода слабо диссоциирует. Примерно одна молекула воды из каждых 10 миллионов диссоциирована, а остальные остаются в недиссоциированной (или молекулярной) форме. Эту ионизацию воды (иногда называемую самоионизацией или автоионизацией) можно обобщить следующей формулой. Чистая вода образует очень мало ионов в результате своей диссоциации и поэтому является плохим электролитом или проводником электричества.
Следующее уравнение описывает процесс ионизации молекулы воды (разделения на ионы) с образованием иона водорода (протона) и иона гидроксида.
H 2 O → H + + OH –
Другой способ описания диссоциации воды: + + OH –
, где две молекулы воды образуют ион гидроксония (по сути, молекула воды с присоединенным протоном) и ион гидроксида.
Кислоты — это молекулы, которые могут отдавать протоны (водород или ионы H + ) другим молекулам. Альтернативная точка зрения состоит в том, что кислота — это вещество, которое вызывает увеличение концентрации ионов водорода в растворе.
Альтернативная точка зрения состоит в том, что кислота — это вещество, которое вызывает увеличение концентрации ионов водорода в растворе.
Диссоциация сильной кислоты (такой как соляная кислота, HCl) практически составляет 100%.
HCl → H + + CI –
В этом случае почти каждая молекула HCl диссоциирует (разделяется на ионы). При диссоциации любого вещества образуются как положительные, так и отрицательные ионы. В этом случае положительный ион (катион) — это протон, а отрицательный ион (анион) — хлорид-ион. Сильная кислота является сильным электролитом и хорошим проводником электрического тока. В случае сильного основания почти 100 % молекул также диссоциированы, и
сильные основания (такие как гидроксид натрия, NaOH) также являются сильными электролитами.
NaOH → Na + + OH –
Слабая кислота, такая как фтористоводородная кислота, лишь слегка диссоциирует. В молекулярной (недиссоциированной или неионизированной) форме существует гораздо больше молекул, чем в ионизированной форме. Поскольку она образует меньше ионов, слабая кислота будет слабым электролитом.
Поскольку она образует меньше ионов, слабая кислота будет слабым электролитом.
HF→H + + F —
В случае слабого основания, такого как гидроксид алюминия, Al(OH) 3 , лишь небольшой процент молекул ионизируется, образуя небольшое количество ионов и превращая слабые основания в слабые электролиты.
Al(OH) 3 → Al + 3 + 3OH –
В любой реакции диссоциации суммарные заряды математически компенсируют друг друга. В приведенном выше случае ион алюминия имеет три положительных заряда и один отрицательный заряд на каждом из трех ионов гидроксида, что в сумме равно нулю.
Соли являются продуктом реакции нейтрализации между кислотой и основанием (другим продуктом этой реакции нейтрализации является вода). Соли, растворимые в воде, диссоциируют на свои ионы и являются электролитами. Соли, нерастворимые или малорастворимые в воде, образуют в растворе очень мало ионов и являются неэлектролитами или слабыми электролитами. Хлорид натрия, NaCl, представляет собой водорастворимую соль, которая полностью диссоциирует в воде.
Хлорид натрия, NaCl, представляет собой водорастворимую соль, которая полностью диссоциирует в воде.
NaCl→Na + + Cl —
Процесс, посредством которого это происходит, включает окружение каждого положительного иона натрия и каждого отрицательного иона хлорида молекулами воды. Молекулы воды полярны и имеют два отдельных конца, каждый из которых имеет частичный положительный или отрицательный заряд. Поскольку противоположные заряды притягиваются, отрицательный конец молекулы воды будет обращен к положительному иону натрия, а положительный конец — к отрицательному иону. Этот процесс, показанный на рисунке 1, известен как сольватация.
ПЕРИОДИЧЕСКИЕ ИЗДАНИЯ
Карафоли, Эрнест и Джон Пеннистон. «Сигнал кальция», Scientific American 253 (ноябрь 1985 г.).
Эззелл, Кэрол. «Техника воздействия соли на вкусовые рецепторы», Science News 140 (2 ноября 1991 г.).
ДРУГОЕ
Shodor Education Foundation, Inc . «Кислотно-основная химия»
«Кислотно-основная химия»
Университет Пердью, Научный колледж, отделение химического образования Группы «Вода, кислоты и основания»
Louis Gotlib
The Gale Encyclopedia of Science
gale
просмотров обновлено 29 мая 2018
Диссоциация — это процесс, посредством которого молекулы4 разделяются на 9013 ионов. Его также можно назвать ионизацией, но, поскольку существуют и другие способы образования ионов, предпочтительным является термин диссоциация. Вещества диссоциируют в разной степени, начиная от веществ, диссоциирующих очень слабо, таких как вода , до почти полностью диссоциирующих, таких как сильные кислоты и основания . Степень диссоциации вещества прямо связана с его способностью проводить электрический ток . Вещество, которое лишь слегка диссоциирует (как в случае со слабой кислотой, такой как уксус), является слабым электролитом , так как оно плохо проводит электричество . Почти полностью диссоциированное вещество (например, столовая соль , NaCl или соляная кислота, HCl) очень хорошо проводит электричество. Способность проводить электричество основана на ионном составе вещества. Чем больше ионов содержит вещество, тем лучше оно проводит электричество.
Вещество, которое лишь слегка диссоциирует (как в случае со слабой кислотой, такой как уксус), является слабым электролитом , так как оно плохо проводит электричество . Почти полностью диссоциированное вещество (например, столовая соль , NaCl или соляная кислота, HCl) очень хорошо проводит электричество. Способность проводить электричество основана на ионном составе вещества. Чем больше ионов содержит вещество, тем лучше оно проводит электричество.
Диссоциация воды
Чистая вода лишь незначительно диссоциирует. Примерно одна молекула воды из каждых 10 миллионов диссоциирована, а остальные остаются в недиссоциированной (или молекулярной) форме. Эту ионизацию воды (иногда называемую само- или автоионизацией) можно обобщить следующей формулой. Чистая вода образует очень мало ионов в результате своей диссоциации и поэтому является плохим электролитом или проводником электричества.
Следующее уравнение описывает процесс ионизации молекулы воды (разделения на ионы) с образованием ион водорода ( протон ) и ион гидроксида.
Другой способ описания диссоциации воды выглядит следующим образом:
где две молекулы воды образуют ион гидроксония (фактически молекула воды с присоединенным протоном) и ион гидроксида.
Диссоциация кислот и оснований
Кислоты — это молекулы, которые могут отдавать протоны (водород или ионы H+) другим молекулам. Альтернативная точка зрения состоит в том, что кислота — это вещество, вызывающее увеличение концентрация ионов водорода в растворе .
Диссоциация сильной кислоты (такой как соляная кислота, HCl) практически составляет 100%.
В этом случае почти каждая молекула HCl диссоциирует (разделяется на ионы). При диссоциации любого вещества образуются как положительные, так и отрицательных иона . При этом положительный ион ( катион ) — это протон, а отрицательный ион ( анион ) — хлорид-ион. Сильная кислота является сильным электролитом и хорошим проводником электрического тока. В случае сильного основания почти 100 % молекул также диссоциированы, а сильные основания (например, гидроксид натрия , NaOH) также являются сильными электролитами.
Слабая кислота, такая как фтористоводородная кислота, лишь слегка диссоциирует. В молекулярной (недиссоциированной или неионизированной) форме существует гораздо больше молекул, чем в ионизированной форме. Поскольку она образует меньше ионов, слабая кислота будет слабым электролитом.
В случае слабого основания, такого как гидроксид алюминия , Al(OH)3, только небольшие процента молекул ионизируются, производя мало ионов и делая слабые основания также слабыми электролитами.
В любой реакции диссоциации общие заряды математически нейтрализуют друг друга. Приведенный выше случай имеет три положительных заряда на ионе алюминия и один отрицательный заряд на каждом из трех ионов гидроксида, в сумме ноль .
Диссоциация солей
Соли являются продуктом реакции нейтрализации между кислотой и основанием (другим продуктом этой реакции нейтрализации является вода). Соли, растворимые в воде, диссоциируют на свои ионы и являются электролитами. Соли, нерастворимые или малорастворимые в воде, образуют в растворе очень мало ионов и являются неэлектролитами или слабыми электролитами. Хлорид натрия , NaCl, представляет собой водорастворимую соль, которая полностью диссоциирует в воде.
Соли, нерастворимые или малорастворимые в воде, образуют в растворе очень мало ионов и являются неэлектролитами или слабыми электролитами. Хлорид натрия , NaCl, представляет собой водорастворимую соль, которая полностью диссоциирует в воде.
Процесс, посредством которого это происходит, включает окружение каждого положительного иона натрия и каждого отрицательного иона хлорида молекулами воды. Молекулы воды полярны и имеют два отдельных конца, каждый из которых имеет частичный положительный или отрицательный заряд. Поскольку противоположные заряды притягиваются, отрицательный конец молекулы воды будет обращен к положительному иону натрия, а положительный конец — к отрицательному иону. Этот процесс, показанный на рисунке 1, известен как сольватация.
Ресурсы
Периодические издания
Карафоли, Эрнест и Джон Пеннистон. «Сигнал кальция». Scientific American 253 (ноябрь 1985 г.).
Эззелл, Кэрол. «Техника соли для щекотки вкусовых рецепторов». Science News 140 (2 ноября 1991 г.).
Science News 140 (2 ноября 1991 г.).
Луи Готлиб
Научная энциклопедия Гейла
Оксфорд
просмотра обновлено 18 мая 2018 г.
dis·so·ci·ate / diˈsōshēˌāt; -ˈsōsē-/ •
v. [tr.] 1. отключить или отделить (используется, особенно в абстрактных контекстах) : голоса не должны быть оторваны от своего социального контекста. ∎ (отмежеваться от) заявить, что он не связан или не поддерживает (кого-то или чего-то): он приложил все усилия, чтобы отмежеваться от религиозных радикалов. ∎ [ввод.] отделиться или разъединиться: область будет отделяться от страны. ∎ (обычно быть диссоциированным) Психиатрия отделилась (компонент психической деятельности), чтобы действовать как самостоятельная часть психической жизни.2. (обычно быть диссоциированным) Chem. заставить (молекулу) расщепляться на отдельные более мелкие атомы, ионы или молекулы, особ. обратимо: эти соединения диссоциируют под действием солнечного излучения с образованием атомов хлора. ∎ [внутр.] (молекулы) подвергаются этому процессу. ПРОИЗВОДНЫЕ: dis·so·ci·a·tive / -ˌātiv; -shətiv/ прил.
обратимо: эти соединения диссоциируют под действием солнечного излучения с образованием атомов хлора. ∎ [внутр.] (молекулы) подвергаются этому процессу. ПРОИЗВОДНЫЕ: dis·so·ci·a·tive / -ˌātiv; -shətiv/ прил.
The Oxford Pocket Dictionary of Current English
oxford
просмотров обновлено 14 мая 2018 (в психиатрии) процесс, при котором мысли и идеи могут отделяться от сознания и могут функционировать независимо, позволяя одновременно иметь противоречивые мнения об одном и том же объекте. Диссоциация может быть основным фактором в случаях диссоциативной фуги и множественных личностей (см. диссоциативное расстройство).
— диссоциативный (дис- сох -ша-тив) прил.
Словарь медсестер
Оксфорд
просмотра обновлено 08 июня 2018 г.
диссоциировать XVII.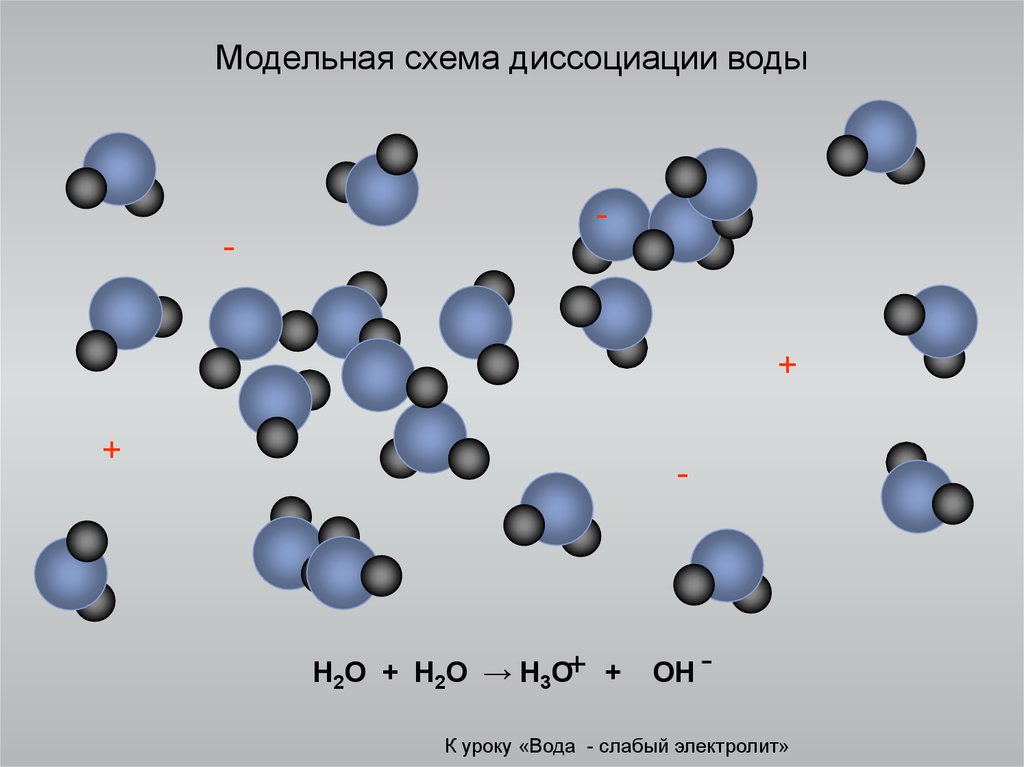 ф. pp. основа L. dissociāre , f. DIS- 1 + sociāre объединиться, f. социус компаньон; см. -АТЭ 3.
ф. pp. основа L. dissociāre , f. DIS- 1 + sociāre объединиться, f. социус компаньон; см. -АТЭ 3.
Т.о. диссоциация XVII.
The Concise Oxford Dictionary of English Etymology T. F. HOAD
Расшифровка самодиссоциации воды — ChemistryViews
Новости
Автор: ChemistryViews.org
Величайшая тайна воды — это ее собственная диссоциация . Этот самопроизвольный распад молекул воды на ионы делает воду таким хорошим растворителем. Но то, как этот распад протекает в деталях и при каких условиях, до сих пор было известно лишь в общих чертах.
Связующие силы внутри молекул воды настолько сильны, что спонтанный распад крайне маловероятен. Однако даже чистая вода имеет низкую электропроводность. На каждые десять миллиардов молекул воды приходится всего 36 ионов. Ионы также имеют тенденцию к прямому воссоединению. Эта динамика затрудняет физическое обнаружение ионного продукта жидкой воды. Кроме того, моделирование распада молекул воды с помощью классического моделирования невозможно. Самодиссоциация настолько редка, что на компьютере пришлось бы моделировать многие миллиарды частиц. Это превышает возможности современного оборудования.
На каждые десять миллиардов молекул воды приходится всего 36 ионов. Ионы также имеют тенденцию к прямому воссоединению. Эта динамика затрудняет физическое обнаружение ионного продукта жидкой воды. Кроме того, моделирование распада молекул воды с помощью классического моделирования невозможно. Самодиссоциация настолько редка, что на компьютере пришлось бы моделировать многие миллиарды частиц. Это превышает возможности современного оборудования.
Фрэнк Вайнхольд, Университет Висконсин-Мэдисон, США, и его коллеги выполнили основные расчеты и механистическую характеристику ионного продукта жидкой воды (КВ) на основе теории квантового кластерного равновесия (ККЭ) с различными initio и методы теории функционала плотности (DFT). Они упростили модель, используя тот факт, что молекулы воды полярны и в растворе расположены в виде кластеров. Некоторые из этих кластеров предлагают среду, в которой ионы чувствуют себя особенно «комфортно». В своей модели ученые рассчитали, какие типы кластеров присутствуют в жидкой воде.
