Диссоциация воды. Водородный показатель рН. Диссоциация воды
Что такое диссоциация воды?
Частным случаем диссоциации (процесса распада более крупных частиц вещества — молекул ионов или радикалов — на частицы меньшего размера) является электролитическая диссоциация, при которой нейтральные молекулы вещества, называемого электролитом, в растворе (в результате воздействия молекул полярного растворителя) распадаются на заряженные частицы: катионы и анионы. Этим объясняется способность растворов электролитов проводить ток.
Принято делить все электролиты на две группы: слабые и сильные. Вода относится к слабым электролитам, диссоциация воды характеризуется небольшим количеством диссоциированных молекул, так как они достаточно стойкие и практически не распадаются на ионы. Чистая (без примесей) вода слабо проводит электрический ток. Это обусловлено химической природой самой молекулы, когда положительно поляризованные атомы водорода внедрены в электронную оболочку сравнительно небольшого атома кислорода, который поляризован отрицательно.
Сила и слабость электролитов характеризуется степенью диссоциации (обозначается α, часто эта величина выражается в % от 0 до 100 или в долях единицы от 0 до 1) — способностью распадаться на ионы, то есть отношением количества распавшихся частиц к числу частиц до распада. Такие вещества, как кислоты, соли и основания под действием полярных молекул воды распадаются на ионы полностью. Диссоциация воды сопровождается распадом молекул Н2О на протон Н+ и гидроксильную группу ОН-. Если представить уравнение диссоциации электролита в виде: М=К++А- , тогда диссоциация воды может быть выражена уравнением: Н2О↔Н++ОН-, а уравнение, с помощью которого рассчитывается степень диссоциации воды, можно представить в двух видах (через концентрацию образовавшихся протонов или концентрацию образовавшихся гидроксильных групп): α=[Н+]/[Н2О] или α=[ОН-]/[Н2О]. Так как на величину α влияет не только химическая природа вещества, но и концентрация раствора или его температура, то принято говорить о кажущейся (мнимой) степени диссоциации.
Склонность молекул слабых электролитов, включая воду, распадаться на ионы в большей степени характеризуется константой диссоциации (частный случай константы равновесия), которую принято обозначать, как Кд. Для расчета этой величины применяется закон действующих масс, который устанавливает соотношение между массами полученных и исходных веществ. Электролитическая диссоциация воды — это распад исходных молекул воды на протоны водорода и гидроксильную группу, поэтому константа диссоциации выражается уравнением: Кд = [Н+] • [ОН-]/[Н2О]. Эта величина для воды является постоянной и зависит только от температуры, при температуре, равной 25оС, Кд=1.86•10-16.
Зная молярную массу воды (18 грамм/моль), а также пренебрегая концентрацией диссоциированных молекул и принимая массу 1 дм3 воды за 1000 г, можно рассчитать концентрацию недиссоциированных молекул в 1 дм3 воды: [Н2О]=1000/18,0153=55,51 моль/дм3. Тогда из уравнения константы диссоциации можно найти произведение концентраций протонов и гидроксильных групп: [Н+]•[ОН-]=1,86•10-16•55,51=1•10-14. При извлечении квадратного корня из полученной величины получают концентрацию протонов (ионов водорода), определяющую кислотность раствора и равную концентрации гидроксильных групп: [Н+]=[ОН-]=1•10-7.
Но в природе воды такой чистоты не существует из-за присутствия в ней растворенных газов или загрязнения воды другими веществами (фактически вода — это раствор различных электролитов), поэтому при 25оС концентрация протонов водорода или концентрация гидроксильных групп отличается от величины 1•10-7. То есть кислотность воды обусловлена протеканием не только такого процесса, как диссоциация воды. Водородный показатель является отрицательным логарифмом концентрации водородных ионов (рН), он введен для оценки кислотности или щелочности воды и водных растворов, так как числами с отрицательными степенями пользоваться затруднительно. Для чистой воды рН=7, но так как в природе чистой воды нет, и диссоциация воды протекает наряду с распадом других растворенных электролитов, то водородный показатель может быть меньше или больше 7, то есть для воды, практически, рН≠7.
fb.ru
Диссоциация воды. Водородный показатель рН
случае слабых кислот (от английского слова "acid") и Кb для слабых оснований (от слова "base").
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, процесс диссоциации щавелевой кислоты протекает следующим образом:
I ступень: h3C2O4 ↔ H+ + HC2O4 , | Ka(I) = 6,4610–2; |
II ступень: HC2O4 ↔ H+ + C2O42 , | Ka(II) = 6,1710–5; |
общее уравнение диссоциации: h3C2O4 ↔ 2H+ + C2O42 ,Ka =Ka(I) Ka(II). Аналогично для гидроксида свинца можно записать:
I ступень: Pb(OH)2 ↔ PbOH+ + OH , | Kb(I) = 9,5510–4; |
II ступень: PbOH+ ↔ Pb2+ + OH , | Kb(II) = 3,010–8; |
общее уравнение ионизации: Pb(OH)2 ↔ Pb2+ + 2OH , | Kb= Kb(I)Kb(II). |
В случае разбавленных растворов сильных электролитов можно считать, что их диссоциация происходит практически полностью.
Вода слабый электролит, по упрощенной схеме ее диссоциацию можно представить следующим уравнением:
Н2О ↔ Н+ + ОН В условиях равновесия константа диссоциации воды
[H ][ОН- ]
Кд,с= [h3О]недисс
Поскольку степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул можно принять равной молярной
концентрации жидкой воды. Поэтому при Т=const [H+] [OH ] =Kд,с[h3O] =const.
Произведение концентраций ионов [H+] и [ОН ] называетсяионным
произведением воды и является постоянной величиной при неизменной температуре и при 298К составляет:
[H+] [ОН ] =K(h3O) =KВ =Kw =10–14 . | (7.5) |
Ионное произведение воды Кw увеличивается с ростом температуры, так как диссоциация воды–эндотермическийпроцесс. (KW(1000C) = 610-13)
Для указания концентрации ионов водорода в растворе используют так
называемый водородный показатель: |
|
pH = –lg[H+], | (7.6) |
а для обозначения концентрации гидроксид-ионовгидроксидный показатель:
pOH = –lg[ОН] . | (7.7) |
При температуре 298 К |
|
рН + рОН = 14, | (7.8) |
поэтому в чистой воде [H+] = [ОН ] = 110–7 моль/л, следовательно, рН = рОН = 7;
вкислотной среде [H+] > [ОН ], следовательно, рН < 7, а рОН > 7;
вщелочных растворах [H+] < [ОН ], поэтому рН > 7, а рОН < 7.
В случае растворов сильных электролитов вместо концентрации пользуются активностью. Поэтому при необходимости более точных расчетов в таких растворах следует вычислять не рН, а ра(Н+):
ра(Н+) =–lga(H+)= рН – lg (Н+).
Произведение растворимости
Понятие произведения растворимости связано с насыщенными растворами малорастворимых сильных электролитов, как правило, солей. Большинство труднорастворимых электролитов в очень разбавленных растворах диссоциируют полностью, т.е. их можно рассматривать как сильные электролиты. Поэтому все приведенные ниже рассуждения относятся не только к растворам солей, но и к растворам оснований, таких как Al(OH)3, Fe(OH)3, Cu(OH)2 и др.
В случае низкой растворимости электролита образуется крайне разбавленный раствор, который близок к идеальному раствору и можно
использовать концентрационную константу равновесия: Кс = | [Kz1 ]m [Az2 - ]n |
[Km An (т) ]. |
Концентрация твердой фазы [КmАn(т)]=const, отсюда:
Кс[КmАn (т)] = [Kz1 ]m[Az2 ]n = ПР = const. (7.9) При постоянной температуре в насыщенном растворе произведение концентраций (или активностей) ионов, на которые диссоциирует электролит, с учетом показателей степеней, соответствующих стехиометрическим коэффициентам, есть величина постоянная. Она
называется произведением растворимости (ПР) малорастворимого сильного электролита.
Чем меньше значение ПР, тем хуже растворяется соединение. При внесении в раствор избытка ионов Kz1 илиAz2 , изменятся концентрации ионов в растворе (сдвиг равновесия диссоциации влево по принципу Ле Шателье). Величина ПР останется постоянной при неизменной температуре, но выпадет дополнительное количество осадка
Условием образования осадка является превышение величины произведения концентраций ионов над величиной произведения растворимости:
Сm(Kz1 )Сn(Az2 ) > ПР
Когда в растворе мала концентрация ионов, то Cm(Kz1 )Cn(Az2 ) < ПР, и электролит будет растворяться до тех пор, пока произведение концентраций ионов не сравняется со значением ПР.
Гидролиз солей
Растворение солей в нейтральной воде часто сопровождается изменением величины pH из-заобразования кислотных или щелочных растворов. Значение рH=7 в нейтральной воде меняется на pH 7 или pH 7. Это явление обусловлено процессом гидролиза.
Гидролиз соли это обменное взаимодействие ионов соли с молекулами воды, в результате которого образуется слабый электролит и смещается равновесие электролитической диссоциации воды.
Среди обменных реакций с участием электролитов, протекающих в направлении образования слабых электролитов, различают четыре случая взаимодействия соли и воды.
1. Гидролиз практически не происходит, если соли образованы катионами сильного основания и анионами сильной кислотой. Например: KCl, NaNO3, CaSO4. Очевидно, что в этом случае единственным слабым электролитом является вода и взаимодействие типа
KCl + h3O ↔ KOH + HCl
не нарушает равновесия Н2О↔ Н+ +ОН–,т.е. в таких растворах рН=7 и равновесие практически полностью смещено влево.
2. Если соли образованы катионами сильного основания и анионами слабой кислоты (KCN, Na3PO4, Ch4COOK и др.), то имеет местогидролиз по аниону. Пример, гидролиз соли К2СО3.
I ступень: К2СО3 + Н2О ↔ КНСО3 + КОН
Уравнения гидролиза обычно записывают, указывая сильные электролиты в ионном виде, а слабые – в молекулярном. Данное уравнение может быть записано так:
2К+ + СО32– + Н2О ↔ К+ + НСО3 + К+ + ОН или в сокращенном виде:
СО32 + Н2О ↔ НСО3 + ОН ;
Как правило, самопроизвольно гидролиз идет в этом случае в основном по I ступени.
II ступень: КНСО3 + Н2О ↔ Н2СО3 + КОН или сокращенноеионно-молекулярноеуравнение:
НСО3 + Н2О ↔ Н2СО3 + ОН .
Видно, что гидролиз по аниону приводит к появлению избытка ионов ОН , т. е. раствор становится щелочным (рН>7). Для усиления гидролиза по
IIступени следует принять меры к сдвигу равновесия.
3.В случае, когда соль образована катионом слабого основания и анионом сильной кислоты (CuSO4, ZnCl2, Nh5NO3 и т.п.), то происходит
гидролиз по катиону. Пример, гидролиз соли ZnCl2.
I ступень: ZnCl2 + h3O ↔ Zn(OH)Cl + HCl или сокращенноеионно-молекулярноеуравнение:
Zn2+ + h3O ↔ Zn(OH)+ + H+.
II ступень: Zn(OH)Cl +h3O ↔ Zn(OH)2 + HCl или сокращенноеионно-молекулярноеуравнение:
Zn(OH)+ +h3O ↔ Zn(OH)2 + H+.
Избыток ионов водорода в этом случае обусловливает кислотную среду раствора (рН<7).
4. Если соли образованы катионами слабого основания и анионами слабой кислоты, то происходит гидролиз и по катиону и по аниону. Примером может служить гидролиз соли СН3СООNh5:
Ch4COONh5 + Н2О ↔ Nh5OH + Ch4COOH.
studfiles.net
Диссоциация воды. Водородный показатель
Вода служит не только наиболее распространенным растворителем для многих веществ, но и сама является очень слабым амфотерным электролитом:
Н2О ↔ H+ + ОH-; ∆Н°298 = 56 кДж /моль,
в воде присутствуют катионы водорода и гидроксид - анионы в строго эквивалентных количествах. Константа ионизации воды (Кu)
Ku = [H][OH-]/[h3O],
определена по электрической проводимости и равна 1,8∙10-16 при 22 °С. Так как вода - очень слабый электролит, то концентрация недиссоциированных молекул может быть принята
равной общему числу молей в 1 дм3 воды, то есть: [Н2О] = 1000/18 = 55,56 моль/дм3.
Тогда Ки [Н20] = [H+] [ОН-] или [H+][ОН-] = 1,8∙10-16 ∙55,56 = 10-14 = Кw
Величина [Н+ ][ОН-] = 10-14 называется ионным произведением воды. Так как в воде концентрации гидратированных ионов равны, то
____
[H+]= [ОH-] = √10-14=10-7 моль/дм3
При добавлении кислоты концентрация ионов водорода увеличивается и соответственно уменьшается концентрация гидроксид – ионов, поскольку при данной температуре ионное произведение воды – величина постоянная. При добавлении щелочи наблюдается обратная зависимость. Таким образом, концентрация ионов водорода в растворе может служить мерой кислотности или щелочности среды. В кислых растворах [Н+]10-7, в щелочных [Н+]10-7.
В 1909 г. Сёренсен ввел значение отрицательного десятичного логарифма концентрации водородных ионов, которое называют водородным показателем рН
рН= - lg[H+].
Тогда для нейтральной среды рН = - lg10-7 = 7, для кислых растворов рН 7, а для щелочных рН 7. Аналогичным образом реакция среды может быть охарактеризована так называемым гидроксильным показателем рОН
рОН = -lg[OH-].
Для воды рН = рОН = 7, а изменение рОН в кислых и щелочных растворах противоположно изменению рН. Прологарифмировав ионное произведение воды, получим
lg[H+] + lg[OH-] = -14.
Заменив отрицательные логарифмы, получим соотношение
рН + рОН = 14.
Наглядно зависимость между концентрацией ионов водорода, значением рН и реакцией раствора можно выразить схемой:
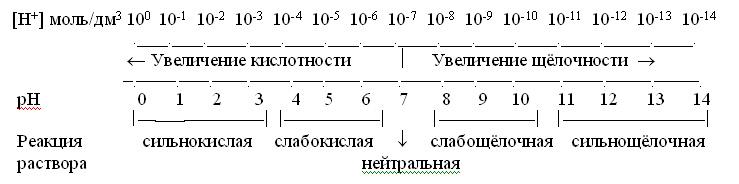
Из схемы видно, что чем меньше рН, тем больше концентрация ионов Н+, т.е. тем выше кислотность среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т.е. тем выше щелочность среды. Исключительно важна роль реакции среды в самых различных явлениях и процессах, как в природе, так и в медицинской практике. Многие процессы, протекающие в живых организмах, требуют определенной реакции среды.
Гидролиз солей
Реакции обменного разложения между водой и соответствующими соединениями называются гидролизом. Он является частным случаем сольволиза - обменного разложения
растворенного вещества и растворителя. Наиболее типичным случаем является гидролиз солей в водных растворах. Гидролиз солей, распадающихся в растворе на ионы, зависит от природы катионов и анионов. Чем сильнее поляризующее действие ионов, тем в большей степени протекает гидролиз.
Рассмотрим гидролиз соли, образованной сильным гидроксидом и сильной кислотой Поляризующее действие невелико у катионов щелочных и щелочноземельных металлов (Nа+, К+, Ва2+), то есть катионов образующих сильные гидроксиды - щелочи, и анионов (Сl,- Вr-, I-, N0-3, СlО-4, SО2-4), образующих сильные кислоты. Поэтому соли, образованные катионами сильного гидроксида и анионами сильной кислоты, практически не подвергаются гидролизу, рН растворов таких солей 7. Например, гидролиз NаNО3:
Na+ + НОН - реакция практически не идет
N03- + НОН - реакция практически не идет
NaNОз гидролизу практически не подвергается.
Если соль при растворении ионизуется на катионы, образующие сильные основания (Na+,К+,Ва2+) и анионы, образующие слабые кислоты (СО32-, РО4-3, SОз2-, S2-,СN-), то происходит гидролиз по аниону и в результате создается щелочная среда (рН > 7)
CO32- + HOH ↔ HCO3-; + OH-.
Такой тип гидролиза имеет место у солей сильных гидроксидов и слабых кислот. Очевидно, чем слабее кислота, тем гидролиз протекает интенсивнее. Гидролиз многозарядного аниона протекает ступенчато в связи со ступенчатой диссоциацией многоосновных кислот и при обычных условиях протекает по первой ступени. Например
К2СО3 + НОH ↔ КHСO3 + КОН
СНзСООNа + НОН ↔ СН3СООН + NаОН
Если соль при растворении ионизируется на сильно поляризующие катионы (Zп2+, Си2+, Fе3+, Сr3+, Аl3+ и т.п.), образующие слабые гидроксиды и анионы сильных кислот (Сl-, Вr-, I-, NОз-, СlО4-, SО42-), то происходит гидролиз по катиону. В результате в растворе создается кислая среда (рН < 7)
Си2+ + НО↔ СиОН+ + Н+.
Этот тип гидролиза имеет место у солей слабых гидроксидов и сильных кислот. Гидролиз многозарядного катиона протекает ступенчато в связи со ступенчатой диссоциацией гидроксидов и при обычных условиях протекает по первой ступени (для металлов Ме2+) и по 1,2 ступеням (для Ме3+). Например
ZпС12 + НОН ↔ Zп(ОН)С1 + НС1
А12(S04)3 + 2НОН ↔ 2А1(ОН)SО4 + Н2SО4
2А1(ОН)SО4 + 2НОH ↔ [А1(ОН)2]2SО4 + Н2SО4
Если соль при растворении ионизируется на катионы, образующие слабые основания и анионы слабых кислот, то происходит гидролиз и по аниону и по катиону. При этом образуются малорастворимые слабые гидроксиды и слабые кислоты
А12(СО3)3 + ЗНОН = 2А1(ОН)3 + ЗСО2.
Гидролиз протекает необратимо и характер среды определяется относительной силой образующихся продуктов.
Если в раствор гидролизующейся соли ввести реактив, связывающий образующиеся ионы H+ и ОH-, то в соответствии с принципом Ле-Шателье, равновесие смещается в сторону усиления гидролиза, в результате гидролиз может протекать полностью, до образования его конечных продуктов. При этом ионы H+ или ОH- можно связать в молекулы воды, вводя в раствор не только щелочь или кислоту, но и другую соль, гидролиз которой приводит к накоплению в растворе ионов Н+ или ОH-. Эти ионы будут нейтрализовывать друг друга, что вызовет взаимное усиление гидролиза обеих солей и в результате - образование конечных продуктов гидролиза. Например, при смешивании растворов Na2S и CrCl3, в которых соответственно имеется избыток ионов Н+ и ОH-, взаимное усиление гидролиза приводит к выделению газа Н2S и образованию осадка Сr(ОН)3
ЗNа2S + 2СrС13 + ЗНОН = ЗН2S + 2Сr(ОН)3 + 6NaС1;
3S2- + 2Сr3+ + ЗНОН = ЗН2S + 2Сr(ОН)3.
Количественно гидролиз соли характеризуется степенью гидролиза h и константой гидролиза Кг, степень гидролиза. Чем слабее кислота (гидроксид), образующая (образующее) соль, тем сильнее соль гидролизуется, Кг ее больше. Гидролиз процесс эндотермический, поэтому при повышении температуры константа гидролиза увеличивается.
studfiles.net
Диссоциация воды. Водородный показатель рН
случае слабых кислот (от английского слова "acid") и Кb для слабых оснований (от слова "base").
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, процесс диссоциации щавелевой кислоты протекает следующим образом:
I ступень: h3C2O4 ↔ H+ + HC2O4 , | Ka(I) = 6,4610–2; |
II ступень: HC2O4 ↔ H+ + C2O42 , | Ka(II) = 6,1710–5; |
общее уравнение диссоциации: h3C2O4 ↔ 2H+ + C2O42 ,Ka =Ka(I) Ka(II). Аналогично для гидроксида свинца можно записать:
I ступень: Pb(OH)2 ↔ PbOH+ + OH , | Kb(I) = 9,5510–4; |
II ступень: PbOH+ ↔ Pb2+ + OH , | Kb(II) = 3,010–8; |
общее уравнение ионизации: Pb(OH)2 ↔ Pb2+ + 2OH , | Kb= Kb(I)Kb(II). |
В случае разбавленных растворов сильных электролитов можно считать, что их диссоциация происходит практически полностью.
Вода слабый электролит, по упрощенной схеме ее диссоциацию можно представить следующим уравнением:
Н2О ↔ Н+ + ОН В условиях равновесия константа диссоциации воды
[H ][ОН- ]
Кд,с= [h3О]недисс
Поскольку степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул можно принять равной молярной
концентрации жидкой воды. Поэтому при Т=const [H+] [OH ] =Kд,с[h3O] =const.
Произведение концентраций ионов [H+] и [ОН ] называетсяионным
произведением воды и является постоянной величиной при неизменной температуре и при 298К составляет:
[H+] [ОН ] =K(h3O) =KВ =Kw =10–14 . | (7.5) |
Ионное произведение воды Кw увеличивается с ростом температуры, так как диссоциация воды–эндотермическийпроцесс. (KW(1000C) = 610-13)
Для указания концентрации ионов водорода в растворе используют так
называемый водородный показатель: |
|
pH = –lg[H+], | (7.6) |
а для обозначения концентрации гидроксид-ионовгидроксидный показатель:
pOH = –lg[ОН] . | (7.7) |
При температуре 298 К |
|
рН + рОН = 14, | (7.8) |
поэтому в чистой воде [H+] = [ОН ] = 110–7 моль/л, следовательно, рН = рОН = 7;
вкислотной среде [H+] > [ОН ], следовательно, рН < 7, а рОН > 7;
вщелочных растворах [H+] < [ОН ], поэтому рН > 7, а рОН < 7.
В случае растворов сильных электролитов вместо концентрации пользуются активностью. Поэтому при необходимости более точных расчетов в таких растворах следует вычислять не рН, а ра(Н+):
ра(Н+) =–lga(H+)= рН – lg (Н+).
Произведение растворимости
Понятие произведения растворимости связано с насыщенными растворами малорастворимых сильных электролитов, как правило, солей. Большинство труднорастворимых электролитов в очень разбавленных растворах диссоциируют полностью, т.е. их можно рассматривать как сильные электролиты. Поэтому все приведенные ниже рассуждения относятся не только к растворам солей, но и к растворам оснований, таких как Al(OH)3, Fe(OH)3, Cu(OH)2 и др.
В случае низкой растворимости электролита образуется крайне разбавленный раствор, который близок к идеальному раствору и можно
использовать концентрационную константу равновесия: Кс = | [Kz1 ]m [Az2 - ]n |
[Km An (т) ]. |
Концентрация твердой фазы [КmАn(т)]=const, отсюда:
Кс[КmАn (т)] = [Kz1 ]m[Az2 ]n = ПР = const. (7.9) При постоянной температуре в насыщенном растворе произведение концентраций (или активностей) ионов, на которые диссоциирует электролит, с учетом показателей степеней, соответствующих стехиометрическим коэффициентам, есть величина постоянная. Она
называется произведением растворимости (ПР) малорастворимого сильного электролита.
Чем меньше значение ПР, тем хуже растворяется соединение. При внесении в раствор избытка ионов Kz1 илиAz2 , изменятся концентрации ионов в растворе (сдвиг равновесия диссоциации влево по принципу Ле Шателье). Величина ПР останется постоянной при неизменной температуре, но выпадет дополнительное количество осадка
Условием образования осадка является превышение величины произведения концентраций ионов над величиной произведения растворимости:
Сm(Kz1 )Сn(Az2 ) > ПР
Когда в растворе мала концентрация ионов, то Cm(Kz1 )Cn(Az2 ) < ПР, и электролит будет растворяться до тех пор, пока произведение концентраций ионов не сравняется со значением ПР.
Гидролиз солей
Растворение солей в нейтральной воде часто сопровождается изменением величины pH из-заобразования кислотных или щелочных растворов. Значение рH=7 в нейтральной воде меняется на pH 7 или pH 7. Это явление обусловлено процессом гидролиза.
Гидролиз соли это обменное взаимодействие ионов соли с молекулами воды, в результате которого образуется слабый электролит и смещается равновесие электролитической диссоциации воды.
Среди обменных реакций с участием электролитов, протекающих в направлении образования слабых электролитов, различают четыре случая взаимодействия соли и воды.
1. Гидролиз практически не происходит, если соли образованы катионами сильного основания и анионами сильной кислотой. Например: KCl, NaNO3, CaSO4. Очевидно, что в этом случае единственным слабым электролитом является вода и взаимодействие типа
KCl + h3O ↔ KOH + HCl
не нарушает равновесия Н2О↔ Н+ +ОН–,т.е. в таких растворах рН=7 и равновесие практически полностью смещено влево.
2. Если соли образованы катионами сильного основания и анионами слабой кислоты (KCN, Na3PO4, Ch4COOK и др.), то имеет местогидролиз по аниону. Пример, гидролиз соли К2СО3.
I ступень: К2СО3 + Н2О ↔ КНСО3 + КОН
Уравнения гидролиза обычно записывают, указывая сильные электролиты в ионном виде, а слабые – в молекулярном. Данное уравнение может быть записано так:
2К+ + СО32– + Н2О ↔ К+ + НСО3 + К+ + ОН или в сокращенном виде:
СО32 + Н2О ↔ НСО3 + ОН ;
Как правило, самопроизвольно гидролиз идет в этом случае в основном по I ступени.
II ступень: КНСО3 + Н2О ↔ Н2СО3 + КОН или сокращенноеионно-молекулярноеуравнение:
НСО3 + Н2О ↔ Н2СО3 + ОН .
Видно, что гидролиз по аниону приводит к появлению избытка ионов ОН , т. е. раствор становится щелочным (рН>7). Для усиления гидролиза по
IIступени следует принять меры к сдвигу равновесия.
3.В случае, когда соль образована катионом слабого основания и анионом сильной кислоты (CuSO4, ZnCl2, Nh5NO3 и т.п.), то происходит
гидролиз по катиону. Пример, гидролиз соли ZnCl2.
I ступень: ZnCl2 + h3O ↔ Zn(OH)Cl + HCl или сокращенноеионно-молекулярноеуравнение:
Zn2+ + h3O ↔ Zn(OH)+ + H+.
II ступень: Zn(OH)Cl +h3O ↔ Zn(OH)2 + HCl или сокращенноеионно-молекулярноеуравнение:
Zn(OH)+ +h3O ↔ Zn(OH)2 + H+.
Избыток ионов водорода в этом случае обусловливает кислотную среду раствора (рН<7).
4. Если соли образованы катионами слабого основания и анионами слабой кислоты, то происходит гидролиз и по катиону и по аниону. Примером может служить гидролиз соли СН3СООNh5:
Ch4COONh5 + Н2О ↔ Nh5OH + Ch4COOH.
studfiles.net
диссоциация воды - это... Что такое диссоциация воды?
диссоциация водыwater dissociation
Русско-английский словарь по химии. 2013.
- диссоциация в поле
- диссоциация на молекулы
Смотреть что такое "диссоциация воды" в других словарях:
ДИССОЦИАЦИЯ — (лат. dissociatio). 1) разложение вещества на составные части. 2) в психологии распадение ассоциации представлений. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ДИССОЦИАЦИЯ лат. dissociatio. Распадение общества … Словарь иностранных слов русского языка
ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТИЧЕСКАЯ — ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТИЧЕСКАЯ, распад находящихся в растворе электролитов на электрически заряженные ионы. Коеф. вант Гоффа. Вант Гофф (van t Ной) показал,что осмотическое давление раствора равно давлению, к рое производило бы растворенное… … Большая медицинская энциклопедия
Диссоциация — химических соединений представляет одну из хорошо изученных форм так назыв. обратимых химических реакций, т. е. таких, которые идут в обе стороны химического равновесия (см. это слово, а также Реакция , Вытеснение ), а именно обозначает класс… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ионное произведение воды — Ионное произведение воды произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды. Содержание 1 Вывод значения ионного произведения воды … Википедия
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ — полный или частичный распад молекул растворенного в ва на катионы и анионы. Э. д. называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Э. д., как правило, происходит в полярных р рителях. При Э. д.… … Химическая энциклопедия
Электролитическая диссоциация — или ионизация (литер. Svante Arrhenius, Ueber die Dissociation der in Wasser gelösten Stoffe , Zeitschr. für physikalische Chemie , 1887; Sv. Arrhenius, La dissociation électrolytique des solutions. Rapport au Congrès internat. à Paris 1900 ; Max … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Константа диссоциации — Константа диссоциации вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда… … Википедия
ВОДОРОДНЫЕ ИОНЫ — ВОДОРОДНЫЕ ИОНЫ, представляют собой положительно заряженные атомы водорода. Атом водорода состоит из положительного ядра и одного единственного электрона, при потере которого он превращается в В. и., обозначаемый Н ; В. ион, т. о., тождествен с… … Большая медицинская энциклопедия
Водородный показатель — pH, отрицательный десятичный логарифм концентрации (точнее, активности) ионов водорода (в г ион/л) в данном растворе: В. п. служит количественной характеристикой кислотности растворов, которая оказывает существенное… … Большая советская энциклопедия
ТОПЛИВНЫЙ ЭЛЕМЕНТ — электрохимический генератор, устройство, обеспечивающее прямое преобразование химической энергии в электрическую. Хотя то же самое происходит в электрических аккумуляторах, топливные элементы имеют два важных отличия: 1) они функционируют до тех… … Энциклопедия Кольера
Электрохимия* — Содержание: Введение. Историческая справка. Обозначения, принятые в Э. Основные законы и принципы. Перенос ионов. Электропроводность растворов. Электровозбудительная сила. Переход химической энергии в электрическую. Классификация гальванических… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
chemistry_ru_en.academic.ru



















