Содержание
Практическое занятие № 5. Получение СО2 и изучение его свойств. Распознавание карбонатов
Задания. 1. Получите углекислый газ взаимодействием мрамора с соляной кислотой.
2. Изучите некоторые физические свойства диоксида углерода (IV) (цвет, запах, растворимость в воде, относительную плотность).
3. а) Изучите взаимодействие углекислого газа с водой;б) осуществите следующие превращения;
4. Распознайте известняк среди выданных образцов минералов.
5. Получите карбонат бария с помощью реакции обмена.
Оборудование. Прибор для получения газов, заправленный кусочками мрамора и соляной кислотой, лабораторный штатив, штатив с пробирками, пипетки, стаканы на 150 мл (2 шт.), картонный кружок для стакана, пробиркодержатели (2 шт.), нагревательный прибор.
Вещества. 10%-е растворы карбоната натрия и хлорида бария, 10%-я соляная кислота, известковая вода, раствор лакмуса, дистиллированная вода, минералы гипс, каолин, известняк, кварц.
Выполнение работы
1. Получение оксида углерода (IV). Зарядите прибор для получения углекислого газа (рис. 22.4). Получите углекислый газ, соберите его в химический стакан и прикройте картонным кружком. (Для чего?)
Получение оксида углерода (IV). Зарядите прибор для получения углекислого газа (рис. 22.4). Получите углекислый газ, соберите его в химический стакан и прикройте картонным кружком. (Для чего?)
2. Изучение свойств оксида углерода (IV). Внесите в стакан горящую спичку. Что наблюдаете? «Перелейте» содержимое в другой стакан. Убедитесь с помощью горящей спички, что углекислый газ действительно «перелился» из одного стакана в другой.
Какое свойство углекислого газа лежит в основе этого опыта? Опишите физические свойства исследуемого газа.
Налейте в пробирку (на 1 /4 ее объема) дистиллированную воду, подкрасьте ее фиолетовым раст
вором лакмуса и пропускайте через эту воду углекислый газ до изменения окраски индикатора. Почему изменилась окраска лакмуса? Составьте уравнение соответствующей реакции. Нагрейте содержимое пробирки до начала кипения. Почему снова изменился цвет лакмуса? Объясните это с помощью уравнения реакции.
3. Прилейте в пробирку (на 1/4 ее объема) известковую воду и пропускайте через нее углекислый газ.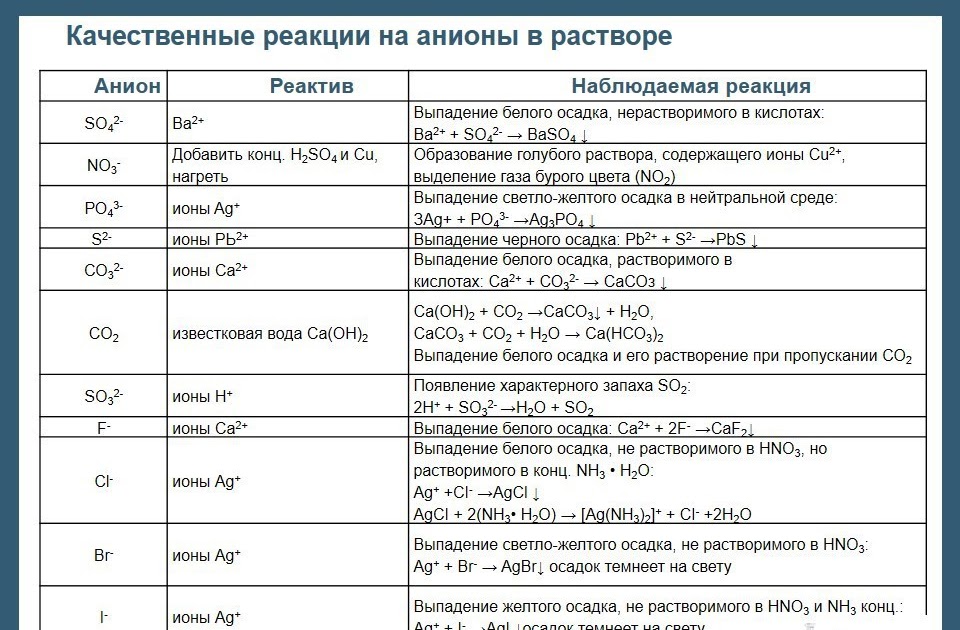 Что вы наблюдаете? Где используется в практике эта реакция? Продолжайте пропускать углекислый газ через мутную смесь до полного осветления раствора. Что произошло? Составьте уравнения наблюдаемых реакций.
Что вы наблюдаете? Где используется в практике эта реакция? Продолжайте пропускать углекислый газ через мутную смесь до полного осветления раствора. Что произошло? Составьте уравнения наблюдаемых реакций.
Содержимое пробирки с полученным гидрокарбонатом кальция разделите на две равные части. В одну пробирку добавьте известковую воду, а другую нагрейте до начала кипения раствора. Что вы наблюдаете? Объясните происходящее явление с помощью уравнений реакций. Сделайте выводы: а) каким образом карбонаты можно превратить в гидрокарбонаты;б) как можно гидрокарбонаты превратить в карбонаты.
4. Из выданных вам минералов с помощью химических реакций определите известняк. Составьте ионные уравнения проделанной реакции.
5. Получите реакцией обмена карбонат бария. Опытным путем докажите, что выпавший осадок действительно является карбонатом. Составьте полные и сокращенные ионные уравнения проделанных реакций.
1.
Картонным кружком стакан прикрывают для того, чтобы не улетучивался углекислый газ.
2.
При внесении в стакан с углекислым газом спичка тухнет, т.к. углекислый газ не поддерживает горения. Углекислый газ можно переливать из одного стакан в другой, т.к. он тяжелее воздуха и оседает на дне.
Физические свойства.
3.
Наблюдается помутнение раствора, на практике это используется при побелке стен. Происходит реакция:
Выводы:
а) карбонаты можно перевести в гидрокарбонаты, пропуская через них углекислый газ;
б) гидрокарбонаты можно перевести в карбонаты нагреванием или добавлением известковой воды.
4.
5.
Выделяется газ, который не поддерживает горение.
Источник:
Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
задача №5
к главе «Практические занятия».
Все задачи
← Практическое занятие № 4.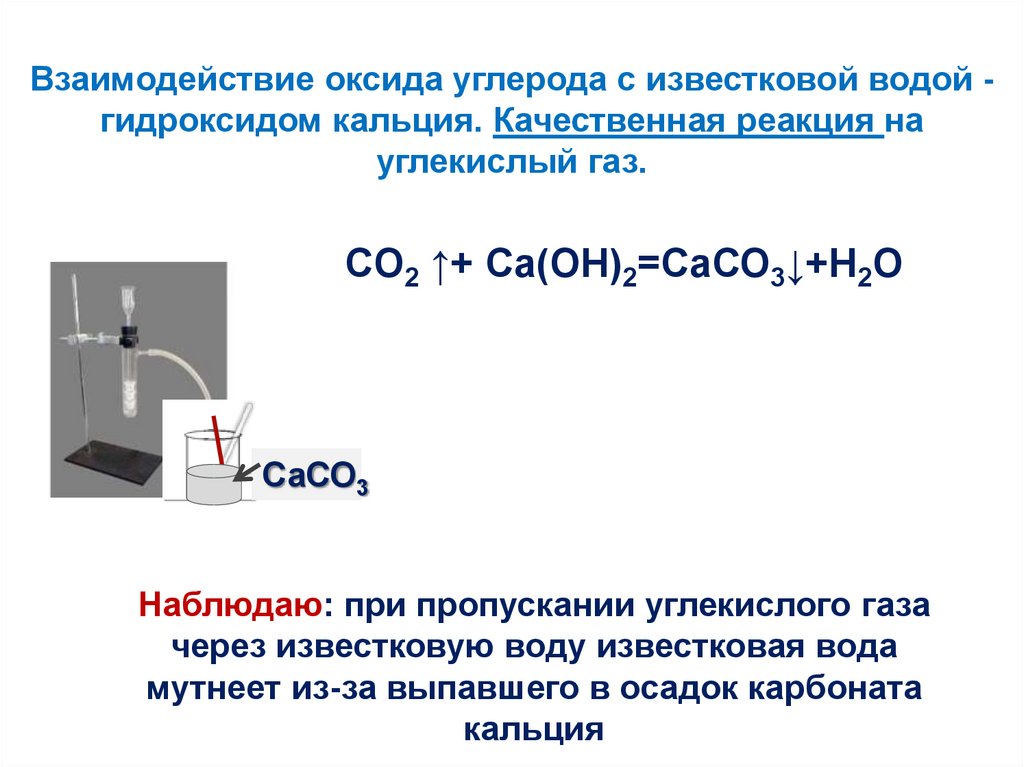 Распознавание минеральных удобрений
Распознавание минеральных удобрений
Практическое занятие № 6. Решение экспериментальный задач по теме «Азот и фосфор» →
Level 2 — Анионы — Качественные реакции
Level 1
Level 3
Level 2
Learn these words
13
words
0 ignored
Check the boxes below to ignore/unignore words, then click save at the bottom. Ignored words will never appear in any learning session.
All
None
Ignore?
S04 2-
Выпадение белого осадка, нерастворимого в кислотах: Ва(2+) + SO4(2-) = BaSO4↓ 2) Осадок сульфата свинца белого цвета.
MnS — телесный (розовый). ZnS — белый. PbS — черный. Ag2S — черный. CdS — лимонно-желтый. SnS — шоколадный. HgS (метакиноварь) — черный. HgS (киноварь) — красный. Sb2S3 — оранжевый. Bi2S3 — черный.
SO3 2-
При добавлении к раствору сильных кислот образуется диоксид серы SO2 — газ с резким запахом (запах зажженной спички): SO3(2-) + 2H(+) = SO2↑ + h3O
CO3 2-
При добавлении к раствору карбоната сильных кислот образуется CO2, гасящий горящую лучинку: CO3(2-) + 2H(+) = CO2↑ + h3O 2) выпадение белого осадка, растворимого в кислотах: Са(2+) + СO3(2-) = СаСОз↓
известковая вода Са(ОН)2. Са(ОН)2 + С02 -СаСО3↓ + Н2O, СаСО3 + СO2 + Н2O -Са(НСO3)2 Выпадение белого осадка и его растворение при пропускании СO2
Выпадение-белого осадка: Са(2+)+ 2F= CaF2
FeO4 2-
Осаждение из раствора феррата бария красного цвета (реакция проводится в среде щелочи): Ba(2+) + FeO4(2-) =OH(-)= BaFeO4↓ Ферраты — сильнейшие окислители (сильнее перманганатов). Устойчивы в щелочной среде, неустойчивы в кислой: 4FeO4(2-)+ 2OH = 4Fe(3+) + 3O2↑ + 10h3O
PO4 3-
При добавлении к раствору фосфата раствора соли серебра выпадает желтоватый осадок фосфата серебра (I) Ag3PO4: 3Ag(+)+ PO4(3-) = Ag3PO4↓ Аналогична реакция и к дигидрофосфат-аниону h3PO4
Ag(+) + Cl(-) = AgCl↓
Нитраты в растворе не проявляют окислительных способностей. Но при подкислении раствора способны окислить, к примеру, медь (раствор подкисляют обычно разб. h3SO4): 3Cu + 2NO(3-) + 8H(+) = 3Cu(2+) + 2NO↑ + 4h3O Образование голубого раствора, содержащего ионы Сu2+, выделение газа бурого цвета (NO2) 2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(h30)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца»)
Но при подкислении раствора способны окислить, к примеру, медь (раствор подкисляют обычно разб. h3SO4): 3Cu + 2NO(3-) + 8H(+) = 3Cu(2+) + 2NO↑ + 4h3O Образование голубого раствора, содержащего ионы Сu2+, выделение газа бурого цвета (NO2) 2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(h30)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца»)
AsO4 3-
Образование нерастворимого в воде арсената серебра (I) Ag3AsO4, имеющего цвет «кофе с молоком»: 3Ag(+) + AsO4(3-) = Ag3AsO4↓
Cr2O7 2-
При добавлении к раствору дихромата раствора соли серебра образуется осадок оранжевого цвета Ag2Cr2O7: 2Ag(+)+ Cr2O7(2-) = Ag2Cr2O7↓
MnO 4-
Перманганат-анион «выдает» темно-фиолетовая окраска раствора. Кроме того, перманганаты — сильнейшие окислители, в кислой среде восстанавливаются до Mn2+ (фиолетовая окраска исчезает), в нейтральной — до Mn+4 (окраска исчезает, выпадает бурый осадок диоксида марганца MnO2) и в щелочной — до MnO42- (окраска раствора изменяется на темно-зеленый):
Реакция диоксида углерода с известковой водой
В этой статье мы подробно обсудим и ответим на все вопросы, связанные с реакцией оксида меди и серной кислоты. Но прежде чем перейти к вопросам и соответствующим ответам на них, сначала позвольте познакомить вас с серной кислотой и оксидом меди. Серная кислота — сильная кислота, образующаяся при окислении растворов диоксида серы. Формула серной кислоты. Эта кислота в больших количествах используется в промышленности и лабораториях в качестве реагента. Концентрированная форма серной кислоты является плотной, маслянистой и коррозионно-активной. Другой сложный оксид меди представляет собой соединение, которое образуется, когда два элемента, медь и кислород, реагируют друг с другом. Его формула CuO.
Но прежде чем перейти к вопросам и соответствующим ответам на них, сначала позвольте познакомить вас с серной кислотой и оксидом меди. Серная кислота — сильная кислота, образующаяся при окислении растворов диоксида серы. Формула серной кислоты. Эта кислота в больших количествах используется в промышленности и лабораториях в качестве реагента. Концентрированная форма серной кислоты является плотной, маслянистой и коррозионно-активной. Другой сложный оксид меди представляет собой соединение, которое образуется, когда два элемента, медь и кислород, реагируют друг с другом. Его формула CuO.
Реакция оксида меди с серной кислотой
Смешивание оксида меди и серной кислоты представляет собой эксперимент, включающий нерастворимый оксид металла , который реагирует с разбавленной кислотой с образованием растворимой соли . Оксид меди (II) представляет собой черное твердое вещество, которое при реакции с серной кислотой образует химическое вещество голубовато-голубого цвета, называемое сульфатом меди II. Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Написание уравнения оксида меди + серная кислота
Эту химическую реакцию можно записать следующим образом: ) Чтобы узнать, как сделать сульфат меди в домашних условиях, ознакомьтесь с этой статьей.
Что происходит, когда медь реагирует с концентрированной серной кислотой?
Восстановительный потенциал разбавленной серной кислоты выше, чем у водорода. Медь не способна вытеснять водород из неокисляющих кислот, например соляной или разбавленной серной кислоты. Другими словами, можно сказать, что медь не реагирует с разбавленной серной кислотой. Однако он реагирует с концентрированной серной кислотой, потому что серная кислота в концентрированной форме является окислителем. При нагревании меди с концентрированной серной кислотой происходит окислительно-восстановительная реакция, и кислота превращается в диоксид серы. Уравнение этой химической реакции приведено ниже:
Уравнение этой химической реакции приведено ниже:
Какое сбалансированное уравнение для оксида меди и серной кислоты?
Балансное уравнение оксида меди и серной кислоты приведено ниже:
Почему оксид меди и серная кислота окрашиваются в синий цвет?
Все мы знаем, что реакция оксида меди + серная кислота приводит к химическому веществу синего цвета. Но задумывались ли вы когда-нибудь, почему реакция оксида меди с серной кислотой приводит к химическому веществу синего цвета? Что ж, мы подробно ответим на этот вопрос здесь. Оксид меди представляет собой твердое вещество черного цвета. Когда он реагирует с серной кислотой, он производит химическое вещество голубовато-синего цвета, известное как сульфат меди. Синий цвет обусловлен образованием растворимой соли. Ионы меди и сульфата диссоциируют, когда сульфат меди растворяется в воде. Хотя эффект не меняется, однако характер расщепления между t2g и eg-орбиталями в этом новом комплексе таков, что он поглощает красновато-оранжевый свет. Из-за этого поглощения вы увидите раствор голубоватого цвета.
Из-за этого поглощения вы увидите раствор голубоватого цвета.
Растворяет ли серная кислота медь?
Нет, серная кислота не может растворить медь. Однако, если наблюдается растворение, это может быть вызвано одной из следующих двух причин:
- Существует вероятность того, что поверхность порошка металлической меди частично окислена до . Серная кислота может растворить окисленную поверхность меди
- Образование вихря при перемешивании. Небольшое количество воздуха (кислорода), введенное в выщелачивающий раствор, действовало как окислитель.
Какая соль образуется при взаимодействии оксида меди с соляной кислотой?
Реакция меди и соляной кислоты невозможна. Однако оксид меди может реагировать с этой кислотой. Когда металл реагирует с кислотой, происходит окислительно-восстановительная реакция. Из-за более высокого восстановительного потенциала меди по сравнению с водородом она не может реагировать с неокисляющими кислотами, такими как серная кислота и соляная кислота.
Но оксид меди — это не металл, а оксид металла. Оксиды металлов являются основными веществами, которые могут реагировать с кислотами с образованием соли и воды. Эти кислотно-щелочные реакции также известны как нейтрализация и не являются окислительно-восстановительными по своей природе.
Будучи слабым основанием, оксид меди легко реагирует с HCl с образованием растворимого хлорида меди и воды. Уравнение этой химической реакции приведено ниже:
[Растворенный] CO2 при пропускании в избытке известковой воды становится бесцветной ag
Посмотреть все бумаги HP TET >
- Карбонат кальция
- Бикарбонат кальция
- Хлорид кальция
- Карбонат меди
Вариант 2: Бикарбонат кальция
Бесплатно
Bihar Police SI Prelims 2020: Полный пробный тест
1,4 миллиона пользователей
100 вопросов
200 марок
120 минут
Объяснение:
- Гидроксид кальция умеренно растворим в воде, образуя щелочной раствор, известный как известковая вода.

- Карбонат кальция — это химическое соединение, которое обычно содержится в горных породах в виде минералов и является основным компонентом жемчуга и раковин морских организмов, яиц и т. д.
- Когда газообразный диоксид углерода пропускают через известковую воду или над ней, она становится молочной из-за образования карбоната кальция.
- В химической реакции это может быть показано как:
\(\rm \underset{Известь\вода}{Ca (OH)_2} \ (водн.) \ + \ \underset{Углерод \ Двуокись}{CO_2 \ (г)}\ \longrightarrow \ \underset{Кальций \ Карбонат}{CaCO_3\(g)}\)Ca(OH)2
- Однако при пропускании через этот раствор избытка CO2 молочность исчезает. Это связано с образованием бикарбоната кальция, бесцветного и растворимого в воде.
\(\rm \underset{Известь\вода}{Ca (OH)_2} \ (водн.) \ + \ \underset{Углерод \ Двуокись}{CO_2 \ (g)}\ \longrightarrow \ \underset{Кальций \ Карбонат}{CaCO_3 \ (г)}\)\(\rm \underset{Известь\ вода}{Ca CO_3} \ (водн. ) \ + \ \underset{Углерод \ Двуокись}{CO_2 \ (g)}\ \longrightarrow \ \underset{Кальций \ Карбонат}{Ca(HCO_3)_2 \ (г)}\) Известковая вода (водн.) + CO2 (г) Двуокись углерода ⟶ CaCO3 (г) Карбонат кальция\(\rm \underset{Кальций \ Карбонат}{Ca CO_3} \ \ +H_2O+ \ \underset{Углерод \ Диоксид}{CO_2 \ (g)} \ \longrightarrow \ \ underset{Кальций \ bi\ Карбонат}{Ca(HCO_3)_2 \ (g)} \)
) \ + \ \underset{Углерод \ Двуокись}{CO_2 \ (g)}\ \longrightarrow \ \underset{Кальций \ Карбонат}{Ca(HCO_3)_2 \ (г)}\) Известковая вода (водн.) + CO2 (г) Двуокись углерода ⟶ CaCO3 (г) Карбонат кальция\(\rm \underset{Кальций \ Карбонат}{Ca CO_3} \ \ +H_2O+ \ \underset{Углерод \ Диоксид}{CO_2 \ (g)} \ \longrightarrow \ \ underset{Кальций \ bi\ Карбонат}{Ca(HCO_3)_2 \ (g)} \)
Дополнительная информация Вовлеченная реакция-
CACO 3 + 2HCL → CACL 2 + CO 2 + H 2 + D 2 + H 2 O 2 + H 2 O 2 + H 2 . проходит через известковую воду и делает ее молочной.
Ca(OH) 2 + CO 2 → H 2 O + CaCO 3
8
CACO 3 + H 2 O + CO 2 → CA (HCO 3 ) 2
- Бикарбонат, который снова снят.



