Содержание
химическая формула, чем опасен бром, его оксид, с чем реагирует, взаимодействует, обесцветится ли раствор при добавлении Br, реакция — как выглядит, чем отличается, что это такое
Рассмотрим раствор, активно используемый в промышленности. В фокусе внимания – бромная вода: что это такое, состав, как выглядит, структурная химическая формула и свойства, чем опасен бром для человека – пройдемся по всем этим вопросам, чтобы вы имели полное представление.
Сразу отметим, что особенно важна и востребована оно в лабораториях, где используется для выявления алкенов, которые она идентифицирует, изменяя свой цвет. И развеем один старый миф: что ее якобы давали советским солдатам для снижения потенции. Вряд ли, потому что для этого не было поводов, она не уменьшает либидо и не оказывает отрицательного влияния на мужскую силу. Если ее и подливали в напитки, то лишь в качестве мягкого снотворного, хотя и этому нет никаких доказательств. Ну а теперь сосредоточимся на более специфических моментах.
Определение
Это раствор, состав которого можно записать по схеме:
«бром плюс вода и кислоты» (бромоводородная и бромноватистая)
В обычных условиях это желто-оранжевая по своему цвету жидкость с высокой степенью прозрачности. Является достаточно активным веществом, успешно сочетающимся как с органикой, так и с неорганическими соединениями. Довольно сильный окислитель, быстро воздействующий в щелочной среде на катионы Mn+3, Ni+3, Cr+3, Co+2, Fe+2, а также в отдельном порядке на фенолы.
Формула
Записывается максимально просто – Br2, – не только соответствуя встречающейся в природе молекуле элемента, но и отражая ее количественный и качественный состав.
Но также содержит HBr и HBrO, которые тоже заслуживают внимания, так как определяют особенности хранения. За счет наличия этих свободных кислот значительно снижает pH-уровень той технологической среды, в которую добавлена (и эта ее особенность имеет ключевое значение при фильтрации, естественно, при соблюдении должной дозировки).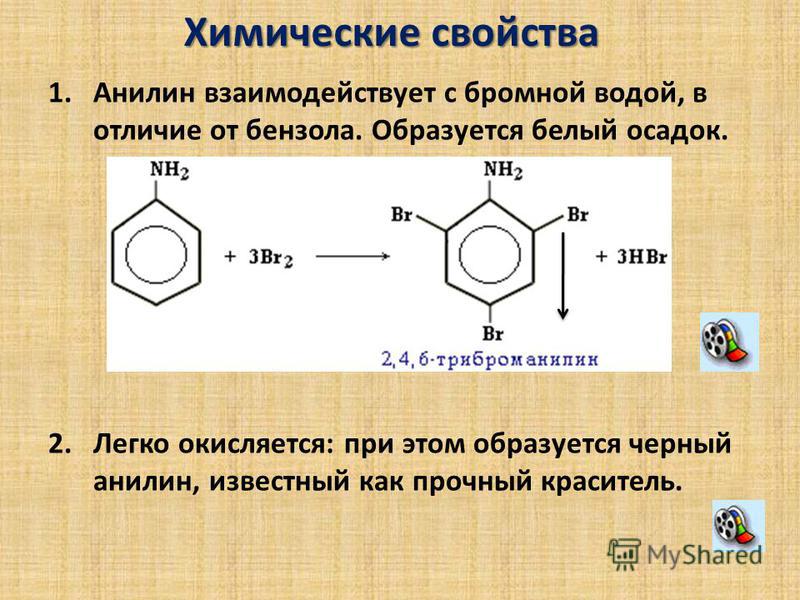 И является важным компонентом при проведении целого ряда анализов и при изготовлении многих органических препаратов.
И является важным компонентом при проведении целого ряда анализов и при изготовлении многих органических препаратов.
Формула бромной воды в химии
Br2 позволяет определить молекулярную массу – из следующих уравнений:
Mr(Br2) = 2 х Ar(Br), то есть Mr(Br2) = 2 х 80 = 160
Одна из наиболее частых реакций:
Br2 + h3O ⇌ HBr + HBrO
Если развернуть это описание и осветить его более подробно, система уравнений приобретет вид:
Br2(K) + nh3O ⇌ Br2 x nh3O(P),
что, в свою очередь, можно преобразовать в:
Br2 x nh3O ⇌ HBr + HBrO + (n – 1) x h3O,
из этого вырастает:
HBr + h3O → Br- + h4O+,
и, наконец:
HBrO + h3O ⇌ BrO- + h4O+
К тому, как взаимодействуют оксид брома и вода, нужно добавить, что массовая доля элемента в составе в норме не превышает 3,5%, но при наличии бромидов степень растворимости увеличится благодаря появлению следующих комплексов:
Br2 + Br- ⇌ [Br3],
которые подвергаются постепенному разложению под воздействием света:
2HBrO → 2HBr + O2
Последний процесс запускает бромноватистая кислота и, чтобы его предупредить, следует держать вещество в затемненной таре или хотя бы не подвергать его воздействию прямых лучей. При должном хранении с соблюдением всех норм оно сбережет свои полезные в условиях лаборатории свойства в течение долгого срока.
При должном хранении с соблюдением всех норм оно сбережет свои полезные в условиях лаборатории свойства в течение долгого срока.
Электронная формула
Оставим на время в стороне вещества, которые взаимодействуют с бромной водой, и посмотрим на строение атома Br. При массовом числе 80 у него 4 орбиты, по которым вокруг ядра вращаются 35 электронов. Также у него есть 45 нейтронов и 35 протонов.
Распределение можно записать так:
+35Br)2)8)18)7
или, по-другому:
1s22s22p63s23p63d104s24p5.
История открытия
Сам Br был впервые описан в 1826 году Антуаном Баларом – препаратором из Монпелье. Молодой ученый получил темно-бурую жидкость из сожженных морских водорослей и назвал ее муридом (по аналогии с латинским muria, то есть «рассол»). Хотя немногим раньше, в 1825м, ассистент профессора Гмелина, студент Левиг с помощью хлора выделил элемент из кройцнахского источника. Правда, пока немец собирал достаточное количество материала для проведения исследований, француз его опередил, заявив о своем открытии.
В любом случае заседатели специально собранной комиссии (среди которых был и знаменитый Гей-Люссак) из Парижской академии наук посовещались и признали название Балара неудачным. Дело в том, что в то время семейству солей хлороводородной кислоты было дано имя муриаты. Вот ученые и посчитали, что слишком созвучные термины вызовут путаницу, и вместо этого предложили вариант Brome (с греческого переводится как «зловонный»), потому что открытие неприятно пахло. Его и ввели в употребление по всему миру, естественно, с поправкой на языковые особенности.
Приготовление бромной воды: получение, применение, цвет
Сначала – несколько слов о самом Br. При стабильно комнатной температуре он является жидким (и это единственный неметалл с таким состоянием) и обладает теми же характеристиками, что и галогены. По своей реакционной способности он находится между хлором и йодом. Визуально он тягучий и красно-коричневый, прямо как NO2, но спутать их невозможно из-за запаха, ярко выраженного и негативно воспринимаемого обонянием.
Элемент повсеместно распространен и сегодня, причем наивысшее его содержание фиксируется в соленых озерах и морях (откуда он может попадать и в пресные источники). За счет более высокой плотности бром растворяется в воде очень легко, делая ее оранжевой.
Есть два способа приготовления – рассмотрим каждый. Согласно первому методу, нужно:
- взять 4 мл Br и 1 л дистиллированной h3O;
- интенсивно перемешать их в закрытой колбе.
При всей кажущейся простоте действия важно соблюдать предельную осторожность и работать только в защитной одежде и в вытяжном шкафу. Все потому, что при соединении двух компонентов выделяются ядовитые испарения.
Более безопасный, а значит и удобный вариант – расщепление порошка NaBr и помощью отбеливателя (с хлором, но без добавок и ароматизаторов) и HCl. Происходит следующим путем:
- ингредиенты соединяются в стакане;
- полученный раствор отправляют в чистую емкость (бутылку), в которую вливают средство бытовой химии;
- резервуар закрывают крышкой, проверяя плотность ее прилегания, и аккуратно встряхивают;
- результат смешивают с дистиллятом h3O.

Чем отличается бромная вода от брома: состав
Растворяясь, рассматриваемый нами элемент запускает реакции оксидации, которые приводят к диспропорциональному выделению бромида и гипобромита – в соответствии с представленной ниже закономерностью:
Br2 + h3O → BrO- + Br- + 2H+
Это продолжается таким же неравным образованием бромата и бромида – следующим образом:
3Br2 + 6OH → BrO3- + 5 Br- + 3h3O
Поведение присутствующих кислот определяет условия хранения. Содержать данный продукт необходимо в затемненной стеклянной посуде и не вынося на свет. Если пренебречь этими правилами и поднести жидкость под прямые солнечные лучи (или в тепло), это спровоцирует выделение кислорода. Что происходит с бромной водой в этом случае? Она не только теряет свои полезные характеристики, но и начинает испускать газ HBr, пары которого ядовиты и очень неприятно пахнут.
Химические свойства
Подобно галогеновым смесям является замечательным оксидантом, хотя и немного проигрывает в этом плане хлорному раствору. Эффективно окисляет марганец, железо, никель, кобальт, хром, другие металлы. Отдельной строкой идут фенолы, при добавлении которых замещенные соединения выпадут в осадок. Эта операция выполняется с небольшим вливанием h3O в роли катализатора (иначе она протекала бы несколько дней).
Эффективно окисляет марганец, железо, никель, кобальт, хром, другие металлы. Отдельной строкой идут фенолы, при добавлении которых замещенные соединения выпадут в осадок. Эта операция выполняется с небольшим вливанием h3O в роли катализатора (иначе она протекала бы несколько дней).
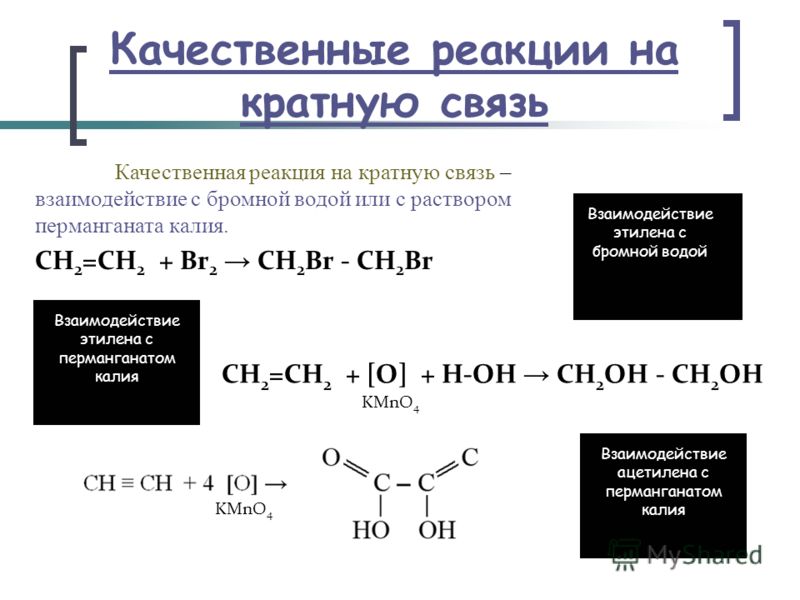
Важнейшей особенностью является качественная реакция взаимодействия с бромной водой: если она обесцветится при введении органического соединения, значит, в добавке есть как минимум одна двойная связь СС, и взятый в качестве образца углеводород непредельный.
В каждом из случаев происходит именно радикальная замена, поэтому обязательным условием для эффективного течения эксперимента является наличие катализаторов и/или яркий свет.
Все объясняется электрофильным сложением, и особенно четко эта закономерность видна по пропусканию через среду любого алкина или алкена, допустим, этилена. По местам разрыва начнут присоединяться атомы Br, продолжая цепи. А если в качестве примера взять муравьиную кислоту, то будет также выделяться H и CO2 (диоксид серы, бром, вода – характерная комбинация).
Физические свойства
Тягучая желто-оранжевая жидкость, возможно, с красновато-коричневым оттенком с явным и сразу узнаваемым неприятным запахом. Внимание, ее пары ядовиты, поэтому хранить ее следует не просто в темноте, а в герметично закрытой емкости.
Также необходимо избегать ее попадания на кожу. В случае непродолжительного контакта пораженное место будет достаточно сильно зудеть, а вот длительное воздействие уже грозит болезненными ожогами или даже появлением язвочек. Поэтому, если вы вдруг допустите неосторожность, как можно скорее промойте поврежденный участок, а если рана еще и глубокая, смажьте ее мазью с NaHCO3.
Применение
1. Актуальна в лабораторных условиях, при проведении анализов на наличие непредельных углеводородов и масел. Используется ключевая особенность – делается ставка на то, что раствор брома в воде обесцветится при добавлении алкинов или алкенов. Например, при взаимодействии с этиленом (эффективном и в ситуации с перманганатом калия) будут образованы двойные и тройные связи ионов Br с p-электронами и выделится дибромэтан.
2. В медицинской сфере на основе данной жидкости изготавливают широкий ряд препаратов, применять которые необходимо строго по предписанию врача. Почему? Из-за накопительного эффекта элемента, при передозировке вызывающего целый ряд неприятных последствий (их мы отдельно разберем ниже).
3. Еще одна ниша – производство антипиренов, востребованных в строительстве. Br2 входит в состав многих пропиток, которыми обрабатывают древесину, ткани и другие материалы для придания им огнеупорных свойств.
Отдельно отметим, что ракетное топливо часто подвергается процедуре окисления бромной водой, что помогает сократить его расход, а соли рассматриваемого вещества востребованы при выпуске инсектицидов и пестицидов.
Способы получения
По характеру использования оборудования их можно разделить на два вида – рассмотрим оба.
Механический – мы уже описывали его раньше, но для закрепления предоставим еще один пример с другими концентрациями. Итак, потребуется:
- 1 мл Br и на каждые 250 мл дистиллированной h3O;
- закрытая колба для перемешивания компонентов;
- вытяжной шкаф и спецодежда для безопасности проведения процесса.

В числе минусов, напоминаем, ядовитые испарения. После приготовления жидкость необходимо хранить в непрозрачной и герметичной стеклянной емкости.
Электрохимический – в данном случае схема такая:
- на электролизер направляется водный раствор KBr, NaBr или другого щелочного металла с концентрацией 60 г/л;
- под током плотностью 1 кА/м2 поток подают на мембрану МФ-4СК-100;
- этот фильтр улавливает частицы Na и пропускает Br, который, при взаимодействии с h3O, образует Br2 и сопутствующие кислоты (HBr, HBrO).
Преимущество данной технологии в том, что все ее этапы можно проводить, не находясь в непосредственной близости с веществами, а значит и не вдыхая ядовитые испарения и не рискуя получить ожог от капли, случайно попавшей на кожу. Еще один плюс – в промышленных масштабах, ведь при производстве жидкости объем не ограничен размером колбы.
Методы очистки воды от брома
Каждый из них представляет собой комплекс последовательно осуществляемых воздействий: аэрирование, удаление углекислот, фильтрование, регенерацию и воплощается в жизнь на специализированном оборудовании. Поэтому рассмотрим их тезисно.
Поэтому рассмотрим их тезисно.
- обработка адсорбентом, например, сильноосновным анионитом, смолой AB-17-8 – актуальна для стоков фармацевтических производств;
- введение иодидов с последующим поглощением загрузкой на основе гидроксида алюминия – подходит для подземных источников, также богатых железом и марганцем;
- комплексное воздействие – с кондиционированием, использованием гранулированных катионитов (сульфо- и карбоксильных), анодированием, пропусканием через слой активированного угля – вариант для жидкости, которая будет использоваться в хозяйственных целях и для питья и приготовления пищи.
Примеры реакций, при которых бромная вода обесцвечивается
Все они являются качественными, то есть сопровождающимися ощутимым эффектом.
Первый случай – с алкеном, но также можно провести и другие аналогии:
Ch3=Ch3 – Br2 → Br – Ch3–Ch3 – Br
Второй – уже с алкином:
CH≡CH + Br2 → CHBr=CHBr
Есть еще одна показательная ситуация и связана она с этиленом, который нужно пропустить через рассматриваемую жидкость; тогда получим:
Ch3=Ch3 + Br2 → Ch3Br–Ch3Br
Алкадиены отличаются только тем, что у них сразу пара двойных связей, но взаимодействие будет таким же, как в примере №1. С кратными и тройными та же история.
С кратными и тройными та же история.
Особняком стоит соединение, через которое зачастую пропускают изопрен, технический карбид кальция, нитраты алюминия и хрома. Это избыток бромной воды, формула которого записывается как 3Br2, и сочетание с ним приводит к самым разным результатам, в том числе и к выпадению осадка, и к образованию производных.
Значение Br для организма человека
Данный биогенный элемент оказывает важное влияние на здоровье, так как задействован в ряде реакций и входит в состав большинства тканей (мышечной, костной, зубной), содержится в крови, щитовидке, почках, а выводится с естественными выделениями.
У него комплексная роль:
- Способствует улучшению переваривания белка (за счет активации пепсина), регулирует кислотность желудочного сока.
- Оказывает влияние на катаболизм, улучшая выработку амилазы (расщепляет крахмал) и липазы (сложные жиры), снижает уровень сахара.
- Уменьшает потребление йода и концентрацию его радиоактивного изотопа, используется при профилактике эндемического зоба.

- Вытесняет хлор и позитивно воздействует на нервную систему, являясь отличным помощником при истерии, стрессах, бессоннице, эпилепсии, гипертонии.
- Улучшает работу гипофиза, надпочечников, желез внутренней секреции.
Отдельно отметим, как бромная вода реагирует с эякулятом: она повышает количество сперматозоидов. Таким образом, она не просто не снижает половое влечение – этот миф мы развенчали в самом начале обзора, – а даже способствует сохранению мужской силы и укреплению либидо.
Как сказывается недостаток Br на человеческом здоровье
- О его дефиците говорят такие признаки:
- раздражительность и общая нервозность, нарушения сна;
- проблемы с пищеварением;
- малое содержание гемоглобина в крови;
- понижение уровня кислотности желудочного сока.
У детей также может наблюдаться отставание в росте. Но обычно элемента вполне хватает – он в достаточном количестве поступает с пищей, причем даже тогда, когда питание не самое сбалансированное.
Передозировка Br
Рассуждая о том, какие вещества взаимодействуют с бромной водой, нельзя забывать, что это жидкость, которая может вызвать серьезнейшую интоксикацию – в силу следующих причин:
- пренебрежение правилами безопасности и/или неосторожность на производстве, оборачивающаяся вдыханием паров;
- злоупотребление Валокордином, Корвалолом и другими подобными лекарственными препаратами;
- неверное использование пестицидов, удобрений, ядохимикатов при работе в саду или огороде.
Признаки отравления:
- приступы сухого кашля;
- головокружение, спутанность сознания;
- спазмы в горле, слезотечение;
- жидкий стул;
- увеличение лимфоузлов.
Кроме того, элемент может накапливаться в организме и со временем спровоцировать бромизм, то есть хроническую интоксикацию, для которой характерны:
- постоянные бронхиты и риниты;
- вялость, апатия, упадок сил;
- ухудшение зрения и слуха;
- конъюнктивит;
- специфические угри на коже.

В обоих случаях нужно идти к врачам, просто в первом – в срочном порядке, а во втором – не затягивая.
Воспользовавшись услугами компании «Вода Отечества», поставляющей высококачественное оборудование для водоочистки, вам не придется беспокоиться о здоровье ваших близких и собственном. Своевременное обнаружение и устранение причин опасного превышения веществ очень важно.
Всегда следует внимательно следить за чистотой скважины (или другого источника), регулярно проводя проверки на наличие примесей. Если в очередном заборе будет обнаружена повышенная концентрация Br, обращайтесь к нам. У нас вас проконсультируют опытные специалисты, не просто знающие, какого цвета бромная вода, какие у нее свойства и с чем она взаимодействует, но и в каждой конкретной ситуации подбирающие лучшее оборудование для эффективной фильтрации.
Бромная вода — водный раствор брома
Бромная вода представляет собой разведенный водой бром. Ее в уравнениях реакции принято записывать через такую формулу — Br2, хотя она в растворе находится в виде смеси двух кислот — HBrO (бромноватистая кислота) и HBr (бромоводородная кислота). Данное соединение имеет желто-оранжевый цвет и довольно низкую температуру замерзания. Является сильным окислителем, который способен в щелочной среде окислять катионы таких металлов — Сг+3, Мп+3, Fe+2, Co +2, Ni+3. Добавление Br2 уменьшает водородный показатель раствора (рН), т.к. бромная вода содержит свободные кислоты.
Данное соединение имеет желто-оранжевый цвет и довольно низкую температуру замерзания. Является сильным окислителем, который способен в щелочной среде окислять катионы таких металлов — Сг+3, Мп+3, Fe+2, Co +2, Ni+3. Добавление Br2 уменьшает водородный показатель раствора (рН), т.к. бромная вода содержит свободные кислоты.
Это химически активное вещество, которое может вступать во взаимодействие как с неорганическими, так и с органическими веществами. Рассмотрим некоторые химические процессы с данным соединением.
Обесцвечивание бромной воды служит качественной реакцией на все непредельные углеводороды. Для проведения такого эксперимента необходимо небольшое количество любого алкена или алкина смешать в пробирке с Br2. В ходе данной реакции происходит присоединение атомов брома по месту разрыва двойной или тройной связи. Исчезновение желто-оранжевой окраски при таком взаимодействии является доказательством непредельности взятого углеводорода.
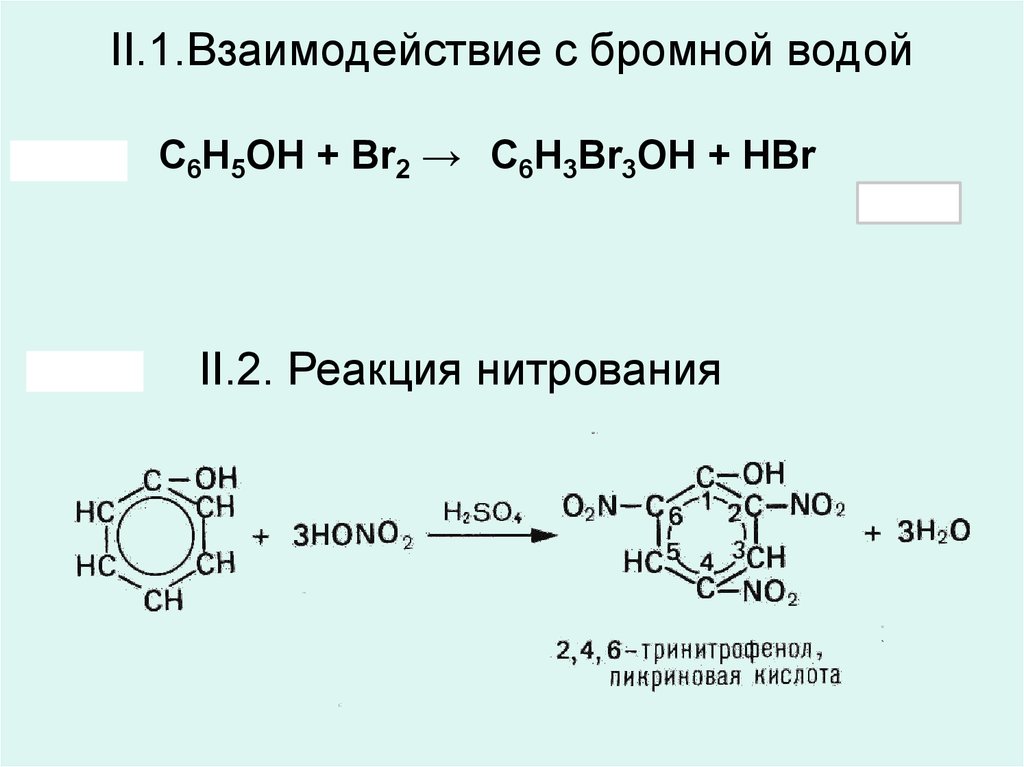
Химическая реакция «фенол — бромная вода» используется для осаждения из растворов бромзамещенных соединений. Если данное взаимодействие веществ проводить в безводной среде, то образование трибромфенола займет пару дней. Поэтому в качестве катализатора добавляют небольшое количество Н2О.
Бромная вода в лаборатории готовится так: к 1 мл брома добавляют 250 мл дистиллированной воды, при этом интенсивно перемешивают. Приготовленный раствор хранят в плотно закрытой емкости из темного стекла. Если приготовленную Br2 хранить на свету или в светлой склянке, то будет происходить выделение кислорода из-за содержания бромноватистой кислоты. Работу по приготовлению реактива проводят в вытяжном шкафу. Так как сам бром ядовит, а бромная вода его содержит, то при работе с ней необходимо соблюдать осторожность.
Необходимо учитывать и тот факт, что при попадании Br2 на кожу появляется сильный зуд, а при длительном воздействии могут возникнуть язвочки.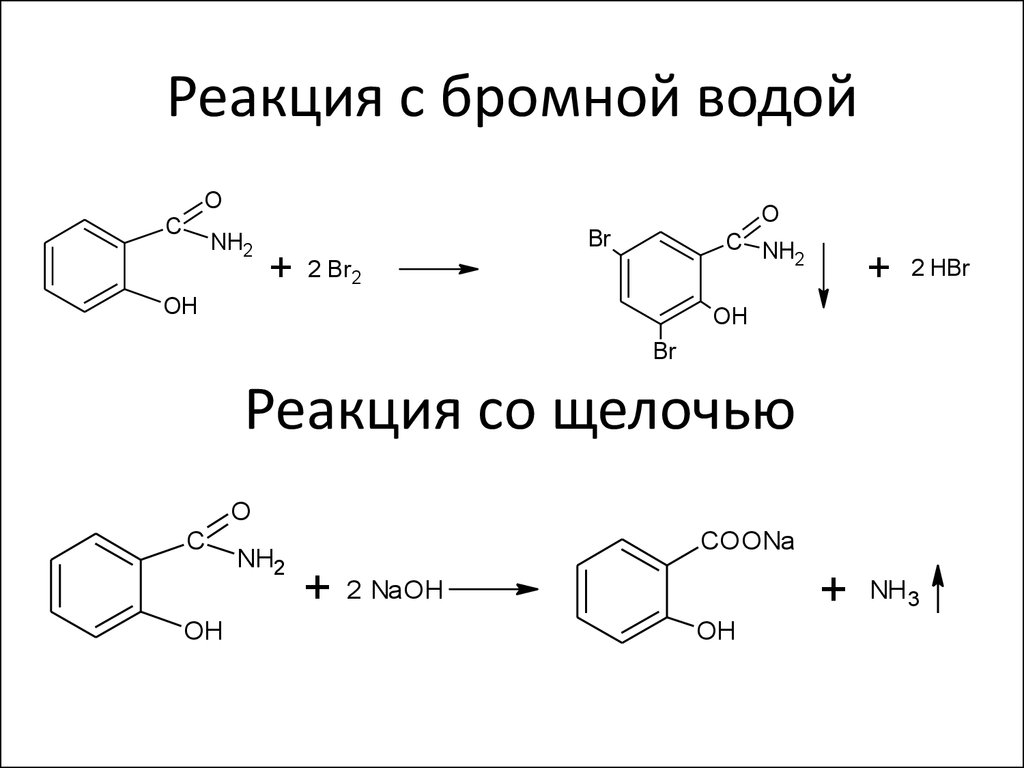 Если вещество попало на кожу, ее следует промыть большим количеством воды, а затем карбонатом натрия. При большой раневой поверхности или глубоких поражениях эпидермиса кожа дополнительно смазывается мазью, в состав которой входит NaHCO3.
Если вещество попало на кожу, ее следует промыть большим количеством воды, а затем карбонатом натрия. При большой раневой поверхности или глубоких поражениях эпидермиса кожа дополнительно смазывается мазью, в состав которой входит NaHCO3.
Бромная вода широко используется в химическом анализе и синтезе органических препаратов. Так, ее используют при производстве бромсодержащих лекарственных средств. И здесь необходимо быть осторожными, т.к. длительное их употребление может привести к заболеванию – бромизм. Основные симптомы – апатия, вялость, появление кожной сыпи. Для более быстрого выведения ионов брома из организма соблюдают диету с повышенным содержанием соли и обильное питье. Еще бромную воду применяют на промежуточных этапах производства антипиренов – веществ, которые защищают органические соединения от воспламенений. Ими пропитывают ткани, древесину, строительный материал.
CDC | Факты о броме
Что такое бром
- Бром – это встречающийся в природе элемент, который представляет собой жидкость при комнатной температуре.

- Имеет коричневато-красный цвет с запахом отбеливателя, растворяется в воде.
Где встречается бром и как он используется
- Бром естественным образом содержится в земной коре и в морской воде в различных химических формах. Бром также можно найти в качестве альтернативы хлору в плавательных бассейнах.
- Продукты, содержащие бром, используются в сельском хозяйстве и санитарии, а также в качестве антипиренов (химических веществ, которые помогают предотвратить возгорание).
- Некоторые бромсодержащие соединения исторически использовались в качестве седативных средств (лекарств, которые могут сделать людей спокойными или сонными). Однако эти препараты по большей части больше не продаются на рынке Соединенных Штатов.
Как вы можете подвергнуться воздействию брома
- После попадания брома в воду вы можете подвергнуться воздействию, выпив загрязненную воду.
- Если пища загрязнена бромом, вы можете заразиться, употребляя в пищу зараженную пищу.

- После выброса газообразного брома в воздух вы можете заразиться, вдыхая пары.
- Воздействие брома на кожу может произойти при прямом контакте с жидким или газообразным бромом.
- Газообразный бром тяжелее воздуха, поэтому он будет оседать в низинах.
Как действует бром
- Бром оказывает непосредственное раздражающее действие на кожу, слизистые оболочки и ткани.
- Серьезность отравления, вызванного бромом, зависит от количества, пути и продолжительности воздействия, а также от возраста и ранее существовавшего состояния здоровья человека, подвергшегося воздействию.
Непосредственные признаки и симптомы воздействия брома
- Вдыхание газообразного брома может вызвать кашель, проблемы с дыханием, головную боль, раздражение слизистых оболочек (внутри рта, носа и т. д.), головокружение, или слезятся глаза.
- Попадание жидкого или газообразного брома на кожу может вызвать раздражение кожи и ожоги.
 Жидкий бром, попадая на кожу, может сначала вызвать ощущение охлаждения, за которым вскоре следует чувство жжения.
Жидкий бром, попадая на кожу, может сначала вызвать ощущение охлаждения, за которым вскоре следует чувство жжения. - Проглатывание бромсодержащих соединений (сочетаний брома с другими химическими веществами) может вызвать различные эффекты в зависимости от соединения. Проглатывание большого количества брома за короткий промежуток времени может вызвать такие симптомы, как тошнота и рвота (желудочно-кишечные симптомы).
- Наличие этих признаков и симптомов не обязательно означает, что человек подвергся воздействию брома.
Долгосрочные последствия воздействия брома на здоровье
- Выжившие после серьезного отравления, вызванного вдыханием (вдыханием) брома, могут иметь длительные проблемы с легкими.
- У людей, переживших серьезное отравление бромом, могут также наблюдаться долгосрочные последствия повреждений, вызванных так называемым системным отравлением, например поражением почек или головного мозга из-за низкого кровяного давления.

Как защитить себя и что делать при воздействии брома
- Во-первых, выйти на свежий воздух, покинув место выброса брома. Переезд в район со свежим воздухом — хороший способ снизить вероятность негативных последствий для здоровья от воздействия брома.
- Если выброс брома произошел на открытом воздухе, отойдите от места, где произошел выброс брома. Поднимитесь на максимально возможную высоту, потому что бром тяжелее воздуха и опустится в низменности.
- Если выброс брома произошел в помещении, выйдите из здания.
- Если вы находитесь вблизи места выброса брома, координаторы по чрезвычайным ситуациям могут попросить вас либо эвакуироваться (покинуть) район, либо «укрыться на месте» (оставаться на месте) внутри здания, чтобы избежать воздействия химиката. Для получения дополнительной информации об эвакуации во время химической аварийной ситуации см. «Факты об эвакуации». Для получения дополнительной информации об укрытии на месте во время химической чрезвычайной ситуации см.
 «Факты об укрытии на месте».
«Факты об укрытии на месте». - Если вы считаете, что могли подвергнуться воздействию брома, вам следует снять одежду, быстро вымыть все тело водой с мылом и как можно быстрее обратиться за медицинской помощью.
- Снятие одежды:
- Быстро снять одежду, на которой может быть бром. Любая одежда, которую нужно надевать через голову, должна быть срезана с тела, а не натянута через голову.
- Если вы помогаете другим людям снимать одежду, старайтесь не прикасаться к загрязненным участкам и снимайте одежду как можно быстрее.
- Мыться:
- Как можно быстрее смойте бром с кожи большим количеством воды с мылом. Мытье водой с мылом избавит вас и других людей от любых химических веществ на вашем теле.
- Если ваши глаза горят или ваше зрение затуманено, промывайте глаза простой водой в течение 10–15 минут. Если вы носите контактные линзы, снимите их и положите вместе с загрязненной одеждой.
 Не вставляйте контактные линзы обратно в глаза (даже если они не одноразовые). Если вы носите очки, промойте их водой с мылом. Вы можете снова надеть очки после того, как вымоете их.
Не вставляйте контактные линзы обратно в глаза (даже если они не одноразовые). Если вы носите очки, промойте их водой с мылом. Вы можете снова надеть очки после того, как вымоете их.
- Утилизация одежды:
- После того, как вы вымылись, положите одежду в полиэтиленовый пакет. Не прикасайтесь к загрязненным участкам одежды. Если вы не можете не прикасаться к загрязненным участкам или не знаете, где находятся загрязненные участки, наденьте резиновые перчатки или положите одежду в мешок с помощью щипцов, рукояток инструментов, палок или подобных предметов. Все, что касается загрязненной одежды, также должно быть помещено в пакет. Если вы носите контактные линзы, положите их тоже в полиэтиленовый пакет.
- Запечатайте пакет, а затем запечатайте этот пакет в другом пластиковом пакете. Утилизация одежды таким образом поможет защитить вас и других людей от любых химических веществ, которые могут быть на вашей одежде.
- Когда прибудут сотрудники местного или государственного департамента здравоохранения или службы экстренной помощи, сообщите им, что вы сделали со своей одеждой.
 Департамент здравоохранения или персонал службы экстренной помощи организуют дальнейшую утилизацию. Не занимайтесь пластиковыми пакетами самостоятельно.
Департамент здравоохранения или персонал службы экстренной помощи организуют дальнейшую утилизацию. Не занимайтесь пластиковыми пакетами самостоятельно. - Для получения дополнительной информации об очистке тела и утилизации одежды после выброса химикатов см. «Химические агенты: факты о личной чистке и утилизации загрязненной одежды».
- Если кто-то проглотил бром, не пытайтесь вызвать у него рвоту или давать пить.
- Немедленно обратитесь за медицинской помощью. Наберите 911 и объясните, что произошло
Как лечат отравление бромом
Отравление бромом лечат поддерживающей медицинской помощью (например, кислородом, введением жидкостей через иглу в вену) в условиях больницы. Специфического антидота при отравлении бромом не существует. (Противоядие — это лекарство, нейтрализующее действие яда.) Самое главное, чтобы люди удалились с места воздействия и как можно скорее обратились за медицинской помощью.
Как получить дополнительную информацию о броме
Вы можете связаться с одним из следующих:
- Региональный токсикологический центр: 1-800-222-1222
- Центры по контролю и профилактике заболеваний
- Горячая линия общественного реагирования (CDC)
- 800-CDC-INFO
- 888-232-6348 (TTY)
- Электронная почта: cdcinfo@cdc.
 gov
gov
- Горячая линия общественного реагирования (CDC)
- Центры по контролю и профилактике заболеваний (CDC), Национальный институт охраны труда и здоровья (NIOSH), Карманный справочник по химическим опасностям
Центры по контролю и профилактике заболеваний (CDC) защищают здоровье и безопасность людей, предотвращая и контролируя болезни и травмы; улучшает решения в области здравоохранения, предоставляя достоверную информацию о критических проблемах со здоровьем; и продвигает здоровый образ жизни посредством прочных партнерских отношений с местными, национальными и международными организациями.
неорганическая химия. Следует ли называть бромную воду раствором?
Согласно Goldbook IUPAC a решение это:
Жидкая или твердая фаза, содержащая более одного вещества, когда для удобства одно (или более) вещество, называемое растворителем, обрабатывается иначе, чем другие вещества, называемые растворенными веществами. Когда, как это часто бывает, но не обязательно, сумма мольных долей растворенных веществ мала по сравнению с единицей, раствор называется разбавленным.
Верхний индекс, прикрепленный к символу ∞ для свойства решения, обозначает свойство в пределе бесконечного разбавления.
Нет упоминания о том, что растворенное вещество может не реагировать с растворителем. Если вы исследуете несколько распространенных растворов, вы также обнаружите, что действительно довольно часто растворитель реагирует с раствором. Возьмем, к примеру, растворение гидрохлорида в воде, которое часто выражается следующим уравнением:
$$\ce{HCl (г) + h3O (ж) <=> Cl- (водн.) + h4O+ (водн.)}$$
Здесь видно, что протон переносится на молекулу воды и с одной точки зрения это реакция замещения; хлорид вытесняется водой.
Другим примером является растворение уксусной кислоты. Его часто описывают следующим уравнением:
$$\ce{h4C-COOH (т) + h3O (ж) <=> h4C-COO- (водн.) + h4O+ (водн.)}$$
То же самое происходит и здесь. Тот факт, что процесс растворения включает попадание растворителя в очень гибкую сеть водородных связей, мы скрываем в дополнении $\ce{(aq)}$.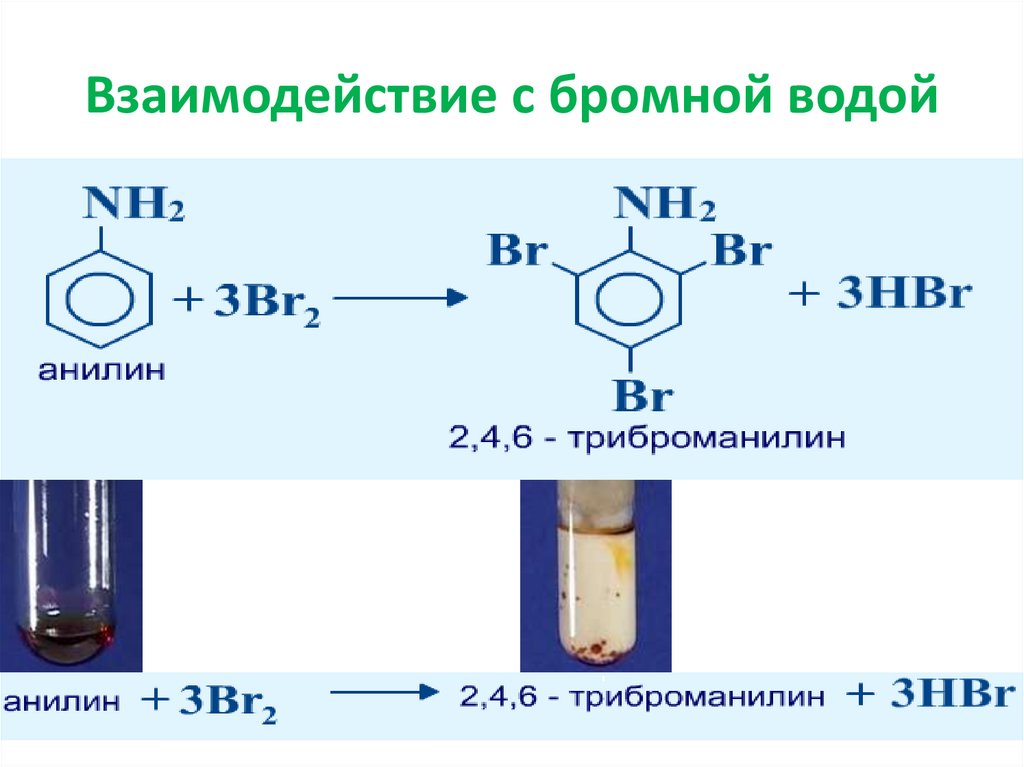
Когда вы смотрите на обычные соли, которые растворяются, часто бывает так, что ион металла реагирует как слабая кислота, совместно координируя молекулы растворителя. Во многих случаях это настолько гибко, как для щелочных металлов, что мы не можем приблизительно описать даже первую сольватную сферу. 92- (водн.)}.$$
На самом деле происходит химическая реакция. А поскольку все находится в равновесии, в растворах все время происходит множество химических реакций.
Теперь растворение брома в воде ничем не отличается. На самом деле диспропорция
$$\ce{Br2 (ж) + 2 h3O <=> BrOH (водн.) + Br- (водн.) + h4O+ (водн.)}$$
совершенно необходимо растворить бром в первую очередь. Хотя я даже немного не согласен с тем, что наличие диполя означает наличие полярной молекулы, я все же вижу, что молекула брома менее полярна, чем вода. Однако он довольно хорошо поляризуется; имеет квадрупольный момент. 9{-9} и 0,70, и 1,78, и 5,8, и 8,3, и 11,3\\
\end{array}$$
Заключение
Без химических реакций растворов не бывает.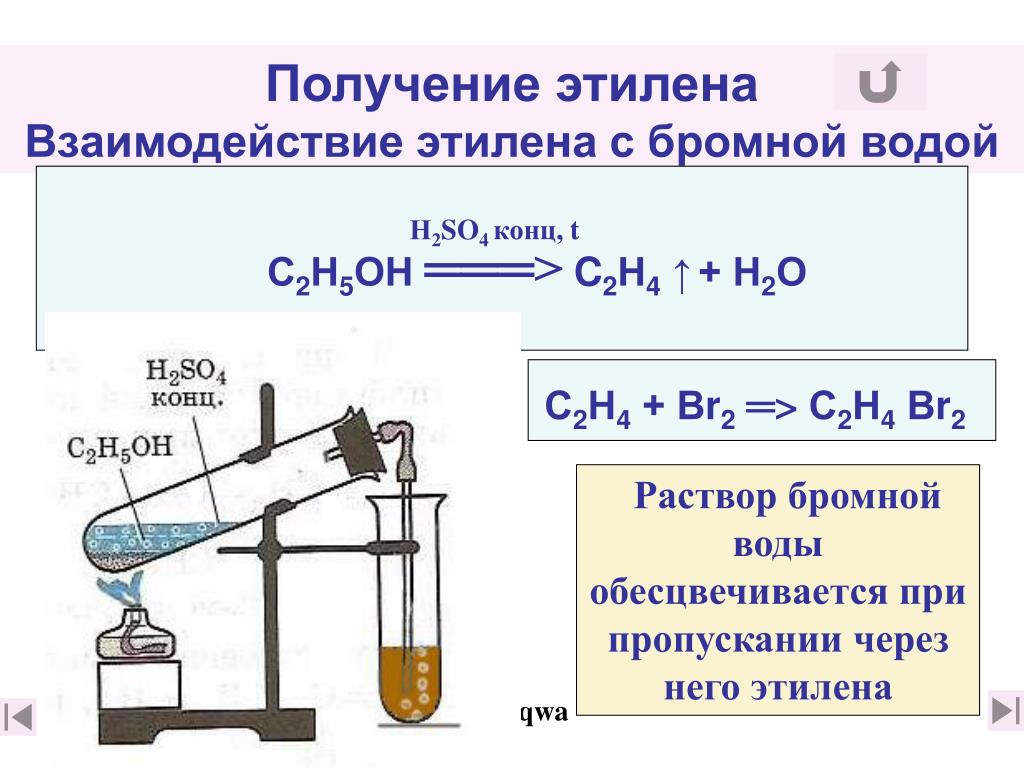





 Жидкий бром, попадая на кожу, может сначала вызвать ощущение охлаждения, за которым вскоре следует чувство жжения.
Жидкий бром, попадая на кожу, может сначала вызвать ощущение охлаждения, за которым вскоре следует чувство жжения.
 «Факты об укрытии на месте».
«Факты об укрытии на месте». Не вставляйте контактные линзы обратно в глаза (даже если они не одноразовые). Если вы носите очки, промойте их водой с мылом. Вы можете снова надеть очки после того, как вымоете их.
Не вставляйте контактные линзы обратно в глаза (даже если они не одноразовые). Если вы носите очки, промойте их водой с мылом. Вы можете снова надеть очки после того, как вымоете их. Департамент здравоохранения или персонал службы экстренной помощи организуют дальнейшую утилизацию. Не занимайтесь пластиковыми пакетами самостоятельно.
Департамент здравоохранения или персонал службы экстренной помощи организуют дальнейшую утилизацию. Не занимайтесь пластиковыми пакетами самостоятельно. gov
gov Верхний индекс, прикрепленный к символу ∞ для свойства решения, обозначает свойство в пределе бесконечного разбавления.
Верхний индекс, прикрепленный к символу ∞ для свойства решения, обозначает свойство в пределе бесконечного разбавления.