|
КАТЕГОРИИ: Археология
ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрации Техника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Балочные системы. Определение реакций опор и моментов защемления
|
⇐ ПредыдущаяСтр 15 из 20Следующая ⇒
Реактивы: 1) Анилин 2) Бромная вода, насыщенный раствор Оборудование: 1) Пробирка
ХОД ОПЫТА В пробирку помещают бромную воду и анилиновую воду. Выпадает белый осадок триброманилина. Написать уравнение реакции. Аминогруппа, как сильный окислитель 1 рода. Значительно повышает активность водородов бензольного ядра. Вместо анилина можно использовать соли анилина. Они бромируется также легко, как и сам анилин.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Анилин – сильный яд крови, способный проникать через кожу и дыхательные пути. Работу проводить в вытяжном шкафу. Соблюдать все меры предосторожности. Нитробензол – сильный яд для нервной системы.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ К ЛАБОРАТОРНОЙ РАБОТЕ № 14 ТЕМА 4.2 Углеводы, глюкоза, сахароза
ЦЕЛЬ РАБОТЫ: Исследование свойств глюкозы и сахарозы.
ОПЫТ № 1 Окисления глюкозы реактивом Фелинга
Реактивы: 1) Глюкоза, 0,5 % раствор 2) Реактив Фелинга Оборудование: 1) Пробирка 2) Спиртовка
ХОД ОПЫТА
В пробирку вносят раствор глюкозы и реактив Фелинга. Держа пробирку наклонно, осторожно нагревают верхнюю часть раствора на пламени спиртовки. При этом часть раствора окрашивается в оранжево – желтый цвет, вследствие образования гидроокиси меди (I) Сu (OH), которая в дальнейшем переходит в красный осадок окиси меди Сu2O. Реактивы Фелинга проводить окисление более удобно, чем гидроокисью меди Сu (OH)2, в присутствии щелочи, так как при добавлении большого количества сернокислой меди может произойти побочная реакция образования избытка гидроокиси меди Сu(OH)2 и частично окиси меди (II) Сu O черного цвета. Окисление реактивом Фелинга служит качественной реакцией на глюкозу.
ОПЫТ № 2 Окисление глюкозы аммиачным раствором окиси серебра реакцией «серебряного зеркала»
Реактивы: 1) Глюкоза, 0,5 % раствор 2) Азотнокислое серебро, 0,2 н. раствор 3) Аммиака 2 н. раствор 4) Едкий натр 2 н. раствор Оборудование: 1) Пробирка 2) Спиртовка
ХОД ОПЫТА
В пробирку помещают раствор азотнокислого серебра, раствор едкого натра и приливают по каплям раствор аммиака до растворения, образовавшегося осадка гидроокиси серебра. Затем добавляют раствор глюкозы и слегка подогревают содержимое пробирки на пламени спиртовки до начала почернения раствора. Дальше реакция идет без нагревания, и металлическое серебро выделяется на стенках пробирки в виде блестящего зеркального налета. Написать уравнения реакции. Подобно альдегидам моносахариды восстанавливаются аммиачный раствором окиси серебра с образованием осадка металлического серебра (серебряного зеркала). Эту реакцию дают как альдозы так и котозы. Окисление окиси серебра в щелочной среде служит качественной реакцией на моносахариды. Примечание: пробирку для опыта необходимо тщательно мыть (обезжирить), прокипятить ее со щелочью и промыть водой. Если стенки пробирки грязные, то металлическое серебро выделяется в виде черного осадка.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Аммиак – вызывает химический ожог кожи, глаз, слизистой оболочки желудка. Смыть обильной струей воды. Глаза промыть 2% раствором борной кислоты, закапать альбуцид. Желудок промыть водой.
ОПЫТ № 3 Осмоление глюкозы щелочью
Реактивы: 1) Глюкоза, 0,5 % раствор 2) Едкий натр, концентрированный раствор Оборудование: 1) Пробирка 2) Спиртовка
ХОД ОПЫТА
В пробирку помещают глюкозу, и добавляют раствор едкого натрия, нагревают смесь до кипения и осторожно кипятят смесь 2-3 минуты.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Едкий натр — вызывает сильный глубоко проникающий химический ожог кожи, сильный ожог глаз, возможно полная потери зрения. Сильный химический ожог слизистой желудка. Стряхнуть вещество, снять тампоном, смоченным растительным или минеральным маслом, интенсивно промыть пораженную кожу водой в течение 5 минут, промочить 2 % раствором уксусной кислоты и снова промыть чистой водой
⇐ Предыдущая10111213141516171819Следующая ⇒ Читайте также: Коммуникативные барьеры и пути их преодоления Рынок недвижимости. Решение задач с использованием генеалогического метода История происхождения и развития детской игры |
|
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 506; Нарушение авторского права страницы; Мы поможем в написании вашей работы!
infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь — 38.242.236.216 (0.004 с.)
|
Опыты по химии. Амины | Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Бромирование анилина
Аминогруппа влияет на свойства бензольного кольца. Она делает его более реакционноактивным. К насыщенному водному раствору анилина прильем бромную воду.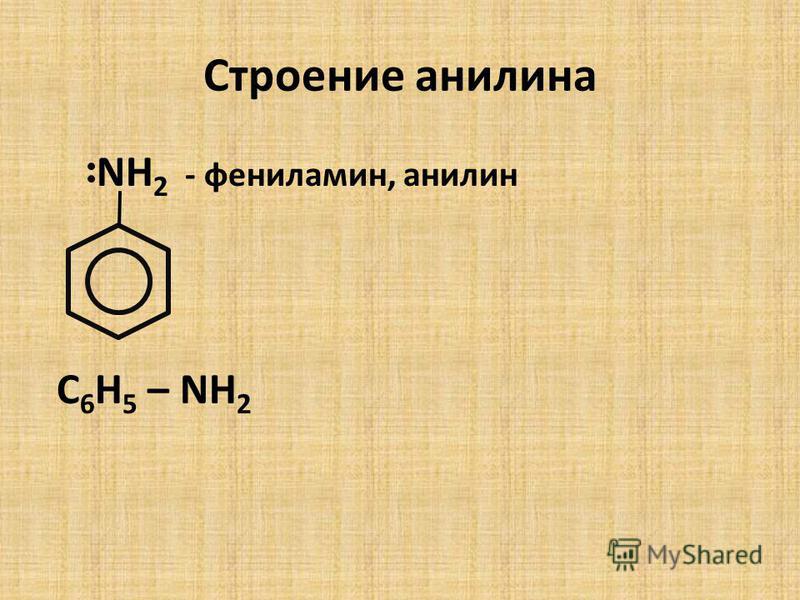 Раствор мутнеет. Выпадает белый осадок 2,4,6-триброманилина.
Раствор мутнеет. Выпадает белый осадок 2,4,6-триброманилина.
С6Н5NH2 + 3 Br2 = C6H2Br3 + 3HBr
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и бромом.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие анилина с соляной кислотой
Анилин – слабое основание. С сильными кислотами анилин способен образовывать соли. Приготовим смесь анилина с водой. Прибавим к смеси соляную кислоту. Происходит растворение анилина. В растворе образуется солянокислый анилин или хлорид фениламмония
Происходит растворение анилина. В растворе образуется солянокислый анилин или хлорид фениламмония
С6Н5NH2 + HCI = [C6H5NH3] CI
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение среды раствора анилина
Анилин мало растворим в воде. При 18 оС в 100 мл воды растворяется 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов. Возьмем пробу раствора анилина. Добавим в пробирку лакмус. Окраска индикатора не изменяется, это значит, что раствора анилина имеет нейтральную реакцию среды. Оборудование: пробирка, штатив для пробирок.
Возьмем пробу раствора анилина. Добавим в пробирку лакмус. Окраска индикатора не изменяется, это значит, что раствора анилина имеет нейтральную реакцию среды. Оборудование: пробирка, штатив для пробирок.
Оборудование: пробирка, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение физических свойств анилина
Анилин – бесцветная маслянистая жидкость. При хранении анилин постепенно окисляется и приобретает вначале желтую, затем бурую окраску. Изучим растворимость анилина в воде. Прибавим анилин к воде и перемешаем раствор. Анилин мало растворим в воде. При 18оС в 100 мл воды растворяется всего 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов.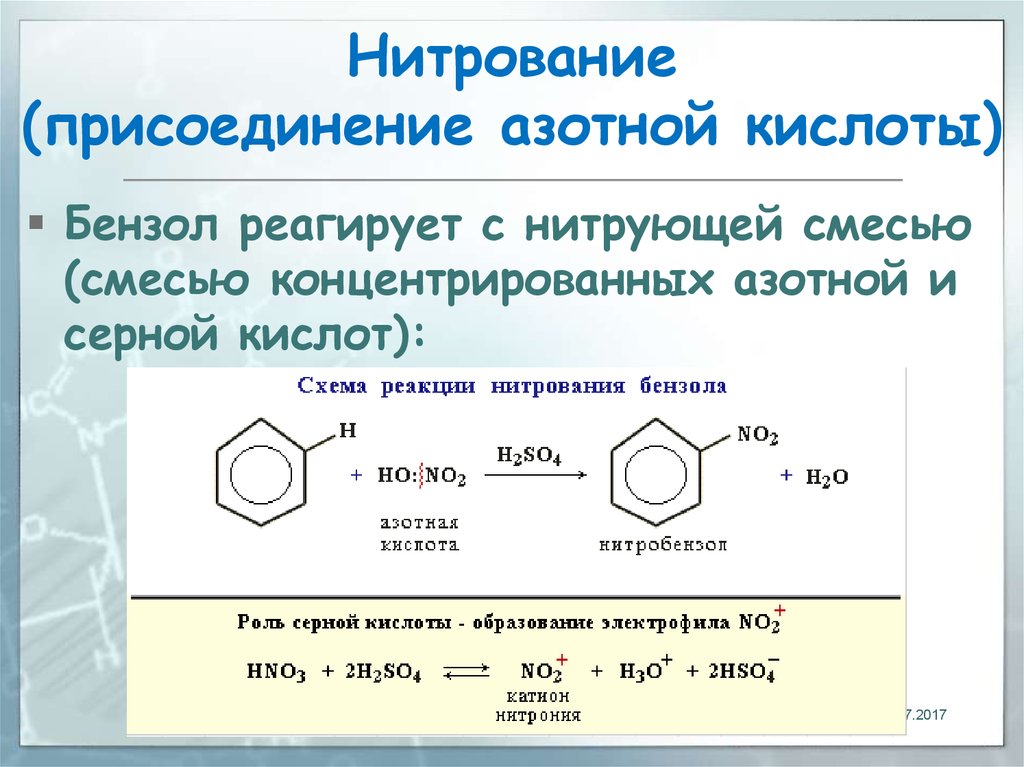
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественное определение азота в органических соединениях
Очень чувствительным методом определения азота в органических соединениях является сплавление вещества с металлическим натрием. Небольшую порцию анализируемого вещества сплавляем с кусочком металлического натрия. Важно, чтобы весь натрий прореагировал или окислился. Когда весь натрий прореагировал, охлаждаем пробирку, заливаем ее водой и кипятим. К полученному раствору добавляем крупинку сульфата железа (II) и вновь нагреваем. Затем добавляем соляную кислоту. Появление синего окрашивания свидетельствует о наличии азота в исследуемом органическом соединении. При сплавлении натрия с азотсодержащим веществом образуется цианид натрия. С солью двухвалентного железа цианид натрия образует гексацианоферрат (II) натрия. Так как сульфат железа (II) всегда содержит примесь железа (III), то с железом (III) гексацианоферрат натрия образует берлинскую лазурь. Появляется голубое окрашивание.
При сплавлении натрия с азотсодержащим веществом образуется цианид натрия. С солью двухвалентного железа цианид натрия образует гексацианоферрат (II) натрия. Так как сульфат железа (II) всегда содержит примесь железа (III), то с железом (III) гексацианоферрат натрия образует берлинскую лазурь. Появляется голубое окрашивание.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, стакан, фильтровальная бумага, скальпель, пинцет.
Техника безопасности. Соблюдать правила работы со щелочными металлами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление анилина раствором дихромата калия
Окисление анилина дихроматом калия позволяет получить важный промышленный краситель – черный анилин. К насыщенному раствору дихромата калия прибавим раствор серной кислоты и эмульсию анилина. Жидкость окрашивается в зеленый цвет, который постепенно переходит в черный. Образуется черный анилин — нерастворимый в воде краситель.
Жидкость окрашивается в зеленый цвет, который постепенно переходит в черный. Образуется черный анилин — нерастворимый в воде краситель.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами и кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление анилина раствором хлорной извести
Определить наличие анилина в растворе можно с помощью раствора хлорной извести. К сильно разбавленному раствору анилина добавим отфильтрованный раствор хлорной извести. Раствор становится синим. Реакция с хлорной известью – качественная реакция на анилин, она основана на легкой окисляемости анилина. Реакция очень чувствительна и позволяет определить даже следы анилина.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение гидроксида диметиламмония и изучение его свойств
Амины с водой образуют достаточно сильные основания. Приготовим раствор диметиламина в воде. Газ диметиламин хорошо растворяется в воде. При этом образуется гидроксид диметиламмония (гидрат диметиламина)
(СН3)2NH + H2O = [(СН3)2NH2]ОН
Пробу гидроксида диметиламмония (гидрата диметиламина) испытаем раствором фенолфталеина. Фенолфталеин приобретает малиновую окраску: среда раствора – щелочная. К следующей порции раствора прибавим раствор хлорида железа (III) – выпадает бурый осадок гидроксида железа.
К следующей порции раствора прибавим раствор хлорида железа (III) – выпадает бурый осадок гидроксида железа.
3[(СН3)2NH2]ОН + FeCI3 = Fe(OH)3 ↓+ 3[(СН3)2NH2]CI
Вносим палочку, смоченную концентрированной соляной кислотой, в выделяющийся газ диметиламин, образуется густой белый дым. Дым – кристаллы гидрохлорида диметиламина.
(СН3)2NH + HCI = [(СН3)2NH2] CI
Оборудование: пробирки, штатив для пробирок, горелка.
Техника безопасности. Соблюдать правила работы со щелочами, кислотами. Правила работы нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение диметиламина и его горение
Получим диметиламин действием гидроксида натрия на хлорид диметиламина. Смешаем в пробирке хлорид диметиламина со щелочью и прибавим воды. При легком нагревании выделяется газ диметиламин.
[(СН3)2NH2] CI + NaOH = (СН3)2NH + NaCI + H2O
При поджигании диметиламин сгорает с образованием углекислого газа, водяных паров и азота.
4(СН3)2NH +15 O2 = 8CO2 + 14H2O + 2N2
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, газоотводная трубка.
Техника безопасности. Соблюдать правила работы со щелочами и нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
5 способов научить студентов тесту на бром для ненасыщенных связей
Тест на бром — это качественный тест, который используется для определения того, имеет ли исследуемое вещество алкеновые или алкановые функциональные группы. В отсутствие света алкеновые группы соединяются с бромной водой, вызывая реакцию присоединения, в результате которой раствор теряет свою окраску. С другой стороны, алкан не реагирует с бромной водой, о чем свидетельствует тот факт, что окраска бромной воды не изменяется. Тест бромной воды чаще всего проводят на енолы, анилин, алкены, глюкозу, фенолы и химические вещества ацетильной группы. Кроме того, тест может определить, содержит ли рассматриваемое вещество альдегидную группу.
Тест бромной воды чаще всего проводят на енолы, анилин, алкены, глюкозу, фенолы и химические вещества ацетильной группы. Кроме того, тест может определить, содержит ли рассматриваемое вещество альдегидную группу.
Вода, содержащая бром, из желтоватого становится полностью бесцветной по ходу процесса. Бромный тест используется для определения того, является ли углерод-углеродная связь ненасыщенной, например, в случае алкена или алкина. В тесте используется реакция присоединения, которая является своего рода химической реакцией. В этой реакции реагент, в данном случае бром, вводится в органическое соединение для разрыва двойной или тройной связи. Одним из таких может быть введение брома в бут-2-ен:
Когда бром растворяется в воде, он приобретает оттенок между оранжевым и коричневым. Из-за этого цвет раствора меняется, когда присутствует алкен или алкин, с которыми бром реагирует. Поскольку алканы имеют только одинарную связь, бром не может с ними взаимодействовать; в результате при комбинировании этих двух типов соединений цвет не меняется. Однако бром будет реагировать с ароматическими соединениями, такими как фенол. В присутствии катализаторов бензол способен реагировать с бромом; однако это невозможно в отсутствие катализатора, поскольку бензол недостаточно реакционноспособен. Поскольку фенол гораздо более реакционноспособен, чем бензол, он способен реагировать с бромом даже в отсутствие катализатора. Из-за этого электронная плотность делокализованного бензольного кольца увеличивается за счет вклада спиртовой группы.
Однако бром будет реагировать с ароматическими соединениями, такими как фенол. В присутствии катализаторов бензол способен реагировать с бромом; однако это невозможно в отсутствие катализатора, поскольку бензол недостаточно реакционноспособен. Поскольку фенол гораздо более реакционноспособен, чем бензол, он способен реагировать с бромом даже в отсутствие катализатора. Из-за этого электронная плотность делокализованного бензольного кольца увеличивается за счет вклада спиртовой группы.
Материалы
Предупреждения и меры предосторожности
Элемент бром является едким, ядовитым и опасным для окружающей среды. Ожоги могут возникать в пищеварительном тракте, дыхательных путях, глазах и коже, когда присутствует бром. Поскольку это мощный окислитель и потенциально смертельный при вдыхании, избегайте этого. Если этот материал вступит в контакт с другими веществами, может начаться пожар. Разъедает металл. Четыреххлористый углерод является канцерогенным веществом. Химический хлороформ опасен. Рекомендуется проводить это испытание при комнатной температуре.
Химический хлороформ опасен. Рекомендуется проводить это испытание при комнатной температуре.
Процедура
В 2 мл четыреххлористого углерода растворяют 0,1 г органической молекулы, что эквивалентно 5 каплям. Если у вас нет доступа к четыреххлористому углероду, вы можете растворить органический химикат хлороформом или водой, которые также являются примерами растворителей.
По каплям при постоянном встряхивании добавить водный раствор брома с концентрацией 2%.
Если бромный раствор теряет окраску, это свидетельствует о наличии в органическом компоненте ненасыщенной углерод-углеродной связи. Для проверки результатов этого теста следует использовать тест Байера.
Почему тест на бром сложен для учащихся?
1. Непонимание основной идеи
Это одна из основных причин непонимания подавляющим большинством учащихся того, как проводится тест Бомина и другие биохимические тесты на загрязнение продуктов питания углеводородами. Студенты сообщают, что тест становится менее рациональным и более теоретическим, когда основная идея не объясняется должным образом. Учащиеся младшего возраста должны иметь всестороннее понимание как «почему» (причина выполнения теста), так и «как» (основной принцип теста) каждого теста, который проводится для отдельной макромолекулы.
Студенты сообщают, что тест становится менее рациональным и более теоретическим, когда основная идея не объясняется должным образом. Учащиеся младшего возраста должны иметь всестороннее понимание как «почему» (причина выполнения теста), так и «как» (основной принцип теста) каждого теста, который проводится для отдельной макромолекулы.
2. Отсутствуют основные понятия биохимии
Возможно, вам следует пересмотреть вопрос о включении урока по тесту на бром в следующее занятие. Многие студенты не знают о принципиальных различиях между такими темами, как «углеводы и сахара», «основная химия бромной воды», «углеводы и углеводороды», «различие типов углеводородов», «природа молекулярного брома» и т. д. Прежде чем перейти к более продвинутым областям, таким как биохимическое тестирование и реагенты, используемые для различных тестов, необходимо иметь фундаментальное представление об углеводах, включая их структуру, связанные с ними связи и так далее.
3. Неосведомленность о его значимости в повседневной жизни
Когда учащиеся не могут представить себя проводящими исследования, работающими в промышленности или управляющими собственным бизнесом, используя полученные знания, сдача теста по биохимии кажется бессмысленной. . Студентам часто проводят тест на бром, не будучи проинформированы о фактическом применении этого метода. В результате процесс обучения становится неинтересным и неблагоприятным.
. Студентам часто проводят тест на бром, не будучи проинформированы о фактическом применении этого метода. В результате процесс обучения становится неинтересным и неблагоприятным.
Пять способов преподавания студентам теста на бром для ненасыщенных связей
1. Основная концепция углеводородов
Дайте учащимся представление об углеводородах. Любые органические химические соединения класса углеводородов включают только атомы углерода (С) и водорода (Н). Атомы водорода связываются с атомами углерода различными способами, создавая структурную основу соединения. Основными компонентами природного газа и нефти являются углеводороды. Они используются в качестве топлива, смазочных материалов и сырья для производства промышленных химикатов, каучука, полимеров, волокон, растворителей и взрывчатых веществ. В природе много углеводородов. Помимо того, что они являются компонентом ископаемого топлива, они также встречаются в деревьях и растениях, таких как морковь и зеленые листья, где их можно найти в качестве каротиноидных пигментов. Виды химических связей, которые удерживают вместе атомы молекул, составляющих углеводород, играют важную роль в определении его структуры и химического состава.
Виды химических связей, которые удерживают вместе атомы молекул, составляющих углеводород, играют важную роль в определении его структуры и химического состава.
2. Существуют ли различные типы углеводородов?
Дайте учащимся представление об истории классификации углеводородов. По своему происхождению и характеристикам углеводороды были классифицированы химиками девятнадцатого века как алифатические или ароматические.
При химическом разложении масел или жиров образуются алифатические углеводороды, название которых происходит от греческого слова «алейфар», обозначающего жир. Алканы, алкены и алкины — это три категории.
Алкины обладают тройной углерод-углеродной связью, алкены — двойной углерод-углеродной связью, а алканы имеют только одинарную связь.
Ряд подобных соединений, известных как ароматические углеводороды, получают химическим путем при расщеплении некоторых экстрактов ароматных растений. Их можно разделить на арены, имеющие в качестве структурного компонента бензольное кольцо, и небензоидные ароматические углеводороды, более стабильные, чем арены, но не имеющие бензольного кольца.
3.
Покажите им, как подходить с научной точки зрения
Один из многих различных биохимических тестов, которые используются в академических исследованиях, а также в процессах НИОКР различных корпораций, известен как бромный тест. Если вы научите своих учеников подходить к проблеме с научной точки зрения, им будет легче рассуждать об обстоятельствах, в которых следует и не следует использовать тест на бром. Благодаря этому они смогут лучше распознавать применение стратегий в практических ситуациях. Кроме того, это повысит их уверенность в себе в применении теоретических концепций к реальным ситуациям.
4. Подробно продемонстрируйте метод.
Учащиеся, участвующие в практических занятиях с использованием лабораторных методов, с большей вероятностью вспомнят содержание уроков, а также особенности этих уроков. Мы знаем, что преподавателям не всегда практично проводить отдельные практические занятия для каждого эксперимента, и мы уважаем это ограничение. Если это так, одна из наших рекомендаций — как минимум провести демонстрацию эксперимента. Студенты могут найти тест на бром довольно интересным, когда они видят изменение цвета перед своими глазами, потому что тест зависит от хромогенного изменения, что означает изменение цвета. Кроме того, если вы хотите привлечь к эксперименту больше студентов, вы можете попросить их принести из дома ряд продуктов, которые, по их мнению, содержат много ненасыщенных углеводов, чтобы вы могли включить их в эксперимент. Это позволит вам проверить гипотезы учащихся.
Если это так, одна из наших рекомендаций — как минимум провести демонстрацию эксперимента. Студенты могут найти тест на бром довольно интересным, когда они видят изменение цвета перед своими глазами, потому что тест зависит от хромогенного изменения, что означает изменение цвета. Кроме того, если вы хотите привлечь к эксперименту больше студентов, вы можете попросить их принести из дома ряд продуктов, которые, по их мнению, содержат много ненасыщенных углеводов, чтобы вы могли включить их в эксперимент. Это позволит вам проверить гипотезы учащихся.
5. Использование моделирования виртуальной лаборатории
В Labster знают о трудностях, с которыми сталкиваются учителя и ученики. Поэтому мы предлагаем современным педагогам возможность использовать симуляцию теста на бром от Labster в полной мере. Он переносит ваших учеников в виртуальную среду, где они могут увидеть, как бром реагирует с ненасыщенными связями.
Они изучат процесс на молекулярном уровне под микроскопом. Проверьте свои способности в экспериментальном режиме и помогите химикам найти жидкости с неправильной маркировкой. Вашим детям больше не придется бороться, потому что вам на помощь придет наше интерактивное игровое моделирование теста на бром (https://www.labster.com/simulations/bromine-test-for-unsaturated-bonds/). Наша виртуальная учебная платформа использует этот метод интерактивного, иммерсивного обучения, чтобы подробно познакомить будущих ученых с «основами их конкретных областей».
Проверьте свои способности в экспериментальном режиме и помогите химикам найти жидкости с неправильной маркировкой. Вашим детям больше не придется бороться, потому что вам на помощь придет наше интерактивное игровое моделирование теста на бром (https://www.labster.com/simulations/bromine-test-for-unsaturated-bonds/). Наша виртуальная учебная платформа использует этот метод интерактивного, иммерсивного обучения, чтобы подробно познакомить будущих ученых с «основами их конкретных областей».
Ссылки
https://byjus.com/jee/bromine-water-test/
https://www.britannica.com/summary/hydrocarbon
Радиоактивность1
Теория реакции для оценки анилина C
6 H 5 NH 2
Анилин реагирует с бромом с образованием триброманилина, который можно представить с помощью следующего уравнения
C 6 NH
H 0115 2 + 3BR 2 → C 6 H 2 NH 2 BR 3 + 3HBR
Эквивалентная масса анилина является молярной массой/6 = 15,5 Грамовые эквиваленты
. Фактическая Реаг. Реагирование используется для реакции. Для реакции используется реакция. Для реакции используется реакция. Реактивная. Для реакции. это не раствор брома, а бром выделяется в результате окислительно-восстановительной реакции. Бромат калия при обработке бромидом калия в присутствии HCl высвобождает Br 2 . Высвобожденный бром используется в титровании
Фактическая Реаг. Реагирование используется для реакции. Для реакции используется реакция. Для реакции используется реакция. Реактивная. Для реакции. это не раствор брома, а бром выделяется в результате окислительно-восстановительной реакции. Бромат калия при обработке бромидом калия в присутствии HCl высвобождает Br 2 . Высвобожденный бром используется в титровании
KBrO 3 + 5 KBr + 6 HCl → 6KCl + 3Br 2 + 3H 2 O
Требуемые реагенты
- Раствор тиосульфата натрия ориентировочная концентрация = 0,1N
- Бромирующая смесь KBrO 3 /KBr ориентировочная концентрация = 0,1N
- Раствор йодида калия 10 %
- Раствор крахмала
Этот эксперимент состоит из двух частей
- Сначала определите концентрацию тиосульфата натрия – Стандартизация
- Вторично оценить раствор Анилина
Стандартизация Na
2 S 2 O 3 – Тиосульфат натрия
Массу 1,25 г дихромата калия помещают в стандартную колбу на 250 мл. Сначала растворите твердое вещество, используя минимальное количество воды, когда все кристаллы растворятся, добавьте еще воды до градуированной отметки в колбе. Смешайте раствор, чтобы сделать его однородным, прежде чем эксперимент будет сделан.
Сначала растворите твердое вещество, используя минимальное количество воды, когда все кристаллы растворятся, добавьте еще воды до градуированной отметки в колбе. Смешайте раствор, чтобы сделать его однородным, прежде чем эксперимент будет сделан.
10 мл этого раствора переносят пипеткой в колбу Эрленмейера-Мейера, добавляют около 3 мл концентрированной HCl (1M), а затем 5 мл 10 % раствора KI.
Выделившийся бром титруют раствором тиосульфата натрия, взятым в бюретку. Когда раствор станет бледно-желтым, добавьте раствор крахмала, титрование проводят до получения конкордантных значений. (Альтернативные методы)
Оценка содержания анилина
Если вам дают раствор анилина, его следует сначала разбавить соответствующим образом. 20 мл этого анилинового раствора и примерно 40 мл бромирующей смеси пипеткой переносят в закрытую колбу Эрленмейера на 250 мл (коническая колба) и разбавляют примерно 20 мл воды и 5 мл концентрированной HCl (можно использовать от 1М до 3М). После закрытия колбы Эрленмейера тщательно перемешивайте смесь в течение следующих 30 минут. Охладите содержимое колбы и осторожно откройте колбу, не теряя выделившегося брома (используйте колбу Эрленмейера со стеклянной пробкой, налейте немного 10 % KI вокруг пробки, а затем осторожно откройте ее, чтобы не потерять выделившийся бром, KI отсасывают в колбу) и добавляют 20 мл 10% раствора KI. Закройте колбу и встряхивайте ее в течение 25 секунд, дайте смеси постоять 10 минут.
Охладите содержимое колбы и осторожно откройте колбу, не теряя выделившегося брома (используйте колбу Эрленмейера со стеклянной пробкой, налейте немного 10 % KI вокруг пробки, а затем осторожно откройте ее, чтобы не потерять выделившийся бром, KI отсасывают в колбу) и добавляют 20 мл 10% раствора KI. Закройте колбу и встряхивайте ее в течение 25 секунд, дайте смеси постоять 10 минут.
Снимите пробку, промойте содержимое небольшим количеством дистиллированной воды и оттитруйте свободный йод тиосульфатом натрия, используя крахмал в качестве индикатора. Когда цвет раствора станет бледно-желтым, добавить 1 мл уже приготовленного свежего раствора крахмала.
Осторожно и медленно титруйте раствор, пока не исчезнет синяя окраска крахмально-йодного комплекса. Объем израсходованного тиосульфата натрия равен высвободившемуся избытку брома (поэтому следует соблюдать осторожность, чтобы не потерять бром перед добавлением KI)
Проведите контрольное титрование, используя 20 мл бромирующей смеси и воды, используя ту же процедуру.

 Работу проводить в вытяжном шкафу. Соблюдать все меры предосторожности.
Работу проводить в вытяжном шкафу. Соблюдать все меры предосторожности. При окислении реактивом Фелинга сегнетовая соль связывает избыток гидроокиси меди (II) Сu (OH)2, и основная реакция окисления глюкозы протекает быстрее и более четко.
При окислении реактивом Фелинга сегнетовая соль связывает избыток гидроокиси меди (II) Сu (OH)2, и основная реакция окисления глюкозы протекает быстрее и более четко.
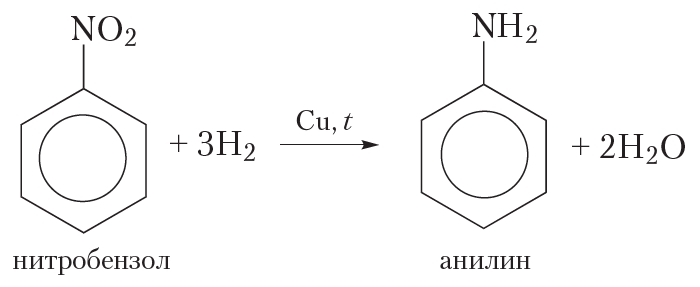 Раствор при этом желтеет, а затем становится коричневым. При нагревании со щелочью моносахариды подобно альдегидам, осмоляются и буреют, подвергаясь при этом расщеплению и отчасти окислению. Процесс осмоления ведет к образованию сложной смеси веществ. Продукты осмоления содержит несколько свободных гидроксильных групп и поэтому в отличии от альдегидной смолы хорошо растворимы в воде.
Раствор при этом желтеет, а затем становится коричневым. При нагревании со щелочью моносахариды подобно альдегидам, осмоляются и буреют, подвергаясь при этом расщеплению и отчасти окислению. Процесс осмоления ведет к образованию сложной смеси веществ. Продукты осмоления содержит несколько свободных гидроксильных групп и поэтому в отличии от альдегидной смолы хорошо растворимы в воде.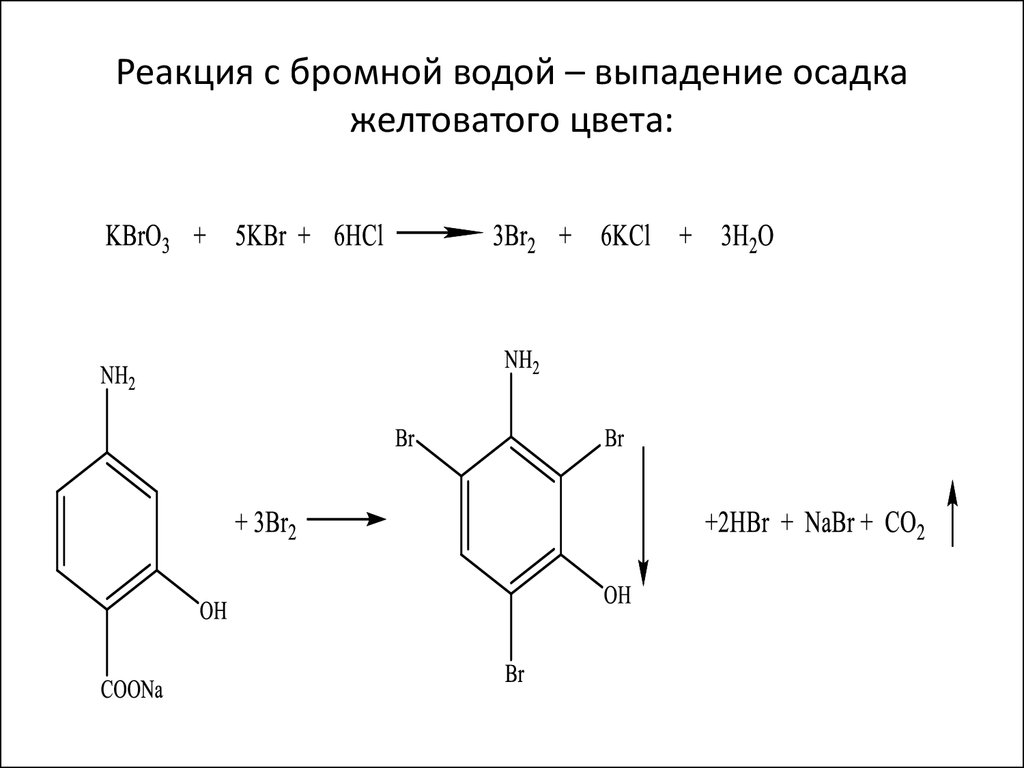 Сущность недвижимости
Сущность недвижимости