КАЧЕСТВЕННЫЕ РЕАКЦИИ ОРГАНИЧЕСКИХ ВЕЩЕСТВ Москва-2008 ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Вот поэтому алканы и не реагируют при обычных условиях с такими активными веществами, как серная и азотная кислоты, металлический натрий, перманганат калия. В реакции с бромной водой и перманганатом калия алканы не вступают. АЛКЕНЫ (ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ, ОЛЕФИНЫ)
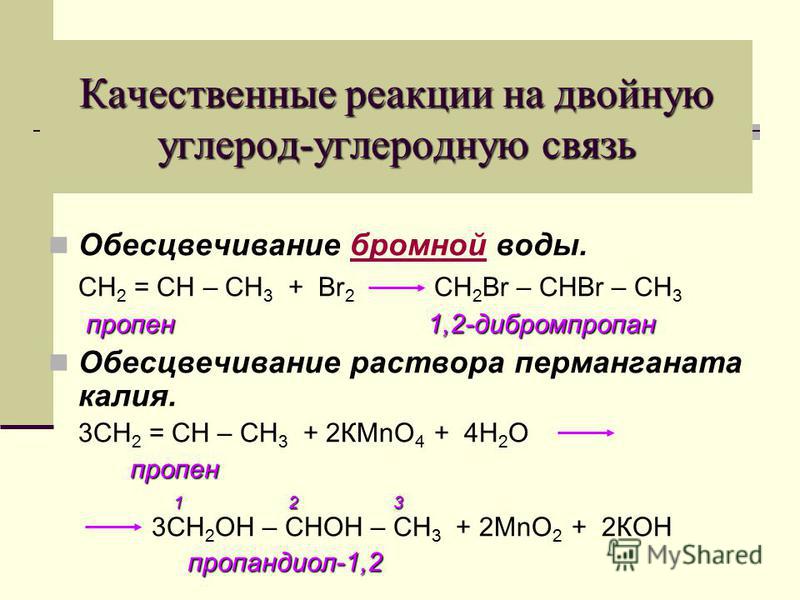
Благодаря присутствию двойной связи алкены гораздо более химически активны, чем алканы. Основные типы химических реакций алканов — это присоединение, окисление и полимеризация. Алкены легко присоединяют бром; например, пропилен превращается в 1,2-дибромпропан: Для реакции можно использовать бромную воду – раствор брома в воде. Кроме того, алкены окисляются перманганатом калия KMnO4, причем если реакцию проводят в присутствии серной кислоты, то раствор перманганата обесцвечивается. Если реакцию проводить в нейтральной среде, выпадает коричневый осадок MnO2: Фиолетовая окраска KMnO4 в ходе реакции исчезает. Органический продукт реакции – двухатомный спирт пропандиол-1,2. АЛКИНЫ (АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ)
Как и алкены, алкины склонны к реакциям присоединения, окисления и полимеризации. Следовательно, реакции с бромной водой и раствором перманганата калия являются качественными реакциями на алкины. Отличить ацетиленовый углеводород от этиленового позволяет реакция с аммиачным раствором оксида серебра: Образующийся ацетиленид серебра дает осадок бледно-желтого цвета. ПЕРЕД ВЫПОЛНЕНИЕМ ЛАБОРАТОРНОЙ РАБОТЫ прочитайте вопросы, набранные курсивом в экспериментальной части лабораторной работы. Подумайте, на какие из них вы можете ответить до ее выполнения? Попробуйте составить уравнения реакций, которые вы будете выполнять. Постарайтесь ответить на вопросы для обсуждения на семинаре (они даны в конце пособия). При подготовке ответов на вопросы пользуйтесь материалами школьного учебника и электронного учебника по органической химии WWW.chemistry.ssu.samara.ru ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Записать наблюдения вам помогут эти вопросы! Смешиваются ли вода и гексан? Какой слой – верхний или нижний – является органическим, а какой водным? Как это проверить? Какой вывод о соотношении плотностей воды и гексана можно сделать, основываясь на результатах опыта? Наблюдения записывайте здесь: 1.2 Взаимодействие гексана с бромной водой и раствором перманганата калия. В одну из пробирок налейте примерно 1-2 мл (столбик высотой 1-1,5 см) раствора перманганата калия, в другую пробирку – такое же количество бромной воды. В каждую из пробирок добавьте по 1-2 мл гексана. Встряхните пробирки. Дайте жидкостям отстояться. Запишите наблюдаемые явления и выводы. Обесцвечивается ли раствор перманганата калия под действием гексана? Обесцвечивается ли бромная вода под действием гексана? Как меняется окраска гексана после встряхивания с бромной водой? В чем причина изменения окраски? Наблюдения и ответы на вопросы записывайте здесь: Опыт 2. В каждую из пробирок добавьте по 1-2 мл гексена. Встряхните пробирки. Дайте жидкостям отстояться. Запишите наблюдаемые явления и выводы. Какое изменение окраски наблюдается в каждой из пробирок? В какой из пробирок выпадает ли осадок, какого цвета? Объясните наблюдаемые явления. Запишите уравнения протекающих реакций. 2.2 Получение этилена и качественные реакции на двойную связь. Приготовьте пробирки или стаканчики с бромной водой и подкисленным раствором перманганата калия (к раствору перманганата калия добавьте немного раствора серной кислоты). Соберите прибор, состоящий из колбы Вюрца с пробкой и газоотводной трубкой. В пробирку или колбу Вюрца налейте 10 мл этанола и 10 мл серной кислоты. В пробирку добавьте стеклянные капилляры или битый фарфор для равномерного кипения. Запишите уравнение реакции получения этилена из этилового спирта. Запишите уравнения реакций взаимодействия этилена с бромной водой и раствором перманганата калия. Какое изменение окраски наблюдается в каждом случае?. Опыт 3. СВОЙСТВА АЛКИНОВ В колбу с боковым отводом (колбу Вюрца) положите кусочек карбида кальция, налейте 15-20 мл воды и закройте колбу пробкой. Газоотводную трубку прибора последовательно опускайте в стаканчики или пробирки с раствором перманганата калия и с бромной водой (по 3-5 мл) и продолжайте пропускать ацетилен через растворы до изменения окраски. . Какое изменение окраски наблюдается в каждой пробирке? Запишите уравнение реакции получения ацетилена из карбида кальция и уравнение реакции взаимодействия ацетилена с бромной водой. 3.2 Взаимодействие ацетилена с аммиачным раствором оксида серебра. В пробирку налейте небольшое количество (около 5 мл) свежеприготовленного аммиачного раствора оксида серебра. В пробирку пропускайте ацетилен и наблюдайте происходящие с раствором изменения. Что вы наблюдали при пропускании ацетилена через аммиачный раствор оксида серебра? Напишите уравнение протекающей реакции. Опыт 4. СВОЙСТВА АРЕНОВ В каждую из пробирок добавьте по 1-2 мл бензола. Встряхните пробирки. Дайте жидкостям отстояться. Запишите наблюдаемые явления и выводы. Обесцвечивается ли раствор перманганата калия под действием бензола? Обесцвечивается ли бромная вода под действием бензола? Как можно объяснить устойчивость бензола к действию перманганата калия и бромной воды? 4. В каждую из пробирок добавьте по 1-2 мл толуола. Встряхните пробирки. Дайте жидкостям отстояться. Запишите наблюдаемые явления и выводы. Обесцвечивается ли раствор перманганата калия под действием толуола? Обесцвечивается ли бромная вода под действием толуола? Запишите уравнение реакции, объясняющей наблюдаемые явления. ВОПРОСЫ ДЛЯ ОБСУЖДЕНИЯ НА СЕМИНАРЕ
После выполнения работы и подготовки отчета выполните итоговый тест. Личные данные и ответы на вопросы теста внесите в таблицу 1. Отчет и результаты теста вышлите преподавателю для проверки по адресу SVLADLEN@RAMBLER.RU ИТОГОВЫЙ ТЕСТ 1) синяя 3) зеленая 2) бурая 4) фиолетовая 1) раствориться в ней 2) всплывет на поверхность 3) опустится на дно 4) взорвется 1) алкан 2) алкен 3) арен 4) алкадиен 1) этилен 2) ацетилен 3) этан 3) гексан 1) с перманганатом калия 2) с бромной водой 3) с аммиачным раствором оксида серебра 4) с лакмусом Фамилия: Имя: Отчество: Школа: Класс: Таблица 1. Личные данные и результаты тестирования абитуриента МИСиС
Каталог: Portals жүктеу/скачать 0. Достарыңызбен бөлісу: | |||||||||||||||||||||||||||||||||||||||||||||||
Насыщенная бромная вода — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Насыщенная бромная вода поглощает также ацетилен. В то же время слабые растворы бромной воды почти не поглощают ацетилена, так как реакция идет крайне медленно.
[1]
Насыщенная бромная вода, дистиллированную воду насыщают бромом.
[2]
Насыщенная бромная вода, дистиллированную воду насыщают бромом.
[3]
| Система бром-вода.
[4] |
Насыщенная бромная вода кипит при 53 601 ( 748 8 мм рт. ст.), при этой температуре в ней содержится 3 50 % брома; в парах содержится 98 8 % брома.
[5]
Насыщенную бромную воду получают продол — Хоггельным взбалтыванием брома с водой.
[6]
Насыщенную бромную воду получают продолжительным взбалтыванием брома с водой.
[7]
Добавляют насыщенную бромную воду до тех пор, пока раствор при перемешивании не останется желтым. Затем раствор кипятят до исчезновения желтой окраски и еще 2 мин после этого. Охлаждают, отмывают стенки колбы водой, добавляют 2 мл 10 % — ного раствора KI и титруют свободный иод 0 02 М стандартным раствором тиосульфата из бюретки емкостью 10 мл, добавляя в качестве индикатора крахмал.
[8]
Для получения насыщенной бромной воды в склянке с притертой пробкой сильно встряхивают 5 г брома с 100 мл воды, изредка приоткрывая пробку, чтобы дать выход скопившимся парам брома.
[9]
Для получения насыщенной бромной воды в склянке с притертой пробкой сильно встряхивают 5 г брома с 100 мл воды, изредка приоткрывая пробку, чтобы дать выход скопившимся парам брома.
[10]
Работу с насыщенной бромной водой обязательно проводить под тягой.
[11]
Прибавив 2 мл насыщенной бромной воды, дают стоять 5 мин.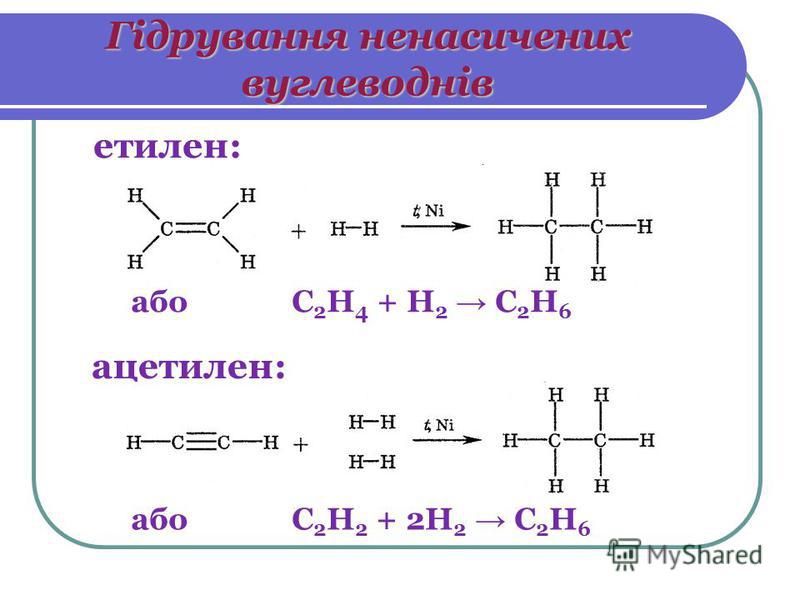 Вливают 10 мл 25 % — ного раствора ( МН СОз, 2 мл 25 % — ного цитрата аммония, дают остыть. Прибавляют по каплям, перемешивая, 8 мл 25 % — ного раствора NaOH; устанавливают рН 4 5 Jh 0 5 с помощью того же раствора NaOH. В один стакан прибавляют 2 мл 1 % — ного спиртового раствора диметилглиоксима, второй оставляют без реактива для сравнения. Оба раствора разбавляют точно до 50 мл, дают стоять 30 мин.
Вливают 10 мл 25 % — ного раствора ( МН СОз, 2 мл 25 % — ного цитрата аммония, дают остыть. Прибавляют по каплям, перемешивая, 8 мл 25 % — ного раствора NaOH; устанавливают рН 4 5 Jh 0 5 с помощью того же раствора NaOH. В один стакан прибавляют 2 мл 1 % — ного спиртового раствора диметилглиоксима, второй оставляют без реактива для сравнения. Оба раствора разбавляют точно до 50 мл, дают стоять 30 мин.
[12]
Добавьте 5 капель насыщенной бромной воды для окисления железа и кипятите раствор 5 мин, чтобы удалить избыток брома.
[13]
К 100 мл насыщенной бромной воды прибавляют 35 мл 8 % — ного раствора гидроокиси натрия и перемешивают. Раствор сохраняют в холодильнике при 5 С. Концентрацию раствора устанавливают титрованием тиосульфатом.
[14]
Добавляют 5 капель свежеприготовленной насыщенной бромной воды, смешивают и затем добавляют по каплям при встряхивании концентрированный раствор аммиака до исчезновения окраски брома; в заключение добавляют еще 3 — 4 капли избытка аммиака.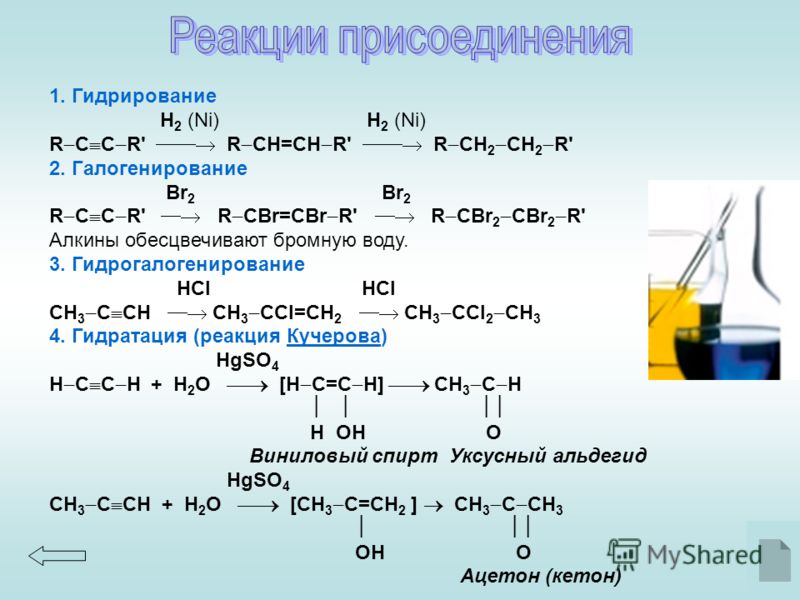 Затем прибавляют 0 5 мл 1-процентного спиртового раствора диметилглиоксима, смешивают и, если пользуются мерной колбой, разбавляют до метки водой. Интенсивность окраски раствора постепенно усиливается при стоянии; поэтому исследуемый и эталонный растворы должны обрабатываться реактивом одновременно.
Затем прибавляют 0 5 мл 1-процентного спиртового раствора диметилглиоксима, смешивают и, если пользуются мерной колбой, разбавляют до метки водой. Интенсивность окраски раствора постепенно усиливается при стоянии; поэтому исследуемый и эталонный растворы должны обрабатываться реактивом одновременно.
[15]
Страницы:
1
2
3
Вопрос Видео: Идентификация продукта галогенирования этина бромной водой
Стенограмма видео
Во время галогенирования этина газообразный этин пропускают через бромную воду, растворенную в четыреххлористом углероде. Оранжевая окраска брома теряется по мере протекания реакции присоединения. Что является конечным продуктом этой реакции?
Для ответа на этот вопрос необходимо определить продукт галогенирования этина с использованием бромной воды, растворенной в четыреххлористом углероде. Происходящая реакция является реакцией присоединения. Реакция присоединения — это тип химической реакции, при которой одна или несколько молекул объединяются в одну большую молекулу без образования побочных продуктов. Галогенирование представляет собой особый тип реакции присоединения, который включает присоединение одного или нескольких галогенов.
Галогенирование представляет собой особый тип реакции присоединения, который включает присоединение одного или нескольких галогенов.
В вопросе упоминаются два галогена. Бромная вода состоит из двухатомного брома, растворенного в воде. А четыреххлористый углерод – бесцветная жидкость. Глядя на варианты ответов, мы видим, что все структуры содержат атомы брома, но ни одна из структур не содержит атомов хлора. Таким образом, это галогенирование включает добавление атомов брома. Таким образом, мы можем сделать вывод, что двухатомный бром является реагентом, а четыреххлористый углерод является нереакционноспособным растворителем.
Теперь, когда мы можем признать, что двухатомный бром является реагентом, и атомы брома будут добавляться во время этой реакции, давайте взглянем на другой реагент этин. Этин представляет собой двухуглеродный алкин. Таким образом, два атома углерода должны быть соединены тройной углерод-углеродной связью. Тройная связь углерод-углерод довольно реакционноспособна из-за двух 𝜋-связей, которые она содержит. Во время реакции присоединения одна из 𝜋-связей может разорваться, что позволяет добавить два новых заместителя.
Во время реакции присоединения одна из 𝜋-связей может разорваться, что позволяет добавить два новых заместителя.
Во время реакции этина с двухатомным бромом разрывается одна из 𝜋-связей между двумя атомами углерода, а также связь между двумя атомами брома, что позволяет образовать две новые связи между атомами углерода и атомами брома. Получается 1,2-дибромэтен. Но эта молекула содержит связь 𝜋, которая может реагировать с двухатомным бромом. И снова связь 𝜋 между двумя атомами углерода разорвется вместе со связью между двумя атомами брома. Это позволяет образовать две новые углерод-бромные связи. Это дает соединение 1,1,2,2-тетрабромэтан.
Другой момент, о котором нам говорят в вопросе, заключается в том, что оранжевый цвет брома теряется по мере протекания реакции присоединения. Бромная вода имеет характерный оранжевый цвет. Но 1,1,2,2-тетрабромэтан имеет цвет от бесцветного до бледно-желтого. Поэтому, когда этин барботируют через бромную воду, бром реагирует с этином, образуя бесцветное вещество. Так оранжевый цвет раствора будет становиться все светлее и светлее по мере протекания реакции. А когда весь бром прореагирует, оранжевый цвет полностью пропадет.
Так оранжевый цвет раствора будет становиться все светлее и светлее по мере протекания реакции. А когда весь бром прореагирует, оранжевый цвет полностью пропадет.
Возвращаясь к вопросу, мы определили, что продуктом галогенирования этина является 1,1,2,2-тетрабромэтан. Это соединение содержит четыре атома брома. Таким образом, мы можем исключить варианты ответов (C), (D) и (E), поскольку эти структуры не содержат правильного количества атомов брома. В продукте два атома углерода соединены одинарной связью. Таким образом, мы можем исключить вариант ответа (B), который показывает два атома углерода, соединенных двойной связью. Таким образом, вариант ответа (А) должен быть правильной скелетной структурой 1,1,2,2-тетрабромэтана. Следовательно, при галогенировании этина бромной водой, растворенной в четыреххлористом углероде, образуется продукт, показанный в варианте ответа (А).
Получение и испытание этина (ацетилена) | Эксперимент
Получение газообразного этина с помощью карбида кальция и проверка его свойств в этом микромасштабном практическом классе
В этом эксперименте учащиеся производят газообразный этин или ацетилен в пластиковой чашке Петри путем реакции карбида кальция и воды. Газ тестируют с помощью раствора манганата калия (VII) в пропаноне, который меняет цвет с фиолетового на коричневый. Когда реакция закончилась, учащиеся проверяют остаток карбида кальция каплей раствора индикатора полного диапазона.
Газ тестируют с помощью раствора манганата калия (VII) в пропаноне, который меняет цвет с фиолетового на коричневый. Когда реакция закончилась, учащиеся проверяют остаток карбида кальция каплей раствора индикатора полного диапазона.
Практика займет примерно 20 минут.
Оборудование
Аппарат
- Защита глаз
- Лист из прозрачного пластика (например, лист OHP)
- Пластиковые пипетки
- Пластиковая чашка Петри, диаметр 5,5 см (например, Philip Harris ref: Y 36340)
- Стакан, 10 см 3
- Ножницы
- Пинцет
Химикаты
- Пропанон
- Вода
- Карбид кальция, мелкие кусочки
- Кристаллы манганата калия(VII)
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки (брызгозащитные очки в соответствии с BS EN166 3) и работайте в хорошо проветриваемом помещении.

- Пропанон очень ВОСПЛАМЕНЯЕТСЯ. См. карту опасности CLAPSS HC085A.
- Карбид кальция, CaC 2 (s), при контакте с водой может выделять легковоспламеняющиеся газы, которые могут самовозгораться. Наденьте защитные очки и обеспечьте достаточную вентиляцию. См. карточку опасности CLAPSS HC019.С.
- Манганат калия (VII) является ОКИСЛИТЕЛЕМ, вредным при проглатывании и токсичным для водных организмов. Избегайте прямого контакта и храните в темноте, пятнах на стекле, пластике, одежде и коже. См. карточку опасности CLAPSS HC081.
Процедура
- Накройте рабочий лист прозрачным пластиковым листом.
- Поместите дно чашки Петри над большим кругом на диаграмме (см. ниже).
- Отрежьте концы двух пластиковых пипеток (как показано ниже) и поместите их в чашку Петри.
Источник: Королевское химическое общество
Как настроить оборудование, необходимое для производства и тестирования этинового газа в микромасштабе .
Источник: Королевское химическое общество
Разрежьте пипетку в точке, близкой к тому месту, где луковица достигает стебля
- Осторожно добавьте в пипетку несколько кристаллов манганата калия (VII).
- Добавьте пропанон в пипетку, пока она не наполнится примерно наполовину.
- С помощью пипетки добавьте четыре капли манганата калия (VII) в растворе пропанона на один из концов пипетки в чашке Петри.
- С помощью пинцета осторожно поместите один небольшой кусочек карбида кальция в другой конец пипетки.
- Аккуратно добавьте четыре капли деионизированной воды к карбиду кальция и быстро накройте чашку Петри крышкой.
- Наблюдайте за любыми изменениями в течение следующих нескольких минут.
- Когда газ больше не образуется, добавьте одну каплю раствора индикатора полного диапазона к остатку карбида кальция и наблюдайте.
Учебные заметки и ожидаемые наблюдения
Карбид кальция бурно реагирует с водой.


 Бромная вода в ходе реакции обесцвечивается.
Бромная вода в ходе реакции обесцвечивается.
 Можно для наглядности подкрасить воду. Добавьте в пробирку примерно 1 мл гексана. Встряхните пробирку, затем дайте жидкостям отстояться. Запишите наблюдения и выводы.
Можно для наглядности подкрасить воду. Добавьте в пробирку примерно 1 мл гексана. Встряхните пробирку, затем дайте жидкостям отстояться. Запишите наблюдения и выводы.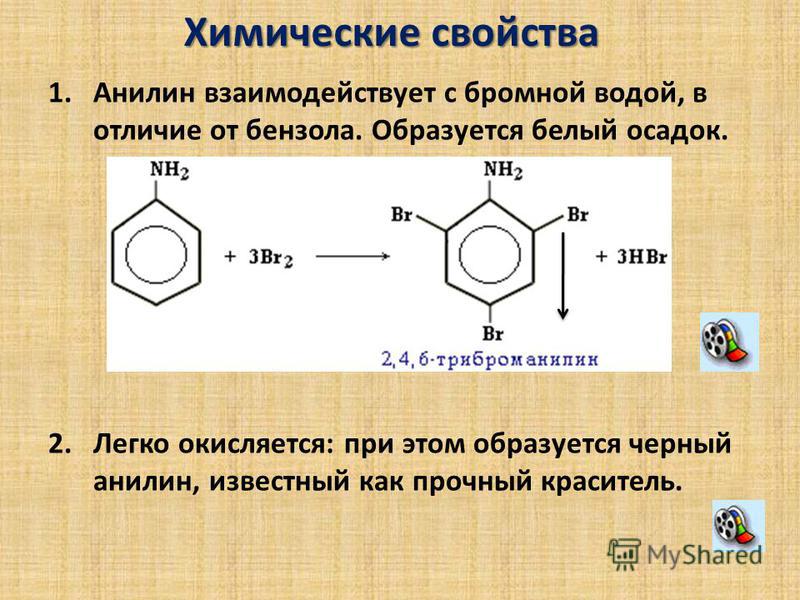 СВОЙСТВА АЛКЕНОВ
СВОЙСТВА АЛКЕНОВ Смесь осторожно нагрейте на пламени спиртовки до кипения. Газоотводную трубку прибора последовательно опустите в стаканчики или пробирки с раствором перманганата калия и с бромной водой и пропускайте этилен через каждый раствор до изменения окраски.
Смесь осторожно нагрейте на пламени спиртовки до кипения. Газоотводную трубку прибора последовательно опустите в стаканчики или пробирки с раствором перманганата калия и с бромной водой и пропускайте этилен через каждый раствор до изменения окраски.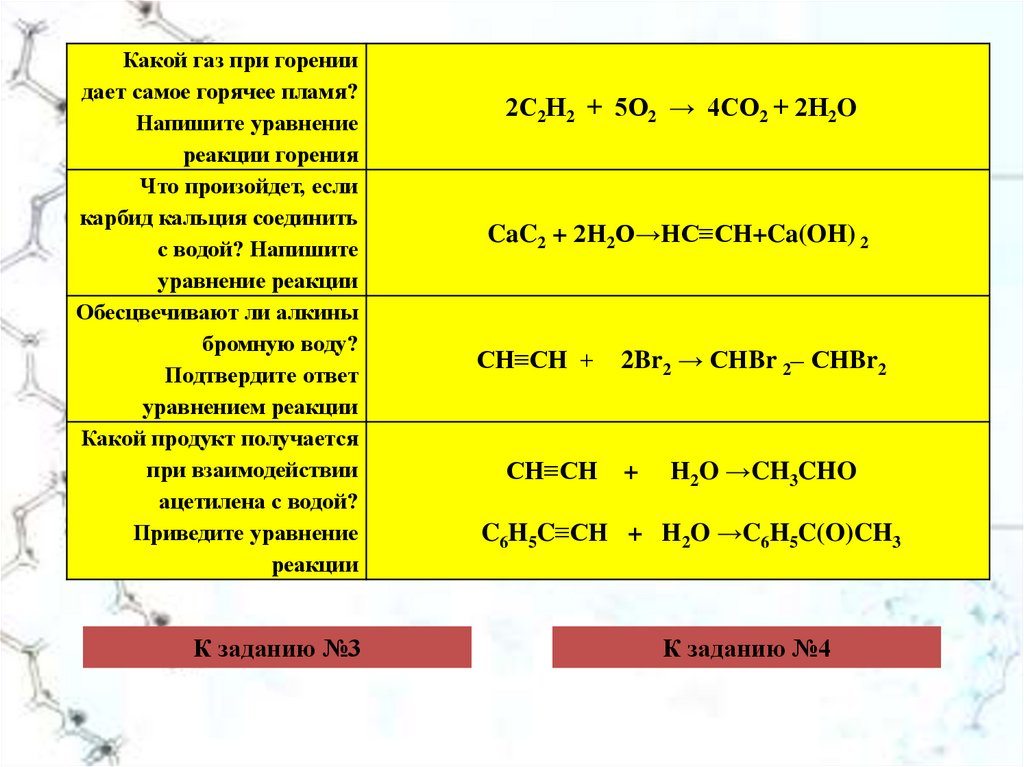
 2 Отношение толуола к перманганату калия и бромной воде. В одну из пробирок налейте примерно 1-2 мл водного раствора перманганата калия, в другую пробирку – такое же количество бромной воды.
2 Отношение толуола к перманганату калия и бромной воде. В одну из пробирок налейте примерно 1-2 мл водного раствора перманганата калия, в другую пробирку – такое же количество бромной воды.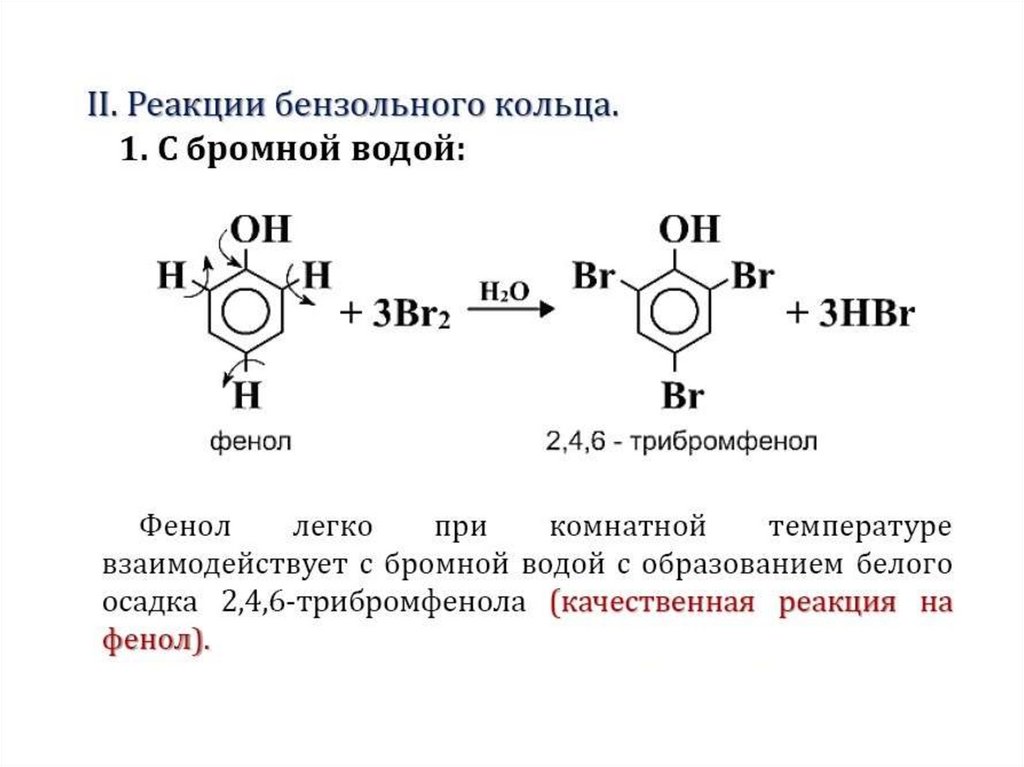
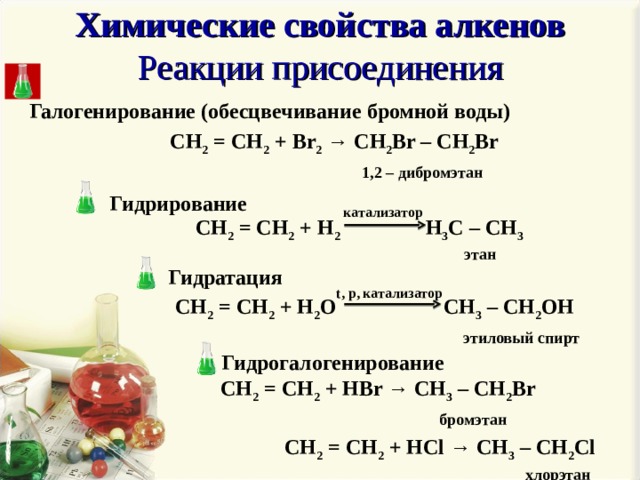 Если гекcан прилить к обычной воде, то он
Если гекcан прилить к обычной воде, то он 59 Mb.
59 Mb.