Содержание
Бензол. Химические свойства
1. Реакции замещения в бензольном кольце
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
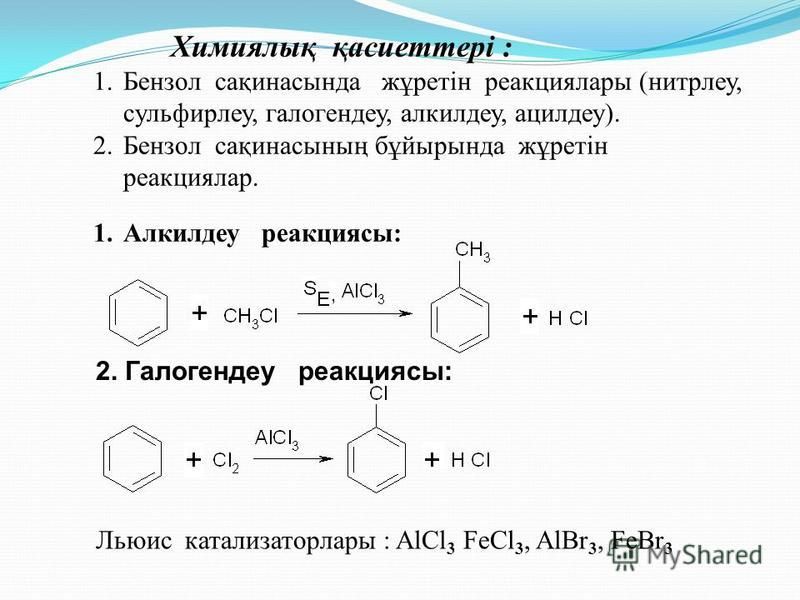
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.
Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство алкилирование бензола галогеналканами.
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.
Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.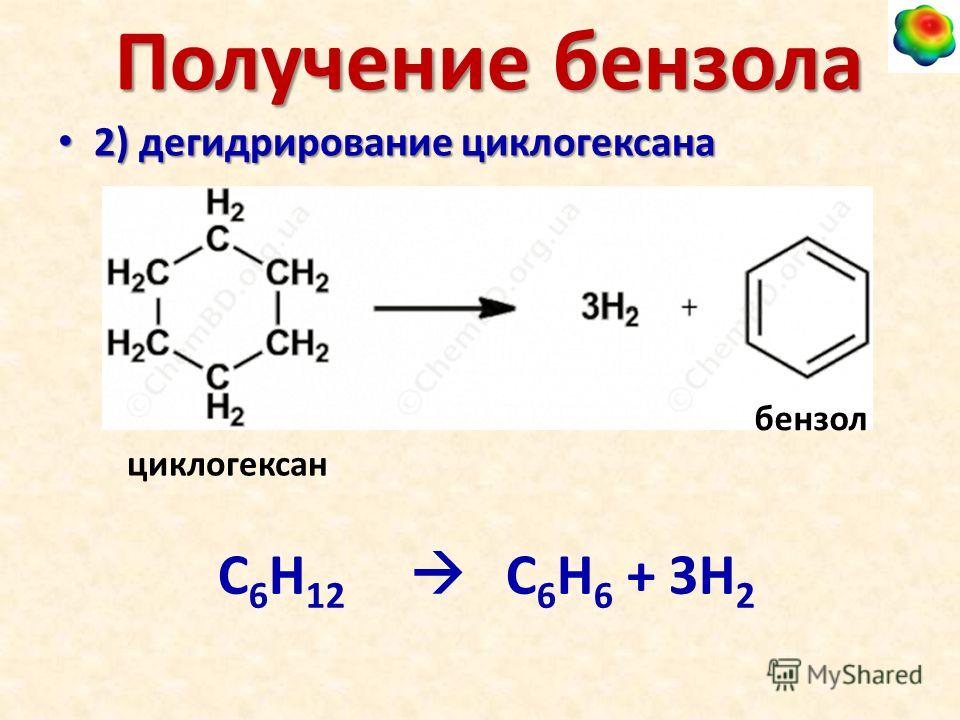
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
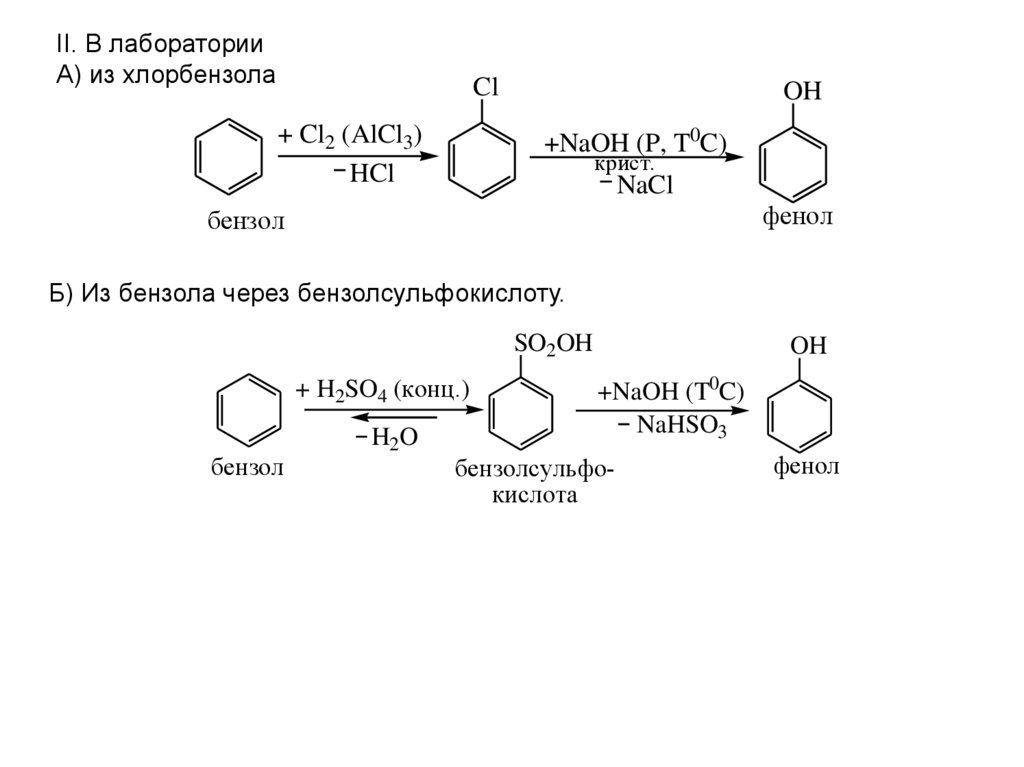
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.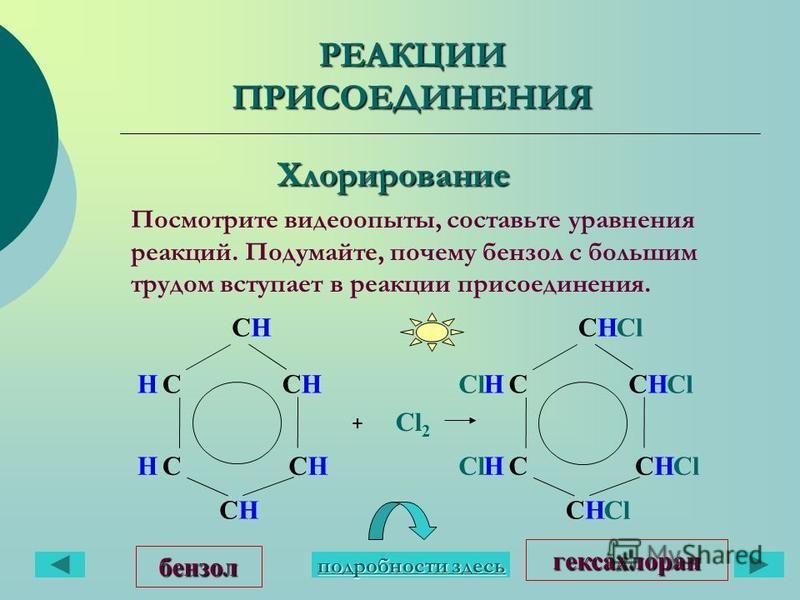
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
Может ли бензол реагировать с водным бромом?
Бромная вода является оранжевым раствором брома. Это становится бесцветным, когда он встряхивается алкеном. alkenes могут разоблачить бромную воду, но алканы не могут. Слайд -шоу показывает этот процесс.
Какое условие бензол не реагирует с бромной водой?
Когда бром добавляется в бензол, бром остается оранжевым , и реакции нет. Это потому, что: бензол имеет делокализованные электроны, распространяющиеся по 6 атомам углерода, тогда как алкены имеют локализованные электроны выше и ниже 2 атомов углерода в двойной связи.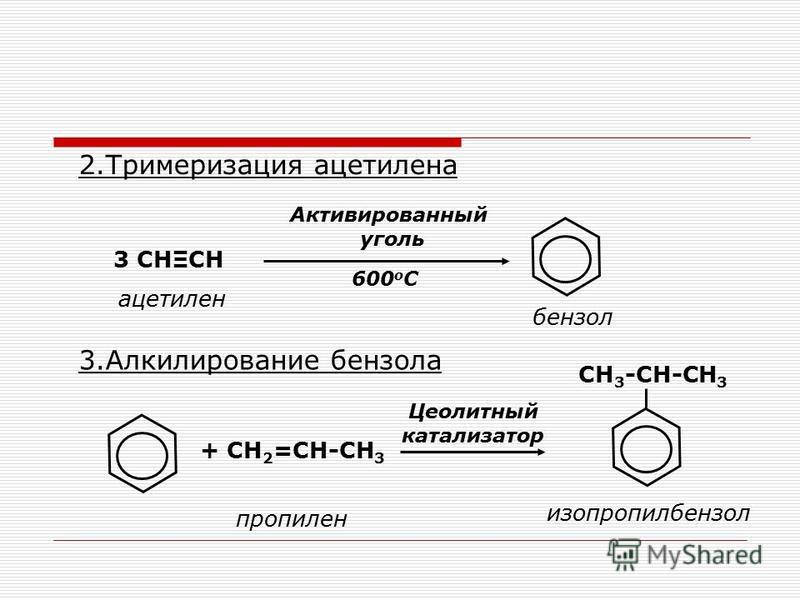
может ли бензол реагировать с водой?
бензол неполярный, а вода очень полярная. Если мы добавим бензол в воду, бензол будет плавать на вершине воды без видимого смешивания. … но, по большей части, вода и бензол несмешиваемые . Они не растворяются друг в друге.
Вода Бромов деколуриза?
Ethyne расшифровывает воду брома как только ненасыщенные углеводороды могут сделать это . Насыщенный углеводородный, то есть этан не будет деколуризируется.
Какое соединение будет быстро расколоть бромную воду?
Ответ: Алкен деколорирует бромную воду, поэтому она часто используется в качестве испытания ненасыщенного углеводорода.
может ли C510 деколуризировать бромную воду?
Соединения A, B и C имеют молекулярную формулу C5h20. A и B Decolourise Бромная вода, но C не . … Соединение C не является алкеном, но является циклоалканом, так как он не раскрывает воду брома. Соединение A может быть pent-1-ene, 2 метилбут-2-ene.
Фенол деколуризирует бромную воду?
Подсказка: когда бромная вода добавляется в раствор фенола в воде, вода брома деколуризируется и образуется белый осадок, который пахнет антисептическим. … мы знаем, что реакция фенола и воды с бромом известна как бромирование фенола.
Почему бензол не деколуризирует брома?
молекула бензола ненасыщена, но она не подвергается электрофилическому добавлению, потому что насыщают углеродные связи, разрушает делокализованный Pi-Cloud и, как мы знаем, эта делокализованная структура PI очень стабилена. Таким образом, из -за этого бензола не деколуризует бромную воду.
Что происходит, когда Бромн добавлен в бензол?
бромирование бензола является примером электрофильной реакции ароматической замещения. В этой реакции электрофил (Bromine) образует сигма -связь с бензольным кольцом, что дает промежуточное соединение. Затем протон удаляется из промежуточного соединения с образованием замещенного бензольного кольца.
Что происходит, когда бензол реагирует с бромом?
бензол реагирует с хлором или бромом в присутствии катализатора, заменяя один из атомов водорода на кольце на кольцо хлором или атомом брома. Реакции случаются при комнатной температуре. … он реагирует с некоторыми из хлора или брома с образованием хлорида железа (III), FECL3 или железа (III), в феврале.
проверяет ли бензол бромная вода?
тест брома, также известный как тест на бромскую воду, обычно используется для проверить наличие алкенов . … Несмотря на то, что бензол имеет ненасыщенные связи, они стабильны и, следовательно, не будут реагировать с раствором брома и, следовательно, никакой декодуризации бромной воды.
Что происходит, когда фенол реагирует с бромной водой?
фенол производит белый осадок 2,4,6-тибромофенолола в сочетании с избыточной бромами. Чтобы иметь 2,4,6-трибромофенол, фенол реагирует с бромной водой. Ионизация продвигается в жидкостях.
Что такое формула воды Bromine?
Бромная вода, также называемая раствором бромидного бромата или раствором брома с химической формулой br 2 . Молекулярная масса брома воды составляет 159,81, а плотность составляет 1,307 г/мл. Бромная вода представляет собой раствор желтой смеси с высоким окисляющим свойством, приготовленным растворением диатомного брома (Br 2 ) в воде (H 2 o).
Молекулярная масса брома воды составляет 159,81, а плотность составляет 1,307 г/мл. Бромная вода представляет собой раствор желтой смеси с высоким окисляющим свойством, приготовленным растворением диатомного брома (Br 2 ) в воде (H 2 o).
Какой газ не раскрывает бромную воду?
Как правило, насыщенный углеводород не раскрывает бромную воду. Алканы являются насыщенными углеводородами, которые не раскрывают воду брома.
дает ли циклопропан тест на воду брома?
При наличии ультрафиолетового света циклопропан будет подвергаться реакциям замещения хлором или бромом, как нециклический алкан. … Например, с Bromine циклопропан дает 1,3-дибромпропан .
разоблачают ли карбоновые кислоты брома?
Это и алкен, и карбоновая кислота. Таким образом, это будет Decolourise Bromine Water , а также шипение при добавлении в карбонатные растворы.
может ли фениламин реагировать с бромом?
Например, фениламин будет реагировать с водным раствором брома (брома) в холодном и в отсутствие какого -либо катализатора. Неактивированные кольца будут реагировать только с бромом только в присутствии катализатора.
Неактивированные кольца будут реагировать только с бромом только в присутствии катализатора.
C2h3 расшифровывает воду брома?
Эфиен является ненасыщенным соединением деколуризации брома, тогда как метан насыщен и не дает такого теста.
Бромне насыщен или ненасыщенным?
test bromine
Бромс образует продукт добавления с ненасыщенным углеводородом . ПРИМЕЧАНИЕ. Деколуризация оранжево-красного цвета раствора брома указывает на ненасыщение.
Какое из следующих органических соединений будет деколуризировать бромную воду?
Ненасыщенные углеводороды имеют свойство для расшифровки бромной воды. Таким образом, Алкены, такие как этена, содержащие связи PI , используются для расшифровки брома …
безопасен ли бром?
вредно, если вдыхает . Вызывает раздражение дыхательных путей и возможные ожоги. Вызывает раздражение глаз и кожи и возможные ожоги. Может вызвать раздражение пищеварительного тракта с тошнотой, рвотой и диареей.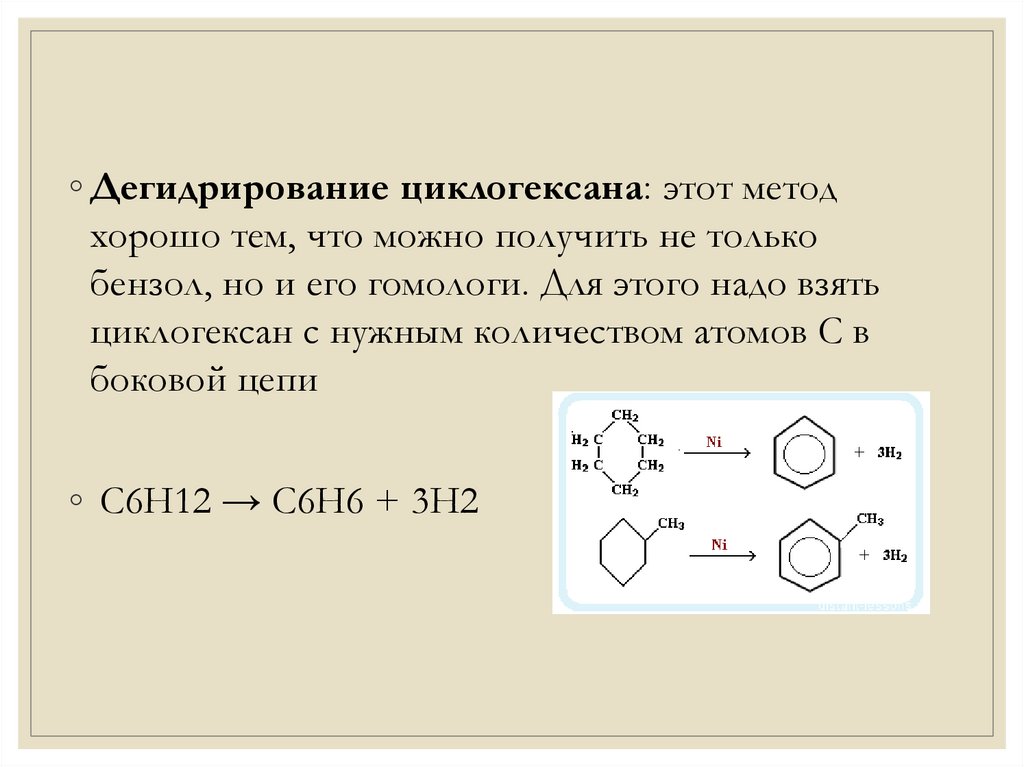
Как вы можете сказать разницу между циклогексаном и бензолом?
Основное различие между циклогексаном и бензолом заключается в том, что циклогексан содержит 12 атомов водорода, связанных с шестью атомами углерода, два атома водорода на каждый атом углерода, тогда как бензол содержит шесть атомов водорода, связанные с шести атомов углерода, один Атом водорода на каждый атом углерода.
дает ли фруктоза тест на воду брома?
фруктоза не реагирует с бромной водой .
Бензол и фенол — Revise.im
Ароматические углеводороды
Ароматический углеводород, также известный как арен, представляет собой углеводород, содержащий по крайней мере одно бензольное кольцо.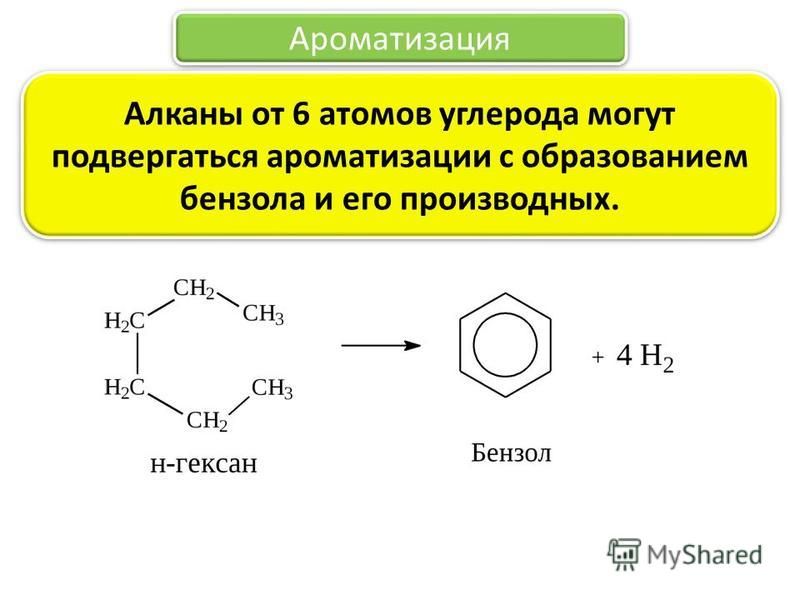 Молекула бензола имеет молекулярную формулу $C_{6}H_{6}$ или эмпирическую формулу $CH$, в которой атомы углерода расположены в циклическом кольце. Его можно нарисовать в виде шестиугольника, окружающего круг.
Молекула бензола имеет молекулярную формулу $C_{6}H_{6}$ или эмпирическую формулу $CH$, в которой атомы углерода расположены в циклическом кольце. Его можно нарисовать в виде шестиугольника, окружающего круг.
Когда атом водорода в кольце замещается другим атомом или группой, такой как галоген или -этильная группа, образуется производное бензола.
При наличии нескольких функциональных групп атомы углерода в бензольном кольце нумеруются, начиная с алкильной группы, как в случае с 2-бромметилбензолом.
Синтез
Бензол часто используется в синтезе важных ароматических соединений, таких как этилбензол, фенол и стирол. Меньшие количества можно использовать при перегонке спирта и взрывчатых веществ. Бензол — бесцветная жидкость со сладковатым запахом. Также известно, что это канцерогенное соединение, так как воздействие может привести к увеличению риска развития рака.
Структура Кекуле
В 1800-х годах для бензола была предложена структура Кекуле с шестичленным циклическим кольцом атомов углерода с чередующимися одинарными и двойными связями. Техническое название этой структуры — циклогекса-1,3,5-триен.
Техническое название этой структуры — циклогекса-1,3,5-триен.
Эта структура оказалась неправильной из-за ряда неожиданных физических и химических свойств.
Низкая реакционная способность
Если бы присутствовали двойные связи $C=C$, то бензол реагировал бы аналогично алкенам, обесцвечивая бромную воду. Однако этого не происходит, так как бензол не реагирует с бромом. Бензол не может реагировать ни в каких других реакциях электрофильного присоединения.
Длины связей C-C
Структура Кекуле содержит три одинарные связи $C-C$ длиной $0,153~нм$ и три двойные связи меньшей длины $0,134~нм$. Это приведет к неправильной форме. Наблюдения с помощью рентгеновских лучей показывают, что бензол на самом деле имеет правильную гексагональную форму с шестью углерод-углеродными связями одинаковой длины ($0,139~нм$).
Гидрирование бензола
Для одиночной связи $C=C$ изменение энтальпии гидрирования ($\Delta_{\text{гидрирование}}$) составляет $-120~кДжмоль^{-1}$. {-1}$ более стабильна, чем структура Кекуле. Эта энергия известна как энергия делокализации.
{-1}$ более стабильна, чем структура Кекуле. Эта энергия известна как энергия делокализации.
Модель делокализованного электрона
Делокализованные электроны
Электроны, общие для нескольких атомов.
Неудачи в структуре Кекуле привели к развитию делокализованной модели бензола.
Эта структура имеет форму гексагонального плоского кольца с шестью атомами углерода. Валентные углы вокруг каждого атома углерода составляют $120˚$, образуя треугольную плоскую форму. Каждый атом углерода соединен с двумя другими атомами углерода и одним атомом водорода сигма-($\sigma$)-связями. Четвертый электрон на $2p$-орбитали остается над и под атомом. Соседние $p$-орбитальные электроны перекрываются, образуя систему $\pi$-связей с делокализованной электронной кольцевой структурой.
Химическая активность бензола
Повышенная стабильность бензола затрудняет реакции присоединения. Некоторые реакции, которые не происходят с бензолом, включают:
- Обесцвечивание бромной воды.

- Реакции с сильными кислотами ($HNO_{3}$).
- Реакции с галогенами ($Cl_{2}$, $Br_{2}$).
Это связано с тем, что реакции присоединения требуют разрушения делокализованной кольцевой структуры, что снижает стабильность молекулы. Поэтому реакции замещения более благоприятны.
Реакции бензола
Области с высокой электронной плотностью выше и ниже плоскости атомов углерода притягивают электрофилы, вызывая электрофильное замещение. Электрофил — это акцептор электронной пары, притягиваемый к области с высокой плотностью электронов.
Нитрование электрофильным замещением
В этой реакции связанный атом водорода заменяется группой $-NO_{2}$. Бензол может реагировать с концентрированной азотной кислотой ($HNO_{3}$), с концентрированной серной кислотой ($H_{2}SO_{4}$) в качестве катализатора при температуре 50°. 9{-} \rightarrow FeBr_{3} + HBr $$
Реакционная способность циклогексена и бензола
Циклогексен реагирует как типичный алкен, но атомы брома присоединяются поперек двойной связи в реакции электрофильного присоединения.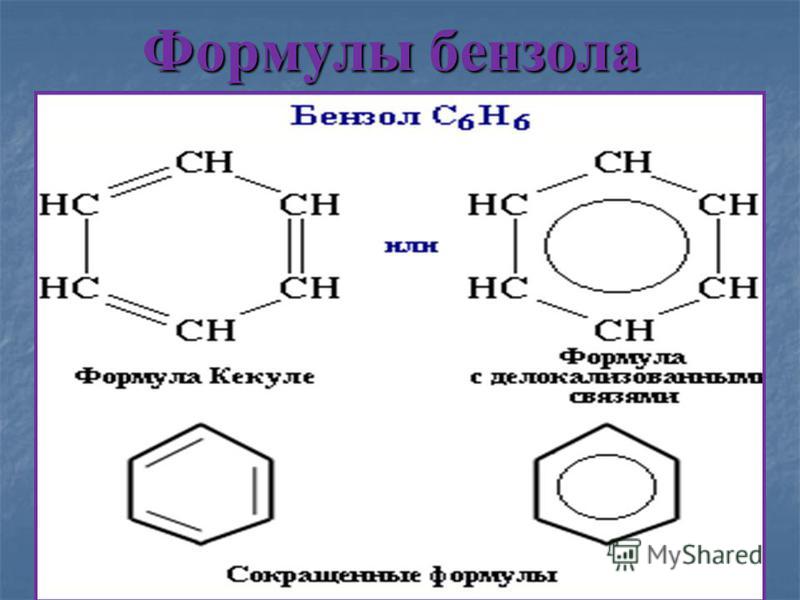
Однако при добавлении брома к бензолу бром остается оранжевым и реакции не происходит. Это происходит потому, что:
- Бензол имеет делокализованные электроны, распределенные по 6 атомам углерода, тогда как алкены имеют локализованные электроны выше и ниже 2 атомов углерода в двойной связи.
- Бензол имеет более низкую электронную плотность $\pi$, что приводит к недостаточной электронной плотности для поляризации молекулы $Br_{2}$. Это приводит к необходимости использования галогенового носителя.
Фенол
Фенолы представляют собой группу органических соединений, в которых гидроксильная группа ($-OH$) присоединена непосредственно к бензольному кольцу. Фенол — простейший из фенолов, у которого один из присоединенных атомов водорода в бензольном кольце заменен группой $-OH$. Это малорастворимое твердое вещество серого цвета, растворимость которого обусловлена полярной группой $-OH$, способной образовывать водородные связи с молекулами воды. 9{+} + H_{2} $$
9{+} + H_{2} $$
Реакция с бромом
В отличие от бензола фенол может подвергаться электрофильному замещению галогенами при комнатной температуре без необходимости использования галогенового носителя. При добавлении брома к водному раствору фенола выпадает белый осадок 2,4,6-трибромфенола.
Повышенная реакционная способность по сравнению с бензолом обусловлена наличием неподеленной пары p-орбитальных электронов на атоме кислорода в фенольной группе. Электронная пара делокализована в кольцевую структуру, активируя кольцо. Это увеличивает электронную плотность молекулы, что индуцирует диполи в молекуле брома. Затем может иметь место электрофильное замещение.
© Andrew Deniszczyc, 2022
Галогенирование бензола — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3772
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице представлены факты и простой, лаконичный механизм реакции электрофильного замещения между бензолом и хлором или бромом в присутствии катализатора, такого как хлорид алюминия или железо.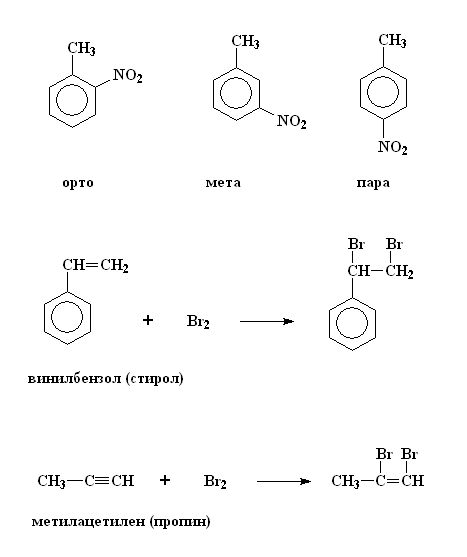
Реакция электрофильного замещения между бензолом и хлором или бромом
Бензол реагирует с хлором или бромом в реакции электрофильного замещения, но только в присутствии катализатора. Катализатором является либо хлорид алюминия (или бромид алюминия, если вы взаимодействуете с бензолом с бромом), либо железо. Строго говоря, железо не является катализатором, поскольку в ходе реакции оно постоянно изменяется. Он реагирует с некоторым количеством хлора или брома с образованием хлорида железа (III), \(FeCl_3\), или бромида железа (III), \(FeBr_3\).
\[ 2Fe + 3Cl_2 \rightarrow 2FeCl_3\]
\[ 2Fe + 3Br_2 \rightarrow 2FeBr_3\]
Эти соединения действуют как катализатор и ведут себя в этих реакциях точно так же, как хлорид алюминия.
Реакция с хлором
Реакция между бензолом и хлором в присутствии хлорида алюминия или железа дает хлорбензол.
\[C_6H_6 + Cl_2 \rightarrow C_6H_5Cl + HCl\]
или:
Реакция с бромом
Реакция между бензолом и бромом в присутствии бромида алюминия или железа дает бромбензол. Железо обычно используется, потому что оно дешевле и более доступно.
Железо обычно используется, потому что оно дешевле и более доступно.
\[C_6H_6 + Br_2 \rightarrow C_6H_5Br + HBr\]
или:
Образование электрофила
Мы собираемся исследовать реакцию с использованием хлора и хлорида алюминия. Если вам нужна одна из других комбинаций, все, что вам нужно сделать, это заменить каждый \(Cl\) на \(Br\) или каждый \(Al\) на \(Fe\). Когда молекула хлора приближается к бензольному кольцу, делокализованные электроны в кольце отталкивают электроны в связи хлор-хлор. 9-\) ион, который образовался на первой стадии. Катализатор из хлорида алюминия регенерируется на этой второй стадии.
Авторы
Джим Кларк (Chemguide.co.uk)
Эта страница под названием «Галогенирование бензола» распространяется по незаявленной лицензии, автором, ремиксом и/или куратором которой является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Джим Кларк
- Показать страницу Содержание
- нет на странице
- Метки