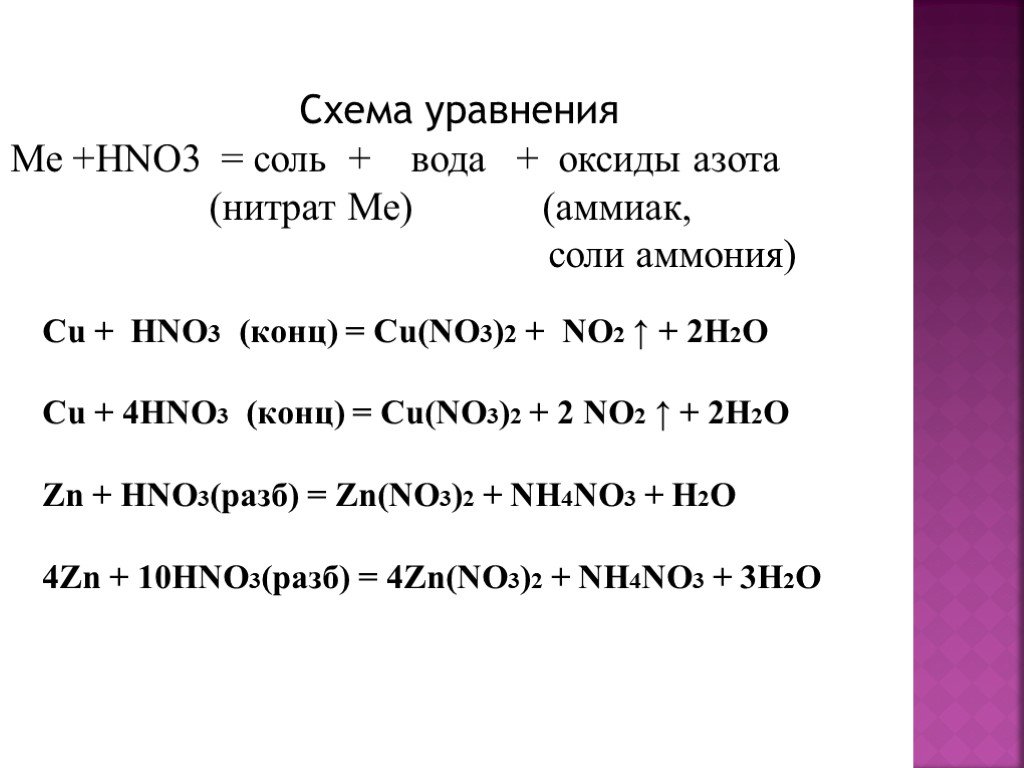
Содержание
Азот — степени окисления, свойства и реакции
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Важно
Валентности азота V нет!
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
youtube.com/embed/wBrC6oI6M8c» title=»YouTube video player» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»» ssmarticle=»»>
Бесплатные занятия по английскому с носителем
Занимайтесь по 15 минут в день. Осваивайте английскую грамматику и лексику. Сделайте язык частью жизни.
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
с металлами
N2 + 6Li = 2Li3Nазот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.

Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.

Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2OОкисление оксида азота (II)
2NO + O2 = 2NO2Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O.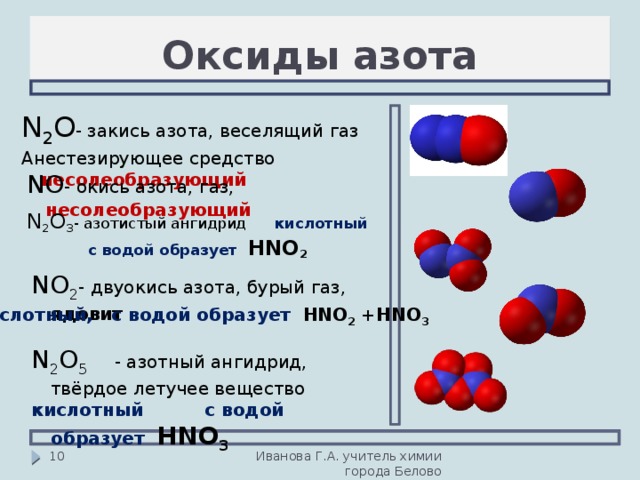 Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
Одинарную.
Двойную.

Тройную.
Выберите высшую и низшую степени окисления азота:
−3 и +5,
−5 и +3,
0 и +4,
−3 и +3.
Максимальная валентность азота равна:
V,
III,
IV,
II.
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
Только окислитель.
Только восстановитель.
И окислитель, и восстановитель.

Не участвует в реакциях с изменением степеней окисления.
Выберите формулу веселящего газа:
NO,
N2O3,
N2O,
N2O4.
Ответы
c
a
c
b
c
Азот газообразный и жидкий — Щекиноазот
При нормальных условиях азот — это бесцветный газ, не имеет запаха, мало растворим в воде
Трудность преобразования N2 в другие соединения и легкость превращения соединений азота в элементарный N2 обуславливают важную роль азота и в природе, и хозяйственной деятельности человека.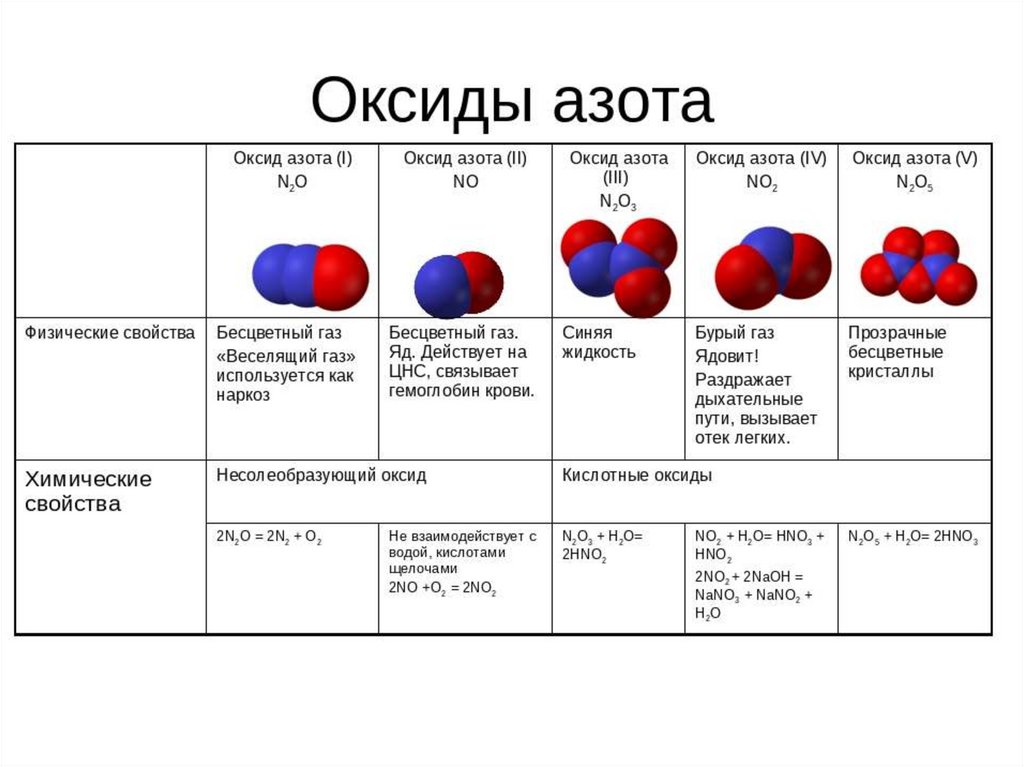
Температура кипения — минус 195,8 0С
Температура плавления — минус 210,0 0С
В жидком состоянии – бесцветная, подвижная, как вода, жидкость.
Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
По физико-химическим показателям азот газообразный и жидкий соответствует нормам ГОСТ 9293-74
|
Наименование показателя
|
Норма для марки газообразного и жидкого азота
| |||||
|
|
особой чистоты
|
повышенной чистоты
|
технического
| |||
|
|
1-й сорт
|
2-й сорт
|
1-й сорт
|
2-й сорт
|
1-й сорт
|
2-й сорт
|
|
1 Объемная доля азота, %, не менее
|
99,999
|
99,996
|
99,99
|
99,95
|
99,6
|
99,0
|
|
2 Объемная доля кислорода, %, не более
|
0,0005
|
0,001
|
0,001
|
0,05
|
0,4
|
1,0
|
|
3 Объемная доля водяного пара в газообразном азоте, %, не более
|
0,0007
|
0,0007
|
0,0015
|
0,004
|
0,009
|
выдерживает испытание по п.
|
|
4 Содержание масла в газообразном азоте
|
не определяется
|
выдерживает испытание по п. 3.7 ГОСТ 9293-74
| ||||
|
5 Содержание масла, механических примесей и влаги в жидком азоте
|
выдерживает испытание по п. 3.8 ГОСТ 9293-74
| |||||
|
6 Объемная доля водорода, %, не более
|
0,0002
|
0,001
|
не нормируется
| |||
|
7 Объемная доля суммы углеродсодержащих соединений в пересчете на СН4, %, не более
|
0,0003
|
0,001
|
не нормируется
| |||
Производство
В промышленных масштабах азот получают низкотемпературной ректификацией жидкого воздуха
В химической лаборатории его получают путем обработки водного раствора хлорида аммония с нитритом натрия.
Nh5Cl (водный) + NaNO2 → N2 (г) + NaCl (водный) + 2h3O
Очень чистый азот может быть получен путем термического разложения азида бария или азида натрия.
2NaN3 → 2Na + 3N2
Сферы применения
Промышленные применения газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению.
Газообразный азот используется для создания инертной атмосферы при производстве, хранении и транспортировании легко окисляемых продуктов, при высокотемпературных процессах обработки металлов, не взаимодействующих с азотом, для консервации замкнутых металлических сосудов и трубопроводов и других целей.
Кроме того, азот:
- Чистый азот используется в качестве пищевой добавки E941:добавка к консервированным сокам, защитный газ для упаковки мяса и мясных изделий, рыбы, хлебобулочной продукции, различных жиров, склонных к окислению продуктов.
- Используется в недорогих лампах накаливания в смеси с аргоном.

- Используется в некоторых топливных системах самолетов для снижения пожарной опасности.
- Азотом заполняют автомобильные и авиационные шины из-за его инертности, отсутствия влаги или окислительных свойств (такими характеристиками не может похвастать воздух).
- Жидкий азот популярен в качестве хладагента. Помимо всего прочего, он используется в криоконсервации крови, половых клеток, а также других биологических образцов и материалов. Он используется в клинической практике в криотерапии для удаления кисты и бородавок на коже.
Хранить азот следует при температуре 20°C в специальных герметичных баллонах во избежание утечки.
Безопасность
Быстрое выделение газообразного азота в замкнутом пространстве может вытеснить кислород, и, следовательно, существует угроза удушья. Симптомы «отравления» – сонливость, возникающая из-за гипоксии.
Если газ вдыхают при больших парциальных давлениях, то азот начинает действовать в качестве анестезирующего средства. Это может привести к азотному наркозу и временному легкому опьянению (аналогичным действием обладает закись азота – «веселящий газ»).
Это может привести к азотному наркозу и временному легкому опьянению (аналогичным действием обладает закись азота – «веселящий газ»).
Азот растворяется в крови и жирах организма. Быстрая декомпрессия может привести к кессонной болезни, когда пузырьки азота образуются в крови, нервах, суставах и других чувствительных или важных областях. Пузырьки других «инертных» газов (за исключением углекислого газа) оказывают аналогичное воздействие, поэтому замена азота в дыхательных газах может предотвратить азотный наркоз, но не мешает развитию декомпрессионной болезни.
Прямой контакт кожи с жидким азотом вызывает серьезные обморожения (криогенные «ожоги»). Нахождение в природе
Азот является важным строительным блоком аминокислот и нуклеиновых кислот, необходимых для жизнедеятельности на Земле. Он составляет 78% атмосферного воздуха (кислород занимает лишь 21%, все остальное – другие газы).
Распад организмов и их отходов может производить небольшое количество нитрата, но большая часть азота в конечном итоге возвращается в атмосферу. Циркуляция азота из атмосферы к органическим соединениям, а затем обратно в атмосферу, называется азотным циклом.
Циркуляция азота из атмосферы к органическим соединениям, а затем обратно в атмосферу, называется азотным циклом.
Транспортирование
Жидкий азот – криогенная жидкость, которая условиях атмосферного давления кипит при -195,8 °C. Если его изолировать в специальные контейнеры (сосуд Дьюара), то транспортировка пройдет без потерь за счет испарения.
Обратите внимание на другие сферы деятельности ОХК»Щекиноазот»:
- спанбонд (нетканый материал)
- сухой лёд
- производство и продажа гидроизоляционных пленок
Просмотреть прайс-лист
Двуокись азота и реакция с водой
Двуокись азота (NO 2 ) представляет собой кислый газ и легко реагирует с водой
(H 2 O) для получения кислого раствора
азотная кислота
(HNO 3 ) и монооксид азота (NO). Коричневый цвет газообразного диоксида азота исчез.
когда идет реакция.
Газообразный диоксид азота реагирует с водой с образованием азотной кислоты и монооксида азота.

Эта реакция очень легко протекает в воде. Поэтому образующийся газообразный диоксид азота направляют в воду для производства азотной кислоты в химической промышленности. Эта реакция является окислительно-восстановительной реакцией.
NO
2 + H 2 O → HNO 3 + NO
Иногда мы пишем химическое уравнение диоксида азота и воды, как показано ниже.
2NO
2 + H 2 O → HNO 3 + HNO 2
В этой реакции (рассматриваем как реакцию 1) мы видим азотную кислоту
и азотистая кислота образуются как продукты.
Почему существует два уравнения для выражения продуктов реакции диоксида азота и воды?
Мы можем объяснить это так.
- Азотистая кислота является
неустойчивая кислота и легко разлагается на азотную кислоту, воду и окись азота. - HNO 2 → HNO 3 + NO + H 2 O
Когда мы уравновесим это уравнение (рассмотрим как реакция 2),
- 3HNO 2 → HNO 3 9004 + 2NO + HNO + HNO + HNO + HNO 2 2 O
Объединив реакцию 1 и реакцию 2 для удаления азотистой кислоты из основного уравнения, мы получим правильное уравнение.
( 3 * реакция 1 + реакция 2 )
- 6NO 2 + 3H 2 O + 3HNO 2 → 3HNO 3 + 3HNO 2 + HNO 3 + 2NO + H 2
- 3NO 2 + H 2 O + → 2HNO 3 + NO
9004 6 60004 + 2 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 2 4 2 2 2 4 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 . 2 O + → 4HNO 3 + 2NO
- NO 2 — коричневый газ. Коричневый цвет исчезает при взаимодействии NO 2 с водой.
- Эта реакция используется в промышленности для производства азотной кислоты по методу Оствальда.
- Кроме того, это реакция, которая вызывает кислотные дожди из газообразного диоксида азота в атмосфере.

- Эта реакция является реакцией диспропорционирования , потому что азот на молекуле диоксида азота восстанавливается и
окисленный. Это подробно обсуждается позже в этом руководстве. - Благодаря реакции с водой диоксид азота очень хорошо растворяется в воде.
Сбалансированное химическое уравнение с физическими состояниями
Газообразный диоксид азота реагирует с жидкой водой с образованием азотной кислоты, хорошо растворимой в воде.
(поэтому азотная кислота существует в виде водного раствора) и газообразные
монооксид азота.
3NO
2 (G) + H 2 O (L) → 2HNO 3 (AQ) + NO (G)
NO
2 + H 2 9004 O реакция диспропорционирования Степень окисления азота при NO 2 +4 согласно Эта реакция используется в азотной кислоте 2 (G) + H 2 O (L) → 2HNO 3 (AQ) + NO (G) 9003
структура Льюиса NO 2 .
При протекании реакции NO 2 окисляется до азотной кислоты. В азотной кислоте степень окисления азота равна +5.
Одновременно с окислением другие молекулы NO 2 восстанавливаются до NO. Степень окисления
азот в NO +2. Следовательно, атом азота в NO 2 восстанавливается и окисляется одновременно, и эти реакции
определяются как реакции диспропорционирования. Использование реакции диоксида азота и воды
производство; Оствальдовский процесс. Произведенный газообразный диоксид азота направляется в воду для производства
азотная кислота. В качестве побочного продукта образуется оксид азота (NO). Он также используется для производства азотной кислоты путем разделения и
превращение в диоксид азота в производственном процессе. диоксида азота и уравнения сбалансированного воды
3NO

Вопросы студентов
Задайте свой вопрос и найдите
ответ бесплатно.
Степень окисления азота в диоксиде азота +4. Также степень окисления азота в трехокиси азота равна четырем. Будут ли и диоксид азота, и триоксид диазота реагировать с водой одинаково?
Как двуокись азота, трехокись азота реагирует с водой и образует азотную кислоту и окись азота. Терапевтическая степень окисления азота изменяется, когда и диоксид азота, и триоксид диазота реагируют с водой.
Каково значение pH при растворении диоксида азота в воде? (когда диоксид азота реагирует с водой)
Значение pH будет меньше семи из-за образования азотной кислоты. Если много диоксида азота растворяется, значение pH
будет иметь значение, подобное 1,2, образуя сильный кислый раствор (азотная кислота является сильной кислотой).
Как использовать NO
2 + H 2 O реакция на тест NO 2 газ и Br 2 газ?
Газы брома и диоксида азота имеют коричневый цвет. Поэтому мы не можем идентифицировать их, наблюдая за их цветами.
Поэтому мы не можем идентифицировать их, наблюдая за их цветами.
В этом уроке мы узнали, что NO 2 легко вступает в реакцию с водой и теряет свой коричневый цвет во время
реакция. Но газообразный бром, который тоже имеет коричневый цвет, не растворяется, как NO 2 9.0004 . Так коричневый цвет
Br 2 остается в воде.
Связанные учебные пособия
Оксиды азота Структура Льюиса диоксида азотаЧисло окисления диоксида азота
Облако жидкого азота | Химическое образование Xchange
- Домашний
- Блоги
- Блог Тома Кунцлемана
- Облако жидкого азота
Том Кунцлеман | Пт, 26.07.2019- 10:42
Один из моих любимых экспериментов — это облако жидкого азота. Пока у вас есть немного жидкого азота, это невероятно легко выполнить. Все, что вам нужно сделать, это налить немного горячей воды в жидкий азот , и получится массивное облако. Проверьте это (также обязательно посмотрите видео, размещенное ниже):
Проверьте это (также обязательно посмотрите видео, размещенное ниже):
Какой фантастический эксперимент! Трудно представить, что такие совершенно замечательные результаты получены в результате эксперимента, который так легко поставить и провести. Некоторое время я задавался вопросом, как образуется облако в этом эксперименте. Я видел заявления о том, что облако формируется, когда горячая вода испаряет жидкий азот при контакте, и образующийся в результате холодный восходящий пар азота охлаждает атмосферный водяной пар, конденсируя его в облако. 1 Я не убежден в этом объяснении по двум причинам. Во-первых, вы заметите, что образовавшееся облако массивное и плотное. Мне кажется, что в непосредственной близости от восходящего холодного газообразного азота недостаточно атмосферного водяного пара, чтобы образовалось облако такого размера. Также этот эксперимент напоминает облако сухого льда, в котором облако образуется при помещении сухого льда в воду. В ходе эксперимента с сухим льдом легко показать, что облако образуется не из атмосферного водяного пара, а из воды, в которую помещен сухой лед. 2,3 Я решил провести несколько экспериментов, чтобы увидеть, образовалась ли вода в облаке жидкого азота из воды, налитой на азот, а не из атмосферного водяного пара. Я проводил различные испытания заливки воды в жидкий азот, а также жидкого азота в воду, и наблюдал за результатами. Результаты моих исследований привели к рабочей гипотезе о том, что облако возникает на границе между жидким азотом, горячей водой и расширяющимся газообразным азотом (рис. 1). В этом сценарии контакт двух жидкостей вызывает быстрое испарение азота, в результате чего образуются большие карманы расширяющегося газообразного азота, который поднимается и проталкивает жидкую воду (рис. 1, в середине). Часть этой жидкой воды испаряется в эти расширяющиеся шлейфы холодного газообразного азота (рис.
Также этот эксперимент напоминает облако сухого льда, в котором облако образуется при помещении сухого льда в воду. В ходе эксперимента с сухим льдом легко показать, что облако образуется не из атмосферного водяного пара, а из воды, в которую помещен сухой лед. 2,3 Я решил провести несколько экспериментов, чтобы увидеть, образовалась ли вода в облаке жидкого азота из воды, налитой на азот, а не из атмосферного водяного пара. Я проводил различные испытания заливки воды в жидкий азот, а также жидкого азота в воду, и наблюдал за результатами. Результаты моих исследований привели к рабочей гипотезе о том, что облако возникает на границе между жидким азотом, горячей водой и расширяющимся газообразным азотом (рис. 1). В этом сценарии контакт двух жидкостей вызывает быстрое испарение азота, в результате чего образуются большие карманы расширяющегося газообразного азота, который поднимается и проталкивает жидкую воду (рис. 1, в середине). Часть этой жидкой воды испаряется в эти расширяющиеся шлейфы холодного газообразного азота (рис. 1, справа, синие стрелки), а затем быстро конденсируется в большие карманы, содержащие сконденсированный водяной пар — облако (рис. 1, справа, красные уравнения).
1, справа, синие стрелки), а затем быстро конденсируется в большие карманы, содержащие сконденсированный водяной пар — облако (рис. 1, справа, красные уравнения).
Рис. 1: Диаграмма, обобщающая гипотезу образования облака во время эксперимента с жидким азотом.
Изображение на рис. 1 слишком схематично; взрывной характер этого процесса, несомненно, превращает жидкую воду в бесчисленные жидкие капли. Основная идея, однако, заключается в том, что все поверхности контакта между жидкой водой и холодным газообразным азотом приводят к образованию крошечных капелек конденсированного водяного пара. Подводя итог уравнениям:
H 2 O ( l , in bulk water and pulverized droplets) à H 2 O ( g , in pockets of cool gaseous nitrogen)
H 2 O ( г , в карманах холодного газообразного азота) à H 2 O ( л , капли, в прохладном газообразном азоте)
Результаты моих экспериментов вы можете увидеть на видео ниже , и судите сами, что вы думаете о моей рабочей гипотезе.
Если у вас есть комментарии или критические замечания по поводу того, как, по моему мнению, формируется облако жидкого азота, я хотел бы услышать от вас, особенно если у вас есть предложения относительно возможных экспериментов, чтобы улучшить мое понимание того, что происходит в этот увлекательный эксперимент.
Ссылки:
1. См., например, https://www.noble.org/videos/liquid-nitrogen-demo/ (по состоянию на июль 2019 г.).
2. https://www.chemedx.org/blog/dry-ice-water-cloud (по состоянию на июль 2019 г.).).
3. Кунцлеман, Томас С., Форд, Натан, Но, Джин-Хван, Отт, Марк Э., Молекулярное объяснение того, как образуется туман при помещении сухого льда в воду, J. Chem. Эд. 2015 92
Концепции:
фазовые переходы
физические изменения
вода
Коллекция:
Демонстрации безопасности
09
9 9
Общая безопасность
Для лабораторных работ: См. Руководство ACS по безопасности химических лабораторий в средних школах (2016 г.).
Руководство ACS по безопасности химических лабораторий в средних школах (2016 г.).
Для демонстраций: Пожалуйста, обратитесь к Руководству по безопасности химических демонстраций отдела химического образования ACS.
Прочие ресурсы по безопасности
RAMP: Распознавание опасностей; Оценить риски опасностей; Свести к минимуму риски опасностей; Подготовка к чрезвычайным ситуациям
Безопасность: видеодемонстрация
Демонстрационные видеоматериалы, представленные здесь, не предназначены для обучения химическим методам демонстрации. Они предназначены для использования в классе. Демонстрации могут представлять угрозу безопасности или показывать явления, которые трудно наблюдать всему классу во время живой демонстрации.
Те, кто выполняет демонстрации, показанные в этом видео, прошли обучение и соблюдают передовые методы обеспечения безопасности.
Любой, кто собирается провести демонстрацию химии, должен сначала прочитать, а затем придерживаться Руководство по безопасности для демонстрации химии (2016 г. ) Эти рекомендации также доступны на веб-сайте ChemEd X.
) Эти рекомендации также доступны на веб-сайте ChemEd X.
НГСС
Научная практика: задавать вопросы и определять проблемы
Задание вопросов и определение задач в 9–12 классах основывается на опыте классов K–8 и переходит к формулированию, уточнению и оценке эмпирически проверяемых вопросов и проектных задач с использованием моделей и симуляций.
Резюме:
Задание вопросов и определение задач в 9–12 классах основывается на опыте классов K–8 и переходит к формулированию, уточнению и оценке эмпирически проверяемых вопросов и проектных задач с использованием моделей и симуляций.
вопросы, ставящие под сомнение предпосылки аргумента, интерпретацию набора данных или пригодность дизайна.
Граница оценки:
Уточнение:
Научные вопросы возникают по-разному. Ими может двигать любопытство к миру (например, почему небо голубое?). Они могут быть вдохновлены предсказаниями модели или теории или попытками расширить или уточнить модель или теорию (например, как модель частиц объясняет несжимаемость жидкостей?). Или они могут возникнуть в результате необходимости предоставить лучшие решения проблемы. Например, вопрос о том, почему нельзя откачивать воду выше 32 футов, привел Евангелиста Торричелли (изобретателя барометра XVII века) к его открытиям об атмосфере и идентификации вакуума.
Они могут быть вдохновлены предсказаниями модели или теории или попытками расширить или уточнить модель или теорию (например, как модель частиц объясняет несжимаемость жидкостей?). Или они могут возникнуть в результате необходимости предоставить лучшие решения проблемы. Например, вопрос о том, почему нельзя откачивать воду выше 32 футов, привел Евангелиста Торричелли (изобретателя барометра XVII века) к его открытиям об атмосфере и идентификации вакуума.
Вопросы также важны в технике. Инженеры должны уметь задавать наводящие вопросы, чтобы определить инженерную проблему. Например, они могут спросить: Какая потребность или желание лежит в основе проблемы? Каковы критерии (спецификации) успешного решения? Каковы ограничения? При выработке возможных решений возникают другие вопросы: будет ли это решение соответствовать критериям проектирования? Можно ли объединить две или более идей, чтобы получить лучшее решение?
Научная практика: построение объяснений и разработка решений
Построение объяснений и разработка решений в 9–12 базируется на опыте K–8 и переходит к объяснениям и проектам, которые поддерживаются многочисленными и независимыми источниками данных, созданными учащимися, в соответствии с научными идеями, принципами и теориями.
Резюме:
Построение объяснений и разработка решений в 9–12 основывается на опыте K–8 и переходит к объяснениям и проектам, которые поддерживаются многочисленными и независимыми источниками данных, созданными учащимися, в соответствии с научными идеями, принципами и теориями. Построить и пересмотреть объяснение, основанное на действительных и надежных доказательствах, полученных из различных источников (включая собственные исследования учащихся, модели, теории, симуляции, экспертные оценки) и предположении, что теории и законы, описывающие мир природы, действуют сегодня так же, как и раньше. в прошлом и будет продолжать делать это в будущем.
Граница оценки:
Уточнение:
Научная практика: разработка и использование моделей
Моделирование в 9–12 основывается на K–8 и переходит к использованию, синтезу и разработке моделей для прогнозирования и демонстрации взаимосвязей между переменными между системами и их компонентами в естественном и созданном мирах.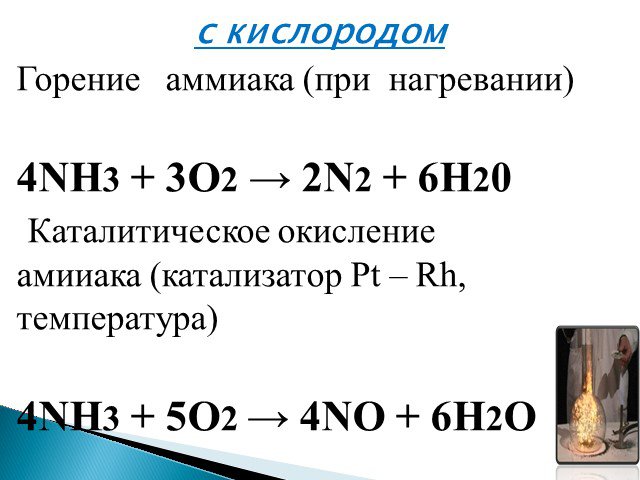
Резюме:
Моделирование в 9–12 основывается на K–8 и переходит к использованию, синтезу и разработке моделей для прогнозирования и демонстрации взаимосвязей между переменными между системами и их компонентами в естественном и созданном мирах. Используйте модель для прогнозирования взаимосвязей между системами или между компонентами системы.
Граница оценки:
Уточнение:
Научная практика: участие в аргументации, основанной на доказательствах
Построение объяснений и разработка решений в 9–12 базируется на опыте K–8 и переходит к объяснениям и проектам, которые поддерживаются многочисленными и независимыми источниками данных, созданными учащимися, в соответствии с научными идеями, принципами и теориями.
Резюме:
Построение объяснений и разработка решений в 9–12 базируется на опыте K–8 и переходит к объяснениям и проектам, которые поддерживаются многочисленными и независимыми источниками доказательств, созданными учащимися, в соответствии с научными идеями, принципами и теориями. Построить и пересмотреть объяснение, основанное на действительных и надежных доказательствах, полученных из различных источников (включая собственные исследования учащихся, модели, теории, симуляции, экспертные оценки) и предположении, что теории и законы, описывающие мир природы, действуют сегодня так же, как и раньше. в прошлом и будет продолжать делать это в будущем.
Построить и пересмотреть объяснение, основанное на действительных и надежных доказательствах, полученных из различных источников (включая собственные исследования учащихся, модели, теории, симуляции, экспертные оценки) и предположении, что теории и законы, описывающие мир природы, действуют сегодня так же, как и раньше. в прошлом и будет продолжать делать это в будущем.
Граница оценки:
Уточнение:
Научная практика: получение, оценка и передача информации
Участие в споре на основе доказательств в 9–12 основывается на опыте K–8 и переходит к использованию соответствующих и достаточных доказательств и научных рассуждений для защиты и критики утверждений и объяснений о естественных и созданных мирах. Аргументы могут также исходить из текущих научных или исторических эпизодов в науке.
Резюме:
Участие в аргументации на основе доказательств в 9–12 основывается на опыте K–8 и переходит к использованию соответствующих и достаточных доказательств и научных рассуждений для защиты и критики утверждений и объяснений о естественных и созданных мирах.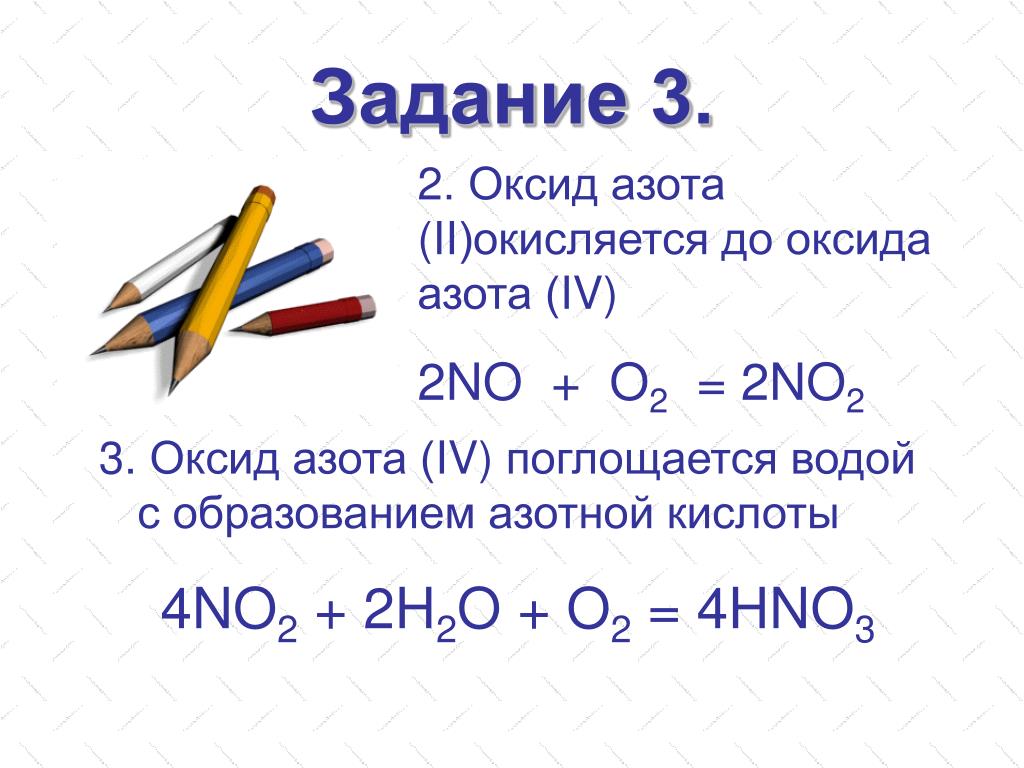 Аргументы могут также исходить из текущих научных или исторических эпизодов в науке.
Аргументы могут также исходить из текущих научных или исторических эпизодов в науке.
Оцените утверждения, доказательства и обоснование принятых в настоящее время объяснений или решений, чтобы определить достоинства аргументов.
Граница оценки:
Уточнение:
Научная практика: планирование и проведение исследований
Планирование и проведение расследований в 9-12 базируется на опыте K-8 и включает в себя исследования, которые предоставляют доказательства и тестируют концептуальные, математические, физические и эмпирические модели.
Резюме:
Планирование и проведение расследований в 9-12 основывается на опыте K-8 и включает в себя исследования, которые предоставляют доказательства и проверяют концептуальные, математические, физические и эмпирические модели. Планируйте и проводите расследование индивидуально и совместно, чтобы получить данные, которые послужат основой для доказательств, а в плане: определите типы, количество и точность данных, необходимых для получения надежных измерений, и учтите ограничения точности данных ( например, количество испытаний, стоимость, риск, время) и соответствующим образом уточнить план.
Граница оценки:
Уточнение:
HS-ESS2-5 Вода
Учащиеся, демонстрирующие понимание, могут планировать и проводить исследования свойств воды и ее воздействия на земные материалы и поверхностные процессы.
Дополнительную информацию обо всех DCI для HS-ESS2 можно найти https://www.nextgenscience.org/dci-arrangement/hs-ess2-earths-systems, а дополнительные ресурсы – на https://www.nextgenscience.org.
Резюме:
Учащиеся, демонстрирующие понимание, могут спланировать и провести исследование свойств воды и ее воздействия на земные материалы и поверхностные процессы.
Граница оценки:
Пояснение:
Упор делается на механические и химические исследования воды и различных твердых материалов, чтобы предоставить доказательства связи между гидрологическим циклом и системными взаимодействиями, известными как цикл горных пород.




 3.6 ГОСТ 9293-74
3.6 ГОСТ 9293-74