Алкены. Получение, химические свойства и применение алкенов. Алкен вода
Физические и химические свойства алкенов
Общая формула гомологического ряда алкенов (табл. 2) – Cnh3n
Таблица 2. Гомологический ряд алкенов.
|
Этен (этилен) |
C2h5 (Сh3 = Ch3) |
|
Пропен (пропилен) |
C3H6 (Сh3 = CH-Ch4) |
|
Бутен |
C4H8 |
|
Пентен |
C5h20 |
|
Гексен |
C6h22 |
|
Гептен |
C7h24 |
|
Октен |
C8h26 |
|
Нонен |
C9h28 |
|
Декен |
C10h30 |
Углеводородные радикалы, образованные от алкенов: -CH = Ch3 – винил и –СН2-СН = СН2 – аллил.
Для алкенов, начиная с бутена, характерна изомерия углеродного скелета:
Ch3 = CH-Ch3-Ch4 (бутен-1)
СН2-С(СН3)-СН3 (2-метилпропен-1)
и положения двойной связи:
Ch3 = CH-Ch3-Ch4 (бутен-1)
Ch4-C = CH-Ch4 (бутен-2)
Для алкенов, начиная с бутена-2, характерна геометрическая (цис-транс) изомерия (рис. 1).
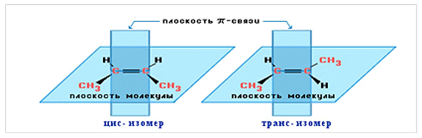
Рис. 1. Геометрические изомеры бутена-2.
Для алкенов, начиная с пропена, характерна межклассовая изомерия с циклоалканами. Так, составу C4H8 отвечают вещества класса алкенов и циклоалканов – бутен-1(2) и циклобутан.
Атомы углерода в молекулах алкенов находятся в sp2-гибридизациии: 3σ-связи располагаются в одной плоскости под углом 120 друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
Химические свойства алкенов
Большинство химических реакций алкенов протекают по механизму электрофильного присоединения:
— гидрогалогенирование – взаимодействие алкенов с галогенводородами (HCl, HBr), протекающее по правилу Марковникова (при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрированному атому углерода при двойной связи)
Ch4-CH = Ch3 + HCl = Ch4-CHCl-Ch4
— гидратация — взаимодействие алкенов с водой в присутствии минеральных кислот (серной, фосфорной) с образованием спиртов, протекающее по правилу Марковникова
Ch4-C(Ch4) = Ch3 + h3O = Ch4-C(Ch4)OH-Ch4
— галогенирование — взаимодействие алкенов с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды
Ch3 = Ch3 + Br2 = BrCh3-Ch3Br
При нагревании смеси алкена с галогеном до 500 С возможно замещение атома водорода алкена по радикальному механизму:
С возможно замещение атома водорода алкена по радикальному механизму:
Ch4-CH = Ch3 + Cl2 = Cl-Ch3-CH = Ch3 + HCl
По радикальному механизму протекает реакция гидрирования алкенов. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
Ch3 = Ch3 + h3 = Ch4-Ch4
Алкены способны окисляться с образованием различных продуктов, состав которых зависит от условий проведения реакции окисления. Так, при окислении в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомных спиртов:
3Ch3 = Ch3 + 2KMnO4 +4h3O = 3Ch3(OH)-Ch3(OH) +2MnO2 + 2KOH
При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием кетоны, карбоновых кислот или углекислого газа:
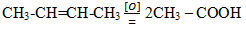
Окисление этилена кислородом при 200 С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
Ch3 = Ch3 +1/2O2 = Ch4-CH = O
Алкены вступают в реакции полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов. Так, полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n Ch3 = Ch3 = -(-Ch3-Ch3-)n—
Физические свойства алкенов
При обычных условиях С2-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение алкенов
Основные способы получения алкенов:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
Ch4-Ch3-CHBr-Ch4 + KOH = Ch4-CH = CH-Ch4 + KBr + h3O
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Ch4-CHCl-CHCl-Ch4 + Zn = ZnCl2 + Ch4-CH = CH-Ch4
— дегидратация спиртов при их нагревании с серной кислотой (t >150 C) или пропускании паров спирта над катализатором
C) или пропускании паров спирта над катализатором
Ch4-CH(OH)- Ch4 = Ch4-CH = Ch3 + h3O
— дегидрирование алканов при нагревании (500 С) в присутствии катализатора (Ni, Pt, Pd)
С) в присутствии катализатора (Ni, Pt, Pd)
Ch4-Ch3 — Ch4 = Ch4-CH = Ch3 + h3
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Примеры решения задач
ru.solverbook.com
Алкены — номенклатура, получение, характерные химические свойства » HimEge.ru
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Строение алкенов
Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n. Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел. Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталейсоседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталейсоседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.

Строение этилена

Образование двойной связи в алкенах
Гомологический ряд этена
Неразветвленные алкены составляют гомологи- ческий ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен, С7Н14 — гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
 Особым видом структурной изомерии является изомерия положения двойной связи:
Особым видом структурной изомерии является изомерия положения двойной связи:

Алкены изомерны циклоалканам (межклассовая изомерия), например:

Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- и транс-изомерии.

 Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.Например,правильное название соединения:

5-метилгексен-2
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.

3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов. Например:

Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:

Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.3. Гидрогалогенирование (присоединение галогеноводорода).
 Эта реакция подчиняется правилу Марковникова:При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
Эта реакция подчиняется правилу Марковникова:При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.

 4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.

Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.

Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
 Эта реакция присоединения протекает по свободнорадикальному механизму.Реакции окисления.1. Горение. Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
Эта реакция присоединения протекает по свободнорадикальному механизму.Реакции окисления.1. Горение. Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
 2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:




himege.ru
Получение. Свойства - Алкены - Углеводороды с двойной связью - Органическая химия
Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Например, пентан имеет температуру кипения 36 °С, а пентен-1 — 30 °С. При обычных условиях алкены С2 — С4 — газы. С5– С15 — жидкости, начиная с C16 — твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
| t | ||
| С8Н18 | → | С4Н10 + С4Н8 |
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С).
2. Другой промышленный способ получения алкенов — дегидрирование алканов:
| t, Cr2O3 | ||
| СН3-СН2-СН3 | → | СН3-СН=СН2 + Н2 |
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная p-связь. К таким реакциям относятся следующие.
1) Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С:
| h3SO4 | ||
| СН3-СН2-ОН | → | СН2=СН2 + Н2О |
2) Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на моноалкилгалогениды:
| С2Н6ОН | ||
| СН3-СН2-СНВr-СН3 + КОН | → | СН3-СН=СН-СН3 + КВr + Н2О |
При отщеплении Н2O от спиртов, НВr и HCl от алкилгалогенидов атом водорода преимущественно отщепляется от того из соседних атомов углерода, который связан с наименьшим числом атомов водорода (от наименее гидрогенизированного атома углерода). Эта закономерность носит название правила Зайцева.
3) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
Ch3Br—CHBr—Ch4 + Mg → СН2=СН-СН3 + MgВr2.
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность p-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения, обозначаемому символом AE(от англ, addition electrophilic). Реакции злектрофильного присоединения это ионные процессы, протекающие в несколько стадий.
На первой стадии электрофильная частица (чаще всего это бывает протон H+) взаимодействует с p-электронами двойной связи и образует p-комплекс, который затем превращается в карбокатион путем образования ковалентной s-связи между электрофильной частицей и одним из атомов углерода:
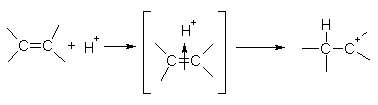
алкен p-комплекс карбокатион
На второй стадии карбокатион реагирует с анионом X—, образуя вторую s-связь за счет электронной пары аниона:
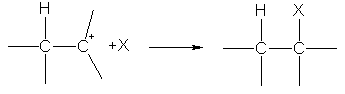
Ион водорода в реакциях электрофильного присоединения присоединяется к тому из атомов углерода при двойной связи, на котором больше отрицательный заряд. Распределение зарядов определяется смещением p-электронной плотности под влиянием заместителей: 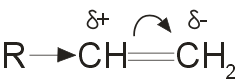 .
.
Электронодонорные заместители, проявляющие +I -эффект, смещают p-электронную плотность к более гидрогенизированному атому углерода и создают на нем частичный отрицательный заряд. Этим объясняется правило Марковникова: при присоединении полярных молекул типа НХ(X= Hal, ОН, CN и т.п.) к несимметричным алкенам водород преимущественно присоединяется к более гидрогенизированному атому углерода при двойной связи.
Рассмотрим конкретные примеры реакций присоединения.
1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (HCl, НВr) образуются алкилгалогениды:
СН3-СН=СН2 + НВr ® СН3-СНВr-СН3.
Продукты реакции определяются правилом Марковникова.
Следует, однако, подчеркнуть, что в присутствии какого-либо органического пероксида полярные молекулы НХ реагируют с алкенами не по правилу Марковникова:
| R-O-O-R | ||
| СН3-СН=СН2 + НВr | → | СН3-СН2-СН2Вr |
Это связано с тем, что присутствие перекиси обусловливает радикальный, а не ионный механизм реакции.
2) Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
СН3-СН=СН2 + НОН ® СН3-СН(ОН)-СН3.
3) Галогенирование. Алкены обесцвечивают бромную воду:
СН2=СН2 + Вr2 ® ВrСН2-СН2Вr.
Эта реакция является качественной на двойную связь.
4) Гидрирование. Присоединение водорода происходит под действием металлических катализаторов:
| t, Ni | ||
| СН3-СН=СН2 + Н2 | → | СН3-СН2-СН3 |
5) Полимеризация алкенов и их производных в присутствии кислот протекает по механизму АE:
| Н* | ||
| nCh3=CHR | → | (-Ch3-CHR-)n |
где R = Н, СН3, Cl, С6Н5 и т.д. Молекула Ch3=CHR называется мономером, полученное соединение — полимером , число n-степень полимеризации.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и другие.
Кроме присоединения, для алкенов характерны также реакции окисления. При мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера) образуются двухатомные спирты:
ЗСН2=СН2 + 2КМnО4 + 4Н2О ® ЗНОСН2-СН2ОН + 2MnO2↓ + 2KOH.
В результате протекания этой реакции фиолетовый раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV). Эта реакция, как и реакция обесцвечивания бромной воды, является качественной на двойную связь. При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2, например:
| [О] | ||
| СН3-СН=СН-СН3 | → | 2СН3-СООН |
По продуктам окисления можно установить положение двойной связи в исходном алкене.
Как и все другие углеводороды, алкены горят, и при обильном доступе воздуха образуют диоксид углерода и воду:
СnН2n + Зn/2О2 ® nСО2↑ + nН2О.
При ограниченном доступе воздуха горение алкенов может приводить к образованию монооксида углерода и воды:
СnН2n + nО2 ® nCO↑ + nh3O.
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 200°С серебряным катализатором, то образуется оксид алкена (эпоксиалкан), например:
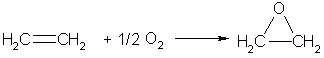
При любых температурах алкены окисляются озоном (озон более сильный окислитель, чем кислород). Если газообразный озон пропускают через раствор какого-либо алкена в тетрахлор-метане при температурах ниже комнатной, то происходит реакция присоединения, и образуются соответствующие озониды (циклические перекиси). Озониды очень неустойчивы и могут легко взрываться. Поэтому обычно их не выделяют, а сразу после получения разлагают водой — при этом образуются карбонильные соединения (альдегиды или кетоны), строение которых указывает на строение подвергавшегося озонированию алкена.
Низшие алкены — важные исходные вещества для промышленного органического синтеза. Из этилена получают этиловый спирт, полиэтилен, полистирол. Пропен используют для синтеза полипропилена, фенола, ацетона, глицерина.
www.himhelp.ru
Общая формула алкенов. Свойства и характеристика алкенов
Самыми простыми органическими соединениями являются предельные и непредельные углеводороды. К ним относят вещества класса алканов, алкинов, алкенов.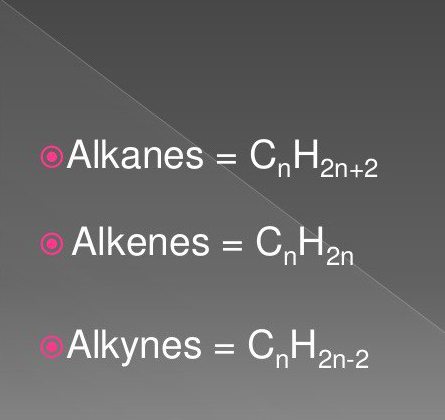
Формулы их включают атомы водорода и углерода в определенной последовательности и количестве. Они часто встречаются в природе.
Определение алкенов
Другое их название – олефины или углеводороды этиленовые. Именно так назвали данный класс соединений в 18 столетии при открытии маслянистой жидкости − хлористого этилена.
К алкенам относятся вещества, состоящие из водородных и углеродных элементов. Они относятся к ациклическим углеводородам. В их молекуле присутствует единственная двойная (ненасыщенная) связь, соединяющая два углеродных атома между собой.
Формулы алкенов
Каждый класс соединений имеет свое химическое обозначение. В них символами элементов периодической системы указывается состав и структура связи каждого вещества.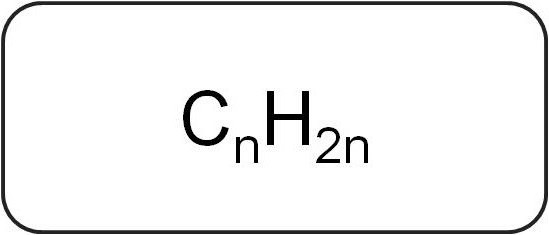
Общая формула алкенов обозначается следующим образом: Cnh3n, где число n больше или равняется 2. При ее расшифровке видно, что на каждый атом углерода приходится по два атома водорода.
Молекулярные формулы алкенов из гомологического ряда представлены следующими структурами: C2h5, C3H6,C4H8, C5h20, C6h22, C7h24, C8h26, C9h28, C10h30. Видно, что каждый последующий углеводород содержит на один больше углерода и на 2 больше водорода.
Существует графическое обозначение расположения и порядка химических соединений между атомами в молекуле, которое показывает формула алкенов структурная. С помощью валентных черточек обозначается связь углеродов с водородами.
Формула алкенов структурная может быть изображена в развернутом виде, когда показываются все химические элементы и связи. При более кратком выражении олефинов не показывается соединение углерода и водорода с помощью валентных черточек.
Формулой скелетной обозначают самую простую структуру. Ломаной линией изображают основу молекулы, в которой атомы углерода представлены ее верхушками и концами, а звеньями указывают водород.
Как образуются наименования олефинов
Исходя из систематической номенклатуры, формулы алкенов и их названия составляют из структуры алканов, относящихся к предельным углеводородам. Для этого в наименовании последних суффикс -ан заменяют на -илен или -ен. Примером может служить образование бутилена из бутана, а пентена из пентана.
Для обозначения положения связи двойной относительно атомов углерода указывают арабскую цифру в конце наименования.
В основе названия алкенов лежит обозначение углеводорода с самой длинной цепочкой, в которой присутствует двойная связь. За начало нумерации цепи обычно выбирают конец, который ближе всего расположен к непредельному соединению атомов углерода.
Если структурная формула алкенов имеет ответвления, то указывают названия радикалов и их количество, а перед ними ставят цифры, соответствующие месту в углеродной цепочке. Затем следует наименование самого углеводорода. После цифр обычно ставят дефис.
Существуют непредельные радикальные ответвления. Их названия могут быть тривиальными или образуются по правилам номенклатуры систематической.
Например, ННС=СН- именуется этенилом или винилом.
Изомеры
Молекулярные формулы алкенов не могут указывать на изомерию. Однако для данного класса веществ, за исключением этиленовой молекулы, присуще пространственное видоизменение.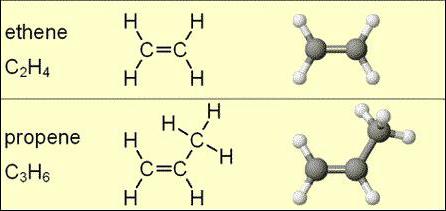
Изомеры этиленовых углеводородов могут быть по углеродному скелету, по положению непредельной связи, межклассовые или пространственные.
Общая формула алкенов определяет количество атомов углерода и водорода в цепочке, однако по ней не видно наличие и расположение двойной связи. Примером может служить циклопропан как межклассовый изомер C3H6 (пропилена). Другие виды изомерии проявляются у C4H8 или бутена.
Разное положение непредельной связи наблюдается у бутена-1 или бутена-2, в первом случае двойное соединение находится возле первого атома углерода, а во втором – в середине цепи. Изомерию по углеродному скелету можно рассмотреть на примере метилпропена (Ch4-C(Ch4)=Ch3) и изобутилена ((СН3)2С=СН2).
Пространственное видоизменение присуще бутену-2 в транс- и цис- положении. В первом случае боковые радикалы располагаются сверху и снизу от основной углеродной цепи с двойной связью, во втором изомере заместители находятся на одной стороне.
Характеристика олефинов
Общая формула алкенов определяет физическое состояние всех представителей данного класса. Начиная с этилена и заканчивая бутиленом (от С2 до С4), вещества существуют в газообразном виде. Так у бесцветного этена имеется сладковатый запах, малая растворимость в воде, молекулярная масса меньше, чем у воздуха.
В жидкой форме представлены углеводороды гомологического промежутка от С5 до С17. Начиная с алкена, имеющего в основной цепи 18 атомов углерода, происходит переход физического состояния в твердую форму.
Всем олефинам причисляют растворимость плохую в водной среде, зато хорошую в растворителях органической природы, типа бензола или бензина. Их молекулярная масса меньше, чем у воды. Увеличение углеродной цепочки приводит к повышению температурных показателей при плавлении и кипении данных соединений.
Свойства олефинов
Структурная формула алкенов показывает наличие в скелете двойной связи из π- и σ- соединения двух атомов углерода. Такое строение молекулы обуславливает ее химические свойства. Связь-π считается не очень прочной, что дает возможность ее разрушать с формированием новых двух связей-σ, которые получаются в результате присоединения пары атомов. Ненасыщенные углеводороды являются электронными донорами. Они принимают участие в процессах присоединения по электрофильному типу.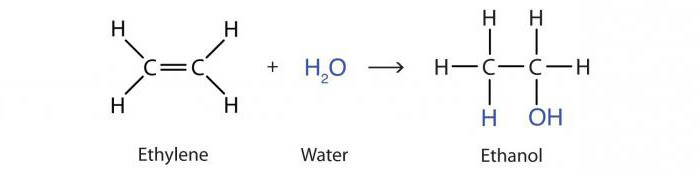
Важным химическим свойством всех алкенов является процесс галогенирования с выделением соединений, подобным дигалогенопроизводным веществам. Галогеновые атомы способны прикрепляться по двойному соединению к углеродам. Примером может служить бромирование пропилена с формированием 1,2-дибромпропана:
h3C=CH–Ch4 + Br2 → BrCh3–CHBr–Ch4.
Данный процесс нейтрализации цвета в бромной воде алкенами считается качественным доказательством наличия двойной связи.
К важным реакциям относится гидрирование олифинов с присоединением молекулы водорода под действием каталитических металлов типа платины, палладия или никеля. В результате получаются углеводороды с насыщенной связью. Формулы алканов, алкенов приведены ниже в реакции гидрирования бутена:
Ch4–Ch3–CH=Ch3 + h3 Ni→ Ch4–Ch3–Ch3–Ch4.
Процесс присоединения молекулы галогеноводорода к олефинам называется гидрогалогенированием, проходящим по правилу, открытому Марковниковым. Примером может служить гидробромирование пропилена с образованием 2-бромпропана. В нем водород соединяется при двойной связи с углеродом, который считается наиболее гидрогенизированным:
Ch4–CH=Ch3 + HBr → Ch4–BrCH–Ch4.
Реакция присоединения алкенами воды под действием кислот носит название гидратации. В результате получается молекула спирта пропанола-2:
Ch4–HC=Ch3 + h3O → Ch4–OHCH–Ch4.
При воздействии на алкены кислотой серной происходит процесс сульфирования:
Ch4–HC=Ch3 + HO−OSO−OH → Ch4–Ch4CH–O−SO2−OH.
Реакция протекает с образованием кислых эфиров, например, изопропилсерной кислоты.
Алкены подвержены окислению во время их сжигания при действии кислорода с формированием воды и газа углекислого:
2Ch4–HC=Ch3 + 9O2 → 6CO2 + 6h3O.
Взаимодействие олефиновых соединений и разбавленного калия перманганата в форме раствора приводит к возникновению гликолей или спиртов двухатомного строения. Данная реакция также является окислительной с образованием этиленгликоля и обесцвечиванием раствора:
3h3C=Ch3 + 4h3O+ 2KMnO4 → 3OHCH–CHOH+ 2MnO2 +2KOH.
Молекулы алкенов могут быть задействованы в процессе полимеризации со свободнорадикальным или катионно-анионным механизмом. В первом случае под влиянием пероксидов получается полимер типа полиэтилена.
По второму механизму катионными катализаторами выступают кислоты, а анионными являются вещества металлорганические с выделением стереоселективного полимера.
Что такое алканы
Их еще называют парафинами или предельными ациклическими углеводородами. Они обладают линейной или разветвлённой структурой, в которой содержатся только насыщенные простые связи. Все представители гомологического ряда данного класса имеют общую формулу Cnh3n+2.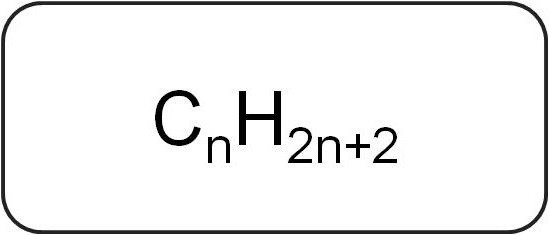
В их составе присутствуют только атомы углерода и водорода. Общая формула алкенов образуется из обозначения предельных углеводородов.
Названия алканов и их характеристика
Самым простым представителем данного класса является метан. За ним следуют вещества типа этана, пропана и бутана. В основе их названия лежит корень числительного на греческом языке, к которому прибавляют суффикс -ан. Наименования алканов занесены в IUPAC номенклатуру.
Общая формула алкенов, алкинов, алканов включает только две разновидности атомов. К ним относятся элементы углерода и водорода. Количество углеродных атомов во всех трех классах совпадает, отличие наблюдается только в численности водорода, который может отщепляться или присоединяться. Из насыщенных углеводородов получают ненасыщенные соединения. У представителей парафинов в молекуле содержится на 2 атома водорода больше, чем у олефинов, что подтверждает общая формула алканов, алкенов. Алкенов структура считается ненасыщенной за счет наличия двойной связи.
Если соотнести число водородных и углеродных атомов в алканах, то значение будет максимальным в сравнении с другими классами углеводородов.
Начиная с метана и заканчивая бутаном (от С1 до С4), вещества существуют в газообразном виде.
В жидкой форме представлены углеводороды гомологического промежутка от С5 до С16. Начиная с алкана, имеющего в основной цепи 17 атомов углерода, происходит переход физического состояния в твердую форму.
Для них характерна изомерия по углеродному скелету и оптические видоизменения молекулы.
В парафинах углеродные валентности считаются полностью занятыми соседними углеродами или водородами с образованием связи σ-типа. С химической точки зрения это обуславливает их слабые свойства, именно поэтому алканы носят название предельных или насыщенных углеводородов, лишенных сродства.
Они вступают в реакции замещения, связанные с галогенированием по радикальному типу, сульфохлорированием или нитрованием молекулы.
Парафины подвергаются процессу окисления, горения или разложения при высоких температурах. Под действием ускорителей реакций происходит отщепление атомов водорода или дегидрирование алканов.
Что такое алкины
Их еще называют ацетиленовыми углеводородами, у которых в цепочке углеродной присутствует тройная связь. Структура алкинов описывается общей формулой Cnh3n–2. Из нее видно, что в отличие от алканов, у ацетиленовых углеводородов недостает четыре атома водорода. Их заменяет тройная связь, образованная двумя π- соединениями.
Такое строение обуславливает химические свойства данного класса. Структурная формула алкенов и алкинов наглядно показывает ненасыщенность их молекул, а также наличие двойной (h3C꞊Ch3) и тройной (HC≡CH) связи.
Наименование алкинов и их характеристика
Самым простым представителем является ацетилен или HC≡CH. Его также именуют этином. Происходит оно от названия насыщенного углеводорода, в котором убирают суффикс -ан и добавляют -ин. В наименованиях длинных алкинов цифрой указывают расположение тройной связи.
Зная строение углеводородов насыщенных и ненасыщенных, можно определить, под какой буквой обозначена общая формула алкинов: а) Cnh3n; в) Cnh3n+2; c) Cnh3n-2; г) Cnh3n-6. Правильным ответом будет третий вариант.
Начиная с ацетилена и заканчивая бутаном (от С2 до С4), вещества имеют газообразную природу.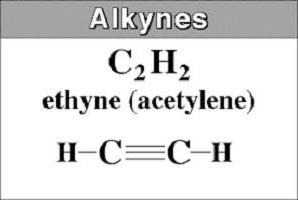
В жидкой форме находятся углеводороды гомологического промежутка от С5 до С17. Начиная с алкина, имеющего в основной цепи 18 атомов углерода, происходит переход физического состояния в твердую форму.
Для них характерна изомерия по углеродному скелету, по положению связи тройной, а также межклассовые видоизменения молекулы.
По химическим характеристикам ацетиленовые углеводороды подобны алкенам.
Если у алкинов тройная связь концевая, то они выполняют функцию кислоты с образованием солей алкинидов, например, NaC≡CNa. Наличие двух π-связей делает молекулу ацетиледина натрия сильным нуклеофилом, вступающим в реакции замещения.
Ацетилен подвергается хлорированию в присутствии хлорида меди с получением дихлорацетилена, конденсации под действием галогеналкинов с выделением диацетиленовых молекул.
Алкины участвуют в реакциях присоединения электрофильного, принцип которых лежит в основе галогенирования, гидрогалогенирования, гидротации и карбонилирования. Однако такие процессы протекают слабее, чем у алкенов с двойной связью.
Для ацетиленовых углеводородов возможны реакции присоединения по нуклеофильному типу молекулы спирта, первичного амина или сероводорода.
fb.ru
Алкены. Химические свойства
Для алкенов характерны, прежде всего, реакции присоединения по двойной связи. В основном эти реакции идут по ионному механизму. Пи-связь разрывается, и образуются две новые сигма-связи. Напомню, что для алканов типичными были реакции замещения и шли они по радикальному механизму. Присоединяться к алкенам могут молекулы водорода, эти реакции называются гидрирование, молекулы воды, гидратация, галогены галогенирование, галогенводороды гидрогалогенирование. Но обо всем по порядку.
Реакции присоединения по двойной связи
Итак, первое химическое свойство способность присоединять галогеноводороды, гидрогалогенирование.
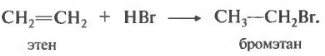
Пропен и остальные алкены реагируют с галогеноводородами по правилу Марковникова.
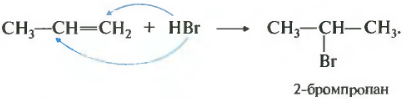
Атом водорода присоединяется к наиболее гидрированному, или правильнее сказать гидрогенизированному, атому углерода.
Вторым номером в нашем списке свойств будет гидратация, присоединение воды.
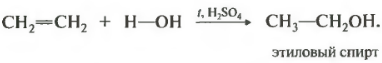
Реакция проходит при нагревании в присутствии кислоты обычно серной или фосфорной. Присоединение воды происходит также по правилу Марковникова, то есть первичный спирт можно получить только гидратацией этилена, остальные неразветвленные алкены дают вторичные спирты.
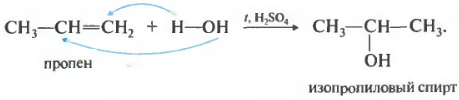
И для гидрогалогениерования и для гидратации существуют исключения из правила Марковникова. Во-первых, против этого правила присоединение протекает в присутствии пероксидов.
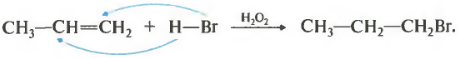
Во-вторых, для производных алкенов, в которых присуствуют электронноакцепторне группы. Например, для 3,3,3-трифторпропена-1.
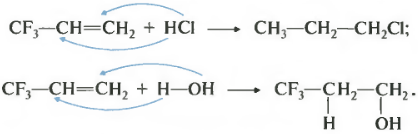
Атомы фтора за счет высокой электроотрицательности оттягивают на себя электронную плотность по цепи сигма-связей. Такое явление называется отрицательным индуктивным эффектом.
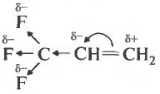
Из-за этого происходит смещение подвижных пи-электронов двойной связи и у крайнего атома углерода оказывается частичный положительный заряд, который обычно обозначается как дельта плюс. Именно к нему и пойдет отрицательно заряженный ион брома, а катион водорода присоединится к наименее гидрированному атому углерода.
Помимо трифторметильной группы отрицательным индуктивным эффектом обладает, например, трихлорметильная группа, нитрогруппа, карбоксильная группа и некоторые другие.
Этот второй случай нарушения правила Марковникова в ЕГЭ встречается очень редко, но все-таки желательно иметь его в виду, если вы планируете сдать экзамен на максимальный балл.
Третье химическое свойство присоединение молекул галогенов.
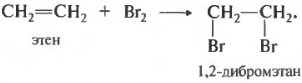
В первую очередь это касается брома, поскольку данная реакция является качественной на кратную связь. При пропускании, например, этилена через бромную воду, то есть раствор брома в воде, имеющий коричневый цвет, происходит ее обесцвечивание. Если пропускать через бромную воду смесь газов, например, этан и этен, то можно получить чистый этан без примеси этена, поскольку тот останется в реакционной колбе в виде дибромэтана, представляющего собой жидкость.
Особым образом стоит отметить реакцию алкенов в газовой фазе при сильном нагревании, например, с хлором.
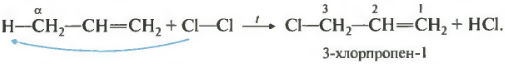
При таких условиях протекает не реакция присоединения, а реакция замещения. При чем исключительно по альфа-атому углерода, то есть атому, соседствующему с двойной связью. В данном случае получается 3-хлорпропен-1. Эти реакции на экзамене встречаются нечасто, поэтому большинство учеников их не помнит и, как правило, совершает ошибки.
Четвертым номером идет реакция гидрирования, а вместе с ней и реакция дегидрирования. То есть присоединение или отщепление водорода.
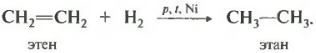
Гидрирование происходит при не очень высокой температуре на никелевом катализаторе. При более высокой температуре возможно дегидрирование с получением алкинов.

Пятым свойством алкенов является способность к полимеризации, когда сотни и тысячи молекул алкена за счет разрыва пи-связи и образования сигма-свзяей друг с другом образуют очень длинные и прочные цепочки.
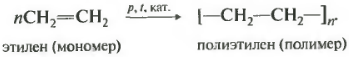
В данном случае получился полиэтилен. Обратите внимание, что в получившейся молекуле кратные связи отсутствуют. Такие вещества называются полимерами, исходные молекулы называются мономерами, повторяющийся фрагмент это элементарное звено полимера, а число n степень полимеризации.
Также возможны реакции получения других важных полимерных материалов, например, полипропилена.
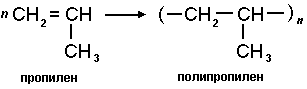
Еще один важный полимер поливинилхлорид.
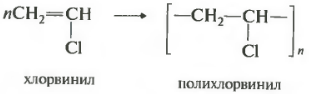
Исходным веществом для производства этого полимера является хлорэтен, тривиальное название которого винилхлорид. Поскольку этот непредельный заместитель называется винил. Часто встречающаяся аббревиатура на пластмассовых изделиях ПВХ как раз расшифровывается как поливинилхлорид.
Мы обсудили пять свойств, которые представляли собой реакции присоединения по двойной связи. Теперь обратимся к реакциям окисления.
Реакции окисления алкенов
Шестое химическое свойство в нашем общем списке это мягкое окисление или реакция Вагнера. Оно протекает при воздействии на алкен водным раствором перманганата калия на холоду, поэтому часто в экзаменационных заданиях указывают температуру ноль градусов.
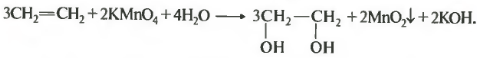
В результате получается двухатомный спирт. В данном случае этиленгликоль, а в целом такие спирты носят общее название гликоли. В процессе реакции фиолетово-розовый раствор перманганата обесцвечивается, поэтому эта реакция также является качественной на двойную связь. Марганец в нейтральной среде из степени окисления +7 восстанавливается до степени окисления +4. Рассмотрим еще несколько примеров. УРАВНЕНИЕ
Здесь получился пропандиол-1,2. Однако таким же образом будут реагировать и циклические алкены. УРАВНЕНИЕ
Еще один вариант, когда двойная связь находится, например, в боковой цепи ароматических углеводородов. Регулярно в заданиях егэ встречается реакция Вагнера с участием стирола, его второе название винилбензол.
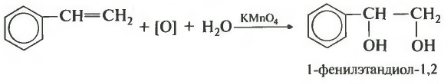
Я надеюсь, что представил вашему вниманию достаточно примеров, чтобы вы поняли, что мягкое окисление двойной связи всегда подчиняется довольно простому правилу пи-связь разрывается и к каждому атому углерода присоединяется гидроксигруппа.
Теперь, что касается жесткого окисления. Это будет наше седьмое свойство. Такое окисление происходит, когда алкен реагирует с кислотным раствором перманганата калия при нагревании.
Происходит деструкция молекулы, то есть ее разрушение по двойной связи. В случае бутена-2 получились две молекулы уксусной кислоты. В целом же, по продуктам окисления можно судить о положении кратной связи в углеродной цепи.
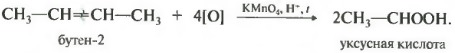
При окислении бутена-1 получается молекула пропионовой (пропановой) кислоты и углекислый газ.

В случае этилена получится две молекулы углекислого газа. Во всех случаях в кислой среде марганец из степени окисления +7 восстанавливается до +2.
И, наконец, восьмое свойство полное окисление или горение.
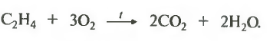
Алкены сгорают, как и другие углеводороды, до углекислого газа и воды. Запишем уравнение сгорания алкенов в общем виде.
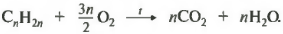
Молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле алкена, поскольку в состав молекулы CO2 входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа плюс n из воды, итого 3n. Слева атомов кислорода столько же, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть 3n/2 молекул кислорода. Можно записать 1,5n.
Мы рассмотрели восемь химических свойств алкенов.
stepenin.ru
Тема №17 «Алкены» | CHEM-MIND.com
Алкены
Оглавление
- Непредельные углеводороды
- Строение алкенов
- Гомологический ряд алкенов
- Изомерия и номенклатура алкенов
- Физические свойства алкенов
- Химические свойства алкенов
- Шпаргалка
- Задания для самопроверки

Непредельные углеводороды
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.

Строение алкенов
Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от англ. oil — масло).
Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной.

Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π-связи.
Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π-связь, располагаются перпендикулярно плоскости молекулы.
Двойная связь (0,132 нм) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.

Гомологический ряд алкенов
Первые три члена гомологического ряда алкенов газы, с C5h20 до C17h44 – жидкости, с C18h46 – твердые вещества. Жидкие и твердые алкены практически нерастворимы в воде, но хорошо растворимы в органических растворителях.
В соответствии с правилами ИЮПАК, в названии гомологов ряда алкенов используется суффикс -ен. Положение двойной связи указывается с помощью цифры, обозначающей месторасположение связи. Цифра проставляется после названия основной цепи через дефис. Нумерация атомов в молекуле алкена начинается с того конца, к которому ближе связь, например, алкен, отвечающий формуле Ch4−Ch3−CH=CH−Ch4 следует называть пентен-2, поскольку связь начинается у второго атома углерода, начиная с конца цепи.
Неразветвленные алкены составляют гомологический ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, C4H8 — бутен, С5Н10 — пентен, С6Н12 — гексен и т. д.
Изомерия и номенклатура алкенов
Для алкенов, так же как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен.

Особым видом структурной изомерии является изомерия положения двойной связи:

Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- транс-изомерии.

Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:

Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:

5-метилгексен-2, а не 2-метилгексен-4, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.

3. Формирование названия. Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов. Например:


Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.

Химические свойства алкенов
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:

Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (CCl4) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов:

3. Гидрогалогенирование (присоединение галогеноводорода).

Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:

Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.

Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:

Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение. Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:

2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:

Химические свойства алкенов - конспект



Шпаргалка
 Алкены
Алкены

Справочный материал для прохождения тестирования:
 Таблица Менделеева
Таблица Менделеева  Таблица растворимости
Таблица растворимости www.chem-mind.com
Алкены. Получение, химические свойства и применение алкенов
Разделы: Химия
Тема урока: Алкены. Получение, химические свойства и применение алкенов.
Цели и задачи урока:
- рассмотреть конкретные химические свойства этилена и общие свойства алкенов;
- углубить и конкретизировать понятия о ?-связи, о механизмах химических реакций;
- дать первоначальные представления о реакциях полимеризации и строении полимеров;
- разобрать лабораторные и общие промышленные способы получения алкенов;
- продолжить формирование умения работать с учебником.
Оборудование: прибор для получения газов, раствор КМnO4, этиловый спирт, концентрированная серная кислота, спички, спиртовка, песок, таблицы «Строение молекулы этилена», «Основные химические свойства алкенов», демонстрационные образцы «Полимеры».
ХОД УРОКА
I. Организационный момент
Мы продолжаем изучение гомологического ряда алкенов. Сегодня нам предстоит рассмотреть способы получения, химические свойства и применение алкенов. Мы должны охарактеризовать химические свойства, обусловленные двойной связью, получить первоначальные представления о реакциях полимеризации, рассмотреть лабораторные и промышленные способы получения алкенов.
II. Активизация знаний учащихся
- Какие углеводороды называются алкенами?
- Каковы особенности их строения?
- В каком гибридном состоянии находятся атомы углерода, образующие двойную связь в молекуле алкена?
Итог: алкены отличаются от алканов наличием в молекулах одной двойной связи, которая обуславливает особенности химических свойств алкенов, способов их получения и применения.

III. Изучение нового материала
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C8h28 ––> C4H8
+ C4h20; (термический крекинг при 400-700 oС)
октан
бутен
бутан
– дегидрирование алканов C4h20 ––> C4H8
+ h3; (t, Ni)
бутан
бутен
водород
– дегидрогалогенирование галогеналканов C4H9Cl
+ KOH ––> C4H8 + KCl
+ h3O;
хлорбутан
гидроксид бутен
хлорид
вода
калия
калия
– дегидрогалогенирование дигалогеналканов  – дегидратация спиртов С2Н5ОН ––> С2Н4
+ Н2О (при нагревании в присутствии
концентрированной серной кислоты)Запомните! При реакиях
дегидрирования, дегидратации,
дегидрогалогенирования и дегалогенирования
нужно помнить, что водород преимущественно
отрывается от менее гидрогенизированных атомов
углерода (правило Зайцева, 1875 г.)
– дегидратация спиртов С2Н5ОН ––> С2Н4
+ Н2О (при нагревании в присутствии
концентрированной серной кислоты)Запомните! При реакиях
дегидрирования, дегидратации,
дегидрогалогенирования и дегалогенирования
нужно помнить, что водород преимущественно
отрывается от менее гидрогенизированных атомов
углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов
Характер углерод – углеродной связи
определяет тип химических реакций, в которые
вступают органические вещества. Наличие в
молекулах этиленовых углеводородов двойной
углерод – углеродной связи обуславливает
следующие особенности этих соединений:
– наличие двойной связи позволяет отнести
алкены к ненасыщенным соединениям. Превращение
их в насыщенные возможно только в результате
реакций присоединения, что является основной
чертой химического поведения олефинов;
– двойная связь представляет собой значительную
концентрацию электронной плотности, поэтому
реакции присоединения носят электрофильный
характер;
– двойная связь состоит из одной  - и одной
- и одной  -связи, которая достаточно легко
поляризуется.
-связи, которая достаточно легко
поляризуется.

Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.

Запомни! Возможны следующие
механизмы разрыва  -связи:
-связи:
а) если алкены и реагент – неполярные
соединения, то  -связь
разрывается с образованием свободного радикала:
-связь
разрывается с образованием свободного радикала:
h3C = Ch3 + H : H ––> [h3C· – Ch3·] + [H·] + [H·]
б) если алкен и реагент – полярные
соединения, то разрыв  -связи приводит к образование ионов:
-связи приводит к образование ионов:

в) при соединении по месту разрыва  -связи реагентов, содержащих
в составе молекулы атомы водорода, водород
всегда присоединяется к более гидрированному
атому углерода (правило Морковникова, 1869 г.).
-связи реагентов, содержащих
в составе молекулы атомы водорода, водород
всегда присоединяется к более гидрированному
атому углерода (правило Морковникова, 1869 г.).
– реакция полимеризации nCh3 = Ch3 ––> n – Ch3 – Ch3 –– > (– Ch3 – Ch3 –)n этен полиэтилен
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства ( инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной серной кислоты, 1 мл спирта и небольшое количество песка. 2. Закройте пробирку пробкой с газоотводной трубкой и нагрейте в пламени спиртовки. 3. Выделяющийся газ пропустите через раствор с перманганатом калия. Обратите внимание на изменение цвета раствора. 4. Подожгите газ у конца газоотводной трубки. Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C2h5 + 3O2 ––> 2CO2 + 2h3O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)

При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
Ch4– CH = Ch3 + 4 [O] ––> Ch4COOH + HCOOH
– каталичесикое окисление

Запомните главное!
1. Непредельные углеводороды активно вступают в
реакции присоединения.
2. Реакционная активность алкенов связана с тем,
что  - связь под
действием реагентов легко разрывается.
3. В результате присоединения происходит переход
атомов углерода из sp2 – в sp3-
гибридное состояние. Продукт реакции имеет
предельный характер.
4. При нагревании этилена, пропилена и других
алкенов под давление или в присутствии
катализатора их отдельные молекулы соединяются
в длинные цепочки – полимеры. Полимеры
(полиэтилен, полипропилен) имеют большое
практическое значение.
- связь под
действием реагентов легко разрывается.
3. В результате присоединения происходит переход
атомов углерода из sp2 – в sp3-
гибридное состояние. Продукт реакции имеет
предельный характер.
4. При нагревании этилена, пропилена и других
алкенов под давление или в присутствии
катализатора их отдельные молекулы соединяются
в длинные цепочки – полимеры. Полимеры
(полиэтилен, полипропилен) имеют большое
практическое значение.
3. Применение алкенов (сообщение учащегося по следующему плану).
1 – получение горючего с высоким октановым числом; 2 – пластмасс; 3 – взрывчатых веществ; 4 – антифризов; 5 – растворителей; 6 – для ускорения созревания плодов; 7 – получение ацетальдегида; 8 – синтетического каучука.
III. Закрепление изученного материала

Домашнее задание: §§ 15, 16, упр. 1, 2, 3 стр. 90, упр. 4, 5 стр. 95.
xn--i1abbnckbmcl9fb.xn--p1ai




















