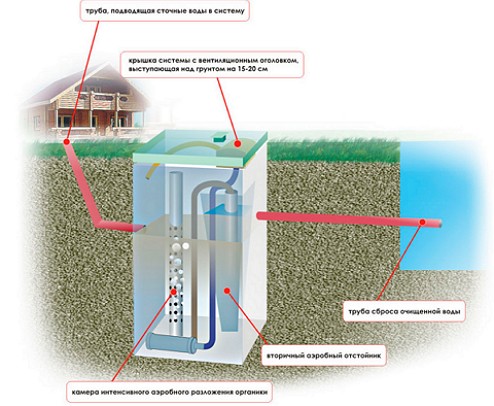
Агрегатное состояние воды и фазовые переходы. Агрегатное состояние воды
Три состояния воды, агрегатные природные состояния воды

Агрегатные состояния воды
В настоящее время в мире у воды известно всего лишь три состояния. Можно говорить о том, что есть и четвертое, а, может быть, и пятое, но пока что человеческий глаз может наблюдать в естественной среде только три агрегатных состояния.
Вариантов, как видно, ограниченное количество, поэтому можно перечислить довольно быстро все. Так что не стоит больше оттягивать этот момент. Все три состояния имеются в каждой точке планеты, и нет такого места, где бы жидкости ни было вообще. Эти состояния: лед, вода, пар. Некоторые удивятся, но порой все три состояния присутствуют рядом одновременно.
Вероятно, строгое соответствие физическим законам не всегда должно иметь место, потому что еще в школе говорили о том, что некоторые процессы могут протекать параллельно, а некоторые даже без промежуточного этапа. Именно об этом и стоит напомнить тем, кто наивно полагает, что вода переходит из одного состояния в другое только напрямую.
Предельные температуры
Начать стоит с того, что ограничений по температуре нет никаких. Лед может остыть до невероятно низких температур, а водяной пар в замкнутом пространстве легко разогреть больше ста градусов. Правда, при этом заметно вырастает давление, но если постараться сделать хорошую барокамеру, то проблем не возникнет. Иначе говоря, все допустимые температуры, которые имеются для всех трех состояний, можно получить искусственным путем. Даже границы замерзания и парообразования тоже можно сместить. Верите?
Привычные знания о том, что три агрегатных состояния самой главной жидкости планеты переходят одно в другое лишь при температурах в 0 и 100 градусов Цельсия пора подкорректировать. За счет того, что давление можно изменить в той же барокамере, температурные границы также сдвигаются. При низком давлении можно заставить воду закипеть при температуре менее 50 градусов. Если давление сделать более высоким, то температура кипения вырастет. Так можно попробовать уничтожить все бактерии без исключения.
Лед и еще раз пар
Что касается нулевых температур, то здесь давление тоже играет свою роль, но уже в обратном направлении: чем больше давление, тем меньше возможностей у молекул воды для движения в пространстве. Если же давление низкое, то температура замерзания сдвигается ниже нуля, но медленнее, чем температура кипения. Вот такие сложные процессы порой протекают в мире. Если есть те, кто сомневается в существовании подобных законов, могут узнать пример о метане, который присутствует в виде газа на Земле, но на дальних планетах из-за высокого давления и особых условий он присутствует лишь в виде жидкости.
 Теперь о том, как одно состояние вещества сменяет другое, минуя переходное. То есть, когда речь идет о переходе льда в пар. Весьма сомнительное явление, скажут многие. Разница в температуре составляет более ста градусов и она просто нереальна, если лед вдруг переходит в газообразное состояние. Но это реально и процесс этот называется сублимацией. То есть, кристаллы льда за счет локального изменения температуры меняют свое состояние и минуя жидкий вид сразу же испаряются. Довольно оригинальное явление, которое невозможно увидеть своими глазами без специальных приборов. Но при этом надо помнить о том, что процесс сублимации также обратим.
Теперь о том, как одно состояние вещества сменяет другое, минуя переходное. То есть, когда речь идет о переходе льда в пар. Весьма сомнительное явление, скажут многие. Разница в температуре составляет более ста градусов и она просто нереальна, если лед вдруг переходит в газообразное состояние. Но это реально и процесс этот называется сублимацией. То есть, кристаллы льда за счет локального изменения температуры меняют свое состояние и минуя жидкий вид сразу же испаряются. Довольно оригинальное явление, которое невозможно увидеть своими глазами без специальных приборов. Но при этом надо помнить о том, что процесс сублимации также обратим.
То есть, взвешенные в воздухе молекулы воды, которые называются паром или иногда туманом, при низкой температуре не собираются в большие капли воды, а сразу же замерзают, превращаясь в кристаллы льда. Поэтому на нашей планете три состояния воды имеют возможности для разнообразных переходов, которые, в конечном итоге, определяют множество уникальных погодных состояний.
Вконтакте
Google+
voday.ru
Информация о воде: Агрегатные состояния
Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Изменения агрегатного состояния это термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация; из жидкого в твёрдое — кристаллизация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
По состоянию различают:
Твёрдое — лёд
Жидкое — вода
Газообразное — водяной пар
Типы снежинок
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твердое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния льда и кипения воды при создании температурной шкалы «по Цельсию» в системе СИ). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм.) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
В нормальных атмосферных условиях вода закипает при температуре +98,9 °С и с ростом давления эта температура растёт.
При росте давления температура кипения воды растёт, плотность водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм.) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения.
Так же возможны метастабильные состояния — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, нетрудно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Чистая вода способна как переохлаждаться, не замерзая до температуры -33°C, так и быть перегрета до +200°C. За это её свойство она получила применение в промышленности (например, в паровых турбинах).
Существует тип воды, которая имеет плотность на 40% выше нормальной и закипает при температуре +300°С. Эта разновидность воды была открыта советским учёным Б. В. Дерягиным на поверхности кристаллов кварца.
Чтобы понять, что такое затвердевание и кипение, нужно знать, почему вещества принимают форму твердого тела, жидкости или газа. Эти формы известны как состояния вещества. В целом, при постоянной температуре размеры и форма твердого тела не изменяются. Жидкость, растекаясь, меняет форму, но ее объем остается неизменным. А у газа постоянными не являются ни объем, ни форма. Газ расширяется или сжимается, чтобы заполнить объем или форму занимаемого им сосуда.
Почти вся материя состоит из атомов, которые группируются в молекулы. Молекулы находятся в постоянном движении, и именно энергия их движения (кинетическая энергия) определяет состояние вещества - твердое, жидкое или газообразное. В твердом теле у молекул мало кинетической энергии, они колеблются вокруг фиксированных точек. Поэтому твердое тело сохраняет свою форму. Молекулы жидкости обладают достаточной энергией, чтобы преодолеть силу взаимного притяжения. Они могут перемещаться и, таким образом, изменять форму жидкости. Молекулы газа обладают большой кинетической энергией и практически свободны в своем движении.
Переход твердое вещество - жидкость. Можно заставить жидкость перейти в твердое состояние, забрав у нее тепло. Для этого достаточно поместить ее в более холодную среду. При потере тепла молекулы жидкости замедляют свое движение и, в конце концов, уже не могут перемещаться, а просто колеблются вокруг фиксированных точек. С наступлением этой фазы жидкость отвердевает, т. е. превращается в твердое вещество. Например, вода замерзает при температуре 0°С. Большинство веществ кристаллизуются при переходе из жидкого состояния в твердое. Так, NaCl (поваренная соль) образует кристаллы кубической формы. Нагреваясь, твердые вещества могут снова перейти в жидкое состояние, так как при этом увеличивается скорость движения их молекул.
При нагревании твердого вещества с целью превращения в жидкость его температура растет за счет поглощения тепла. Но, достигнув точки плавления, температура вещества остается постоянной, хотя процесс поглощения тепла продолжается. Тепло, используемое для превращения твердого вещества в жидкость, не увеличивается после достижения точки плавления и называется скрытой теплотой плавления. Лишь после того, как все твердое вещество перейдет в жидкое состояние, его температура вновь начинает расти.
Переход жидкость - газ. Если продолжать нагревать жидкость, ее температура будет расти до достижения точки кипения, после чего остается неизменной, так как превращение жидкости в газ требует большого количества тепла. Тепло, используемое для перехода жидкости в газообразное состояние, называется теплотой парообразования. Как только все вещество превратится в пар, его температура будет опять расти.
При охлаждении газа его температура вначале падает. Затем, после достижения точки кипения вещества, газ отдает свою теплоту парообразования и переходит в жидкое состояние при той же температуре. Только когда весь газ превратится в жидкость, температура вещества начинает падать.
Пар снова превращается в воду при определенной потере тепла. Это явление можно наблюдать при продолжительном кипении воды в чайнике. Холодные поверхности в помещении покрываются влагой, так как часть образовавшегося пара отдает им тепло при контакте. В результате молекулы пара замедляют движение, и он превращается в воду. Говорят, что пар конденсировался в жидкое состояние, а явление называют "конденсацией".
Мы ошибочно считаем паром белые клубы у носика чайника, но настоящий пар нельзя увидеть. Видимые клубы состоят из крошечных капелек воды, образующихся при конденсации пара, когда на выходе из чайника он сталкивается с относительно холодным окружающим воздухом.
Сублимация — переход вещества из твёрдого состояния сразу в газообразное, минуя жидкое. Хорошо поддается возгонке вода, что определило широкое применение данного процесса как одного из способов сушки. При промышленной возгонке сначала производят заморозку исходного тела, а затем помещают его в вакуумную или заполненную инертными газами камеру. Физически процесс возгонки продолжается до тех пор, пока концентрация водяных паров в камере не достигнет нормального для данной температуры уровня, в связи с чем избыточные водяные пары постоянно откачивают. Возгонка применяется в химической промышленности, в частности, на производствах взрывоопасных или взрывчатых веществ, получаемых осаждением из водных растворов.
Возгонка также используется в пищевой промышленности: так, например, фрукты после сублимирования весят в несколько раз меньше, а восстанавливаются в воде. Сублимированные продукты значительно превосходят сушеные по пищевой ценности, так как возгонке поддаётся только вода, а при термическом испарении теряются многие полезные вещества. Перед сублимацией пищевых продуктов используется быстрое замораживание (-100 до -190 град. Цельсия), что приводит к образованию мелких кристаллов, не разрушающих клеточные мембраны.
nasha-voda.blogspot.ru
Агрегатные состояния воды : Построй свой дом
Размещено 8 февраля 2018в рубрике Строительная физика | Прокомментировать

Влажность, с точки зрения химии и физики, это вода в какой-либо форме. Агрегатные состояния воды могут быть в трех формах — твердой, жидкой и газообразной, причем при изменении формы нельзя перепрыгнуть, как правило, из твердой формы в газообразную и наоборот. Хотя, на первый взгляд, могут быть и исключения, связанные со скоростью перехода из одной формы в другую.
Агрегатные состояния
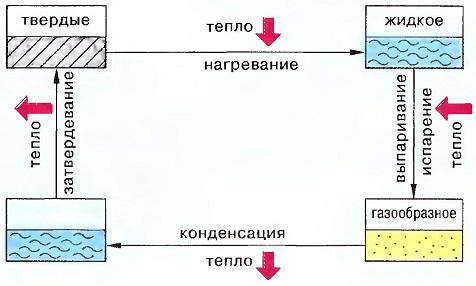
Относительно агрегатных состояний действуют следующие правила:
- Твердое тело плавится, т.е. становится жидким, при его нагревании.
- Каждое тело плавится при определенной температуре.
- Растворы имеют более низкую температуру замерзания и более высокую температуру кипения, чем вода (посыпка дорог солью зимой).
- Когда газы охлаждаются, они становятся жидкими => (конденсируются).
- При конденсации и затвердевании тело отдает воспринятое при плавлении и испарении тепло.
- Вода превращается в пар и без кипения.Конденсация: Образование пара ниже 100°С.Испарение при кипении: Образование пара при 100°С и более.
- Конденсация идет тем быстрее:— чем больше площадь испарения— чем выше температура— чем сильнее движение воздуха у поверхности
- Вблизи испаряющейся воды воздух охлаждается, т.к. у него отбирается тепло, которое необходимо для испарения.
Энергетический баланс изменения состояния воды
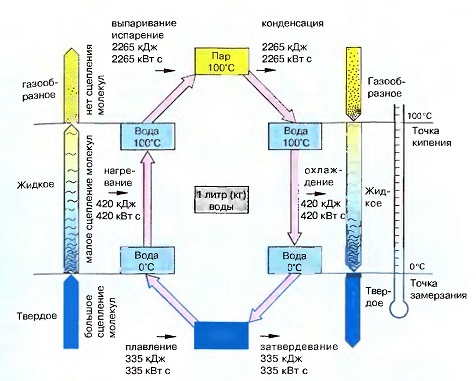
С агрегатным состоянием связан не только круговорот воды в природе, но и энергетический круговорот, который состоит в том, что тепло, которое должно быть подведено при таянии и испарении, должно быть снова отдано в атмосферу при конденсации и замерзании.
Диаграмма энергетического баланса изменения агрегатных состояний воды
Виды воды
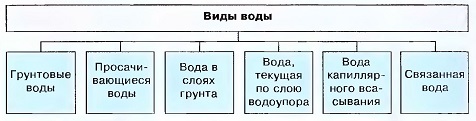
Вода — это вещество, которое в повседневной жизни играет незаменимую роль.Она заключается в:
- Необходимости для поддержания жизни людей, животных, растений.
- Она проводит электрический ток.
- Она проводит звук и тепло.
- Она растворяет большинство веществ.
- Может содержать растворенные твердые вещества, газы, кислоты и щелочи. Имеет при +4°С свою наибольшую плотность (1дм3 ~ 1кг)
- Она является предпосылкой для эрозии и осаждения почв.
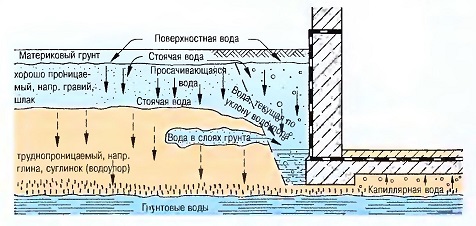
Кругооборот воды в природе
Вода — это не объект потребления, а объект использования, и, поэтому, может снова и снова выполнять свою функцию.То, что вода в желаемом качестве и в нужном количестве больше не всегда может использоваться неограниченно, можно отнести только за счет загрязнения нашей окружающей среды.Рост населения, запросы цивилизации и беззаботное обращение с жизненно необходимым богатством привели к тому, что вода не может больше использоваться так, как ее предоставляет нам природа. Теперь мы должны иметь между источником воды и ее «потреблением» станцию водоподготовки.Только гораздо позже у людей созрело мнение, что во многих смыслах загрязненная человеком вода должна быть обработана, т.е. очищена, прежде чем она поступит снова в круговорот воды в природе. Так природный кругооборот воды дополняется «водоподготовительными станциями и очистными сооружениями» для того, чтобы можно было наслаждаться и далее этим животворным веществом.
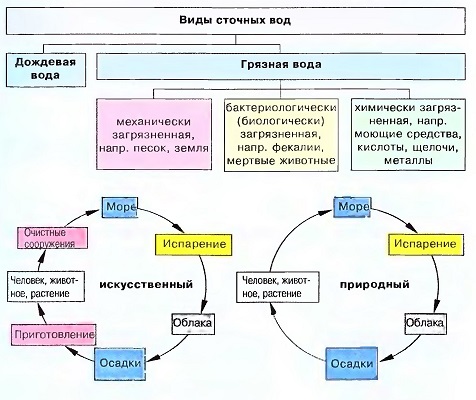
Вода и ее значение
Если ограничить многообразное значение и применение воды сектором «Строительство», то можно различать:
Воду как строительный материал
- Вода для затвердения раствора и бетона
- Для гашения извести СаО + Н2O —> Са(ОН)2
- Для кристаллизации гипса CaSO4 • 2Н2O
Воду как вспомогательный материал
- Транспортное средство
- Средство для очистки
- Средство для образования растворов NaCl + Н2O
Воду как фактор человеческого комфорта
- Влажные помещения вызывают аллергии и определенные болезни, такие, как болезни суставов, ревматизм, туберкулез.
Воду как причину повреждений в зданиях и сооружениях
- Капиллярность
- Образование конденсата, талой воды, таяние льда
- Коррозия —> арматура в бетоне и в преднапряженном железобетоне
- Высолы —> растворимые соли транспортируются на поверхность конструкции водой
- Действие мороза —> фундаменты, дороги выпучиваются Грибки и гниль на древесине
- Агрессивные воды за счет кислот и щелочей
- Снижение теплозащитных свойств материалов (заполненные водой поры лучше проводят тепло)
- Плесень и грибки на штукатурке, кладке и древесине
Капиллярность
Как это выражает тема настоящей главы, центром тяжести рассмотрения является повреждающее действие воды. Одной из причин разрушающего действия воды является капиллярность строительных материалов. Как показывает структурограмма, капиллярность зависит от взаимодействия таких факторов как пористость, сила сцепления (когезия и адгезия).
Пористость
Основной предпосылкой является то, что большинство строительных материалов имеют поры. Вода может проникать только в пористые материалы и там скапливаться.
Преимущества пористости строительных материалов:
- Легкие
- Хорошо обрабатываемые и перерабатываемые
- Хорошая теплозащита
- Хорошее звукопоглощение
- Хороший воздухо- и влагообмен
Недостатки пористости строительных материалов:
- Малая прочность на сжатие и растяжение
- Повреждаются морозом
- Капиллярное всасывание
- Водопроницаемость
- Опасность разложения
Когезия или сила сцепления молекул
Когезия (cohere — держать вместе, лат.) или сила сцепления связана также с капиллярностью.  В твердых материалах молекулы имеют между собой сильную связь, тогда как в жидких материалах молекулы связаны между собой значительно слабее и поэтому очень подвижны.В воде сила сцепления молекул на поверхности называется также поверхностным натяжением. Оно так велико, что иголка или бритва плавает на поверхности воды.
В твердых материалах молекулы имеют между собой сильную связь, тогда как в жидких материалах молекулы связаны между собой значительно слабее и поэтому очень подвижны.В воде сила сцепления молекул на поверхности называется также поверхностным натяжением. Оно так велико, что иголка или бритва плавает на поверхности воды.
Газы не имеют когезии, что означает их свободное рассеяние в воздухе. В грунтах сила сцепления молекул оценивается по величине углом естественного откоса.
Адгезия или сцепление с другими материалами
Не только молекулы одного материала удерживаются прочно друг с другом, но также и два различных материала сцепляются друг с другом. Это свойство называется адгезией или силой сцепления с другими материалами.
Адгезия имеет место между:
- Двумя твердыми материалами
- Твердым и жидким материалами
- Твердым и газообразным материалами (сигаретный дым в одежде)
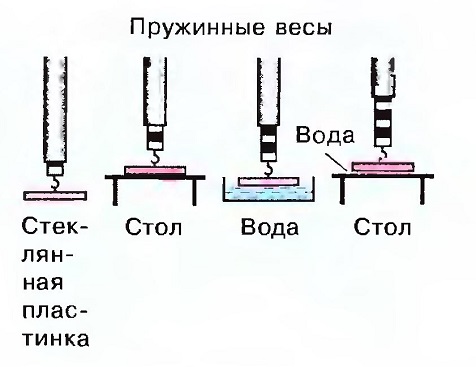
Капиллярность в зависимости от поперечного сечения
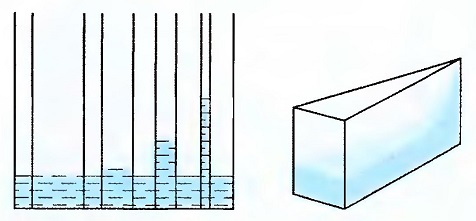
Опыты показывают: чем меньше поперечное сечение, тем выше поднимается вода. Это явление объясняется следующим образом:
Связь между когезией — адгезией — силой тяжести
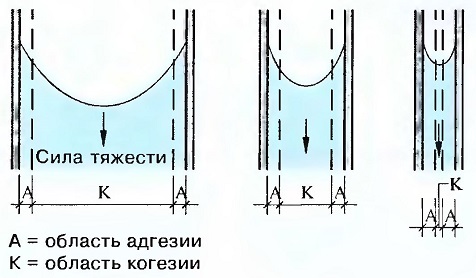
- Если рассматривать сечение трубочки как пору, то внутри этой поры имеет место сравнение этих усилий.
- Сила адгезии между материалами воды и стеклянной стенки направлена кверху, т.к. последняя наверху сухая.
Сила тяжести воды направлена вниз. Сила тяжести зависит от когезии материала. Величина области адгезии зависит от материала, хотя, несмотря на различную величину пор, почти одинакова. Область когезии, где сила тяжести сильнее чем сила адгезии, с уменьшением диаметра пор становится все меньше, так, что в случае маленьких пор соотношение сил изменяется в пользу адгезии, и, таким образом, вода может подниматься вверх.
Таким образом можно сказать:
- Капиллярность основана на взаимодействии когезии, адгезии и силы тяжести. Чем более пористым является материал, и чем мельче поры, тем больше капиллярность.
- Чем плотнее материал, тем меньше его капиллярность.
- Чем меньше поры и чем больше количество пор, тем больше его капиллярность.
Различные материалы и их капиллярность
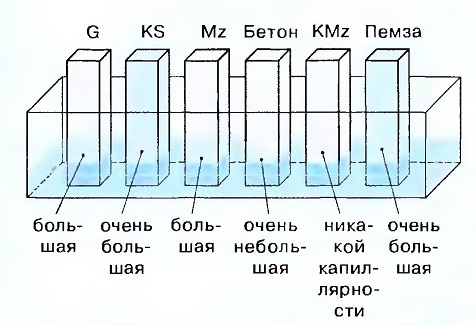
Поэтому (в идеале) в одной стене не должны применяться различные материалы => различная способность всасывания (абсорбция) строительных материалов имеет негативные последствия. Это особенно проявляется в штукатурке.
Различные виды грунта и их капиллярность

Опыты показывают, что чем больше поры между отдельными частицами грунта, тем меньше капиллярность.Например, устройство (под подошвой фундамента и под полом подвала) слоя крупного гравия для разрушения капиллярности грунта.
Таблица 1 Равновесная влажность строительных материалов при температуре 10 оС и относительной влажности 50%.

Вода, таким образом, может перемещаться:
- вниз: в соответствии со своим весом
- вбок: в соответствии со своей плотностью и разницей уровней
- вверх: в соответствии с величиной пор и пористой структурой материала
Пористая структура влияет на:
- Водовосприятие
- Перемещение воды
- Степень насыщения материала водой
Подъем капиллярной влаги зависит от радиуса пор.
Максимальная высота подъема может быть определена по формуле:
hmax = 0.15 / Rp
где Rp — радиус пор в см, h — высота подъема в см.
Радиус пор:
Бетон: Rp = около 0,02 μm до 10 μm в зависимости от водоцементного отношения и степени гидратации.Кирпич: Rp = около 0,01 μm до 100 μm в зависимости от температуры обжига.
Примеры:
Кирпич: Rp = 10 μm = 0,000010 м = 0,0010 см;
hmax = 0.15 / 0.001 = 1.50 м
Бетон: Rp = 1 μm = 0,000001 м = 0,0001 см;
hmax = 0,15 /0,00010 см = 1500 см = 15 м
В следующей статье я я расскажу о гидроизоляции и пароизоляции при строительстве.
Рекомендую еще почитать:
Kомментарии
www.ocenin.ru
Агрегатное состояние вещества
Физическое или агрегатное состояние материи характеризуется ее определенными свойствами при конкретных условиях (давлении и температуре). То есть она может быть твердой, жидкой или газообразной. Изменение агрегатных состояний вещества приводит к изменению его физические свойства (плотность, энтропия, свободная энергия). Находясь в твердом состоянии, оно способно сохранять фиксированный объем и форму. Перейдя в жидкость, при том же объеме, меняет форму, приспосабливаясь к сосуду или емкости. Будучи газообразным, это же вещество не сохраняет не только форму, но и объем, так как, расширяясь, заполняет все пространство.
Например, агрегатное состояние воды может быть твердым, жидким или газообразным. При этом химическая формула (h3O) и состав молекулы (два водородных атома и один кислородный атом) не меняются. При температурах от 0 °С и ниже она находится в твердом состоянии и называется льдом. От 0 °С и до 99,944 °С представляет собой бесцветную (для малых объемов) прозрачную жидкость, не имеющую запаха и вкуса. При температуре 99,944 °С переходит в газовую фазу и называется водяным паром. На этом примере видно, что агрегатное состояние вещества меняется при изменении внешних условий. В данном случае при почти не изменяющимся давлении окружающей среды, но изменении температуры, лед плавится при 0 °С и превращается в воду, а та кипит при 99,944 °С и, испаряясь, превращается в пар.
Вода, можно сказать, отличается по своим свойствам, находясь в разных агрегатных состояниях. Плотность льда равняется 0,917 г/см³, жидкой воды при стандартных условиях 0,9982 г/см³, водяного пара (также при стандартных условиях) — менее 0,001 г/см³. Динамическая вязкость воды при температуре плавления льда (температуре замерзания воды) равна: μ = 1,793·103 Па·с, а при 20 °С динамическая вязкость воды составляет: μ = 1,003·10ˉ³ Па·с. Таким образом, агрегатное состояние вещества и его свойства меняются при фазовом переходе. Это переход характеризуется температурой плавления (из твердой материя становится жидкой), равной температуре кристаллизации (жидкость затвердевает), и температурой кипения (жидкость переходит в газ), равной температуре конденсации (газ становится жидкостью).
Следует подчеркнуть, что агрегатное состояние вещества зависит и от его состава. Так, например, при одинаковых внешних условиях различные вещества отличаются своими свойствами. При стандартных условиях вода h3O — это жидкость. Водород h3 и кислород O2 — это газы. Железо Fe — твердое тело (его температура плавления 1538,9 °C, температура кипения 2860,9 °C). Но одно и то же агрегатное состояние для разных веществ может иметь некоторые сходства.
Например, для газов характерны сравнительно малые силы межмолекулярного взаимодействия. Поэтому их молекулы находятся друг от друга на больших расстояниях. В результате газы способны сильно сжиматься. Молекулы газов постоянно двигаются, а движение является хаотичным. Именно это объясняет способность газообразных веществ заполнять равномерно весь объем, им предоставленный: газы приобретают форму и объем емкости, в которой они находится.
Жидкости между газообразными и твердыми веществами занимают промежуточное положение. С повышением температуры, они большей становятся похожими на газы, а с понижением температуры, они больше напоминают твердые вещества. Молекулы жидкостей более плотно размещаются благодаря заметным силам притяжения между ними. Рентгенографические исследования их показали, что они имеют некоторые зачатки, напоминающие кристаллическое строение.
Твердые вещества имеют всегда определенные формы и объемы. Чтобы их изменить, необходимо затратить усилие, так как молекулы, атомы и ионы прочно связаны между собой. Частицы твердой материи не могут свободно перемещаться, так как сохраняют взаимное расположение и около центров равновесия совершают упорядоченные колебания. Известно два состояния твердых тел — аморфное и кристаллическое. Кристаллы последнего характеризуются определенной для них формой. Например, кристаллы натрия хлорида NaCl напоминают по форме куб, калия нитрата KNO3 — призму и так далее. Структура аморфных — это беспорядочно сагрегатированные молекулы. В отличие от кристаллических веществ, которые плавятся при определенной температуре, аморфные характеризуется широким интервалом температуры плавления. Иногда их рассматривают, как жидкость с очень высокой вязкостью. При изменении условий, в которых происходит застывание вещества, оно может получиться, как в кристаллическом, так и в аморфном состоянии.
Агрегатное состояние вещества иногда описывают, как плазму или жидкие кристаллы. Но это не совсем корректное определение. Вопрос требует отдельного и более подробного изучения, поэтому в данной статье это состояние материи не затронуто.
fb.ru
Агрегатное состояние воды и фазовые переходы
Вода может находиться в трех агрегатных состояниях или фазах – твёрдом (лёд), жидком (вода), газообразном (водяной пар).
Изменение агрегатного состояния вещества называется фазовыми переходами, которые сопровождаются выделением или поглощением энергии, называемой «скрытой теплотой». Зависимость агрегатного состояния воды от температуры и давления выражается фазовой диаграммой состояния воды (рис. 4).
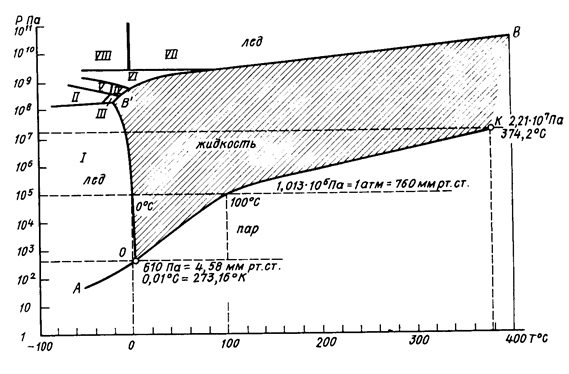
Рис. 4. Диаграмма состояния воды
I-VIII – различные модификации льда
Рассмотрим эту диаграмму:
а) точка «З», при которой происходит плавление льда или замерзание, кристаллизация воды, при нормальном атмосферном давлении, называется точкой плавления льда или точкой замерзания воды и она соответствует по шкале Цельсия –00 или 237К (по шкале Кельвина). Нормальное давление равно 1 атм = 760 мм рт. ст. = 1,013×105 Па = 1,013 бар.
При замерзании воды удельный объём увеличивается на 10 %. Точка замерзания при увеличении давления снижается так на максимальных глубинах в океане (около 11 км) давление превышает 1000 атм (108 Па) и Т3 могла бы быть –120С.
При увеличении давления до 2200 атм (2,2×108 Па) Т3 уменьшается до – 220С, а при дальнейшем увеличении давления Т3 быстро возрастает, образуя особые модификации льда (лёд ІІ- VІІІ). Например при давлении 20670 атм вода замерзает при +760С, образуя «горячий лёд».
Продолжаем анализировать фазовую диаграмму:
б) кривая ОБВ носит название кривой плавления. При переходе через эту кривую происходит - слева направо  плавление льда; справа налево
плавление льда; справа налево  льдообразование и кристаллизация воды.
льдообразование и кристаллизация воды.
в) кривая АО носит название кривой стабилизации или кривой возгонки. При пересечении её сверху вниз и слева направо происходит испарение льда или возгонка, а снизу вверх и справа налево - конденсация пара в твёрдую фазу или сублимация.
г) точка «О» - тройная точка, где вода одновременно находится в трёх состояниях.
д) точка «К» - это точка кипения воды при температуре 1000С при нормальном атмосферном давлении.
В чём суть кипения? Что это такое? С поверхности воды, а также льда и снега постоянно отрываются и уносятся в воздух молекулы водяного пара. Идёт испарение воды. Часть этих молекул пара возвращается на поверхность воды – это конденсация водяного пара. Испарение идёт при любой температуре и тем интенсивнее, чем больше дефицит влажности воздуха (например, в пустыне). С ростом температуры упругость водяного пара, насыщающего пространство, растёт, и испарение ускоряется.
Когда интенсивное испарение охватывает не только поверхность воды, но и её толщу, где испарение идёт с внутренней поверхности образующихся при этом пузырьков, начинается процесс кипения. Температура, при которой давление насыщенного водяного пара равно внешнему давлению, называется температурой или точкой кипения (Ткип.). Она соответствует 1000С. Её ещё можно назвать точкой конденсации пара.
Температура кипения находится в прямой зависимости от давления, уменьшаясь с его снижением (это свойство использовалось для определения высоты местности гипсотермометром) и, повышаясь с увеличением (с этим свойством связаны образование гейзеров, формирование местонахождений полезных ископаемых и пр.).
В горах, где давление меньше, вода кипит при температурах ниже 1000С.
е) точка «Кр» - так называемая «критическая точка». Соответствует состоянию, когда при росте давления до 2200 атм температура кипения равна 374,20С, и вода одновременно имеет свойства жидкости и газа.
ж) следует отметить также, что температуры кипения и замерзания зависят не только от давления, но и от солёности. Увеличение солёности на каждые 10 промилей (10о/оо) снижает температуру замерзания на 0,54оС. Географическое следствие этого: на глубине 4000-5000 м вода в океанах не замерзает при Т= - 30С.
Основное географическое следствие: аномально высокое значение температуры замерзания и кипения воды предопределили существование на Земле (с её температурным режимом) воды во всех трёх фазах. Это определяет многообразие форм участия воды в различных гидрологических и экзогенно-геологических природных процессах на Земле.
Малоизученные свойства воды
Вода, как никакое другое вещество на Земле, «многолика». В соответствии с законами фазовых переходов, она может находиться в виде пара, жидкой воды или льда, переходя при изменении термодинамических условий из одного фазового состояния в другое. Эти фазовые переходы – также одна из загадок воды. Например, как происходит сублимация льда – прямой переход его в парообразное состояние, минуя жидкое? До последнего времени считалось, что испаряется именно лёд. В действительности поверхность льда даже при отрицательных температурах покрыта плёнкой переохлаждённой квазижидкой связанной воды. Кстати, именно поэтому лёд такой скользкий.
Но одна из самых сложных загадок природы – это поведение воды в различных условиях.
В диапазоне от 0 до 100оС мы привыкли иметь дело с жидкой водой. Но кроме гравитационной воды, заполняющей впадины морей и океанов, текущей в руслах рек, фильтрующейся сквозь толщу горных пород, имеется капиллярная вода в порах грунтов, напротив поднимающаяся по порам на несколько метров. В 60-е годы ХХ ст. профессора Костромского университета Б. Дерягин и Н. Федякин обнаружили в сверхтонких (0,1 – 10 микрон) капиллярах совершенно особую воду. Она имеет плотность 1,4, температуру максимальной плотности –10,0оС, не замерзает даже при –100оС, постепенно густея и застекловываясь,как смола. При охлаждении до – 30оС - –40оС столбик воды в капилляре начинает расширяться и мутнеть, делясь на не смешивающиеся между собой капли. Химические свойства и состав аномальной воды – П, как назвали её учёные, пока изучен слабо. Здесь нас ждёт много неожиданностей.
Не менее интересно ведёт себя жидкая вода и будучи физиологически связанной. Человек на 65-70% состоит из воды, в том числе – 50% внутриклеточной, 15% - межтканевой и лишь 5% циркулирующей в виде крови и лимфы. В пищевой канал человека за сутки поступает до 10 литров жидкости, из которых лишь 2 литра имеют экзогенное происхождение. Потеря 1-2% воды в организме (0,5 – 1,0 л.) – это жажда, 5% - это пересыхание, вызывающее галлюцинации, 14 – 15% - смерть… О значении воды в жизни человека, животных и растений можно рассказывать много. Но это уведёт нас в сторону от темы. Сейчас отметим другой аспект проблемы: ежегодно живые и растительные организмы пропускают через себя более 700 млн.т. воды. Таким образом, примерно каждый миллион лет жизнь буквально «процеживает» через себя воду, имеющуюся на Земном шаре. Раствор органических веществ в воде также обнаруживает неожиданные свойства. Так, например, в капиллярах растений он замерзает при +4оС. Именно поэтому при первых похолоданиях гибнут многие растения и цветы.
Вода в твёрдой фазе (лёд), на первый взгляд не таит в себе особых загадок. Однако, уже в начале ХХ века немецкий и американский учёные П. Бриджмен и Г. Тамман выявили шесть разновидностей льда, различающихся давлениями и температурами. Лёд І – это обычный лёд, существующий при давлении до 2200 атм. При повышении давления он переходит в лёд ІІ и лёд ІІІ, которые тяжелее воды. Дальнейший рост давления порождает лёд ІV, который опять легче воды. Наконец, при сверхвысоких давлениях 10 – 20 т/см2 образуется лёд V – VІІІ. Их из-за высокой температуры существования (+10оС - +70оС) называют горячими льдами. Поистине, вода и лёд – самые удивительные минералы на Земле.
С водой как растворителем связана одна из нерешённых проблем физической химии – «случайные» изменения в скорости прохождения химических реакций в водных растворах. Химикам давно известно, что время выпадения в осадок трудно растворимых продуктов реакции непостоянно: то осадок образуется сразу, то его появления приходится ждать довольно долго. Был проведён интересный эксперимент. Сотни химиков в один и тот же момент мирового времени провели серию опытов. На протяжении 15 лет было поставлено 300000 экспериментов. Статистическая обработка выявила три факта, пока не поддающиеся теоретическому объяснению:
a. Изменения скорости реакции по времени на всём земном шаре одинаковы.
b. Характер реакции следует ритму солнечной активности (появлению пятен и вспышек на Солнце).
c. Скорость реакции зависит от изменения относительной скорости движения Земли по эллиптической орбите.
Принципиально новый подход к структуре воды предложил М. Аджено (1967). Основываясь на представлениях квантовой механики, он показал возможность существования пяти видов молекулярных агрегатов, образующих димеры, тримеры, цепочки, трёх и шестимолекулярные кольца. Аджено считает, что молекула воды может участвовать не в четырёх, а лишь в двух водородных связях, которые нельзя затронуть, не разрушив всю структуру.
В воде в один и тот же момент могут присутствовать все возможные типы агрегатов молекул, причём равновесие между ними зависит от термодинамического состояния системы. По данным Франка и Вэна (1967) они образуют «мерцающие рои», в которых содержится от 12 до 150 молекул. Размеры роёв уменьшаются с увеличением температуры.
Вода различной структуры, очевидно, имеет не только различные физические, но биологические свойства. Об этом убедительно свидетельствуют опыты эстонских учёных. Они «активировали» воду в дезинтеграторе – мельнице со стремительно вращающимися роторами. В активированной воде форель растёт в полтора раза быстрее, повышается её продуктивность, полив такой водой увеличивает урожайность. Очевидно, при дезинтеграции происходит разрушение структурных цепочек молекул воды.
Таким образом, структурные связи – это одна из причин аномальных свойств воды.
| физические основы гидрологических процессов |
infopedia.su
Что такое агрегатное состояние? Агрегатное состояние вещества
Вопросы о том, что такое агрегатное состояние, какими особенностями и свойствами обладают твердые вещества, жидкости и газы, рассматриваются в нескольких учебных курсах. Существует три классических состояния материи, со своими характерными чертами строения. Их понимание является важным моментом в постижении наук о Земле, живых организмах, производственной деятельности. Эти вопросы изучают физика, химия, география, геология, физическая химия и другие научные дисциплины. Вещества, находящиеся при определенных условиях в одном из трех базовых типов состояния, могут изменяться при повышении или понижении температуры, давления. Рассмотрим возможные переходы из одних агрегатных состояний в другие, как они осуществляются в природе, технике и повседневной жизни.
Что такое агрегатное состояние?
Слово латинского происхождения "aggrego" в переводе на русский язык означает «присоединять». Научный термин относится к состоянию одного и того же тела, вещества. Существование при определенных температурных значениях и разном давлении твердых тел, газов и жидкостей характерно для всех оболочек Земли. Помимо трех базовых агрегатных состояний, существует еще и четвертое. При повышенной температуре и неизменном давлении газ превращается в плазму. Чтобы лучше понять, что такое агрегатное состояние, необходимо вспомнить о мельчайших частицах, из которых состоят вещества и тела.
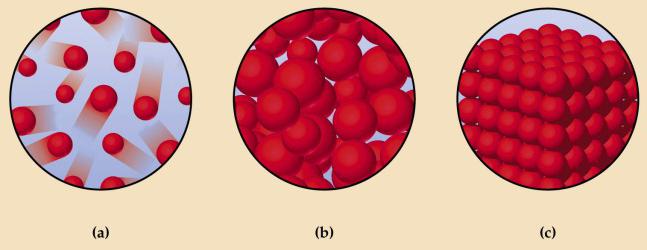
На схеме вверху показаны: а — газ; b — жидкость; с — твердое тело. На подобных рисунках кружочками обозначаются структурные элементы веществ. Это условное обозначение, на самом деле атомы, молекулы, ионы не являются сплошными шариками. Атомы состоят из положительно заряженного ядра, вокруг которого на большой скорости движутся отрицательно заряженные электроны. Знания о микроскопическом строении вещества помогают лучше понять различия, существующие между разными агрегатными формами.
Представления о микромире: от Древней Греции до XVII века
Первые сведения о частицах, из которых сложены физические тела, появились в Древней Греции. Мыслители Демокрит и Эпикур ввели такое понятие, как атом. Они считали, что эти мельчайшие неделимые частицы разных веществ обладают формой, определенными размерами, способны к движению и взаимодействию друг с другом. Атомистика стала наиболее передовым для своего времени учением Древней Греции. Но ее развитие затормозилось в средние века. Так как тогда ученых преследовала инквизиция римской католической церкви. Поэтому вплоть до нового времени не было внятной концепции, что такое агрегатное состояние вещества. Только после XVII века ученые Р. Бойль, М. Ломоносов, Д. Дальтон, А. Лавуазье сформулировали положения атомно-молекулярной теории, не утратившие своего значения и в наши дни.
Атомы, молекулы, ионы — микроскопические частицы строения материи
Значительный прорыв в понимании микромира произошел в XX веке, когда был изобретен электронный микроскоп. С учетом открытий, сделанных учеными ранее, удалось сложить стройную картину микромира. Теории, описывающие состояние и поведение мельчайших частиц вещества, довольно сложные, они относятся к области квантовой физики. Для понимания особенностей разных агрегатных состояний материи достаточно знать названия и особенности основных структурных частиц, которые образуют разные вещества.
- Атомы — химически неделимые частицы. Сохраняются в химических реакциях, но разрушаются в ядерных. Металлы и многие другие вещества атомарного строения имеют твердое агрегатное состояние при обычных условиях.
- Молекулы — частицы, которые разрушаются и образуются в химических реакциях. Молекулярное строение имеют кислород, вода, углекислый газ, сера. Агрегатное состояние кислорода, азота, диоксидов серы, углерода, кислорода при обычных условиях — газообразное.
- Ионы — заряженные частицы, в которые превращаются атомы и молекулы, когда присоединяют или теряют электроны — микроскопические отрицательно заряженные частички. Ионное строение имеют многие соли, например поваренная, железный и медный купорос.
Есть вещества, частицы которых определенным образом расположены в пространстве. Упорядоченное взаимное положение атомов, ионов, молекул называют кристаллической решеткой. Обычно ионные и атомарные кристаллические решетки характерны для твердых веществ, молекулярные - для жидкостей и газов. Высокой твердостью отличается алмаз. Его атомная кристаллическая решетка образована атомами углерода. Но мягкий графит тоже состоит из атомов этого химического элемента. Только они по-другому расположены в пространстве. Обычное агрегатное состояние серы — твердое, но при высоких температурах вещество превращается в жидкость и аморфную массу.
Вещества в твердом агрегатном состоянии
Твердые тела при обычных условиях сохраняют объем и форму. Например, песчинка, крупинка сахара, соли, кусок горной породы или металла. Если нагревать сахар, то вещество начинает плавиться, превращаясь в вязкую коричневую жидкость. Прекратим нагревание — снова получим твердое вещество. Значит, одно из главных условий перехода твердого тела в жидкость — его нагревание или повышение внутренней энергии частиц вещества. Твердое агрегатное состояние соли, которую используют в пищу, тоже можно изменить. Но чтобы расплавить поваренную соль, нужна более высокая температура, чем при нагревании сахара. Дело в том, что сахар состоит из молекул, а поваренная соль - из заряженных ионов, которые сильнее притягиваются друг к другу. Твердые вещества в жидком виде не сохраняют свою форму, потому что кристаллические решетки разрушаются.
Жидкое агрегатное состояние соли при расплавлении объясняется разрывом связи между ионами в кристаллах. Освобождаются заряженные частички, которые могут переносить электрические заряды. Расплавы солей проводят электричество, являются проводниками. В химической, металлургической и машиностроительной промышленности твердые вещества превращают в жидкие для получения из них новых соединений или придания им разной формы. Большое распространение получили сплавы металлов. Есть несколько способов их получения, связанных с изменениями агрегатного состояния твердого сырья.

Жидкость — одно из базовых агрегатных состояний
Если налить в круглодонную колбу 50 мл воды, то можно заметить, что вещество сразу же примет форму химического сосуда. Но как только мы выльем воду из колбы, то жидкость сразу же растечется по поверхности стола. Объем воды останется тот же — 50 мл, а ее форма изменится. Перечисленные особенности характерны для жидкой формы существования материи. Жидкостями являются многие органические вещества: спирты, растительные масла, кислоты.
Молоко — эмульсия, т. е. жидкость, в которой находятся капельки жира. Полезное жидкое ископаемое — нефть. Добывают ее из скважин с помощью буровых вышек на суше и в океане. Морская вода тоже является сырьем для промышленности. Ее отличие от пресной воды рек и озер заключается в содержании растворенных веществ, в основном солей. При испарении с поверхности водоемов в парообразное состояние переходят только молекулы Н2О, растворенные вещества остаются. На этом свойстве основаны методы получения полезных веществ из морской воды и способы ее очистки.
При полном удалении солей получают дистиллированную воду. Она кипит при 100 °С, замерзает при 0 °С. Рассолы кипят и превращаются в лед при других температурных показателях. Например, вода в Северном Ледовитом океане замерзает при температуре на поверхности 2 °С.
Агрегатное состояние ртути при обычных условиях — жидкость. Этим серебристо-серым металлом обычно заполняют медицинские термометры. При нагревании столбик ртути поднимается по шкале, происходит расширение вещества. Почему же в уличных термометрах используется подкрашенный красной краской спирт, а не ртуть? Объясняется это свойствами жидкого металла. При 30-градусных морозах агрегатное состояние ртути меняется, вещество становится твердым.
Если медицинский термометр разбился, а ртуть вылилась, то собирать руками серебристые шарики опасно. Вредно вдыхать пары ртути, это вещество очень токсичное. Детям в таких случаях надо обратиться за помощью к родителям, взрослым.

Газообразное состояние
Газы не способны сохранять ни свой объем, ни форму. Заполним колбу доверху кислородом (его химическая формула О2). Как только мы откроем колбу, молекулы вещества начнут смешиваться с воздухом в помещении. Это происходит благодаря броуновскому движению. Еще древнегреческий ученый Демокрит считал, что частички вещества находятся в постоянном движении. В твердых телах при обычных условиях у атомов, молекул, ионов нет возможности покинуть кристаллическую решетку, освободиться от связей с другими частицами. Такое возможно только при поступлении большого количества энергии извне.
В жидкостях расстояние между частицами немного больше, чем в твердых телах, им требуется меньше энергии для разрыва межмолекулярных связей. К примеру, жидкое агрегатное состояние кислорода наблюдается только при снижении температуры газа до −183 °C. При −223 °C молекулы О2 образуют твердое вещество. При повышении температуры сверх приведенных значений кислород превращается в газ. Именно в таком виде он находится при обычных условиях. На промышленных предприятиях действуют специальные установки для разделения воздуха атмосферы и получения из него азота и кислорода. Сначала воздух охлаждают и сжижают, а затем постепенно повышают температуру. Азот и кислород превращаются в газы при разных условиях.
Атмосфера Земли содержит 21 % по объему кислорода и 78 % азота. В жидком виде эти вещества в газовой оболочке планеты не встречаются. Жидкий кислород имеет светло-синий цвет, им при высоком давлении заполняют баллоны для использования в медицинских учреждениях. В промышленности и строительстве сжиженные газы необходимы для проведения очень многих процессов. Кислород нужен для газовой сварки и резки металлов, в химии — для реакций окисления неорганических и органических веществ. Если открыть вентиль кислородного баллона, давление уменьшается, жидкость превращается в газ.
Сжиженные пропан, метан и бутан находят широкое применение в энергетике, на транспорте, в промышленности и хозяйственно-бытовой деятельности населения. Получают эти вещества из природного газа или при крекинге (расщеплении) нефтяного сырья. Углеродные жидкие и газообразные смеси играют важную роль в экономике многих стран. Но запасы нефти и природного газа сильно истощены. По оценкам ученых, этого сырья хватит на 100–120 лет. Альтернативный источник энергии - воздушный поток (ветер). Используются для работы электростанций быстротекущие реки, приливы на берегах морей и океанов.

Кислород, как и другие газы, может находиться в четвертом агрегатном состоянии, представляя собой плазму. Необычный переход из твердого состояния в газообразное — характерная черта кристаллического йода. Вещество темно-фиолетового цвета подвергается сублимации — превращается в газ, минуя жидкое состояние.
Как осуществляются переходы из одной агрегатной формы материи в другую?
Изменения агрегатного состояния веществ не связаны с химическими превращениями, это физические явления. При повышении температуры многие твердые тела плавятся, превращаются в жидкости. Дальнейшее повышение температуры может привести к испарению, то есть к газообразному состоянию вещества. В природе и хозяйстве такие переходы характерны для одного из главных веществ на Земле. Лед, жидкость, пар — это состояния воды при разных внешних условиях. Соединение одно и то же, его формула — Н2О. При температуре 0 °С и ниже этого значения вода кристаллизуется, то есть превращается в лед. При повышении температуры возникшие кристаллики разрушаются — лед тает, вновь получается жидкая вода. При ее нагревании образуется водяной пар. Испарение — превращение воды в газ — идет даже при низких температурах. Например, замерзшие лужи постепенно исчезают, потому что вода испаряется. Даже в морозную погоду мокрое белье высыхает, но только процесс этот более длительный, чем в жаркий день.
Все перечисленные переходы воды из одного состояния в другое имеют огромное значение для природы Земли. Атмосферные явления, климат и погода связаны с испарением воды с поверхности Мирового океана, переносом влаги в виде облаков и тумана на сушу, выпадением осадков (дождя, снега, града). Эти явления составляют основу Мирового круговорота воды в природе.

Как меняются агрегатные состояния серы?
При обычных условиях сера — это яркие блестящие кристаллы или светло-желтый порошок, т. е. это твердое вещество. Агрегатное состояние серы меняется при нагревании. Сначала при повышении температуры до 190 °C желтое вещество плавится, превращаясь в подвижную жидкость.
Если быстро вылить жидкую серу в холодную воду, то получается коричневая аморфная масса. При дальнейшем нагревании расплава серы он становится все более вязким, темнеет. При температуре свыше 300 °C агрегатное состояние серы снова изменяется, вещество приобретает свойства жидкости, становится подвижным. Эти переходы возникают благодаря способности атомов элемента образовывать цепочки разной длины.
Почему вещества могут находиться в разных физических состояниях?
Агрегатное состояние серы — простого вещества — твердое при обычных условиях. Диоксид серы — газ, серная кислота — маслянистая жидкость тяжелее воды. В отличие от соляной и азотной кислот она не летучая, с ее поверхности не испаряются молекулы. Какое агрегатное состояние имеет пластическая сера, которую получают при нагревании кристаллов?
В аморфном виде вещество имеет структуру жидкости, обладая незначительной текучестью. Но пластическая сера одновременно сохраняет форму (как твердое вещество). Существуют жидкие кристаллы, обладающие рядом характерных свойств твердых веществ. Таким образом, состояние вещества при разных условиях зависит от его природы, температуры, давления и других внешних условий.
Какие существуют особенности в строении твердых тел?
Имеющиеся различия между основными агрегатными состояниями материи объясняются взаимодействием между атомами, ионами и молекулами. Например, почему твердое агрегатное состояние вещества приводит к способности тел сохранять объем и форму? В кристаллической решетке металла или соли структурные частицы притягиваются другу к другу. В металлах положительно заряженные ионы взаимодействуют с так называемым «электронным газом» — скоплением свободных электронов в куске металла. Кристаллы солей возникают благодаря притяжению разноименно заряженных частиц — ионов. Расстояние между вышеперечисленными структурными единицами твердых тел намного меньше, чем размеры самих частиц. В этом случае действует электростатическое притяжение, оно придает прочность, а отталкивание недостаточно сильное.
Чтобы разрушить твердое агрегатное состояние вещества, надо приложить усилия. Металлы, соли, атомные кристаллы плавятся при очень высоких температурах. К примеру, железо становится жидким при температуре выше 1538 °С. Тугоплавким является вольфрам, из него изготавливают нити накаливания для электрических лампочек. Есть сплавы, которые становятся жидкими при температурах свыше 3000 °С. Многие горные породы и минералы на Земле находятся в твердом состоянии. Добывают это сырье с помощью техники в шахтах и карьерах.

Для отрыва даже одного иона от кристалла необходимо затратить большое количество энергии. Но ведь достаточно растворить соль в воде, чтобы кристаллическая решетка распалась! Это явление объясняется удивительными свойствами воды как полярного растворителя. Молекулы Н2О взаимодействуют с ионами соли, разрушая химическую связь между ними. Таким образом, растворение — это не простое перемешивание разных веществ, а физико-химическое взаимодействие между ними.
Как взаимодействуют молекулы жидкостей?
Вода может быть жидкостью, твердым веществом и газом (паром). Это ее основные агрегатные состояния при обычных условиях. Молекулы воды состоят из одного атома кислорода, с которым связаны два атома водорода. Возникает поляризация химической связи в молекуле, на атомах кислорода появляется частичный отрицательный заряд. Водород становится положительным полюсом в молекуле, притягивается атомом кислорода другой молекулы. Это слабое взаимодействие получило название «водородная связь».
Жидкое агрегатное состояние характеризуют расстояния между структурными частицами, сравнимые с их размерами. Притяжение существует, но оно слабое, поэтому вода не сохраняет форму. Парообразование происходит из-за разрушения связей, которое идет на поверхности жидкости даже при комнатной температуре.

Существуют ли межмолекулярные взаимодействия в газах?
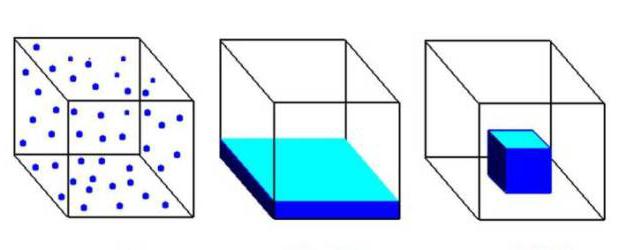
Газообразное состояние вещества по ряду параметров отличается от жидкого и твердого. Между структурными частицами газов существуют большие промежутки, намного превышающие размеры молекул. При этом силы притяжения совсем не действуют. Газообразное агрегатное состояние характерно для веществ, присутствующих в составе воздуха: азота, кислорода, диоксида углерода. На рисунке ниже первый куб заполнен газом, второй жидкостью, а третий — твердым вещество.
Многие жидкости являются летучими, с их поверхности отрываются и переходят в воздух молекулы вещества. Например, если к отверстию открытой бутылки с соляной кислотой поднести ватку, смоченную в нашатырном спирте, то появляется белый дым. Прямо в воздухе происходит химическая реакция между соляной кислотой и аммиаком, получается хлорид аммония. В каком агрегатном состоянии находится это вещество? Его частички, образующие белый дым, представляют собой мельчайшие твердые кристаллы соли. Этот опыт надо проводить под вытяжкой, вещества являются токсичными.
Заключение
Агрегатное состояние газа изучали многие выдающиеся физики и химики: Авогадро, Бойль, Гей-Люссак, Клайперон, Менделеев, Ле-Шателье. Ученые сформулировали законы, объясняющие поведение газообразных веществ в химических реакциях, при изменении внешних условий. Открытые закономерности не только вошли в школьные и вузовские учебники физики и химии. Многие химические производства основаны на знаниях о поведении и свойствах веществ, находящихся в разных агрегатных состояниях.
fb.ru
Проект -агрегатные состояния воды
Просмотр содержимого документа «Проект -агрегатные состояния воды»

Проект
По теме «Агрегатное состояние воды»
2017 учебный год

Актуальность
Этот проект нужен для того чтобы знать описание разных агрегатных состояний воды, чтобы различить их. Узнать как мы можем применять воду в разных агрегатных состояниях.

Цель: выяснить какие виды агрегатного состояния воды существуют, и где мы можем столкнуться с ними в жизни, какое действие они оказывают на человеческий организм.
Задачи:
1) Найти информацию об агрегатных состояниях воды.
2) Применение агрегатных состояний в жизни.
3) Польза и вред, которые может нанести вода вода в разных состояниях.

Что такое агрегатное состояние вещества?
- Агрегатное состояние вещества - состояние одного и того же вещества в определённом интервале температур и давлений, характеризующееся определёнными, изменными в пределах указанных интервалов, качественными свойствами.
- Традиционно выделяют три агрегатных состояния: твёрдое тело, жидкость и газ. К агрегатным состояниям принято причислять также плазму, в которую переходят газы при повышении температуры и фиксированном давлении.

Состояние воды:

Изменение агрегатных состояний воды
- Кипение и парообразование — переход воды из жидкого состояния в пар;
- Конденсация — процесс перехода пара в жидкое состояние воды ;
- Кристаллизация — переход жидкости в лед;
- Плавление – переход льда в жидкость;
- Сублимация – переход льда прямо в парообразное состояние;
- Десублимация – переход пара сразу в лед, примером может служить иней.

Жидкость
Жидкость — вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями. В жидком состоянии вещество сохраняет объём, но не сохраняет форму. Это означает, что жидкость может занимать только часть объёма сосуда, но также может свободно перетекать по всей поверхности сосуда. Жидкое состояние обычно считают промежуточным между твёрдым телом и газом

Применения:
- Вода нужна для хорошего функционирования всего организма.
- Она участвует в обмене веществ в организме.
- Выступает средством очистки в организме
Лечебные свойства и гигиена:
- Лечебные: ванны, обливание, обтирание, обёртывание.
- Гигиена: умывание, чистка зубов, мытьё рук, уборка, стирка и т.д.
- Для большей пользы нам надо употреблять от 1.5 до 2.5 литров воды в день.

Вред:
- Заражение от употребления грязной воды.
- Наводнение, затопление, цунами.
- Излишки воды могут привести к заболеваниям.
- Техногенные катастрофы.

Газ
- Газ - одно из четырёх агрегатных состояний вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью.
- Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни объём. Газ заполняет всё доступное пространство и проникает в любые его закоулки. Это состояние, свойственное веществам с малой плотностью. Переход из жидкого в газообразное состояние называют испарением, а противоположный ему переход из газообразного состояния в жидкое — конденсацией. Переход из твёрдого состояния в газообразное, минуя жидкое, называют сублимацией или возгонкой.

Вред и польза
Польза :
- Паровые ванночки для лица.
- Сухой пар в сауне и влажный в бане.
- В строительстве и производстве строительных материалов.
- В сельском хозяйстве.
Вред :
- Паровые ожоги.
- Вдыхание щелочных и кислотных паров.
- Летальный исход.

Твёрдое тело
- Твёрдое тело — это одно из четырёх агрегатных состояний вещества, отличающееся от других агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия.
- В твёрдом состоянии вещество сохраняет как форму, так и объём. При низких температурах все вещества замерзают — превращаются в твёрдые тела. Температура затвердевания может быть несколько повышена при увеличении давления. Твёрдые тела делятся на кристаллические и аморфные.

Польза:
- Лёд замедляет старение кожи.
- Очищает и сужает поры.
- Способствует улучшению циркуляции крови.
- Снимает опухлости и отёки.
- Избавляет от тёмных кругов.

Вывод:
Одно вещество в разных агрегатных состояниях может оказывать как положительное, так и отрицательное действие на человеческий организм, принося положительную пользу, но так же и смертельный вред нашему организму.

Спасибо за внимание!
multiurok.ru