Содержание
Карбид кальция, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
«Зеленое» использование карбида кальция
1917
Добавить в закладки
Химики-теоретики Санкт-Петербургского государственного
университета и Института органической химии РАН имени
Н.Д. Зелинского разработали новую стратегию использования
карбида кальция в синтезе органических соединений.
Исследователи предложили новый подход, основываясь
на результатах моделирования взаимодействия карбида кальция
с водой и диметилсульфоксидом. Научная
работа опубликована в журнале Королевского
химического общества Chemical Science.
Карбид кальция известен человечеству уже более 150 лет — это
твердое вещество желтовато-белого, бежевого или серого цвета,
полученное в результате соединения кальция с углеродом.
Сегодня карбид кальция используют для получения газообразного
ацетилена, который широко применяется
в промышленности — от производства уксусной
кислоты и этилового спирта, до пластмассы, каучука
и ракетных двигателей.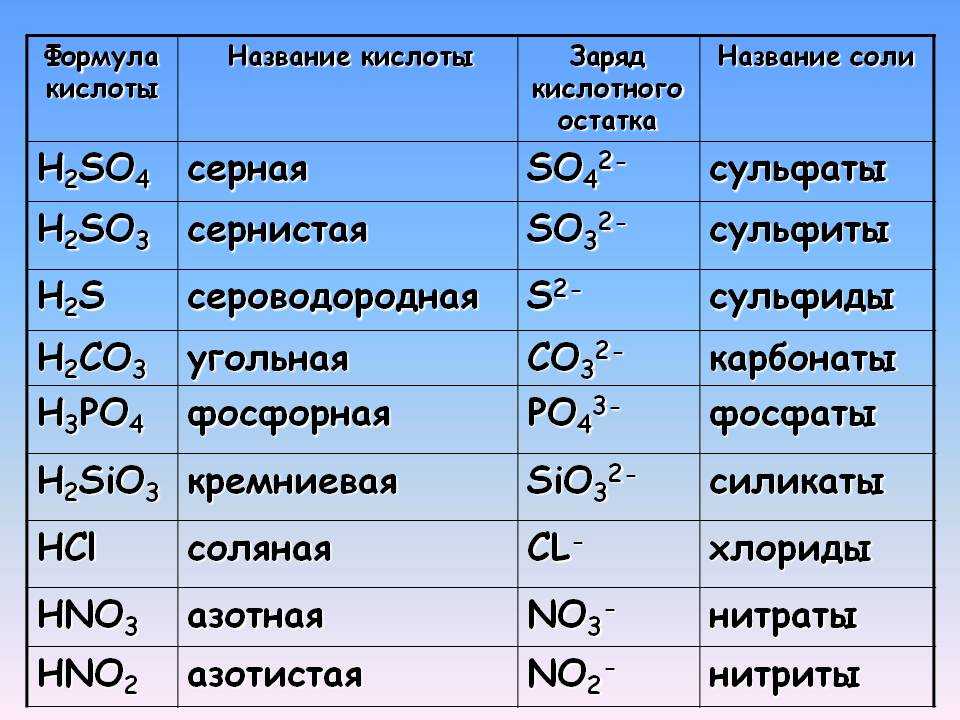
Углерод, необходимый для синтеза карбида кальция, добывается
не оптимальным с точки зрения концепции устойчивого
развития способом — в шахтах. В результате запасы
ископаемого ресурса истощаются (не устойчивый подход),
а над поверхностью земли растет количество углерода.
«Мы работаем над стратегией
углерод-нейтрального цикла производства. В частности,
для получения карбида кальция можно использовать углерод,
добываемый при термическом разложении (пиролизе) отходов,
а полученное в результате вещество — применять
в промышленности для создания новых соединений», —
отметил Константин Родыгин, научный сотрудник лаборатории
кластерного катализа СПбГУ.
Исследование было поддержано грантом СПбГУ и проводилось
в рамках проекта по актуальной химии карбида кальция,
которым занимается лаборатория кластерного катализа Университета
при участии исследователей из Института органической химии
имени Н.Д. Зелинского РАН. Значительная часть моделирования
была проведена с помощью мощностей РЦ «Вычислительный
центр» Научного парка СПбГУ.
«Главным вызовом для человечества сегодня является создание
промышленных процессов нового поколения, позволяющих получать
важнейшие органические соединения и материалы в рамках
углерод-нейтрального подхода. Особое значение имеет замена
ископаемых ресурсов на возобновляемые
и решение, таким образом, экологических задач. Как было
показано в наших работах, органический синтез на базе
карбида кальция открывает новые возможности для реализации
углерод-нейтральных технологий. Причем ключевое значение имеет
понимание химических процессов трансформации карбидных частиц
в химических процессах в растворе», — отметил
руководитель лаборатории кластерного катализа СПбГУ, заведующий
лабораторией металлокомплексных и наноразмерных
катализаторов Института органической химии имени
Н.Д. Зелинского РАН, академик РАН Валентин Анаников.
Предложить новую стратегию использования вещества химики смогли
с помощью моделирования процессов, возникающих
на уровне атомов и молекул при взаимодействии карбида
кальция с водой и растворителем диметилсульфоксидом.
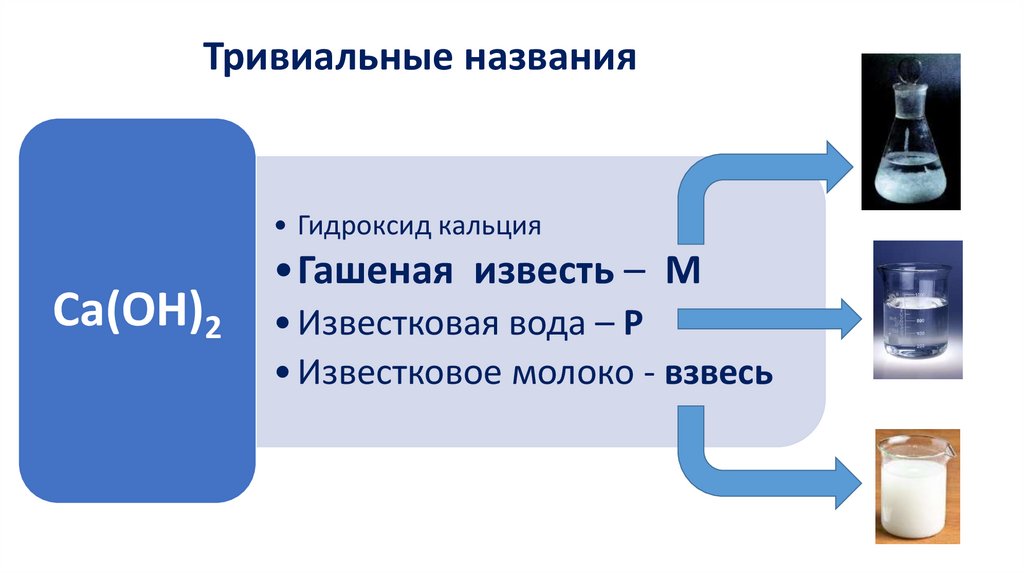
Карбид кальция — это, по сути, соль, включающая
отрицательно заряженные кислотные остатки ацетилена (так
называемые ацетиленид-анионы с зарядом -2)
и положительно заряженные ионы кальция. В работе
исследовались кислотно-основные свойства ацетиленид-анионов, воды
и некоторых других веществ в растворителе
диметилсульфоксиде. В таком растворителе можно наблюдать
необычную ситуацию: взаимодействие ацетиленид-анионов
и воды, называемое гидролизом, идет не полностью.
Образуются анионы с зарядом -1, которые потом могут вступать
в широкий спектр ключевых для органического синтеза
химических реакций.
«После проведения анализа выяснилось, что вместо воды можно
использовать и другие протонирующие вещества для перевода
ацетиленида в раствор, а в качестве растворителя
для реакций с карбидом кальция можно искать альтернативные
диметилсульфоксиды, еще менее токсичные и «зеленые»
растворители. Таким образом, производство с участием карбида
кальция в перспективе может стать более «зеленым»
не только из-за потенциально более безопасных способов
добычи углерода, но и благодаря возможности карбида
кальция вступать в реакции с менее токсичными
растворителями», — рассказал соавтор статьи, ассистент
Института химии СПбГУ Михаил Полынский.
Отметим, что одним из авторов статьи стала выпускница СПбГУ
Мария Сапова, начавшая работу над проектом во время обучения
в магистратуре. «Задача меня сразу привлекла: идея
комбинации различных расчетных методов открывает большие
возможности для моделирования сложных процессов, как, например,
процесс растворения в нашем случае. Эта работа помогла
не просто расширить кругозор, а выйти за рамки
задач по моделированию кристаллов, которыми
я занималась, и почувствовать границы применимости
различных методов расчетной химии. Думаю, что такие сложные
многоступенчатые подходы в моделировании должны развиваться
дальше: это позволит нам приблизиться к описанию реальных
экспериментов», — отметила Мария Сапова.
Как уточнил Михаил Полынский, работа на данном этапе —
полностью теоретическая и заключалась в компьютерном
моделировании процесса получения ацетиленидов из карбида
кальция. «Для моделирования мы использовали так
называемые квантово-химические методы, борн-оппенгеймеровскую
молекулярную динамику. В результате такого моделирования
В результате такого моделирования
можно сделать короткое молекулярное кино, показывающее, как
выглядит движение атомов и молекул на очень коротких,
пикосекундных временных интервалах», — заключил Михаил
Полынский.
Фото — СПбГУ.
Автор Пресс-Служба СПБГУ
Разместила Наталия Малахова
СПбГУ
карбид кальция
карбидные частицы
органические соединения
Источник:
СПбГУ
Информация предоставлена Информационным агентством «Научная Россия». Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано
Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
НАУКА ДЕТЯМ
Ученые разработали биоразлагаемые нетканые материалы для ускоренного заживления ран
14:00 / Медицина, Химия
Самая рождественская сказка. Эрнст Теодор Амадей Гофман, «Щелкунчик»
13:00 / Досуг, Персона, Чтение
Похолодание на 10 тысяч лет «изгнало» неандертальцев с Северо-Западного Кавказа
12:00 / Археология, Климат
«Уродилась Коляда накануне Рождества». Лекция главного научного сотрудника Российского этнографического музея Изабеллы Шангиной
Лекция главного научного сотрудника Российского этнографического музея Изабеллы Шангиной
10:30 / История, Этнография
Нитрид бора очистит сточные воды от антибиотиков
14:00 / Химия
Ученые Пермского Политеха изучили стабильность «основы» для потенциального анальгетика
12:00 / Химия
Праздник на орбите
10:30 / Космонавтика, Наука и общество
Казанские ученые первыми в России вырастили кристалл LiGdF4 с заданными магнитными свойствами
14:00 / Физика
Тяжелые металлы и органические загрязнители активировали почвенную плесень
12:00 / Биология
Как в СССР заново создавали Новый год? Лекция кандидата исторических наук Марьяны Архиповой
10:30 / История, Наука и общество, Этнография
Памяти великого ученого. Наука в глобальном мире. «Очевиднное — невероятное» эфир 10.05.2008
04.03.2019
Памяти великого ученого.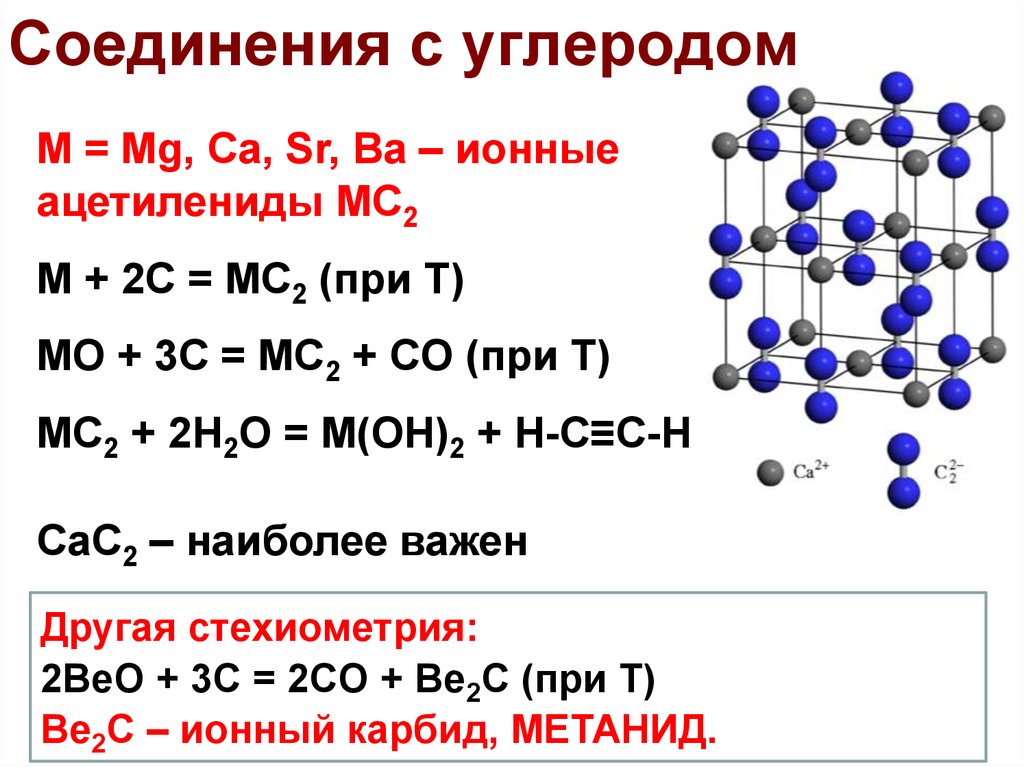 Нанотехнологии. «Очевидное — невероятное» эфир 3.08.2002
Нанотехнологии. «Очевидное — невероятное» эфир 3.08.2002
04.03.2019
Вспоминая Сергея Петровича Капицу
14.02.2017
История новогодних праздников
01.08.2014
Смотреть все
WebWISER — Главная
WISER — это система, предназначенная для оказания помощи аварийно-спасательным службам при инцидентах с опасными материалами. Известные вещества Поиск вещества в базе данных известных веществ WISER. Помогите определить химическое вещество Определите неизвестное химическое вещество на основе его физических свойств, симптомов воздействия, окружающей среды и других критериев. Инструменты Ознакомьтесь с общими инструментами и справочными материалами. Последние новости
WebWISER лучше всего просматривать в следующих браузерах (указанная версия или выше): Internet Explorer 9, Firefox 26, Safari 7 или Google Chrome 30. WISER также доступен как отдельное приложение для ПК и различных мобильных платформ. | Другие ресурсы для чрезвычайных ситуаций с химическими веществами в NLM
Other Chemical Emergency Resources
|
ICSC 0406 — КАРБИД КАЛЬЦИЯ
ICSC 0406 — КАРБИД КАЛЬЦИЯ
| КАРБИД КАЛЬЦИЯ | ICSC: 0406 (апрель 2017 г. ) ) |
| Кальция ацетилид Ацетиленоген | |
| Номер CAS: 75-20-7 |
| № ООН: 1402 |
| Номер ЕС: 200-848-3 |
| ОСТРЫЕ ОПАСНОСТИ | ПРЕДУПРЕЖДЕНИЕ | ПОЖАРОТУШЕНИЕ | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горюч, но образует легковоспламеняющийся газ при контакте с водой или влажным воздухом. Многие реакции могут привести к возгоранию или взрыву. Опасность возгорания и взрыва при контакте с водой. | НЕТ контакта с водой. Используйте искробезопасный ручной инструмент. Замкнутая система, пылевзрывозащищенное электрооборудование и освещение. Предотвратить осаждение пыли. Предотвратить осаждение пыли. | Используйте специальный порошок, сухой песок. НИКАКИХ других агентов. В случае пожара: охлаждайте бочки и т. д., обрызгивая их водой. НЕТ прямого контакта с водой. |
| ПРЕДОТВРАТИТЬ РАССЕЯНИЕ ПЫЛИ! СТРОГО ГИГИЕНА! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРЕДУПРЕЖДЕНИЕ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Затрудненное дыхание. Одышка. Больное горло. | Используйте местную защиту от выхлопных газов или дыхательных путей. | Свежий воздух, отдых. Полупрямое положение. Немедленно обратитесь за медицинской помощью. |
| Кожа | Покраснение. Кожа горит. Боль. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промойте кожу большим количеством воды или примите душ. Немедленно обратитесь за медицинской помощью. Немедленно обратитесь за медицинской помощью. |
| Глаза | Покраснение. Боль. Затуманенное зрение. Тяжелые глубокие ожоги. | Носите защитные очки или средства защиты глаз в сочетании с защитой органов дыхания, если порошок. | Промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно). Немедленно обратитесь за медицинской помощью. |
| Проглатывание | Затрудненное дыхание. Шок или коллапс. Далее см. Вдыхание. | Не есть, не пить и не курить во время работы. Мойте руки перед едой. | Прополоскать рот. Не вызывает рвоту. Немедленно обратитесь за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Удалите все источники воспламенения. Смести просыпанное вещество в закрытые чистые сухие контейнеры. Аккуратно соберите остаток. Затем храните и утилизируйте в соответствии с местным законодательством. НЕ используйте воду. Смести просыпанное вещество в закрытые чистые сухие контейнеры. Аккуратно соберите остаток. Затем храните и утилизируйте в соответствии с местным законодательством. НЕ используйте воду. | В соответствии с критериями СГС ООН ОПАСНОСТЬ При контакте с водой выделяют легковоспламеняющиеся газы, которые могут самовозгораться Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от несовместимых материалов. См. Химическая опасность. Сухой. Хорошо закрытый. | |
| УПАКОВКА | |
| Герметичный. |
| КАРБИД КАЛЬЦИЯ | КМГС: 0406 |
| ФИЗИЧЕСКАЯ И ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физические опасности Химическая опасность | Формула: CaC 2 |
| ВОЗДЕЙСТВИЕ И ВЛИЯНИЕ НА ЗДОРОВЬЕ | |
|---|---|
Пути воздействия Последствия кратковременного воздействия | Риск вдыхания Последствия длительного или многократного воздействия |
| ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ НА РАБОЧЕМ МЕСТЕ |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| Настоятельно рекомендуется не допускать попадания химиката в окружающую среду. |
| ПРИМЕЧАНИЯ |
|---|
Бурно реагирует с такими средствами пожаротушения, как вода, с образованием взрывоопасного газа.
|


 Эта функция ограничена только данными ERG.
Эта функция ограничена только данными ERG.

 Затем следуйте инструкциям вашего устройства, чтобы поделиться ссылкой через приложение (например, текстовое сообщение) или скопировать ссылку данных в буфер обмена. В WebWISER скопируйте ссылку из меню или, в случае более сложных данных (например, химическая активность и защитное расстояние), выберите соответствующую кнопку «Копировать ссылку».
Затем следуйте инструкциям вашего устройства, чтобы поделиться ссылкой через приложение (например, текстовое сообщение) или скопировать ссылку данных в буфер обмена. В WebWISER скопируйте ссылку из меню или, в случае более сложных данных (например, химическая активность и защитное расстояние), выберите соответствующую кнопку «Копировать ссылку».
 Будьте в курсе последней информации из следующего:
Будьте в курсе последней информации из следующего:


 ..
..