Лабораторная работа. Определение остаточного активного хлора. Определение остаточного хлора в воде питьевой
ГОСТ 18190-72
ГОСТ 18190-72
Группа Н09
МКС 13.060.20
Дата введения 1974-01-01
1. УТВЕРЖДЕН и ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 25.10.72 N 1967
2. ВВЕДЕН ВПЕРВЫЕ
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка | Номер пункта |
ГОСТ 61-75 | 2.2 |
ГОСТ 84-76 | 2.2 |
ГОСТ 1770-74 | 2.2, 3.2, 4.2 |
ГОСТ 2874-82 | 1.1 |
ГОСТ 3118-77 | 3.2 |
ГОСТ 4198-75 | 4.2 |
ГОСТ 4204-77 | 2.2, 4.2 |
ГОСТ 4208-72 | 4.2 |
ГОСТ 4220-75 | 2.2 |
ГОСТ 4232-74 | 2.2, 4.2 |
ГОСТ 6709-72 | 2.2, 3.2, 4.2 |
ГОСТ 9147-80 | 3.2 |
ГОСТ 10163-76 | 2.2 |
ГОСТ 10652-73 | 4.2 |
ГОСТ 11773-76 | 4.2 |
ГОСТ 24481-80 | 1.1 |
ГОСТ 25336-82 | 2.2, 3.2 |
ГОСТ 27068-86 | 2.2 |
ГОСТ 29169-91 | 2.2 |
ГОСТ 29251-91 | 2.2, 3.2, 4.2 |
ТУ 6-09-5171-84* | 3.2 |
________________* ТУ, упомянутые здесь и далее по тексту, являются авторской разработкой. За дополнительной информацией обратитесь по ссылке. - Примечание изготовителя базы данных.
4. Ограничение срока действия снято Постановлением Госстандарта СССР от 25.12.91 N 2120
5. ПЕРЕИЗДАНИЕ. Ноябрь 2009 г.Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания остаточного активного хлора.
1. МЕТОДЫ ОТБОРА ПРОБ
1.1. Пробы воды отбирают по ГОСТ 24481* и ГОСТ 2874**.__________________* На территории Российской Федерации действует ГОСТ Р 51593-2000.** На территории Российской Федерации действует ГОСТ Р 51232-98.
1.2. Объем пробы воды для определения содержания активного хлора не должен быть менее 500 см
1.3. Пробы воды не консервируют. Определение следует проводить немедленно после отбора пробы.
2. ЙОДОМЕТРИЧЕСКИЙ МЕТОД
2.1. Сущность методаМетод основан на окислении йодида активным хлором до йода, который титруют тиосульфатом натрия. Озон, нитриты, окись железа и другие соединения в кислом растворе выделяют йод из йодистого калия, поэтому пробы воды подкисляют буферным раствором с рН 4,5.Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0,3 мг/дм

2.2. Аппаратура, материалы и реактивыПосуда мерная лабораторная стеклянная по ГОСТ 1770, ГОСТ 29169 и ГОСТ 29251, вместимостью: колбы мерные 100 и 1000 см




2.3. Подготовка к анализу
2.3.1. Приготовление 0,1 н. раствора серноватистокислого натрия
25 г тиосульфата натрия Na






2.3.2. Приготовление 0,01 н. раствора серноватистокислого натрия
100 см


2.3 3. Приготовление 0,005 н. раствора серноватистокислого натрия
50 см


2.3.4. Приготовление 0,01 н. раствора двухромовокислого калия0,4904 г двухромовокислого калия K



2.3.5. Приготовление 0,5%-ного раствора крахмала0,5 г растворимого крахмала смешивают с небольшим объемом дистиллированной воды, приливают к 100 cм
2.3.6. Приготовление буферного раствора рН 4,5
102 cм






2.3.7. Поправочный коэффициент 0,01 н. раствора серноватистокислого натрия определяют по 0,01 н. pacтвopy двухромовокислого калия следующим образом: в коническую колбу и с пришлифованной пробкой помещают 0,5 г йодистого калия, проверенного на отсутствие йода, растворяют в 2 cм




2.3.8. Поправочный коэффициент (

где 

2.4. Проведение анализаВ коническую колбу насыпают 0,5 г йодистого калия, растворяют его в 1-2 cм


2.5. Обработка результатовСодержание суммарного остаточного хлора (


где 





3. МЕТОД ОПРЕДЕЛЕНИЯ СВОБОДНОГО ОСТАТОЧНОГО ХЛОРА ТИТРОВАНИЕМ МЕТИЛОВЫМ ОРАНЖЕВЫМ
3.1. Сущность методаМетод основан на окислении свободным хлором метилового оранжевого, в отличие от хлораминов, окислительный потенциал которых недостаточен для разрушения метилового оранжевого.
3.2. Аппаратура, материалы, реактивыПосуда мерная лабораторная стеклянная по ГОСТ 1770 и ГОСТ 29251, вместимостью: колбы мерные 100 и 1000 cм


3.3. Подготовка к анализу
3.3.1. Приготовление 0,005%-ного раствора метилового оранжевого
50 мг метилового оранжевого растворяют в дистиллированной воде в мерной колбе и доводят дистиллированной водой до 1 дм

3.3 2. Приготовление 5 н. раствора соляной кислотыВ мерную колбу наливают дистиллированную воду, затем медленно добавляют 400 cм

3.4. Проведение анализа
100 cм
3.5. Обработка результатовСодержание свободного остаточного хлора (


где 





4. МЕТОД РАЗДЕЛЬНОГО ОПРЕДЕЛЕНИЯ СВОБОДНОГО ХЛОРА, СВЯЗАННОГО МОНОХЛОРАМИНА И ДИХЛОРАМИНА ПО МЕТОДУ ПЕЙЛИНА
4.1. Сущность методаМетод основан на способности разных видов хлора превращать в определенных условиях восстановленную бесцветную форму диэтилпарафенилендиамина в полуокисленную окрашенную форму, которую восстанавливают опять до бесцветной ионами двухвалентного железа. Используется серия титрований раствором соли Мора для определения свободного хлора, монохлорамина и дихлорамина в присутствии диэтилпарафенилендиамина, как индикатора. Свободный хлор образует окраску индикатора в отсутствии йодистого калия, монохлорамин дает окраску в присутствии очень маленьких количеств йодистого калия (2-3 мг), а дихлорамин образует окраску лишь в присутствии больших количеств KI (около 1 г) и при стоянии раствора в течение 2 мин. По количеству раствора соли Мора, израсходованному на титрование, определяют содержание того вида активного хлора, за счет которого образуется окрашенная форма индикатора.
4.2. Аппаратура, материалы, реактивыПосуда мерная стеклянная лабораторная по ГОСТ 1770 и ГОСТ 29251, вместимостью: колбы мерные 100 и 1000 cм




4.3. Подготовка к анализу
4.3.1. Приготовление стандартного раствора соли Мора 1,106 г соли Мора Fe(NH











4.3.2. Приготовление фосфатного буферного раствораК 2,4 г фосфорнокислого натрия двузамещенного Na





4.3.3. Приготовление индикатора диэтилпарафенилендиамина (оксалата или сульфата) 0,1%-ного раствора0,1 г диэтилпарафенилендиамина оксалата (или 0,15 г сульфата) растворяют в 100 cм

4.4. Проведение анализа
4.4.1. Определение содержания свободного хлораВ коническую колбу для титрования помещают 5 cм







4.4.2. Определение содержания монохлораминаВ колбу с оттитрованным раствором добавляют кристаллик (2-3 мг) йодистого калия, раствор перемешивают. В присутствии монохлорамина мгновенно появляется розовая окраска, которую тотчас же оттитровывают стандартным раствором соли Мора. Количество кубических сантиметров соли Мора, пошедшее на титрование (


4.4.3. Определение содержания дихлораминаК оттитрованному раствору после определения содержания монохлорамина вновь добавляют около 1 г йодистого калия, перемешивают до растворения соли и оставляют раствор стоять в течение 2 мин. Появление розовой окраски свидетельствует о наличии в воде дихлорамина. Раствор титруют стандартным раствором соли Мора до исчезновения окраски. Расход соли Мора (


4.5. Обработка результатовСодержание суммарного остаточного активного хлора (


где 





docs.cntd.ru
Определение остаточного активного хлора
В водопроводной воде
Цель работы:научиться определять концентрацию остаточного активного хлора в водопроводной воде.
Основные теоретические положения
Хлор может существовать в воде в составе хлоридов и таких соединений как: свободный хлор (Cl2), гипохлорит-анион (ClO-), хлорноватистая кислота (HСlO), хлорамины (монохлорамин Nh3Cl, дихлорамин NHCl2, трихлорид азота NCl3).
Суммарное содержание этих соединений называют термином «активный хлор». Активный хлор существует в двух формах: свободный хлор и связанный хлор. Свободный хлор – хлор, присутствующий в воде в виде хлорноватистой кислоты, иона гипохлорита или растворенного элементарного хлора. Связанный хлор – хлор, присутствующий в воде в виде хлораминов. Общий хлор – сумма свободного и связанного хлора. Хлорамины – производные аммиака, образованные замещением одного, двух или трех атомов водорода атомами хлора.
Соединения, содержащие активный хлор используют для обеззараживания (дезинфекции) питьевой воды и воды в бассейнах, химической очистки некоторых сточных вод, ликвидации очагов распространения инфекционных загрязнений (например, хлорная известь).
Наиболее широко для дезинфекции питьевой воды используют свободный хлор, который при растворении в воде диспропорционирует по реакции
Cl2 +h3O = H+ + Cl- + HOCl
Эффект действия хлора на микроорганизмы зависит от начальной дозы хлора, продолжительности сохранения его воде и pH воды. Хлор расходуется на окисление примесей органического и неорганического происхождения.
При выборе дезинфицирующего вещества следует учитывать содержание в нем «активного хлора». «Активным» называют количество молекулярного хлора, отвечающее окислительной способности данного соединения относительно йодистого калия в кислой среде. Понятие «активный хлор» определяет не истинное содержание хлора в соединении, а окислительную способность соединения в кислой среде по йодистому калию.
В природной воде содержание «активного хлора» не допускается; в питьевой воде его предельно-допустимая концентрация (ПДК) установлена в пересчете на хлор, на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде.
«Активный хлор» присутствует в питьевой воде не более нескольких десятков минут и нацело удаляется даже при кратковременном кипячении воды. По этой причине анализ отобранной пробы на содержание активного хлора следует производить немедленно.
Сущность метода
Активный хлор определяется йодометрическим методом (методом йодометрического титрования). Метод основан, на свойстве всех содержащих активный хлор соединений в кислой среде, выделять из йодида калия свободный йод
Cl2 + 2I- = I2 + 2Cl-
ClO- + 2H+ + 2I- = I2 + Cl- + h3O
HClO + H+ + 2I- = I2 + Cl- + h3O
Nh3Cl + 2H+ + 2I- = I2 + Nh5+ + Cl-
Свободный йод оттитровывают раствором тиосульфата натрия в присутствии крахмала, который добавляют для более точного определения точки эквивалентности. Озон, нитриты, окись железа и другие соединения в кислом растворе выделяют йод из йодистого калия, поэтому пробы воды подкисляют буферным раствором с pH 4,5.
Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0,3 мг/л. Метод может использоваться для анализа мутных и окрашенных вод.
Посуда, реактивы
Колба коническая с пробкой на 250 мл, мерный цилиндр на 100 мл, бюретка на 25 мл, микробюретка на 5 мл, пипетки на 1мл, воронка
Раствор буферный ацетатный (pH 4,5), калий йодистый в кристаллах, раствор тиосульфата натрия (натрий серноватистокислый) (0,01 н. и 0,005 н.), раствор калия двухромовокислого (0,01 н.), кислота серная (25 %), раствор крахмала (0,5 %), дистиллированная вода
Порядок выполнения работы
1. Определение поправочного коэффициента
В коническую колбу помещают 0,5 г йодистого калия, растворяют в 2 мл дистиллированной воды, прибавляют 5 мл серной кислоты (25 %), затем 10 мл 0,01 н. раствора двухромовокислого калия, добавляют 80 мл дистиллированной воды, закрывают колбу пробкой, перемешивают и ставят в темное место на 5 мин. Выделившийся йод титруют тиосульфатом натрия в присутствии 1 мл крахмала, прибавленного в конце титрования.
2. Определение остаточного активного хлора
В коническую колбу насыпают 0,5 г йодистого калия, растворяют его в 1-2 мл дистиллированной воды, затем добавляют 1 мл буферного раствора, после чего добавляют 250 мл анализируемой воды. Выделившийся йод оттитровывают 0,005 н. раствором тиосульфата натрия из микробюретки до появления светло-желтой окраски, после чего прибавляют 1 мл 0,5 %-ного раствора крахмала и раствор титруют до исчезновения синей окраски. По делениям микробюретки определяют общий объем тиосульфата, израсходованный на титрование (как до, так и после добавления крахмала).
Обработка результатов
1. Поправочный коэффициент (0,01; 0,005 н. растворов серноватистокислого натрия) вычисляют по формуле
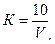
где 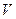 – количество серноватистокислого натрия, израсходованное на титрование, мл.
– количество серноватистокислого натрия, израсходованное на титрование, мл.
2. Концентрацию остаточного активного хлора (мг/л) вычисляют по формуле
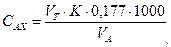
где VT – количество 0,005 н. раствора тиосульфата натрия, израсходованное на титрование, мл; K – поправочный коэффициент нормальности раствора тиосульфата натрия; 0,177 – содержание активного хлора в мг, соответствующее 1 мл 0,005 н. раствора тиосульфата; 1000 – коэффициент пересчета единиц измерения из миллилитров в литры; VA – объем пробы воды, взятый для анализа, мл.
Оформление результатов
Полученные результаты заносят в таблицу 1.1.
Таблица 1.1
Экспериментальные данные
| № пробы | V, мл | VT, мл | VА, мл |
Вопросы для самопроверки
1. Для чего необходимо хлорировать воду?
2. В составе каких соединений может присутствовать хлор в воде?
3. Что такое «активный» хлор, «свободный» и «связанный» хлор?
4. Сущность метода йодометрического титрования при определении «активного» хлора?
5. Предельно-допустимая концентрация «активного» хлора в питьевой воде?
6. Допускается ли содержание «активного» хлора в природной воде?
7. Почему анализ отобранной пробы на содержание «активного» хлора следует проводить немедленно?
Лабораторная работа № 2.
infopedia.su
Лабораторная работа. Определение остаточного активного хлора
Поиск ЛекцийСвободный хлор и некоторые соединения хлора применяют для дезинфекции питьевой и сточной воды. В промышленности хлор используют при отбеливании в бумажном производстве и производстве ваты, для уничтожения паразитов в холодильных установках и т.д.
При растворении хлора в воде образуются соляная и хлорноватистая кислоты:
Cl2 + h3O ↔ H+ + Cl- + HClO.
Активным называют хлор, который выделяется в свободном виде при взаимодействии вещества с соляной кислотой. Массовая доля активного хлора в веществе (в процентах) равна массе молекулярного хлора, который выделяется из 100 г вещества при взаимодействии с избытком HCI. Понятие «активный хлор» включает, кроме растворенного молекулярного хлора, и другие соединения хлора, как, например, хлорамины (монохлорамин - Nh3Cl и дихлорамин – NHCl2, а также в виде треххлористого азота NCl3), органические хлорамины, гипохлориты (гипохлорит-анион ClO-) и хлориты, т.е. вещества, определяемые иодометрическим методом.
Cl2 + 2I- = I2 + 2Cl-
ClO- + 2H+ + 2I- = I2 + 2Cl- + h3O
HClO + H+ + 2I- = I2 + Cl- + h3O
Nh3Cl+ 2H+ + 2I- = I2 + Nh5+ +Cl-.
Активный хлор содержат многие вещества. Самое старое известно под названием жавелевая вода (Жавель — пригород Парижа), которую приготовил еще в 1785 г. К. Бертолле из хлора и калиевого щелока и предложил заменить ею хлорную воду для отбеливания тканей. С 1820 г. начали пользоваться натриевым аналогом жавелевой воды — «лабараковой жидкостью». Эти растворы обычно содержат от 8 до 15 % активного хлора. Широкое применение нашла хлорная известь — дешевый технический продукт, имеющий переменный состав, который зависит от условий получения. Ею отбеливают ткани и целлюлозу, обеззараживают сточные воды, обезвреживают отравляющие вещества. Растворы гипохлоритов применяют для смыва полимерных покрытий с металлических сеток при производстве конденсаторов или для обработки полимерных подошв, чтобы они лучше приклеивались к верху обуви.
Иодометрический метод определения основан на том, что хлорсодержащие сильные окислители выделяют иод из раствора иодида. Выделившийся иод титруют раствором тиосульфата натрия, используя в качестве индикатора крахмал. Результаты определения выражают в мг Cl на 1 л воды. Чувствительность метода – 0,3 мгCl/л при объеме пробы 250 мл, однако, при использовании растворов тиосульфата с различной концентрацией объем пробы может составлять, в зависимости от требуемой чувствительности определения, от 500 до 50 мл воды и менее.
Содержание активного хлора определяют в дезинфицированной им питьевой воде, в сточных водах, загрязненных хлором или соединениями, выделяющими хлор. В природной воде содержание активного хлора не допускается; в питьевой воде его содержание установлено в пересчете на хлор на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде. Активный хлор в указанных концентрациях присутствует в питьевой воде непродолжительное время (не более нескольких десятков минут) и нацело удаляется даже при кратковременном кипячении воды. При определении активного хлора пробы нельзя консервировать, определение следует проводить немедленно после отбора пробы. Лимитирующий показатель вредности для активного хлора – общесанитарный.
Цель работы:измерение содержания активного хлора в воде и в образцах дезинфицирующих средств.
Объекты исследования:пробы водопроводной воды и образцы дезинфицирующих средств, в состав которых входят хлорсодержащие вещества.
Реактивы и оборудование:
- буферный ацетатный раствор (рН = 4,5),
- йодид калия,
- универсальная индикаторная бумага,
- 0,5%-ный раствор крахмала,
- 0,005 н раствор тиосульфата натрия,
- бюретки, конические колбы объемом 250 мл, мерный цилиндр на 100 мл, стеклянные палочки, пипетки на 5 мл,
- весы.
Ход работы:
1) Проведите предварительное исследование образцов на содержание активного хлора, например, с помощью тест-системы. При необходимости проведите разбавление образцов.
Объем пробы, необходимый для анализа при концентрации активного хлора от 0,5 до 5,0 мг/л составляет 50 мл, при концентрации 0,3 до 0,5 мг/л – 250 мл.
2) В коническую колбу насыпьте 0,5 г КI и растворите в 1-2 мл дистиллированной воды.
3) Добавьте 1 мл буферного раствора и затем 50-250 мл анализируемой воды (в зависимости от предварительных результатов анализа).
3) Колбу закройте пробкой и поместите в темное место. Через 10 мин выделившийся йод титруйте 0,005 н раствором тиосульфата натрия до появления светло-желтой окраски, после чего добавьте 1 мл 0,5%-ного раствора крахмала и продолжите титровать до исчезновения синей окраски.
4) Проведите расчеты и сделайте выводы.
Х = (а . К. 0,177. 1000)/V,
где: X – суммарный остаточный хлор, мг/л;
а – объем 0,005 н раствора тиосульфата натрия, израсходованного на титрование, мл;
К – поправочный коэффициент;
V – объем анализируемой пробы;
0,177 – содержание активного хлора, соответствующее 1 мл 0,005 н р-ра тиосульфата натрия, мг.
Дополнительная информация. Хлоремкость. Прежде чем решить вопрос об очистке сточной воды хлорированием, ее специально исследуют. При этом необходимо определить, с какой скоростью проходят реакции между содержащимися в воде веществами и хлором, доходят ли они до конца, какой требуется избыток добавляемого хлора для того, чтобы реакция прошла в желаемой степени в заданный промежуток времени t.
ОА – показывает содержание веществ, быстро окисляющихся хлором.
АК – процесс окисления и хлорирования веществ, медленно реагирующих с хлором, которые за время опыта не успевают прореагировать и остаются в растворе вместе с остаточным хлором.
КВ – отсутствие веществ, реагирующих с хлором.
Вопросы и задания для самостоятельной работы:
1. Зачем хлорируют воду? В чем преимущества и недостатки использования хлорированной питьевой воды?
2. Можете ли Вы предложить другие подходы к решению этой проблемы? Укажите преимущества и недостатки каждого из предложенных методов.
3. Сколько активного хлора содержит одна тонна вещества с массовой долей его 52%?
4. Почему хлороформ хранят в темных и заполненных доверху склянках?
5. Формально активный хлор могут содержать соединения, в которых вообще нет хлора — ведь это понятие определяет не истинное содержание хлора в соединении, а его окислительную способность по отношению к KI в кислой среде. Предложите несколько соединений, в растворах которых можно определить «активный хлор».
Приготовление растворов
1. Для приготовления 0.01 н раствора тиосульфата натрия 2,5 г его растворяют в свежепрокипяченной и охлаждённой дистиллированной воде, добавляют 0,2 г Na2СО3 и доводят объем до 1 л.
2. Для приготовления 0,005 н раствора тиосульфата натрия в мерную колбу объемом 1 л прибавляют 500 мл 0,01 н раствора тиосульфата натрия, 0,2 г Nа2СО3 и доводят объём до метки. Раствор используют при содержании активного хлора менее 1 мг/л.
3. Для приготовления 0,5%-ного раствора крахмала смешивают 0,5 г растворимого крахмала с небольшим количеством дистиллированной воды, а затем приливают к 100 мл кипящей дистиллированной воды и кипятят несколько минут. После охлаждения раствор консервируют, добавляя хлороформ или 0,1 г салициловой кислоты.
4. Для приготовления ацетатного буфера (рН = 4,5) в мерную колбу объемом 1 л приливают 102 мл 1 М уксусной кислоты (60г ледяной уксусной кислоты в 1 л дистиллированной воды), 98 мл 1 М раствора ацетата натрия (136,1 г СН3СООNа . 3Н2О в 1 л дистиллированной воды) и доводят объём раствора дистиллированной водой до метки.
poisk-ru.ru











