Химический анализ сточных вод предприятия. Сточные воды химического комбината вполне отвечают санитарным нормам
Олимпиада по химии. 9 класс. Ответы. на Сёзнайке.ру
Общее время выполнения работы – 4 часа
Задание 1.
Причиной образования смога – опасного для здоровья тумана – считают большое количество выхлопных газов автомобилей при высокой влажности воздуха. В смоге присутствует ядовитый диоксид, в состав которого входит элемент Х. Диоксид получается по реакции монооксида элемента Х с атомарным кислородом, источником которого являются молекулы вещества Y.
1) Определите элемент Х и формулы монооксида и диоксида элемента Х, вещество Y.
2) Каким образом образуется атомарный кислород? Под действием чего в атмосфере образуются радикалы?
3) Напишите два уравнения реакций образования диоксида Х из монооксида.
4) Рассчитайте скорость реакции образования диоксида Х, если через 5 минут после ее начала концентрация диоксида Х стала равна 0,05 моль/л, а через 20 минут – 0,08 моль/л.
5)
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
1) Элемент Х – азот, диоксид – NO2 , монооксид - NO, вещество Y – О3(озон). |
4 |
|
2) Уравнение реакции образования атомарного кислорода: О3 = О2 + О Радикалы образуются под действием ультрафиолетового излучения. |
0,5 0,5 |
|
3) Уравнения реакций образования диоксида: NO + О = NO2 (1) NO + О3 = NO2 + О2 (2) |
2 |
|
4) Расчет скорости реакции образования диоксида Х: скорость ? = ?C /??; скорость ? = (0,05 – 0,08) : (5 – 20) = 0,002 : 60 = 3,3 · 10-5(моль/л·сек). |
1 2 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
10 |
Задание 2.
Сточные воды химического комбината вполне отвечают санитарным нормам по содержанию азотной кислоты (30 мг/л). Объем промышленных стоков, содержащих азотную кислоту, составляет ежесуточно 75 м3.
1) Рассчитайте массовую долю и молярную концентрацию азотной кислоты в этих стоках (плотность раствора 1 г/мл).
2) Чему равна кислотность раствора азотной кислоты?
3) Сколько азотной кислоты уходит в канализацию с комбината ежесуточно?
4) Какой объем известковой воды, с массовой долей гидроксида кальция 5% (плотность = 1 г/мл), нужно добавить для полной нейтрализации азотной кислоты?
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
1) ?(НNO3) = 0,03 г : 1000 г = 3·10-5 или 3·10-3% С = m / М · V; С = 0,03 г : (63 г/моль · 1 л) = 4,8·10-4 моль/л |
1 1 |
|
2) Кислотность раствора азотной кислоты равна: рН = - lg4,8·10-4 моль/л; рН = 3,32. 3) Вычислим массу раствора кислоты, которая уходит с комбината ежесуточно: m(р-ра) = 75000 дм3 · 1 кг/дм3 = 75000 кг; m(НNO3) = 75000 кг · 3·10-5 = 2,25 кг |
2 1 1 |
|
4) 2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2h3O n(HNO3) = 2,25 : 63 = 0, 0357 Кмоль; n(Са(ОН)2 = 0,01786 Кмоль |
1 1 |
|
m(Ca(OH)2) = 0,01786 Кмоль · 74 кг/ Кмоль = 1,322 кг. m(р-ра) = 1,322 кг : 0,05 = 26,433 кг; V(р-ра) = 26,4 л. |
1 1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
10 |
Задание 3.
Расставьте коэффициенты в схеме
FeS2 + HNO3 (конц.) ? Fe(NO3)3 + h3SO4 + NO + h3O
методом электронного баланса. Укажите процессы окисления и восстановления, назовите окислитель(и) и восстановитель(и).
Запишите уравнение этого процесса в полной и сокращенной ионной формах.
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Fe+2S2-1 + HN+5O3 ? Fe+3(NO3)3 + h3S+6O4 + N+2O + h3O FeS2 – 15е ? Fe3+ + 2S 1 окисление - N+5 + 3e ? N+2 5 - восстановление |
4 |
|
Восстановитель: FeS2 ; окислитель: N+5 или NO3 – или НNO3 |
1 |
|
FeS2 + 8HNO3 (конц.) ? Fe(NO3)3 + 2h3SO4 + 5NO + 2h3O
|
2 |
|
FeS2 + 8Н+ + 8NO3 -(конц.) ? Fe3+ + 3NO3 - + 4Н+ + 2SO42- + 5NO + 2h3O |
1 |
|
FeS2 + 4Н+ + 5NO3 -(конц.) ? Fe3+ + 2SO42- + 5NO + 2h3O |
2 |
Задание 4.
Серебристо-белое легкое простое вещество «А», обладающее хорошей тепло- и электропроводностью, бурно реагирует с темно-фиолетовым простым веществом «В».
После растворения продукта в избытке щелочи и пропускания через образовавшийся раствор газа «С» выпадает белый осадок, растворимый как в кислотах, так и щелочах.
1) Назовите вещества «А», «В» и «С».
2) Напишите уравнения перечисленных реакций.
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Вещества: «А» - алюминий, «В» - йод, «С» - СО2 |
3 |
|
2Al + 3I2 = 2AlI3 ____________________________________________________________________ AlI3 + 3NaOH = Al(OH)3 + 3NaI AlI3 + 4NaOH(изб.) = Na[Al(OH)4] + 3NaI ____________________________________________________________________ Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3? или 2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3? +Н2О |
1 ________ 2 ______ 2 |
|
Al(OH)3 + 3HCl = 2AlCl3 + 3h3O |
1 |
|
Al(OH)3 + NaOH = Na[Al(OH)4] |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
10 |
Задание 5.
В пяти пронумерованных пробирках находятся разбавленные растворы веществ: хлорида натрия, гидроксида бария, карбоната натрия, сульфата натрия, азотной кислоты.
1) Как, не используя дополнительных реагентов, определить, в какой пробирке находится каждое из веществ?
2) Составьте таблицу мысленного эксперимента.
3) Запишите уравнения реакций в молекулярной и ионной формах.
4) Укажите признаки реакций, используя следующие обозначения:
? - осадок, ? - газ, ? - нет взаимодействия, ± Q – тепловой эффект.
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
||||||||||||||||||||||||||||||||||||||||||
|
Ba(OH)2 + Na2CO3 = BaCO3? + 2NaOH Ba2+ + CO32- = BaCO3? |
1 0,3 |
||||||||||||||||||||||||||||||||||||||||||
|
Ba(OH)2 + Na2SO4 = BaSO4? + 2NaOH Ba2+ + SO42- = BaSO4? _____________________________________________________________________ Ba(OH)2 + 2HNO3 = Ba(NO3)2? + 2h3O + Q (без указания теплового эффекта -1балл) 2H+ + 2OH- = 2h3O или H+ + OH- = h3O ____________________________________________________________________ Na2 CO3 + 2HNO3 = 2NaNO3 + CO2? + h3O CO32- + 2H+ = CO2? + Н2О |
1 0,3 _____ 2 0,3 ______ 1 0,3 |
||||||||||||||||||||||||||||||||||||||||||
|
BaCO3 + 2HNO3 = Ba(NO3)2 + CO2? + h3O BaCO3 + 2H+ = Ba2+ + CO2? + Н2О |
1 0,3 |
||||||||||||||||||||||||||||||||||||||||||
|
BaSO4 + HNO3 ? |
1 |
||||||||||||||||||||||||||||||||||||||||||
|
NaСl не вступает во взаимодействие |
0,5 |
||||||||||||||||||||||||||||||||||||||||||
|
Таблица
|
1 |
||||||||||||||||||||||||||||||||||||||||||
|
Все элементы ответа записаны неверно |
0 |
||||||||||||||||||||||||||||||||||||||||||
|
Максимальный балл |
10 |
www.seznaika.ru
Особенности организации работы с детьми с задержкой психического развития на уроках химии
Разделы: Химия
В развитии детей часто возникают проблемы, которые выражаются в отклонении от общепринятых социальных возрастных ожиданий, школьно-образовательных нормативов успешности, уставных норм. Причины этих отклонений самые разнообразные: биогенные, психогенные, социогенные.
По мнению Г.К. Селевко, дети с проблемами – это результат сложного взаимодействия неблагоприятных условий, ошибок в воспитании и пробелов в психическом развитии ребенка [1].
Именно к данной группе относятся дети с задержкой психического развития (ЗПР). Для таких ребят существуют специальные (коррекционные) классы (школы) VII вида. Однако, чтобы определить ребенка в подобного рода класс (школу) необходимо, в первую очередь, согласие родителей пройти психолого-медико-педагогическую комиссию и потом уже заключение данной комиссии. Даже имея все показания для перехода в данный класс, без родительского согласия сделать это невозможно.
В конечном счете, получается, что некоторая группа детей с ЗПР обучается в общеобразовательных классах (школах). В результате чего и возникает первая проблема.
Иногда либо за неимением соответствующего опыта у педагогов, либо при отсутствии хорошо организованной социально-психологической службы в школе, учителя принимают таких детей как педагогически запущенных. А ведь это в корне не верно. Отсюда вытекает и вторая проблема: пытаемся чему-то научить, заставляем “зазубривать”, проводим дополнительные занятия, даем больший объем домашних заданий, а результат только ожидаемый.
В данном случае необходима планомерная, четко организованная коррекционно-развивающая работа. И одному педагогу в рамках только своего предмета с этим не справиться. Следует привлекать и психолога школы, и логопеда, и социального педагога, и школьного врача, и классного руководителя, и желательно, вернее необходимо, родителей. Но главное, определить причину неуспеваемости или неадекватности ребенка и здесь без квалифицированного педагога-психолога Вам не обойтись.
В конечном счете, причина определена и ребенка переводят (определяют) в специальный (коррекционный) класс VII вида. Естественно, что желательно данную процедуру провести еще в начальной школе. По своему опыту я убедилась, что дети, которые обучаются в таком классе со второго года обучения, быстрее адаптируются к школьной программе, более эффективно работают на уроках, уровень мотивации к обучению тоже повышается. Учащиеся, которые перешли в данный класс в 5 классе (чего по-хорошему не должно происходить, т.е. в свое время мы их просмотрели) испытывают ряд трудностей и реализоваться в школьном учебном пространстве им тяжело, т.к. самое драгоценное для коррекции и психического развития время потеряно.
Основные цели и задачи коррекционно-развивающего обучения.
- Развитие общеинтеллектуальных умений: приемов анализа, сравнения, классификации, обобщения и т.д.
- Развитие познавательной активности детей.
- Развития словарного запаса.
- Формирование и закрепление умений и навыков.
Конечно, решить все эти задачи одному педагогу на своем уроке не всегда реально. Но можно выделить ряд направлений коррекционно-развивающей работы, которые необходимо использовать при организации и проведении уроков:
- Коррекция отдельных сторон психологической
деятельности:
- развитие зрительного восприятия;
- развитие зрительной памяти и внимания;
- формирование обобщенных представлений.
- Развитие основных мыслительных операций:
- навыков классификации;
- умения работать по словесной и письменной инструкции, алгоритму;
- навыков анализа.
- Развитие различных видов мышления.
- Коррекция индивидуальных пробелов в знаниях.
Химия – достаточно сложная наука. И в тоже время на уроках химии можно (нужно) в полной мере реализовать все вышеперечисленные направления. Предлагаю некоторые, проверенные формы и методы работы, которые использую на уроках химии в 8 классе специального (коррекционного) класса VII вида. Данные задания можно использовать и для всех групп учащихся, и для плохо успевающих ребят, и для детей с ЗПР, которые обучаются в общеобразовательных классах.
1. Заведите “Ценную тетрадь”, в которой учащиеся собирают всю справочную информацию: формулы, определения, алгоритмы составления молекулярных и ионных уравнений, алгоритмы решения задач, составление формулы по валентности, и т.д. Данной тетрадкой можно пользоваться во время урока, но при выполнении самостоятельной работы – нет.
2. Проводите лабораторные и практические занятия. Отказаться от них невозможно, т.к. именно данный вид работы – главный источник мотивации обучения химии. Чтобы облегчить работу учащихся, да и свою, пришлось для данного класса самостоятельно разработать адаптированные тетради для практических работ, чтобы сократить время на проведение лабораторного занятия.
3. Обязательно проверяйте домашнее задание у доски с полным разбором.
4. Не бойтесь задавать использовать на уроках проблемные ситуации. Нужно только помнить, что вопросы и ситуации, которые вы задаете, не должны быть очень сложными. Главное направить ход мыслей учащихся в нужное русло с помощью наводящих вопросов. В результате учащиеся должны осознать, что ответ нашли они, причем самостоятельно.
5. Побуждайте учащихся к поиску собственных ошибок, их анализу и осмыслению.
6. Используйте наглядный материал в полной мере. В этом плане очень хорошо помогают электронные учебники и виртуальная химическая лаборатория. Не пытайтесь объяснить без подтверждения или наглядности даже элементарных, на ваш взгляд, понятий.
7. Проводите диктанты по формулам химических соединений: сульфат кальция, оксид бария, карбонат натрия, оксид серы (VI). Причем, первое время, необходимо делать проверку у доски, работая “по цепочке”.
8. Используйте тестовые задания. В данном случае ребенок как раз видит ответ, а не долго и тяжело его вспоминает. Но не следует отказываться и от традиционных контрольных работ. Желательно, заменить их просто на зачет.
9. Используйте:
9.1. различные задания, имеющие практическое применение полученных знаний.
* Составьте формулы названных в тексте оксидов [2].
В земной коре – литосфере – находятся оксид алюминия____________ (глина), оксид кремния (IV) _________________ (песок), оксид железа (III) _______________ . Водная оболочка Земли - гидросфера – это оксид водорода ____________. В воздухе есть оксид углерода (IV) ______________ (углекислый газ). В результате хозяйственной деятельности человека образуется вещества, загрязняющие атмосферу: оксид углерода (II) __________ (угарный газ), оксид серы (IV) _______________ (сернистый газ), оксид азота (II) ________ и оксид азота (IV) __________________.
* Значение оксида углерода (IV) состоит в том, что он является:
- продуктом дыхания и горения
- источником развития растений
- препятствием для нормальной теплоотдачи Земли в космическое пространство
- основой производства шипучих напитков, тушения пожаров
9.2. задания с экологическим содержанием (http://www.alchimic.ru).
* Задача №1. Хорошо известно, что легковой автомобиль загрязняет воздух вредными выбросами: на каждые 10 километров пути с его выхлопными газами в атмосферу попадает 7 моль оксида углерода (II) и 1 моль оксида азота (II). Какая масса этих вредных веществ попадет в атмосферу при автомобильной поездке на дачу, которая расположена в 80 км от дома?
* Задача №2. Сточные воды химического комбината вполне отвечают санитарным нормам по содержанию азотной кислоты (30 мг в 1 л). Рассчитайте массовую долю HNO3 в этих сточных водах (при плотности, примерно равной 1 г в 1 мл). Сколько азотной кислоты уходит в канализацию с комбината, если объем промышленных стоков составляет ежесуточно 75 м3.
10. Примеры заданий для развития внимания и памяти:
10.1. Подчеркните формулы оксидов в записанном “тексте” [2]:
Al2O3MgSiO2CS2Fe2O3K2Sh3OCaClO2OF2COAlSO4HSNONSiCINO2Cr
10.2. Подчеркните формулы солей.
h3CO3Na2CO3HNO3MgCO3ZnCl2SO2BaSO4Fe(NO3)2h3SO4AgClSO3AlPO4
10.3. Определите формулы оснований: h4PO4, Cu (OH)2, NaOH, h3CO3, Ca(OH)2, Na2O, SO3, Al2O3
10.4. Разделите перечисленные названия и формулы в группы:
Оксид кальция, соляная кислота, сульфат бария, гидроксид натрия, карбонат натрия, азотная кислота, гидроксид железа (II), оксид железа (II), оксид серы (IV), фосфат кальция, гидроксид меди (II)
SO3, h3CO3, CaCO3, N2O3, BaSO4, CO2, Na2O, Al (NO3)3, NaNO3, MgO, BaO
10.5. Определите соединение, которое является лишним в данной группе
SO3, N2O3, CO2, Na2O, NaNO3, MgO, BaO
11. Применяйте разнообразные задания на сравнение:
- неметаллические свойства больше выражены у О или S;
- сравните заряд ядра, число электронных слоев, число электронов на последнем уровне в атомах Cl и Br.
12. Особую трудность вызывают у учащихся задания на составление уравнений реакции, особенно цепочек превращений. Поэтому задание типа

Пытайтесь давать больше информации при составлении уравнений реакций, со временем вы будете что-то убирать и исключать, а может быть и усложните задания.
13. Составляйте схемы и таблицы, не сильно перегруженных информацией.
| Окcид серы (IV) | Оксид серы (VI) | |
| Формула, тривиальное название | ||
| Образование и тип химической связи | ||
| Физические свойства | ||
| Химические свойства | ||
| Практическое значение |
14. Существует множество способов развития мышления. Но у нас с вами есть самый главный помощник в этом вопросе – Периодическая система химических элементов Д.И. Менделеева. Именно работая с ней, мы можем разработать различного вида задания и упражнения, составление разнообразных логических цепочек для данных детей, которые и помогут вам в решении проблемы.
Вы спросите: где взять время для проведения всего вышеперечисленного - закрепления, постоянного повторения, проговаривания, полного разбора домашнего задания и т.д.
Попытайтесь проанализировать тот материал, который вы собираетесь давать учащимся на уроке. Выделите самое главное и основное, удалите сложные вопросы или давайте их только в ознакомительном плане, углубите практическую направленность вашего урока. Ведь целью вашей работы в данном классе и с данной группой учащихся должно быть скорее не слово “научить” чему-то, а - “содействовать развитию умения, навыков; создать условия для формирования ….” и главное – научить учиться
Литература
- Селевко Г.К. Технологии воспитания и обучения детей с проблемами. М.: НИИ школьных технологий, 2005. - 144 с.
- Габриелян О.С. Химия. 8 класс: рабочая тетрадь к учебнику. М.: Дрофа, 2006. – 176 с.
xn--i1abbnckbmcl9fb.xn--p1ai
Олимпиада по химии. 9 класс. Ответы.
Общее время выполнения работы – 4 часа
Задание 1.
Причиной образования смога – опасного для здоровья тумана – считают большое количество выхлопных газов автомобилей при высокой влажности воздуха. В смоге присутствует ядовитый диоксид, в состав которого входит элемент Х. Диоксид получается по реакции монооксида элемента Х с атомарным кислородом, источником которого являются молекулы вещества Y.
1) Определите элемент Х и формулы монооксида и диоксида элемента Х, вещество Y.
2) Каким образом образуется атомарный кислород? Под действием чего в атмосфере образуются радикалы?
3) Напишите два уравнения реакций образования диоксида Х из монооксида.
4) Рассчитайте скорость реакции образования диоксида Х, если через 5 минут после ее начала концентрация диоксида Х стала равна 0,05 моль/л, а через 20 минут – 0,08 моль/л.
5)
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
1) Элемент Х – азот, диоксид – NO2 , монооксид - NO, вещество Y – О3(озон). |
4 |
|
2) Уравнение реакции образования атомарного кислорода: О3 = О2 + О Радикалы образуются под действием ультрафиолетового излучения. |
0,5 0,5 |
|
3) Уравнения реакций образования диоксида: NO + О = NO2 (1) NO + О3 = NO2 + О2 (2) |
2 |
|
4) Расчет скорости реакции образования диоксида Х: скорость ? = ?C /??; скорость ? = (0,05 – 0,08) : (5 – 20) = 0,002 : 60 = 3,3 · 10-5(моль/л·сек). |
1 2 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
10 |
Задание 2.
Сточные воды химического комбината вполне отвечают санитарным нормам по содержанию азотной кислоты (30 мг/л). Объем промышленных стоков, содержащих азотную кислоту, составляет ежесуточно 75 м3.
1) Рассчитайте массовую долю и молярную концентрацию азотной кислоты в этих стоках (плотность раствора 1 г/мл).
2) Чему равна кислотность раствора азотной кислоты?
3) Сколько азотной кислоты уходит в канализацию с комбината ежесуточно?
4) Какой объем известковой воды, с массовой долей гидроксида кальция 5% (плотность = 1 г/мл), нужно добавить для полной нейтрализации азотной кислоты?
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
1) ?(НNO3) = 0,03 г : 1000 г = 3·10-5 или 3·10-3% С = m / М · V; С = 0,03 г : (63 г/моль · 1 л) = 4,8·10-4 моль/л |
1 1 |
|
2) Кислотность раствора азотной кислоты равна: рН = - lg4,8·10-4 моль/л; рН = 3,32. 3) Вычислим массу раствора кислоты, которая уходит с комбината ежесуточно: m(р-ра) = 75000 дм3 · 1 кг/дм3 = 75000 кг; m(НNO3) = 75000 кг · 3·10-5 = 2,25 кг |
2 1 1 |
|
4) 2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2h3O n(HNO3) = 2,25 : 63 = 0, 0357 Кмоль; n(Са(ОН)2 = 0,01786 Кмоль |
1 1 |
|
m(Ca(OH)2) = 0,01786 Кмоль · 74 кг/ Кмоль = 1,322 кг. m(р-ра) = 1,322 кг : 0,05 = 26,433 кг; V(р-ра) = 26,4 л. |
1 1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
10 |
Задание 3.
Расставьте коэффициенты в схеме
FeS2 + HNO3 (конц.) ? Fe(NO3)3 + h3SO4 + NO + h3O
методом электронного баланса. Укажите процессы окисления и восстановления, назовите окислитель(и) и восстановитель(и).
Запишите уравнение этого процесса в полной и сокращенной ионной формах.
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Fe+2S2-1 + HN+5O3 ? Fe+3(NO3)3 + h3S+6O4 + N+2O + h3O FeS2 – 15е ? Fe3+ + 2S 1 окисление - N+5 + 3e ? N+2 5 - восстановление |
4 |
|
Восстановитель: FeS2 ; окислитель: N+5 или NO3 – или НNO3 |
1 |
|
FeS2 + 8HNO3 (конц.) ? Fe(NO3)3 + 2h3SO4 + 5NO + 2h3O
|
2 |
|
FeS2 + 8Н+ + 8NO3 -(конц.) ? Fe3+ + 3NO3 - + 4Н+ + 2SO42- + 5NO + 2h3O |
1 |
|
FeS2 + 4Н+ + 5NO3 -(конц.) ? Fe3+ + 2SO42- + 5NO + 2h3O |
2 |
Задание 4.
Серебристо-белое легкое простое вещество «А», обладающее хорошей тепло- и электропроводностью, бурно реагирует с темно-фиолетовым простым веществом «В».
После растворения продукта в избытке щелочи и пропускания через образовавшийся раствор газа «С» выпадает белый осадок, растворимый как в кислотах, так и щелочах.
1) Назовите вещества «А», «В» и «С».
2) Напишите уравнения перечисленных реакций.
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|
Вещества: «А» - алюминий, «В» - йод, «С» - СО2 |
3 |
|
2Al + 3I2 = 2AlI3 ____________________________________________________________________ AlI3 + 3NaOH = Al(OH)3 + 3NaI AlI3 + 4NaOH(изб.) = Na[Al(OH)4] + 3NaI ____________________________________________________________________ Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3? или 2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3? +Н2О |
1 ________ 2 ______ 2 |
|
Al(OH)3 + 3HCl = 2AlCl3 + 3h3O |
1 |
|
Al(OH)3 + NaOH = Na[Al(OH)4] |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
10 |
Задание 5.
В пяти пронумерованных пробирках находятся разбавленные растворы веществ: хлорида натрия, гидроксида бария, карбоната натрия, сульфата натрия, азотной кислоты.
1) Как, не используя дополнительных реагентов, определить, в какой пробирке находится каждое из веществ?
2) Составьте таблицу мысленного эксперимента.
3) Запишите уравнения реакций в молекулярной и ионной формах.
4) Укажите признаки реакций, используя следующие обозначения:
? - осадок, ? - газ, ? - нет взаимодействия, ± Q – тепловой эффект.
Решение:
|
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
||||||||||||||||||||||||||||||||||||||||||
|
Ba(OH)2 + Na2CO3 = BaCO3? + 2NaOH Ba2+ + CO32- = BaCO3? |
1 0,3 |
||||||||||||||||||||||||||||||||||||||||||
|
Ba(OH)2 + Na2SO4 = BaSO4? + 2NaOH Ba2+ + SO42- = BaSO4? _____________________________________________________________________ Ba(OH)2 + 2HNO3 = Ba(NO3)2? + 2h3O + Q (без указания теплового эффекта -1балл) 2H+ + 2OH- = 2h3O или H+ + OH- = h3O ____________________________________________________________________ Na2 CO3 + 2HNO3 = 2NaNO3 + CO2? + h3O CO32- + 2H+ = CO2? + Н2О |
1 0,3 _____ 2 0,3 ______ 1 0,3 |
||||||||||||||||||||||||||||||||||||||||||
|
BaCO3 + 2HNO3 = Ba(NO3)2 + CO2? + h3O BaCO3 + 2H+ = Ba2+ + CO2? + Н2О |
1 0,3 |
||||||||||||||||||||||||||||||||||||||||||
|
BaSO4 + HNO3 ? |
1 |
||||||||||||||||||||||||||||||||||||||||||
|
NaСl не вступает во взаимодействие |
0,5 |
||||||||||||||||||||||||||||||||||||||||||
|
Таблица
|
1 |
||||||||||||||||||||||||||||||||||||||||||
|
Все элементы ответа записаны неверно |
0 |
||||||||||||||||||||||||||||||||||||||||||
|
Максимальный балл |
10 |
lib.repetitors.eu
Анализ сточных вод предприятия: химический анализ канализации
Выполняя строительство и обустройство загородного дома необходимо провести анализ сточных вод. Характеристика и состав воды является важной составляющей, т.к. именно качество воды влияет на здоровье и жизнь человека. В этой статье мы расскажем для чего необходимо выполнять химический анализ сточных вод, а также кто выполняет забор и проводит экспертизу.
Классификация и степень загрязнения канализационных вод
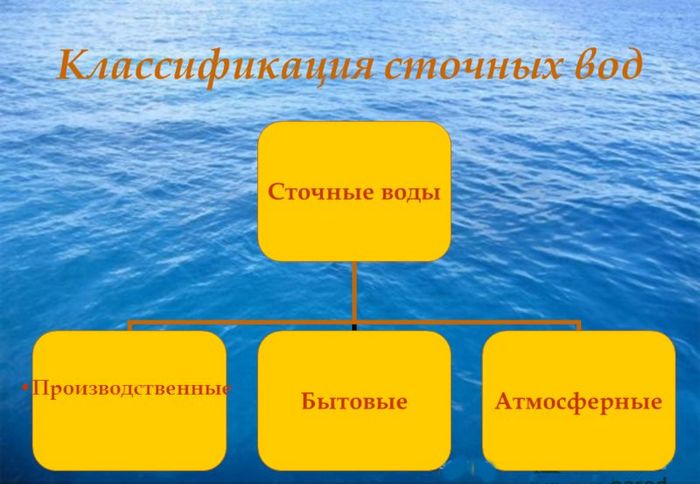 В зависимости от происхождения все канализационные воды можно разделить на три вида
В зависимости от происхождения все канализационные воды можно разделить на три видаВ зависимости от происхождения все канализационные воды можно разделить на три вида:
- хозяйственно-фекальные или бытовые;
- атмосферные;
- производственные или промышленные сточные воды.
Бытовые воды включают в себя канализацию, сливаемую с квартирных ванн, бань, столовых, кухонь, химчисток или прачечных. По своему химическому составу хозяйственно-фекальная жидкость однообразна, а концентрация загрязнения зависит от нормы и количества расходуемой воды одного потребителя. По степени загрязнения бытовые воды делят на нерастворимые, образующие эмульсии, пену и растворимые. По степени загрязнения они могут быть минеральными, органическими или биологическими. В минеральном загрязнении присутствует песок, шлак, раствор минеральной соли, кислоты и щелочи. В органических загрязнениях присутствуют вещества и частицы растительного и животного происхождения. К биологическим загрязнениям относят различные частицы мелких водорослей, грибков, плесени.
Атмосферные сточные воды включают в себя остатки минеральных загрязнений и по своему составу они менее опасны для здоровья людей и окружающей среды. Уровень загрязнения определяют по количеству концентрации примесей в их массовой единице измерения.
Состав промышленных сточных вод содержит остатки производственных отходов, в которых могут быть ядовитые или радиоактивные вещества.
Для информации! Проведение анализов сточных вод и разбор химико лабораторного заключения является приоритетной задачей для каждого владельца локальной (местной) канализационной системы.
Специфика проведения и основные показатели анализа сточных вод
 Анализ канализационных сточных вод выполняется для определения уровня и специфики загрязнения водоема
Анализ канализационных сточных вод выполняется для определения уровня и специфики загрязнения водоема Анализ канализационных сточных вод выполняется для определения уровня и специфики загрязнения водоема, которое загрязняется промышленными предприятиями или природным путем. При несоответствии санитарных условий, проводят повторный забор жидкости. Как правило, воду набирают на выходе из промышленного очищающего комплекса. После повторного проведения анализа у состава сточных вод должны полностью отсутствовать специфические загрязнители. В процессе исследования сточных вод руководствуются такими показателями, как:
- Физический — необходим для определения цвета, запаха, прозрачности и температурного режима. Все перечисленные показатели определяются поверхностно, без использования специального оборудования или химических веществ. Известно, сточная вода имеет завышенный температурный режим, ярко выраженный запах и низкий показатель прозрачности.
- Химический — необходим для определения уровня изменения рН реакции, которая меняется на промышленных стоках.
 Определение сухого остатка — необходим для выявления санитарных норм и количества примесей в жидкости
Определение сухого остатка — необходим для выявления санитарных норм и количества примесей в жидкости - Определение сухого остатка — необходим для выявления санитарных норм и количества примесей в жидкости. В процессе его проведения используют нефильтрованные пробы, которые позволяют определить уровень сухого стока. Основная цель определения сухого стока заключается в том, что все промышленные стоки нуждаются в очистке с использованием специальных бактерий. Стоит отметить, количество взвешенных бактерий на исследуемом участке не должен превышать отметки 10 л/ г, при заниженном показателе чистка будет не эффективной.
- Уровень окисляемости — является санитарным показателем, который дает возможность определить уровень загрязнения воды органическими и неорганическими веществами. Уровень окисляемости воды определяется путем потребления химического и биохимического кислорода. Показатели химии и биохимии помогают определить и спрогнозировать количество загрязнений в стоках, которое можно убрать при помощи биологического способа чистки.
- Фосфор и азотистые содержания — данный показатель является одним из основных, который отвечает за результативность биологической чистки и сохранения гидросферы. На предприятиях, где используются промышленные стоки этот показатель отвечает за уровень наличия нитратов, нитритов и аммонийного азота, все эти составляющие влияют на уровень биоочистки.
Для информации! Показатель завышенного уровня фосфора объясняется большим его содержанием в современных моющих средствах.
- Токсины — их определяют исключительно в промышленных стоках, по составу их делят на органические и неорганические. Правила проведения анализа с определением токсинов в промышленных стоках выполняется исходя из специфики производственного процесса.
- Поверхностно-синтетические активные вещества — данный показатель влияет на уровень кислорода в воде, при его заниженном значении страдает окружающая среда.
Кто выполняет анализ канализационных вод
 Выполнить забор воды и провести его комплексный анализ могут несколько организаций
Выполнить забор воды и провести его комплексный анализ могут несколько организацийВыполнить забор воды и провести его комплексный анализ могут несколько организаций. Например, подобную работу может провести лаборатория любого промышленного предприятия или главное управление водоканала. При заказе исследования сточных вод, поинтересуйтесь наличием сертификатов на проведение подобной работы. При отсутствии сертификатов, разрешений и лицензий, документ не будет иметь юридической силы.
Способ забора воды и выполнение анализа
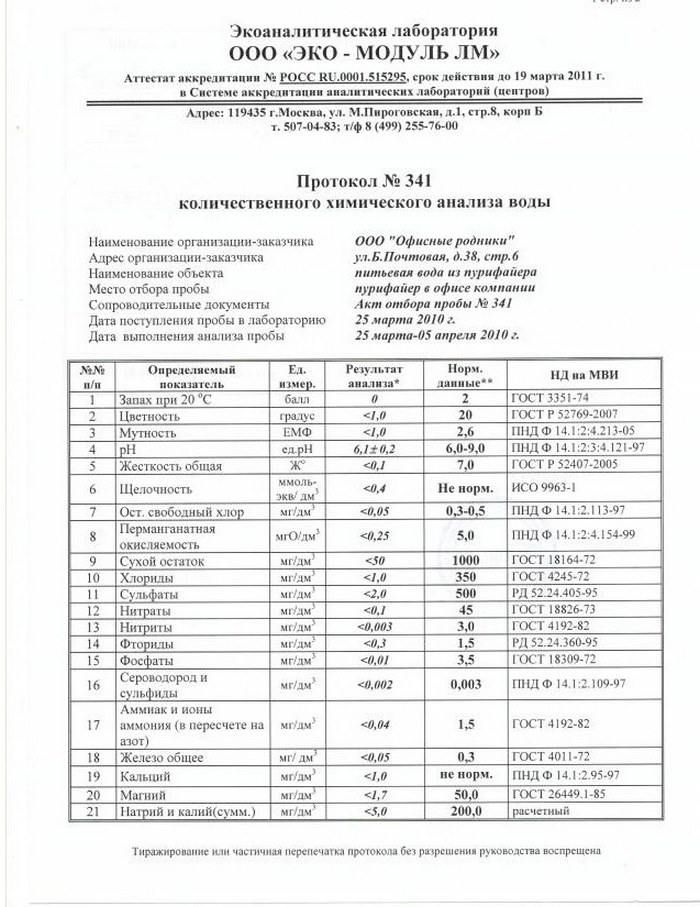 Специалист лаборатории в завершении исследования проб обязательно составляет протокол исследования качества воды
Специалист лаборатории в завершении исследования проб обязательно составляет протокол исследования качества водыДля проведения исследования стоков используют:
- Чистую тару (объем 1 литр), в которую делают забор воды. Чтобы исключить попадания мусора ее предварительно промывают под проточной водой, это исключит попадание бактерий;
- При бактериологическом анализе необходимо использовать стерильную тару с герметичным механизмом;
- Емкость заполняется почти до верха, а по истечение не более двух часов материал следует доставить в лабораторию. В процессе транспортировки тара не должна находится под прямыми солнечными лучами.
Специалист лаборатории в завершении исследования проб обязательно составляет протокол исследования качества воды. Именно, протокол качества воды и является основным аргументом для того, чтобы делать заключения о пригодности и чистоте исследуемых сточных вод. В случае завышения допустимых показателей загрязнения на предприятие накладывается штраф. Поэтому, промышленные организации заинтересованы в самостоятельном контроле канализации, и достаточно часто делают заказ на проведение исследовании канализационных вод. Подобные меры предосторожности обходятся значительно дешевле наложенного штрафа, а главное без вреда для окружающей среды и жизни людей.
Из видео можно узнать более подробно о том, как выполняется анализ воды
vodakanazer.ru









