Большая Энциклопедия Нефти и Газа. Вода океаническая
Океанические воды - Большая Энциклопедия Нефти и Газа, статья, страница 1
Океанические воды
Cтраница 1
Океанические воды отличаются от вод суши по своим свойствам и особенностям. [1]
Сброс загрязнений в океанические воды рано или поздно приведет к еще большим экономическим потерям, когда моря и океаны станут безжизненными. В связи с критической санитарной обстановкой, в основном с продолжающимися сбросами загрязненных сточных вод, в июне - июле 1988 г. было запрещено купание на морских пляжах в Юрмале, Паланге, Пярну, Одессе, Мариуполе. [2]
В результате взаимодействия с загрязнениями атмосферы поверхностные и океанические воды могут изменять свой химический состав. С атмосферными осадками загрязняющие компоненты поступают в почву. Некоторые растения могут накапливать эти загрязнения как из почвы, так и из атмосферы. [3]
Однако более важным является растворение СаСО3 по мере осаждения частичек в глубинные океанические воды. [5]
Несмотря на то, что вода - самое распространенное вещество на Земле, около 98 % ее запасов составляют соленые океанические воды, и только 0 01 % общих запасов пресной воды доступны для использования при современном уровне техники. [6]
Важно обратить внимание, что иловые растворы как окисленных, так и восстановленных осадков содержат во много раз больше органического вещества, чем морские и океанические воды; например, содержание Сорг. [8]
Подток соленых вод является основной проблемой при организации водоснабжения на морском побережье между Ошен-Сити ( штат Мэриленд) и Рехобот-Бич ( штат Делавэр) на северо-востоке США. Здесь соленые океанические воды также проникают в глубь территории по руслам рек и каналов, а затем инфильтру-ются в грунт. [10]
Если относительно растворенных и взвешенных веществ подземные воды приобретают свой облик в основном при взаимодействии воды с водовмещающими породами, многообразие которых безгранично, то концентрация дейтерия в глубоких подземных водах практически не изменяется со времени поверхностной стадии формирования исследуемых вод. Следовательно, если нет процесса смешения с водами иного генезиса, концентрация дейтерия является информатором об условиях формирования воды на поверхности. Поскольку океанические воды значительно тяжелее по дейтерию, чем метеорные воды, имеется возможность отличать воды морского генезиса от близких по составу инфильтрационных вод. Таким образом, можно отличать воды с унаследованным составом ( со времени морского режима на данной территории) от вод, которые приобрели свой состав в результате процессов выщелачивания и растворения водовме-щающих пород. [11]
Так как океанические воды, как показали многочисленные измерения, содержат 0 0002 - 0 0010 % SiO2, то весьма вероятно, что это значение представляет собой равновесную растворимость коллоидного алюмосиликата в суспензии. Экспериментально доказано, что чистый аморфный кремнезем, растворенный в воде, дает концентрацию 0 0100 - 0 011 % монокремневой кислоты, однако в присутствии многозарядных катионов металлов ( железа, алюминия и др.) образуются коллоидные силикаты со значительно более низкой концентрацией монокремневой кислоты. [12]
И наконец, авторы адиабатической теории пытаются объяснить зафиксированный многими факт повышения концентрации СО2 в межледниковые потепления на Земле отрицательной зависимостью растворимости СО2 в Мировом океане и законом Генри о динамическом равновесии между парциальным давлением газа в атмосфере и его содержанием в гидросфере. Так, в результате потепления растворимость СО2 в воде уменьшается и часть диоксида углерода переходит в атмосферу, а при похолодании - в океанические воды. Поэтому изменение концентрации СО2 в атмосфере сторонники рассматриваемой теории считают следствием, а причиной - изменение климата. В подтверждение сказанного приводится известный факт, что в настоящее время в водах океанов содержится СО2 примерно в 60 раз больше, чем в атмосфере. [13]
В глубинных океанических водах, где циркуляция гораздо более медленная, вертикальное перемешивание обычно моделируют в виде процесса диффузии. Кроме того, модель может включать простую циркуляцию с непосредственным привносом из поверхностных вод на дно океана, уравновешенную движением воды вверх через глубинные океанические воды, чтобы отразить процессы конвекции. Пространственное и глубинное распределение радиоактивных веществ, таких, как изотоп 14С ( см. вставку 1.1) ( поступающих как из космических лучей, так и в результате ядерных взрывов в 1950 - х и 1960 - х), может быть использовано для оценки скоростей обмена СО2 между атмосферой и поверхностными слоями океанов, его диффузии в глубинные океанические воды и транспорта в процессе вертикальной циркуляции. [14]
Соленость воды связана с содержанием в ней растворенных карбонатов, сульфатов и хлоридов. В пресных водах их содержание невелико, причем до 80 % составляют карбонаты. Океанические воды имеют соленость до 35 г / л, воды Черного моря - 19, а Мертвого - до 260 г / л с преобладанием хлоридов калия, натрия, кальция и магния. Количество и состав солей в водоеме определяют видовой состав живых организмов, поскольку большинство организмов приспособлено к тому или иному значению солености воды и погибает при перемещении из морской воды в пресную или наоборот. [15]
Страницы: 1 2
www.ngpedia.ru
Морская вода Википедия
 Стандартная морская вода
Стандартная морская вода Морска́я вода́ — вода морей и океанов. Солёность Мирового океана составляет в среднем 3,47 % (34,7 ‰), с колебаниями от 3,4 до 3,6 % (34-36 ‰). Это значит, что в каждом литре морской воды растворено 35 граммов солей (в основном хлорида натрия). Это 0,6 моль/литр (в предположении, что вся соль представляет собой NaCl, что на самом деле не так)[1].
Свойства морской воды
Солёность
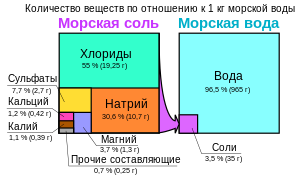 Химический состав морской воды
Химический состав морской воды В океанах солёность воды почти повсеместно близка к 3,5 %, однако в морях вода имеет неравномерно распределённую солёность. Наименее солёной является вода Финского залива и северной части Ботнического залива, входящих в акваторию Балтийского моря. Наиболее солёной является вода Красного моря и восточная часть Средиземного моря. Солёные озёра, такие как Мёртвое море, могут иметь значительно больший уровень содержания солей.
Морская вода слабощелочная, pH варьируется в пределах от 7,5 до 8,4. Относительно высокая стабильность pH связана с наличием карбонатной буферной системы[2][3][4]. Несколько меньшее значение для поддержания pH имеет боратная система[5]. Наиболее высоко значение pH у поверхности моря, с глубиной оно несколько снижается. В опреснённых участках величина pH может снижаться до нейтральной и даже слабокислой[6].
| ||||||||||||||||||||||||||
|
Биогенные вещества
Биогенные элементы необходимы для живых организмов. К ним относят фосфор, азот (в неорганических соединениях) и (для некоторых организмов) кремний. Важную роль играют металлы, встречающиеся в следовых количествах[8].
Содержание биогенных веществ в морской воде непостоянно, и различается в зависимости от места, глубины и времени взятия пробы. Обычно их содержание минимально у поверхности, возрастает до максимума до глубины 1000—1500 метров, и затем снова плавно снижается. Содержание фосфатов может резко повышаться у дна океана[9].
При апвеллинге вода поднимается к поверхности и приносит туда содержащиеся в ней биогены.
Растворённые газы
Контактируя с атмосферой, морская вода обменивается с воздухом содержащимися в нём газами: кислородом, азотом и углекислым газом. Эти же газы попадают в морскую воду в результате химических и биологических процессов, протекающих в океане. Некоторое количество газов вносится в океан с речной водой.
Количество газов, растворенных в морской воде, зависит от их растворимости и от парциального давления в воздухе. С повышением температуры растворимость газов и, соответственно, содержание их в морской воде уменьшается.
Соотношение растворенного кислорода и азота в морской воде отличается от их соотношения в атмосфере. Из-за лучшей растворимости кислорода концентрация его в воде относительно выше, его соотношение с азотом 1:2[10].
В анаэробных условиях в воде может накапливаться сероводород — например, в Черном море на глубине более 200 метров.
Физические свойства
Плотность морской воды колеблется в пределах от 1020 до 1030 кг/м³ и зависит от температуры и солености. При солености, превышающей 24 ‰, температура максимальной плотности становится ниже температуры замерзания[11] — при охлаждении морская вода всегда сжимается, и плотность её растет[12].
Скорость звука в морской воде — около 1500 м/с.
| Морская вода | Чистая вода | |
| Плотность при 25 °C, г/см3: | 1,02412 | 0,9971 |
| Вязкость при 25 °C, миллипуаз: | 9,02 | 8,90 |
| Давление пара при 20 °C, мм. рт. ст.: | 17,35 | 17,54 |
| Температура максимальной плотности, °C: | -3,52 (переохлаждённая жидкость) | +3,98[1] |
| Точка замерзания, °C: | -1,91 | 0,00 |
| Поверхностное натяжение при 25 °C, дин/см: | 72,74 | 71,97 |
| Скорость звука при 0 °C, м/с: | 1450 | 1407 |
| Удельная теплоёмкость при 7,5 °C, Дж/(г·°C): | 3,898 | 4,182 |
Геохимическое объяснение
Научное объяснение появлению солёной воды в море было положено работами Эдмунда Галлея в 1715 году. Он предположил, что соль и другие минералы вымывались из почвы и доставлялись в море реками. Достигнув океана, соли оставались и постепенно концентрировались. Галлей заметил, что большинство озёр, не имеющих водной связи с океанами, имеют солёную воду.
Теория Галлея отчасти верна. Вдобавок к ней следует упомянуть, что соединения натрия вымывались из дна океанов на ранних этапах их формирования. Присутствие другого элемента соли, хлора, объясняется его высвобождением (в виде хлороводорода) из недр Земли при извержениях вулканов. Атомы натрия и хлора постепенно стали основными составляющими солевого состава морской воды.
Непригодность для питья
Морская вода непригодна для питья из-за высокого содержания солей и минеральных веществ, для выведения которых из организма требуется воды больше, чем её выпитое количество. Однако после опреснения такую воду можно пить.
В 1950-х годах французский врач и путешественник Ален Бомбар экспериментально доказал, что морскую воду можно без вреда для здоровья пить в небольших (порядка 700 мл/сутки) количествах в течение 5—7 дней[13]. См.также Физиологическая адаптация. Распреснённая морская вода соленостью в 3-4 раза ниже океанической (не более 8—11 промилле) в некоторых заливах, лагунах, эстуариях, куда впадают крупные реки, таких морях, как Азовское, Балтийское, Каспийское, намного менее вредна, чем океаническая, и может понемногу применяться для питья и выживания в чрезвычайных ситуациях. Аналогичное достигается, если разбавить океанскую воду пресной как минимум в соотношении 2:3.
Морская вода в гигиене
В Гонконге морская вода широко используется в сливных системах туалетов. Более чем 90 % из них используют для смыва именно морскую воду в целях экономии воды пресной. Начало этой практике было положено в 1960-х и 1970-х годах, когда добыча пресной воды стала затруднительна для жителей бывшей британской колонии.
См. также
Примечания
- ↑ 1 2 3 Хорн, 1972, с. 51.
- ↑ Хорн, 1972, с. 160.
- ↑ Zeebe et al, 2001, с. 3.
- ↑ Схема карбонатной системы океана (по R. Zeebe 2001):CO2atm.⇕CO2+h3O=HCO3−+H+=CO32−+2H+{\displaystyle {\begin{matrix}CO_{2}{\mbox{atm.}}\\\Updownarrow \\CO_{2}+H_{2}O=HCO_{3}^{-}+H^{+}=CO_{3}^{2-}+2H^{+}\end{matrix}}}Б.Находящаяся в равновесии с атмосферой океанская вода при солёности 35 ‰ и температуре 25 °C имеет pH 8,1. Соотношение форм неорганического растворённого углерода при этом:CO2:HCO3−:CO32−≈0,5%:86,5%:13%{\displaystyle CO_{2}:HCO_{3}^{-}:CO_{3}^{2-}\approx 0,5\%:86,5\%:13\%}
- ↑ Zeebe et al, 2001, с. 8.
- ↑ Хорн, 1972, с. 139.
- ↑ Chapter 5 — Physical and thermodynamic data
- ↑ Grasshoff et al, 1999, с. 159.
- ↑ Grasshoff et al, 1999, с. 160.
- ↑ Смирнов и др., 1988, с. 37.
- ↑ Вейль, 1977, с. 89—90.
- ↑ в отличие от пресной воды, имеющей максимальную плотность при 4 °C.
- ↑ Ален Бомбар. За бортом по своей воле. — М.: Альпина Паблишер, 2014. — 234 с. — ISBN 978-5-9614-4794-1.
Литература
- Хорн Р. Морская химия (структура воды и химия гидросферы) = Marine Chemistry (The structure of Water and the Chemistry of Hydrosphere). — Москва: Мир, 1972. — (Науки о земле).
- Руководство по химическому анализу морских вод (РД52.10.243-293) / С. Г. Орадовский. — С.-Пб: «Гидрометеоиздат», 1993. — (Руководящий документ).
- Zeebe R. E., Wolf-Gladrow D. CO2 in Seawater: equilibrum, kinetics, isotopes. — Elsevier Science B.V, 2001. — P. 346. — (Elsevier Oceanography Series). — ISBN 0 444 50579 2.
- Grasshoff K., Kremling K., Ehrhardt M. Methods of seawater analysis. — Third, Completely Revised and Extended Edition. — WILEY-VCH, 1999. — ISBN 3-527-29589-5.
- Смирнов Г.Н., Курлович Е.В., Витрешко И.А., Мальгина И.А. Гидрология и гидротехнические сооружения: Учеб. для вузов по спец. «Водоснабжение и канализация» / под ред. Г.Н. Смирнова. — Высш. шк.. — М., 1988. — 472 с. — 10 000 экз.
- Вейль П. Популярная океанография = Oceanography. An Introduction to the Marine Environment by Peter K. Weyl / Пер. с англ. Г.И. Баранова, В.В. Панова, А.О. Шпайхера. Под ред. А.Ф. Трешникова. — Л.: «Гидрометеоиздат», 1977. — 504 с илл. с. — 50 000 экз.
Ссылки
wikiredia.ru
Состав океанической воды. Источники растворенного вещества океанических вод.
Океаническая вода - сложный солевой раствор с концентрацией солей около 3,5% или 35%. Растворенные соли составляют огромную массу (около 48∙1015 т), ее осаждение образовало бы на дне океанов слой толщиной не менее 30 м. Соли и другие вещества находятся в океанической воде преимущественно в виде ионов, значительно меньше в виде взвесей и, наконец, в виде газов. В ней были обнаружены все химические элементы и все их изотопы. Однако основную массу солей составляют девять главных ионов, которые в сумме дают 99,88% всех растворенных в океане соединений: Na+ -30,61%,К+ - 1,10%,, Mg+ - 3,69%, Са+ -1,16%, Сl- - 55,04%, Вr- -0,19%, SO4- -- 7,68%, НСО3- + СО3- - -0,41% Солевой состав океанической воды эволюционировал вместе с развитием самого океана. Представления о глубинном, ювенильном происхождении океанских вод основываются также на сходстве солевого состава океанских и ювенильных вод, выделяемых при вулканических извержениях, и на данных о содержании определенных химических элементов в веществе хондритов с учетом количества имеющейся в них воды
Кислотно-щелочные и окислительно-восстановительные условия в океане. Взаимодействие океана с атмосферой, растворенные газы в океанической воде, их роль в процессах седиментогенеза.
Содеражаниегазов, растворенных в воде, зависит от времени года. Летом воды отдают газы (CO2,O2) в атмосферу, зимой – их поглощают. Количество растворенного кислорода зависит от массы живых организмов, поглощающих кислород, и водорослей, его выделяющих. По подсчетам А.П. Виноградова (1967), объем растворенных газов в Мировом океане составляет 4,32.1024 см3, что в 3,15 раза превышаетвесь объем воды в океане (1,37.1024 см3). Пресные воды растворяют в себе больше газов, чем соленые океана. Чем больше атомный вес газа, тем больше его растворимость, поэтому для тяжелых инертных газовокеаническая вода служит природным концентратором. С повышением температуры и солености количество растворенных газов убывает. Высокая растворимость CO2 в воде обусловлена реакцией:CO2 + h3O ⇔ h3CO3.При низких температурах реакция сдвинута вправо.Время пребывания элементов во взвешенном, ионном состоянии в воде различно. Нахождение натрия сопоставимо с возрастом океана, что указывает на его пониженную реакционную способность. Распространенные K, Ca, Mg содержатся около 107 лет, Mn – 1400 лет. Наиболее короткое время пребывания имеют Si и Al. Часть кремния захватывается организмами, алюминий осаждается из раствора. Искусственные радиоизотопы цезия и стронция дольше пребывают в воде по сравнению с периодом их полураспада. Металлы из воды удаляются путем осаждения, адсорбции сульфидом железа, оксидом марганца и глинами или в результате деятельности организмов.
Особенности гидросферы континентов.
Материковые воды (ледники, озерные, болотные, речные, подземные, термальные вулканических областей) в основном формируются за счет атмосферных осадков, часть их инфильтруется, пополняя подземные воды. Они соприкасаются с породами, живыми организмами, атмосферой, поэтому компонентный состав материковых вод аналогичен океаническим, за исключением вод с минимальной минерализацией (пресных) и преобладающих катионов и анионов. Основной химический состав материковых вод гидрокарбонатно-кальциевый. Закономерности соотношений химических элементов по материкам близкие. Повышенным содержанием в водах SiO2 за счет вод зоны экваториальных и тропических лесов выделяются ЮжнаяАмерика и Африка. Минерализация материковых вод испытывает сезонные колебания: зимой минерализация выше, чем в период половодий, сезона дождей или таяния ледника. В зонах избыточного увлажнения воды могут быть ультрапресные. Озера гумидной зоны имеют пресные воды, аридной – соленые, чаще хлоридно-сульфатные. Подземные воды изменяются от пресных до соленых, некоторые бассейны их изолированы водонепроницаемыми осадочными породами и содержат очень мало свободного кислорода.Грунтовые воды – источник питания многих рек, содержат растворенный кислород, поэтому могут окислять сульфидные руды. Минерализация их повышается в направлении север–юг, соответственно_ изменяется кислая реакция в тундре на нейтральную и слабощелочную в зоне пустынь.
Ресурсы гидросферы
В прибрежно-морской зоне кроме кремния и титана могут формироваться россыпи при выветривании материнских пород и руд. Они представлены местами самородными золотом и платиной, оловом, вольфрамом, ртутью, ниобием, танталом, церием, цирконием. По мере удаления от прибрежной зоны отлагаются бокситы, которые сменяются бурыми железняками, марганцевыми рудами. Перед склономокеанического дна аккумулируются фосфориты и глаукониты, на склоне – батиальные известково-кремнистые осадки органического генезиса. На дне глубоководных впадин, кроме илов, образуются железо-марганцевые конкреции. В них содержание Mn достигает 50,3 %, Ni – 2,78, Cu – 1,90, Co – 2,53 %, встречаются практически все элементы Соли, извлеченные из вод Мирового океана, покрыли бы материки слоем 200 м. На каждого жителя пришлось бы 1,2 кг золота, 4 млн.т натрия. Почти половину мировой добычи магния. Океан дает почти половину мировой добычи магния (200 тыс. т) и 40 тыс. т брома. Йод извлекают из морских водорослей. Основным технологическим приемом по извлечению элементов из морской воды является сорбция.
Геохимия атмосферы
На Земле газы образуют самостоятельную оболочку – атмосферу. В земной коре они встречаются в трех формах: свободной; растворимой в воде, расплавах и нефти; адсорбированной и окклюдированнойгорными породами. Общая масса газов оценивается величиной 8,38 ·1015 т, из них на массу атмосферы приходится 5,15 · 1015 т. Относительно массы всей Земли газы составляют всего лишь 9 · 10–5 %.Образование и классификация газов. А. И. Перельман (1989) выделил три основные группы процессов образования газов: физико-химическую, биогенную и техногенную. Физико-химические процессы включают реакции, которые приводят к образованию CO2, h3S, водяного пара и других газов. Радиоактивный распад генерирует инертные газы, радиолиз воды создает химически активные H+ и ОН–, космические лучи приводят к образованию 14С, 3Н и других радиоактивных изотопов. Биогенные процессы (фотосинтез, биохимический) участвуют в образовании O2, CO2, N2, h3S, Ch5 и других газов. С техногенными процессами связано поступление в атмосферу CO2, CO, оксидов азота, серы, органических летучих соединений (диоксин, бензапирен и др.).
cyberpedia.su
Морская вода
О.В.Мосин
Огромный слой соленой воды, покрывающий большую часть Земли, представляет собой единое целое и имеет примерно постоянный состав. Мировой океан огромен. Его объем достигает 1,35 миллиардов кубических километров. Он покрывает около 72% земной поверхности. Почти вся вода на Земле (97%) находится в мировом океане. Приблизительно 2,1% воды сосредоточено в полярных льдах и ледниках. Вся пресная вода в озерах, реках и в составе грунтовых вод составляет лишь 0,6%. Остальные 0,1% воды входят в состав соленой воды из скважин и солончаковых вод.
Ионные вещества, содержащиеся в морской воде в концентрации выше 0,001 г/кг (1 млн.д.) по весу:
Вещество - Содержание, г/кг морской воды Хлорид-ион C1 19,35 Ион натрия Na + 10,76 Сульфат-ион SO4 2 2,71 Ион магния Mg2 + 1,29 Ион кальция Са2 + 0,412 Ион калия К + 0,40 Диоксид углерода - 0,106 Бромид-ион Вr 0,067 Борная кислота - 0,027 Ион стронция Sr2 + 0,0079 Фторид-ион F 0,001
Морскую воду часто называют соленой. Под соленостью морской воды понимают массу (в граммах) сухих солей в 1 кг морской воды. В пределах мирового океана соленость колеблется от 33 до 37, в среднем ее можно считать равной 35. Это означает, что в морской воде содержится приблизительно 3,5% растворенных солей. Перечень элементов, содержащихся в морской воде, очень велик, однако концентрация большинства из них очень низка. В таблице указаны 11 ионных частиц, присутствующих в морской воде в концентрациях, превышающих 0,001 г/кг, т.е. 1 миллионную долю (млн. д.) по весу. Среди веществ, содержащихся в морской воде в несколько меньших, концентрациях (от 1 млн. д. до 0,01 млн. д.), имеются элементы азот, литий, рубидий, фосфор, йод, железо, цинк и молибден. В морской воде обнаружено не менее 50 других элементов в еще более низких концентрациях.
С тех пор как люди стали следить за составом океанической воды, он остается неизменным. Постоянство состава воды в мировом океане свидетельствует о равновесии между процессами поступления и удаления воды. В океаны постоянно втекает речная вода, которая имеет совершенно другой минеральный состав, чем океаническая вода. Например, выветривание горных пород приводит к появлению в речной воде алюминия, кремния, железа или кальция. В морской воде эти элементы постепенно включаются в биологический цикл или удаляются из нее в результате осаждения. Поэтому среднее содержание многих элементов в океанической воде устанавливается в результате равновесия между скоростью процессов поступления этих элементов в морскую воду и удаления их из нее. Этим и объясняется более или менее постоянный состав океанической воды.
Океан является огромной кладовой воды и многих химических веществ. В каждой кубической миле морской воды содержится 1,5 -1011 кг растворенных твердых веществ. Океан столь огромен, что если концентрация какого-либо вещества в морской воде составляет всего 1 миллиардную долю по весу, то его содержание в мировом океане исчисляется в 5-109 кг. Тем не менее океан еще мало используется как источник сырьевых материалов, поскольку стоимость извлечения необходимых веществ из воды слишком высока. Лишь три вещества получают из морской воды в промышленно широких масштабах: хлорид натрия, бром и магний.
Наиболее ценной составной частью морской воды является пресная вода. Нехватка пресной воды все больше ощущается даже в таких странах, как Соединенные Штаты, где с ежегодным уровнем осадков дело обстоит совсем неплохо. Во многих областях Соединенных Штатов потребность в пресной воде для бытовых нужд, сельского хозяйства и промышленности превышает ее имеющиеся запасы. В таких странах, как Израиль или Кувейт, где уровень осадков очень низок, запасы пресной воды совершенно не соответствуют потребностям в ней, которые; возрастают в связи с модернизацией хозяйства и приростом населения. В конце концов все человечество окажется перед необходимостью рассматривать океаны как источник воды.
Высокая концентрация солей делает морскую воду непригодной для питья и для большинства других целей. В Соединенных Штатах содержание солей в водопроводной воде, согласно требованиям органов здравоохранения, не превышает 0,05%. Это намного меньше по сравнению с их 3,5%-ным содержанием в нормальной морской воде или по сравнению с 0,5%-ным или около того содержанием в солоноватых подземных водах. Снижение содержания солей в морской воде или солоноватых водах до уровня, при котором вода становится пригодной к использованию, называется опреснением воды.
Существует множество способов опреснения воды (дистилляция, ионный обмен, обратный осмос, электродиализ), и на основе любого из них могут быть построены большие производственные предприятия. Проблема заключается в том, чтобы проводить опреснение с минимальной затратой энергии и минимальными расходами на оборудование. Это требование важно потому, что нация, которая вынуждена в большей мере полагаться на опресненную воду, должна выдерживать экономическую конкуренцию с другими нациями, располагающими более обильными и дешевыми источниками пресной воды. Такая небольшая страна, как Кувейт, расположенная на берегу Персидского залива и почти не располагающая природными источниками пресной воды, может позволить себе роскошь зависеть от опресненной воды только потому, что она извлекает большие доходы от продажи нефти.
По мере того как возрастает заселенность районов вблизи морских берегов, увеличивается потребность в опреснении морской воды. Это делает экономически оправданным превращение океанической воды в пресную воду. Самый распространённый способ опреснения морской воды – это дистилляция (см. ниже). Для опреснения морской воды также используется также ионный обмен и обратный осмос. Осмотическое давление морской воды относительно пресной воды составляет 22 атм.; поэтому, для осуществления обратного осмоса необходимо приложить к морской воде давление, превыщающее эту величину. Стоимость получения пресной воды этим способом составляет всего 1 доллар за 16000 литров воды, что делает метод обратного осмоса конкурентноспособным с другими способами получения пресной воды.
Развитие принципа обычного диализа привело к разработке метода электродиализа, который также используется для получения пресной воды. Морская вода накачивается между двумя полупроницаемыми мембранами, которые отделяют её от электродов. При пропускании тока через электроды, катионы перемещаются по направлению к катоду, а анионы – по направлению к аноду. Концентрация ионов вблизи электродов, за пределами полупроницаемых мембран, снижается за счёт прокачивания морской воды, а вода в пространстве между мембранами постепенно опресняется. Для работы установки по опреснению морской воды методом электродиализа используется напряжение 500 В и слабые токи порядка миллиампера.
www.o8ode.ru
Океанические воды - Справочник химика 21
В данной главе мы узнаем о том, что вода на поверхности нашей планеты подразделяется на соленую и пресную. Мы обсудим состав океанической воды, а также некоторые из ее физических и химических свойств. Равновесия между океанами и атмосферными газами играют важную роль в поддержании жизни в океанах и даже на суше. Океаны представляют собой огромный, практически неисчерпаемый источник химических и минеральных ресурсов. [c.143] Реки ежегодно вносят.в океан около 1,5 млн.т карбоната кальция, однако солевой состав океанической воды остается практически неизменным. Объясните, почему [c.103]С тех пор как люди стали следить за составом океанической воды, он остается неизменным. Конечно, химические данные о составе морской воды известны всего за ка-кие-нибудь неполные 100 лет. Если ее состав и подвергается изменениям, то Э1о, вероятно, происходит за гораздо большие промежутки времени, чем 100 лет. Однако существуют и другие доказательства, подтверждающие, что химический состав океанов существенно не менялся за долгие периоды. [c.145]
Атмосферный диоксид углерода находится в равновесии с диоксидом углерода, растворенным в океане. Равновесие между атмосферным СО 2 и СО2 в слое океанической воды глубиной приблизительно 100 м устанавливается в среднем за два года . Поверхностные воды находятся в равновесии и с более глубинными водами, но эго равновесие устанавливается гораздо медленнее, в течение нескольких тысяч лет. [c.145]
ХИМИЧЕСКИЙ СОСТАВ ОКЕАНИЧЕСКОЙ ВОДЫ [c.25]
Мировой океан — величайшее богатство человечества. Уже сегодня он приобретает важнейшее значение как источник питательных веществ и минерального сырья. В океанической воде, например, в весьма малых концентрациях растворены многие редкие элементы, представляющие большую ценность для современной техники. Ориентировочно [1, с. 27] в морской части планеты сосредоточено 90 млрд. т иода. 5 млрд. т урана, по 3 млрд. т марганца, ванадия и никеля, 6 млрд. т золота. [c.327]
Зона фотосинтеза (разд. 17.1)-верхний слой океанической воды толщиной до 150 м, в котором происходит рост фито- [c.167]
Концентрационные элементы являются источниками электрических потенциалов и токов между участками с различной концентрацией ионов в живых организмах, растениях, в земной коре, океанических водах и т. п. [c.273]
В табл. 1.4 приведено содержание главных ионов в океанической воде. [c.13]
Аналогично — является ли океаническая вода одной фазой Приведите другие подобные примеры фаз. [c.160]
Галоген со держащие соединения. Наиболее распространенной примесью в атмосфере является хлор-ион, входящий в состав аэрозолей морских солей (Na+, К+, 80 )или твердых частиц пыли. По имеющимся данным, содержание хлора в дождевой воде изменяется от 1 мг/л вдоль морского побережья до 0,1 мг/л — в континентальных районах. Если принять количество сульфатов, инжектируемых в атмосферу в виде аэрозолей морских солей, равным 45 Тг/год, а отношение [С1 ]/[50, ] =7 (в океанической воде), то в глобальном масштабе, не учитывая других источников С1 , в атмосферу поступает около 300 Тг/год хлоридов с поверхности океанов. [c.15]
Гидросфера состоит из пресной и соленой воды на поверхности Земли, а также из кристаллической воды, которая образует континентальный снег и лед. Согласно данным Гольдшмидта, на каждый квадратный сантиметр земной поверхности приходится 273 л воды, причем 268,5 л из этого количества находится в виде океанической воды, 0,1 л в виде пресной воды, а 4,5 л в виде континентального льда. [c.443]
По мере того как возрастает заселенность районов вблизи морских берегов, увеличивается потребность в опреснении морской воды. Это делает экономически оправданным превращение океанической воды в пресную воду. Здесь мы рассмотрим несколько способов опреснения морской воды, перечисляя их в порядке повышения стоимости. [c.510]
Однако активность процессов самоочищения Северного моря у берегов всех прилегающих к нему стран - ФРГ, Нидерландов, Бельгии, Франции, Англии, Норвегии и Дании - до сего времени значительно переоценивалась. Средняя глубина моря ближе к берегам (на шельфе) составляет 80 м, на Доггер-Банке - даже 20 м, так что в сравнении с Атлантикой (средняя глубина 3500 м) это прямо-таки чайное блюдце . Реки, впадающие в Северное море, будь то Рейн или Везер, Эльба или Темза, давно уже несут в него не чистую воду, а тонны грязи и отбросов. Даже соленая океаническая вода не способна справиться с этим. [c.24]
Концентрация органических кислот и сложных эфиров редко превышает пределы 40—200 и 50—100 мкг/л. Содержание углеводов несколько выше и нередко достигает единиц миллиграммов в 1 л. Значительную часть органического вещества природных вод составляют гумусовые вещества гуминовые кислоты и фульвокислоты. Особенно богаты гуминовыми веществами воды северных районов страны, где концентрация их часто составляет единицы и десятки миллиграммов на 1 л. В морских и океанических водах среднее содержание гумусовых веществ ниже и редко превышает 3 мг/л. [c.136]
Мировой океан - непрерывная водная оболочка Земли, окружающая континенты и острова, - занимает около 70,8 % земной поверхности. Океанические воды распределены между полушариями неравномерно в Северном они покрывают 66 %, а в Южном - 81 /] поверхности. По географическим особенностям Мировой океан делят на четыре части, основные морфометрические показатели которых приведены в табл. 1.3. [c.22]
Распределение взвешенных частиц по размерам характеризуется двумя максимумами преобладают частицы с радиусом 0,5-1,0 и 25-50 мкм. Таким образом, это тонкодисперсный материал с большой удельной поверхностью (50-200 м /г). Если в столбе океанической воды с площадью поперечного сечения 1 м содержится 2000 г взвесей, то суммарная поверхность частиц в нем может достигать 4 Ю" м . Большая удельная поверхность определяет высокие сорбционные характеристики взвесей, которые могут захватывать при осаждении на дно океана как растворенное органическое вещество, так и минеральные компоненты, в частности, ионы тяжелых металлов. [c.31]
Еще более сложными и усовершенствованными являются блочно-диффузионные модели, учитывающие вертикальные движения океанических вод. В частности, океан ниже слоя перемешивания может рассматриваться в качестве горизонтальной однородной среды, в которой перенос углерода в вертикальном направлении описывается уравнением вида [c.93]
Казалось бы, химический состав океанического аэрозоля должен полностью соответствовать составу морской воды. Действительно, основными составляющими частиц являются главные компоненты солевого состава воды. Однако морской аэрозоль оказывается аномально обогащенным некоторыми элементами, такими как РЬ, Си, Мп, Ре, d, Н , Ag, гп. Коэффициент обогащения по отношению к натрию океанической воды для калия и магния примерно равен 1, для кобальта - 10, меди - 800, марганца - 1000, свинца - 4000, алюминия - 5000, железа - 10 и цинка - 2 Ю . По некоторым расчетам, океанический источник ответственен за поступление в атмосферу от 5 до 20 % таких элементов, как медь, ванадий и цинк (эмиссия железа, цинка и меди из океанов оценивается значениями 2,6, 1,4 и 0,17 Мт/год соответственно). [c.127]
Дифференциальные уравнения описывают целый класс однородных явлений (например, одним уравнением - Навье - Стокса - описываются такие разные, на первый взгляд, явления, как движение жидкости по трубопроводам и каналам и перемещение больших объемов океанической воды и атмосферного воздуха). Для практического использования этих уравнений следует при их решении учитывать ограничения, вытекающие из свойств конкретного явления (процесса). Для химико-технологических процессов такими ограничениями могут быть пределы изменений геометрических характеристик аппаратов, физических свойств веществ и т.п. Поэтому для выделения конкретного явления из класса явлений, описываемых единой системой дифференциальных уравнений, необходимо эти уравнения ограничить дополнительными условиями, которые называют условиями однозначности, т. е. условиями, которые полностью, однозначно характеризуют данное явление (например, температура насыщенного пара полностью, т.е. однозначно определяется его давлением). [c.63]
При взаимодействии тепловых нейтронов с ядрами элементов земной коры, пресных и океанических вод образуются такие радионуклиды, как кремний-31, железо-59, кальций-45, натрий-24, калий-42, фосфор-32, марганец-56, медь-64. [c.312]
Главные ионы. К главным ионам, или макрокомпонентам природных вод относятся элементы, характеризующиеся высокими значениями кларков и хорошей растворимостью их соединений в воде. В некоторых случаях (это характерно для морских и океанических вод) к группе главных ионов относятся также Вг" и HS. [c.133]
Природные воды содержат органические вещества в сравнительно невысоких конценфациях. Средняя конценфация органического углерода в речных и озерных водах редко превышает 20 мг/л. В морских и океанических водах содержание Сорг еще более низкое. Содержание белковоподобных веществ, свободных аминокислот и аминов колеблется в пределах 20—340, 2—25 и 6—200 мкг азота на 1 л соответственно. [c.135]
Элементы, распределяющиеся по типу питательных веществ, обычно имеют очень длительные времена пребывания в океанах. Времена пребывания N07, кремния и фосфора составляют по оценкам 57000, 20000 и 69000 лет соответственно (табл. 4.6). Наличие обширных резервуаров питательных веществ в глубинных океанических водах означает, что увеличение концентрации N07 в речных водах в результате человеческой деятельности (см. п. 3.7.5) оказывает небольшое влияние на концентрацию N07 в океанах (здесь предполагается, что N07 эффективно перемешивается в пределах всего объема океанов). Мы рассмот- [c.199]
Растворенное органическое вещество океанической воды на 30-70 % состоит из гумусовых веществ, как аллохтонного (поступающего главным образом с речным стоком), так и автохтонного происхождения, образовавшегося в океане при гумификации дет puma - мертвых остатков растительных и животных организмов, в группу РОВ входят также сахара, аминокислоты и высшие жирные кислоты. [c.30]
Предьщущее обсуждение поведения микроэлементов в морской воде было основано на допущении, что океаны имеют единый теплый, обедненный питательными веществами верхний смешанный слой и статическую глубоководную зону. На самом деле, в высоких широтах поверхностные океанические воды достаточно холодны и могут нарушить стратификацию по плотности и перемешать воду в океанах на глубину до 1000 м. Плотная поверхностная вода опускается и медленно перетекает в центральную часть океана в виде холодного обогащенного кислородом слоя, который замещает нижележащую воду. Замещенная вода принуждена медленно двигаться вверх, что создает океаническую циркуляцию (рис. 4.18 и 4.19). [c.206]
В глубинных океанических водах, где циркуляция гораздо более медленная, вертикальное перемешивание обычно моделируют в виде процесса диффузии. Кроме того, модель может включать простую циркуляцию с непосредственным привносом из поверхностных вод на дно океана, уравновешенную движением воды вверх через глубинные океанические воды, чтобы отразить процессы конвекции. Пространственное и глубинное распределение радиоактивных веществ, таких, как изотоп С (см. вставку 1.1) (поступающих как из космических лучей, так и в результате ядерных взрывов в 1950-х и 1960-х), может быть использовано для оценки скоростей обмена СОз между атмосферой и поверхностными слоями океанов, его диффузии в глубинные океанические воды и транспорта в процессе вертикальной циркуляции. [c.225]
Для хорошо перемешанных резервуаров записывается уравнение сохранения вещества, в котором приход С в результате привноса в резервуар (атмосферу или поверхностные слои океана) уравновешивается выносом в другие резервуары плюс радиоактивным распадом (см. вставку 2.6) микроэлемента во время его нахождения в резервуаре. Для глубинных океанических вод сохранение вещества описывается частичным дифференциальным уравнением адвекции-диффузии. Берется тот коэффициент диффузии, который лучше всего соответствует измеренному глубинному распределению С в океанах. [c.225]
Преобразование ОВ уже в водной толще осуществляется достаточно энергично. А. И. Горская и Е. А. Глебовская в органическом детрите из поверхностных океанических вод обнаружили смолы и асфальтены, УВ не только метановые, но и нафтеновые и ароматические. Таким образом, состав ОВ даже в поверхностных водах характеризуется рядом черт, отличающих его от химического состава живых организмов и сближающих с ископаемой органической материей осадков. [c.214]
Из общего количества воды 1350 млн км (свыше 97,2%) -океаническая вода. Баланс других источников (в км ) воды приведен ниже [c.339]
Постоянство состава воды в мировом океане свидетельствует о равновесии между процессами поступления и удаления воды. В океаны постоянно втекает речная вода, которая имеет совершенно другой минеральный состав, чем океаническая вода. Например, выветривание горных пород приводит к появлению в речной воде алюминия, кремния, железа или кальция. В морской воде эти элементы постепенно включаются в биологический цикл или удаляются из нее в результате осаждения. Поэтому среднее содержание многих элементов в океанической воде устанавливается в результа1е равновесия между скоростью процессов поступления этих элементов в морскую воду и удаления их из нее. Этим и объясняется более или менее постоянный состав океанической воды. [c.145]
Некоторые из этих элементов, например магний и бром, извлекают из морской воды в промышленных масштабах. Состав морской воды может претерпевать некоторые изменения, особенно в тех районах, где испаряется больше воды, чем возмещается пресной водой рек и других источников. Например, в Красном море и Персидском заливе количество растворенных в воде веществ приблизительно на 14% превышает их среднее содержание в океанической воде на всем земном шаре. В результате повьш1енной биологической активности в отдельных частях океана заметно понижена концентрация кальция [c.443]
Океанические воды находятся в непрерывном движении, что связано с различными факторами вращением Земли и Луны, атмосферной циркуляцией, землетрясениями и извержениями подводных вулканов и т. п. Масштабы этих движений сильно различаются. Одни из них, такие как приливные, охватывают всю массу воды от поверхности до дна другие (например, ветровые волны) затрагивают лишь верхний слой до глубины 50-60 м. Благодаря этим движениям происходит выравнивание гидрологических и гидрохимических характеристик океанической воды. В сравнении с атмосферой, круговорот в океаносфере происходит гораздо медленнее время полного перемешивания воды оценивается примерно в 1600 лет. [c.25]
По составу минеральных компонентов океанические воды очень однородны. В открытых частях океанов массовое содержание солей в среднем составляет 34,7 %о (в интервале от 32,0 до 37,5 %о). Наивысшая соленость наблюдается в тропических широтах, характеризующихся наиболее высоким уровнем испарения. Между основными химическими элементами морской воды существует довольно строгая связь, выражающаяся законом Дитмара (1884) в воде открытых районов океана соотношения между главными компонентами основного солевого состава постоянны и не зависят от их абсолютных концентраций. [c.26]
Второй цикл также не полностью замкнут, поскольку в океанах постоянно происходит осаждение и захоронение углерода в донных осадках в составе карбонатов. По некоторым оценкам скорость накопления углерода в этой форме составляет 0,1 Гт С/год. Из табл. 2.1 видно, что в водах океанов содержится около 1000 Гг органического углерода. Это количество превышает запас углерода в биомассе континентов и близко к его содержанию в гумусе почв. Рассеянное во всей толще океанических вод органическое вещество иногда называют водным гумусом. Важно, что он, как гумус почв и рассеянное органическое вещество горных пород (кероген), недоступен для ассимиляции микроорганизмам. Правда, причины этой недоступности различны. Геополимеры - компоненты почвенного гумуса и кероген - устойчивы по отношению к биохимическому разложению в силу их химического строения (см. раздел 1.4). Напротив, водный гумус образован легко разрушаемыми соединениями - углеводами, аминокислотами и жирными кислотами. Однако их концентрации в морской воде ниже концентрации, соответствующей половине максимальной скорости роста микроорганизмов (примерно 10 мг/л). Это делает невыгодным использование микроорганизмами водного гумуса, и он становится огромным резервуаром углерода (Г. А. Заварзин, 1984). [c.54]
Выделение биогенных элементов в отдельную группу до некоторой степени условно, поскольку множество других элементов также необходимо для нормального функционирования организмов. Содержание их колеблется в очень широких пределах от следов, часто не улавливаемых существующими методами определения, до единиц и десятков миллифаммов на 1 л. В наименьших количествах в природных водах встречается фосфор, содержание которого редко превышает 0,5 мг/л. Наибольшие уровни концентрации характерны для кремния, они достигают иногда 15 мг/л. Азот и железо занимают промежуточное положение, причем в морских и океанических водах они содержатся в меньших количествах, чем в речных. [c.134]
Содержание микроэлементов в природных водах обычно невысоко в пределах от единиц до десятков, реже сотен микрофаммов на 1 л, а содержание многих микроэлементов часто недоступно определению обычными химическими или физико-химическими методами. Особенно это характерно для морских и океанических вод. [c.137]
Самым распространенным загрязняющим веществом гидросферы является нефть и нефтепродукты. Если учесть, что в Мировой океан и поверхностные воды суши ежегодно привносится 15—17 млн,т нефти и нефтепродуктов, а 1 т нефти покрывает тонкой пленкой акваторию средней площадью 12 км то потенциально 150—180 млакм поверхности Мирового океана каждый год покрывается нефтяной пленкой. Эта оценка условна, так как не учитывает скорости разложения отдельных компонентов нефти, ее способности коагулировать, сбиваясь комками, но, тем не менее, многими исследователями отмечено, что нефтяные пятна на поверхности океанических вод между Европой и Северной Америкой уже смыкаются. [c.167]
Одни только дейтериевые циклы представляют неисчерпаемые источники энергии. Действительно, энергия дейтерия, содержащегося в 1 л воды, эквивалентна 300 л бензина, а на Земле 14-10 л воды. По современным оценкам содержащиеся в морской и океанической водах запасы дейтерия эквивалентны 10 т нефти. Для сравнения следует отметить, что мировое потребление энергетических ресурсов в 1980 г. составило 6-10 т нефти. Ученые считают, что дейтерий-тритиевый цикл, в котором тритий получается из лития, будет лежать в основе первых коммерческих реакторов. Он имеет самую низкую рабочую температуру и в 100 раз большую скорость реакции по сравнению с конкурирующими видами ядерных топлив. Тем не менее в перспективе три-тиевое топливо может рассматриваться лишь как промежуточная ступень. Главная цель — создание реактора, работающего на чисто дейтериевом или протоновом топливе, и тoчни сложного процесса получения трития. По мере того как исчерпываются наиболее доступные источники энергии, возникает потребность в передаче энергии к месту потребления на дальние и сверхдальние расстояния. Примером может служить сооружение гигантского газопровода, призванного транспортировать природный газ из Восточной Сибири в Западную Европу, и строительство высоковольтных линий электропередач, связывающих крупнейшие гидроэлектростанции нашей страны с промышленными регионами. [c.81]
Концентрации кремнезема 0,0002 % достигались при по-гру кении в разбавленный солевой раствор слюды и каолина, при растворении монтмориллонита они составляли до 0,0015 % [36]. Когда морская вода обогащалась растворимым кремнеземом до 0,0025 %, то при отсутствии подобных минералов в воде концентрация сохранялась на одном уровне в течение года. Однако при введении в раствор минералов кремнезем удалялся из раствора и концентрация падала до уровня 0,0002—0,0015 °/о, т. е. до концентрации, получаемой при растворении минералов. Так как океанические воды, как показали многочисленные измерения, содержат 0,0002—0,0010 % 5102, то весьма вероятно, что это значение представляет собой равновесную растворимость коллоидного алюмосиликата в суспензии. Экспериментально доказано, что чистый аморфный кремнезем, растворенный в воде, дает концентрацию 0,0100—0,011 7о монокремневой кислоты, однако в присутствии многозарядных катионов металлов (железа, алюминия и др.) образуются коллоидные силикаты со значительно более низкой концентрацией монокремневой кислоты. Айлер [37] показал, что добавка катиона алюминия снижает растворимость аморфного кремнезема приблизительно от 0,0110 до менее чем 0,0010 % [c.25]
К факторам, контролирующим распределение морских илов, частично относится доступность питательных веществ, которьк должно быть достаточно для поддержания жизни значительных популяций фитопланктона (см. п. 3.7.4). Однако более важным является растворение СаСОз по мере осаждения частичек в глубинные океанические воды. В глубинных водах океанов, осо- [c.176]
Гидротермальные реакции с участием сульфатов и калия. Влияние гидротермальных реакций на запасы океанических 80 и К еще более сложно. Сера в виде сульфида водорода (НгВ) или Н8- была обнаружена в гидротермальных флюидах, и известно, что осаждение 80 [ангидрит (Са804)[ происходит как в коре из нисходящей просачивающейся морской воды, так и на участках гидротермальных выходов. Судьба СаЗОд в коре неизвестна, тогда как СаЗОд на выходах, по-видимому, вновь растворяется в глубинных океанических водах и мало влияет на общие запасы 564 . Ранние оценки крупномасштабного выноса 80 на срединных океанических хребтах, основанные на данных по Галапагосу, вероятно, неточны и существенно дисбалансируют в противном случае удовлетворительные резервуары. Хорошо известно, что НгЗ осаждается из гидротермальных флюидов в виде сульфидов железа, но общий вынос по этому механизму, скорее всего, невелик, поскольку в геологическом временнбм масштабе 80 , поступающие с речным потоком, достаточно хорошо удаляются в результате образования эвапоритов и осадочных сульфидов. [c.189]
chem21.info
Океаническая вода - Большая Энциклопедия Нефти и Газа, статья, страница 3
Океаническая вода
Cтраница 3
Однако подземные воды, производные от океанической воды, имеют другую общую минерализацию, и в составе их после натрия обычно стоит кальций, а после хлора часто гидрокарбонатный ион. Что касается сульфатов, то в некоторых водах они почти исчезают и взамен их появляется сероводород. Эти изменения объясняются процессами десульфатизации, доломитизации и обмена катионов. [31]
Рапа Мертвого моря в сравнении со сгущенной океанической водой других водоемов отличается высоким содержанием хлористого кальция. Солевой состав рапы ( в %): СаС12 - 14 0, NaCl - 27 8, MgCl2 - 51 4, КС1 - 4 6 и MgBr2 - 2 2; сумма солей изменяется от 23 до 33 %, причем в более глубоких слоях концентрация выше, чем у поверхности. [32]
Тепловое загрязнение создает проблемы в реках и прибрежных океанических водах. Обычно такое загрязнение связано с использованием природных вод в качестве охлаждающих агентов в промышленных процессах, например на электростанциях. Вода, возвращаемая в водоемы предприятиями, теплее исходной и, следовательно, содержит меньше растворенного кислорода. Одновременно нагревание среды увеличивает интенсивность метаболизма ее обитателей, а, значит, их потребность в кислороде. Если температура сбрасываемой воды незначительно отличается от температуры воды в водоеме, то никаких изменений биотического компонента экосистемы может не произойти. Если же температура повышается существенно, то в биоте могут произойти серьезные изменения. Например, для проходных рыб типа лосося бедные кислородом участки рек становятся непреодолимыми препятствиями, и связь этих видов с нерестилищами прерывается. [33]
Геофизические данные доказывают, что состав морской или океанической воды мало изменился за геологическое время. [34]
В табл. 1.4 приведено содержание главных ионов в океанической воде. Однако некоторые из них, несмотря на низкую концентрацию, играют важную роль в химических процессах в морской воде и в жизни морских организмов. В этом отношении видная роль принадлежит азоту, фосфору, кремнию. [35]
С тех пор как люди стали следить за составом океанической воды, он остается неизменным. Конечно, химические данные о составе морской воды известны всего за какие-нибудь неполные 100 лет. Если ее состав и подвергается изменениям, то это, вероятно, происходит за гораздо большие промежутки времени, чем 100 лет. Однако существуют и другие доказательства, подтверждающие, что химический состав океанов существенно не менялся за долгие периоды. [36]
Однако указанное постоянство химического состава относится только к общей массе океанической воды. В отдельных местах у берегов вода океана часто очень значительно отличается от среднего состава как общей минерализацией, так и соотношением между отдельными частями солевого состава. Это объясняется главным образом влиянием материковых вод, поступающих в океан. [37]
Наиболее интенсивно в пределах данной проблемы исследовалась двумерная задач об интрузии океанических вод, которая чаще всего решалась в предпосылке о наличии резкой границы раздела пресной и соленой воды. [38]
Речные и грунтовые воды по своему химическому составу резко отличаются от океанической воды. [39]
В результате этих закономерностей наблюдается повышенное содержание [ СО2 ] над теплыми океаническими водами в низких широтах и более низкое парциальное давление СО2 в высоких широтах. К сожалению, имеется очень немного измерений концентрации СО2 в воздухе над океанами с параллельным определением равновесного парциального давления [ С02 ] в морской воде. Эрикссон [76] дал обзор этих данных. [40]
Равновесие между твердым СаСО3 и ионами Са2 и СО2, находящимися в океанической воде, имеет важное значение для развития многих морских организмов, например коралловых полипов и моллюсков. Равновесие растворения СаСО3 в морской воде смещено в сторону большей растворимости вследствие влияния других ионов, присутствующих в этой среде. Более чем 100-кратное увеличение растворимости СаСО3 в морской воде служит еще одним примером роли межионного притяжения в водной среде с высокой концентрацией ионов. [41]
Опресненная электродиализом вода по содержанию макрокомпонентов отличается от воды, получаемой простым разведением океанической воды, что говорит о селективности метода. В табл. 2 приведены соотношения между компонентами для морской воды и диализатов и рассчитаны коэффициенты обогащения по кальцию, магнию, сульфату и бикарбонату, которые особенно значительны для сульфат - и бикарбонат-ионов. [42]
Обычно расход серной кислоты на 1 т брома составляет 2 5 т для океанической воды и 0 8 - 1 т для той же воды, сконцентрированной до начала садки NaCl. Хлоркальциевые рассолы следует подкислять соляной кислотой, так как h3S04 вызывает образование гипса. [43]
Дальнейшее выпадение трития в период с 1956 г. по 1959 г., а также его концентрация в дождевой, речной и океанической воде увеличивались неравномерно. Это, возможно, свидетельствует о том, что при воздушных и наземных взрывах тритий ведет себя так же, как другие изотопы, и что особенности распространения трития, образовавшегося в результате серии взрывов Касл, свойственны только взрывам вблизи водной поверхности. [44]
По классам объектов подсистема СО подразделяется на о раздела: СО для контроля, соответственно, почв, поверхностных и океанических вод, атмосферы. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Морская вода — Википедия РУ
Солёность
 Химический состав морской воды
Химический состав морской воды В океанах солёность воды почти повсеместно близка к 3,5 %, однако в морях вода имеет неравномерно распределённую солёность. Наименее солёной является вода Финского залива и северной части Ботнического залива, входящих в акваторию Балтийского моря. Наиболее солёной является вода Красного моря и восточная часть Средиземного моря. Солёные озёра, такие как Мёртвое море, могут иметь значительно больший уровень содержания солей.
Морская вода слабощелочная, pH варьируется в пределах от 7,5 до 8,4. Относительно высокая стабильность pH связана с наличием карбонатной буферной системы[2][3][4]. Несколько меньшее значение для поддержания pH имеет боратная система[5]. Наиболее высоко значение pH у поверхности моря, с глубиной оно несколько снижается. В опреснённых участках величина pH может снижаться до нейтральной и даже слабокислой[6].
| ||||||||||||||||||||||||||
|
Биогенные вещества
Биогенные элементы необходимы для живых организмов. К ним относят фосфор, азот (в неорганических соединениях) и (для некоторых организмов) кремний. Важную роль играют металлы, встречающиеся в следовых количествах[8].
Содержание биогенных веществ в морской воде непостоянно, и различается в зависимости от места, глубины и времени взятия пробы. Обычно их содержание минимально у поверхности, возрастает до максимума до глубины 1000—1500 метров, и затем снова плавно снижается. Содержание фосфатов может резко повышаться у дна океана[9].
При апвеллинге вода поднимается к поверхности и приносит туда содержащиеся в ней биогены.
Растворённые газы
Контактируя с атмосферой, морская вода обменивается с воздухом содержащимися в нём газами: кислородом, азотом и углекислым газом. Эти же газы попадают в морскую воду в результате химических и биологических процессов, протекающих в океане. Некоторое количество газов вносится в океан с речной водой.
Количество газов, растворенных в морской воде, зависит от их растворимости и от парциального давления в воздухе. С повышением температуры растворимость газов и, соответственно, содержание их в морской воде уменьшается.
Соотношение растворенного кислорода и азота в морской воде отличается от их соотношения в атмосфере. Из-за лучшей растворимости кислорода концентрация его в воде относительно выше, его соотношение с азотом 1:2[10].
В анаэробных условиях в воде может накапливаться сероводород — например, в Черном море на глубине более 200 метров.
Физические свойства
Плотность морской воды колеблется в пределах от 1020 до 1030 кг/м³ и зависит от температуры и солености. При солености, превышающей 24 ‰, температура максимальной плотности становится ниже температуры замерзания[11] — при охлаждении морская вода всегда сжимается, и плотность её растет[12].
Скорость звука в морской воде — около 1500 м/с.
| Морская вода | Чистая вода | |
| Плотность при 25 °C, г/см3: | 1,02412 | 0,9971 |
| Вязкость при 25 °C, миллипуаз: | 9,02 | 8,90 |
| Давление пара при 20 °C, мм. рт. ст.: | 17,35 | 17,54 |
| Температура максимальной плотности, °C: | -3,52 (переохлаждённая жидкость) | +3,98[1] |
| Точка замерзания, °C: | -1,91 | 0,00 |
| Поверхностное натяжение при 25 °C, дин/см: | 72,74 | 71,97 |
| Скорость звука при 0 °C, м/с: | 1450 | 1407 |
| Удельная теплоёмкость при 7,5 °C, Дж/(г·°C): | 3,898 | 4,182 |
Научное объяснение появлению солёной воды в море было положено работами Эдмунда Галлея в 1715 году. Он предположил, что соль и другие минералы вымывались из почвы и доставлялись в море реками. Достигнув океана, соли оставались и постепенно концентрировались. Галлей заметил, что большинство озёр, не имеющих водной связи с океанами, имеют солёную воду.
Теория Галлея отчасти верна. Вдобавок к ней следует упомянуть, что соединения натрия вымывались из дна океанов на ранних этапах их формирования. Присутствие другого элемента соли, хлора, объясняется его высвобождением (в виде хлороводорода) из недр Земли при извержениях вулканов. Атомы натрия и хлора постепенно стали основными составляющими солевого состава морской воды.
Морская вода непригодна для питья из-за высокого содержания солей и минеральных веществ, для выведения которых из организма требуется воды больше, чем её выпитое количество. Однако после опреснения такую воду можно пить.
В 1950-х годах французский врач и путешественник Ален Бомбар экспериментально доказал, что морскую воду можно без вреда для здоровья пить в небольших (порядка 700 мл/сутки) количествах в течение 5—7 дней[13]. См.также Физиологическая адаптация. Распреснённая морская вода соленостью в 3-4 раза ниже океанической (не более 8—11 промилле) в некоторых заливах, лагунах, эстуариях, куда впадают крупные реки, таких морях, как Азовское, Балтийское, Каспийское, намного менее вредна, чем океаническая, и может понемногу применяться для питья и выживания в чрезвычайных ситуациях. Аналогичное достигается, если разбавить океанскую воду пресной как минимум в соотношении 2:3.
http-wikipediya.ru

 Б.Находящаяся в равновесии с атмосферой океанская вода при солёности 35 ‰ и температуре 25 °C имеет pH 8,1. Соотношение форм неорганического растворённого углерода при этом:CO2:HCO3−:CO32−≈0,5%:86,5%:13%{\displaystyle CO_{2}:HCO_{3}^{-}:CO_{3}^{2-}\approx 0,5\%:86,5\%:13\%}
Б.Находящаяся в равновесии с атмосферой океанская вода при солёности 35 ‰ и температуре 25 °C имеет pH 8,1. Соотношение форм неорганического растворённого углерода при этом:CO2:HCO3−:CO32−≈0,5%:86,5%:13%{\displaystyle CO_{2}:HCO_{3}^{-}:CO_{3}^{2-}\approx 0,5\%:86,5\%:13\%}