Гидроксид натрия: свойства, получение и применение. Вода гидроксид
Гидроксиды: свойства и все характеристики
Характеристики и физические свойства гидроксидов
Большинство оснований – твердые вещества с различной растворимостью в воде. Гидроксид меди (II) голубого цвета (рис. 1), гидроксид железа (III) бурого, большинство других белого цвета.

Рис. 1. Гидроксид меди (II). Внешний вид.
Получение гидроксидов
Растворимые основания (щелочи) в лаборатории можно получить при взаимодействии активных металлов и их оксидов с водой:
CaO + h3O = Ca(OH)2.
Щелочи гидроксид натрия и гидроксид кальция получают электролизом водных растворов хлорида натрия и хлорида калия.
Нерастворимые в воде основания получают по реакции солей с щелочами в водных растворах:
FeCl3 + 3NaOHaq = Fe(OH)3↓ + 3NaCl.
Химические свойства гидроксидов
Растворимые и нерастворимые основания имеют общее свойства: они реагируют с кислотами с образованием солей и воды (реакция нейтрализации):
NaOH + HCl = NaCl + h3O;
Cu(OH)2 + 2HCl = CuCl2 + h3O.
Растворы щелочей изменяют цвет некоторых веществ – лакмуса, фенолфталеина и метилового оранжевого, называемых индикаторами (табл. 1).
Таблица 1. Изменение цвета индикаторов под воздействием растворов кислот и оснований.
|
Индикатор |
Цвет индикатора в среде |
||
|
кислой |
щелочной |
нейтральной |
|
|
Лакмус |
Красный |
Синий |
Фиолетовый |
|
Фенолфталеин |
Бесцветный |
Малиновый |
Бесцветный |
|
Метиловый оранжевый |
Розовый |
Желтый |
Оранжевый |
Кроме общего свойства, щелочи и нерастворимые в воде основания обладают также специфическими. Например, при нагревании голубого осадка гидроксида меди (II) образуется вещество черного цвета – это оксид меди (II):
Cu(OH)2 = CuO + h3O.
Щелочи, в отличие от нерастворимых оснований, при нагревании обычно не разлагаются. Их растворы действуют на индикаторы, разъедают органические вещества, реагируют с растворами солей (если в их состав входит металл, способный образовать нерастворимое основание) и кислотными оксидами:
Fe2(SO4)3 + 6KOH = 2Fe(OH)3↓ + 3K2SO4;
2KOH + CO2 = K2CO3 + h3O.
Применение гидроксидов
Гидроксиды находят широкое применение в промышленности и быту. Например, большое значение имеет гидроксид кальция. Это белый рыхлый порошок. При смешивании его с водой образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диокисда углерода. Гашеную известь применяют дляприготовления бордосской смеси –средства борьбы с болезнями и вредителями растений. Известковое молоко широко используют в химической промышленности, например при производстве сахара, соды и других веществ.
Гидроксид натрия применяют для очистки нефти, производства мыла, в текстильной промышленности. Гидроксид калия и гидроксид лития используют в аккумуляторах.
Примеры решения задач
ru.solverbook.com
Основные гидроксиды и их химические свойства
К основным классам неорганических веществ, кроме оксидов, кислот и солей, относится группа соединений, называемых основаниями или гидроксидами. Все они имеют единый план строения молекулы: обязательно содержат в ее составе одну или несколько гидроксильных групп, соединенных с ионом металла. Основные гидроксиды генетически связаны с оксидами металлов и солями, это обуславливает не только их химические свойства, но и способы получения в лаборатории и промышленности.

Существует несколько форм классификации оснований, которые базируются как на характеристике металла, входящего в состав молекулы, так и на способности вещества растворяться в воде. В нашей статье мы рассмотрим эти особенности гидроксидов, а также ознакомимся с их химическими свойствами, от которых зависит применение оснований в промышленности и быту.
Физические свойства
Все основания, образованные активными или типичными металлами, представляют собой твердые вещества, обладающие широким диапазоном температур плавления. По отношению к воде они делятся на хорошо растворимые – щелочи и нерастворимые в воде. Например, основные гидроксиды, содержащие в качестве катионов элементы IA группы, легко растворяются в воде и являются сильными электролитами. Они мыльные на ощупь, разъедают ткань, кожу и называются щелочами. При их диссоциации в растворе обнаруживаются ионы ОН-, определяемые с помощью индикаторов. Например, бесцветный фенолфталеин в щелочной среде становится малиновым. Как растворы, так и расплавы гидроксидов натрия, калия, бария, кальция являются электролитами, т.е. проводят электрический ток и считаются проводниками второго рода. К растворимым основаниям, наиболее часто используемым в промышленности, относится около 11 соединений, например, таких, как основные гидроксиды натрия, калия, аммония и др.

Строение молекулы основания
Между катионом металла и анионами гидроксильных групп в молекуле вещества образуется ионная связь. Она достаточно прочная у нерастворимых в воде гидроксидов, поэтому полярные молекулы воды не способны разрушить кристаллическую решетку такого соединения. Щелочи являются веществами стойкими и практически не образуют при нагревании оксид и воду. Так, основные гидроксиды калия и натрия кипят при температуре более 1000 °С, при этом они не разлагаются. В графических формулах всех оснований хорошо видно, что атом кислорода гидроксильной группы связывается одной ковалентной связью с атомом металла, а другой – с атомом водорода. Строение молекулы и тип химической связи обуславливают не только физические, но и все химические характеристики веществ. Остановимся на них подробнее.
Кальций и магний и особенности свойств их соединений
Оба элемента являются типичными представителями активных металлов и могут взаимодействовать с кислородом и водой. Продуктом первой реакции является основный оксид. Гидроксид образуется вследствие экзотермического процесса, идущего с выделением большого количества теплоты. Основания кальция и магния представляют собой малорастворимые белые порошковидные вещества. Для соединения кальция часто применяют следующие названия: известковое молоко (если это суспензия в воде) и известковая вода. Будучи типичным основным гидроксидом, Са(ОН)2 взаимодействует с кислотными и амфотерными оксидами, кислотами и амфотерными основаниями, например, с гидроксидами алюминия и цинка. В отличие от типичных щелочей, устойчивых к нагреванию, соединения магния и кальция под действием температуры разлагаются на оксид и воду. Оба основания, особенно Са(ОН)2, широко используются в промышленности, сельском хозяйстве и в бытовых нуждах. Рассмотрим их применение далее.

Области применения соединений кальция и магния
Хорошо известно, что в строительстве применяют химический материал, называемый пушенкой или гашеной известью. Это - основание кальция. Чаше всего его получают реакцией воды с основным оксидом кальция. Химические свойства основных гидроксидов позволяют широко использовать их в различных отраслях народного хозяйства. Напимер, для очистки примесей в производстве сахара-сырца, для получения хлорной извести, в отбеливании хлопчатобумажной и льняной пряжи. До изобретения ионообменников – катионитов, основания кальция и магния применяли в технологиях умягчения воды, что позволяло избавиться от гидрокарбонатов, ухудшающих ее качество. Для этого воду кипятили с небольшим количеством кальцинированной соды или гашеной извести. Водную суспензию гидроксида магния можно применять в качестве лечебного средства больным гастритом для снижения кислотности желудочного сока.

Свойства основных оксидов и гидроксидов
Наиболее важными для веществ это группы являются реакции с кислотными оксидами, кислотами, амфотерными основаниями и солями. Интересно, что нерастворимые основания, например, такие как гидроксиды меди, железа или никеля нельзя получить прямой реакцией оксида с водой. В этом случае в лаборатории пользуются реакцией между соответствующей солью и щелочью. В результате образуются основания, которые выпадают в осадок. Например, так получают голубой осадок гидроксида меди, зеленый осадок основания двухвалентного железа. В дальнейшем их выпаривают до твердых порошковидных веществ, относящихся к нерастворимым в воде гидроксидам. Отличительная особенность этих соединений заключается в том, что при действии высоких температур они разлагаются на соответствующий оксид и воду, чего нельзя сказать о щелочах. Ведь растворимые в воде основания являются термически стойкими.

Способность к электролизу
Продолжая изучать основные свойства гидроксидов, остановимся еще на одной черте, по которой можно отличить основания щелочных и щелочно-земельных металлов от нерастворимых в воде соединений. Это невозможность последних диссоциировать на ионы под действием электрического тока. Напротив, расплавы и растворы гидроксидов калия, натрия, бария, стронция легко подвергаются электролизу и являются проводниками второго рода.
Получение оснований
Говоря о свойствах этого класса неорганических веществ, мы частично перечислили химические реакции, лежащие в основе их получения в лабораторных и промышленных условиях. Наиболее доступным и экономически выгодным можно считать способ термического разложения природного известняка, в результате которого получить негашеную известь. Если провести реакцию с водой, то она образует гидроксид основного характера – Са(ОН)2. Смесь этого вещества с песком и водой называют строительным раствором. Его продолжают использовать для оштукатуривания стен, для связки кирпичей и в других видах строительных работ. Щелочи также можно получить реакцией соответствующих оксидов водой. Например: К2О + Н2О = 2КОН. Процесс является экзотермическим идет с выделением большого количества теплоты.

Взаимодействие щелочей с кислотными и амфотерными оксидами
К характерным химическим свойствам растворимых в воде оснований можно отнести их способность образовывать соли в реакциях с оксидами, содержащими в молекулах атомы неметаллов, например, такими, как углекислый газ, диоксид серы или оксид кремния. В частности, гидроксид кальция используют для осушения газов, а гидроксиды натрия и калия для получения соответствующих карбонатов. Оксиды цинка и алюминия, относящиеся к амфотерным веществам, могут взаимодействовать как с кислотами, так и со щелочами. В последнем случае могут образовываться комплексные соединения, например, такие, как гидроксоцинкат натрия.
Реакция нейтрализации
Одним из наиболее важных свойств оснований, как нерастворимых в воде, так и щелочей, является их способность реагировать с неорганическими или органическими кислотами. Данная реакция сводится к взаимодействию между собой двух видов ионов: водорода и гидроксильных групп. Оно приводит к образованию молекул воды: HCI + КОН = KCI + Н2О . С точки зрения теории электролитической диссоциации вся реакция сводится к образованию слабого малодиссоциированного электролита – воды.

В приведенном примере образовалась средняя соль – хлорид калия. Если же для реакции взяты гидроксиды основного характера в количестве меньшем, чем нужно для полной нейтрализации многоосновной кислоты, то при выпаривании образовавшегося продукта обнаруживаются кристаллы кислой соли. Реакция нейтрализации играет важную роль в метаболических процессах, протекающих в живых системах – клетках и позволяет им с помощью собственных буферных комплексов нейтрализовать избыточное количество ионов водорода, накапливающихся в реакциях диссимиляции.
fb.ru
Основания (гидроксиды). Свойства, получение, применение
 Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
h3SO4 + h3O ⇄ HSO4— + h4O+(катион гидроксония)
h3SO4 + Ch4COOH ⇄ HSO4— + Ch4COOh3+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калияCa(OH)2 — гидроксид кальцияFe(OH)2 — гидроксид железа (II)Fe(OH)3 — гидроксид железа (III)
Существует также основание Nh5OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония Nh5+.
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(Oh3), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).
- По силе (по степени диссоциации) различают:а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое Nh5OH.
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты. Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода. Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pKb. Например, для аммиака Nh4 имеем:
Получение
-
Взаимодействие активного металла с водой:
2Na + 2h3O → 2NaOH + h3
Ca + 2h3O → Ca(OH)2 + h3
Mg + 2h3O Mg(OH)2 + h3
-
Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + h3O → 2NaOH,
CaO + h3O → Ca(OH)2.
-
Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4h3O 2NaOH + 2h3 + CI2
-
Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.

Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
-
Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый

Фенолфталеин придаёт раствору щёлочи малиновую окраску
-
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2KOH + h3SO4 → K2SO4 + 2h3O,
растворимое
Mg(OH)2 + 2HCI → MgCI2 + 2h3O.
нерастворимое
-
Взаимодействие с кислотными оксидами:
2KOH + SO3 → K2SO4 + h3O
-
Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 → 2NaAIO2 + h3O,
NaOH + AI(OH)3 → NaAIO2 + 2h3O.
б) в растворе:
2NaOH + AI2O3 +3h3O → 2Na[AI(OH)4],
NaOH + AI(OH)3 → Na[AI(OH)4].
-
Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2h3O → Na2[Zn(OH)4] + h3
2NaOH + Si + h3O → Na 2SiO3 + 2h3
-
Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
-
Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2 → CaO + h3O,
Cu(OH)2 → CuO + h3O.
in-chemistry.ru
Гидроксид кальция: свойства и применение
Ca(OH)2 – это гидроксид кальция (от латинского Calcium hydroxide), он является довольно распространенным химическим веществом. Оно по своей природе считается сильным основанием. Представляет собой мелкокрупинчатый порошок желтоватого цвета или бесцветные кристаллы. Способен разлагаться при нагревании, в результате выделяется оксид кальция. Он плохо растворим в воде. При этом водный раствор гидроксида кальция по своим химическим свойствам является средним основанием. В присутствии металлов может выделять водород, который признан взрывоопасным газом.
Гидроксид кальция при поступлении в организм через рот или в результате вдыхания аэрозоля может всасываться в ткани и накапливаться в них. При обычной комнатной температуре в 20-22 градусов это вещество практически не испаряется, но при распылении его частиц может быть опасно для здоровья. Попадая на кожу, в дыхательные пути или слизистые оболочки глаз, гидроксид кальция оказывает раздражающее, даже разъедающее действие. Длительный контакт с кожными покровами может стать причиной дерматита. Также может поражаться легочная ткань при постоянном воздействии частиц гидроксида кальция.
Это химическое соединение имеет много тривиальных названий, таких как гашеная известь (ее получают методом гашения оксида кальция обычной водой), известковая вода (представляет собой прозрачный водный раствор). Другие названия: пушонка (гидроксид кальция в виде сухого порошка ) и известковое молоко (насыщенная водная суспензия). Зачастую негашеной известью или известкой принято называть также оксид кальция.
Гидроксид кальция, химические свойства которого считаются агрессивными по отношению к другим веществам, получают методом гашения извести, то есть, в результате взаимодействия (химической реакции) оксида кальция и воды. Схематически эта реакция выглядит таким образом:
CaO + h3O = Ca(OH)2
Для полученного водного раствора характерна щелочная реакция среды. Как и все типичные гидроксиды, гидроксид кальция реагирует с:
1. неорганическими кислотами с образованием типичных солей кальция
h3SO4 +Ca(OH)2 = CaSO4 + 2h3O
2. углекислым газом, который растворен в воде, поэтому водный раствор очень быстро мутнеет на воздухе, при этом образуется белый нерастворимый осадок – карбонат кальция
CO2 + Ca(OH)2 = CaCO3 + h3O
3. угарным газом при повышении температуры до 400 градусов Цельсия
CO (t°) + Ca(OH)2 = CaCO3 + h3
4. солями, в результате также выпадает белый осадок – сульфат кальция
Na2SO3 + Ca(OH)2 = CaSO3 + 2NaOH
Использование гидроксида кальция очень популярно. Наверняка, каждому известно, что известью обрабатывают стены помещений, стволы деревьев, а также используют ее как компонент строительного известкового раствора. Применение гидроксида кальция в строительстве известно с древнейших времен. А в настоящее время его включают в состав штукатурки, из него производят силикатный кирпич и бетон, составы которых практически одинаковы со строительным раствором. Основное отличие состоит в методе приготовления этих самых растворов.
Гидроксид кальция используется для смягчения жесткости воды, для изготовления хлорной извести, известковых неорганических удобрений, каустификации карбоната калия и натрия. Также это вещество незаменимо при дублении кож в текстильной промышленности, при получении различных соединений кальция, а также для нейтрализации кислых растворов, и сточных вод в том числе. На его основе получают органические кислоты.
Гидроксид кальция нашел свое применение и в пищевой промышленности, где он больше известен как пищевая добавка Е526, использующаяся как регулятор кислотности, отвердитель и загуститель. В сахарной промышленности он применяется для обессахаривания патоки.
В лабораторных и демонстрационных опытах известковая вода является незаменимым индикатором обнаружения углекислого газа при протекании химических реакций. Известковым молоком обрабатывают растения в целях борьбы с болезнями и вредителями.
fb.ru
Гидроксид водорода Википедия
| Вода | |
 | |
 | |
 | |
| Оксид водорода Вода[1] | |
| вода | |
| h3O | |
| жидкость | |
| 18,01528 г/моль | |
| 0,9982 г/см³ | |
| 1,5[3] | |
| 0,00101 Па·с | |
| 0,01012 см²/с (при 20 °C) | |
| (дистиллированная вода) 1348 м/с | |
| 273,1 K (0 ° C) | |
| 373,1 K (99,974 ° C) °C | |
| 273,2 K (0,01 ° C), 611,72 Па | |
| 647,1 K (374 ° C), 22,064 МПа | |
| 75,37 Дж/(моль·К) | |
| 0,56 Вт/(м·K) | |
| 2256,2 кДж/кг[2] | |
| 332,4 кДж/кг[2] | |
| 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | |
| 7732-18-5 | |
| 962 | |
| 231-791-2 | |
| ZC0110000 | |
| 15377 | |
| 937 | |
 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает вода Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[4][5].
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км2[6][7]. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % — ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды)[8][9]. Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах[8].
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[10], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[11].
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH- и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH-
- Монооксид дигидрогена
- Дигидромонооксид
Образование воды
Известно, что 2 объема водорода взаимодействуют с 1 объемом кислорода с образованием воды. При реакции выделяется большое количество тепла, как и при горении свечи. Продукт реакции — вода не похожа на исходные вещества — водород и кислород. Следовательно, превращение, происходящее при взаимодействии водорода и кислорода, должно быть отнесено к химическим реакциям.
В соответствии с атомно-молекулярной теорией мы начинаем рассуждение, предполагая, что в реакции участвуют молекулы Н2 и О2. В результате реакции образуются молекулы воды. Связи между атомами в реагирующих веществах разрываются и атомы перегруппировываются. При этом возникают новые связи в молекулах продукта реакции. Эти превращения легко представить с помощью молекулярных моделей. Молекулярную модель можно представить как две молекулы Н2 (четыре атома) и одна молекула О2 (два атома). Если эти молекулы будут реагировать с образованием воды, то связи между атомами в молекулах водорода и кислорода должны разорваться. Затем «завязываются» новые связи и образуются две молекулы воды. Отметим, что в результате реакции происходит перегруппировка атомов, но общее число атомов при этом не изменяется.
Пример образования молекул воды
Один миллион молекул кислорода реагирует с достаточно большим количеством молекул водорода с образованием воды. Сколько молекул воды образуется? Сколько молекул водорода требуется для этой реакции?
Для получения 100 молекул воды расходуется 100 молекул водорода и 50 молекул кислорода. Таким образом, для получения 1 моля воды (6,02 · 1023 молекул) нам потребуется 1 моль водорода (6,02 · 1023 молекул) и 0,5 моля кислорода (3,01 · 1023 молекул). Результаты приведены в таблице:
| Водород | Кислород | Вода | |
| Число молекул | 2 | 1 | 2 |
| 4 | 2 | 4 | |
| 100 | 50 | 100 | |
| 6,02 · 1023 | 3,01 · 1023 | 6,02 · 1023 | |
| Число молей | 1 | 0,5 | 1 |
| 2 | 1 | 2 | |
| 10 | 5 | 10 |
Реакция между водородом и кислородом протекает намного быстрее, если эти газы смешать и затем поджечь смесь искрой. Происходит сильный взрыв. Тем не менее, на 1 моль реагирующего водорода образуется такое же количество продукта реакции — воды — и выделяется столько же тепла, как и при обычном горении.
Если реагируют 1 моль чистого водорода и 0,5 моля чистого кислорода, образуется 1 моль воды. Количество тепла, выделяющееся при образовании 1 моля воды, равно 68000 кал. Если же мы возьмем только 0,025 моля чистого водорода, то потребуется 0,5 · 0,025 моля кислорода. При этом образуется 0,025 моля воды. Если получено только 0,025 моля воды, то выделяется лишь 0,025 · 68 000 = 1700 кал тепла.
Источником этой тепловой энергии должны быть сами реагирующие вещества (водород и кислород), так как к системе извне подводится только тепло, необходимое для поджигания смеси. Отсюда можно сделать вывод, что вода содержит меньше энергии, чем реагирующие вещества, используемые для ее получения. Реакция, при которой выделяется тепло, называется экзотермической. Количество тепла, выделяющееся при сгорании 1 моля водорода (68 000 кал, или 68 ккал), называется молярной теплотой сгорания водорода.
Свойства
Физические свойства
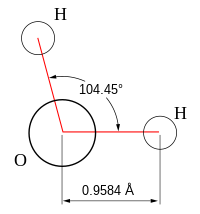
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (h3S, Ch5, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[12]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[12]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[13].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[14]:
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[15][16][17]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[18]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
 Капля, ударяющаяся о поверхность воды
Капля, ударяющаяся о поверхность воды Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония h4O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния
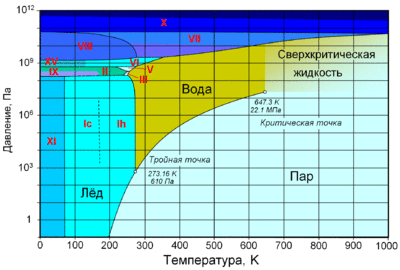
По состоянию различают:

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[19]:
| 0,987 (105 Па — нормальные условия) | 99.63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (h3O17 и h3O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[13].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[13].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.Воду можно получать:
- в ходе реакций —
- Восстановлением водородом оксидов металлов —
Под воздействием очень высоких температур или электрического тока (при электролизе)[20], а также под воздействием ионизирующего излучения, как установил в 1902 году[21]Фридрих Гизель[en] при исследовании водного раствора бромида радия[22], вода разлагается на молекулярный кислород и молекулярный водород:
2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}Вода реагирует при комнатной температуре:
2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}- со фтором и межгалоидными соединениями
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}}h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот;
- с ацетиленом и другими алкинами;
- с алкенами;
- с нитрилами.
Волновая функция основного состояния воды
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}} в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}, один со спином α{\displaystyle \alpha }, другой со спином β{\displaystyle \beta }, или 8 спин-орбиталей ψ{\displaystyle \psi }. Волновая функция молекулы, Ψ{\displaystyle \Psi }, представленная единственным детерминантом Слэтера Ф, имеет вид
|ϕ1a1(1)α(1)ϕ1a1(1)β(1)ϕ1b2(1)α(1)...ϕ1b1(1)β(1)ϕ1a1(2)α(2)ϕ1a1(2)β(2)ϕ1b2(2)α(2)...ϕ1b1(2)β(2)ϕ1a1(3)α(3)ϕ1a1(3)β(3)ϕ1b2(3)α(3)...ϕ1b1(3)β(3)...............ϕ1a1(8)α(8)ϕ1a1(8)β(8)ϕb2(8)α(8)...ϕ1b1(8)β(8)|{\displaystyle {\begin{vmatrix}\phi _{1a_{1}}(1)\alpha (1)&\phi _{1a_{1}}(1)\beta (1)&\phi _{1b_{2}}(1)\alpha (1)&...&\phi _{1b_{1}}(1)\beta (1)\\\phi _{1a_{1}}(2)\alpha (2)&\phi _{1a_{1}}(2)\beta (2)&\phi _{1b_{2}}(2)\alpha (2)&...&\phi _{1b_{1}}(2)\beta (2)\\\phi _{1a_{1}}(3)\alpha (3)&\phi _{1a_{1}}(3)\beta (3)&\phi _{1b_{2}}(3)\alpha (3)&...&\phi _{1b_{1}}(3)\beta (3)\\...&...&...&...&...\\\phi _{1a_{1}}(8)\alpha (8)&\phi _{1a_{1}}(8)\beta (8)&\phi _{b_{2}}(8)\alpha (8)&...&\phi _{1b_{1}}(8)\beta (8)\end{vmatrix}}}
Симметрия этой волновой функции определяется прямым произведением НП, по которым преобразуются все занятые спин-орбитали
(a1)⊗(a1)⊗(b2)⊗(b2)⊗(a1)⊗(a1)⊗(b1)⊗(b1).{\displaystyle (a_{1})\otimes (a_{1})\otimes (b_{2})\otimes (b_{2})\otimes (a_{1})\otimes (a_{1})\otimes (b_{1})\otimes (b_{1}).}
Принимая во внимание, что:
- прямое произведение невырожденного НП самого на себя является полносимметричным НП.
- прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем:
a1⊗a1⊗⏟A1b2⊗b2⏟A1⊗a1⊗a1⏟A1⊗b1⊗b1⏟A1⏟A1{\displaystyle \underbrace {\underbrace {a_{1}\otimes a_{1}\otimes } _{A_{1}}\underbrace {b_{2}\otimes b_{2}} _{A_{1}}\otimes \underbrace {a_{1}\otimes a_{1}} _{A_{1}}\otimes \underbrace {b_{1}\otimes b_{1}} _{A_{1}}} _{A_{1}}}
Виды
Вода на Земле может существовать в трёх основных состояниях:
- жидком,
- газообразном
- твёрдом.
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения:
по содержанию катионов кальция и магнияпо изотопам водорода в молекуледругие виды- Пресная вода,
- Дождевая вода,
- Морская вода,
- Подземные воды,
- Минеральная вода,
- Солоноватая вода,
- Питьевая вода и Водопроводная вода,
- Дистиллированная вода и деионизированная вода,
- Сточные воды,
- Ливневая вода или поверхностные воды,
- Апирогенная вода,
- Поливода,
- Структурированная вода — термин, применяемый в различных неакадемических теориях,
- Талая вода,
- Мёртвая вода и Живая вода — виды воды со сказочными свойствами,
- Святая вода — особый вид воды с мистическими свойствами (согласно религиозным учениям). По христианским представлениям святая вода — это вода, посвященная Богу. Никакие свойства воды как таковой при этом не меняются.
В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, подземные воды — около 0,63 %, ледники — 1,81 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %[7].
Атмосферные осадки
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[23].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[24][25], Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[26], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[27], Венеры (0,002 %)[28], Луны[29], Марса (0,03 %)[30], Юпитера (0,0004 %)[31], Европы[32], Сатурна, Урана (следы)[33] и Нептуна[34] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10−5% в Антарктиде[35].
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b[36], HD 209458 b[37] и GJ 1214 b[38].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Биологическая роль
 Полный стакан с водой
Полный стакан с водойВода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Применение
В земледелииВыращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию, доходящих до 90 % в некоторых странах.
Для питья и приготовления пищи
Живое человеческое тело содержит от 50 % до 75 % воды[39], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды. Ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[40][41].
Как растворительВода является растворителем для многих веществ. Она используется для очистки как самого человека, так и различных объектов человеческой деятельности. Вода используется как растворитель в промышленности.
В качестве теплоносителя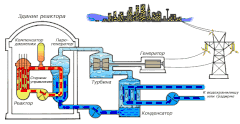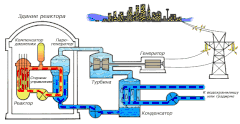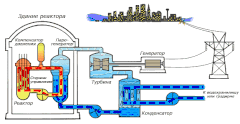 Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР) Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью. Теплота её испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку. В качестве теплоносителя воду используют в тепловых сетях, для передачи тепла по теплотрассам от производителей тепла к потребителям. Воду в виде льда используют для охлаждения в системах общественного питания, в медицине. Большинство атомных электростанций используют воду в качестве теплоносителя.
Как замедлительВо многих ядерных реакторах вода используется не только в качестве теплоносителя, но и замедлителя нейтронов для эффективного протекания цепной ядерной реакции. Также существуют тяжеловодные реакторы, в которых в качестве замедлителя используется тяжёлая вода.
Для ПожаротушенияВ пожаротушении вода зачастую используется не только как охлаждающая жидкость, но и для изоляции огня от воздуха в составе пены, так как горение поддерживается только при достаточном поступлении кислорода.
В спортеМногими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.
В качестве Инструмента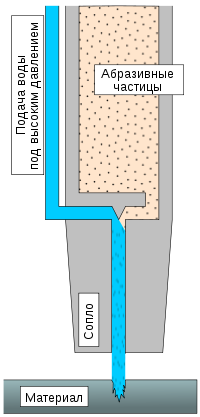
Вода используется как инструмент для разрыхления, раскалывания и даже резки пород и материалов. Она используется в добывающей промышленности, горном деле и в производстве. Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода, выходящая под давлением несколько тысяч атмосфер способна разрезать стальную пластину толщиной несколько миллиметров, или более при добавлении абразивных частиц.
Для смазкиВода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[42].
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В настоящее время установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад[43].
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Факты
 | Данный раздел имеет чрезмерный объём или содержит маловажные подробности. Если вы не согласны с этим, пожалуйста, покажите в тексте существенность излагаемого материала. В противном случае раздел может быть удалён. Подробности могут быть на странице обсуждения. |
- В среднем в организме растений и животных содержится более 50 % воды[44].
- В составе мантии Земли воды содержится в 10-12 раз больше, чем в Мировом океане[45].
- При средней глубине в 3,6 км Мировой океан покрывает около 71 % поверхности планеты и содержит 97,6 % известных мировых запасов свободной воды.[источник не указан 125 дней]
- Если бы на Земле не было впадин и выпуклостей, вода покрыла бы всю Землю слоем толщиной 3 км[46].
- При определённых условиях (внутри нанотрубок) молекулы воды образуют новое состояние, при котором они сохраняют способность течь даже при температурах, близких к абсолютному нулю[47].
- Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.[источник не указан 125 дней]
- Синий цвет чистой океанской воды в толстом слое объясняется избирательным поглощением и рассеянием света в воде.[источник не указан 125 дней]
- С помощью капель воды из кранов можно создать напряжение до 10 киловольт, опыт называется «Капельница Кельвина».[источник не указан 125 дней]
- Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма[48], висмут, галлий, германий и некоторые соединения и смеси).
- Вода и водяной пар горят в атмосфере фтора фиолетовым пламенем. Смеси водяного пара со фтором в пределах взрывчатых концентраций взрывоопасны. В результате этой реакции образуются фтороводород и элементарный кислород.[источник не указан 125 дней]
Примечания
- ↑ англ. International Union of Pure and Applied Chemistry. Nomenclature of Inorganic Chemistry. IUPAC RECOMMENDATIONS 2005. RSC Publishing, 2005. — p. 306.
- ↑ 1 2 Маленков Г. Г. Вода // Физическая энциклопедия. — М.: Советская энциклопедия, 1988. — Т. I. Ааронова — Бома эффект — Длинные линии. — С. 294—297.
- ↑ Петрушевский Ф. Ф., Гершун А. Л. Лед, в физике // Энциклопедический словарь — СПб.: Брокгауз—Ефрон, 1896. — Т. XVII. — С. 471–473.
- ↑ Henniker, J. C. (1949). «The Depth of the Surface Zone of a Liquid». Reviews of Modern Physics (Reviews of Modern Physics) 21 (2): 322–341. DOI:10.1103/RevModPhys.21.322.
- ↑ Pollack, Gerald. Water Science. University of Washington, Pollack Laboratory. — «Water has three phases – gas, liquid, and solid; but recent findings from our laboratory imply the presence of a surprisingly extensive fourth phase that occurs at interfaces.». Проверено 5 февраля 2011. Архивировано 15 февраля 2013 года.
- ↑ CIA- The world fact book. Central Intelligence Agency. Проверено 20 декабря 2008.
- ↑ 1 2 Marine Science: An Illustrated Guide to Science
- ↑ 1 2 Gleick, P.H. Water in Crisis: A Guide to the World's Freshwater Resources. — Oxford University Press, 1993.
- ↑ Water Vapor in the Climate System (англ.). American Geophysical Union. Проверено 13 февраля 2013. Архивировано 15 февраля 2013 года.
- ↑ Криволуцкий А. Е. Голубая планета. Земля среди планет. Географический аспект. — М.: Мысль, 1985. — С. 212.
- ↑ United Nations. Un.org (22 марта 2005). Проверено 25 июля 2010. Архивировано 15 февраля 2013 года.
- ↑ 1 2 Ларионов А. К. Занимательная гидрогеология. — Москва: Недра, 1979. — С. 5—12. — 157 с.
- ↑ 1 2 3 Петрянов И.В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ Physics of Ice (15 страница)
- ↑ Свойства воды. Физические свойства воды
- ↑ Основные физические свойства воды, водяного пара, льда, снега
- ↑ Коэффициенты поверхностного натяжения жидкостей
- ↑ Молекулярные преобразователи энергии в живой клетке (Тихонов А. Н., 1997)
- ↑ П. И. Воскресенский Техника лабораторных работ. 9-е изд. Л.: «Химия», 1970. С. 696—697
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 7. Атомы // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 15—18. — 240 с. — 1 630 000 экз.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Le Caër S. (2011). «Water Radiolysis: Influence of Oxide Surfaces on h3 Production under Ionizing Radiation». Water 3: 236.
- ↑ Вода на Луне: но откуда?
- ↑ NASA Space Assets Detect Ocean inside Saturn Moon. NASA (3 April 2014). Проверено 3 апреля 2014.
- ↑ (4 April 2014) «The Gravity Field and Interior Structure of Enceladus». Science (journal) 344: 78—80. DOI:10.1126/science.1250551. Проверено 3 April 2014.
- ↑ Solanki, S. K. (1994). «New Light on the Heart of Darkness of the Solar Chromosphere». Science 263 (5143): 64–66. DOI:10.1126/science.263.5143.64. PMID 17748350. Bibcode: 1994Sci...263...64S.
- ↑ MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere. Planetary Society (3 июля 2008). Проверено 5 июля 2008. Архивировано 17 января 2010 года.
- ↑ Bertaux, Jean-Loup (2007). «A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, h3O and HDO». Nature 450 (7170): 646–649. DOI:10.1038/nature05974. PMID 18046397. Bibcode: 2007Natur.450..646B.
- ↑ Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, and Gogulapati Supriya (2010). «'Direct' evidence for water in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I». Planetary and Space Science 58 (6). DOI:10.1016/j.pss.2010.02.013. Bibcode: 2010P&SS...58..947S.
- ↑ Donald Rapp. Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. — Springer, 28 November 2012. — P. 78–. — ISBN 978-3-642-32762-9.
- ↑ (2005) «Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes» (PDF). Space Science Reviews 116: 121–136. DOI:10.1007/s11214-005-1951-5. ISSN 0032-0633. Bibcode: 2005SSRv..116..121A.
- ↑ Hubble Sees Evidence of Water Vapor at Jupiter Moon. NASA (December 12, 2013). Проверено 12 декабря 2013.
- ↑ Encrenaz, 2003, p. 92.
- ↑ Hubbard, W. B. (1997). «Neptune's Deep Chemistry». Science 275 (5304): 1279–1280. DOI:10.1126/science.275.5304.1279. PMID 9064785.
- ↑ Земля (планета) — статья из Большой советской энциклопедии.
- ↑ Water Found on Distant Planet 12 July 2007 By Laura Blue, Time
- ↑ Water Found in Extrasolar Planet’s Atmosphere
- ↑ Атмосфера экзопланеты GJ 1214b переполнена водой. Компьюлента (24 февраля 2012). — «Новые наблюдения транзитов GJ 1214 b, удалённой от Земли на 40 световых лет, показали, что вода должна составлять не менее половины от всей массы атмосферы этой «суперземли»». Проверено 21 июля 2013. Архивировано 29 августа 2013 года.
- ↑ Watson, P. E. et al. (1980) Total body water volumes for adult males and females estimated from simple anthropometric measurements, The American Journal for Clinical Nutrition, Vol. 33, No 1, pp.27-39.
- ↑ Моргунова Г.С. Вода, которую мы пьём // Химия и жизнь. — 1965. — № 3. — С. 15—17.
- ↑ Sharma B.K. Water Pollution. — 1994. — P. 408—409.
- ↑ Воскресенский В. А., Дьяков В. И. Глава 2. Смазочные вещества и их физико-химические свойства // Расчет и проектирование опор скольжения (жидкостная смазка): Справочник. — М.: Машиностроение, 1980. — С. 15. — (Библиотека конструктора). — ISBN ББК 34.42, УДК 621.81.001.2 (031).
- ↑ Ученые: вода появилась в мантии Земли 2,7 млрд лет назад. ТАСС. Проверено 26 апреля 2016.
- ↑ Наука и техника. Книги. Загадки простой воды.
- ↑ Состав и природа мантии Земли
- ↑ Биосфера Земли
- ↑ Science Daily (англ.)
- ↑ Сурьма // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 235. — ISBN 5-7155-0292-6.
Литература
Ссылки
Справочные материалыwikiredia.ru
свойства, получение и применение :: SYL.ru
Введение
 Вы пришли в магазин, стремясь купить мыло без запаха. Естественно, для того чтобы понять, какие продукты из данного ассортимента имеют запах, а какие - нет, вы берете в руки каждую бутылочку с мылом и читаете его состав и свойства. Наконец выбрали подходящее, но во время просмотра различных составов мыла заметили странную тенденцию - практически на всех бутылочках было написано: "В структуру мыла входит гидроксид натрия". Такова стандартная история знакомства большинства людей с гидроксидом натрия. Какая-то половина людей "плюнет и забудет", а какая-то - захочет узнать о нем побольше. Вот для них я сегодня и расскажу, что это за вещество.
Вы пришли в магазин, стремясь купить мыло без запаха. Естественно, для того чтобы понять, какие продукты из данного ассортимента имеют запах, а какие - нет, вы берете в руки каждую бутылочку с мылом и читаете его состав и свойства. Наконец выбрали подходящее, но во время просмотра различных составов мыла заметили странную тенденцию - практически на всех бутылочках было написано: "В структуру мыла входит гидроксид натрия". Такова стандартная история знакомства большинства людей с гидроксидом натрия. Какая-то половина людей "плюнет и забудет", а какая-то - захочет узнать о нем побольше. Вот для них я сегодня и расскажу, что это за вещество.
Определение
Гидроксид натрия (формула NaOH) является самой распространенной в мире щелочью. Для справки: щелочь - это хорошо растворимое в воде основание.
Название
В разных источниках его могут обозвать гидратом окиси натрия, каустической содой, каустиком, едким натром или едкой щелочью. Хотя название "едкая щелочь" можно применить ко всем веществам этой группы. Только в XVIII веке им дали отдельные наименования. Также существует "перевернутое" название описываемого сейчас вещества - натрия гидроксид, обычно употребляемое в украинских переводах.
 Свойства
Свойства
Как я уже сказала, гидроксид натрия хорошо растворим в воде. Если положить даже небольшой его кусочек в стакан с водой, через несколько секунд он воспламенится и будет с шипением "носиться" и "прыгать" по ее поверхности (фото). И это будет продолжаться до тех пор, пока он полностью в ней не растворится. Если после завершения реакции вы опустите руку в получившийся раствор, то он будет мылким на ощупь. Чтобы узнать, насколько сильна щелочь, в нее опускают индикаторы - фенолфталеин или метилоранж. Фенолфталеин в ней приобретает малиновую окраску, а метилоранж - желтую. В гидроксиде натрия, как и во всех щелочах, присутствуют гидроксид-ионы. Чем больше их в растворе, тем ярче цвет индикаторов и сильнее щелочь.
Получение
Существует два пути получения гидроксида натрия: химический и электрохимический. Рассмотрим детальнее каждый из них.
- Химическим путем гидроксид натрия можно получить известковым и ферритным методами. Известковым способом он получается при взаимодействии раствора гидрокарбоната натрия и гидроксида кальция. Температура при данном процессе должна быть не ниже 80оС. Результат этой реакции - раствор гидроксида натрия и карбонат кальция. Последний можно легко отделить от раствора. Потом тот упаривают, чтобы получить расплавленный продукт, который содержит 92% гидроксида натрия. Затем последний плавят и после этого разливают по специальным формочкам, где происходит его застывание. Ферритный же способ заключается в спекании карбоната натрия и оксида железа (III). Продукт этой реакции - феррит натрия и газообразный оксид углерода (IV). Потом проводят выщелачивание данного феррита, при котором происходит получение раствора гидроксида натрия и осадка (оксид железа (III) * вода). Осадок достаточно легко отделить. А раствор упаривают, чтобы получить продукт, который содержит 92% гидроксида натрия. Потом он затвердевает и имеет вид хлопьев или гранул.
 Электрохимическим путем гидроксид натрия получают посредством электролиза раствора галита. Всего есть три способа такого пути получения: два из них (мембранный и диафрагменный) заключаются в использовании при электролизе твердого, а третий (ртутный) - жидкого ртутного катода. Подробнее о них вы можете узнать, изучая физику. А сейчас мы поговорим о роли гидроксида натрия в жизни человека.
Электрохимическим путем гидроксид натрия получают посредством электролиза раствора галита. Всего есть три способа такого пути получения: два из них (мембранный и диафрагменный) заключаются в использовании при электролизе твердого, а третий (ртутный) - жидкого ртутного катода. Подробнее о них вы можете узнать, изучая физику. А сейчас мы поговорим о роли гидроксида натрия в жизни человека.
Применение
Делигнификация целлюлозы, производство картона, бумаги, древесно-волоконных плит и искусственных волокон не обходятся без гидроксида натрия. А при его реакции с жирами получают мыло, шампуни и другие моющие средства. В химии он используется в качестве реагента или катализатора во многих реакциях. Еще гидроксид натрия известен как пищевая добавка Е524. И это еще не все отрасли его применения.
Заключение
Теперь вы знаете о гидроксиде натрия всё. Как видите, он приносит человеку очень большую пользу - как в промышленности, так и в быту.
www.syl.ru
Растворимость гидроксидов металлов в воде
Растворимость гидроксидов металлов в воде [c.115]Металлы, гидроксиды которых растворимы в воде, взаимодействуют с водой. При этом образуется гидроксид металла и водород. [c.148]
Гидролиз солей металлов. В большинстве случаев коагулянты представляют собой соли слабых оснований и сильных кислот. При растворении их в воде происходит гидролиз и образуются малорастворимые основания — гидроксиды алюминия или железа. При этом в результате смещения равновесия диссоциации в воде накапливаются ионы водорода и в растворе появляется кислота. Растворимость гидроксидов алюминия и железа чрезвычайно мала. Они выделяются из раствора, образуя сначала коллоидные частицы (разбавленные золи гидроксидов), которые иод влиянием электролитов, растворенных в воде, коагулируют и выпадают вместе с коллоидами, загрязняющими воду, в осадок. Этот осадок содержит связанную воду, а также несколько слоев молекул неструктурной воды, ад-сорбционно связанной с поверхностью осадка силами различной прочности [11]. [c.17]
Таким образом, амфотерными свойствами, т. е. способностью растворяться в растворах щелочи, могут обладать и многие гидроксиды металлов. Течение процесса в конечном итоге определяется растворимостью веществ и прочностью связей ионов металла с водой, так в заметной мере растворимы в растворах щелочей [c.258]Поскольку вода всегда содержит ионы гидроксония НдО , она должна действовать на металлы подобно кислотам. Но концентрация этих ионов в чистой воде очень мала. Поэтому водород из воды вытесняют наиболее активные металлы и лишь при условии образования растворимых гидроксидов (металлы IA- и ПА-групп). [c.240]
Хорошо растворимые в воде сульфиды щелочных и щелочноземельных металлов в виде гидратов получают взаимодействием гидроксидов металлов с h3S. [c.599]
Из уравнения (1.26) следует, что значения pH при обработке воды коагулянтами понижаются с увеличением их дозы, поскольку это приводит к повышению активности катионов алюминия и железа. Присутствие посторонних ионов в растворе изменяет его ионную силу и приводит к изменению +. С уменьшением растворимости гидроксидов металла и повышением ионного произведения воды значение pH понижается. [c.29]
Таким образом, наиболее полно удаляются из воды плохо растворимые красители (иапример, дисперсные) и красители (преимущественно диазо-), образующие в водных растворах крупные агрегаты. Для удаления последних целесообразно обработку воды коагулянтами проводить при относительно высоких концентрациях красителей, т. е. перед другими стадиями очистки, когда образование собственной твердой фазы красителя происходит одновременно с коагуляцией гидроксидов металлов. [c.27]
Основания тоже разделяются по своей силе, но немного не гак, как кислоты. Поскольку практически все гидроксиды металлов представляют собой в индивидуальном состоянии твердые кристаллические вещества, построенные из ионов металлов и гидроксид-ионов, то степень их диссоциации всегда велика, даже для малорастворимых оснований. Поэтому нельзя рассматривать степень диссоциации как критерий дпя оценки силы основания, но можно дпя этих целей воспользоваться растворимостью. Чем выше растворимость основания в воде, тем оно сильнее. Итак, [c.126]
Растворимость одного вещества в другом — свойство, присущее всем веществам. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя. Даже при чрезвычайно малой растворимости одного вещества в другом всегда имеет место переход веществ через поверхность их контакта. Любой металл растворяется в воде, однако растворимость в ряду металлов изменяется в очень широких пределах. Например, щелочные металлы бурно взаимодействуют с водой, при этом выделяется из воды водород и в растворе образуются гидроксиды металлов. Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается так называемая серебряная вода . Таким образом, одни металлы активно растворяются в воде, другие — крайне мало. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает отрасль химической науки — электрохимия. [c.257]
В основу разделения оксидов на кислотные и основные (см. гл. II, 1) были положены свойства образуемых ими гидроксидов. Кислотным и основным оксидам соответствуют гидроксиды, относящиеся к классу кислот или оснований. Кислоты представляют собой гидроксиды неметаллов, в то время как основания являются гидроксидами металлов. Следует отметить, что растворимость в воде характерна только для оксидов наиболее типичных металлов и неметаллов. Оксиды остальных элементов-в воде, как правило, нерастворимы. Однако любому солеобразующему оксиду соответствует гидроксид. [c.133]
Химически довольно активны. На воздухе окисляются, образуя окислы основного характера состава ЭО. Взаимодействуя с водой, дают основания состава Э (0Н)2, например М (0Н)2, Са(6Н)2 и т. д., менее растворимые в воде, чем гидроксиды щелочных металлов. Растворимость гидроксидов возрастает в подгруппе от бериллия к радию. В такой же последовательности изменяются основной характер и химическая активность гидроксид бериллия амфотерен, гидроксид бария — сильное основание. [c.411]
Растворимость гидроксида лития в воде 11%, намного меньше, чем гидроксидов других щелочных металлов (более 50%). [c.134]
Элюирование растворами кислот. Этот метод применяют при образовании в хроматограмме гидроксидов металлов или малорастворимых соединений с анионами слабых кислот (фосфатов, карбонатов, фторидов некоторых металлов, солей с анионами органических кислот и др.). Поскольку в результате растворения М А , НгА и других соединений образуется одна и та же слабая кислота Н А (или вода при растворении гидроксидов), то относительная концентрация М ", и других ионов на выходе из колонки будет определяться соотношениями ПР малорастворимых соединений в соответствии с уравнением (189). Оптимальную концентрацию кислоты рассчитать нельзя, так как неизвестна активная концентрация осадителя в фазе сорбента. Поэтому концентрацию кислоты, обеспечивающую избирательное извлечение из колонки наиболее растворимого соединения или последовательное растворение осадков в хроматограмме, находят экспериментально. [c.239]
В решетках кристаллов гидроксидов щелочных металлов имеется ион ОН , т. е. эти решетки являются ионными и растворение гидроксида в воде, в сущности, сводится к разделению ионов металла и ОН и их последующей гидратации без образования каких-либо новых частиц (т. е. продуктов гидролиза). Типичными свойствами указанных оксидов является резко выраженный основный характер (способность, реагируя с водой, образовать растворимые щелочные гидроксиды, а с кислотами — соли), высокая температура плавления, большая теплота образования. Все они кристаллизуются в кубической системе, образуя кристаллы с ионными связями. [c.287]
Растворимость. Гидроксиды щелочных металлов, металлов главной подгруппы второй группы, начиная с кальция, гидроксид таллия (I) [ТЮН] и гидроксид аммония растворимы в воде. Гидроксиды других металлов в воде практически нерастворимы. [c.25]
В качестве амфотерных электролитов хорощо известны много- исленные гидроксиды сравнительно малоактивных металлов — бериллия, алюминия, цинка, галлия и др. Двойственная пэнрода амфотерных гидроксидов связана с тем, что онн диссоциируют как по типу основания, так и по типу кислоты. Такие гидроксиды являются соединениями ковалентной природы, мало растворимы а воде. В той мере, в какой они растворимы, гидроксиды ведут себя как потенциальные электролиты, т, е. их ионизация происходит лишь иод действием воды. Приняв условно формулу гидроксида Ме (ОН) у, рассмотрим, как будет происходить его ионизация по двум направлениям— основному I) и кислотному 2) [c.182]
Для очистки промышленных сточных вод, содержащих высокоустойчивые загрязнения, проводят электролиз с использованием растворимых стальных или алюминиевых анодов. Под действием тока происходит растворение металла, в результате чего в воду переходят катионы железа или алюминия, которые встречаясь с гидроксидными группами, образуют гидроксиды металлов в виде хлопьев. Наступает интенсивная коагуляция. [c.97]
За исключением довольно хорошо растворимых в воде гидроксидов щелочных металлов (и Т1 ) и гораздо менее растворимых соединений щелочноземельных металлов, большинство гидроксидов металлов почти или совсем нерастворимы в воде. Некоторые из них, например Ве(0Н)2, А1(0Н)з и 2п(ОН)2,. осаждаются гидроксидом натрия в виде гелеобразной массы и растворяются в избытке щелочи, в то время как другие, такие, как Си (ОН) 2 и Сг(ОН)з, после растворения в избытке щелочи при хранении снова выпадают в осадок. Такие гидроксиды, которые растворяются не только в кислотах, но и в щелочах, называют амфотерными, причем растворимость в щелочах считается проявлением кислотных свойств. На самом деле в некоторых случаях растворимость является следствием образования гидроксо-ионов, которые могут быть одноядерными, например, [c.351]
Низкая степень пересыщения может быть достигнута и в отсутствие гидроксидов металлов [2446]. Кристалл кварца размалывали до получения частиц размером менее 6 мкм и встряхивали затем порошок в морской воде при концентрации солей 0,5 % и температуре 20°С в течение почти 3 лет. За это время концентрация растворенного кремнезема установилась на уровне 0,00044 + 0,00003 % и произошло образование новых кристаллов кварца микронных размеров. В морской воде никакого пересыщения кремнезема не наблюдалось. Концентрация растворимого кремнезема возрастала до 0,0003 °/о в течение одного месяца и до 0,00044 % за один год при поддержании постоянным pH 8,1. Было сделано предположение, что кремнезем не осаждался на уже имеющихся поверхностях кварца, поскольку они были покрыты органическими или неорганическими загрязнениями, например оксидом железа. Присутствие следов железа или алюминия в системе могло бы также разъяснить вопрос, почему наблюдаемая растворимость до некоторой степени ниже значения 0,00095 %, которое следует ожидать при экстраполяции данных Ван Лира до 20" С (см. рис. 1.4). Как было показано [37, 38], присутствие следов оксида алюминия понижает равновесную растворимость кремнезема. [c.111]
Образование солей. Сульфокислоты подобно серной кислоте принадлежат к сильным кислотам и образуют соли с гидроксидами металлов. В отличие от соответствующих сульфатов, сульфонаты кальция, бария и свинца (И) хорошо растворимы в воде. [c.478]
Химические свойства. Лантаноиды следуют в таблице за щелочноземельными металлами, в трехвалентном состоянии образуют оксиды, гидроксиды, различные простые, двойные и комплексные соли. Основность оксидов (и гидроксидов) увеличивается с увеличением атомного номера, а растворимость гидроксидов уменьшается, т. е. снижается тенденция к отрыву протона от воды с образованием растворимого аква-иоиа. [c.294]
Ионы элементов подгруппы имеют электронную конфигурацию благородных газов, невелики по размерам, двухзарядны, поэтому их гидроксиды в точном соответствии со схемой Косселя (см. рисунок в начале раздела 5) являются более слабыми основаниями, чем гидроксиды щелочных металлов (щелочи). Рост радиусов ионов приводит к тому, что Ве (0Н)2 — амфотерное основание, Ме (ОН)з — слабое основание, Са (ОН)з (гашеная известь) — сильное основание, а Ва (0Н)2 — почти щелочь. Растворимость гидроксидов в воде растет в этом ряду. Почти все соли щелочно-земельных элементов хорошо растворимы в воде, кроме сульфатов, фосфатов, хроматов, оксалатов (солей щавелевой кислоты Н2С2О4) и карбонатов. [c.136]
Элементы главной подгруппы И группы относятся к s-элементам и обладают (кроме бериллия) ярко выраженными металлическими свойствами, уступая в этом отношении только щелочным металлам. Основной характер элементов усиливается от бериллия к радию вследствие последовательного увеличения радиусов их атомов и ионов и ослабления сил связи между валентными электронами и ядром, поэтому барий, в отличие от кальция, бурно взаимодействует с водой. В той же последовательности происходит повышение растворимости гидроксидов в воде. Так, растворимость Э(ОН)г при 20°С увеличивается от Mg(0H)2 (83-10- моль1л) к Ва(ОН)г (2,8-10 моль/л). Гидроксиды бария Ва(ОН)г и радия Ra(0H)2 — самые сильные основания и хорошо диссоциируют в водных растворах [c.419]
Гидроксиды. Соединения щелочных металлов МОН — твердые бесцветные, очень гигроскопичные вещества, хорошо растворяются в воде, при этом выделяется большое количество теплоты. Растворимость гидроксидов в ряду LiOH— sOH повышается. В водных растворах они диссоциируют почти нацело, являются самыми сильными основаниями и носят название едких щелочей. По подгруппе щелочных металлов сверху вниз основные свойства щелочей увеличиваются. [c.255]
В соответствии со значениями электродных потенциалов (см. табл. 37) цинк и кадмий взаимодействуют с водой и разбавленными растворами обычных кислот с выделением водорода, а ртуть не взаимодействует. Однако вследствие образования па поверхности цинка и кадмия нерастворимой гидроксидной пленки их взаимодействие с водой быстро прекращается. С азотной кислотой, как концентрированной, так и разбавленной, взаимодействуют все три металла с образованием соответствуюищх нитратов и нродуктов восстановления азота концентрированная серная кислота (содержащая больше 50% h3SO4) при нагревании действует так же на все три металла, как окислитель. В связи с растворимостью гидроксида цинка в водных растворах сильных щелочей с последними цинк взаимодействует с врлделением водорода. [c.330]
Воздействие на иефтеводяную эмульсию электрическим полем вызывает коагуляцию частиц дисперсной фазы (капли нефтепродуктов) и, как следствие этого, их коалесценщ1ю. При использовании растворимых электродов образуется гидроксид металла анода, способный адсорбировать на своей поверхности эмульгированные нефтепродукты. Таким образом, метод электрообраиотки открывает новые возможности для глубокой очистки судовых нефтесодержащих вод. [c.91]
Щелочи — хорошо растворимые в воде основания, создающие в водном растворе высокую концентрацию гидроксиД-ионов (0Н ). К Щ. относятся гидроксиды металлов главных подгрупп I и П группы периодич. системы Д. И. Менделеева (кроме Be(OH)-2-Mg(OH)2). Гидроксиды щелочных металлов, как LiOH, NaOH, КОН, являются самыми сильными основаниями и называются едкими щелочами. Гидроксиды щелочноземельных металлов — Са(ОН)г, 5г(0Н)г, Ва(ОН)г, Ra(OH)a— более слабые основания. Щ.— твердые, белые гигроскопические вещества. При их растворении выделяется большое количество теплоты. Растворы Ш,. окрашивают лакмус в синий цвет, фенолфталеин — в малиново-красный. Щ. разъедают ткани, особенно животные. Щ. широко приме11Я10т в различных отраслях промышленности. См. Натрия гидроксид. Калия гидроксид. [c.155]
Гидроксиды содержат атом элемента и связанные с ним гидроксильные группы ОН. Гидроксильная группа ОН одновалентна. Гидроксиды металлов называют основаниями. Растворимые в воде основания называют щелочами. Чем ярче выражены металлические свойства элемента, тем выше основные свойства его гидроксида. Чем ярче выражены неметаллические свойства элемента, тем сильнее выражены кислотные свойства его гидроксида. [c.14]
Немаловажное значение имеет правильное промывание осадка. Если он имеет достаточно низкую растворимость, для промывания применяют дистиллированную воду. Исключения составляют легко пептизирующиеся осадки (сульфиды и гидроксиды металлов, бромид и иодид серебра и др.), которые промывают раствором электролита, например нитрата или хлорида аммония. Ионы электролита предотвращают пептизацию и, кроме того, в адсорбционном слое кристаллов замещают ионы других нелетучих электролитов. Сами аммонийные соли при прокаливании осадка улетучиваются. [c.142]
В воде хорошо растворимы только гидроксиды ш,елочных металлов, за исключением LiOH, который близок к умерен но растворимым гидроксидам ш,елочно-земельных металлов [c.42]
Для титана известны ортотитановая кислота- Н4ТЮ4 (амфотерный гидроксид титана Ti(OH)4) и метатитановая- Н2ТЮ3, химически более инертная. Титановые кислоты очень слабые, поэтому их соли (титанаты), как и другие растворимые соли металлов IVB и VB подгрупп, сильно гидролизованы. При неполном гидролизе растворимых в воде соединений образуются соли, содержащие группировку (МеО) , например, (TiO)" - титанил-ион, (VO) - ванадил-ион. [c.36]
Напишите уравнения реакций полу11ения оксида магния и его растворения в воде. Отметьте слабую растворимость гидроксида магния в воде (1 10 моль/л) по сравнению с гидроксидами щелочных металлов, [c.217]
Гидроксиды металлов Ш-подгруппы получают действием на их соли растворов ш,елочей. Известны сульфиды этих металлов типа 3jS и 3S (у золота также AuaSa). Галогениды серебра (за исключением AgF) мало растворимы в воде и используются в качестве светочувствительных материалов. [c.435]
Такая запись получила название краткого ионного уравнения или просто ионного уравнения. В нем записывают только те ионы, которые действительно принимают участие в реакции. Для написания ионных уравнений надо знать, растворимы ли в воде вещества, которые участвуют в реакции и образуются в результате реакции. Для решения эюго вопроса можно пользоваться таблицей растворимости кислот, солей и оснований в воде. Целесообразно отметить, что все соли натрия и калия, а также нитраты и большинство ацетатов хорошо растворимы в воде. Гидроксиды всех металлов, кроме металлов главной подгруппы 1 группы и некоторых металлов главной подгруппы II группы периодической системы, нерастворимы в воде. [c.230]
Соединения элементов подгруппы НА. Оксиды ЭО — белые, очень тугоплавкие вещества. Присоединяя воду, они образуют белые гидроксиды Э(0Н)2. Энергия гидратации увеличивается от ВеО к ВаО (от 14 до 103 кДж/моль), а растворимость гидроксидов увеличивается от 8-10- до 2-10 1 моль/л при 20° С. Основной характер быстро усиливается в том же ряду. Для щелочноземельных металлов известны пероксиды типа ЭО2. Пероксид бария получают нагреванием ВаО в токе воздуха до 600° С. При нагревании Ва02 выше 800 С он вновь разлагается на оксид бария и кислород. [c.342]
Кремнезем как в растворимой, так и в коллоидной форме может быть удален из воды варьированием низких уровней концентраций в нейтральном или в слабощелочном растворе методом соосаждения с нерастворимыми гидроксидами металлов in situ или в результате адсорбции на свежеобразованных гидроксидах, добавляемых в воду. [c.112]
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например, NaOH Mg (0Н>2 А1(0Н)з. Число гидроксогрупп в молекуле основания, определяющее его кислотность, равно валентности металла. Например, КОН — однокислотное основание, Fe(0H)2 — двухкислотное основание. Большинство оснований не растворимо в воде. Растворимы гидроксиды щелочных, щелочноземельных металлов и гидроксид аммония. Растворимые в воде основания, проявляющие кроме того свойства сильных электролитов, называют щелочами. [c.199]
При сгорании на воздухе литий окисляется до Ь аО, натрий до КааО и частично КааОа, калий — до КОд и КОд. Пероксидные соединения с высоким содержанием кислорода неустойчивы и легко отдают избыточный кислород. При растворении в воде металлов и их оксидов образуются хорошо растворимые гидроксиды, называемые щелочами. Все щелочи — устойчивые соединения, плавящиеся без разложения. Щелочи широко используют в виде растворов в гидрометаллургии для выщелачивания кислых и амфотерных оксидов и их производных, а в твердом виде для спекания с различными оксидами или солями с целью перевода их в растворимое состояние. Классическим примером является выщелачивание природного боксита при производстве глинозема по методу Байера (подробности см. в разделе 2.3) [c.132]
Вещество № 6 ие растворяется в воде. При действии кислоты НС1 выделяет сероводород, следовательно, данное вещество — сульфид. Из солянокислого раствора вещества № 6 при действии щелочи выпадает белый осадок, растворимый в избытке раствора щелочи (что указывает на амфотериость гидроксида металла) и в растворе аммиака. Из указанных в условии задачи катионов такой гидроксид может образовывать Zп +. Следовательно, вещество № 6 — сульфид циика ZnS. [c.166]
chem21.info


![K_{b}={\frac {[{\mathsf {NH_{4}^{+}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {NH_{3}}}]}}=1{,}79\cdot 10^{{-5}};](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/3a84df26045c54cf2f49c317887b42b68713f776)

 NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}}
NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}} 2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}}
2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}} h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}}
h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}} HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}}
HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}} 2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}
2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}



 h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}}
h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}} (при низких температурах) 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}}
(при низких температурах) 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}} 9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}
9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}

 h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
 в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.}
в основном состоянии: (1a1)1(1b2)2(1b1)2(2b2)0(3a1)0.{\displaystyle (1a_{1})^{1}(1b_{2})^{2}(1b_{1})^{2}(2b_{2})^{0}(3a_{1})^{0}.} Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}}
Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО ϕi{\displaystyle \phi _{i}} , один со спином α{\displaystyle \alpha }
, один со спином α{\displaystyle \alpha } , другой со спином β{\displaystyle \beta }
, другой со спином β{\displaystyle \beta } , или 8 спин-орбиталей ψ{\displaystyle \psi }
, или 8 спин-орбиталей ψ{\displaystyle \psi } . Волновая функция молекулы, Ψ{\displaystyle \Psi }
. Волновая функция молекулы, Ψ{\displaystyle \Psi } , представленная единственным детерминантом Слэтера Ф, имеет вид
, представленная единственным детерминантом Слэтера Ф, имеет вид 



















