Этиленгликоль (стр. 1 из 2). Вода этиленгликоль
Этиленгликоль
Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра ТООНС
Контрольная работа по курсу:
«Основы технологии органического синтеза»
на тему:
Этиленгликоль
Казань
2007
Содержание:
Введение
Физические свойства
Химические свойства
Способы получения этиленгликол
Технологическая схема получения этиленгликоля гидратацией окиси этилена
Технологическая схема совместного получения этиленгликоля и окиси этилена в стационарном слое катализатора
Применение этиленгликоля
Список литературы
Введение
Этиленгликоль — простейший двухатомный спирт ряда гликолей, впервые синтезированный Вюрцем в 1859 г. В промышленных масштабах эти-ленгликоль начали получать в Германии в период первой мировой войны. В настоящее время этиленгликоль (а также диэтиленгликоль и полиэтиленгликоли) вырабатывают в очень больших количествах и используют в различных отраслях народного хозяйства.
Будучи весьма гигроскопичным, этиленгликоль в то же время хорошо растворяет смолы, красители и некоторые вещества растительного происхождения. Благодаря сочетанию этих свойств этиленгликоль применяется при крашении тканей, в ситцепечатании, для приготовления штемпельных красок и косметических препаратов, для увлажнения табака и т. д. Этиленгликоль является также важным полупродуктом в производстве синтетических смол, растворителей, взрывчатых веществ и пр.
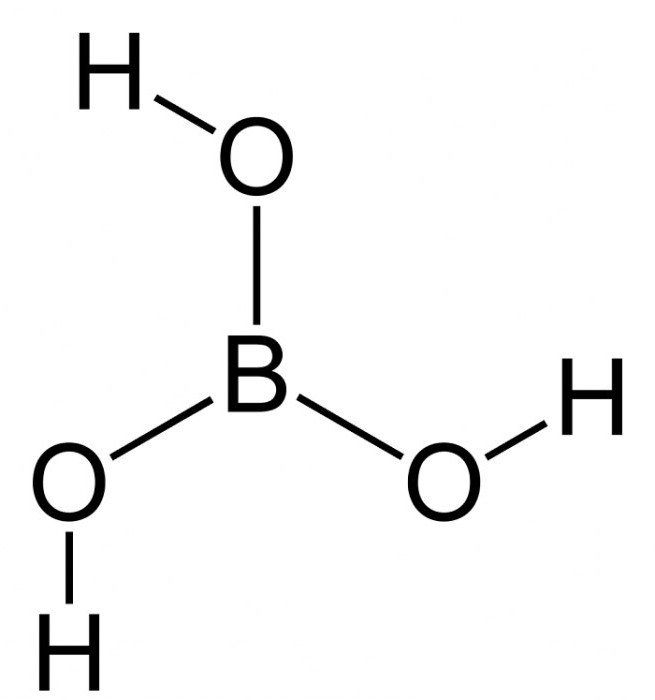
Состав этиленгликоля: С2 Н6 О2 .
Структурная формула:
Н Н
׀ ׀
Н – С – С - Н
׀ ׀
ОН НО
Физические свойства
Этиленгликоль СН2 ОН—СН2 ОН — вязкая бесцветная жидкость со слабым запахом и сладким вкусом. Температура кипения 197° С. Температуры кипения гликолей значительно выше температуры кипения спиртов, что является следствием усиления ассоциации молекул (образования водородных связей) из-за наличия в гликолях двух гидроксильных групп. Температура плавления —11,5° С. Плотность 1,11г/см3 ; теплота парообразования 191 ккал/кг. Смешивается во всех отношениях с водой, глицерином, одноатомными алифатическими спиртами, ацетоном, ледяной уксусной кислотой, пиридином и фурфуролом; не смешивается с бензолом, ксилолом, толуолом, хлорбензолом, хлороформом, четыреххлористым углеродом. Этиленгликоль обладает токсическим действием, сходным с действием метилового спирта.
Этиленгликоль сравнительно устойчив при высокой температуре — не разлагается при пропускании над пемзой, нагретой до 400°С. Разложение гликоля начинается при 500 - 520°С, а при 550°С происходит уже со значительной скоростью; но даже при этой температуре до 36% этиленгликоля не подвергается разложению.
Важным свойством этиленгликоля является его способность сильно понижать температуру замерзания воды. Водный раствор, содержащий 40 объемных % этиленгликоля, замерзает при —25°С, а 60%-ный водный раствор при — 40°С. Поэтому этиленгликоль с успехом применяется для приготовления антифризов.
Химические свойства
Химические свойства этиленгликоля, как и других гликолей аналогичны свойствам одноатомных спиртов. Однако у гликолей могут вступать в реакции как одна, так и обе гидроксильные группы.
1. С щелочными металлами гликоли образуют полный и неполный гликоляты: Ch3 ONa — Ch3 ONa, Ch3 OH — Ch3 ONa.
Гликоляты образуются не только со щелочными металлами, но и с оксидами некоторых других металлов, например с гидроксидом меди. При действии щелочи на сульфат меди (II) образуется голубой осадок гидроксида меди (II). Этот осадок не растворяется в спирте, но очень легко на холоде растворяется в гликоле вследствие образования комплексного гликолята меди:
Н
׀

 СН2 ОН СН2 - О О – СН2
СН2 ОН СН2 - О О – СН2 2 ׀ + Cu (OH)2 →׀Cu׀ + 2 h3 O
2 ׀ + Cu (OH)2 →׀Cu׀ + 2 h3 O  СН2 ОН СН2 - О О – СН2
СН2 ОН СН2 - О О – СН2 ׀
Н
2. С минеральными и органическими кислотами получаются полные и неполные эфиры. Например, в приведенной реакции образуются неполный и полный эфиры этиленгликоля и азотной кислоты — нитраты:
СН2 ONO2

 СН2 ОН +НОNO2 Н2 О + ׀
СН2 ОН +НОNO2 Н2 О + ׀  _ СН2 OH
_ СН2 OH +2HONO2 СН2 ONO2
 СН2 ОН 2Н2 О + ׀
СН2 ОН 2Н2 О + ׀ СН2 ONO2
Соответственно можно получить полные и неполные простые эфиры, например диэтиловый эфир этилен гликоля C2 Н5 ОСН2 – СН2 ОС2 Н5 и моноэтиловый эфир СН2 ОН — СН2 ОС2 Н5 . Последний под названием этилцеллозольв применяется как растворитель в производстве нитролаков, бездымного пороха (пироксилина), ацетатного шелка и других производных целлюлозы.
С двуосновными кислотами этиленгликоль ступает реакцию поликонденсации, образуя высокомолекулярные полиэфиры



 HO – C = OOO
HO – C = OOO Н2 С – ОН ׀ ׀׀ ׀׀
n ׀ + n R → – OCh3 – Ch3 – O – C – R – C – + 2n h3 O
Н2 С – ОН ׀

 HO – C = On
HO – C = On 3. Окисление гликолей проходит сложно, ступенчато:
О
׀׀
О СН2 OH – СООН → НООС – С - Н

 СН2 ОН ׀׀ ↓
СН2 ОН ׀׀ ↓ 
 ׀ → С О О СООН
׀ → С О О СООН СН2 ОН ׀ Н ׀׀ ׀׀ ׀
 СН2 OH С - С СООН
СН2 OH С - С СООН ׀׀
ֽ ֽ
4. Отщепление воды от этиленгликоля может иметь внутримолекулярный и межмолекулярный характер. Направление отщепления воды зависит от условий реакции. Пример внутримолекулярного выделения воды:
СН2 ОН - СН2 ОН → [СН2 = СНОН] → СН3 – СНО
Межмолекулярное выделение воды приводит к образованию оксиэфиров (спиртоэфиров) или циклических простых эфиров:
СН2 – СН2
СН2 ОН НО – СН2 СН2 – О – СН2 ׀ ׀
׀ + ׀ → ׀ ׀ → О О
СН2 ОН СН2 ОН СН2 ОН СН2 ОН ׀׀
СН2 – СН2
При межмолекулярной дегидратации этиленгликоля могут быть получены зависимости от условий диэтиленгликоль или диоксан:
СН2 – СН2
׀ ׀
2НОСН2 – СН2 ОН → НОСН2 – СН2 –О-СН2 – СН2 ОН → О О
׀ ׀
СН2 – СН2
Способы получения этиленгликоля
В промышленном масштабе этиленгликоль получают главным образом гидратацией окиси этилена:


 Н2 С – СН2+Н2О СН2 ОН – СН2 ОН
Н2 С – СН2+Н2О СН2 ОН – СН2 ОН О
При гидратации окиси этилена, кроме этиленгликоля, образуются ди-, три-, тетра- и полиэтиленгликоли. Чтобы уменьшить образование полигликолей, гидратацию проводят с большим избытком воды (на 1 моль окиси этилена берут от 10 до 22 моль воды) и добавляют к водному раствору окиси этилена 0,1—0,5% кислоты. В этих условиях получается этиленгликоль, содержащий лишь немного диэтиленгликоля и следы высших полиэтиленгликолей.
Процесс проводят в жидкой фазе в присутствии катализаторов (небольшое количество кислоты — серной, фосфорной или щавелевой) при 50—100°С и атмосферном давлении или без катализатора — при 10 ат и 190—200° С.
Гидратацию окиси этилена при атмосферном давлении можно проводить, обрабатывая раствором кислоты контактные газы процесса прямого окисления этилена. Получаемый разбавленный раствор этиленгликоля нейтрализуют, отгоняют большую часть воды и далее фракционной перегонкой удаляют остатки воды и высшие гликоли.
В отсутствие катализаторов гидратацию окиси этилена проводят обычно под давлением 10 ат. при мольном соотношении окиси этилена и воды примерно 1 : 16; продолжительность контакта 30 мин. Раствор гликолей упаривают в многокорпусном выпарном аппарате до содержания воды около 15% и далее подвергают ректификации. Соковый пар из последнего аппарата конденсируют и конденсат, содержащий 0,5—1,0% этиленгликоля, возвращают на гидратацию свежей окиси этилена. На 1 т этиленгликоля получается примерно 120 кг диэтиленгликоля и 30 кг триэтилен- гликоля.
Общий выход гликолей (считая на окись этилена) при получении их методом гидратации превышает 90%.
mirznanii.com
Теплоноситель для систем отопления - вода, этиленгликоль, теплый дом 65, dixis
Чтобы система отопления частного дома работала стабильно и не приносила дополнительных хлопот, необходимо использовать качественное отопительное оборудование и радиаторы.
Не стоит упускать из виду и жидкость, которая будет осуществлять теплообмен между несколькими теплоносителями системы. Любая система отопления работает по одному принципу: имеется нагревательный элемент, теплоноситель и радиаторы отопления, теплоноситель забирает тепло от нагревательного элемента и переносит его к радиаторам. Параметры теплоносителя системы отопления напрямую влияют на эффективность и долговечность всей системы.
Оглавление
Виды теплоносителей для системы отопления
Для начала стоит разобраться в том, какие требования предъявляются к теплоносителям. Есть три основных: инертность по отношению к материалам системы отопления, включая различные уплотнения; высокая теплоемкость при высокой теплопередаче; приемлемая вязкость. Если предполагается, что система может быть отключена на долгое время без обогрева, следует учитывать также температуру замерзания теплоносителя.
Вода
Самым простым и дешевым способом обеспечить перенос тепла является вода. На долю воды приходиться порядка 70% всех используемых теплоносителей. В целом вода является отличным вариантом, кроме того, она не токсична. Но и вода не лишена своих недостатков, к которым можно отнести повышенную коррозийную активность при соприкосновении с металлом и образование накипи на стенках теплообменника. Плюсы такого теплоносителя – сравнительная простота и дешевизна, тем более что так называемых присадок-ингибиторов на полках магазинов сегодня предостаточно. Использование присадок позволяет в разы уменьшить негативное воздействие воды, сделав ее инертной, тем самым повысив срок службы отопительного оборудования.
Антифризы
 Использование антифриза – удовольствие недешевое, поэтому следует подумать, необходимы ли такие меры. Если в здании часто случаются перебои с энергоносителями, из-за чего в морозы система отопления может быть отключена на несколько дней, то антифриз нужен. К примеру, можно взять теплоноситель теплый дом 65 и разбавить его до нужной концентрации. Если заливать даже подготовленную воду, все равно есть риск вывести из строя всю систему отопления, и виновата в этом физика.
Использование антифриза – удовольствие недешевое, поэтому следует подумать, необходимы ли такие меры. Если в здании часто случаются перебои с энергоносителями, из-за чего в морозы система отопления может быть отключена на несколько дней, то антифриз нужен. К примеру, можно взять теплоноситель теплый дом 65 и разбавить его до нужной концентрации. Если заливать даже подготовленную воду, все равно есть риск вывести из строя всю систему отопления, и виновата в этом физика.
При замерзании образующийся лед имеет больший объем, при этом силу и масштабы его разрастания не стоит недооценивать, поскольку замерзшая вода способна разорвать даже толстостенную стальную трубу, не говоря уже о пластике.
 Часто встречаются советы по поводу заливки в систему отопления добавок в виде этилового спирта, но стоит знать, что этиловый спирт, этанол, этилен, этиленгликоль – это четыре разных вещества с разными физическими и химическими свойствами.
Часто встречаются советы по поводу заливки в систему отопления добавок в виде этилового спирта, но стоит знать, что этиловый спирт, этанол, этилен, этиленгликоль – это четыре разных вещества с разными физическими и химическими свойствами.
Лучше всего будет воспользоваться сертифицированным антифризом, к большинству систем подойдеттеплоноситель dixis 65. Он соответствует требованиям, предъявляемым к использованию в жилых помещениях, то есть пожаробезопасен и инертен по отношению к элементам системы отопления. Как правило, основой для всех антифризов служит либо пропиленгликоль, либо этиленгликоль, также отличия идут по набору присадок и температуре кристаллизации.
Выбор теплоносителя по типу системы отопления
Если вы спросите, может ли при использовании этиленгликоля быть безопасным теплообмен между несколькими теплоносителями, ответ однозначен – нет. Любое повреждение стенки обменников может привести к очень печальным последствиям, поэтому этиленгликоль нежелательно использовать в двухконтурных котлах. В отличие от воды, применение этого вещества в системах с расширительными баками открытого типа запрещено. Дело в том, что этиленгликоль имеет класс опасности 3 и крайне нежелателен для попадания внутрь организма человека. Он не источает никакого запаха и сладковатый по вкусу, поэтому опасен при протечках, особенно если в доме есть дети или животные.
 В зависимости от концентрации этиленгликоля температура замерзания может находиться на отметках от -35 до -65 градусов, при этом он обладает отличными теплофизическими свойствами и недорогой ценой. На данный момент большинство антифризов на рынке мира сделаны на базе этиленгликоля. Есть умельцы, которые ищут,как получить из этилена этиленгликоль – это довольно просто при окислении первого перманганатом калия, но купить готовый антифриз будет намного дешевле. Тем более что для реакции следует просчитать также правильное количество компонентов.
В зависимости от концентрации этиленгликоля температура замерзания может находиться на отметках от -35 до -65 градусов, при этом он обладает отличными теплофизическими свойствами и недорогой ценой. На данный момент большинство антифризов на рынке мира сделаны на базе этиленгликоля. Есть умельцы, которые ищут,как получить из этилена этиленгликоль – это довольно просто при окислении первого перманганатом калия, но купить готовый антифриз будет намного дешевле. Тем более что для реакции следует просчитать также правильное количество компонентов.
 Пожалуй, единственный минус этиленгликоля – его токсичность – отсутствует у пропиленгликоля. Теплоноситель пропиленгликоль абсолютно нетоксичен, поэтому разрешен к эксплуатации во всех странах мира, в отдельных случаях его можно даже увидеть в составе пищевых продуктов под индексом Е1520. Также пропиленгликоль имеет очень низкую температуру кристаллизации, около -40 градусов. Одним из подобных представителей на отечественном рынке является Гольфстрим теплоноситель, который изготавливается на основе пропиленгликоля и глицерина. Но все преимущества, такие как экологическая безопасность, отличные физические характеристики и очень низкая точка замерзания, перекрывает высокая цена пропиленгликоля. Этот немаловажный фактор очень сильно сузил применение вещества в качестве теплоносителя.
Пожалуй, единственный минус этиленгликоля – его токсичность – отсутствует у пропиленгликоля. Теплоноситель пропиленгликоль абсолютно нетоксичен, поэтому разрешен к эксплуатации во всех странах мира, в отдельных случаях его можно даже увидеть в составе пищевых продуктов под индексом Е1520. Также пропиленгликоль имеет очень низкую температуру кристаллизации, около -40 градусов. Одним из подобных представителей на отечественном рынке является Гольфстрим теплоноситель, который изготавливается на основе пропиленгликоля и глицерина. Но все преимущества, такие как экологическая безопасность, отличные физические характеристики и очень низкая точка замерзания, перекрывает высокая цена пропиленгликоля. Этот немаловажный фактор очень сильно сузил применение вещества в качестве теплоносителя.
Бывают также смеси воды с этиловым спиртом, они, как правило, представлены в вариациях от 40% до 55% спирта. Точка кристаллизации такого раствора – приблизительно -30 градусов. Но применять подобные антифризы следует только в закрытых системах отопления с принудительной циркуляцией, так как из открытой системы спирт достаточно быстро испаряется. Минус – низкая точка кипения около 85-90 градусов, поэтому стандартное отопительное оборудование, способное нагревать теплоноситель до 95 градусов, следует ограничивать. Особенно это необходимо при наличии блока автоматики, использующего в качестве заданной величины температуру воздуха, а не теплоносителя.
Выбирая теплоноситель для систем отопления, отзывы – это последнее, на что стоит опираться, так как в каждом конкретном здании и системе имеется множество индивидуальных факторов.
Как не испортить антифриз
При перегревании обычной воды та превращается в пар, создается эффект кавитации, разрушающий внутренние стенки теплообменника котла. Но после охлаждения пар конденсируется, превращаясь обратно в воду. Что же касается антифриза, то его перегрев может его же самого и уничтожить. Этиленгликоль, нагретый выше 107 градусов, разлагается, как и различные антикоррозийные присадки, находящиеся в нем. Чтобы подобного не случалось, следует в котлах с автоматикой периодически контролировать ее работу, а в котлах без автоматической регулировки температуры обеспечить систему байпасом, который даже при отключении электричества позволит жидкости циркулировать в системе.
Влияние теплоносителя на характеристики отопительной системы
У воды самая высокая теплоемкость из вышеописанных кандидатов, поэтому мощные радиаторы отопления не понадобятся, ее вязкость оптимальна, она прекрасно движется как в гравитационных системах, так и с принудительным циркулированием. Во всех циркуляционных насосах в характеристике указывается создаваемый перепад высот столба жидкости из расчета вязкости воды. Нагрузки на насосное оборудование стандартны, а котлы, как правило, рассчитаны на максимальную температуру нагрева в 95 градусов, что на 5 градусов ниже температуры кипения воды.
Если вам нужен теплый дом, теплоноситель из ряда антифризов может быть лучшим решением, чем вода. Антифриз обладает хорошими, но меньшими параметрами теплоемкости, поэтому понадобятся дополнительные секции радиаторов или же более частая укладка трубы теплого пола. Плотность этиленгликоля создает дополнительную нагрузку на насосное оборудование, так что при необходимости отопления многоэтажного дома следует брать больший запас мощности.
Если вы используете этиленгликоль, учитывайте его химические свойства, поскольку он реагирует с щелочными металлами. При выборе радиаторов лучше у официального представителя выяснить допустимость использования данного антифриза. Не все алюминиевые или биметаллические батареи можно использовать в системах, заправленных антифризом. Если будут использоваться оцинкованные трубы, то задача еще усложняется, ведь некоторые компоненты способны вступать в реакцию, образуя металлические взвеси и труднорастворимые осадки, при этом могут измениться и характеристики самого антифриза.
При подборе котла также стоит просмотреть, подходит ли к нему антифриз. Хотя сейчас производители чаще всего унифицируют оборудование, но все же теплоноситель для электродных котлов должен подбираться тщательней, так как через него будет непосредственно проходить электрический ток.
Этиленгликоль
Многоатомный спирт – этиленгликоль – получил широкое применение не только в качестве антифриза, но и в качестве составляющего элемента при производстве полиуретана и целлофана.
Этиленгликоль – бесцветная жидкость, структурная формула выглядит так: HO—Ch3—Ch3—OH.
Был получен в 1859 году, но повсеместно стал использоваться только в Первую мировую войну в виде замены глицерину при производстве взрывчатых веществ. Получение этиленгликоля из этилена возможно несколькими способами: путём гидратации его оксида (для этого требуется высокое давление и температура в 200 градусов) или с добавлением ортофосфорной кислоты (в этом случае на выходе получается 90% раствор).
 Загрузка ...
Загрузка ... Рекомендуем прочесть!

moikotly.ru
Этиленгликоль
Применение
Благодаря своей дешевизне этиленгликоль (моноэтиленгликоль) нашёл широкое применение в технике.- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при -45°С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе: - в качестве высокотемпературного растворителя. - для защиты карбонильной группы путём получения 1,3-диоксалана.
- В составах для противообледенительной обработки лобовых стёкол и самолётов.
- Как компонент жидкости "И", используемой для предотвращения обводнения авиационных топлив.
- В качестве криопротектора
- Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
- при производстве конденсаторов
- при производстве 1,4-диоксана
- компонент в составе систем жидкостного охлаждения компьютеров
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1-2%)
- в составе для мытья стёкол вместе с изопропиловым спиртом
Описание
| гликоль, этандиол-1,2, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол |
| Ethylene glycol, Ethane-1,2-diol, 1,2-EthanediolGlycol, Ethylene Alcohol,Hypodicarbonous acid, Monoethylene glycol |
| HO—Ch3—Ch3—OH |
| 62.07 |
| ГОСТ 19710-83 |
| 107-21-1 |
| 203-473-3 |
| KW2975000 |
| 24 2212 |
| 2905310000 |
| 290531 |
| 721677 |
Физико-химические свойства
Прозрачная бесцветная жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов внутрь организма человека может привести к необратимым изменениям в организме и к летальному исходу.| 1,113 г/см3 |
| -13°C |
| 196-198 ºC |
| 1.43-1.433 |
| смешивается в любых пропорциях |
| 116°C |
Фасовка
Бочка 100 кг.
Хранение
Упаковка: моноэтиленгликоль упаковывается в железнодорожные цистерны, неоцинкованные алюминиевые и стальные бочки. Хранение: Этиленгликоль и моноэтиленгликоль хранят в герметичных емкостях из алюминия, коррозионной стойкой или алюминированной стали. Этиленгликоль хранится в бочках в неотапливаемых складских помещениях. Бочки с продуктом должны храниться вертикально. Высота штабеля бочек не может превышать три яруса.
Спецификация
| 99,8 | 98,5 |
| 0,05 | 1,0 |
| 520 | 20- |
| 0,001 | 0,002 |
| 0,00001 | 0,0005 |
| 0,1 | 0,5 |
| 0,0006 | 0,005 |
| 1,431–1,432 | 1,430-1,432 |
| 7595100 | --- |
| 9,7±0,3 | 9,2-10,3 |
| 30 | - |
| 80 | - |
| 97 | - |
| - | 0,5 |
| - | 3 |
| - | 50 |
- Код Товара: 75-01
- Наличие: В наличии
- 99
develope.himlogistik.com
Этиленгликоль. Свойства, характеристики и определение этиленгликоля
Этиленгликоль (Гликоль; 1,2-этандиол)
Определение этиленгликоля. Бесцветная сиропообразная сладковатая жидкость без запаха. Температура кипения 197,9°C; температура плавления 12,6°C. Смешивается с водой и спиртом. Порог восприятия запаха 1320 мг/л, привкуса 450 мг/л. Этиленгликоль - Яд! Токсическое действие этиленгликоля зависит от ряда обстоятельств: индивидуальной чувствительности организма; количества; состояния нервной системы; от степени наполнения желудка; наличия или отсутствия рвоты. Дозы, вызывающие смертельное отравление этиленгликолем варьируются в широких пределах - от 100 до 600 мл. По данным ряда авторов, смертельной дозой для человека является 50-150 мл. Смертность при поражении этиленгликолем очень высока и составляет более 60% всех случаев отравления.
Механизм токсического действия этиленгликоля до настоящего времени изучен недостаточно. Этиленгликоль быстро всасывается (в том числе через поры кожи) и в течение нескольких часов циркулирует в крови в неизмененном виде, достигая максимальной концентрации через 2-5 часов. Затем его содержание в крови постепенно снижается, и он фиксируется в тканях.
Характерно двухфазное действие яда. Первоначально проявляется наркотический эффект, что связано с действием на центральную нервную систему всей молекулы спирта(ЭГ), проявляющийся в состоянии опьянения и нарушения психической деятельности. Эти явления наблюдаются в течение 24-48 часов с момента отравления. При этом отмечается угнетение дыхания. Будучи сосудистым и протоплазматическим ядом, этиленгликоль вызывает отек, набухание и некроз сосудов. Результатом этого действия является кислородное голодание тканей мозга. Понижается кислородопереносящая функция гемоглобина. Нарушается обмен веществ с накоплением недоокисленных продуктов.
В ранние сроки отравления больные погибают от острой сердечной недостаточности или от отека легких. Если отравленный вышел из стадии мозговых явлений, то дальнейшая симптоматика является результатом второй фазы токсического действия этиленгликоля, а именно результатом второй фазы токсического действия продуктов его окисления - щавелевой кислоты и её солей (щавелевого кальция). Последний накапливается в мозгу, в почках и других органах. Происходит обеднение кальцием крови и тканей, что ведет к нарушению нервно-мышечной функции, нарушению свертываемости крови. Этиленгликоль ведет к усиленному распаду белков и глубокому изменению углеводного обмена.
Теплоносители на основе этиленгликоля
Вместе с тем, водные растворы этиленгликоля обладают удовлетворительными теплофизическими свойствами и получили широкое распространение в качестве автомобильных антифризов, позднее и бытовых антифризов для систем отопления. Однако, при замене воды на этиленгликолевые антифризы необходимо помнить и об изменении коэффициента температуры расширения антифриза. Для Вашего удобства мы приводим зависимость расширительных баков от объема системы в таблице 1.Зависимость объема расширительных баков от объема системы:
Табл. 1|
Объем системы, л |
Объем расширительного бака, л |
|
|
вода |
этиленгликоль |
|
|
120 |
25 |
35 |
|
345 |
50 |
80 |
|
580 |
80 |
100 |
|
810 |
100 |
150 |
|
1155 |
150 |
200 |
|
1730 |
200 |
300 |
|
2310 |
300 |
500 |
|
2890 |
300 |
500 |
|
3470 |
500 |
2*300 |
Зависимость температуры замерзания теплоносителей от концентрации в них этиленгликоля:
Табл. 2|
tзамерзания °С |
-40 |
-30 |
-20 |
-10 |
-5 |
0 |
|
содержание, % масс. |
53 |
46 |
36 |
24 |
14 |
1 |
В домашних условиях можно определить температуру замерзания tзамерзания °С эксплуатируемого теплоносителя по плотности. Зависимость плотности от температуры замерзания для водных растворов этиленгликоля приведена в таблице 3.
Зависимость плотности от температуры замерзания этиленгликоля:
Табл. 3|
tзамерзания °С |
-40 |
-30 |
-20 |
-10 |
-5 |
0 |
|
Плотность, кг/м3 |
1069 |
1060 |
1047 |
1030 |
1017 |
999,2 |
www.teplonositeli.ru
Этиленгликоль, водный раствор - Справочник химика 21
Водные растворы этиленгликоля и глицерина замерзают при низких температурах, поэтому их используют в качестве антифризов — жидкостей с низкой температурой замерзания, применяемых для охлаждения двигателей внутреннего сгорания. [c.373]Технологическая схема процесса получения окиси этилена, разработанного фирмой S ientifi Design, изображена на рис. 6.24. Воздух, подаваемый компрессором У, смешивается с этиленом и циркулирующим реакционным газом и вводится в низ контактного аппарата 2, в трубки которого загружен катализатор. Температура окисления регулируется скоростью циркуляции теплоносителя. Реакционные газы охлаждаются в теплообменнике, нагревая циркулирующий газ, и в холодильнике, а затем компримируются дожимающим компрессором 3. Далее газ поступает в основной скруббер 4, где окись этилена улавливается водой. Большая часть выходящего газа направляется на смешение с исходной эти-лено-воздушной смесью, меньшая — в дополнительный контактный аппарат 5 для окисления непрореагировавшего этилена, а затем на промывку водой в дополнительный скруббер 6. Отходящий из скруббера газ выбрасывается в атмосферу. Водные растворы из скрубберов 4 и 6 смешиваются и поступают в десорбер 7. Из верхней части десорбера отводят окись этилена, пары воды и Oj. Они компримируются и направляются на двухступенчатую ректификацию. В колонне 9 выделяется этилен, Oj и другие легкокипящие компоненты. С верха колонны 10 отбирают окись этилена. В кубе этой колонны остаются высококипящие примеси (вода, ацетальдегид, этиленгликоль). [c.206]
Свойство растворов понижать температуру замерзания воды широко используется в практике для приготовления так называемых антифризов, которые представляют собой водные растворы некоторых органических и неорганических веществ. Эти растворы не замерзают при низких температурах и потому широко применяются для охлаждения двигателей автомобилей и тракторов в условиях Крайнего Севера. Например, такой антифриз, как 55%-ный раствор этиленгликоля в воде, не замерзает даже при температуре 233 К- [c.106]Получение этиленгликоля из формальдегида организовано в США фирмой Е. I. du Pont de Nemours and o. По этому способу смесь паров формальдегида и воды (объемное соотношение 1 1) абсорбируется водным раствором гликолевой кислоты (мольное соотношение 1 2) с примесью каталитических количеств серной кислоты и затем пропускается через реактор вместе с избытком окиси углерода при 200 "С и 70 МПа (время контакта 5 мин). В результате образуется гликолевая кислота (выход 90—95%), выделяемая перегонкой прн пониженном давлении. После этерификации гликолевой кислоты метиловым спиртом и очистки зфира перегонкой, проводится гидрирование метилового эфира гликолевой кислоты при 200 °С и 3 МПа в присутствии катализатора медь—хромат бария. На стадии восстановления получают этиленгликоль с выходом 90%. Данный метод не получил широкого распространения вследствие многостаднйности и высокой коррозионности среды, но может быть перспективным при снижении стоимости и расщирении производства синтез-газа. [c.274]
Этиленгликоль и глицерин — высококипящие жидкости сладкого вкуса, смешивающиеся с водой во всех отношениях. Этиленгликоль применяется в качестве составной части так называемых антифризов, т. е. веществ с низкой температурой замерзания, заменяющих воду в радиаторах автомобильных и авиационных моторов в зимнее время. Водный раствор этиленгликоля (58%-ный по массе) замерзает только при температуре -50 °С. Этиленгликоль применяется и для изготовления синтетического волокна лавсан (см. разд. 31.1.1). При приеме внутрь — сильно ядовит. [c.572]
Водные растворы этиленгликоля Водные растворы глицерина Водные растворы хлористого натрия Водные растворы хлористого кальция [c.81]
Реактивы и их приготовление. 1. Едкий натр, 1 н. раствор. 2. Индикатор мурексид (аммонийная соль одноосновной пурпуровой кислоты). Приготовление раствора. 0,15 г мурексида растворяют в 100 мл абсолютного этиленгликоля. Водный раствор мурексида неустойчив. Приготовление индикаторной смеси. 0,20 г мурексида растирают в ступке и смешивают с 100 г хлористого натрия. Смесь устойчива. В точке эквивалентности цвет индикатора меняется от розового до лилового. 3. Трилон Б, 0,1 п. 0,01 н. растворы. 1 л 0,1 п. раствора содержит 18,6 г трилона Б. [c.100]
ТХФ получали путем взаимодействия 1,2,4,5-тетрахлорбензола с гидроксидом натрия в присутствии этиленгликоля и ксилола (см. рис. 15.8). Несмотря на то что этиленгликоль считается растворителем, в процессах органического синтеза он, по-видимому, играет роль химического агента, образующего промежуточные вещества (алкоксиды), в составе которых натрий попадает в сферу реакции. Ксилол, очевидно, добавляют для того, чтобы иметь возможность азеотропно отогнать воду из конечной смеси. Вследствие этого равновесие в уравнении реакции, представленном на рис. 15.8, сдвинется вправо. Это дает некоторое подтверждение тому, что в полученной смеси непрореагировавший натрий скорее будет присутствовать в форме органического соединения, нежели в форме водного раствора гидроксида. [c.411]
ЧЕРНИЛА (атрамент) — водный раствор синтетического органического кислотного красителя (метиленовый синий, кислотный фиолетовый, кислотный ярко-красный и т. д.) или смеси красителей с различными добавками, которые обусловливают соответствующие специфические свойства Ч. Изготовляют Ч. для письма (школьные, конторские), для авторучек, специальные (для документов), гектографические, штемпельные, для печатания и т. д. Для улучшения пишущих свойств, лучшего смачивания пера, быстрого высыхания надписей в состав Ч. вводят загустители — сахар, глицерин или этиленгликоль (в зимний период), в качестве антисептиков против загнивания и плесневения — фенол, формалин, уротропин. По своему цвету, интенсивное ги, пишущим свойствам, однородности, стойкости Ч. должны отвечать утвержденным техническим условиям и образцам-эталонам. Ч. для авторучек должны высыхать не более чем за 30 с. Такие Ч. по своему составу и консистенции значительно отличаются от чернильных паст. Например, в состав синих Ч. для авторучек входит краситель метиленовый голубой или синий, сахар, глицерин, фсиол, вода дистиллированная в состав фиолетовых Ч.— кислотный фиолетовый и кислотный ярко-красный красители, сахар, глицерин, формалин, аммиачная вода, вода дистиллированная черные Ч. содержат кислотный голубой, кислотный оранжевый и кислотный ярко-красный красители, сахар, глицерин, фенол, дистиллированную воду. [c.286]
Глиоксаль [24]. Каталитическим окислением этиленгликоля над окисно-медным катализатором при температуре около 270—280 и давлении 3,5 ат в газовой фазе можно гликоль окислить в глиоксаль, получающийся в виде водного раствора глиоксальгидрата. Возможности применения глиоксаля в промышленности многочисленны и разнообразны. Он является исходным материалом для получения ниразин-2,3-дикарбоновой кислоты — витамина, применяемого при лечении пеллагры. [c.189]
Водные растворы этиленгликоля Водные растворы глицерина [c.82]
Сырьем для риформинга является фракция, содержащая углеводороды легче пентана. Выходящий из реактора рексформинга продукт имеет октановое число около 95 единиц (с добавкой О,Ъ мл/л ТЭС). Риформат поступает в экстракционную колонну, куда противотоком к нему подается водный раствор ди-этиленгликоля. Ароматические углеводороды вместе с низко-кииящими парафинами переходят в раствор. Высококипящие парафины отбираются сверху экстракционной колонны. Смесь гликоля и рексформата поступает на разделение в отнарную ко- [c.154]
Этиленгликоль (этандиол) СН2ОН—СНгОН — бесцветная вязкая жидкость, растворимая в воде и многих органических растворителях (спирте, ацетоне и др.). Этиленгликоль обладает более кислыми свойствами, чем этиловый спирт. Широко используется в химической промышленности. Водные растворы этиленгликоля применяются в качестве антифризов (незамерзающих при низкой температуре жидкостей) для охлаждения автомобильных двигателей в зимний период. Например, 50%-ный водный раствор этиленгликоля замерзает только при —34°С. [c.121]
Dunstan и Bir h предложили следующий метод получения этиленгликоля. Водный раствор этиленхлоргидрина непрерывш смешивается с водным раствором слабой щелочи (например карбоната натрия) и нагревается под давлением при 105—150°. Горячая реакционная смесь протекает, под давлением и при температуре реакции, через серию нагреваемых U-образных труб. В этих трубах нижние части заполнены насадкой, а верхние снабжены изогнутыми внутрь ребрами. [c.553]
Растворители, применяемые 1в процессе карбамидной депарафинизации, предназначены в основном для снижения вязкости сырья и создания необходимого контакта карбамида с углеводородами, что при прочих равных условиях обеспечивает большую-полноту извлечения комплексообразующих компонентов. Для создания гомогенной системы растворитель должен в той или иной степени растворять и сырье и карбамид. В качестве растворителей для карбамидной депарафинизации предложено много соединений (спирты и кетоны, хлористый метилен, дихлорэтан, ди-фтордихлорметан, бензол, крезол, этиленгликоль, уксусная кислота, изоо ктан, петролейный эфир, бензин, лигроин, а также вода или водные растворы низших спиртов). Однако далеко не все предложенные растворители нашли промышленное применение в--этом процессе. [c.215]
Как и одноатомные спирты, этиленгликоль может быть получен гидролизом галогенпроизводных алканов водным раствором щелочей. Для этой реакции необходимы 1,2-дигалогенпроизводные этана [c.372]
Принципиальная технологическая схема процесса приведена на рис. 8.14. Окись этилена, водный раствор катализатора и двуокись углерода поступают в трубчатый реактор 4. Теплосъем осуществляется холодным сырьем и водой, циркулирующей в межтрубном пространстве реактора. Верхняя часть реактора служит сепаратором высокого давления. Гидролизат после реактора направляется в испаритель 6 для отделения от катализаторов, основная часть которых ( 90%) возвращается на синтез. Из смеси этиленгликолей, содержащей 5—10% воды, вакуумной ректификацией выделяют на колонне 8 этиленгликоль, а на колонне 9 диэтиленгликоль. [c.277]
Окись этилена выделяют из газообразной смеси продуктов реакции отмывкой водой под нормальным или повышенным давлением после перегонки водного раствора получают окись этилена высокой степени чистоты. Запатентовано выделение окиси этилена с помощью адсорбции активированным углем, однако на практике этот способ не применяется. На некоторых полузаводских установках испытывался метод выделения окиси этилена из газообразных продуктов реакции промывкой последних горячей разбавленной серной кислотой при этом окись этилена непосредственно превращалась в этиленгликоль. Полагают, что в настоящее время этот метод оставлен. [c.160]
Мономерный глиоксаль — твердое вещество желтого цвета (т. пл. 15°, т. кип. 50,4°). Обычно он существует в разнообразных полимерных формах. В процессе производства глиоксаля окислением этиленгликоля этот диальдегид получается в виде 30%-ного водного раствора, в котором глиоксаль, как и формальдегид, находится в виде ряда нелетучих гидратов. [c.309]
Опубликованы подробности метода гидратации окиси этилена под давлением в отсутствие катализаторов [3, 4]. Смесь 1 объема окиси этилена и 6 объемов воды выдерживают в течение 30 мин. при 190—200° и 22 ата. Водный раствор гликолей после доведения pH до 7 упаривают в трехкорпусном выпарном аппарате. Отгоняющиеся сладкие воды , в которых содержится 0,5—1% этиленгликоля, возвращают в аппарат для гидратации окиси. Упаренную смесь гликолей, содержащую 15% воды, разгоняют на нескольких ректификационных колоннах. На каждые 35 весовых частей этиленгликоля получают 4 части диэтиленгликоля и 1 часть триэтиленгликоля [3]. Выход гликолей из окиси этилена превышает 90%. [c.354]
Этиленгликоль можно также получать гидролизом водного раствора этиленхлоргидрина (гл. 10, стр. 188) [c.354]
Получают этаноламины реакцией оксида этилена с аммиаком. Процесс проводят с водным раствором Nh4 прн 40—60 °С, что связано с необходимостью отгонки больших количеств воды при выделении этаноламинов. Ввиду основных свойспз аммиака и этаноламинов, а также из-за побочного образования гидроксида четырехзамещенного аммония, катализирующих гидратацию а-оксида, побочно образуется этиленгликоль. Для увеличения селективности в реакционную смесь добавляли СО2, нейтрализующий гидроксильные ионы. [c.291]
В данном случае также получаются побочные продукты — триэтиленгликоль и высшие полигликоли. По одному из методов [3] 1 объем окиси этилена растворяют в 6 объемах 50%-ного водного раствора этиленгликоля и нагревают при 200° и 14 ата в отсутствие катализаторов. [c.356]
Водные растворы этиленгликоля имеют низкую температуру замерзания, что позволяет применять их в качестве низкоза-мерзающих охлаждающих жидкостей (антифриз). [c.318]
Из этилена этиленгликоль может быть получен и путем окисления в водном растворе [c.123]
В четырех склянках без надписей находятся следующие органические соединения ацетон, уксусный альдегид, этиленгликоль, водный раствор фенола. На> пищите уравнения реакций, при помощи которых можно раэ уичить названные вещества. [c.217]
Озон, 5 моль в кислороде Монометакри ловый эфир этиленгликоля Водный раствор, эмульсия, блок, 100—140 С [c.147]
Жесткие пенополиуретанопласты можно пилить, обтачивать, штамповать, обрабатывать на токарных станках. Они устойчивы к действию кипящей воды, дизельных и смазочных масел до 100° С, бензина, керосина, глицерина, этиленгликоля, водных растворов солей, 30%-ной уксусной кислоты, этилового спирта, четыреххлористого углерода и т. п. Но они разрушаются ацетоном, этилацетатом, крезолом, метилэтилке-. тоном, 30%-ной соляной и 10%-ной серной кислотами, 15—20% растворами едкого натра. Пенопласты легко очищаются при мытье мыльной водой на них не действуют моль и различные бактерии. Они обладают хорошей атмосферо- и озоностойкостью. [c.653]
Схема процесса получения этиленгликоля некатализированной гидратацией окиси этилена представлена на рис. 8.13. Водный раствор окиси этилена подается в подогреватель 5 и далее поступает в гидрататор 6 — колонный аппарат с автотермическкм режимом. Гидролизат представляет собой 15—20%-ный раствор гликолей в воде. Часть воды испаряется при дросселировании давления до атмосферного. Пары воды и низкокипящнх примесей (ацетальдегид, ОЭ) отделяются от жидкости в сепараторе 7. Водногликолевая смесь из сепаратора 7 после добавления раствора гидроксида натрия до pH = 8, поступает на выпаривание воды в трехкорпусную вакуум-выпарную батарею 8, работающую при ступенчатом [c.276]
Отщепление протона от координированного лиганда обычно происходит при более низком pH, чем от свободного. Так, р/С диссоциации этилендиаминтетраацетат-иона НУ при ионной силе 0,1 составляет 10,3, а комплекса ЬаНУ — около 2,2. С электростатической точки зрения это объясняется контраполяризацией — выталкиванием положительно заряженного иона Н+ положительно заряженным центральным ионом. Этот эффект может привести к диссоциации лигандов, которые сами по себе в водных растворах не отщепляют протона. Так, в аммиачных комплексах РЧ + и Hg протон отщепляется от аммиака, превращающегося в координированный амид-ион NHo, а в комплексах металлов с окснкислотами (винной, лимонной и т. п.), глицерином и этиленгликолем отщепляются протоны спиртовых групп. Явление контраполяризации равносильно смещению электронной плотности к центральному иону вдоль о-связей. [c.40]
Первое промышленное производство этиленгликоля гидролизом этиленхлор-гидрина было организовано в начале 20-х гг. фирмой Union arbide. Гидролиз проводили в водном растворе, содержащем 20% (масс.) этилеихлоргидрина и сте-киометрнческое количество гидрокарбоната натрия, при 70—80 С в течение [c.273]
В немецком процессе [38] получившийся в результате реакции между этиленом, хлором и водой (стр. 185) 4—5%-ный водный раствор этиленхлоргидрина, содержавший некоторое количество дихлорэтана, смешивали с 10—20%-ным избытком горячей кашицы гашеной извести и подавали в верхнюю часть колонного реактора, откуда эта смесь стекала вниз, перетекая с полки на полку. В нижнюю часть колонны вводили острый пар с таким расчетом, чтобы жидкость в верхней части все время кипела. Выходящие из аппарата пары состояли из окиси этилена, дихлорэтана и воды. Больитую часть водяных паров конденсировали и возвращали обратно в реактор. Окись этилена отделяли от дихлорэтана и остатка водяных паров ректификацией под атмосферным давлением на двух колоннах непрерывного действия. В этом процессе потери окиси этилена за счет ее гидратации в этиленгликоль были незначительными. [c.188]
Высококачественный этиленгликоль получают в промышленности неката-лизированной гидратацией окиси этилена при мольном отношении вода/окись этилена 16—20, температуре 190—200 С, давлении около 2 МПа и продолжительности контакта 40 мин. Гидролизат, представляющий собой разбавленный водный раствор гликолей, концентрируют отгонкой воды до 15%-ного содержания и подвергают ректификации. Водный конденсат рециркулируют на синтез. Селективность превращения окиси этилена составляет в этиленгликоль — 82— 86% в диэтиленгликоль — 12—14% в триэтиленгликоль — 2—3%. [c.274]
На отечественных установках для извлечения ароматических углеводородов из катализата платформинга наиболее распространенным экстрагентом является водный раствор диэтиленгликоля (ДЭГ), но его повсеместно заменяют более эффективным три- и тетра этиленгликолями (ТЭГ и тетраЭГ). [c.260]
Явление понижения температуры замерзания растворов имеет очень большое значение как в природе, так и в технике. Так, морская вода (в зависимости от ее солености) замерзает при существенно более низких температурах, чем пресная. В городах для очистки тротуаров от льда их посыпают солью, что приводит к образованию водных растворов, плавяпшхся намного ниже 0°С. Растворы некоторых органических веществ (например, этиленгликоля) сильно понижают температуру замерзания воды (до —40°С). Такие растворы (антифризы) применяются в холодильных установках и машинах, работающих при сильных морозах. [c.69]
Среди двухатомных спиртов этиленгликоль представляет наибольший интерес. Он нашел применение как заменитель глицерина. В технике его используют в виде водного раствора в качестве антифриза — жидкости, имеющей низкую температуру за.мерзання и потому применяемой в зимних условиях для охлаждения цилиндров автомобильных, тракторных и авиационных двигателей. Значительное количество этиленгликоля применяется для получения синтетического волокна лавсан (стр. 381, 481). [c.121]
Введение вещества в желудок производится через 3 часа после кормления в чистом виде или в водном растворе, в растительном масле, индифферентном растворителе (поли-этиленгликоле и т. п.), в виде эмульсий или суспензии в крахмале, полиэтиленгликоле и т. д. Вводимый объем для белых мышей не должен превышать 1 мл и для крыс —5 мл. Кормление животных производится через 3 часа после введения вещества. При однократном ингаляционном воздействии устанавливаются пороги вредного действия по интегральным (неспецифическим) (Ь1шас-) н специфическим показателям, характеризующим состояние отдельных органов и систем организма (Ь1тас, р). Соотношение между порогом вредного действия, установленного по интегральным показателям, и минимальной концентрацией, вызывающей избирательный эффект, служит мерой избирательности действия вещества. [c.113]
chem21.info
Этиленгликоль воды из углеводородов - Справочник химика 21
Определение этиленгликоля. Молекулярный вес 62. Этиленгликоль легко смешивается с водой, этанолом и ацетоном. Не смешивается с углеводородами, в частности с бензином. Температура кипения этиленгликоля 197°, а плотность 1,114 г/с.и . Температура замерзания —11,5°. Смеси этиленгликоля с водой замерзают при более низкой температуре. Самую низкую температуру замерзания (—75°) имеет смесь, содержащая 33% воды. Эти свойства этиленгликоля широко используют для приготовления низкозамерзающих жидкостей. Поэтому важно определять содержание этиленгликоля не только в товарном продукте, но и в водно-гликолевых смесях. [c.242] Простейший двухатомный спирт — этиленгликоль легко смешивается с водой, этиловым спиртом, ацетоном и некоторыми другими органическими веществами, но не смешивается с углеводородами и, в частности, с бензином. Наличие второй гидроксильной группы повышает плотность и температуру кипения этиленгликоля по сравнению с этиловым спиртом. Его температура кипения 197° С, а плотность 1,114 г см . Температура замерзания этиленгликоля — [c.296]Этиленгликоль кипит при 197°. Он полностью смешивается с водой и спиртом, но нерастворим в некоторых углеводородах. Этиленгликоль вступает во все типичные реакции, обусловленные присутствием спиртового гидроксила, которые, однако, осложняются тем, что при соседнем атоме углерода находится вторая гидроксильная группа. Например, этиленгликоль образует с альдегидами и кетонами циклические ацетали и кетали [c.354]
Алканы практически нерастворимы в воде и сами ее не растворяют, Так, в воде при 20 °С растворяется 2,065 % (по объему) бутана. В 100 г воды при 25 °С растворяется 0,005 г гептана, а в 100 г гептана в таких же условиях растворяется 0,0151 г воды. Алканы растворяют хлор, бром, иод, некоторые соли, например фторид бора (И1), хлорид кобальта (II), хлорид никеля (II), некоторые модификации серы, фосфора, хорошо растворимы в углеводородах и их галогенпроизводных, а также в простых и сложных эфирах. Хуже растворимы в этаноле, пиридине, алифатических аминах мало растворимы в метаноле, ацетоне, фурфуроле, феноле, анилине, нитробензоле и др. Практически нерастворимы в глицерине, этиленгликоле. Как правило, растворимость алканов падает с увеличением числа полярных групп в растворителе и возрастает с увеличением длины его углеродной цепи. [c.192]
Для приготовления композиций, ингибирующих коррозию, используют довольно щирокий круг растворителей метанол, этанол, этиленгликоль, воду, углеводороды [17]. [c.334]
Кроме того, для преодоления сил сцепления парафинов и остальных углеводородов масла используются специальные активаторы процесса комплексообразования к ним относятся метиловый и этиловый спирты или смеси их, ацетон, этиленгликоль, вода (в тех случаях, когда продукт или раствор его контактирует с сухим карбамидом). [c.223]
Низшие спирты, алифатические углеводороды Спирты, этиленгликоль, вода [c.383]
В состав смолистых веществ, которые образуются при сравнительно низких температурах (200—350°С), входят такие вещества, как вода, растворимые фенолы, этиленгликоль, алифатические углеводороды, спирты, кислоты, воск и т. д. Состав смолистых веществ сложен, [c.83]
Р-римость в воде 0,073% по массе (25 °С), воды в Б.-0,05% (26 °С). Неограниченно раств. в углеводородах, эфирах, хуже-в метаноле, не раств. в этиленгликоле, глицерине растворяет жиры, каучуки, гудрон, серу, фосфор, иод. Образует азеотропные смеси (см. табл.) [c.268]
Гликоли с короткой углеродной цепью, и прежде всего этиленгликоль, не растворяются в углеводородах и эфире, но смешиваются с водой и спиртами как растворители они ближе стоят к воде и метанолу, чем к обычным органическим растворителям. [c.108]
Если для углеводородов, хлороформа, метиленхлорида, эфиров ацетонитрила и спиртов значения г меньше единицы и имеют какое-либо определенное значение, то для воды, этиленгликоля, органических кислот б больше 1, что говорит о практически необратимой адсорбции этих растворителей на поверхности [c.33]
Питательные вещества поступают в бактериальную клетку через всю её поверхность. Они должны быть растворимы в воде, только при этом создаются условия для диффузии вещества в цитоплазму клетки. Часть органических веществ, которые совсем не растворяются в воде или дают коллоидные растворы, переводятся ферментами бактериальной клетки в водорастворимое состояние после их гидролиза до более простых и растворимых в воде соединений. Углеводороды легко проникают в бактериальную клетку. Труднее проникают молекулы вещества, содержащего полярные группы, и чем их больше, тем труднее проникновение (в ряду этанол этиленгликоль — глицерин проникновение уменьшается). Ещё медленнее диффундируют в клетку маннит и сахара, имеющие несколько оксигрупп и карбонильную. Жирные кислоты с одной карбоксильной группой легче проникают в цитоплазму, чем соответствующие им окси- или аминокислоты. [c.272]
П. у. хорошо растворимы в углеводородах, их галогенонроизводных (напр,, I4, 2h5 I2), простых и сложных эфирах хуже растворимы в этаноле, пиридине, алифатич аминах малорастворимы в метаноле, фурфуроле, феноле, анилине, нитробензоле и др. Практич. нерастворимы в глицерине, этиленгликоле, воде. Как правило, растворимость П, у, падает с увеличением числа полярных групп в растворителе и возрастает с увеличением длины углеродной цепи растворителя. [c.142]
Гере (475) исследовал более 100 органических жидкостей, стре- мясь найти такую, которая хорошо растворяла бы ароматические углеводороды и не растворяла бы вовсе жирные. Хуже всего жирные углеводороды растворяются в пировиноградной кислоте. Этиловый эфир винной кислоты действует вроде диметилсульфата, ацетоуксус-ный эфир но свойствам близок к анилину, а этиловый эфир ш,аве-левой кислоты напоминает в отношении избирательной растворимости уксусный ангидрид. Наиболее удобными растворителями оказались левулиновая кислота, фенилгидразин, неполный уксусный эфир этиленгликоля и фурфурол. Левулиновая кислота берется в кол1гчестве 3—4 объемов по отношению к бензину и удобна тем, что легко растворяется в воде, что делает возможным с одной стороны выделение извлеченных углеводородов, с другой — регенерацию ее. [c.170]
Растворители, применяемые 1в процессе карбамидной депарафинизации, предназначены в основном для снижения вязкости сырья и создания необходимого контакта карбамида с углеводородами, что при прочих равных условиях обеспечивает большую-полноту извлечения комплексообразующих компонентов. Для создания гомогенной системы растворитель должен в той или иной степени растворять и сырье и карбамид. В качестве растворителей для карбамидной депарафинизации предложено много соединений (спирты и кетоны, хлористый метилен, дихлорэтан, ди-фтордихлорметан, бензол, крезол, этиленгликоль, уксусная кислота, изоо ктан, петролейный эфир, бензин, лигроин, а также вода или водные растворы низших спиртов). Однако далеко не все предложенные растворители нашли промышленное применение в--этом процессе. [c.215]
Наибольшее применение в качестве экстрагентов для извлечения ароматических углеводородов получили гликоли, сульфолан (тетрагидротиофендиоксид) [97, 99], диметилсульфоксид [99], N-метилпирролидон (в смеси с этиленгликолем и водой) [100. Первоначально использовали диэтиленгликоль, который в последнее время заменяется триэтиленгликолем [101] и тетраэтилен-гликолем [102]. В табл. 31 даны показатели экстракции с применением различных растворителей [79, с. 69]. [c.179]
Непрерывно действуюш ая осушка эти-ленгликолями сравнительно проста в эксплуатации и пе требует больших первоначальных капиталовложений [10]. На рис. IV.5 ириведена схема последней модификации обезвоживаюш,ей природный газ установки с этиленгликолем [15]. Влажный природный газ поступает в нижнюю часть скруббера 1, устанавливаемого как можно ближе к контактору 2 назначение скруббера — отделить жидкую воду, сконденсировавшиеся углеводороды, смазочное масло, ржавчину, частицы грунта и любую грязь, которая может попасть в трубопровод с газом. В контакторе 2 газ противотоком обрабатывается концентрированным раствором этиленгликоля. Разбавленный, отработанный раствор этиленгликоля сбрасывается регулятором уровня в газосенаратор 4, предпазначенный для отделения кислорода и сероводорода, иоглош енных этиленгликолем из газа в контакторе. Затем этиленгликоль проходит каменный или мешочный фильтр 6 для отделения взвешенных частиц грязи, ржавчины и пр. Через теплообменник 8 разбавленный этиленгликоль поступает в середину колонны-регенератора 9, где из него отгоняется вода. Тепло, необходимое для испарения воды, сообщается паровым, огневым или обогреваемым горячими нефтяными фракциями кипятильником 12. Вода ожижается в конденсаторе орошения 10 и насосом вновь подается па орошение регенератора 9. С низа колонны концентрированный раствор этиленгликоля выводится регулятором уровня в аккумулятор через тенлообменник 8. Отсюда циркуляционный насос 5 вновь подает этиленгликоль в контактор через холодильник 3. [c.154]
Адольф Вюрц (А. Уйг12), франдузский химик (1817 —1884). Ьл о работы в области органической химии весьма многочисленны. Им была открыта реакция синтеза предельных углеводородов (денствием металлического атрия на галоидпроизводные), реакции получения и обнаружения жирных аминов. В 1859 г. Вюрцем был получен первый представитель двухатомных алкого-лей —этиленгликоль ( удвоенный тип воды ). [c.51]
Время перехода электрона из своб. состояния в сольвати-рованное ири 295 К составляет (пс) 0,24 в воде, 5 в этиленгликоле, 11 в мегаиоле, 18 в этаноле, 51 в деканоле, 0,2 в аммиаке. При понижении т-ры это время увеличивается. Переход происходит через стадию образования локализованного (или предсольватированвого) электрона, характеризующегося меньшей энергией захвата средой. Ра-диац.-хим. выходы С. э. прп радиолизе равны 2,7-2,9 в воде, 1-1,8 в спиргах, 3,1 в аммиаке, 0,1-0,2 в нормальных углеводородах и до 1 в разветвленных углеводородах. [c.379]
Диметилсульфоксид (СНзЗОСНз), т. кип. 189°/760 мм (с разложением) или 85—87°/25 мм, имеет ряд преимуществ в качестве растворителя и в настоящее время находит широкое применение. По своей растворяющей способности он близок к диметилформамиду хорошо растворяет ацетилен, окись этилена, двуокись азота, сернистый ангидрид, многие ароматические вещества, гетероциклические соединения, камфору, смолы, сахара, жиры и т. д. Это бесцветная жидкость без запаха не смешивающаяся с насыщенными алифатическими углеводородами и смешивающаяся в любых отношениях с водой, метанолом, этанолом, этиленгликолем, глицерином, ацетоном, этилацетатом, диоксаном, пиридином и ароматическими углеводородами. Диметилсульфоксид растворяет и неорганические соли. Так, например, при 60° он растворяет 10,6% азотнокислого калия, 21,8% хлористого кальция и приблизительно 0,6% сульфата натрия и хлористого калия. [c.599]
Этиленгликоль с выходом 88—97% от теоретического получается при гидроксилировании этилена перекисью водорода в растворе трет-бутилового спирта при температуре около О °С в присутствии 0з04. Гидроксилирование этилена может проводиться также водным 33%-ным раствором в присутствии стабилизаторов — перекисей алифатических и циклоалифатических гликолей, их неполных эфиров, несмешивающихся с водой спиртов и углеводородов [60]. [c.64]
Склонность к гидро.пизу ограничивает применение сложных эфиров гликолей, полученных из окисей олефинов и низших кислот. Этиленгликольдиформиат предложено даже использовать в реакциях и процессах, где желательно постепенное образование муравьиной кислоты, В отсутствие воды сложные эфиры могут служить растворителями. Наиболее распространен диацетат этиленгликоля, как вы-сококипяш,ий, медленно испаряюш ийся растворитель эфиров целлюлозы и фторированных углеводородов. ]В смесях с другими растворителями он употребляется для очистки смазочных масел от свободных жирных кислот [2, р. 128]. [c.324]
Для выделения ароматических углеводородов из катализата риформинга применяется метод экстракции органическими растворителями. Так, бензол, толуол, ксилолы, этилбензол извлекают из катализата такими растворителями, как триэтиленгликоль, сульфолан, N-метшширролидон, N-формилморфолин и др. При экстракции используются также смеси растворителей с антирастворителями (водой, этиленгликолем). Последующей отгонкой растворителя и четкой ректификацией смеси аренов получают индивидуальные углеводороды. В отдельных случаях, например при выделении л-ксилола, используется кристаллизация. [c.773]
ЭТИЛЕН КАРБОНАТ (гликолькарбонат) Н,С0С(0)0СН2, л 38,5-39 С, 243 °С 1,32218, и 1,4190 раств. в СП., эф., ацетоне, аром, углеводородах, уксусной к-те, воде, не раств. в алиф. леводородах, Sj. Получ. взаимод. окиси этилена с Oj в присут. галогенидов тетраалкиламмо-ния или галогенидов щел. металлов вэаимод. этиленгликоля с фосгеном. Примен. р-ритель полимеров (в т. ч. полиакрилонитрила, полиамидов, эфиров целлюлозы) экстрагент аром, углеводородов для интенсификации крашения [c.719]
Краун-эфиры синтезируют алкилированнем этиленгликоля, диэтиленгликоля НОСН2СН2ОСН2СН2ОН, триэтиленгликоля НОСН2СН2ОСН2СН2ОСН2СН2ОН подходящими реагентами, например 2,2 -дихлордиэтиловым эфиром 0(СН2СНгС1)2. Простейшие краун-эфиры являются бесцветными густыми жидкостями или низкоплавкими кристаллическими веществами, растворимыми как в углеводородах, так и в воде. [c.340]
Было найдено, что в качестве смазки для кранов, когда имеют дело с неполярными соединениями, вполне пригодна глицерино-крахмальная смазка [150]. Для этой же цели была рекомендована смесь сахарозы или маннита в глицерине, содержащая 1—3% поливинилового спирта средней вязкости [151]. Применялась также в качестве смазок при работе с алифатическими и ароматическими углеводородами частично этерифицированная и полимеризованная смесь тетра-этиленгликоля и лимонной кислоты [152] или такая же смесь с добавлением ацетата целлюлозы [153]. Спирты, кетоны и вода действуют на эту смесь. Смолоподобная смесь, полученная при реакции себациновой кислоты и этилен-гликоля, нерастворима в алифатических углеводородах, спиртах и диэтиловом эфире, но растворима в бензоле, пиридине и галоидалкилах [154]. Полимери-зованные фталевые эфиры ди- и триэтиленгликоля являются хорошими смазками при работе с алифатическими углеводородами [154]. Различные патентованные смеси, предлагаемые фабрикантами лабораторных приборов в качестве смазок для кранов, имеют обычно ограниченную применимость. [c.247]
Для титрования оснований в качестве сред довольно широко используются также гликолевые растворители, которые обладают более кислыми свюйствамм по сравнению с водой и спиртами [3]. Для уменьшения вязкости и повышения растворяющей способности к гликолям прибавляют спирты, углеводороды и кетоаы. Содержание гликоля может варьироваться в пределах от 15 до 70%, но стандартной растворяющей средой является смесь 1 1 (по объему). Наиболее часто применяют смеси этиленгликоля или про-пиленгликоля с изопропиловым или н-бутиловым спиртами. Хлороформ по сравнению со спиртами улучшает растворимость многих соединений и увеличивает резкость перехода окраски индикаторов. При использовании хлороформа используют пропиленгли-коль, так как с зтиленгликолем хлороформ не смешивается. [c.80]
Интересно отметить, что для экстракции толуола из богатых ароматическими углеводородами продуктов гидроформинга можно применять воду. Однако гораздо более удобным растворителем, который может конкурировать с 80г, является диэтилен-гликоль, используемый в процессе Юдекс . Селективность ди-этиленгликоля по отношению к ароматическим соединениям увеличивается при добавлении 5—12% воды. Этот растворитель, получающий все более широкое распространение, применяют под давлением при относительно высоких температурах (порядка 163° С). Так как диэтиленгликоль имеет высокую температуру кипения, регенерация его из экстракта происходит почти без потерь при этом теряется, скорее, некоторое количество углеводородов. [c.639]
Очевидно, что уравнение Цванцига не дает адекватного количественного описания поведения электролитов, остается неясным и область применимости этого уравнения. В значительной степени это зависит от справедливости закона Стокса. Однако всевозрастаюший объем данных заставляет усомниться в справедливости последнего. Наиболее подробно изучены системы, содержащие растворители с низкой вязкостью, такие, как низшие спирты, вода, ацетонитрил, ацетон, хлорированные углеводороды и различные смеси этих растворителей. В растворителях с высокой вязкостью, таких, как формамид [72], этиленгликоль [73], смесях сахароза - вода [73а], ацетонитрил -октацианэтил — сахароза [74], наблюдаются большие систематические отклонения от закона Стокса. В некоторых случаях произведение Вальдена в 2 - 3 раза превышает величину, рассчитанную теоретически. Аналогичная картина наблюдается при измерении электропроводности электролитов в мицеллярных растворах или гелях [75, 76] и диффузии инертных газов в растворах полимеров [77]. По-видимо-му, вязкие силы действуют на ион не так, как они действуют на макроскопическую сферу. В противоположность модели Эйнштейна - [c.32]
Энтропия, энтальпия и удельная теплоемкость для метилового-и этилового спиртов, ацетилена, этилена, пропилена, воды, аммиака, сероводорода и цианистого водорода приводятся по данным Рибо [212] энтропия, энтальпия и свободная энергия для пропилового и бутилового спиртов, этиленгликоля, пропилена и воды — по данным Дяткиной [70]. Сведения относительно энергии образования непредельных углеводородов можно получить в работах Текера, Фолькинса и Миллера [257] и Фрэнсиса и Клейншмидта [85]. [c.191]
chem21.info
Этиленгликоль - это... Что такое Этиленгликоль?
Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—Ch3—Ch3—OH — простейший представитель полиолов (многоатомных спиртов).
В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу[1].История открытий и производства
Этиленгликоль впервые был получен в 1859 французским химиком Вюрцом из диацетата этиленгликоля омылением гидроксидом калия и в 1860 гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Южного Чарлстона (западная Вирджиния, США) компанией "Carbide and Carbon Chemicals Co." К 1929 году этиленгликоль использовался практически всеми производителями динамита. В 1937 кампания Carbide начало первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются этиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −45 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
-
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксалана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора(толуолсульфоновой кислоты, насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
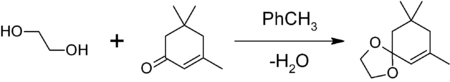
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана[2] или комплекса диметилсульфат-ДМФА[3] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.
- В качестве криопротектора
- Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8- 6,4 % (по объему). Требования безопасности Этиленгликоль горюч, по степени воздействия на организм относится к веществам 3-го класса опасности. Этиленгликоль токсичен. Летальная доза при однократном пероральном употреблении составляет 100—300 мл этиленгликоля (1,5-5мл на 1 кг массы тела)[4]. Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол (англ. Fomepizole)[5].
См. также
Примечания
Ссылки
dal.academic.ru