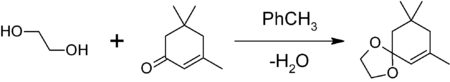
Отчет по работе. Вода cuso4
Безводный сульфат меди - MEL Chemistry
Реагенты
Безопасность
- Перед началом опыта наденьте защитные перчатки и очки.
- Проводите эксперимент на подносе.
- При проведении опыта держите поблизости ёмкость с водой.
- Поместите горелку на пробковую подставку. Не прикасайтесь к горелке сразу после завершения опыта − подождите, пока она остынет.
Общие правила безопасности
- Не допускайте попадания химических реагентов в глаза или рот.
- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.
- Храните экспериментальный набор в месте, недоступном для детей младше 12 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.
- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.
Информация о первой помощи
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым. Немедленно обратитесь к врачу.
- В случае проглатывания промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химический реагент и контейнер от него.
- В случае травм всегда обращайтесь к врачу.
Рекомендации для родителей
- Неправильное использование химических реагентов может вызвать травму и нанести вред здоровью. Проводите только указанные в инструкции эксперименты.
- Данный набор опытов предназначен только для детей 12 лет и старше.
- Способности детей существенно различаются даже внутри возрастной группы. Поэтому родители, проводящие эксперименты вместе с детьми, должны по своему усмотрению решить, какие опыты подходят для их детей и будут безопасны для них.
- Родители должны обсудить правила безопасности с ребенком или детьми перед началом проведения экспериментов. Особое внимание следует уделить безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Перед началом экспериментов очистите место проведения опытов от предметов, которые могут вам помешать. Следует избегать хранения пищевых продуктов рядом с местом проведения опытов. Место проведения опытов должно хорошо вентилироваться и находиться близко к водопроводному крану или другому источнику воды. Для проведения экспериментов потребуется устойчивый стол.
- Вещества в одноразовой упаковке должны быть использованы полностью или утилизированы после проведения одного эксперимента, т.е. после открытия упаковки.
Часто задаваемые вопросы
Синие кристаллы не белеют. Что делать?
Прошло 10 − 15 минут, но кристаллы сульфата меди CuSO4 не белеют? Похоже, что-то не так с нагреванием формочки. Проверьте, горит ли свеча. Не забудьте, что формочка должна стоять по центру пламярассекателя, а свеча – по центру горелки.
Не перепачкайтесь!
Будьте внимательны: пламя свечи достаточно сильно коптит дно формочки. Оно быстро становится чёрным, и об него легко испачкаться.
Не заливайте водой!
Не заливайте алюминиевую формочку с сульфатом меди водой! Это может привести к протеканию бурных процессов: алюминий будет восстанавливаться, выделяя газ водород. Подробнее об этой реакции вы можете узнать в научном описании эксперимента (раздел «Что произошло»).
Другие эксперименты
Пошаговая инструкция
- Поместите три свечи в горелку для сухого горючего и зажгите их. Накройте горелку пламярассекателем, а сверху — фольгой.
- Поставьте на фольгу алюминиевую формочку. Высыпьте в нее одну большую ложку кристаллогидрата сульфата меди CuSO4·5h3O.
- Следите за изменением цвета кристаллов : через 5 минут синие кристаллы станут голубыми, а еще через 10 — белыми.
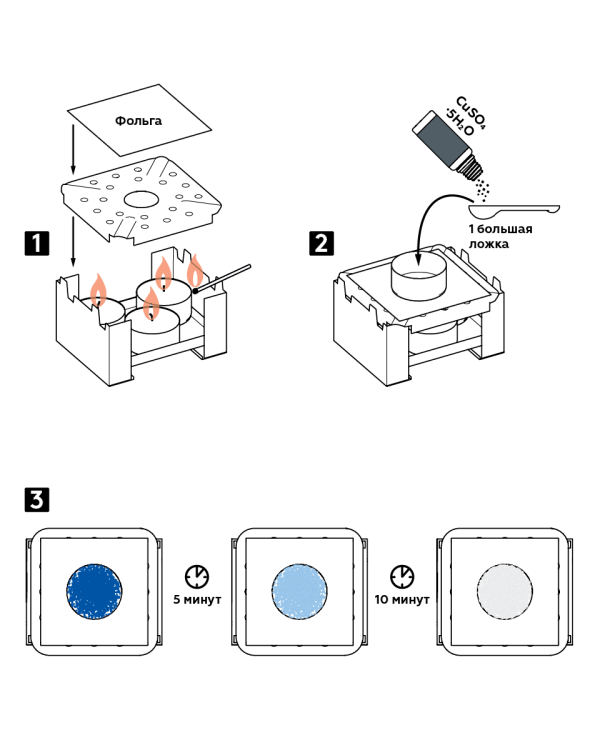
Ожидаемый результат
При нагревании вода, входящая в состав гидрата сульфата меди, покидает кристаллы и испаряется. В результате получается безводный сульфат меди белого цвета.
Утилизация
Утилизируйте твёрдые отходы эксперимента вместе с бытовым мусором.
Что произошло
Почему меняется цвет сульфата меди?
Всякое изменение окраски говорит нам о том, что строение вещества поменялось, ведь именно оно отвечает за само присутствие цвета. Из формулы исходного сульфата меди CuSO45h3O видно, что, кроме самого сульфата CuSO4, в составе этого синего кристаллического вещества есть ещё и вода. Такие твёрдые вещества, в составе которых есть молекулы воды, называют ещё гидратами*.
Вода особым образом связана с сульфатом меди. Когда мы нагреваем этот гидрат, вода удаляется из него, почти как из чайника с кипящей водой. При этом разрушаются связи молекул воды с сульфатом меди. Это и проявляется в изменении окраски.
Узнать больше
Начнём с того, что молекулы воды являются полярными, то есть неоднородными с точки зрения распределения зарядов. Как это понимать? Дело в том, что с одной стороны молекулы есть небольшой избыток положительного заряда, а с другой – отрицательного. Эти заряды в сумме дают ноль – ведь молекулы, как правило, не заряжены. Но это не мешает некоторым их частям нести на себе положительный и отрицательный заряды.
По сравнению с водородом, атомы кислорода лучше притягивает к себе отрицательно заряженные электроны. Поэтому с его стороны в молекуле воды концентрируется отрицательный заряд, а с другой стороны – положительный заряд. Такое неравномерное распределение зарядов делает её молекулы диполями (от греч. «dis» – два, «polos» – полюс). Эта «двуликость» воды позволяет ей легко растворять такие соединения, как NaCl или CuSO4, ведь они состоят из ионов (положительно или отрицательно заряженных частиц). Молекулы воды могут взаимодействовать с ними, поворачиваясь к положительно заряженным ионам своей отрицательно заряженной стороной (то есть атомом кислорода), а к отрицательно заряженным ионам – положительно заряженной стороной (то есть атомами водорода). И все частицы чувствуют себя весьма комфортно друг с другом. Именно поэтому соединения, которые состоят из ионов, обычно хорошо растворяются в воде.
Интересно, что при кристаллизации многих соединений из водных растворов такое взаимодействие отчасти сохраняется и в кристалле, в результате чего образуется гидрат. Ионы меди, как мы видим из всех опытов данного набора, сильно изменяют свою окраску в зависимости от того, какими частицами они окружены.
И раствор сульфата меди, и гидрат CuSO4*5h3O имеют примерно одинаковый насыщенный синий цвет, что может говорить нам о том, что ионы меди в обоих случаях находятся в одинаковом или по крайней мере похожем окружении.
И действительно, в растворе ионы меди окружены шестью молекулами воды, тогда как в гидрате ионы Cu2+ окружены четырьмя молекулами воды и двумя сульфат-ионами. Ещё одна молекула воды (ведь речь идёт о пентагидрате) остаётся связанной с сульфат-ионами и другими молекулами воды, что во многом напоминает её поведение в насыщенном (то есть максимально концентрированном) растворе сульфата меди.
Когда мы нагреваем гидрат, перед молекулами воды встаёт выбор. С одной стороны, есть замечательные ионы меди – вполне приятные и симпатичные соседи. Да и сульфат-ионы тоже весьма приличная компания. С другой стороны, какая молекула воды не мечтает о свободном полёте и познании неизвестных далей? Когда температура повышается, обстановка в гидрате накаляется, и компания видится уже не столь приличной, как хотелось бы молекулам воды. Да и энергии у них становится больше. А потому при ближайшей возможности они покидают сульфат меди, который в самом деле превратился в сущий ад.
Когда вся вода из гидрата испаряется, в окружении ионов меди остаются только сульфат-ионы. Это приводит к тому, что окраска вещества переходит из синей в белую.
Можно ли вернуть синий цвет?
Да, можно. В окружающем нас воздухе достаточно много воды в парообразном состоянии. Да и мы сами выдыхаем пары воды – вспомните, как запотевает стекло, если на него подышать.
Если температура сульфата меди вновь стала комнатной, вода может «оседать» на нём почти так же, как на стекле. При этом она будет вновь особым образом связываться с сульфатом меди и постепенно возвращать ему синий цвет.
Можно и ускорить этот процесс. Если поместить высушенный сульфат меди вместе со стаканом воды в одну закрытую ёмкость, вода будет «перескакивать» к сульфату меди из стакана, переходя по воздуху в виде пара. Следует, однако, предупредить, что для этого опыта необходимо переместить сульфат меди из алюминиевой посуды в стеклянную, так как влажный сульфат меди будет активно взаимодействовать с металлическим алюминием:
3CuSO4 + 2Al → Al2(SO4)3 + 3Cu
Сама по себе эта реакция не сильно испортит картину. Однако она разрушит защитную оболочку Al2O3 вокруг алюминия. Последний, в свою очередь, бурно реагирует с водой:
Al + 6h3O → Al(OH)3 +3h3↑
Почему часть сульфата может почернеть?
Если перестараться с нагреванием, то мы можем обнаружить ещё один переход окраски: белый сульфат меди темнеет.
В этом нет ничего удивительного: мы видим начало термического разложения (распада на части под воздействием температуры) сульфата меди:
2CuSO4 → 2CuO + 2SO2↑ + O2↑
При этом образуется оксид меди CuO чёрного цвета.
Узнать больше
В химии действует общее правило: если атомы, которые входят в состав твёрдого вещества, могут образовывать газообразные продукты, то при нагревании почти наверняка произойдёт его разложение с образованием этих самых газов.
Например, атомы серы S и кислорода O, входящие в состав сульфата меди, могут образовывать газообразные оксид серы SO2 и молекулярный кислород O2. А теперь вернёмся к уравнению реакции термического разложения сульфата меди: 2CuSO4 → 2CuO + 2SO2↑ + O2↑
Как мы видим, именно эти газы и выделяются, если сульфат меди хорошенько погреть.
Развитие эксперимента
Как заставить сульфат меди снова стать синим?
На самом деле это очень даже несложно! Есть несколько вариантов действий.
Во-первых, вы можете просто пересыпать обезвоженный сульфат в пластиковую ёмкость (например, чашку Петри) и оставить её на открытом воздухе. Сульфат будет работать как осушитель и постепенно поглощать воду из воздуха. Через некоторое время он станет светло-голубым, а затем – синим. Это значит, что состав его кристаллов вновь CuSO4*5h3O. Этот вариант является самым простым, однако у него есть один минус: развитие эксперимента таким образом может занять несколько суток.
Во-вторых, можно ускорить процесс. Удобнее всего снова воспользоваться чашкой Петри, но уже обеими её частями. В чашку высыпьте весь (или часть) белый сульфат меди. Рядом, на дно чашки, добавьте пару капель воды. Следите, чтобы вода не попала на сульфат (иначе это было бы слишком просто!). Теперь накройте чашку Петри её крышкой. Через несколько часов сульфат снова посинеет. В этот раз превращение занимает меньше времени, так как мы фактически создали «камеру» с избытком паров воды внутри.
Третий способ – по каплям добавить воду прямо в белый сульфат меди. И снова наиболее удобно использовать чашку Петри, хотя можно взять и обычный одноразовый пластиковый стаканчик из Стартового набора. Не добавляйте слишком много воды – ваша задача не растворить сульфат меди, а насытить его влагой!
Наконец, четвёртый вариант – растворить полученный безводный сульфат меди. Сделайте это в одноразовом пластиковом стаканчике. Вы получите голубой раствор. Кстати, если дать воде из этого раствора медленно испариться (при комнатной температуре), в стаканчике образуются синие кристаллы CuSO4*5h3O.
Итак, есть много способов вернуть синюю окраску кристаллам сульфата меди. Самое главное, что эта реакция обратима, а значит, можно повторять опыт снова и снова, меняя способы получения синего кристаллогидрата сульфата меди.
Важно помнить, что не следует проводить развитие эксперимента в алюминиевой формочке. Чтобы узнать почему, читайте ответ на вопрос «Что произошло? – Можно ли вернуть синий цвет?».
Это интересно
Что такое кристаллогидраты и почему они образуются?
Многие соли, то есть соединения, состоящие из положительно заряженных ионов металлов и самых разных отрицательно заряженных ионов, могут образовывать с водой особые аддукты (от англ. to add – складывать)– гидраты или кристаллогидраты. По сути аддукт – это сложенные вместе части. Многие соединения называют так, либо для простоты и удобства, либо чтобы показать, что они состоят из пары составных частей.
В данном случае рассматриваемые аддукты отличаются от обычных солей тем, что в их состав входит вода. Такую воду называют ещё кристаллизационной. И действительно, она ведь входит в состав кристалла! Обычно такое случается при кристаллизации солей из водных растворов. Но почему же вода остаётся в составе кристалла?
На это есть две основные причины. Как известно, хорошо растворимые в воде соединения (а это как раз многие соли) в ней диссоциируют, то есть распадаются на положительно и отрицательно заряженные ионы. Так вот, первая причина заключается том, что эти ионы находятся в особом окружении, состоящем из молекул воды. Когда происходит концентрирование раствора (в нашем случае, когда вода постепенно испаряется), эти ионы собираются вместе и образуют кристалл. При этом зачастую они в некоторой степени сохраняют своё окружение, фактически забирая с собой в кристалл молекулы воды.
Однако не все соли склонны образовывать гидраты. Например, хлорид натрия NaCl всегда кристаллизуется без воды в своём составе, хотя в растворе каждый ион находится в окружении пяти-шести молекул h3O. Поэтому необходимо упомянуть и вторую причину. Подобно людям, каждый ион ищет себе местечко поуютнее. Оказывается, в некоторых случаях этот «комфорт» намного лучше обеспечивается именно молекулами воды, а не ионами-«антиподами» (как в случае с Na+ и Cl-). То есть связи ионов с молекулами воды оказываются прочнее. Такое свойство больше характерно для положительно заряженных ионов, и в большинстве кристаллогидратов вода находится именно в их окружении. Это становится возможным благодаря электростатическому притяжению (притяжение между «+» и «–») между ионами и молекулой воды, в которой на атоме кислорода есть небольшой отрицательный заряд, а около атомов водорода – положительный.
Все кристаллогидраты разлагаются при нагревании. При температурах выше 100oC вода существует в виде пара. Именно при таких условиях молекулы воды склонны покидать кристаллогидрат.
melscience.com
Сульфат меди(II) - это... Что такое Сульфат меди(II)?

 Кристаллогидрат сульфата меди CuSO4 · 5h3O
Кристаллогидрат сульфата меди CuSO4 · 5h3O Сульфат меди(II) (CuSO4) — медная соль серной кислоты, белые кристаллы, хорошо растворимые в воде.
Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO4 · 5h3O — медный купорос.Получение
В промышленности получают растворением Cu и медных отходов в разб. h3SO4 при продувании воздуха; растворением CuO в h3SO4; сульфатизирующим обжигом сульфидов Cu; как побочный продукт электролитич. рафинирования Cu.


В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании:

Температура не должна превышать 60 градусов Цельсия, так как образуется побочный продукт:

Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди (II) серной кислотой:

Очистка
Обычно технический сульфат меди загрязнен сульфатом железа (II). Реактив Ч. Д. А. не содержит ионов Fe2+. Реактив загрязнен изоморфически и его невозможно очистить простой перекристаллизацией. В нашем случае можно окислить Fe2+ до Fe3+ кипячением полученного раствора сульфата меди с PbO2. Fe2(SO4)3 не формирует изоморфическую смесь с сульфатом меди. После кипячения раствор фильтруют. А потом кристаллизацией получают чистый сульфат меди.
Физические свойства
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO42− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.

Растворимость CuSO4, г/100 г h3O
Термическое воздействие
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4 · 3h3O (этот процесс, то есть выветривание, частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO4 · h3O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650 °C:
![\mathsf{2CuSO_4 \xrightarrow[]{^ot} 2CuO + 2SO_2 + O_2}](/800/600/http/dic.academic.ru3b263af760ea620184767f698f4678c0.png)
Растворимость
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80-200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5·10−3.
Химические свойства
Диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах cульфат меди (II) так же, как и все растворимые соли, диссоциирует в одну стадию:

Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов.

Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:


Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu2+ и SO42-


Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6h3O.
Ион Cu2+ окрашивает пламя в зеленый цвет.
Применение

 Кристаллы сульфата меди (II), выращенные в домашних условиях
Кристаллы сульфата меди (II), выращенные в домашних условиях 
 Монокристалл сульфата меди (II), выращенный в домашних условиях
Монокристалл сульфата меди (II), выращенный в домашних условиях Сульфат меди(II) — наиболее важная соль меди — часто служит исходным сырьём для получения других соединений. Например, гидроксида меди (II) — Cu(OH)2 — вещества, необходимого для качественных реакций на глюкозу, глицерин.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят обезвоживание этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордоской смеси с известковым молоком — от грибковых заболеваний и виноградной тли. Для этих целей сульфат меди (II) имеется в розничной торговле.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Токсикология
Токсикологические данные
Сульфат меди (II) относится к классу опасности 1 (малоопасное вещество), как вещество, содержащее сульфат-ион. С другой же стороны, на стограммовой упаковке сульфата меди, поступающей в розничную продажу, указан класс опасности 2 (высокоопасное вещество). Смертельная доза медного купороса составляет от 8 до 30 граммов для взрослого человека перорально (через рот)[1][2] . Летальная доза зависит от состояния здоровья человека, от его массы, от иммунитета именно к данному веществу и от других факторов.
Первая помощь при отравлении
При попадании вещества на кожу необходимо снять его ватой или куском ткани, затем обмыть прохладной водой с мылом. При попадании в глаза необходимо обильно промыть их проточной водой. При попадании через дыхательные пути нужно вывести пострадавшего на свежий воздух, прополоскать рот водой. При попадании в желудочно-кишечный тракт необходимо промыть желудок пострадавшего 0,1%-ым раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1-2 ложки, вызвать рвоту, дать мочегонное.
Безопасность
При обращении с сульфатом меди (II) в бытовых условиях стоит быть очень осторожным, иначе можно нанести непоправимый вред здоровью[3]. При приготовлении растворов желательно использовать резиновые или одноразовые полиэтиленовые перчатки, очки, резиновые сапоги и также настоятельно рекомендуется использовать респиратор. Ни в коем случае не использовать пищевую посуду. Приготовление раствора и использование медного купороса стоит производить в отсутствие детей и животных. Во время использования нельзя пить, курить, принимать пищу. После работы лицо и руки вымыть с мылом, прополоскать рот.
Хранить в сухом прохладном месте при температуре от −30 до +30 °C, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте. Запрещается хранение вещества в поврежденной упаковке.
Производители и поставщики
Сульфат меди (II), как средство от гниения, сорняков и т. д. находится в розничной продаже в супермаркетах и хозяйственных магазинах. Чаще всего на прилавках можно найти упаковку весом в 100 граммов. Производство данной продукции осуществляется компанией ЗАО Фирма «Август». Также медный купорос можно найти в химических магазинах разной фасовки. Обычно это пластиковые банки весом в 1 кг или полиэтиленовые мешки весом в 500 г.
Нахождение в природе
В природе изредка встречается минерал халькантит, состав которого близок к CuSO4 ∙ 5h3O
См. также
Примечания
dic.academic.ru
Отчет по работе
должен содержать:
- теоретическое обоснование экспериментальной части работы,
- методику эксперимента, включающую схему установки,
- таблицу 2 наблюдений,
- графические зависимости температуры от времени, построенные на миллиметровой бумаге
- расчет теплоты химической реакции,
- расчет относительной и абсолютной погрешности измерений.
Относительная погрешность измерений не должна превышать 5%.
Лабораторная работа 6 определение содержания кристаллизационной воды в CuSo4xh3o
Цель работы: расчет содержания воды в исследуемом образце кристаллогидрата сульфата меди.
Приборы и реактивы: калориметр, мешалка, термометр, ампула, фильтровальная бумага, соли CuSO4h3O, CuSO43h3O и CuSO45h3O.
Теоретическое обоснование
Сульфат меди при соприкосновении с водой образует три формы гидратов: CuSO4h3O, CuSO43h3O и CuSO45h3O. Между ними возможны следующие химические равновесия:
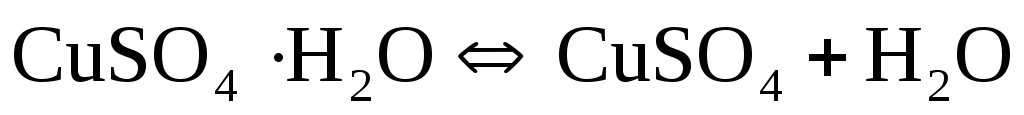 (15)
(15)
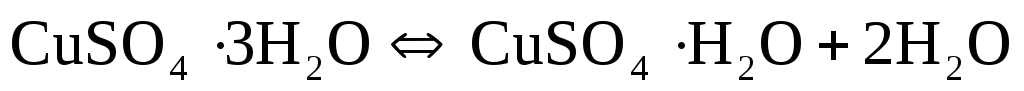 (16)
(16)
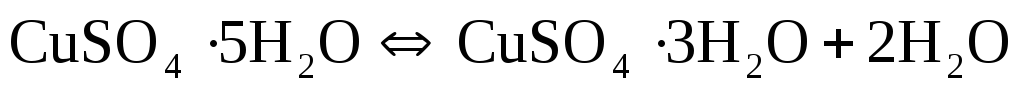 (17)
(17)
Если в соприкосновении с влажным воздухом хранится безводный CuSO4, то в системе устанавливается равновесие (15), (16) или (17), в зависимости от давления водяных паров в системе. Количество воды в твёрдом CuSO4xh3O или соотношение количеств гидратов разных форм можно установить калориметрически. Для этого нужно знать теплоты растворения безводного сульфата меди и всех форм гидратов (табл. 3) и определить экспериментально теплоту растворения одного грамма исследуемого образца.
Таблица 3.3
Интегральные теплоты растворения сульфата меди и его гидратов в воде
| вещество | CuSO4 | CuSO4h3O | CuSO43h3O | CuSO45h3O |
| теплота растворения 1г соли в 50 мл воды, Дж/г | 389,11 | 217,57 | 71,13 | -46,02 |
На основании этих данных и экспериментально определённой теплоты растворения одного грамма исследуемой соли CuSO4xh3O, равной q, можно установить, какой тип равновесия имеет место в данном случае. Величина q зависит от того, в каком соотношении в исследуемом образце смешаны гидраты CuSO4. Очевидно, что если q находится в пределах 389…218 Дж, то в системе содержатся CuSO4 и CuSO4h3O. Если q находится в пределах от 218 до 71 Дж, то равновесие описывается уравнением (16), соответственно, значению q = 71…–46,02 Дж отвечает равенство (17).
Далее, составив соответствующим образом пропорции, можно вычислить содержание воды в исследуемом образце CuSO4xh3O. Исходя из того, что 1 г образца состоит из двух форм гидрата сульфата меди: a молей CuSO4xh3O и b молей CuSO4yh3O можно составить первое уравнение из системы линейных уравнений:
1 г=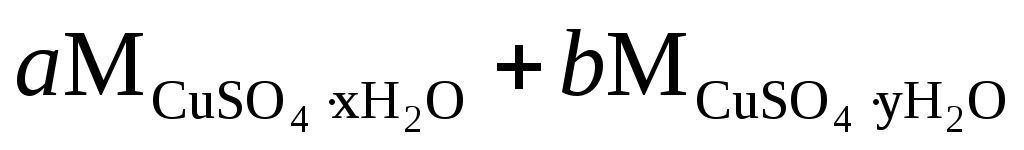 .
.
qx=  .
.
Теплота растворения 1 г образца qx складывается из теплот растворения a молей CuSO4xh3O и b молей CuSO4yh3O (второе уравнение), где 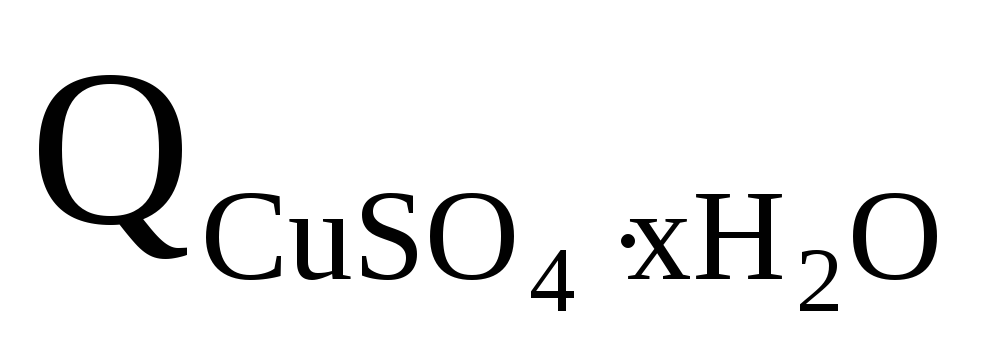 и
и – теплоты растворения одного моля соответствующих веществ (справочные значения).
– теплоты растворения одного моля соответствующих веществ (справочные значения).
Решением составленной системы уравнений находят соотношение количеств различных гидратов, а затем общее содержание кристаллизационной воды.
Методика эксперимента
Проведение эксперимента аналогично таковому в работе 3.
Отчет по работе
должен содержать:
- теоретическое обоснование экспериментальной части работы,
- методику эксперимента, включающую схему установки,
- таблицу 2 наблюдений,
- графические зависимости температуры от времени, построенные на миллиметровой бумаге,
- расчет теплоты химической реакции,
- расчет относительной и абсолютной погрешности измерений.
Относительная погрешность измерений не должна превышать 5%.
Лабораторная работа 7
ОПРЕДЕЛЕНИЕ ТЕПЛОТ ДИССОЦИАЦИИ СЛАБЫХ
КИСЛОТ И ОСНОВАНИЙ
Цель работы: расчет теплового эффекта реакции диссоциации по экспериментальным данным.
Приборы и реактивы: калориметр, мешалка, термометр, ампула, фильтровальная бумага, растворы 0,5н Ch4COOH и HCl, 1н NaOH.
Теоретическое обоснование
Определение теплоты диссоциации слабых кислот и щелочей основано на том, что теплота нейтрализации сильной кислоты сильной щелочью равна теплоте образования молекулы воды из H+ и OH– Q1, а теплота нейтрализации слабой кислоты сильной щелочью Q3 равна сумме теплот двух процессов: 1) теплоты диссоциации Q2 слабой кислоты; 2) теплоты образования воды из ионов Q1. Отсюда следует, что
Q3 = Q1 + Q2 (17)
Q3 определяется из опыта по определению теплоты нейтрализации слабой кислоты;
Q1 – из экспериментальных данных по теплоте нейтрализации сильной кислоты.
Методика эксперимента
Эксперимент делится на два опыта, в первом определяется теплота смешения слабой кислоты со щелочью, во втором – сильной кислоты со щелочью.
1) Для определения теплоёмкости системы в калориметр наливают 150 мл 1 н раствора NaOH; в ампулу помещают 8 мл 0,5 н раствора Ch4COOH и проводят измерение с использованием электрического нагревателя, как показано в работе 2. Затем, не выключая мешалку, разбивают ампулу и измеряют изменение температуры при протекании реакции. По этим данным определяют значение
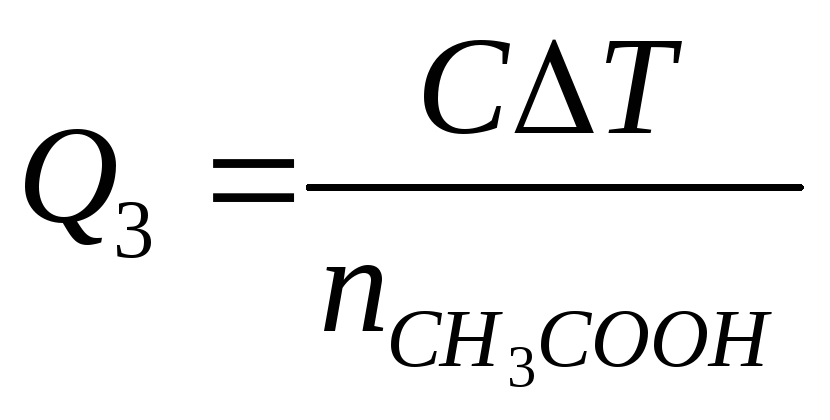 , Дж/моль. (18)
, Дж/моль. (18)
2) Опыт проводится аналогично первому, включая новое определение теплоёмкости, но в ампулу заливают 8 мл 0,5 н раствора HCl. По экспериментальным данным определяется величина Q реакции нейтрализации, Дж/моль.
Теплота диссоциации уксусной кислоты
Q2 = Q3 – Q1, (19)
где: Q3 – теплота нейтрализации Ch4COOH, Q1 – теплота нейтрализации HCl
Q1 = Q – Q4 – Q6, (20)
где: Q4 – теплота разбавления одного моля HCl от начальной концентрации 0,5 моль/л до конечной в 158 мл общего объёма; Q5 – теплота разбавления 150 мл NaOH до 158 мл.
Q3 = Q1 – Q6 – Q5; (21)
где Q6 – теплота разбавления 8 мл 0,5 н раствора уксусной кислоты до объёма 158 мл.
Для определения Q4, Q5 и Q6 необходимо использовать справочные данные.
studfiles.net