Популярная библиотека химических элементов. Вода цезий
Цезий взаимодействие с водой - Справочник химика 21
Гидриды рубидия и цезия являются чрезвычайно химически активными веществами. Они воспламеняются на воздухе, содержащем следы влаги, самовоспламеняются в атмосфере хлора и фтора, взаимодействуют с бромом (КаН с бромом на холоду не реагирует). В отличие от гидридов натрия и калия гидриды рубидия и цезия взаимодействуют с сероуглеродом. При нагревании с азотом или аммиаком гидриды образуют амиды, а с фосфором — фосфиды рубидия и цезия. Важная в практическом отношении реакция гидридов с водой протекает очень бурно с выделением водорода [c.82] Химическая активность цезия необычайна. Он очень быстро реагирует с кислородом и не только моментально воспламеняется на воздухе, но способен поглощать малейшие следы кислорода в условиях глубокого вакуума. Воду он бурно разлагает уже при обычной температуре при этом выделяется много тепла, и вытесняемый из воды водород тут же воспламеняется. Цезий взаимодействует даже со льдом при — 116° С. Его хранение требует большой предосторожности. [c.96]В- А, I Лескова (1947 г.) можно считать, что взаимодействие сравнительно большого катиона рубидия (или цезия) с водой и разными неводными растворителями очень мало. Поэтому химический потенциал этого иона и, следовательно, и гальвани-потенциал на границе рубидий/раствор для всех сред примерно одинаковы. Тогда, если потенциалы всех остальных электродов в каждой среде относить к рубидиевому электроду сравнения, в первом приближении получают универсальную шкалу потенциалов. [c.68]
При взаимодействии калия с водой происходит воспламенение выделяющегося водорода. Реакция рубидия и цезия с водой сопровождается взрывом. [c.211]
Щелочные металлы — калий, натрий, рубидий и цезий— взаимодействуют с водой с выделением водорода и значительного количества тепла [c.76]
Калий и его аналоги располагаются в самом начале ряда напряжений. Взаимодействие калия с водой сопровождается самовоспламенением выделяющегося водорода, а взаимодействие рубидия и цезия — даже взрывом. [c.491]
Объясните резкое возрастание активности взаимодействия щелочных металлов с водой при переходе от лития к цезию. Для ответа на вопрос используйте данные таблицы 5 (см. приложение), причем не только такие, как изменение энтальпии взаимодействия щелочных металлов с водой и гидратации их ионов, но и такие физические характеристики, как температура плавления и плотность. [c.159]
Килограмм равен массе международного прототипа килограмма Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в 0,012 кг углерода-12 Секунда равна 9192631770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133 Кельвин равен 1/273,16 части термодинамической температуры тройной точки воды. Это наименование и его обозначение применяются также для выражения интервала и разности температур Ампер равен силе неизменяющегося тока, который при прохождении по двум параллельным прямолинейным проводникам бесконечной длины и ничтожно малой площади сечения, расположенным в вакууме на расстоянии 1 м один от другого, вызвал бы на участке проводника длиной 1 м силу взаимодействия, равную 2-10 Н Ньютон равен силе, сообщающей телу массой 1 кг ускорение 1 м/с в направлении действия силы [c.477]
Приведенные данные показывают, что ряд свойств как физических, так и химических закономерно изменяется с возрастанием порядкового номера элемента и увеличением числа застраиваемых электронных слоев п в атоме (соответственно номеру периода, в котором расположен данный щелочной металл). Так, радиус атома возрастает, а энергия ионизации падает. В связи с этим химическая активность повышается от Ы к Сз и Рг. Это отчетливо проявляется в процессе окисления металла. Так, литий сравнительно стоек, а, например, цезий самовоспламеняется на воздухе. Литий спокойно взаимодействует с водой, калий при этом самовоспламеняется, а у цезия реакция идет со взрывом. Наиболее активен щелочной металл франций, энергия ионизации его атома наименьшая (3,98 эв). Электролитическая диссоциация гидроксидов ЭОН (щелочей) возрастает в той же последовательности (от ЫОН к СзОН и РгОН). [c.404]
Эта реакция экзотермична и за счет выделяющегося тепла происходит воспламенение водорода и металла, что характерно для наиболее активных калия, рубидия и цезия. Реакция с натрием протекает менее интенсивно и сопровождается лишь плавлением металла на поверхности воды. Литий, как наиболее слабый восстановитель, реагирует с водой еще менее активно, чем натрий, что объясняется наименьшим межатомным расстоянием в кристаллической решетке (см. рис. 7), хотя по величине электродного потенциала литий стоит впереди других щелочных металлов. Водяные пары подобным же образом взаимодействуют со щелочными металлами. [c.36]
Ионы, имеющие большие заряды [железо (III), алюминий], характеризуются и значительными величинами энтальпии и энтропии. Теоретическое вычисление теплот гидратации связано с учетом целого ряда слагаемых. После первых, грубо приближенных расчетов по Борну было сделано много попыток так или иначе улучшить теоретический метод. К. П. Мищенко и А. М. Сухотин, исходя из предположения, что эффективный радиус молекулы воды в гидратной оболочке равен 0,193 нм, предложили метод расчета, в котором были приняты во внимание экзоэффекты взаимодействия иона с жесткими диполями воды, а также ориентационной и деформационной поляризации диполей воды, дисперсионные силы между ионом и молекулами воды, взаимное отталкивание диполей в гидратной сфере, отталкивание иона и диполей при перекрытии их электронных оболочек, поляризация растворителя гидратным комплексом и взаимодействие между водой и гидратным комплексом, отвечающее экзоэффекту. Большое число факторов, принятых во внимание в этих расчетах, делает их результаты наиболее надежными. Между прочим указанные авторы пришли к выводу, что тепловое движение не может существенно влиять на координационные числа гидратации вероятность того, что данная молекула в гидратном слое покинет его и оставит свободное место в гидратной оболочке иона, колеблется по порядку величины от 10 (ион лития) до 10 (ион цезия), т. е. ничтожно мала. [c.255]
Но нами так и не получен ответ на вопрос 7-5, почему же при переходе от лития к цезию реакционная способность взаимодействия с водой явно возрастает. В табл. 7.5 даны температуры плавления щелочных металлов. Хотя это и не имеет прямого отношения к ответу на вопрос, нарисуйте зависимость температур плавления щелочных металлов от их места в периодической системе. [c.338]
Энтальпии растворения кристаллических гидроокисей в воде численно возрастают при переходе от лития к цезию, т. е. в том же направлении, что и усиление реакционной способности взаимодействия металла с водой. [c.363]
Активность взаимодействия металлов с водой (и другими веществами) увеличивается от лития к цезию. Щелочные металлы также активно реагируют с кислотами. [c.119]
Рубидий и цезий — самые реакционноспособные металлы их нормальные потенциалы имеют весьма высокое отрицательное значение (—2,93). Соединяются с кислородом мгновенно, воспламеняясь взаимодействие начинается при весьма низком давлении основные продукты реакции — перекисные соединения. С водой реагируют чрезвычайно бурно, образуя гидроокиси МеОН и вытесняя водород, который моментально вспыхивает. Эта реакция с заметной скоростью протекает даже ниже —100° [6]. Таким образом, они вытесняют водород не только из жидкой воды, но и изо льда. [c.84]
Активность взаимодействия металлов с водой увеличивается от лития к цезию. Так, калпй при взаимодействии с водой воспламеняется, а рубидий и цезий реагируют со взрывом. [c.242]
Водород самовоспламеняется только в том случае, если кусок металла по объему больше горошины (особенно для натрия). Взаимодействие указанных металлов с водой иногда сопровождается взрывом с разбрызгиванием расплавленного металла. Иэ указанных металлов наибольшей активностью обладают рубидий, цезий и калий. [c.120]
Восстановительная способность щелочных металлов настолько велика, что они вытесняют водород даже из воды, образуя сильные основания, например 2Ыа- -2Н20 = h3 + 2NaOH. Калий с водой реагирует с воспламенением выделяющегося водорода. Взаимодействие рубидия и цезия с водой сопровождается взрывом. Щелочные металлы окисляются и водородом, образуя гидриды, например 2К+Н2 = 2КН. У атомов элементов первой основной подгруппы валентность в основном состоянии и в соединениях совпадает они, имея по одному неспаренному электрону, одновалентны. Степень окисления их в основном состоянии равна О, а в соединениях +1. [c.102]
Среди веществ с по,чярными молекулами лучше других, за исключением аммиака, изучена адсорбция воды. Начальная изостерическая теплота адсорбции очень высокая, но уменьшается с увеличением заполнения. Опубликовано несколько работ, в которых тип обменного катиона в цеолитах X сопоставляется с теплотой адсорбции, служащей мерой спехщфичности. В работе Джигит и Киселева [129] показано, что калориметрически измеренные дифференциальные теплоты адсорбции воды зависят от энергии взаимодействия молекул как с обменными катионами, так и с отрицательными ионами кислорода каркаса. На рис. 8.25 представлена зависимость теплоты адсорбции воды от радиуса катиона при разных степенях заполнения полостей. Благодаря большому радиусу ионов калия, рубидия и цезия, взаимодействие молекул воды с катионами и ионами кислорода каркаса уменьшается. При больших величинах адсорбции молекулы воды взаимодействуют между собой с образованием водородных связей. Кроме того, с увеличением содержания в структуре воды катионы изменяют свои положения они гидратируются и смещаются в бо.льшие полости. [c.682]
Цезий взаимодействует и с углеродом. Только самая совершенная модификация углерода — алмаз — в состоянии противостоять его натиску . Жидкий расплавленный цезий и его пары разрыхляют сажу, древесный уголь и даже графит, внедряясь между атомами углерода и образуя своеобразные, довольно прочные соединения золотисто-желтого цвета, которые в пределе, по-видимому, отвечают составу СбСзз. Они воспламеняются на воздухе, вытесняют водород из воды, а при нагревании разлагаются и отдают весь поглощенный цезий. [c.96]
Жданов и сотр. [24] установили, что с увеличением радиуса катиона уменьшается частота колебаний ОН-групп, и объяснили эту зависимость поляризующим влиянием катионов на молекулы адсорбированной воды. Киселев и Лыгин обнаружили линейную зависимость между изменением частоты валентных колебаний и ионным радиусом катиона. Киселев и сотр. [120] исследовали также спектры молекул воды, адсорбированной на цеолитах Li-, К-, Na- и sX при различном заполнении. Они так же, как Берч и Хэбгуд, наблюдали в спектрах всех цеолитов, за исключением цезиевой формы, узкую полосу при 3700 см и широкие полосы вблизи 3650—3000 см . При адсорбции воды в количестве двух молекул на большую полость чувствительной к природе катиона оказалась полоса деформационных колебаний воды при 1650 см , положение которой наиболее сильно менялось при переходе от KY (1660 см ) до NaY (1643 см ). Однако при больших заполнениях эта полоса находилась при 1640—1645 см , и ее положение от природы катиона не зависело. В спектре цезиевого цеолита X в отличие от литиевой, натриевой и калиевой форм узких полос, свидетельствующих о сильном взаимодействии воды с катионами, не обнаружено в спектре этого цеолита наблюдается только широкая полоса. Вероятно, катионы цезия слабее связаны с молекулами воды и оба атома водорода в молекуле воды вступают во взаимодействие с атомами кислорода каркаса. [c.226]
Щелочные металлы энергично взаимодействуют с водой, вытесняя из нее водород и образуя соответствующие гидроксиды. Активность взаимодействия этих металлов с водой возрастает по мере увеличения порядкового номера элемента. Так, литий реагирует с водой без плавления, иатрий — плавится, калий — самовозгорается, взаимодействие рубидия и цезия протекает еще более энергично. [c.127]
РУБИДИЙ (Rubidium, название от характерных линий спектра, лат. rubidus — темно-красный) Rb — химический элемент I группы 5-го периода периодической системы элементов Д. И. Менделеева, п. н. 37, ат. м. 85,4678. Природный Р. состоит из двух изотопов, один из которых радиоактивен. Известны 16 искусственных радиоактивных изотонон. Р. открыт в 1861 г. Р. Бунзеном и Г. Кирхгофом спектральным анализом минеральных вод. Получают Р. вместе с цезием из карналлита и лепидолита. Самостоятельных минералов не имеет. Р.— мягкий серебристо-белый металл, химически активен, самовоспламеняется на воздухе, с водой и кислотами взаимодействует со взрывом. В соединениях Р. одновалентен. Среди солей Р. важнейшие галогениды, сульфат, карбонат и некоторые др. Р. применяют для изготовления фотоэлементов, газосветных трубок, сплавов, в которых Р. является газопоглотителем, для удаления следов воздуха из вакуумных ламп соединения Р. применяют в медицине, в аналитической химии и др. [c.216]
В атмосфере хлора и фтора щелочные металлы самовоспламеняются. С жидким бромом литий и натрий реагируют замедленно, остальные металлы — бурно, со взрывом. С иодом взаимодействие протекает менее энергично. Литий с водой взаимодействует спокойно, для натрия наблюдается значительный тепловой эф( зект, но выделяющийся водород обычно не воспламеняется. У калия взаимодействие с водой сопровождается самовоспламенением водорода, рубидий и цезий реагируют с водой со взрывом, вытесняют водород из воды (льда) даже при —108 °С. Щелочные металлы взаимодействуют ие только с водой, но и с другими водородсодержащими соединениями, например со спиртами [c.252]
Взаимодействие калия с водой сопровождается самовоспламенением выделяющегося водорода, а рубия и цезия — взрывом. [c.260]
Эта реакция протекает не для всех щелочных металлов одинаково. Выделение водорода при взаимодействии лития с водой идет спокойно без воспламенения, и сам металл при этом не плавится. Реакция натрия с водой протекает более знергично если натрию дать свободно двигаться по поверхности воды, то водород не загорается в противном случае происходит воспламенение, и пламя окрашивается в характерный для этого металла желтый цвет при этом натрий расплавляется. Взаимодействие калия с водой происходит бурно и сопровождается воспламенением металла. Рубидий и цезий реагируют с водой с сильным взрывом. Таким образом, чем больше порядковый номер атома, т. е. чем дальше от ядра отстоит валентный электрон, тем энергичнее совершается окисление металла, сопровождаемое выделением водорода. [c.233]
При длительном взаимодействии жидкой двуокиси серы с фторидами Св, КЬ, К и Ка (но не по схеме МР 4- ЗОз = МЗОгР образуются соответствующие ф т о р-с у л ь ф и н а т ы, по строению подобные хлоратам. Теплоты образования по приведенной реакции солей цезия, рубидия и калия равны соответственно 23, 21 и 18 ккал/моль. Свободная фторсульфиновая кислота (НЗОзР) характеризуется точкой плавления —84°С, но существует лишь в смеси жидких ЗОз и Нр (полностью смешивающихся друг с другом). При нагревании или под действием воды фторсульфинаты разлагаются. [c.331]
АЯ°298,обрмонк численно уменьшаются при переходе от лития к цезию, тепловые эффекты реакций также уменьшаются в том же направлении. Следовательно, этими данными нельзя объяснить усиление реакционной способности взаимодействия с водой при переходе от лития к цезию. [c.351]
Соединения с кислородом. Рубидий и цезий в зависимости от условий их окисления образуют с кислородом окиси МеаО, перекиси МеаОг, триоксиды Ме4(Ог)з, надперекиси МеОг и озониды МеОз- При сгорании металлов на воздухе или в кислороде образуются МеОа, всегда содержащие примеси Ме4(Ог)з и МедОг. Все упомянутые кислородсодержащие соединения рубидия и цезия энергично взаимодействуют с парами воды и двуокисью углерода из воздуха, а надперекиси и озониды окисляют органические вещества с воспламенением или взрывом, вследствие чего требуют хранения в герметичной таре 26]. Изучены кислородные соединения рубидия и цезия недостаточно. [c.85]
Соединения с азотом. Нитриды МвзЫ — серовато-зеленые или синие, весьма-гигроскопичные и малоустойчивые соединения, на воздухе воспламеняются. Легко взаимодействуют с хлором, серой и фосфором. При нагревании взрываются, выделяя азот [10]. Водой разлагаются — образуется МеОН и аммиак [10]. Могут быть получены в жидком азоте при электрическом разряде между электродами, изготовленными из рубидия или цезия. [c.104]
Взаимодействие самых активных из щелочных металлов — калия, рубидия и цезия — с кислородом приводит к образованию надпероксидов общей формулы ЭО - Это также ионные соединения с сильно выраженными окислительными свойствами. Их взаимодействие с водой и кислотами протекает с выделением Н2О2 и 0 . [c.66]
Вместе с тем, на первый взгляд многие факты противоречат отмеченной закопомерности снижения химической активности от лития к цезию. Известно, что от лития к цезию усиливается способность самовозгорания металла на воздухе (рубидий и цезий воспламеняются без нагревания). Цезий гораздо энергичнее лития взаимодействует с водой. В действительности эти наблюде-шя не противоречат тому, что рубидий и цезий менее активны по отношению к кислороду н воде, чем литий. Несмотря на то, что при окислении и взаимодействии с зодой рубидий и цезий выделяют меньше теплоты, чем 1ИТИЙ, эта энергия достаточна для быстрого плавления )тих металлов (рубидий, цезий и литий плавятся при 39, 18,5 и 179 °С). Расплавленный металл окисляется зна-1ительно быстрее и, наконец, вспыхивает. [c.409]
Физические и химические свойства. Все щелочные металлы серебристо-белого цвета, а ничтожные примеси кислорода придают цезию золотисто-желтую окраску. Натрий и калий легче воды, а цезий почти в два раза тяжелее. Все щелочные металлы мягки, пластичны, в атмосфере сухого воздуха быстро тускнеют. При этом Ка и К образуют оксиды Э2О, а ЕЬ и Сз пероксиды Э2О2. С водой натрий реагирует бурно, калий — со взрывом, а КЬ и Се воспламеняются даже при соприкосновении со льдом. При взаимодействии с влаж- [c.307]
Щелочные металлы. Щелочными называются металлы литий, натрий, калий, рубидий, цезий и франций, т. е. элементы главной подгруппы I группы (см. периодическую систему элементов Д. И. Менделеева). Они так названы потому, что их окислы при взаимодействии с водой образуют сильные щелочи. Р1апример, [c.292]
Устойчивость озонидов щелочных металлов возрастает от литня к цезию. Если озонид лития в чистом виде неизвестен, а озонид рубидия мало устойчив при комнатной температуре, то озонид цезия не обнаруживает признаков разложения при 17— 19° С в течение нескольких дней. Лишь при нагревании до 70—100° С СзОз распадается с образованием окисн и выделением кислорода [102], Озониды рубидия и цезия крайне неустойчивы по отношению к влаге и двуокиси углерода. Они выделяют иод из кислых растворов иодидов. С водой бурно взаимодействуют по реакции [c.88]
Основные методы получения и очистки иодидов рубидия и цезия (нейтрализация карбонатов иодистоводородной кислотой, использование аннонгалогенаатов [184]) аналогичны методам получения и очистки соответствующих хлоридов и бромидов. Для синтеза иодидов рубидия и цезия могут быть также использованы хорошо известные реакции взаимодействия либо гидроокиси и галогена (в данном случае иода) при нагревании (см. раздел Бромиды рубидия и цезия ), либо карбоната (гидрокарбоната) с иодом в присутствии восстановителя (порошок карбонильного железа, перекись водорода и др.). В обоих случаях сухой остаток после выпаривания раствора прокаливают и выщелачивают водой. Рабочие растворы перед кристаллизацией иодидов можно очищать и экстракционным методом, особенно эффективным, когда требуется удалить примеси переходных элементов. В частности [185], для очистки иодидов от примесей железа, марганца, меди, кобальта и никеля (до 5-10 вес.% каждой примеси) водные растворы иодидов последовательно обрабатывают растворами дити-зона (при pH = 7,0—7,5) и о-оксихинолина (при pH = 5—6) в четыреххлористом углероде, а затем после удаления органического растворителя пропускают (для поглощения воднорастворимой части комплексообразователей и ССЦ) через хроматографическую колонку, наполненную послойно AI2O3 и канальной сажей. [c.104]
chem21.info
Химический элемент цезий: характеристика, формула, свойства
Характеристика цезия, его особенности строения и качества, свойственные этому элементу, обязательно проходят в курсе химии. Не только школьники, но и студенты химических специальностей должны знать специфические особенности этого соединения. Применение цезия в настоящее время довольно широкое – но в специфической сфере. Во многом это связано с тем, что при комнатной температуре элемент приобретает жидкое состояние, а в чистом виде практически не встречается. В настоящее время только пять металлов имеют аналогичные качества. Свойства цезия определяют интерес к нему ученых и возможности по применению соединения.

О чем идет речь?
Мягкий металл цезий обозначается в таблице Менделеева символами Cs. Его порядковый номер - 55. Мягкий металл имеет серебристый, золотистый оттенок. Температура плавления – 28 градусов по шкале Цельсия.
Цезий представляет собой щелочной металл, чьи качества и особенности сходны с калием, рубидием. Строение цезия обусловливает повышенную реактивность. С водой металл может реагировать при температуре по шкале Цельсия 116 градусов ниже нуля. Химический элемент цезий имеет высокую пирофорность. Добывается он из поллуцита. Многие радиоактивные изотопы цезия (включая нашедший себе активное применение цезий 137) производятся в ходе переработки отходов, возникающих при функционировании ядерного реактора. Цезий 137 представляет собой результат реакции расщепления.
Исторические предпосылки
Заслуга открытия электронной формулы цезия принадлежит химикам из Германии, выдающимся умам в свой области Кирхгоффу, Бунзену. Это событие случилось в далеком 1860 году. В тот период начали активно менять только-только изобретенную методику спектроскопии пламенем, и в ходе своих экспериментов немецкие ученые обнаружили прежде неизвестный общественности химический элемент – цезий. В тот момент цезий был представлен в качестве получателя, что актуально для фотоэлементов, электронных ламп.

Заметные изменения в истории определения и выделения элемента случились в 1967-м. С учетом сделанного Эйнштейном заявления о том, что скорость света можно считать наиболее постоянным фактором измерения, присущим нашей вселенной, было решено выделить цезий 133. Это стало важным моментом в расширении спектра применения химического элемента цезия – в частности, на нем изготавливают атомные часы.
Цезий в девяностые годы
Именно в последнем десятилетии прошлого века химический элемент цезий начал использоваться человечеством особенно активно. Выяснилось, что он применим в работах бурения жидкостей. Также удалось найти довольно обширную зону применения в химических отраслях. Оказалось, что хлорид цезия и другие его производные могут использоваться при конструировании сложной электроники.
Тогда же, в девяностые, особенное внимание научного сообщества было приковано ко всему, что могло бы стать новым словом в атомной, ядерной энергетике. Именно тогда наиболее тщательно изучили радиоактивный цезий. Выявлено, что полураспад этого компонента требует около трех десятилетий. В настоящее время радиоактивные изотопы цезия нашли широкое применение в гидрологии. Без них не обходятся и медицина, промышленность. Наиболее широкое распространение получил радиоактивный изотоп цезий 137. Цезию свойственен низкий уровень отравляющих способностей, в то же время радиоактивные производные в большой концентрации могут нанести вред природе и человеку.
Физические параметры
Специфика цезия (а также хлорида цезия и других производных этого металла) обуславливает возможности по широкому применению продукта. Среди прочих элементов именно цезий имеет самый малый показатель твердости – всего 0,2 единицы по шкале Мооса. Кроме мягкости, металлу свойственна податливость. В нормальном состоянии правильная электронная формула цезия позволяет сформировать бледный по цвету материал, способный менять краску на более темную при малейшем контакте с соединениями кислорода.

Точка плавления металла – всего лишь 28 градусов по Цельсию, а это означает, что соединение принадлежит к числу пяти металлов, при комнатной температуре или близкой к таковой находящихся в жидкой фазе. Еще более низкая точка плавления, нежели у цезия, зарегистрирована только у меркурия. Точка кипения цезия тоже невелика – меньше только у ртути. Особенности электрохимического потенциала регламентируют горение металла – он создает фиолетовые оттенки либо синий цвет.
Сочетаемость и особенности
У цезия есть способность вступать в реакции с щелочными соединениями, металлами. Также элемент формирует оксиды цезия. Кроме того, наблюдаются реакции с ртутными смесями, золотом. Особенности взаимодействия с другими соединениями, а также температурные режимы, при которых реакции возможны, декларируют возможные межметаллические составы. В частности, цезий является исходным компонентом для формирования фоточувствительных соединений. Для этого проводят реакцию металла с участием тория, сурьмы, галлия, индия.
Кроме оксида цезия, интерес у химиков вызывают и результаты взаимодействия с рядом щелочных элементов. В то же время нужно учитывать, что металл не может реагировать с литием. Для каждого из сплавов цезия характерен собственный оттенок. Некоторые смеси – это черно-фиолетовые соединения, другие окрашены в золотой оттенок, а третьи практически бесцветны, но с ярко выраженным металлическим блеском.
Химические особенности
Наиболее ярко выраженная особенность цезия – его пирофорность. Кроме того, внимание ученых привлекает и электрохимический потенциал металла. Цезий может спонтанно загореться прямо в воздухе. При взаимодействии с водой происходит взрыв, даже если условия реакции предполагали низкие температуры. Заметно отличается в этом плане цезий от первой группы Менделеевской химической таблицы. При взаимодействии цезия и воды в твердом виде также происходит реакция.
Выявлено, что период полураспада цезия длится порядка трех десятилетий. Материал признали опасным в силу его особенностей. Чтобы работать с цезием, необходимо создать атмосферу инертного газа. В то же время взрыв при контакте с водой при равном количестве натрия и цезия во втором случае будет ощутимо слабее. Химики объясняют это следующей особенностью: при контакте цезия с водой происходит мгновенная взрывная реакция, то есть не остается достаточно продолжительного временного промежутка для накопления водорода. Оптимальный метод хранения цезия – закупоренные емкости из боросиликатного соединения.
Цезий: в составе соединений
Цезий в соединениях выступает в качестве катиона. Есть много разнообразных анионов, с которыми возможна реакция формирования соединения. Большая часть солей цезия не имеет цвета, если только окрашивание не обусловлено анионом. Простые соли гигроскопичны, хотя в меньшей степени, чем у других легких металлов-щелочей. Многие в воде растворяются.
Двойные соли имеют относительно низкую степень растворимости. Это нашло довольно широкое применение в промышленности. Например, сульфат алюминия-цезия активно используется в рудноочистительных установках в силу своей малой растворимости водой.
Цезий: уникальный и полезный
Визуально этот металл сходен с золотом, но немного светлее, нежели самый популярный благородный металл. Если взять кусочек цезия в руку, он быстро расплавится, а полученная субстанция будет подвижной, несколько изменит цвет – ближе к серебру. В расплавленном состоянии цезий отлично отражает лучи света. Из щелочных металлов цезий считается наиболее тяжелым, в то же время ему свойственна самая низкая плотность.

История открытия цезия содержит упоминания о Дюрхгеймском источнике. Именно отсюда прислали образец воды для лабораторного исследования. В ходе анализа составных компонентов особенное внимание уделялось решению вопроса: какой именно элемент обеспечивает лечебные качества жидкости? Немецкий ученый Бунзен решил применить метод спектрального анализа. Именно тогда появились две неожиданные линии голубого оттенка, не свойственные известным на тот момент соединениям. Именно цвет этих полос и помог ученым выбрать имя для нового компонента – небесно-голубой на латыни звучит как «цезий».
Где же мне тебя найти?
Как было выявлено в ходе длительных испытаний, цезий – это рассеянный элемент, который в природных условиях встречается крайне редко. Так, проводя сравнительный анализ содержания в коре планеты рубидия и цезия, ученые выявили, что второго меньше в сотни раз. Приблизительная оценка концентрации дала показатель 7*10(-4) %. Никакой другой менее чувствительный метод, нежели спектроскопия, просто не позволил бы выявить столь редкое соединение. Это объясняет факт того, что раньше ученые даже не подозревали о существовании цезия.
В настоящее время удалось выяснить, что чаще встречается цезий в извлекаемых в горах породах. Его концентрация в этом материале не превышает тысячных долей процента. Категорически малые количества удалось зафиксировать в водах морей. До десятых долей процента доходит уровень концентрации в литиевых, калиевых минеральных соединениях. Чаще всего его удается выявить в лепидолите.
Такой похожий, но совсем другой
При сравнении отличительных особенностей цезия и рубидия, а также других элементов, встречающихся крайне редко, удалось выявить, что цезию свойственно формирование уникальных минералов, на что не способны прочие соединения. Именно таким образом получаются поллуцит, родицит, авогадрит.
Родицит, как выяснили ученые, встречается в исключительно редко. Аналогичным образом очень сложно найти авогадрит. Поллуцит несколько более распространен, в ряде случаев обнаруживались небольшие залежи. Они обладают очень низкой мощностью, но содержат цезий в количестве 20-35 процентов от общей массы. Самые важные, с точки зрения общественности, поллуциты были обнаружены в американских недрах и на территории России. Также есть шведские разработки, казахстанские. Известно, что поллуцит найден на юго-западе Африканского континента.

Работа продолжается
Не секрет, что открытие элемента и получение его в чистом виде – это две совершенно разные задачи, хоть и связанные между собой. Когда стало ясно, что цезий встречается очень редко, ученые начали разрабатывать методики синтезирования металла в лабораторных условиях. Первое время казалось, что это совершенно непосильная задача, если применять доступные в те времена средства и технику. Бунзену за долгие годы так и не удалось выделить металлический цезий в чистом его виде. Лишь два десятилетия спустя передовые химики смогли наконец решить эту задачу.
Прорыв произошёл в 1882-м, когда Сеттерберг из Швеции провел электролиз смеси, на четыре части состоящей из цианидов цезия, к которым была примешана одна часть бария. Последний компонент использовался, чтобы сделать температуру плавления меньше. Цианиды, как в этот момент уже знали ученые, представляли собой очень опасные компоненты. В то же время за счет бария формировалось загрязнение, что не позволяло получить более-менее удовлетворительное количество цезия. Было ясно, что методика требует существенных доработок. Хорошее предложение в этой сфере было вынесено на обсуждение научного сообщества Бекетовым. Именно тогда внимание привлекла гидроокись цезия. Если восстановить это соединение, применяя металлический магний, повышая нагрев и используя водородный ток, можно добиться несколько лучшего результата, нежели доказанный шведским химиком. Впрочем, реальные эксперименты показали, что выход вдвое меньше, нежели рассчитываемый в теории.
Что дальше?
Цезий и дальше оставался в фокусе внимания международного химического научного сообщества. В частности, в своих исследованиях ему посвятил немало усилий и времени французский ученый Акспиль. В 1911 он предложил кардинально новый подход к вопросу извлечения чистого цезия. Необходимо было проводить реакцию в вакууме, в качестве исходного материала брался хлорид металла, а для его восстановления применялся металлический кальций.
Такая реакция, как показали эксперименты, происходит почти до конца. Чтобы добиться достаточного эффекта, необходимо использовать специальный прибор. В лабораториях обычно прибегают к тугоплавкому стеклу либо применяют кварцевые ёмкости. У прибора должен быть отросток. Внутри поддерживается давление порядка 0.001 мм рт. ст. Для успешной реакции необходимо обеспечить нагрев ёмкости до 675 градусов по шкале Цельсия. При этом выделяется цезий, который практически сразу же испаряется. Пары переходят в предназначенный для этого отросток. А вот хлористый калий преимущественно оседает прямо в реакторе. При заданных условиях летучесть этой соли столь мала, что ее можно вообще не учитывать, поскольку для этого соединения характерная температура плавления – 773 градуса (по той же шкале Цельсия). Это означает, что осадок может расплавиться, если емкость перегреть на сто градусов относительно задуманного. Чтобы добиться максимально эффективного результата, необходимо провести повторный процесс дистилляции. Для этого создают вакуум. На выходе будет идеальный металлический цезий. В настоящее время описанная методика применяется наиболее широко и считается оптимальной для получения соединения.
Активность и реакции
В ходе многочисленных исследований ученые смогли определить, что цезию присуща удивительная активность, в норме не свойственная металлам. При контакте с воздухом происходит возгорание, которое приводит к выделению надпероксида. Добиться окиси можно, если ограничить доступ кислорода к реагентам. Есть возможность формирования субоксидов.

Если цезий контактирует с фосфором, серой, галогеном, это провоцирует сопровождающуюся взрывом реакцию. Также взрыв сопутствует реакции с водой. Используя кристаллизатор, стакан, можно столкнуться с тем, что емкость буквально разлетается на кусочки. Также возможна реакция со льдом, если температура по шкале Цельсия – не ниже 116 градусов. В результате такой реакции продуцируются водород, гидроксид.
Гидроксид: особенности
В ходе изучения продуктов реакции, производимых цезием, химики выявили, что получаемый гидроксид – это очень сильное основание. Взаимодействуя с ним, необходимо помнить, что при высокой концентрации это соединение запросто может разрушить стекло даже без дополнительного нагрева. А вот при повышении температуры гидроксид без труда плавит никель, железо, кобальт. Аналогичным будет влияние на циркониевый диоксид, корунд, платину. Если в реакции принимает участие кислород, гидроксид цезия крайне быстро разрушает серебро, золото. Если ограничить поступление кислорода, процесс протекает относительно медленно, но все же не останавливается. Стойкостью к гидроксиду цезия обладают родий и несколько сплавов этого соединения.
Применять с умом
Не только цезий, но и известные на основе этого металла соединения используются в настоящее время очень широко. Без них невозможно представить себе конструирование радиотехники, незаменимы они и в электронике. Активно применяется соединение и вариации цезия в химии, промышленности, офтальмологической сфере, медицинской. Не обойден вниманием цезий и в рамках развития применимых в космосе технологий, а также ядерной энергетики.
В настоящее время распространено использовать цезий при конструировании фотоэлементов. Бромид, иодид этого металла необходимы для создания систем инфракрасного видения. Полученные промышленным путем монокристаллы допускается использовать в качестве элементов детекторов, позволяющих фиксировать ионизирующее излучение. Некоторые соединения на основе цезия активно используются как катализаторы в процессах промышленности. Это необходимо при создании аммиака, формировании окиси этилена и продуцировании бутадиена.
Радиация и цезий
Наибольшее внимание ученых привлекает изотоп цезий 137. Он принадлежит к категории бета-излучателей. В настоящее время этот элемент незаменим в процессе стерилизации продуктов питания, лекарственных соединений. К нему принято прибегать при терапии злокачественных новообразований. Современные подходы позволили применять элемент при гамма-дефектоскопии. На его основе конструируются датчики уровня, а также источники тока. 137-й изотоп в окружающую среду в очень большом количестве попал после аварии на Чернобыльской атомной станции. Именно он – один из самых главных факторов загрязнения после этой катастрофы.

Впрочем, 137-й – это не единственный радиоактивный изотоп цезия, который нашел применение в современной промышленности. Так, атомные часы создаются на изотопе цезия 133. В настоящее время - это самый точный прибор, позволяющий контролировать ход времени. Одна секунда, как выяснили в ходе высокоточных исследований современные ученые, это 9192631770 периодов излучения. Это позволяет использовать атом изотопа цезия 133 как стандарт для определения частоты, времени.
fb.ru
цезий - это... Что такое цезий?
ЦЕ́ЗИЙ -я; м. [от лат. caesius - голубой] Химический элемент (Cs), мягкий щелочной металл серебристого цвета (используется в газовых лазерах).
◁ Це́зиевый, -ая, -ое. Ц. катод. Ц-ое покрытие.
ЦЕ́ЗИЙ (лат. Cesium), Cs (читается «цезий»), химический элемент с атомным номером 55, атомная масса 132,9054. Имеет один стабильный нуклид 133Cs. Расположен в группе IA в 6 периоде. Электронная конфигурация внешнего слоя 6s1, в соединениях проявляет степень окисления +1 (валентность I). Радиус нейтрального атома цезия 0,266 нм, радиус иона Cs+0,181 нм (координационное число 6), 0,202 (координационное число 12). Энергии последовательной ионизации атома 3,89397, 25,1 и 34,6 эВ. Сродство к электрону 0,47 эВ. Работа выхода электрона 1,81 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 0,7. Цезий был открыт в 1860 немецкими учеными Р. В. Бунзеном (см. БУНЗЕН Роберт Вильгельм) и Г. Кирхгофом (см. КИРХГОФ Густав Роберт) в водах Дюрхгеймского минерального источника в Германии методом спектрального анализа. Назван цезием по двум ярким линиям в синей части спектра (от лат. caesius — небесно-голубой). Металлический цезий впервые был выделен в 1882 шведским химиком К. Сеттербергом при электролизе расплава смеси CsCN и Ba. Содержание в земной коре 3,7·10-4% по массе. Типичный редкий, рассеянный элемент. Геохимически тесно связан с гранитнлй магмой, образуя концентрации в пегматитах вместе с Li, Be, Ta, Nb. Известно два крайне редких минерала цезия: поллуцит, (Cs,Na)[AlSi2O6]·nh3O и авогадрит, (K,Сs)[BF]4. Как примесь, 0,0003—5%, цезий содержится в лепидолите (см. ЛЕПИДОЛИТ), флогопите (см. ФЛОГОПИТ), карналлите (см. КАРНАЛЛИТ). Получение Цезий получают из поллуцита методом вакуумтермического восстановления. Руду обогащают, затем выделенный концентрат разлагают соляной или серной кислотами или спекают с оксидно-солевыми смесями, СаО и СаСl2. Из продуктов разложения поллуцита цезий осаждают в виде CsAl(SO4)2 или Cs3[Sb2Cl9]. Далее осадки переводят в растворимые соли. Особо чистые соединения цезия получают дальнейшей дробной кристаллизацией, сорбцией, экстракцией и ионным обменом. Металлический цезий получают металлотермическим восстановлением хлорида цезия CsCl кальцием (см. КАЛЬЦИЙ) или магнием (см. МАГНИЙ) или электролизом расплава галогенидов (см. ГАЛОГЕНИДЫ) цезия. Хранят цезий в ампулах из стекла пирекс в атмосфере аргона или в стальных герметичных сосудах под слоем обезвоженного вазелинового или парафинового масла. Физические и химические свойства Цезий — мягкий серебристо-белый металл. При обычной температуре находится в пастообразном состоянии, температура плавления 28,44°C. Температура кипения 669,2°C. Кристаллическая решетка кубическая объемно центрированная, параметр ячейки а = 0,6141 нм. Плотность 1,904 кг/дм3. Цезий имеет высокую чувствительность к свету, цезиевый катод испускает электроны даже под действием инфракрасного (см. ИНФРАКРАСНОЕ ИЗЛУЧЕНИЕ) излучения с длиной волны до 0,80 мкм. Цезий чрезвычайно реакционноспособен. Стандартный электродный потенциал –2,923 В. На воздухе и в атмосфере кислорода (см. КИСЛОРОД) цезий мгновенно воспламеняется, образуя смесь пероксида Сs2O2 и надпероксида цезия CsO2. При незначительном содержании кислорода в газе, с которым реагирует цезий, возможно образование оксида Cs2O. C водой цезий реагирует со взрывом: 2Cs + 2h3O = 2CsOH + h3При нагревании под повышенным давлением в присутствии катализатора цезий реагирует с водородом с образованием гидрида CsH. Взаимодействуя с галогенами, дает галогениды CsCl, c серой — сульфид Cs2S. С азотом цезий в обычных условиях не реагирует, а нитрид цезия Cs3N образуется при пропускании электрического разряда между электродами из цезия, помещенными в жидкий азот. При нагревании цезий реагирует с красным фосфором, образуя фосфид Cs2P5. При нагревании взаимодействует с графитом, давая следующие карбиды C8Cs, C24Cs, C36Cs, Cs2C2 (ацетиленид цезия). Цезий восстанавливает кремний из стекла и из SiO2. Со многими металлами цезий образует интерметаллиды (см. МЕТАЛЛИДЫ) (CsAu, CsSn4). Гидроксид цезия CsOH — сильное хорошо растворимое в воде основание. Соли цезия (хлорид CsCl, сульфат Cs2SO4, нитрат CsNO3, карбонат Cs2CO3 и другие) хорошо растворимы в воде. Плохо растворимы в воде перхлорат цезия CsClO4, хлорплатинат цезия Cs2PtCl6 и Cs2[Sb2Cl9]. Цезий — компонент различных фотокатодов, фотоэлементов, фотоэлектронных умножителей, электронно-лучевых трубок. Цезий используют как геттер. (см. ГЕТТЕР) Чрезвычайно точны «атомные цезиевые часы», резонансная частота энергетического перехода между подуровнями основного состояния 133Cs положена в основу современного определения секунды (см. СЕКУНДА). Радионуклид 137Cs источник гамма-излучения в радиологии. Цезий — постоянный химический микрокомпонент организма растений и животных. Морские водоросли содержат 0,01—0,1 мкг/г цезия, наземные растения — 0,05—0,2 мкг/г. В организме млекопитающих содержится 0,05 мкг/г цезия, где он концентрируется в мышцах, сердце и печени. В крови до 2,8 мкг/л цезий относительно малотоксичен. Изотоп 137Cs b-, g-излучающий радиоизотоп, один из компонентов радиоактивного загрязнения атмосферы.dic.academic.ru
Таблица ^ =>> v
| История открытия:Цезий был открыт в 1860 году Бунзеном в воде Дюркгаймерского минерального источника на основании присущих ему спектров. В соответствии с этим он был так и назван - по двум характерным синим линиям спектра (caesius - сине-серый). Получение металлического цезия удалось впервые осуществить Сеттербергу (Setterberg, 1882) электролизом расплавленной смеси цианидов цезия и бария. К этому времени Бунзеном уже была получена амальгама цезия. Получение:Получение цезия лучше всего вести нагреванием гидроксида с металлическим магнием в токе водорода или с металлическим кальцием в вакууме. Согласно де Буру, в качестве восстановителя особенно подходит цирконий. Небольшие количества цезия, по де Буру, удобно получать нагреванием его хлорида в смеси с азидом бария в высоком вакууме. Образующийся при распаде азида барий восстанавливает щелочные металлы из их хлоридов. Они испаряются и оседают на холодных стенках сосуда. Физические свойства:Цезий в чистом состоянии имеет по данным Костеану золотисто-желтый цвет. На воздухе тускнеет и вскоре покрывается толстой гидроксидной коркой. Поэтому его следует хранить под слоем керосина или парафинового масла. Как и все щелочные металлы, цезий чрезвычайно мягок (как воск) и легко поддается сжатию. Тпл.= 28,4°С. Обладает высокой электропроводностью. Химические свойства:Цезий - щелочной металл, он тотчас воспламеняется при доступе кислорода с образованием твердого пероксида CsO2 даже в отсутствие воды, в то время, как другие щелочные металлы (за исключением рубидия) на сухом воздухе или в токе кислорода воспламеняются только при умеренном нагревании. Цезий воспламеняется также при взаимодействии с галогенами (с бромом реакция идет со взрывом), фосфором и серой.Цезий очень активно разлагает воду. При этом он плавится, а выделяющийся водород воспламеняется. Со спиртом цезий реагирует с образованием алкоголята:2Cs + 2HOC2H5 = 2CsOC2H5 + h3В соединениях проявляет степень окисления +1. Важнейшие соединения:Оксид цезия.Для цезия известен ряд соединений с кислородом Cs7O, Cs4O (?), Cs7O2, Cs3O, Cs2O. Существование этих своеобразных соединений было установлено уже в 1909 г. Ренгаде. Оксид цезия оранжевый, может быть получен взаимодействием пероксида со стехиометрическим количеством металла. Энергично взаимодействует с водой. При слабом нагревании реагирует с водородом с образованием гидроксида и гидрида:Cs2O + h3 = CsOH + CsHНадпероксид цезия CsO2, желтого цвета, образуется при горении цезия в токе кислорода. При сильном нагревании надпероксид цезия отщепляет кислород, переходя в черную Cs2O3. Взаимодействие надпероксида с водой приводит к образованию пероксида водорода и кислорода.Существует и красный озонид цезия CsO3.Гидроксид цезия CsOH, бесцв. крист., щелочь. Получают электролизом расторов солей цезия, взаимодействием сульфата цезия с гидроксидом бария. Соли цезия похожи на соответствующие соли калия. Поскольку для получения солей цезия используются главным образом остаточные щелока от переработки калийных солей главная задача заключается в том, чтобы отделить его от калия. Хлорид цезия получают взаимодействием карбонатов с соляной кислотой или прокаливанием хлороплатинатов. Хлорид цезия кристаллизуется в виде кубов. Заметно ядовит. Цезий, как и рубидий, склонен к образованию полигалогенидов. Карбонат цезия удобнее всего получать взаимодействием сульфатов с гидроксидом бария и последующим упариванием с карбонатом аммония. Карбонат цезия легко растворим в спирте. Гидрокарбонат цезия растворим лучше, чем гидрокарбонат калия. Сульфат цезия образует ромбические кристаллы, изоморфные сульфату калия. Легко образует двойные соли с сульфатом алюминия, сульфатом железа(III) и с сульфатами двухвалентных металлов. Применение:Металлический цезий используется в фотоэлементах, газовых лазерах, цезиевых лампах. Многие соли цезия используются в составе электролитов топливных элементов. В аналитической и препаративной химии применяют хлорид цезия для получения чистых двойных хлоридов с хлоридами тяжелых металлов; полученные таким образом двойные соли отличаются большей частью плохой растворимостью и способностью хорошо кристаллизоваться. Для обнаружения алюминия применяется образование цезиевых квасцов: CsAl(SO4)2*12h3O. Мировое производство (без СССР) - около 10 т/год (1979). Самоволова Ю. См. также:С.И. Венецкий О редких и рассеянных. Рассказы о металлах. Две голубые незнакомки |
Цезий — Мегаэнциклопедия Кирилла и Мефодия — статья
2Cs + 2h3O = 2CsOH + h3
При нагревании под повышенным давлением в присутствии катализатора цезий реагирует с водородом с образованием гидрида CsH. Взаимодействуя с галогенами, дает галогениды CsCl, c серой — сульфид Cs2S. С азотом цезий в обычных условиях не реагирует, а нитрид цезия Cs3N образуется при пропускании электрического разряда между электродами из цезия, помещенными в жидкий азот. При нагревании цезий реагирует с красным фосфором, образуя фосфид Cs2P5.
При нагревании взаимодействует с графитом, давая следующие карбиды C8Cs, C24Cs, C36Cs, Cs2C2 (ацетиленид цезия). Цезий восстанавливает кремний из стекла и из SiO2. Со многими металлами цезий образует интерметаллиды (CsAu, CsSn4). Гидроксид цезия CsOH — сильное хорошо растворимое в воде основание. Соли цезия (хлорид CsCl, сульфат Cs2SO4, нитрат CsNO3, карбонат Cs2CO3 и другие) хорошо растворимы в воде. Плохо растворимы в воде перхлорат цезия CsClO4, хлорплатинат цезия Cs2PtCl6 и Cs2[Sb2Cl9].Цезий — компонент различных фотокатодов, фотоэлементов, фотоэлектронных умножителей, электронно-лучевых трубок. Цезий используют как геттер. Чрезвычайно точны «атомные цезиевые часы», резонансная частота энергетического перехода между подуровнями основного состояния 133Cs положена в основу современного определения секунды. Радионуклид 137Cs источник гамма-излучения в радиологии.Цезий — постоянный химический микрокомпонент организма растений и животных. Морские водоросли содержат 0,01-0,1 мкг/г цезия, наземные растения — 0,05-0,2 мкг/г. В организме млекопитающих содержится 0,05 мкг/г цезия, где он концентрируется в мышцах, сердце и печени. В крови до 2,8 мкг/л цезий относительно малотоксичен. Изотоп 137Cs β-, γ-излучающий радиоизотоп, один из компонентов радиоактивного загрязнения атмосферы.
- Плющев В. Е., Степин Б. Д. Аналитическая химия рубидия и цезия.
- Юшков В. В. Химия и экология 3d-элементов. - Екатеринбург: УрО РАН, 2004.
- Локшин Э. П. Рубидий и цезий. - Апатиты: КНЦ РАН, 1996.
megabook.ru
Популярная библиотека химических элементов. Раритетные издания. Наука и техника
Цезий
| 55 | |
Cs |
1 8 18 18 8 2 |
| ЦЕЗИЙ | |
| 132,905 | |
| 6s1 | |
Если бы писателю-беллетристу пришлось заняться «биографией» цезия, то он, может быть, начал так: «Открыт цезий сравнительно недавно, в 1860 г., в минеральных водах известных целебных источников Шварцвальда (Баден-Баден и др.). За короткий исторический срок прошел блистательный путь – от редкого, никому не ведомого химического элемента до стратегического металла. Принадлежит к трудовой семье щелочных металлов, по в жилах его течет голубая кровь последнего в роде... Впрочем, это нисколько не мешает ему общаться с другими элементами и даже, если они не столь знамениты, он охотно вступает с ними в контакты и завязывает прочные связи. В настоящее время работает одновременно в нескольких отраслях: в электронике и автоматике, в радиолокации и кино, в атомных реакторах и на космических кораблях...».
Не принимая всерьез шутливого топа и некоторых явно литературных преувеличений, это жизнеописание можно смело принять за «роман без вранья». Не беспредметен разговор о «голубой крови» цезия – впервые он был обнаружен по двум ярким линиям в синей области спектра и латинское слово «caesius», от которого произошло его название, означает небесно-голубой. Неоспоримо утверждение о том, что цезий практически последний в ряду щелочных металлов. Правда, еще Менделеев предусмотрительно оставил в своей таблице пустую клетку для «экацезия», который должен был следовать в I группе за цезием. И этот элемент (франций) в 1939 г. был открыт. Однако франций существует лишь в виде быстро распадающихся радиоактивных изотопов с периодами полураспада в несколько минут, секунд или даже тысячных долей секунды. Наконец, правда и то, что цезий применяется в некоторых важнейших областях современной техники и науки.
Распространенность цезия в природе и его производство
В литературе нет точных данных о том, сколько цезия имеется на земном шаре. Известно лишь, что он относится к числу редких химических элементов. Полагают, что его содержание в земной коре во всяком случае в несколько сот раз меньше, чем рубидия, и не превышает 7·10–4%.
Цезий встречается в крайне рассеянном состоянии (порядка тысячных долей процента) во многих горных породах; ничтожные количества этого металла были обнаружены и в морской воде. В большей концентрации (до нескольких десятых процента) он содержится в некоторых калиевых и литиевых минералах, главным образом в лепидолите. Но особенно существенно то, что, в отличие от рубидия и большинства других редких элементов, цезий образует собственные минералы – поллуцит, авогадрит и родицит. Родицит крайне редок, притом некоторые авторы причисляют его к литиевым минералам, так как в его состав (R2O · 2Al2O3 · 3B2O3, где R2O – сумма окисей щелочных металлов) входит обычно больше лития, чем цезия. Авогадрит (K, Cs) [BF4] тоже редок, да и поллуциты встречаются нечасто; их залежи маломощны, зато цезия они содержат не менее 20, а иногда и до 35%. Наибольшее практическое значение имеют поллуциты США (Южная Дакота и Мэн), Юго-Западной Африки, Швеции и Советского Союза (Казахстан и др.).
Поллуциты – это алюмосиликаты, сложные и весьма прочные соединения. Их состав определяют формулой (Cs, Na) [AlSi2O6] · nh3O, и хотя цезия в них много, извлечь его не так просто. Чтобы «вскрыть» минерал и перевести в растворимую форму ценные компоненты, его обрабатывают при нагревании концентрированными минеральными кислотами – плавиковой или соляной и серной. Затем освобождают раствор от всех тяжелых и легких металлов и, что особенно трудно, от постоянных спутников цезия – щелочных металлов: калия, натрия и рубидия.
Современные методы извлечения цезия из поллуцитов основаны на предварительном сплавлении концентратов с избытком извести и небольшим количеством плавикового шпата. Если вести процесс при 1200°C, то почти весь цезий возгоняется в виде окиси Cs2O. Этот возгон, конечно, загрязнен примесью других щелочных металлов, но он растворим в минеральных кислотах, что упрощает дальнейшие операции.
Из лепидолитов цезий извлекается вместе с рубидием попутно, как побочный продукт производства лития. Лепидолиты предварительно сплавляют (или спекают) при температуре около 1000°C с гипсом или сульфатом калия и карбонатом бария. В этих условиях все щелочные металлы превращаются в легкорастворимые соединения – их можно выщелачивать горячей водой. После выделения лития остается переработать полученные фильтраты, и здесь самая трудная операция – отделение цезия от рубидия и громадного избытка калия. В результате ее получают какую-либо соль цезия – хлорид, сульфат или карбонат. Но это еще только часть дела, так как цезиевую соль надо превратить в металлический цезий. Чтобы понять всю сложность последнего этапа, достаточно указать, что первооткрывателю цезия – крупнейшему немецкому химику Бунзену – так и не удалось получить элемент №55 в свободном состоянии. Все способы, пригодные для восстановления других металлов, не давали желаемых результатов. Металлический цезий был впервые получен только через 20 лет, в 1882 г., шведским химиком Сеттербергом в процессе электролиза расплавленной смеси цианидов цезия и бария, взятых в отношении 4:1. Цианид бария добавляли для снижения температуры плавления. Однако барий загрязнял конечный продукт, а работать с цианидами было трудно ввиду их крайней токсичности, да и выход цезия был весьма мал. Вол ее рациональный способ найден в 1890 г. известным русским химиком Н.Н. Бекетовым, предложившим восстанавливать гидроокись цезия металлическим магнием в токе водорода при повышенной температуре. Водород заполняет прибор и препятствует окислению цезия, который отгоняется в специальный приемник. Однако и в этом случае выход цезия не превышает 50% теоретического.
Наилучшее решение трудной задачи получения металлического цезия было найдено в 1911 г. французским химиком Акспилем. При методе Акспиля, до сих пор остающемся наиболее распространенным, хлорид цезия восстанавливают металлическим кальцием в вакууме, причем реакция
2CsCl + Ca → CaCl2 + 2Cs
идет практически до конца. Процесс ведут в специальном приборе (в лабораторных условиях – из кварца или тугоплавкого стекла), снабженном отростком. Если давление в приборе не больше 0,001 мм рт. ст., температура процесса может не превышать 675°C. Выделяющийся цезий испаряется и отгоняется в отросток, а хлористый кальций полностью остается в реакторе, так как в этих условиях летучесть соли ничтожна (температура плавления CaCl2 равна 773°C, т.е. на 100°C выше температуры процесса). В результате повторной дистилляции в вакууме получается абсолютно чистый металлический цезий.
В литературе описаны еще многие другие способы получения металлического цезия из его соединений, но, как правило, они не сулят особых преимуществ. Так, при замене металлического кальция его карбидом температуру реакции приходится повышать до 800°C, и конечный продукт загрязняется дополнительными примесями. Можно разлагать азид цезия или восстанавливать цирконием его бихромат, но эти реакции взрывоопасны. Впрочем, при замене бихромата хроматом цезия процесс восстановления протекает спокойно, и, хотя выход не превышает 50%, отгоняется очень чистый металлический цезий. Этот способ применим для получения небольших количеств металла в специальном вакуумном приборе.
Мировое производство цезия сравнительно невелико, но в последнее время оно постоянно растет. О масштабах этого роста можно только догадываться – цифры не публикуются.
Свойства цезия
Блестящая поверхность металлического цезия имеет бледно-золотистый цвет. Это – один из самых легкоплавких металлов: он плавится при 28,5°C, кипит при 705°C в обычных условиях и при 330°C в вакууме. Легкоплавкость цезия сочетается с большой легкостью. Несмотря на довольно большую атомную массу (132,905) элемента, его плотность при 20°C всего 1,87. Цезий во много раз легче своих соседей по менделеевской таблице. Лантан, например, имеющий почти такую же атомную массу, по плотности превосходит цезий в три с лишним раза. Цезий всего вдвое тяжелее натрия, а их атомные массы относятся, как 6:1. По-видимому, причина этого кроется в своеобразной электронной структуре атомов цезия. Каждый его атом содержит 55 протонов, 78 нейтронов и 55 электронов, но все эти многочисленные электроны расположены относительно рыхло – ионный радиус цезия очень велик – 1,65 Å*. Ионный радиус лантана, например, равен всего 1,22 Å, хотя в состав его атома входят 57 протонов, 82 нейтрона и 57 электронов.
* Атомный радиус цезия равен 2,62 Å.
Самое замечательное свойство цезия – его исключительно высокая активность. По чувствительности к свету он превосходит все другие металлы. Цезиевый катод испускает поток электронов даже под действием инфракрасных лучей с длиной волны 0,80 мкм. Кроме того, максимальная электронная эмиссия, превосходящая нормальный фотоэлектрический эффект в сотни раз, наступает у цезия при освещении зеленым светом, тогда как у других светочувствительных металлов этот максимум проявляется лишь при воздействии фиолетовых или ультрафиолетовых лучей.
Долгое время ученые надеялись найти радиоактивные изотопы цезия в природе, поскольку они есть у рубидия и калия. Но в природном цезии не удалось обнаружить каких-либо иных изотопов, кроме вполне стабильного 133Cs. Правда, искусственным путем получено 22 радиоактивных изотопа цезия с атомными массами от 123 до 144. В большинстве случаев они недолговечны: периоды полураспада измеряются секундами и минутами, реже – несколькими часами или днями. Однако три из них распадаются не столь быстро – это 134Cs, 137Cs и 135Cs, живущие 2,07; 26,6 и 3·106 лет. Все три изотопа образуются в атомных реакторах при распаде урана, тория и плутония; их удаление из реакторов довольно затруднительно.
Химическая активность цезия необычайна. Он очень быстро реагирует с кислородом и не только моментально воспламеняется на воздухе, но способен поглощать малейшие следы кислорода в условиях глубокого вакуума. Воду он бурно разлагает уже при обычной температуре; при этом выделяется много тепла, и вытесняемый из воды водород тут же воспламеняется. Цезий взаимодействует даже со льдом при –116°C. Его хранение требует большой предосторожности.
Цезий взаимодействует и с углеродом. Только самая совершенная модификация углерода – алмаз – в состоянии противостоять его «натиску». Жидкий расплавленный цезий и его пары разрыхляют сажу, древесный уголь и даже графит, внедряясь между атомами углерода и образуя своеобразные, довольно прочные соединения золотисто-желтого цвета, которые в пределе, по-видимому, отвечают составу C8Cs5. Они воспламеняются на воздухе, вытесняют водород из воды, а при нагревании разлагаются и отдают весь поглощенный цезий.
Даже при обычной температуре реакции цезия с фтором, хлором и другими галогенами сопровождаются воспламенением, а с серой и фосфором – взрывом. При нагревании цезий соединяется с водородом, азотом и другими элементами, а при 300°C разрушает стекло и фарфор. Гидриды и дейтериды цезия легко воспламеняются на воздухе, а также в атмосфере фтора и хлора. Неустойчивы, а иногда огнеопасны и взрывчаты соединения цезия с азотом, бором, кремнием и германием, а также с окисью углерода. Галоидные соединения цезия и цезиевые соли большинства кислот, напротив, очень прочны и устойчивы. Активность исходного цезия проявляется у них разве только в хорошей растворимости подавляющего большинства солей. Кроме того, они легко превращаются в более сложные комплексные соединения.
Сплавы и интерметаллические соединения цезия всегда сравнительно легкоплавки.
У цезия имеется еще одно весьма важное свойство, тесно связанное с его электронной структурой. Дело в том, что он теряет свой единственный валентный электрон легче, чем любой другой металл; для этого необходима очень незначительная энергия – всего 3,89 эВ. Поэтому получение плазмы из цезия требует гораздо меньших энергетических затрат, чем при использовании любого другого химического элемента.
Где применяется цезий
Неудивительно, что замечательные свойства цезия давно открыли ему доступ в различные сферы человеческой деятельности.
Прежде всего он нашел применение в радиотехнике. Вакуумные фотоэлементы со сложным серебряно-цезиевым фотокатодом особенно ценны для радиолокации: они чувствительны не только к видимому свету, но и к невидимым инфракрасным лучам и, в отличие, например, от селеновых, работают без инерции. В телевидении и звуковом кино широко распространены вакуумные сурьмяно-цезиевые фотоэлементы; их чувствительность даже после 250 часов работы падает всего на 5...6%, они надежно работают в интервале температур от –30° до +90°C. Из них составляют так называемые многокаскадные фотоэлементы; в этом случае под действием электронов, вызванных лучами света в одном из катодов, наступает вторичная эмиссия – электроны испускаются добавочными фотокатодами прибора. В результате общий электрический ток, возникающий в фотоэлементе, многократно усиливается. Усиление тока и повышение чувствительности достигаются также в цезиевых фотоэлементах, заполненных инертным газом (аргоном или неоном).
В оптике и электротехнике широко используются бромиды, иодиды и некоторые другие соли цезия. Если при изготовлении флуоресцирующих экранов для телевизоров и научной аппаратуры ввести между кристалликами сернистого цинка примерно 20% иодистого цезия, экраны будут лучше поглощать рентгеновские лучи и ярче светиться при облучении электронным пучком.
На проходившей в 1965 г. в Москве Международной выставке «Химия-65» в павильоне СССР демонстрировались сцинтилляционные приборы с монокристаллами иодида цезия, активированного таллием. Эти приборы, предназначенные для регистрации тяжелых заряженных частиц, обладают наибольшей чувствительностью из всех приборов подобного назначения.
Кристаллы бромистого и иодистого цезия прозрачны для инфракрасных лучей с длиной волны от 15 до 30 мкм (CsBr) и от 24 до 54 мкм (CsI). Обычные призмы из хлористого натрия пропускают только лучи с длиной волны 14 мкм, а из хлористого калия – 25 мкм. Поэтому применение бромистого и иодистого цезия сделало возможным снятие спектров сложных молекул в отдаленной инфракрасной области.
Весьма чувствительны к свету соединения цезия с оловянной кислотой (ортостаннаты) и с окисью циркония (метацирконаты). Изготовленные на их основе люминесцентные трубки при облучении ультрафиолетовыми лучами или электронами дают зеленую люминесценцию.
Активность многих соединений цезия проявляется в их каталитической способности. Установлено, что при получении синтола (синтетической нефти) из водяного газа и стирола из этилбензола, а также при некоторых других синтезах добавление к катализатору незначительного количества окиси цезия (вместо окиси калия) повышает выход конечного продукта и улучшает условия процесса. Гидроокись цезия служит превосходным катализатором синтеза муравьиной кислоты. С этим катализатором реакция идет при 300°C без высокого давления. Выход конечного продукта очень велик – 91,5%. Металлический цезий лучше, чем другие щелочные металлы, ускоряет реакцию гидрогенизации ароматических углеводородов.
В целом же каталитические свойства цезия изучались мало и его положительное действие оценивалось скорее качественно, чем количественно. Вероятно, это можно объяснить недостаточной актуальностью вопроса, поскольку на цезий имеется настоятельный спрос в ряде других весьма важных областей. К числу последних относится, в частности, медицина. Изотопом 137Cs, образующимся во всех атомных реакторах (в среднем из 100 ядер урана 6 ядер 137Cs), заинтересовались специалисты в области рентгенотерапии. Этот изотоп разлагается сравнительно медленно, теряя за год только 2,4% своей исходной активности. Он оказался пригодным для лечения злокачественных опухолей и имеет определенные преимущества перед радиоактивным кобальтом-60: более длительный период полураспада (26,6 года против 5,27) и в четыре раза менее жесткое гамма-излучение. В связи с этим приборы на основе 137Cs долговечнее, а защита от излучения менее громоздка. Впрочем, эти преимущества становятся реальными лишь при условии абсолютной радиохимической чистоты 137Cs, отсутствия в нем примеси 134Cs, имеющего более короткий период полураспада и более жесткое гамма-излучение.
Не только радиоактивный, но и стабильный металлический цезий приобретает все большее значение. Он служит для изготовления специальных выпрямителей, во многих отношениях превосходящих ртутные. В военном и военно-морском деле вакуумные лампы с парами цезия применяются для инфракрасной сигнализации и контроля. В США такого рода прибор, способный обнаружить в темноте всевозможные объекты, называют «снайперскопом».
Но особенно большое внимание уделяется в последнее время цезиевой плазме, всестороннему изучению ее свойств и условий образования. Возможно, она станет «топливом» плазменных двигателей будущего. Кроме того, работы по исследованию цезиевой плазмы тесно связаны с проблемой управляемого термоядерного синтеза. Многие ученые считают, что целесообразно создавать цезиевую плазму, используя высокотемпературную тепловую энергию атомных реакторов, то есть непосредственно превращать эту тепловую энергию в электрическую.
Таков далеко не полный перечень возможностей цезия.
Вскоре после открытия
Цезий, как известно, был первым элементом, открытым с помощью спектрального анализа. Ученые, однако, имели возможность познакомиться с этим элементом еще до того, как Бунзен и Кирхгоф создали новый исследовательский метод. В 1846 г. немецкий химик Платтнер, анализируя минерал поллуцит, обнаружил, что сумма известных его компонентов составляет лишь 93%, но не сумел точно установить, какой еще элемент (или элементы) входит в этот минерал. Лишь в 1864 г., уже после открытия Бунзена, итальянец Пизани нашел цезий в поллуците и установил, что именно соединения этого элемента не смог идентифицировать Платтнер.
Цезий и давление
Все щелочные металлы сильно изменяются под действием высокого давления. Но именно цезий реагирует на него наиболее своеобразно и резко. При давлении в 100 тыс. атм. его объем уменьшается почти втрое – сильнее, чем у других щелочных металлов. Кроме того, именно в условиях высокого давления были обнаружены две новые модификации элементарного цезия. Электрическое сопротивление всех щелочных металлов с ростом давления увеличивается; у цезия это свойство выражено особенно сильно.
Атомные часы
Ядро атома цезия и его валентный электрон обладают собственными магнитными моментами. Эти моменты могут быть ориентированы двояко – параллельно или антипараллельно. Разница между энергиями обоих состояний постоянна, и, естественно, переход из одного состояния в другое сопровождается колебаниями со строго постоянными характеристиками (длина волны 3,26 см). Используя это свойство, ученые создали цезиевые «атомные часы» – едва ли не самые точные в мире.
• Барий
• Оглавление
Дата публикации:
9 августа 2003 года
n-t.ru
Цезий - это... Что такое Цезий?
 Очень мягкий вязкий серебристо-жёлтый, похожий на золото металл Очень мягкий вязкий серебристо-жёлтый, похожий на золото металл | |
| Цезий / Caesium (Cs), 55 | |
| 132,90543 а. е. м. (г/моль) | |
| [Xe] 6s1 | |
| 267 пм | |
| 235 пм | |
| (+1e) 167 пм | |
| 0,79 (шкала Полинга) | |
| -2,923 | |
| 1 | |
| 375,5 (3,89) кДж/моль (эВ) | |
| 1,873 г/см³ | |
| 28,7 °C[1] 28,5°С[2] 28,44°С[3] | |
| 667,6 °C[1] 688 °C[2] 669,2 °C[3] | |
| 2,09 кДж/моль | |
| 68,3 кДж/моль | |
| 32,21[3] Дж/(K·моль) | |
| 70,0 см³/моль | |
| кубическаяобъёмноцентрированная | |
| 6,140 Å | |
| 39,2 K | |
| (300 K) 35,9 Вт/(м·К) | |
Це́зий (лат. Caesium, обозначается символом Cs) — элемент главной подгруппы первой группы шестого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 55. Простое вещество цезий (CAS-номер: 7440-46-2) — мягкий щелочной металл серебристо-жёлтого цвета. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой).
История
Цезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Бад-Дюркхаймского минерального источника в Германии методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
Нахождение в природе
Цезий входит в группу химических элементов с ограниченными запасами[источник не указан 679 дней] вместе с гафнием, танталом, бериллием, рением, металлами платиновой группы, кадмием, теллуром. Общие выявленные мировые ресурсы руд составляют около 180 тыс. тонн (в пересчёте на окись цезия), но они крайне распылены. Сверхвысокие цены — это неотъемлемая черта, сопровождающая цезий и рубидий в прошлом и настоящем. Мировой объём добычи цезия составляет около 9 тонн в год, а потребность свыше 85 тонн в год и она постоянно растёт. У цезия есть и недостатки, которые обусловливают постоянный поиск его минералов: извлечение этого металла из руд неполное, в процессе эксплуатации материала он рассеивается и потому безвозвратно теряется, запасы цезиевых руд очень ограничены и не могут обеспечить постоянно растущий спрос на металлический цезий (потребности в металле более чем в 8,5 раз превышают его добычу, и положение в металлургии цезия ещё более тревожное, чем, например, в металлургии тантала или рения). Промышленность нуждается именно в очень чистом материале (на уровне 99,9—99,999 %), и это является одной из труднейших задач в металлургии редких элементов. Для получения цезия достаточной степени чистоты требуется многократная ректификация в вакууме, очистка от механических примесей на металлокерамических фильтрах, нагревание с геттерами для удаления следов водорода, азота, кислорода и многократная ступенчатая кристаллизация. Цезий весьма активен и агрессивен по отношению к контейнерным материалам и требует хранения, например, в сосудах из специального стекла в атмосфере аргона или водорода (обычные марки лабораторного стекла цезий разрушает).
Месторождения
По добыче цезиевой руды (поллуцита) лидирует Канада. В месторождении Берник-Лейк (юго-восточная Манитоба) сосредоточено около 70 % мировых запасов цезия. Поллуцит также добывается в Намибии и Зимбабве. В России его мощные месторождения находятся на Кольском полуострове, в Восточном Саяне и Забайкалье. Месторождения поллуцита также имеются в Казахстане, Монголии и Италии (о. Эльба), но они обладают малыми запасами и не имеют важного экономического значения.
Геохимия и минералогия
Среднее содержание цезия в земной коре 3,7 г/т. Наблюдается некоторое увеличение содержание цезия от ультраосновных пород (0,1 г/т) к кислым (5 г/т). Основная его масса в природе находится в рассеянной форме и лишь незначительная часть заключена в собственных минералах. Постоянно повышенные количества цезия наблюдаются в воробьевите (1—4 %), родиците (около 5 %), авогадрите и лепидолите (0,85 %). По кристаллохимическим свойствам цезий наиболее близок к рубидию, калию и таллию. В повышенных количествах цезий находится в калиевых минералах. Цезий, как и рубидий, имеет тенденцию накапливаться на поздних стадиях магматических процессов, и в пегматитах его концентрации достигают наивысших значений. Среднее содержание цезия в гранитных пегматитах около 0,01 %, а в отдельных пегматитовых жилах, содержащих поллуцит, даже достигает 0,4 %, что примерно в 400 раз выше, чем в гранитах. Наиболее высокие концентрации цезия наблюдаются в редкометально замещённых микроклин-альбитовых пегматитах со сподуменом. При пневматолито-гидротермальном процессе повышенные количества цезия связанны с массивами грейзенезированных аляскитов и гранитов с кварц-берилл-вольфрамитовыми жилами, где он присутствует главным образом в мусковитах и полевых шпатах. В зоне гипергенеза (в поверхностных условиях) цезий в небольшом количестве накапливается в глинах, глинистых породах и почвах, содержащих глинистые минералы, иногда в гидроокислах марганца. Максимальное содержание цезия составляет лишь 15 г/т. Роль глинистых минералов сводится к сорбции, цезий вовлекается в межпакетное пространство в качестве поглощённого основания. Активная миграция этого элемента в водах очень ограничена. Основное количество цезия мигрирует «пассивно», в глинистых частичках речных вод. В морской воде концентрация цезия составляет ок. 0,5 мкг/л.[4] Из числа собственно цезиевых минералов наиболее распространены поллуцит (Cs, Na)[AlSi2O6]·nh3O (22 — 36 % Cs2O), цезиевый берилл (воробьевит) Be2CsAl2(Si6O18) и авогадрит (KCs)BF4. Последние два минерала содержат до 7,5 % окиси цезия.
Получение
Основными цезиевыми минералами являются поллуцит и очень редкий авогадрит (K,Cs)[BF4]. Кроме того, в виде примесей цезий входит в ряд алюмосиликатов: лепидолит, флогопит, биотит, амазонит, петалит, берилл, циннвальдит, лейцит, карналлит. В качестве промышленного сырья используются поллуцит и лепидолит.
При промышленном получении цезий в виде соединений извлекается из минерала поллуцита. Это делается хлоридным или сульфатным вскрытием. Первое включает обработку исходного минерала подогретой соляной кислотой, добавление хлорида сурьмы SbCl3 для осаждения соединения Cs3[Sb2Cl9] и промывку горячей водой или раствором аммиака с образованием хлорида цезия CsCl. При втором — минерал обрабатывается подогретой серной кислотой с образованием алюмоцезиевых квасцов CsAl(SO4)2 · 12h3O.
В России после распада СССР промышленная добыча поллуцита не велась, хотя в Вороньей тундре под Мурманском ещё в советское время были обнаружены колоссальные запасы минерала. К тому времени, когда российская промышленность смогла встать на ноги, выяснилось, что лицензию на разработку этого месторождения купила Канадская компания[источник не указан 1279 дней]. В настоящее время переработка и извлечение солей цезия из поллуцита ведется в Новосибирске на ЗАО «Завод редких металлов».
Существует несколько лабораторных методов получения цезия[5]. Он может быть получен:
Все методы являются трудоёмкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
Изотопы
Природный цезий — мононуклидный элемент, состоящий из единственного стабильного нуклида 133Cs. На сегодняшний день известно 39 искусственных радиоактивных изотопов цезия с массовыми числами от 112 до 151[6] (бо́льшая часть известных изотопов цезия приводится в таблице нуклидов). Самым долгоживущим искусственным радиоактивным нуклидом цезия является периодом полураспада T1/2 около 2,3 миллиона лет. Другой относительно долгоживущий изотоп 137Cs (T1/2=30,17 года). Оба эти долгоживущих радионуклида являются продуктами ядерного распада. Цезий-137 является одним из виновников радиоактивного загрязнения биосферы, так как образуется при делении ядер.
Физические свойства

 Кристаллы цезия
Кристаллы цезия Цезий — мягкий металл, из-за низкой температуры плавления (Tпл=28,6 °C) при комнатной температуре находится в полужидком состоянии. Металлический цезий представляет собой вещество золотисто-белого цвета, по внешнему виду похожее на золото, но светлее. Расплав представляет подвижную жидкость, при этом его цвет становится более серебристым. Жидкий цезий хорошо отражает свет. Пары цезия окрашены в зеленовато-синий цвет.
Кристаллизуется цезий в объёмноцентрированную кубическую решётку (тип α-железа), пространственная группа I m3m, a = 0,6141 нм, Z = 2. При высоком давлении может переходить в другие полиморфные модификации[7]. Цезий — парамагнетик.
Цезий растворяется в жидком аммиаке (тёмно-синие растворы) и расплавленном CsOH.
Химические свойства
Цезий является наиболее химически активным металлом, полученным в макроскопических количествах (так как активность щелочных металлов растёт с порядковым номером, то франций, вероятно, ещё более активен, но в макроскопических количествах не получен, так как все его изотопы имеют малый период полураспада). Является сильнейшим восстановителем. На воздухе цезий мгновенно окисляется с воспламенением, образуя надпероксид CsO2. При ограниченном доступе кислорода окисляется до оксида Cs2O. Взаимодействие с водой происходит со взрывом, продуктом взаимодействия являются гидроксид CsOH и водород h3. Цезий вступает в реакцию со льдом (даже при −120 °C), простыми спиртами, галогеноорганическими соединениями, галогенидами тяжёлых металлов, кислотами, сухим льдом (взаимодействие протекает с сильным взрывом). Реагирует с бензолом. Активность цезия обусловлена не только высоким отрицательным электрохимическим потенциалом, но и невысокой температурой плавления и кипения (быстро развивается очень большая контактная поверхность, что увеличивает скорость реакции). Многие образуемые цезием соли — нитраты, хлориды, бромиды, фториды, иодиды, хроматы, манганаты, азиды, цианиды, карбонаты и т. д. — чрезвычайно легко растворимы в воде и ряде органических растворителей; наименее растворимы перхлораты (что важно для технологии получения и очистки цезия). Несмотря на то, что цезий является весьма активным металлом, он, в отличие от лития, не вступает в реакцию с азотом при обычных условиях и, в отличие от бария, кальция, магния и ряда других металлов, не способен образовать с азотом соединений даже при сильнейшем нагревании.
Гидроксид цезия — сильнейшее основание с высочайшей электропроводностью в водном растворе; так, например, при работе с ним необходимо учитывать, что концентрированный раствор CsOH разрушает стекло даже при обычной температуре, а расплав разрушает железо, кобальт, никель, а также платину, корунд и диоксид циркония, и даже постепенно разрушает серебро и золото (в присутствии кислорода — очень быстро). Единственным устойчивым в расплаве гидроксида цезия металлом является родий и некоторые его сплавы.
Применение
Цезий нашёл применение только в начале XX века, когда были обнаружены его минералы и разработана технология получения в чистом виде. В настоящее время цезий и его соединения используются в электронике, радио-, электро-, рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике. В основном применяется стабильный природный цезий-133, и ограниченно — его радиоактивный изотоп цезий-137, выделяемый из суммы осколков деления урана, плутония, тория в реакторах атомных электростанций.
Фотоэлементы, фотоумножители
Благодаря крайне низкой работе выхода электрона, цезий используется при производстве высокочувствительных и малоинерционных фотоэлектрических приборов — фотоэлементов, фотоумножителей. В фотоэлементах цезий обычно применяется в виде сплавов с сурьмой, кальцием, барием, алюминием, или серебром, которые вводятся для повышения эффективности устройства, а также для экономии чрезвычайно дорогого цезия. Такие фотоэлементы способны работать в широком диапазоне длин волн: от дальней инфракрасной, до коротковолновой ультрафиолетовой области электромагнитного излучения, что делает цезиевые фотоэлементы эффективнее рубидиевых.
Детекторы ионизирующего излучения
Иодид цезия в виде монокристаллов (обычно активированный небольшой примесью таллия) является одним из наиболее распространённых сцинтилляторов — веществ, конвертирующих энергию ионизирующего излучения в свет. Это связано с высокой эффективностью поглощения гамма-квантов из-за большого атомного номера обоих основных составляющих иодида цезия, а также с высоким световыходом этого сцинтиллятора. Детекторы заряженных частиц и гамма-излучения на его основе применяются в атомной технике, геологии, медицине, космических исследованиях. Так, например, измерения элементного состава поверхности Марса выполнялись с помощью гамма-спектрометра на основе CsI(Tl), установленного на космическом орбитальном аппарате «Марс-5». Недостатком этого сцинтиллятора является его гигроскопичность, не позволяющая использовать его без герметичной оболочки.
Оптика
Иодид и бромид цезия применяются в качестве оптических материалов в специальной оптике — инфракрасные приборы, очки и бинокли ночного видения, прицелы, обнаружение техники и живой силы противника (в том числе из космоса).
Источники света
В электротехнике цезий применяется в изготовлении светящихся трубок, в виде соединений с цирконием или оловом (метацирконаты и ортостаннаты цезия). Наряду с другими металлами цезий используется для наполнения осветительных газоразрядных металлогалогеновых ламп.
Катализаторы
Цезий нашёл большое применение в производственной химии в качестве катализатора (органический и неорганический синтез). Каталитическая активность цезия используется в процессах получения аммиака, серной кислоты, бутилового спирта, в реакциях дегидрогенизации и при получении муравьиной кислоты. Особенно эффективным является применения цезия как промотора при каталитическом получении аммиака, синтезе бутадиена, и имеет очень большое экономическое значение так как резко увеличивает эффективность синтеза. Очень большое значение приобрел рутений-цезий-углеродный катализатор. В целом применение цезия в катализе имеет не только большую сферу его потребления но и большие перспективы дальнейшего развития. В ряде катализаторов оказалось чрезвычайно эффективным применение цезия совместно с рубидием (оба металла значительно увеличивают каталитическую активность друг друга). Цезий промотирует действие серебряного катализатора и повышает его селективность при эпоксидировании этилена.
Химические источники тока
На основе цезия создан и применяется высокоэффективный твёрдый электролит для топливных элементов (в том числе автомобильных), и аккумуляторов чрезвычайно высокой энергоёмкости — цезий-бета-глинозём (алюминат цезия).
Изотопы
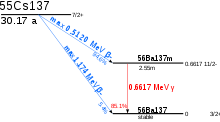
 Схема распада Cs-137.
Схема распада Cs-137. Радиоактивный нуклид цезий-137 претерпевает бета-распад (период полураспада 30,17 лет, продукты распада барий-137m, быстро распадающийся с излучением гамма-кванта с энергией 661,7 кэВ в основное состояние, и барий-137). Гамма-излучение цезия-137 используется в гамма-дефектоскопии, измерительной технике и при стерилизации пищевых продуктов (консервы, туши птиц и животных, мяса), а также для стерилизации медицинских препаратов и лекарств, в радиотерапии для лечения злокачественных опухолей. Также цезий-137 используется в производстве радиоизотопных источников тока, где он применяется в виде хлорида цезия (плотность 3,9 г/см³, энерговыделение около 1,27 Вт/см³). Цезий-137 используется в датчиках предельных уровней сыпучих веществ в непрозрачных бункерах.
Единственный стабильный нуклид цезий-133 используется в атомных часах.
Медицина
На основе соединений цезия созданы эффективные лекарственные препараты для лечения язвенных заболеваний, дифтерии, шоков, шизофрении.
Применение цезия в энергетике и космосе
Значительной сферой применения металлического цезия являются новейшие и стремительно развивающиеся работы и производство энергетических агрегатов. Цезиевая плазма является важнейшей и неотъемлемой компонентой МГД-генераторов с повышенным КПД до 65—70 %. Ионизированые пары цезия являются лучшим рабочим телом для ионных двигателей в космосе.[источник не указан 1309 дней]
Сплав цезия с барием является лучшим [источник не указан 1309 дней] из известных материалов для выпрямления сверхмощных потоков электроэнергии (превосходя в этом отношении ртутные и полупроводниковые вентили) и в будущем займёт важнейшее положение в большой энергетике и космических электроракетных установках. Одним из его отличительных особенностей является возможность выпрямления и коммутирования чудовищных мощностей в импульсном режиме. Ввиду того, что цезий имеет большую теплоёмкость, теплопроводность и ряд собственных сплавов с очень низкой температурой плавления (цезий 94,5 % и натрий 5,5 %) −30 °C, то используется в качестве теплоносителя в атомных реакторах и высокотемпературных турбоэнергетических установках, а сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C среди сплавов.
В течение последних 25 лет цезий исследуется в мире[источник не указан 303 дня] как материя Ридберга (конденсат возбуждённых состояний цезия КВС), по предварительным оценкам, сделанным экспериментально в Швеции и России, КВС цезия при температуре менее 700 K имеет весьма высокую электропроводность и работу выхода менее 1 эВ и вплоть до 0,2 эВ, что позволяет применить металлический цезий для производства высокоэффективных источников тока, электростанций, утилизации тепла (например тепла продуктов сгорания автомобилей). Конденсат возбуждённых состояний цезия образуется при прокачке его паров сквозь перфорированный (губчатый) материал коллектора, имеющий на своей поверхности тончайший слой углерода или окислов (например, карбид гафния, ниобия или тантала). Для исследования КВС цезия применяется растровое лазерное сканирование, оптическая спектроскопия и съёмка видеокамерой, и уже в ходе первых исследований были обнаружены аномальные явления, проявившие себя в образовании кластеров капельной плазменной фракции, окрашенной в зеленые тона, и резком уменьшении работы выхода коллектора.
Металлургия
Металлический цезий на заре поисков его ассимиляции в промышленности обнаружил свойство резко повышать жаропрочность магния и алюминия, так например добавка 0,3—0,4 % цезия к магнию в 3 раза повышает [источник не указан 1309 дней] его прочность на разрыв и резко улучшает его коррозионную стойкость, но ввиду весьма высокой цены, и наличия других более дешёвых металлов для легирования он не применяется для этой цели.
Высокотемпературная сверхпроводимость
Недавно[когда?] найдено, что продукты внедрения цезия в графит (фуллериды) обладают свойством высокотемпературной сверхпроводимости и интенсивно изучаются.
Производство лазеров
В последние годы цезий изучается как рабочее тело и излучательная среда для создания лазеров, имеющих рекордные значения пиковых мощностей как в непрерывном, так и в импульсном режиме работы. В значительной степени этот интерес и капиталовложения направлены на разработку лазеров для вооружения и в области получения термоядерной энергии.[источник не указан 303 дня]
Производство электродов
Цезий используется[источник не указан 303 дня] в качестве добавки к вольфраму для производства электродов мощных осветительных дуговых ламп и электродов, применяемых для сварки алюминия, магния, титана, церия, нержавеющей стали и целого ряда активных сплавов в среде аргона, гелия и водорода. Применение этой добавки (около 0,1—0,35 %) в значительной степени облегчает зажигание и горение дуги при низком напряжении.
Термоэлектрические материалы
Цезий исследуется как компонент Пельтье-охладителей. Оказалось[источник не указан 303 дня], что сплав сверхчистого висмута, сверхчистого теллура и сверхчистого цезия эффективен для создания охладителей, основанных на эффекте Пельтье[источник не указан 1309 дней]. Как показывает практический опыт эксплуатации этого нового полупроводникового материала, его использование наиболее эффективно именно в новейших суперпроцессорах на основе нитрида бора и монокристаллического алмаза в качестве теплоотвода и основы схемы. Применение этого материала открывает широкие возможности для повышения быстродействия микроэлектроники. В опытах с этим новым полупроводниковым материалом удалось на сегодняшний день получить охлаждение вплоть до −237 °C, что позволяет создавать микрохолодильники для охлаждения мощных процессоров (в том числе нанопроцессоров), холодильники для глубокой заморозки тканей и клеточного материала, сжижения газов, охлаждения лазерных систем, тепловизоров, а в перспективе для охлаждения высокотемпературных сверхпроводников для высокоскоростного транспорта на «магнитной подушке». Очень важным направлением использования данного полупроводника ряд специалистов[кто?] рассматривает создание лазеров на монокристаллах алмаза с очень высоким КПД и возможностью работы в пикосекундном диапазоне, что очень важно для конструирования оптоэлектронных систем для обработки информации. Ведущей страной в этой новой области использования является Япония.
Оптические материалы микроэлектроники
Триборат цезия и триборат цезия-лития, а также фосфат цезия-галлия используются как специальные оптические материалы в новейших областях радиоэлектроники.[источник не указан 303 дня]
Пьезоэлектрические материалы
Дигидрофосфат цезия в 7 раз более эффективный пьезоэлектрик, чем кварц [источник не указан 1309 дней]. Хотя несколько уступает по эффективности сегнетовой соли, он более устойчив к влаге, чем последняя.
Атомно-водородная энергетика
Металлический цезий используется[источник не указан 1309 дней] в атомно-водородной энергетике при разложении воды термохимическим способом (цикл «Аэроджет Дженерал»).
Защита воздушных судов
Цезий применяется в производстве специальных ламп[источник не указан 1309 дней] с электронным управлением для создания тепловых помех для ракет противника. Такие цезиевые лампы устанавливаются на современных боевых самолётах и в значительной степени повышают живучесть самолетов в бою.
Прочие области применения цезия
Фторид цезия применяют для получения фторорганических соединений [источник не указан 1309 дней], пьезоэлектрической керамики, специальных стёкол. Хлорид цезия — электролит в топливных элементах, флюс при сварке молибдена.
Биологическая роль
Хлорид рубидия и хлорид цезия участвуют в газовом обмене, активируя деятельность окислительных ферментов, соли этих элементов повышают устойчивость организма к гипоксии.[8]
Цезий в живых организмах
Цезий в живых организмах — постоянный химический микроэлемент организма растений и животных. Морские водоросли например содержат от 0,01-0,1 мкг цезия в 1 г сухого вещества, наземные растения — 0,05—0,2. Животные получают цезий с водой и пищей. В организме членистоногих около 0,067—0,503 мкг/г цезия, пресмыкающихся — 0,04, млекопитающих — 0,05. Главное депо цезия в организме млекопитающих — мышцы, сердце, печень; в крови — до 2,8 мкг/л цезий относительно малотоксичен; его биологическая роль в организме растений и животных окончательно не раскрыта.
Цезий-137 — радиоактивный изотоп цезия, испускающий бета-излучение и гамма-кванты, и один из главных компонентов техногенного радиоактивного загрязнения биосферы. Продукт деления урана-235, урана-238, плутония-244 и других делящихся изотопов. Содержится в радиоактивных выпадениях, радиоактивных отходах, сбросах заводов, перерабатывающих отходы атомных электростанций. Интенсивно сорбируется почвой и донными отложениями; в воде находится преимущественно в виде ионов. Содержится в растениях и организме животных и человека. Коэффициент накопления Cs-137 наиболее высок у пресноводных водорослей и арктических наземных растений, особенно лишайников. В организме животных Cs-137 накапливается главным образом в мышцах и печени. Наибольший коэффициент накопления его отмечен у северных оленей и североамериканских водоплавающих птиц. Накапливается в грибах, ряд которых (маслята, моховики, свинушка, горькушка, польский гриб) считается «аккумуляторами» радиоцезия[9].
Интересные факты
Цезий — самый мягкий металл при комнатной температуре.[10] Также, как и галлий, его можно расплавить в руках (однако, естественно, это можно сделать только при условии, что цезий запаян в стеклянную ампулу, иначе происходит его возгорание).
Примечания
Ссылки
Литература
- Перельман Ф. М. Рубидий и цезий. М., Изд-во АН УССР, 1960. 140 стр. с илл.
- Кульварская Б. С., Соболева Н. А., Татаринова Н. В. Композиционные соединения щелочных металлов — новые эффективные источники ионов и электронов. Изв. АН СССР. Сер. физич.; 1988. Т.52. № 8. С.1509-1512.
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия.- М.-Л.: Химия, 1970.- 407 с
- Солодов Н. А., Рубидий и цезий, М., 1971;
- Плющев В. Е., Степин Б. Д., Аналитическая химия рубидия и цезия, М., 1975
- Коган Б. И., Названова В. А., Солодов Н. А., Рубидий и цезий, М., 1971;
- Моисеев А. А., Рамзаев П. В., Цезий-137 в биосфере, М., 1975;
- Mattsson S., Radionuclides in lichen, reindeer and man, Lund, 1972.
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, h3, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
| ||||||||||
| Библиоинформация: SWD in the DNB: 4147131-3 |
dic.academic.ru

 Кристаллы цезия в ампуле заполненной инертным газом. Плавятся, если ампулу согреть в руке.
Кристаллы цезия в ампуле заполненной инертным газом. Плавятся, если ампулу согреть в руке.  Электрохимический ряд активности металлов
Электрохимический ряд активности металлов 
















