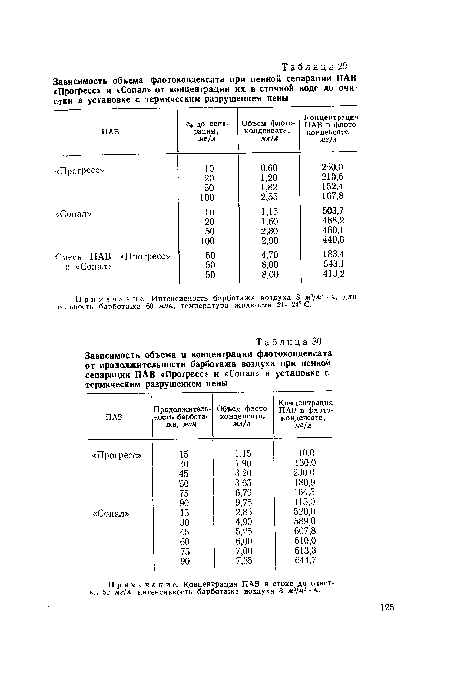
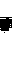16. Протолитическое равновесие. Кислоты, основания, амфолиты по Бренстеду. Вода амфолит
Амфолиты кислотно-основные свойства - Справочник химика 21
Важный класс амфолитов составляют простейшие аминокислоты. Их кислотно-основные свойства обусловлены одновременным присутствием в молекуле функциональных групп, обладающих кислотным и основным характером. В водном растворе типичной аминокислоты, например глицина, устанавливаются три важных равновесия [c.258]Кислотно-основные свойства. а-Аминокислоты являются амфо-терными электролитами (амфолитами). Они образуют соли как с кис- лотами, так и с основаниями [c.500]
Амфотерными электролитами или амфолитами называются такие электролиты, которые могут проявлять одновременно и кислотные, и основные свойства. К ним можно отнести, например, гидроокиси таких металлов, как цинк, алюминий. Подобные гидроокиси могут диссоциировать по уравнениям [c.509]Амфотерные электролиты (амфолиты). Это слабые электролиты, способные проявлять свойства как слабых кислот, так и слабых оснований в зависимости от природы вещества, с которым они вступают в кислотно-основную реакцию. Один и тот же амфолит, взаимодействуя с сильной кислотой, реагирует как слабое основание, а в реакции с сильным основанием ведет себя как слабая кислота. Амфотерными электролитами являются гидроксиды некоторых металлов, например Ве(0Н)2, гп(0Н)2, РЬ(0Н>2, А1(0Н)з, Ге(ОН)з, Сг(ОН)з, 8п(ОН)2, и а-аминокислоты, например глицин СН2(МН2)СООН и аланин СНзСН(КН2)СООН. Вода, которая способна как присоединять протоны, так и отщеплять их, также относится к амфолитам. [c.87]
Соединения, которые в зависимости от условий проявляют как кислотные, так и основные свойства, называются амфотерными, нли амфолитами. К амфотерным электролитам относятся Zn (ОН) 2, А1(0Н)з, Ве(ОН)з, Оа(ОН)з, Сг(ОН)з, Ge(0H)2, Sn(0H)4, Pb(0H)2 и многие другие. Амфотерность проявляется и у соединений, содержащих большие атомы неметаллов, например у H0I. [c.254]
Для индикаторов типа амфолитов, а также для основных индикаторов характерна аминная группа —Такие индикаторы по своим кислотно-основным свойствам являются производными аммиака и в общем виде изображаются формулой К—ЫН , где К — органический радикал. Изменение окраски таких индикаторов обусловлено сдвигом равновесия [c.307]
Амфолит, или амфотерный электролит, — это соединение, обладающее как кислотными, так и основными свойствами. В зависимости от pH среды его суммарный заряд принимает отрицательное, нулевое или положительное значение. С помощью изоэлектрического фокусирования можно фракционировать лишь вещества с амфотерными свойствами. Белки представляют собой наиболее подходящие объекты для изоэлектрического фокусирования. Для этой цели пригодны также многие низкомолекулярные природные соединения. Для создания естественного градиента pH используют преимущественно вещества с амфотерными свойствами. В дальнейшем мы будем называть их амфоли-тами-носителями в отличие от них компоненты разделяемых смесей получат название амфолиты-образцы. [c.298]
Амфотерные соединения (амфотерные электролиты, амфолн-ты) в зависимости от условий способны проявлять либо кислотные, либо основные свойства. Амфолиты — слабые электролиты, с сильной кислотой они обнаруживают основные свойства, а с сильным основанием — кислотные свойства. Амфолитом является вода (h30=И+-fОН ). [c.320]
Для характеристики кислотно-основных свойств амфолитов используют классическую теорию 184], а также константы кислотности по Бренстеду [185]. Исходя из классической теории, амфолиты, не имеющие биполярного строения, характеризуются константами кислотности и основности [c.87]
Единство кислот и оснований подтверждается существованием целого класса соединений, обладающих и кислотными и основными свойствами,— амфотерных электролитов или амфолитов. К амфолитам, помимо воды и аммиака, относятся некоторые гидроокиси металлов 2п(ОН)2, А1(0Н)з и др. Так, для Ме(ОН)г возможны равновесия в кислой среде [c.47]
Определение кислотно-основных свойств амфолитов [c.111]
В справочниках иногда приводят константы диссоциации амфолитов, рассчитанные по результатам их титрования сильными кислотами и щелочами. При этом не учитывается образование биполярных ионов и расчеты основываются на том, что при титровании основаниями нейтрализуются кислотные группы, а при титровании кислотами — основные. Эти константы имеют выражения, приведенные для амфолитов, не имеющих биполярного строения, однако не характеризуют кислотно-основные свойства биполярных ионов. Константы рКа и рКъ и константы диссоциации, характеризующие цвиттерионы рКа и р/Сь )> находятся в следующей зависимости р/Са =14-рАь рКъ =и-рКа. [c.67]
Величина Кг не зависит от pH раствора [184—186]. Для типичных цвиттер-ионов 1д Кг = 4—5, т. е. растворы содержат весьма незначительные концентрации незаряженных молекул. Однако некоторые амфолиты имеют в растворах достаточно высокие концентрации обеих изоэлектрических форм. Кислотно-основные свойства этих амфолитов выражают при помощи четырех констант диссоциации, характеризующих как цвиттер-ионы, так и незаряженные молекулы. При взаимодействии этих соединений с кислотами и основаниями параллельно протекают два процесса с участием незаряженных молекул и цвиттер-ионов, причем отношение их концентраций при титровании остается постоянным. [c.88]
Некоторые оксиды и их гидраты в зависимости от условий проявляют как кислотные, так и основные свойства. Они называются амфотерными соединениями (амфолитами). Такие соединения могут растворяться в кислотах и растворах щелочей. К ним относятся оксиды алюминия, цинка хрома, олова, свинца и др. Например, оксид алюминия А Оз растворяется в кислотах и растворах щелочей по уравнениям [c.18]
Если кислотные и основные свойства участвующих в реакции со щелочью функциональных групп амфолитов характеризуются рКа, + рК у) = 12—16, реакции вытеснения и нейтрализации протекают параллельно, и дифференцированное титрование функциональных групп невозможно. Примером может служить кривая титрования смеси цистеина и глицина (рис. 1, 18). Эта кривая не имеет излома при переходе от реакции вытеснения к реакции нейтрализации, так как сумма р/Св глицина, взаимодействием с которым заканчиваются реакции вытеснения, и р/Са (НЗ) равна 14,52. [c.142]
Характеристические гидроксиды Э(ОН)з — почти нерастворимые в воде вещества. Так, для Са(ОН)з и 1п(ОН)з рПР 37, а для Т1(0Н)з рПР 45. Гидроксид галлия растворяется в сильных кислотах и основаниях. Он является редким примером идеального амфолита, для которого кислотные и основные свойства выражены практически в равной мере. Ниже приводим первые, вторые и третьи константы электролитической ионизации по кислотному и основному типам [c.160]
Большое значение в буферном действии физиологических жидкостей играют белки. Молекулы белков содержат остатки различных аминокислот. Аминокислоты НаМ — Н — СООН проявляют себя как амфолиты. В них группа СООН имеет кислотные, а группа НН 2 — основные свойства. Соответственно белки противодействуют как подкис-лению, так и подщелачиванию среды. [c.155]
Для трехмерных полиамфолитов указанные изменения могут быть выражены в еще больщей степени. При потенциометрическом титровании ионизированных форм это приводит к ряду затруднений. Во-первых, возможны ошибки при интерпретации экспериментальных кривых потенциометрического титрования амфолитов, обусловленных природой оттитрованных функциональных групп. Во-вторых, из-за изменения (уменьшения кислотности или основности) кислотно-основных свойств амфолита при появлении в его фазе зарядов не все функциональные группы полимера могут быть оттитрованы 0,1—0,2н. раствором кислоты или щелочи. Это следует иметь в виду особенно в тех случаях, когда амфолит содержит несколько функциональных групп. Так, амфолит АНКБ-2 содержит группы а-пиколиновой кислоты и 2-метилпиридина. При титровании внутрисолевой формы такого амфолита щелочью получается кривая, на которой имеется один перегиб (см. рис. 3.3). По кривой титрования можно определить концентрацию карбоксильных групп и их р/(а. При титровании такой же формы кислотой на кривой титрования имеется два перегиба, которые ответственны за нейтрализацию пиридиновых групп и азота а-пиколиновой кислоты. Это позволяет достаточно надежно определить концентрацию и рЯг> указанных групп. Интерпретировать же кривые титрования ионизированных форм амфолита значительно сложнее по указанным выше причинам. Для достаточно надежной интерпретации кривых титрования ионизированных форм амфолитов необходимо одновременно использовать другие физико-химические методы, которые позволяют определить состояние ионогенных групп в каждой точке титрования (например, ИК-спектроскопию). [c.113]
Амфолиты — слабые электролиты, с сильной кислотой они обнаруживают основные свойства, а с сильным основанием— кислотные. Амфолитом является вода (НгО = Н+ + ОН-). [c.202]
В данном случае и кислотные, и основные функции определяются свойствами одной и той же группы 0Н . Но существуют амфолиты и другого типа. Их кислотные и основные свойства определяются наличием двух различных функциональных групп. Наиболее характерным примером соединений подобного типа могут служить амино- [c.480]
Большое значение имеют электролиты, которые проявляют и кислотные, и основные свойства. Такие электролиты названы амфотерными или амфолитами. Это гидроокиси некоторых металлов, например цинка и алюминия амфолиты органического происхождения, например аминокислоты. Гидроокись цинка может диссоциировать и как кислота [c.151]
Как показано выше, титрование сильными основаниями позволяет определять в 0,1 н. растворах кислоты, имеющие р/Са Ю, и соли слабых оснований с рК ь 4. С другой стороны, при титровании сильными кислотами определяются основания с р/Сь Ю и соли слабых оснований с р/(ь 4. Ис-ходя из этого, амфолиты, не имеющие биполярного строения, кислотные и основные свойства которых характеризуются рА Ю, могут титроваться как сильными кислотами, так и сильными основаниями. К ним относятся 0-, М-, п-аминофенолы. При их титровании кислотами и щелочами электропроводность раствора до точки эквивалентности увеличивается, так как в процессе реакций в растворе образуются хорощо диссоциирующие соли. [c.67]
Кислотные и основные свойства амфолитов, для которых нехарактерно биполярное строение, слабо выражены и содержание цвиттер-ионов в них ничтожно мало. Типичные цвиттер-ионы, наоборот, обладают довольно сильно выраженными кислотными и основными свойствами. Для многих аминокислот, имеющих биполярную структуру, значение рКа находится в интервале 2—3, а р/Сь имеет значение 4 — 5 [184—186]. [c.88]
В ависимости от условий некоторые вещества проявляют либо кислотные, либо основные свойства. Они называются амфотерными соединениями (или амфолитами). Жидкие Н2О, N113, Н Оз, Н2504 — амфотерные вещества, так как образующиеся при их самоионизации ионы — и кислоты, и основания. Пон Р1зО" — кислота, он может отдавать протон, а ион ОН — основание, так как может принимать протон [c.91]
При титровании кислотами и основаниями пользуются различными методами установления точки эквивалентности (см. 70). Наиболее широко применяются для этой цели различные органические вещества, имеющие характер кислот, которые изменяют свою окраску в зависимости от величины рн раствора. Некоторые цветные индикаторы являются амфолитами, т. е. обладают и кислотными и основными свойствами известны также индикаторы с основными свойствами. Свойства кислотных индикаторов характеризуются следующим равновесием [c.300]
Протонсодержащие ионы НРОГ и Н2РО4 — это частицы-амфолиты, кислотные и основные свойства которых определяются константами соответствующих протолитических равновесий (см. гл. И, 8), Для иона НРО они имеют следующий вид [c.195]
Возможность дифференцированного титрования смесей амфолитов с солями слабых кислот или солями слабых оснований также может быть предсказана, исходя из предложенных критериев. Так как кислотные и основные свойства амфолитов, не образующих цвиттер-ионы, слабо выражены, анализ возможен при условии, что сумма р/(о и р/Сь последовательно взаимодействующих функциональных групп >16. Например, титрование раствором NaOH позволяет проводить анализ смесей 0-, м- и п-аминофенолов с солями слабых оснований—гидроксиламина, семикарбазида и др. Путем титрования раствором НС1 можно анализировать смеси о-, м- и п-аминофенолов с солями слабых кислот — фенолятом натрия, боратом натрия и др. (рис. 93). [c.180]
Продукты реакции, конечно, одни и те же как при одном, так и при другом написании формулы нейтральной аминокислоты, так как нет никакого сомнения, что в кислом растворе аминокислота образует ионы +Nh4 h3 O2H, в то время как в щелочном растворе образуются анионы Nh3 h3 O2. Следует, однако, подчеркнуть, что группы, обусловливающие кислотные и основные свойства, прямо противоположны группам, которым эти свойства приписывались в первоначальных представлениях об аминокислотах. Основные свойства амфолита обусловлены группой — СО2, в то время как кислотные свойства обусловлены группой — Nh4. [c.554]
Термином амфотерностъ систем кислота—основание определяют их специфическое свойство вести себя как кислоты или основания в зависимости от условий. Это понятие издавна занимало важное место в теориях кислотно-основных реакций и нашло также свое отражение в теории Бренстеда-Лоури. Устанавливая критерии кислоты и основания, эта теория ясно говорит, что ам-фотерные свойства имеют вещества, которые в реакциях в растворе могут либо присоединять, либо отдавать протоны такие вещества называются амфипрот-ными веществами или амфолитами. [c.45]
Таким образом, А1(0Н)з не только присоединяет ионы водорода, но и отдает их, т. е. обладает свойствами кислоты и основания, являясь амфолитом. Однако основные и кислотные свойства гидроокиси алюминия выражаются довольно слабо. Константа кислотной диссоциации ее как одноосновной кислоты равна 6-10- 2, а константа основной диссоциации как однокислотного основания равна 210- ° и как трехкислотного основания 110-з2. [c.326]
Кондуктометрический метод позволяет проводить анализ смесей амфолитов, не имеющих биполярного строения, характеризующихся р/Са и рД ь Ю, с солями слабых кислот или слабых оснований. При этом необходимо создавать условия, при которых сумма рЛ а и р/Сь последовательно взаимодействующих функциональных групп или 12, или 16. Поскольку кислотные и основные свойства этих ьмфолитов обычно слабо выражены, более доступны определения в области, когда (р/Са + + р/Сь) >16. [c.76]
Свободная H l дифференцированно не оттитровывается, так как кислотные свойства карбоксильных групп выражены довольно сильно (р/Са = 2,35). Титрование HsN+-rpynn амфолита протекает количественно, потому что их основные свойства выражены достаточно слабо (p/ o = 4,22). [c.131]
chem21.info
16. Протолитическое равновесие. Кислоты, основания, амфолиты по Бренстеду.
ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ На практике наиболее часто имеют дело с протолитическими равновесиями, т. е. реакциями, связанными с переносом про¬тона (реакции нейтрализации, гидролиза и диссоциации). Для рассмотрения протолитических равновесий коротко остановимся на теории кислот и оснований *.
По этой теории кислотой называют всякое вещество, молекулы которого (в том числе и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют всякое вещество, молекулы которого (в том числе и ионы) способны присоединять протон, т.е. быть акцептором протонов; амфолитом называют всякое вещество, которое является и донором, и акцептором протонов.
Данная теория объясняет кислотно-основные свойства не только нейтральных молекул, но и ионов. Кислота, отдавая протон, превращается в основание, которое является сопряженным этой кислоте. Понятия «кислота» и «основание» являются относительными понятиями, так как одни и те же частицы - молекулы или ионы - могут проявлять как основные, так и кислотные свойства в зависимости от партнера.
\
При протолитическом равновесии образуются кислотно-основные пары. Согласно протонной теории, гидролиз, реакции ионизации и нейтрализации не рассматриваются как особое явление, а считаются обычным переходом протонов от кислоты к основанию.
Реакции гидролиза, нейтрализации и ионизации являются частными случаями протолитических равновесий и называются реакциями протолиза. Равновесия, установившиеся в растворах между кислотами и сопряженными основаниями, называются протолитическими.
Многие гидроанионы, например HCO3-, являются в водном растворе амфолитами:
Приведем примеры записи уравнений гидролиза солей, включающих анион-амфолит:
(1) Na2HPO4= 2 Na+ + HPO42-
17. Вода как растворитель. Дифференцирующие и нивелирующие растворители.
Самым распространенным растворителем на нашей планете является вода. Тело среднего человека мас–сой 70 кг содержит примерно 40 кг воды. При этом около 25 кг воды приходится на жидкость внутри клеток, а 15 кг составляет внеклеточная жидкость, в которую входят плазма крови, межклеточная жидкость, спинно-моз-говая жидкость, внутриглазная жидкость и жидкое содержимое желудочно-кишечного тракта. У животных и растительных организмов вода составляет обычно бо–лее 50%, а в ряде случаев содержание воды достигает 90—95%.
Вследствие своих аномальных свойств вода – уни–кальный растворитель, прекрасно приспособленный для жизнедеятельности.
Прежде всего вода хорошо растворяет ионные и мно–гие полярные соединения. Такое свойство воды связа–но в значительной мере с ее высокой диэлектрической проницаемостью (78,5).
Другой многочисленный класс веществ, хорошо раст–воримых в воде, включает такие полярные органиче–ские соединения, как сахара, альдегиды, кетоны, спир–ты. Вследствие высокой полярности во–да вызывает гидролиз веществ.
Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Необходимо отметить, что вода является конечным продуктом биологического окисления веществ, в частно–сти глюкозы.Важны и другие аномальные свойства воды: высо–кое поверхностное натяжение, низкая вязкость, высо–кие температуры плавления и кипения и более высокая плотность в жидком состоянии, чем в твердом.
Для воды характерно наличие ассоциатов – групп молекул, соединенных водородными связями.
В зависимости от сродства к воде функциональные группы растворяемых частиц подразделяются на гид–рофильные (притягивающие воду), легко сольватируе-мые водой, гидрофобные (отталкивающие воду) и ди-фильные.
По характеру влияния на относительную силу кислот, оснований и солей растворители также делят на дифференцирующие и нивелирующие.
Дифференцирующие растворители увеличивают различия в силе электролитов. К этой группе растворителей принадлежат: метил-этилкетон, ацетон. В нивелирующих растворителях электролиты хорошо и примерно одинаково диссоциируют, потому эти растворители уравнивают различия в силе кислот или оснований. Основные растворители (например, жидкий аммиак) являются нивелирующими для кислот.
studfiles.net
Амфолиты - Справочник химика 21
Амфотерными электролитами или амфолитами называются такие электролиты, которые могут проявлять одновременно и кислотные, и основные свойства. К ним можно отнести, например, гидроокиси таких металлов, как цинк, алюминий. Подобные гидроокиси могут диссоциировать по уравнениям [c.509]Известны амфотерные ионообменники (амфолиты), которые в зависимости от условий проведения ионного обмена могут обменивать либо катионы, либо анионы. [c.224]
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидами, или амфотерными электролитами — амфолитами. К таким гидроксидам кроме гидроксида цинка относятся гидроксиды алюминия, хрома(П1), железа (П1), меди(П), олова (IV) и другие. [c.243]
Соединения, которые в зависимости от условий проявляют как кислотные, так и основные свойства, называются амфотерными, нли амфолитами. К амфотерным электролитам относятся Zn (ОН) 2, А1(0Н)з, Ве(ОН)з, Оа(ОН)з, Сг(ОН)з, Ge(0H)2, Sn(0H)4, Pb(0H)2 и многие другие. Амфотерность проявляется и у соединений, содержащих большие атомы неметаллов, например у H0I. [c.254]Для индикаторов типа амфолитов, а также для основных индикаторов характерна аминная группа —Такие индикаторы по своим кислотно-основным свойствам являются производными аммиака и в общем виде изображаются формулой К—ЫН , где К — органический радикал. Изменение окраски таких индикаторов обусловлено сдвигом равновесия [c.307]
Теория мембранного равновесия Доннана позволяет объяснить седлообразную форму кривой, характеризующей зависимость осмотического давления раствора белка от pH среды. В самом деле, в изоэлектрической точке амфолита число ионизированных ионогенных групп минимально. Это и обусловит минимальное давление, Прн добавлении кислоты, например НС1, содержание анионов (хлорид-ионов) в растворе сначала растет быстрее, чем содержание ионов водорода (последние [c.475]
Амфотерные алектролиты. Соедниення, которые способны в зависимости от партнера проявлять себя в качестве как кислот, Tai и осиоваиин, называются амфотерными или амфолитами. Признаком амфотериости с точки зрения теории электролитической диссоциации является способность образовывать как ионы гидроксония, гак и гидроксид-ноны, а с точки зрения протолитической теории — способность быть как донорами, так и акцепторами протогов. [c.182]
Электрический заряд белков, помимо их своеобразного строения, является особенностью их свойств. В белковой молекуле содержатся две полярные группы основная — ЫНг и кислотная — СООН, которые и сообщают макромолекуле амфотерные свойства. Белки не просто электролиты, а электролиты — амфолиты. Это означает, что в водных растворах макромолекулы способны диссоциировать как кислоты, т. е. с отщеплением ионов водорода [c.339]
Аминированием ХМП первичными, вторичными и третичными аминами [309, 310] или аминокислотами [311] получаются соответствующие производные, которые могут быть использованы в качестве анионитов различной основности или амфолитов- [c.291]
Иониты классифицируют по происхождению на природные и синтетические по составу — на неорганические и органические по знаку заряда обменивающихся ионов — на катиониты, аниониты и амфолиты (последние в зависимости от условий могут обмениваться как катионами, так и анионами). [c.164]
Ионы ИЗ , НЗе и НТе представляют собой анионные амфолиты, так что они могут реагировать как кислоты и как основания. [c.515]
Если в предыдущих главах обсуждались примеры анионных амфолитов, то ион [h3N—ЫНз]+ —пример катионного амфолита. [c.537]
В точке эквивалентности, соответствующей стехиометрическому образованию амфолита НСО ", pH находится по формуле (3.56) [c.206]
Обозначим амфи-ион через РН катион, образующийся в кислом растворе,— через а анион, образующийся в щелочном растворе, -- через К . Ионные равновесия в растворах амфолитов удобно рассматривать с точки зрения последовательной диссоциации двухосновной кислоты КНг [c.18]
Подстановка активностей вместо концентрации необходима и при записи выражений для ионного произведения воды, произведения растворимости, констант ассоциации комплексных соединений и констант диссоциации амфолитов. [c.51]
Амфотериым соединением, или амфолитом, по Бренстеду, может быть любая протонсодержащая частица, которая в зависимости от природы партнера по кислотно-основному равновесию либо отдает ему протон, выполняя функцию кислоты, либо присоединяет протон от партнера, выполняя функцию основания. Ниже приводятся примеры таких равновесий [c.44]
При расчете концентрации водородных ионов в растворе гидросоли — амфолита НА — следует исходить из следующих равновесий [c.60]
Это частицы — амфолиты, ибо кроме основной функции, выполняемой в обратном процессе, они способны выполнять и кислотную функцию, например [c.106]
К амфотерным электролитам, или амфолитам, относятся также соединения, способные присоединять или отщеплять протоны, превращаясь соответственно в катионы или анионы. [c.202]
В зависимости от дозы облучения, природы асфальтенового вещества, мономера и их соотношения выход привитого сополимера может составлять 80—90 %. Выход сополимеров для всех изученных мономеров увеличивается при использовании асфальтенового вещества из продуктов первичной переработки нефти. Это очевидно вытекает из его природы, так как асфальтеновое вещество содержит большее по сравнению с продуктами вторичной переработки нефти количество алкильных заместителей и меньщее количество парамагнитных центров. Этот метода нами был использован для получения амфолитов — привитой сополимеризаци-еи акриловой кислоты на порошкообразных слабоосновных анионитах [338]. На основе сополимера асфальтита со стиролом хлор-метилированием с последующим аминированием получен ряд ани-г""тов [339], [c.296]
По знаку заряда обменивающихся ионов иониты разделяются на катиониты, или катионообменники, и аниониты, или анионооб-менники. Существуют также амфотерные иониты, способные к обмену одновременно как катионов, так и анионов. Такие иониты называются амфолитами. [c.100]
В зависимости от знака заряда ионизирующих групп иониты делят на катиониты (катионообменники) и аниониты (аиионообменники). Существуют также амфотерные иониты — амфолиты, которые одновременно обменивают катионы и анионы. [c.155]
При осаждении смешанных галогенидов, например РЬВгР, фторид-ион выпадает в виде труднорастворимой соли. Разумеется, растворимость выпавшей соли сильно зависит от pH раствора. Следует помнить, что фторид-ион в водных системах присутствует в виде ионов Р и НРг . Понижение pH раствора в результате осаждения объясняется освобождением протонов из имеющегося анионного амфолита Нр2 . При достаточном избытке протонов смешанный галогенид снова растворяется. [c.488]
Это уравнение применимо для расчета pH только в растворе амфолита (в рассматриваемом случае ги роселенита натрия) и не пригодно для растворов сильных кислот, например серной. Уравнение (85) можно также применить для расчета pH амфолитов трех- и четырехосновных кислот (например, Н2РО4 , НР04 и др.). Даже в тех случаях, когда уравнение (85) неприменимо для расчета pH растворов амфолитов (для очень сильных или очень слабых многоосновных кислот), по уравнению (85) всегда получают значение pH, при котором концентрация амфолита максимальна. Это значение pH называют изоэлектрической точкой амфолита. [c.134]
Из уравнений (236) и (237) можно получить зависимости a2+= y- и Сд2+=1/2су- соответственно. Если нанести линии сопряженного основания для слабой кислоты HY на логарифмическую диаграмму кислотно-основного равновесия (разд. 38.3.1.2), то в точке ее пересечения с прямой амфолита (1дф = = — 1/2) можно определить растворимость осадка в этой кислоте. Для определения влияния слабой кислоты в сильнокислой области кривой растворимости нужно найти точку пересечения участка кривой с большим наклоном (1 ф = —1) с кривой Ig Y-- lg2. [c.195]
Соединения, которые могут быть как кислотами, так и основаниями, называются, амфипротными или амфолита-ми. Амфолитом является, например, вода, поскольку она может принимать протон и его отдавать, а также многие продукты ступенчатой диссоциации многоосновных кислот, как, например, НРО4 , НС2ОГ и т. д., которые могут и присоединять, и отдавать протон. [c.31]
Некоторые особенности присущи растворам амфолитов — веществ, способных и к присоединению, и к передаче протона (НС2ОГ-, Н2РОГ-, НР04 -ионы и т.д.). Например, НСгОГ-ион наряду с диссоциацией по схеме (3.34) может выступать как акцептор протона [c.51]
Протолитичес1[c.44]
Протонсодержащие ионы НРОГ и Н2РО4 — это частицы-амфолиты, кислотные и основные свойства которых определяются константами соответствующих протолитических равновесий (см. гл. И, 8), Для иона НРО они имеют следующий вид [c.195]
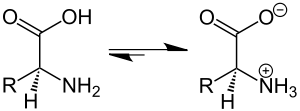
Существует группа соединений, в молекулах которых содержатся кислотные и основные группы. Такие соединения называются амфо-терными электролитами или амфолитами. Классический пример ам-фолитов — аминокислоты жирного ряда NHjR OOH. В водном растворе аминокислот в результате внутренней ионизации образуются цвиттерионы (двойные или диполярные ионы, амфиионы) [c.15]
Конформация цепи определяется степенью ионизации — удаленностью pH от ИЭТ. В ИЭТ раствор полиамфолита показывает минимальные вязкости, степень набухания, растворимость и заряд. Это позволяет использовать зависимость указанных свойств от pH раствора для определения ИЭТ амфолитов. Переход а-спираль— клубок можно наблюдать и по изменению оптического вращения. Удельное вращение [а] раствора складывается из двух членов, одпн из которых соответствует внутреннему вращению, зависящему от асимметричных С-атомов каждого звена, другой — конформа- [c.287]
Аналитическая химия. Т.1 (2001) -- [ c.113 ]Химия для поступающих в вузы 1985 (1985) -- [ c.110 ]
Общая и неорганическая химия 1997 (1997) -- [ c.159 , c.286 , c.406 ]
Общая химия (1987) -- [ c.83 ]
Общая химия в формулах, определениях, схемах (1996) -- [ c.134 ]
Химический энциклопедический словарь (1983) -- [ c.45 , c.224 ]
Общая химия в формулах, определениях, схемах (0) -- [ c.134 ]
Аналитическая химия (1994) -- [ c.48 , c.333 ]
Физикохимия полимеров Издание второе (1966) -- [ c.509 ]
Общая химия в формулах, определениях, схемах (1985) -- [ c.134 ]
Общая химия в формулах, определениях, схемах (0) -- [ c.134 ]
Общая и неорганическая химия (2004) -- [ c.159 , c.286 , c.406 ]
Справочник Химия изд.2 (2000) -- [ c.200 ]
Химия справочное руководство (1975) -- [ c.461 ]
Химический анализ (1966) -- [ c.47 ]
Теории кислот и оснований (1949) -- [ c.139 ]
Энциклопедия полимеров Том 3 (1977) -- [ c.0 ]
Энциклопедия полимеров том 1 (1972) -- [ c.0 ]
Энциклопедия полимеров Том 1 (1974) -- [ c.0 ]
Энциклопедия полимеров Том 3 (1977) -- [ c.0 ]
Общая химия и неорганическая химия издание 5 (1952) -- [ c.126 ]
Курс общей химии (1964) -- [ c.115 ]
Курс качественного химического полумикроанализа 1973 (1973) -- [ c.63 ]
Техника лабораторных работ (1966) -- [ c.453 ]
Справочник полимеров Издание 3 (1966) -- [ c.378 , c.379 ]
Химический анализ (1979) -- [ c.52 , c.54 ]
Курс коллоидной химии (1964) -- [ c.204 ]
Химия (1985) -- [ c.95 ]
Комплексообразующие иониты (1980) -- [ c.174 , c.175 , c.178 , c.290 ]
Физико-химия полимеров 1978 (1978) -- [ c.509 ]
Курс коллоидной химии Поверхностные явления и дисперсные системы (1989) -- [ c.199 , c.203 ]
Общая химия Издание 4 (1965) -- [ c.172 ]
Иониты в химической технологии (1982) -- [ c.14 ]
Химия (1982) -- [ c.75 ]
Основы аналитической химии Часть 2 (1979) -- [ c.0 ]
Краткий курс коллойдной химии (1958) -- [ c.174 ]
Техника лабораторных работ Издание 9 (1969) -- [ c.597 ]
Общая и неорганическая химия (1994) -- [ c.298 ]
Аналитическая химия (1980) -- [ c.57 , c.354 ]
Ионообменный синтез (1973) -- [ c.2 , c.3 , c.4 ]
Курс физической химии Том 2 Издание 2 (1973) -- [ c.480 ]
Лакокрасочные покрытия (1968) -- [ c.344 ]
Курс химического качественного анализа (1960) -- [ c.49 ]
Неорганическая химия (1994) -- [ c.172 , c.174 ]
Химия Издание 2 (1988) -- [ c.102 ]
Курс химического и качественного анализа (1960) -- [ c.49 ]
Основы аналитической химии Издание 2 (1965) -- [ c.144 ]
Основы аналитической химии Кн 3 Издание 2 (1977) -- [ c.310 ]
Физическая химия Книга 2 (1962) -- [ c.0 ]
Общая химия (1968) -- [ c.447 ]
Краткий справочник химика Издание 7 (1964) -- [ c.449 ]
Физическая химия (1967) -- [ c.468 ]
Практическая химия белка (1989) -- [ c.248 ]
Биофизическая химия Т.2 (1984) -- [ c.302 ]
Методы очистки белков (1995) -- [ c.113 , c.225 , c.226 , c.229 , c.324 ]
Методы практической биохимии (1978) -- [ c.118 , c.135 ]
chem21.info
Электролиты амфотерные - Справочник химика 21
Характерным для амфотерных полиэлектролитов является определенное значение рЯ-раствора, при котором электролит отщепляет равные (очень малые) количества н и ОН ионов. При этом молекула белка становится условно электронейтральной. Такое состояние молекулы, свернутой в клубок, с минимальным гидродинамическим сопротивлением называется изоэлектрическим, а соответствующая величина pH - изоэлектрической точкой (точка А на рис. 5,2), [c.83] Таким образом, ири ионизации одновременно образуются ионы Н и ОН , т. е. вода является амфотерным электролитом. Но степень ионизации веды незначительна. При комнатной температуре приме )но лишь одна из 10 молекул воды находится в диссоциированной форме, что подтверждается весьма низкой электропроводностью чистой воды. Вода — очень слабый электролит, ее константа диссоциации и ионное произведение при 25°С равны [c.680]Амфотерный электролит—белок (ср. опыт 272) в растворе проявляет буферные свойства, т. е. может связывать как появляющиеся водородные, так и гидроксильные ионы. В результате окраска индикатора конго переходит от синей к красной (снижается кислотность), а розовая окраска фенолфталеина исчезает (снижается щелочность системы). В этих опытах особенно наглядно обнаруживается амфотерность белка, который в опыте А реагирует как основание, а в опыте Б—как кислота. [c.351]
Гидроксиды галлия и индия амфотерны. Оа(ОН)з— идеальный амфотерный электролит константы диссоциации его по основному и по кислотному типу практически одинаковы. Его кислотные свойства выражены сильнее, чем у гидроксида алюминия. Кислотные свойства 1п(ОН)з выражены слабо. Гидроксид таллия обладает основными свойствами. В кислотах растворяются все гидроксиды, в щелочах — только гидроксиды галлия и индия, образуя гидроксогаллаты и гидрок-соиндаты, например [c.185]
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам обеих этих связей. 1 сли обозначить амфотерный электролит формулой ROH, то его диссоциацию можно выразить схемой [c.244]
Следовательно, вода — самый типичный амфотерный электролит, т. е. она может действовать в равной степени и как кислота, и как основание. [c.192]
Повышение концентрации ОН -ионов в электролите замедляет коррозию таких металлов, как Ре, М (образование гидроокисных защитных пленок на аноде). У металлов же, гидроокиси которых обладают амфотерными свойствами (А1, 2п, РЬ), повышение щелочности среды на разрушение этих металлов действует убыстряющим образом (гидроокиси амфотерных металлов растворимы в щелочах). [c.366]
Вода — слабый амфотерный электролит. При диссоциации ее образуются одинаковые концентрации гидратированных прото- [c.389]
Вода — слабый амфотерный электролит. [c.192]
Зе, Те) — слабые двухосновные кислоты. НгО — очень слабый амфотерный электролит. НгЗ и НгЗе образуют кислые и средние, НгТе — средние соли. [c.352]
Химические свойства Водные растворы НгЭ (Э = 5, 5е, Те) — слабые двухосновные кислоты НгО — очень слабый амфотерный электролит НгЗ и НгЗе образуют кислые и средние, НгТе — средние соли [c.352]
Физико-химическая сущность протекающих при этом явлений объясняется следующим образом. Вода — слабый амфотерный электролит, при диссоциации которого образуются одинаковые количества гидратированных протонов и ионов гидроксила (см. стр. 15, 83). При координации молекул воды ионами металла диссоциация воды усиливается и протоны выталкиваются из внутренней сферы аквокомплексов, в результате чего образуются гидроксокомплексы (лиганды — группы ОН), а раствор становится кислым [c.101]
Оксиды М2О3 (кроме В2О3) и отвечающие им гидроксиды М(ОН)з — амфотерные вещества, плохо растворимые в воде. Свойства гидроксидов как электролитов изменяются немонотонно. А1(0Н)з—амфотерный электролит с некоторой преимущественной диссоциацией как основания, Оа(ОН)з —амфотерный гидроксид практически с одинаковой константой диссоциации как кислоты, так и основания. От Оа(ОН)з к Т1(0Н)з свойства гидроксидов изменяются в целом закономерно в соответствии с возрастанием металлического характера элемента. [c.474]
При переходе к А1(ОН)з в результате увеличения заряда металла и уменьшения ра. иуса его иона обе связи становятся равноценными и диссоциация идет по обеим связям. А1(ОН)з — амфотерный электролит. По мере дальнейшего увеличения заряда элемента Э и уменьшения его радиуса — от кремния к фосфору, сере и хлору — прочность связи Э—О растет, а прочность связи О—Н падает и соединения диссоциируют как кислоты — по типу II. [c.21]
Вода — очень слабый электролит, обл адаюш,ий амфотерными свойствами, т. е. электролит, диссоциирующий с одновременным образованием ионов водорода и гидроксила HaO iH- +ЮН. [c.71]
Как известно, гидроксиды обычно рассматриваются как продукты взаимодействия оксидов с водой независимо от того, наблюдается это взаимодействие в действительности или гидроксид может быть получен только косвенным путем. Вода ио характеру электролитической диссоциации представляет собой идеальный амфолит (амфотерный электролит), поскольку гидроксид-ионы ОН и гид-роксоний-ноны НзО" присутствуют в ней в одинаковой концентрации [c.83]
Водорюдные соединения элементов подгруппы кислорода отвечают формуле НгК (К - символ элемента) Н2О, НгЗ, Н28е, Нг Ге. Они называются хальководородами. При растворении их в воде образуются кислоты (формулы те же). Сила этих кислот возрастает с рюстом порядкового номера элемента, что объ энергии связи в ряду соединений НгК. Вода, диссоциирующая на ионы И и ОН", является амфотерным электролит>зм. [c.209]
Вода — амфотерный электролит, поскольку она при диссоциации образует как ионы водорода, так и гидроксид-ионы. Водные растворы сероводорода, селеноводо-рода и теллуроводорода являются слабыми кислотами, сила, которых от сероводородной к теллуроводородной кислоте возрастает, а устойчивость падает. Разложение воды начинается только при 1000°С, тогда как теллу-роводород неустойчив даже при комнатной температуре. При образовании 1 моля Н2О из элементов выделяется 243 кДж, а при образовании 1 моля НгЗ—только 19 кДж энергии. Образование же 1 моля НаЗе и [c.271]
Химические свойства. НЮ — слабый амфотерный электролит с преобладанием основных свойств, остальные гидроксиды — кислородсодержащие кислоты (оксокислоты). НзЮб — пятиосновная кислота, образующая средние и кислые соли. Кислотные свойства одноосновных кислот усиливаются с увеличением степени окисления галогена и уменьшением его атомного номера. [c.383]
И кислоты, и основания в амфотерных растворителях заметно более слабые электролиты по сравнению с водными растворами. Так, трихлоруксусная кислота, совсем неплохо диссоциирующая в воде (/этиловом спирте — совсем слабый электролит (Кдисс = 2-10 ). Вспомним также и один из тех примеров, с которых начиналась книга сопоставление силы серной кислоты в воде и бутиловом спирте. [c.62]
Гидроокись алюминия нредставляет такой амфотерный электролит. Это вещество имеет очень малое произведение растворимости, и концентрация его ионов, находящихся в насыщенном растворе, чрезвычайно мала. Однако химическое поведение гидроокиси алюминия показывает, что она способна диссоциировать по двум направления.м [c.74]
Физико-химическая сущность протекающих при этом явлений такова. В водных растворах солей алюминия и железа предполагают существование аквакомплексных ионов [А1(Н20)вР и [Ре(Н20)б] , т. е. комплексных ионов, содержащих воду в качестве лигандов. Вода — слабый амфотерный электролит, при диссоциации которого образуются одинаковые количества гидратированных протонов и ионов гидроксила (см. п. 1.6.1). При координации молекул воды ионами металла диссоциация ее усиливается и протоны выталкиваются из внутренней сферы аквакомплексов, в результате чего образуются гидроксокомплексы (лиганды — группы ОН ), а раствор становится кислым [c.608]
Общая химия (1984) -- [ c.262 , c.263 ]Общая химия в формулах, определениях, схемах (1996) -- [ c.125 ]
Общая химия в формулах, определениях, схемах (0) -- [ c.125 ]
Курс аналитической химии Том 1 Качественный анализ (1946) -- [ c.72 ]
Общая химия в формулах, определениях, схемах (1985) -- [ c.125 ]
Общая химия в формулах, определениях, схемах (0) -- [ c.125 ]
Курс общей химии (1964) -- [ c.115 ]
Курс качественного химического полумикроанализа 1973 (1973) -- [ c.266 ]
Аналитическая химия (1975) -- [ c.156 , c.157 , c.158 ]
Общая химия Издание 4 (1965) -- [ c.122 , c.172 ]
Физическая и коллоидная химия (1957) -- [ c.274 , c.275 ]
Физическая химия Том 2 (1936) -- [ c.170 ]
Курс физической химии Том 2 Издание 2 (1973) -- [ c.480 ]
Ионообменные смолы (1952) -- [ c.13 ]
Основы аналитической химии Издание 2 (1965) -- [ c.75 ]
Общая химия (1968) -- [ c.447 ]
Химия Справочник (2000) -- [ c.133 ]
chem21.info
32.Расчет рН протолитических систем. Вывод уравнения Гендерсона- Гассельбаха и его анализ. Зона буферного действия.

Установим на примере ацетатного буфера факторы, влияющие на величину активной кислотности.
В растворе данной буферной системы происходят следующие реакции электролитической диссоциации:
Ch4COOH D Ch4COO– + H+
Ch4COONa → Ch4COO– + Na+
Гидролиз соли, т.е. взаимодействие ацетат-ионов с Н2О
Ch4COO– + HOH D Ch4COOH + OH–
учитывать не будем.)
Таким образом, ионы Н+ образуются только за счет диссоциации некоторого числа молекул уксусной кислоты. Этот процесс является обратимым и количественно характеризуется константой кислотности Kа:
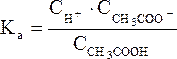
где 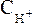 (или
(или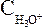 ),
),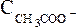 и
и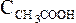 равновесные молярные концентрации ионов Н+, СН3СОО– и непродиссоциированных молекул кислоты.
равновесные молярные концентрации ионов Н+, СН3СОО– и непродиссоциированных молекул кислоты.
Из данного уравнения можно выразить 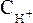 (активную кислотность буферной системы):
(активную кислотность буферной системы):
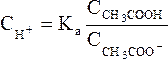
Кроме уксусной кислоты, в растворе присутствует ее соль Ch4COONa. Она является сильным электролитом и полностью распадается на ионы. В результате этого концентрация анионов СН3СОО– резко возрастает, и согласно принципу Ле-Шателье, равновесие реакции диссоциации уксусной кислоты смещается влево, т.е. в сторону образования ее молекул. Причем диссоциация уксусной кислоты в присутствии собственной соли может быть настолько подавленной, что равновесную концентрацию ее нераспавшихся молекул в растворе можно считать равной концентрации СН3СООН, а равновесную концентрацию ацетат-ионов – исходной концентрации соли. В связи с этим выражение, по которому рассчитывается концентрация ионов Н+, можно записать иначе:
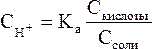
где Скислоты и Ссоли – исходные концентрации компонентов буферной системы.
Прологорифмируем полученное уравнение (с учетом того, что логарифм произведения равен сумме логарифмов сомножителей):
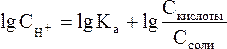
и умножим обе его части на –1:
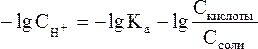
Как было показано нами ранее
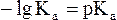
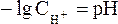
В связи с этим запишем уравнение для расчета концентрации ионов Н+ в окончательном виде:
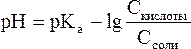
Данное выражение называется иначе уравнением Гендерсона-Гассельбаха. Его можно использовать для вычисления рН любой кислотной буферной системы. Например, для фосфатного буфера уравнение Гендерсона-Гассельбаха запишется следующим образом:
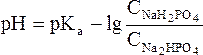 (в данной системе роль слабой кислоты играет анион Н2РО4–, то
(в данной системе роль слабой кислоты играет анион Н2РО4–, то 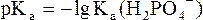 .
.
В водных растворах рН и рОН являются сопряженными величинами. Их сумма всегда равна 14, т.е.:
рН + рОН = 14 Зная концентрацию ионов Н+ или рН, можно вычислить концентрацию гидроксильных ионов или рОН.
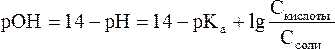
Уравнения Гендерсона-Гассельбаха для расчета рОН и рН в оснóвных буферных системах выглядят следующим образом:
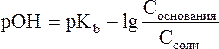
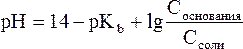
где pKb = –lg Kb (основания), Соснования и Ссоли – исходные молярные концентрации компонентов данных буферных систем, т.е. слабого основания и его соли с сильной кислотой.


34.Буферные системы крови: фосфатная буферная система. Состав, механизм действия, биологическая роль.

35.Буферные системы крови: гемоглобиновая буферная система. Состав, механизм действия, биологическая роль


studfiles.net
Амфолит Википедия
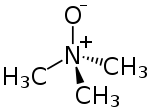 N-оксид триметиламина
N-оксид триметиламина 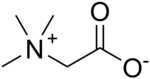 Бетаин — N,N,N-триметиламиноглицин
Бетаин — N,N,N-триметиламиноглицин Цвиттер-ион (биполярный ион; нем. Zwitter — «гибрид»; «гермафродит») — молекула, которая, являясь в целом электронейтральной, в своей структуре имеет части, несущие как отрицательный, так и положительный заряды. Их иногда называют внутримолекулярными солями (например, внутримолекулярные соли аминокислот) и, иногда, (ошибочно) ионными диполярными соединениями. Некоторые химики относят к цвиттер-ионам лишь соединения с зарядами на несоседних атомах. С зарядами на соседних атомах (например, N-оксиды аминов)[1]. Цвиттер-ионные соединения высокополярны и поэтому, как правило, обладают хорошей растворимостью в полярных растворителях (воде, диметилсульфоксиде и т. п.) и слабой — в большинстве органических неполярных растворителей.
Классификация
Бетаины
Одним из наиболее широких классов цвитер-ионных соединений являются бетаины — соединения, в которых содержатся положительно заряженная ониевая группа и анионная группировка, разделенные одним или несколькими атомами[2], среди которых есть как природные соединения, содержащие четвертичную аммонийную группу (N,N,N-триметиламиноглицинат — бетаин, тригонеллин — бетаин N-метилникотиновой кислоты и др.), так и фосфониевые и сульфониевые бетаины.
Особым классом бетаинов являются гетероциклические мезоионные соединения — сидноны и мюнхоны, в которых заряды делокализованы таким образом, что в наборе мезомерных структур присутствуют как структуры с зарядами на соседних так и на несоседствующих атомах:
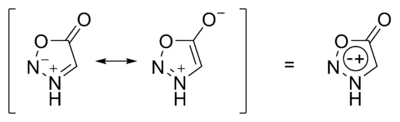 Сидноны
Сидноны 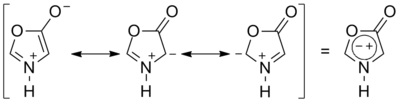 Мюнхоны
МюнхоныИлиды
К цвиттер-ионным соединениям также относят илиды[en]* — 1,2-диполярные соединения, в которых отрицательный заряд локализован на атоме углерода, а положительный — на соседнем гетероатоме, обычно атоме азота (илиды аммониевых солей), фосфора либо серы (илиды фосфония и сульфония). Илиды аммония имеют полностью цвиттер-ионный характер с одинарной связью между атомами с различными зарядами, в случае илидов фосфония и сульфония вследствие участия d-орбиталей гетероатома связь принимает частично двойной характер и структура таких илидов описывается резонансом между иленовой и илидной формами:
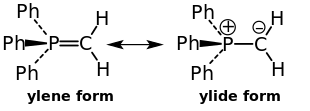
 Аминокислота в нормальной форме (1) и в виде внутренней соли — цвиттер-иона (2)
Аминокислота в нормальной форме (1) и в виде внутренней соли — цвиттер-иона (2) Амфолиты
Амфолиты — молекулы, в структуре которых присутствуют как кислотные, так и основные группы, существующие в виде цвиттер-ионов при определённых значениях pH. Этот pH обозначается как изоэлектрическая точка молекулы. Амфолиты образуют растворы с хорошими буферными свойствами. Благодаря способности к выборочной ионизации они противодействуют изменению pH при добавлении кислоты или основания. В присутствии кислот они принимают на себя протоны, удаляя последние из раствора, и противодействуют повышению его кислотности. При добавлении оснований амфолиты высвобождают ионы водорода в раствор, препятствуя возрастанию pH, и тем сохраняя его равновесие.
Примеры
Типичными примерами цвиттер-ионов являются:
Примечания
wikiredia.ru
13. Ионное произведение воды.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (РН)
Понятие константы диссоциации может быть применено и к растворителям, молекулы которых способны распадаться на ионы.
Если в цепь для определения проводимости воды включить чувст-вительный гальванометр, то он покажет наличие электрического тока. Это значит, что молекулы воды весьма незначительно, но все же диссоцируют на ионы:
h3O ↔ H+ + OH– или 2 h3O ↔ h4O+ + OH–.
(Для простоты записи вместо иона гидроксония h4O+далее будем указывать негидратированный ион Н+. Эта замена совершенно условна, так как протонов в воде не может быть, по расчетам один протон может появиться, если объем раствора равен 1076 л.).
Следовательно, вода является типичным амфотерным электролитом, т. е. она может действовать в равной степени и как кислота, и как основание.
Для процесса диссоциации воды применим закон действующих масс:
v1 = k1 [h3O] v2 = k2[H+][OH–]
v1 = v2, или k1[h3O] = k2[H+][OH]
КД = k1/k2 = [H+][OH] / [h3O].
Константу диссоциации можно вычислить по данным электропроводности. При 22°С она равна 1,8∙10-16, а степень диссоциации 2,9∙10-9, т.е. из 555000000 молекул воды диссоциирует только одна. При такой ничтожно малой диссоциации концентрацию недиссоциированных молекул воды h3O можно полагать равной концентрации общего количества воды, считать величиной постоянной и включить в константу диссоциации
КД·[h3O] = [H+][OH‾] = KW,
т.е. произведение концентраций ионов водорода и гидроксильной группы в любом водном растворе есть величина постоянная (при данной температуре) и называется ионным произведением воды. Можно вычислить Kw.
Рассчитаем молярную концентрацию чистой воды, зная, что 1л воды весит 1 кг (ρ =1кг/л). Молярная концентрация как недиссоциированных, так и исходных молекул воды [h3O] = 1000 / 18 = 55,56 моль/л. Подставив эту величину в выражение для ионного произведения воды, получим
KW = [H+][OH‾] = КД·[h3O] = 1,8∙10-16·55,6 = 10-14
KW показывает, чему равно произведение концентраций ионов водорода и гидроксид-ионов в воде, и называется ионным произведением воды.
Увеличение концентрации водородных ионов вызывает соответствующее уменьшение концентрации гидроксид-ионов, и наоборот. Равновесие между ионами Н+ и ОН‾ существует не только в воде, но и во всех водных растворах. Поэтому соотношение [H+][OH–] = 10–14 может характеризовать кислотность и основность различных сред.
Для процесса нейтрализации
H+(p) + OH‾(p) = h3O(ж)
∆H°298 = -58 кДж/моль; обратный процесс – диссоциация воды является эндотермическим. Отсюда в соответствии с принципом Ле Шателье температура оказывает значительное влияние на КW (табл. 16).
Таблица 16.
Экспериментальные значения константы ионизации воды (KW)
при различных температурах
| t, °С | Kw·1014 | t, °С | Kw·1014 |
| 0 | 0,1139 | 35 | 2,089 |
| 5 | 0,1846 | 40 | 2,919 |
| 10 | 0,2920 | 45 | 4,018 |
| 15 | 0,4505 | 50 | 5,474 |
| 20 | 0,6809 | 55 | 7,297 |
| 25 | 1,008 | 60 | 9,614 |
| 30 | 1,469 | 45 | 4,018 |
Так как KW ≠ 0, то не может быть водного раствора, в котором концентрация H+ или OH– равнялась бы нулю. Следовательно, в любом водном раствope всегда присутствуют совместно ионы H+ и OH–.
В нейтральной среде
[H+][OH–] = 10–14; [H+] = [OH–],
откуда [H+]2 = 10–14, и [H+] = [OH–] = (10–14)1/2 = 10–7.
Изменение концентрации ионов водорода, а отсюда, естественно, и концентрации гидроксид-ионов, приводит к увеличению кислотности (щелочности) среды.
[H+]:
 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14
10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14


увеличение кислотности увеличение щелочности
нейтральный
раствор
Таким образом,
в кислой среде [H+] > 10-7 моль/л и [OH–] < 10-7 моль/л,
в щелочной среде [H+] < 10-7 моль/л и [OH–] > 10-7 моль/л.
Для характеристики кислотности (щелочности) среды можно пользоваться любой из этих величин, так как
[H+] = 10–14 / [OH–], [OH–] = 10–14 / [H+].
Обычно кислотность и щелочность среды характеризуют концентрацией водородных ионов.
Строго говоря, постоянство ионного произведения воды справедливо лишь в том случае, если аналитические концентрации ионов заменены их активностями. Это особенно важно для концентрированных водных растворов сильных кислот и оснований (для малых концентраций H+ и OH– значения концентрации и активности практически совпадают).
Концентрации ионов водорода, а также и гидроксида, выраженные в молях ионов на литр, обычно составляют малые доли единицы. Пользоваться ими неудобно. Поэтому введена особая единица измерения концентраций ионов водорода, называемая водородным показателем, и обозначаемая pH.
Водородным показателем называется отрицательный десятичный логарифм значения молярной концентрации ионов водорода:
pH = −lg[H+].
Например,
[H+] = 1·10-7 моль/л lg[H+] = –7 pH = 7,0
[H+] = 1·10-5 моль/л lg[H+] = –5 pH = 5,0
[H+] = 5·10-3 моль/л lg[H+] = 0,7–3 = –2,3 pH = 2,3
[H+] = 3·10-7 моль/л lg[H+] = 0,48–7 = –2,3 pH = 6,52
Аналогично отрицательный десятичный логарифм OH– называется гидроксильным показателем и обозначается pOH.
Характер среды, выраженный через pH и pOH, можно показать сле-дующим образом:
pH = pOH = 7 – среда нейтральная;
pH < 7; pOH > 7 – среда кислая;
pH > 7; pOH < 7 – среда щелочная.
Из выражения [H+][OH–] = 10–14 очевидно следует, что
рН + pOH = 14.
Зная pH, можно установить pOH, и наоборот.
рН 1н. соляной кислоты должен быть равен 0, а рН 1н. щелочи – 14. Может ли он быть меньше 0 или больше 14? Казалось бы для 10 н. кислоты рН будет равен –1. На самом деле такого нет, поскольку это уже очень концентрированный раствор и кислота в нем далеко не полностью диссоциирована. Поэтому, как было уже отмечено, для концентрированных растворов электролитов концентрации должны быть заменены активностями.
lgаH+ + lgаOH– = – 14;
Кислотность и щелочность (рН) является важнейшей характеристикой всех водных растворов и естественных водных объектов (реки, озера, моря, океаны ).
рН контролирует скорость многих химических, биологических и биохимических процессов, играет важную роль в медицине, в технологии пищевой и перерабатывающей промышленности. Например, pH крови 7,34 (артериальная) и 7,4 (венозная). Повышение pH крови хотя бы на 0,1 ведет к тяжёлому заболеванию. Растения развиваются при определенных значениях pH. Микроорганизмы также развиваются при определенных pH. Так, актиномицеты, ацидофилы, грибковые бактерии растут при pH = 4-6. Все болезнетворные микробы развиваются при pH 7.3-8.0. Даже для деления микробов используют различия в pH их жизнедеятельности.
Приближенные значения рН некоторых растворов приведены в табл. 17.
Таблица 17.
рН некоторых растворов
| Раствор | рН | Раствор | рН |
| 1М раствор HСl | 0,0 | Дождевая вода | 6,5 |
| Желудочный сок | 1,4 | Чистая вода при 25°С | 7,0 |
| Лимонный сок | 2,1 | Раствор пищевой соды | 8,5 |
| Апельсиновый сок | 2,8 | Раствор буры | 9,2 |
| Томатный сок | 4,1 | Известковая вода | 10,5 |
| Молоко | 6,9 | 1М раствор NaOH | 14,0 |
Для измерения pH раствора существуют различные методы.
Точное значение рН определяют потенциометрическим методом. Для этого измеряют ЭДС гальванического элемента, имеющего электрод, потенциал которого зависит от концентрации (активности) ионов водорода. В качестве такого электрода обычно используют стеклянный электрод, действие которого основано на свойстве тонкой стеклянной мембраны обменивать ионы Na+ на ионы водорода.
Сравнительно грубое, но быстрое определение рН раствора может быть произведено с помощью специальных реактивов – кислотно-основных индикаторов, окраска которых меняется в зависимости от концентрации ионов водорода.
studfiles.net