Вода, как химическое вещество. Вещество вода
Какое вещество вода?
Вода – это неорганическое соединение, состоящее из кислорода и водорода. В нормальных условиях это бесцветная, прозрачная жидкость, которая не имеет запаха и вкуса. В твердом виде вода называется снегом, льдом или инеем, в газообразном – паром. Примерно 71% всей поверхности планеты покрыт водой. На океаны припадает примерно 96% водных запасов, на остальные 4% припадают озера, ледники, болота и грунтовые воды. По своей природе вода является отличным растворителем и всегда в своем составе содержит растворенные вещества или газы, за исключением дистиллированной воды. Вода является важнейшим источником жизни на всей планете. Поэтому в нашей статье мы попытаемся рассказать вам все об этом удивительном веществе, а главное, какое вещество вода по своей природе и каковы ее химические и физические свойства.
Физические свойства воды
- При нормальных атмосферных условиях вода сохраняет жидкое состояние, в то же время как остальные водородные соединения схожего плана являются газами. Это явление объясняется особыми свойствами сложения молекул и атомов воды, и присутствующими между ними связями. Атомы кислорода присоединены к атомам водорода, образуя угол почти в 105 градусов, и данная конфигурация сохраняется всегда. Через большую разницу электроотрицательности атомов кислорода и водорода, электронные облака сильно сдвинуты в сторону кислорода. В связи с данной причиной молекула воды считается активным диполем, в котором водородная сторона имеет положительный заряд, а кислородная отрицательный. В результате молекула воды образует связи, разорвать которые довольно сложно и на это потребуются большие затраты энергии.
- Вода практически не поддается сжиманию. Так, при увеличении атмосферного давления на один бар, вода сжимается лишь на 0.00005 часть, от ее первоначального объема.
- Структура льда и воды очень схожи. Как во льду, так и в воде, молекулы стараются расположиться в некотором определенном порядке – они хотят образовать структуру, но тепловое движение препятствует этому. Когда вода переходит в твердое состояние, тепловое вращение молекул уже не препятствует структурному образованию, после чего молекулы упорядочиваются, и пустоты между ними увеличиваются, от чего, следовательно, падает плотность. Вот чем объясняется тот момент, что вода – это вещество очень аномальное. Твердое агрегатное состояние воды – лед, может спокойно плавать на поверхности жидкого агрегатного состояния воды. Когда же происходит испарение, наоборот, все связи сразу же разрываются. На разрыв данных связей требуется немаленькое количество энергии, что объясняет наибольшую теплоемкость воды среди всех веществ. Чтобы подогреть литр воды на 1 градус, необходимо потратить около 4 кДж энергии. Благодаря этому свойству вода часто используется в качестве теплоносителя.
- Вода обладает высоким поверхностным натяжением, уступая в данном показателе лишь ртути. Большая вязкость воды объясняется ее водородными связями, которые мешают молекулам совершать движения с разными скоростями.
- Вода является хорошим растворителем. Молекулы растворяемого вещества сразу же окружаются молекулами воды. Положительные частицы растворяемого вещества притягиваются атомами кислорода, а отрицательные – атомами водорода. Так как размеры молекул воды достаточно малы, то каждую молекулу растворяемого вещества может окружить сразу большое количество молекул воды.
- Вода - это вещество, которое имеет отрицательный электрический потенциал поверхности.
- В чистом виде, вода является хорошим изолятором, но так как в ней зачастую растворены те или иные вещества, соли или кислоты, то в воде всегда находятся отрицательные и положительные ионы. Благодаря этим свойствам вода может проводить электричество.
- Показатель преломления воды – n=1.33. Но вода прекрасно поглощает инфракрасное излучение, и в связи с этим свойством вода, а точнее водяной пар является парниковым газом. Также вода способна поглотить микроволновое излучение, на чем и основано действие СВЧ печей.
Химические свойства
Те, кто думают, что вода - органическое вещество, сильно ошибаются. Воду образуют два элемента – кислород и водород. Далее рассмотрим основные химические свойства воды.
Можно получить воду с помощью следующих реакций:
Также в ходе реакции нейтрализации:
С помощью восстановления оксида меди водородом:
При комнатной температуре вода реагирует:
С активными металлами:
С фтором и галоидными соединениями:
С солями, образованными слабым основанием и слабой кислотой, притом вызывая их гидролиз:

- С галогенангидридами и ангидридами неорганических и карбоновых кислот.
- С металлоорганическими соединениями (реактивы Гриньяра, диэтилцинк, метилнатрий).
- С нитридами, карбидами, фосфидами, гидридами, силицидами щелочных металлов.
- С большинством солей, притом образуя гидраты.
- С силанами и боранами.
- С недокисью углерода и кетеном.
- С фторидами благородных газов.
При нагревании реагирует с магнием, железом:
С метаном и углем:
В присутствии катализаторов реагирует:
- С эфирами и амидами.
- С алкинами.
- С нитрилами.
- С алкенами.
Надеюсь, что наша статья помогла вам разобраться какое вещество вода, и теперь вы будете знать про нее гораздо больше.
elhow.ru
AlvogenORS RU
Несмотря на длительную историю изучения, вода продолжает оставаться одной из самых загадочных субстанций Земли. Ученые насчитывают у нее порядка 60 аномальных свойств, которые не в силах объяснить современная наука. И что удивительно, именно благодаря этим свойствам когда-то зародилась и продолжает существовать жизнь на нашей планете.
5 фактов о воде
Топ-5 особенностей воды выглядит следующим образом:
- Вода — единственное вещество, которое встречается в природе сразу в 3 агрегатных состояниях: твердом, жидком и газообразном. Вероятно, поэтому на планете так трудно найти место, где ее не было бы совсем. Даже знойный воздух пустынь содержит немного влажных испарений.
- Вода — универсальный растворитель. В ней растворяется большинство известных соединений, включая газы. Она же является благоприятной средой для протекания любых видов химических реакций.
- Вода как вещество характеризуется необычно большой теплоемкостью. Чтобы нагреть один ее литр всего на 1 градус необходимо затратить 4200 джоулей энергии. Для сравнения, для нагревания 1 кг железа на тот же градус требуется 460 джоулей. Благодаря этой особенности воды, климатические изменения на планете происходят плавно.
- Вода отличается высокой стабильностью. Даже при нагревании до 2000 градусов ее молекулы сохраняют свою целостность. Лишь очень незначительное их число распадается на атомы водорода и кислорода.
- Вода, по сути, является основным строительным материалом для человеческого организма. Например, мозг состоит из нее на 85%, легкие — на 80%, сердце — на 70%.
Последний факт доказывает огромную значимость воды для человека. Но каковы реальные ее функции в нашем организме?
Вода и человек
Вода не просто входит в состав клеток — она постоянно перемещается в них. С водой в ткани поступают питательные элементы, с ней же наружу вымывается все ненужное и вредное. Именно текучесть воды и ее способность растворять большинство соединений обеспечивают весь спектр биохимических процессов, без которых невозможно существование человека.
Вода также отвечает за сохранение тепла. Благодаря ее большой теплоемкости, температура тела в норме не опускается ниже 36 градусов. Кроме того, вода служит своеобразным внутренним амортизатором. Практически все полости человеческого организма заполнены какими-либо жидкостями, которые защищают жизненно важные органы от динамических нагрузок.
Минимальное количество воды, необходимое человеку для поддержания жизнедеятельности, зависит от массы его тела, климатических условий и тяжести работы. Считается, что в среднем на 1 кг веса следует употреблять 50 мл жидкости в день. В условиях жаркого климата и при больших физических нагрузках физиологическую норму нужно увеличивать в 1,5-2 раза.
Недостаточное поступление воды в организм ведет к замедлению всех обменных процессов и, как следствие, к ухудшению здоровья. Причинами дефицита жидкости могут стать:
- Несоблюдение правильного питьевого режима.
- Пищевое отравление у взрослых и детей.
- Лихорадка.
- Интенсивные физические нагрузки.
- Обильные и частые мочеиспускания.
Распознать обезвоживание можно по мучительной жажде, учащенному пульсу, головокружению и резкому снижению работоспособности.
Чтобы не доводить дело до беды, во всех потенциально опасных ситуациях (например, при первых признаках диареи или перегрева) важно как можно раньше начать мероприятия по восстановлению водного баланса в организме.
К сожалению, парой стаканов воды обойтись не получится. Ведь вместе с жидкостью организм теряет жизненно необходимые ему электролиты: калий и натрий. Решить проблему помогут специальные аптечные средства — регидранты, одним из которых является О.Р.С. Алвоген первая помощь. В его состав входят все необходимые соли и глюкоза, которая повышает их усвоение.
О.Р.С. Алвоген — это средство первой помощи при тепловом ударе, диарее, похмелье и интенсивном потоотделении. Восстанавливая водно-солевой баланс в организме, препарат способствует предотвращению развития тяжелых осложнений и возвращает хорошее самочувствие.
www.alvogenors.ru
Доклад - Обычное и необычное вещество вода
Оглавление
Введение…………………………………………………………………….3
Основная часть
1. Свойства воды…………………………………………………………5
2. Строение молекулы воды…………………………………………….10
Заключение…………………………………………………………………12
Библиография………………………………………………………………13
Приложение…………………………………………………………………14
Введение
Вода – одно из самых распространённых веществ в природе (гидросфера занимает 71 % поверхности Земли). Воде принадлежит важнейшая роль в геологии, истории планеты. Без воды невозможно существование живых организмов. Дело в том, что тело человека почти на 63% — 68% состоит из воды. Практически все биохимические реакции в каждой живой клетке – это реакции в водных растворах. В растворах же (преимущественно водных) протекает большинство технологических процессов на предприятиях химической промышленности, в производстве лекарственных препаратов и пищевых продуктов. И в металлургии вода чрезвычайно важна, причём не только для охлаждения. Не случайно гидрометаллургия – извлечение металлов из руд и концентратов с помощью растворов различных реагентов – стала важной отраслью промышленности.
Вода – вещество обычное и необычное. Известный советский учёный академик И. В. Петрянов свою научно-популярную книгу о воде назвал «самое необыкновенное вещество в мире». А «Занимательная физиология», написанная доктором биологических наук Б. Ф. Сергеевым, начинается с главы о воде – «Вещество, которое создало нашу планету».
Учёные абсолютно правы: нет на Земле вещества, более важного для нас, чем обыкновенная вода, и в тоже время не существует другого такого вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах.
Почти ⅔ поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. От воды зависит климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У неё очень большая теплоёмкость. Нагреваясь, она поглощает тепло; остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много тепла и тем самым «выравнивает» климат. А от космического холода предохраняет Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров…
Свойства воды
Наиболее полно изучены свойства воды, благодаря которым возникла жизнь. Эти свойства сделали возможным существование живой природы в том диапазоне температур, который характерен для Земли как космического тела. Что же это свойства?
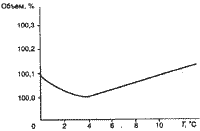
Плотность воды.
Одно из важнейших свойств воды — ее плотность. Максимальную плотность пресная вода имеет при 4 °С. При этой температуре один килограмм воды занимает минимальный объем (рис.1 ). При понижении температуры от 4 °С до 0 плотность уменьшается, т. е. вода с температурой 4°С находится внизу, а более холодная поднимается наверх, где и замерзает, превращаясь в лед.
Плотность обычного льда — твердой кристаллической фазы воды — меньше плотности воды, поэтому лед плавает на поверхности, предохраняя воду от дальнейшего охлаждения. Он выступает в роли ледяной «шубы», защищающей пресноводный объект от полного промерзания. Таким образом формируются условия для жизни обитателей водоемов при низких температурах.
В морской воде растворено значительное количество солей, и она ведет себя при охлаждении совершенно по-другому. Температура ее замерзания зависит от солесодержания, но в среднем составляет — 1,9°С. Максимальная плотность такой воды — при температуре -3,5°С. Морская вода превращается в лед, не достигая максимальной плотности. Поэтому происходит вертикальное перемешивание морской воды при ее охлаждении от плюсовой температуры до температуры замерзания. Благодаря такой циркуляции нижние горизонты океана обогащаются кислородом, а в верхние слои из нижних поступает вода, богатая питательными веществами. Необходимо отметить, что как морской, так и пресный лед легче воды и плавает на ее поверхности, предохраняя глубинные слои воды в морях и океанах от непосредственного контакта с холодными массами воздуха и способствуя тем самым сохранению тепла. В то же время искусственно при высоком давлении были получены разные модификации льда. Одни из них тяжелее воды, другие плавятся и, следовательно, замерзают при высокой температуре. Это так называемый «горячий лед». Поэтому всем нам повезло не только с наличием на Земле воды и солнечной радиации, но и с величиной атмосферного давления. Иначе вся Земля могла бы оказаться скованной ледяным панцирем.
Термодинамические константы воды.
Вода имеет особенные, аномальные свойства. В первую очередь это касается таких термодинамических констант, как теплоемкость воды, теплота парообразования, скрытая теплота плавления льда. Аномальаный характер этих величин определяет большинство физико-химических и биологических процессов на Земле.
Удельная теплоемкость воды составляет 4,1868 кДж/(кг-К), что почти вдвое превышает удельную теплоемкость таких веществ, как этиловый спирт (2,847), растительное масло (2,091), парафин (2,911) и многие другие. А это значит, что при нагревании на одинаковое количество градусов вода способна воспринять почти вдвое больше тепла, чем перечисленные жидкости. Но и при остывании вода отдает больше тепла, чем другие жидкости. Поэтому при нагревании вод Мирового океана под воздействием солнечных лучей и их остывании при отсутствии энергии солнечной радиации теплоемкость выступает как свойство, обеспечивающее минимальные колебания температуры воды днем и ночью, летом и зимой.
Аномально высокое значение имеет теплота парообразования воды. Эта величина более чем вдвое превышает теплоту парообразования этанола, серной кислоты, анилина, ацетона и других веществ. Поэтому даже в самое жаркое время вода испаряется крайне медленно, что способствует ее сохранению и, следовательно, сохранению жизни на Земле.
Высокое значение скрытой теплоты плавления льда также обеспечивает стабильность температурного режима на планете. Одно из интересных свойств воды заключается в том, что ее наименьшая теплоемкость приходится на температуру 37 °С, а это значит, что при данной температуре необходимы минимальные энергетические затраты для ее изменения. Наверное, поэтому температура тела теплокровных существ близка к этому значению.
Вода имеет аномально высокие значения и других констант. Вещества, образованные соединением водорода со стоящими в одном ряду периодической таблицы кислородом, серой, селеном, теллуром, называются гидридами. Гидрид кислорода называется водой. Необычность свойств гидрида кислорода, по сравнению со свойствами других гидридов, заключается в том, что, в отличие от них, вода в обычных условиях (при нормальном давлении и температуре от 0 до 100 °С) находится в жидком состоянии, а не в газообразном. Если бы вода не обладала аномальными значениями температуры кипения и замерзания, то эти процессы происходили бы при значительно более низких отрицательных температурах, и вода в жидком виде присутствовала бы на более холодных планетах. И следовательно, жизни на Земле не было бы.
Сила поверхностного натяжения воды.
Есть и другие особые свойства воды, которые позволяют назвать ее поистине удивительнейшим соединением. Речь идет о поверхностном натяжении жидкости. Силы взаимодействия молекул, составляющих воду, притягивают их друг к другу, и разорвать эту связь не так просто. Большинству людей известен школьный опыт, когда осторожно положенная в блюдце с водой иголка плавает на поверхности. Многие видели интереснейший фокус, когда в полный стакан воды опускают значительное количество монет и вода, не переливаясь через край, поднимается небольшим куполом. Наконец, известна библейская легенда о том, как Христос шел по воде. Все эти явления и легенды связаны с большим поверхностным натяжением воды. Благодаря поверхностному натяжению, вода поднимается по капиллярным каналам в грунте на поверхность Земли, поступает в ткани и клетки растений и живых организмов. Из всех известных жидкостей только у ртути сила поверхностного натяжения выше, чем у воды. Известна очень интересная особенность воды, связанная с распространением в ней звуковых волн. Скорость распространения звука в воде аномально высока, она превышает скорость его распространения в воздухе почти в 6 раз.
Свойства чистой воды.
Чистая вода представляет собой прозрачную жидкость без цвета и запаха. При давлении 1 атм вода замерзает при температуре 0, а кипит при 100 °С. При повышении давления вдвое вода закипает при температуре 120 °С, а при понижении вдвое — при 81 °С. Однако при уменьшении давления температура плавления льда (или замерзания воды) повышается. При низких давлениях вода может существовать только в виде льда или пара, а при высоких температурах — только в виде пара. Существуют также критические значения давления и температуры воды. При давлении свыше 22,1 атм. и температуре свыше 374,4°С исчезает разница между жидкостью и паром вода существует в газообразном состоянии.
Удивительные значения давления и температуры атмосферы сложились на Земле, так как именно при этих значениях вода присутствует на планете в жидком виде, обеспечивая развитие всех существующих форм жизни. При этих параметрах происходит растворение в воде кислорода, необходимого для жизни водных организмов, а также для протекания процессов самоочищения воды. На протяжении многих тысячелетий наличие атмосферы, гидросферы и солнечного излучения создавало незначительный перепад температур летом и зимой, днем и ночью, обеспечивая условия для существования жизни.
Способность воды к растворению.
Однако самая удивительная особенность воды — ее способность растворять другие вещества. Способность веществ к растворению зависит от их диэлектрической постоянной. Чем она выше, тем больше способно вещество растворять другие. Так вот, для воды эта величина выше, чем для воздуха или вакуума в 9 раз. Поэтому пресные или чистые воды практически не встречаются в природе. В земной воде всегда что-то растворено. Это могут быть газы, молекулы или ионы химических элементов. Считается, что в водах Мирового океана могут быть растворены все элементы таблицы периодической системы элементов, по крайней мере, на сегодня их обнаружено более 80.
Строение молекулы воды
Эти два элемента — водород и кислород — являются антагонистами. Один из них господствует в Космосе, другой — на Земле. Один (водород) стремится отдать единственный электрон своей электронной оболочки, а другой (кислород) стремится заполучить два электрона от других химических элементов.
Анализируя состав молекулы воды, можно сказать, что в ней два атома водорода и один атом кислорода «нашли друг друга». Таким образом, в составе воды, химическая формула которой записывается как Н2 0 теоретически могут присутствовать девять различных стабильных видов воды (число перестановок из 5 по 3) Однако 99,97% всей води — в гидросфере представлено обычной водой вида 1 Н216 0. доля тяжелой воды 2 Н216 0 составляет менее 0,02%.
Современной науке известно несколько моделей, с помощью которых можно разрешить многие аномальные свойства воды. Считается, что некоторые свойства определяются количеством ассоциаций молекул мономеров (Н2 О)1, димеров (Н2 О)2 и тримеров (Н2 О)3, которые преимущественно присутствуют в воде при различных температурах. Так, при температуре около 0 в воде присутствуют в основном тримеры, при температуре около 4°С — димеры, а в газообразном состоянии вода содержит главным образом мономеры. Иногда эти ассоциации называют тригидролями.
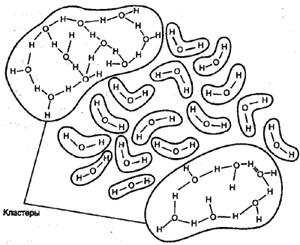
Некоторые ученые предлагают рассматривать воду как совокупность ассоциаций молекул, включая при этом в каждую ассоциацию от одной до восьми молекул. Другие считают, что структура воды представляет собой пространственное «кружево», образованное различными «мерцающими кластерами» (рис.2). Третьи предлагают исследовать свойства воды с учетом особенностей строения ее молекулы, которые, в свою очередь, определяются особенностями составляющих молекулу воды элементов. В соответствии с современными представлениями, молекула воды похожа на маленький магнит.
Почему в воде присутствуют растворенные вещества? Датский ученый Н. Бьеррум в 1951 г. предложил модель молекулы воды с точечным распределением зарядов. В соответствии с современными представлениями, молекула воды представляет собой тетраэдр (или пирамиду, ( рис. 3), в середине которого размещен центр молекулы, а в углах – электрические заряды.
Два положительных заряда соответствуют двум атомам водорода, каждый из которых «предоставил» свои электроны атому кислорода, и т отрицательных заряда, соответствующих «непарным» электронам кислорода. Таким образом, молекула воды представляет собой диполь, один из полюсов которого имеет положительный заряд, а другой — отрицательный. Полюсы диполя разнесены на некоторое расстояние, поэтому в электростатическом поле диполь воды разворачивается вдоль линий напряженности электрического поля. Если электростатическое поле образовано отрицательно заряженным ионом, то диполь воды разворачивается к этому иону своим положительным полюсом, и наоборот. Свойства воды как растворителя во многом определяются поляризованным строением ее молекулы. Высокая полярность молекул является причиной активности воды при химических взаимодействиях, при растворении в ней солей, кислот и оснований, т. е. при образовании электролитов. Вода способна растворять многие вещества, создавая с ними однородные физико-химические системы переменного состава. Растворенные в природных водах соли находятся в ионном состоянии, т. е. подвергнуты электролитической диссоциации.
Заключение
В ходе курсовой работы были рассмотрены свойства и строение молекулы воды. Вода – это вещество на первый взгляд обычное, но если рассмотреть его более подробно, то можно выяснить много чего интересного и необычного. Во первых, вода – это источник жизни на Земле, если бы не было воды то не зародилась бы жизнь. Во вторых, свойства которыми обладает вода, не обладает не одно вещество. Вода может находиться в трех агрегатных состояниях, при определенной температуре. Вода также может принимать и отдавать тепло, и испарятся медленнее чем другие вещества. Более того, в воде могут распространяться звуковые волны и причем с очень высокой скоростью. Но самое удивительное свойство воды, это способность растворять другие вещества.
Что же касается строения воды, то оно по своему также уникально. Вода состоит из двух атомов водорода и одного атома кислорода, можно сказать что эти атомы просто нашли друг друга. Но ученые до сих пор не могут разгадать всех особенностей строения этого удивительного вещества, и многое для нас всех остается загадкой.
Вот что представляет собой на первый взгляд обычное вещество. А ведь никто и не задумывался о том когда каждый день сталкивается с водой, что это столь не вероятное и очень не обычное вещество, хранящее в себе много неразгаданных тайн. Но до конца нам их и не разгадать, в этом и есть вся необычность и особенность воды, без которой бы мы никогда не появились на свет.
Библиография
1. Ахметов Н.С., Неорганическая химия. М., 2001г.
2. Глинка Н.Л., Общая химия. СПб, 2003г.
3. Кнунянц И. Л., Химическая энциклопедия. Том 1. М., 2002г.
4. Петрянов И.В., Самое необыкновенное вещество в мире. М., 2005г.
5. Хомченко Г.П., Химия для поступающих в ВУЗы. М., 2002г.
Приложение
( рис 1.)
( рис. 2)

( рис.3)
www.ronl.ru
вода (вещество) - это... Что такое вода (вещество)?
вода (вещество)- water (substance)
вода (вещество) —[http://www.eionet.europa.eu/gemet/alphabetic?langcode=en]
EN
water (substance)Common liquid (h3O) which forms rain, rivers, the sea, etc., and which makes up a large part of the bodies of organisms. (Source: PHC)[http://www.eionet.europa.eu/gemet/alphabetic?langcode=en]
Тематики
- охрана окружающей среды
EN
DE
FR
Русско-английский словарь нормативно-технической терминологии. academic.ru. 2015.
- вода
- вода в зоне водонефтяного контакта
Смотреть что такое "вода (вещество)" в других словарях:
вода (вещество) — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN water (substance) Common liquid (h3O) which forms rain, rivers, the sea, etc., and which makes up a large part of the bodies of organisms. (Source: PHC)… … Справочник технического переводчика
ВОДА — ВОДА. I. Физико химические свойства и состав воды. Водные пространства мирового океана и морей составляют 361 млн. кв. км и занимают 71% всей земной поверхности. В свободном состоянии В. занимает самую поверхностную часть земной коры, т. н.… … Большая медицинская энциклопедия
Вещество — в химии физическая субстанция со специфическим химическим составом. В философском словаре Григория Теплова в 1751 году словом вещество переводился латинский термин Substantia. Вещество в современной физике как правило понимается… … Википедия
ВЕЩЕСТВО АБСОЛЮТНО СУХОЕ — высушенное при t 105 110 °С. В м лах и г. п. вода может присутствовать в виде: а) гигроскопической воды, т. е. адсорбированной твердым веществом из окружающего его воздуха, которая и удаляется; б) связанной воды, в которую входит и… … Геологическая энциклопедия
ВОДА — главное вещество, содержащееся в живых организмах. Первая среда жизни. Главная отличительная (от других планет) черта Земли. Может оказывать благоприятное (при наличии достаточного количества) или неблагоприятное (при нехватке или отсутствии)… … Экологический словарь
Вода — хим. соединение водорода и кислорода. Весовой состав ее: 11,19% Н и 88,81% О. Молекулярная масса 18,0153. В молекуле В. имеется 10 электронов (5 пар): одна пара внутренних электронов расположена вблизи ядра кислорода, две пары внешних электронов… … Геологическая энциклопедия
Вещество огнезащитное — – огнезащитное вещество (смесь) – вещество (смесь), обеспечивающее огнезащиту. [ГОСТ 12.1.033 81] Рубрика термина: Огнезащита материалов Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги … Энциклопедия терминов, определений и пояснений строительных материалов
ВОДА — (Н2О), жидкость без цвета и запаха, покрывающая более 70% поверхности Земли. Самый распространенный растворитель. Без воды не может быть жизни; она составляет 60 70% человеческого тела. Вода представляет собой соединение водорода и кислорода. Две … Научно-технический энциклопедический словарь
ВЕЩЕСТВО БИОКОСНОЕ — по В. И. Вернадскому (1965), вещество, создаваемое одновременно живыми организмами и косными процессами и являющееся закономерной структурой, состоящей из живого и косного вещества (вода, почва, кора выветривания). Экологический энциклопедический … Экологический словарь
Вещество — – качественная сущность материала, то, из чего состоит физическое тело. [Ушеров Маршак А. В. Бетоноведение: лексикон. М.: РИФ Стройматериалы. 2009. – 112 с.] Вещество – вид материи, обладающий массой покоя. [Блюм Э. Э. Словарь… … Энциклопедия терминов, определений и пояснений строительных материалов
Вещество аварийно химически опасное — – опасное химическое вещество, применяемое в промышленности и сельском хозяйстве, при аварийном выбросе (разливе) которого может произойти заражение окружающей среды в поражающих живой организм концентрациях (токсодозах). [ГОСТ Р 55201… … Энциклопедия терминов, определений и пояснений строительных материалов
normative_ru_en.academic.ru
вода (вещество) - это... Что такое вода (вещество)?
вода (вещество)- Wasser
вода (вещество) —[http://www.eionet.europa.eu/gemet/alphabetic?langcode=en]
EN
water (substance)Common liquid (h3O) which forms rain, rivers, the sea, etc., and which makes up a large part of the bodies of organisms. (Source: PHC)[http://www.eionet.europa.eu/gemet/alphabetic?langcode=en]
Тематики
- охрана окружающей среды
EN
DE
FR
Русско-немецкий словарь нормативно-технической терминологии. academic.ru. 2015.
- вода
- вода для использования в сельском хозяйстве
Смотреть что такое "вода (вещество)" в других словарях:
вода (вещество) — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN water (substance) Common liquid (h3O) which forms rain, rivers, the sea, etc., and which makes up a large part of the bodies of organisms. (Source: PHC)… … Справочник технического переводчика
ВОДА — ВОДА. I. Физико химические свойства и состав воды. Водные пространства мирового океана и морей составляют 361 млн. кв. км и занимают 71% всей земной поверхности. В свободном состоянии В. занимает самую поверхностную часть земной коры, т. н.… … Большая медицинская энциклопедия
Вещество — в химии физическая субстанция со специфическим химическим составом. В философском словаре Григория Теплова в 1751 году словом вещество переводился латинский термин Substantia. Вещество в современной физике как правило понимается… … Википедия
ВЕЩЕСТВО АБСОЛЮТНО СУХОЕ — высушенное при t 105 110 °С. В м лах и г. п. вода может присутствовать в виде: а) гигроскопической воды, т. е. адсорбированной твердым веществом из окружающего его воздуха, которая и удаляется; б) связанной воды, в которую входит и… … Геологическая энциклопедия
ВОДА — главное вещество, содержащееся в живых организмах. Первая среда жизни. Главная отличительная (от других планет) черта Земли. Может оказывать благоприятное (при наличии достаточного количества) или неблагоприятное (при нехватке или отсутствии)… … Экологический словарь
Вода — хим. соединение водорода и кислорода. Весовой состав ее: 11,19% Н и 88,81% О. Молекулярная масса 18,0153. В молекуле В. имеется 10 электронов (5 пар): одна пара внутренних электронов расположена вблизи ядра кислорода, две пары внешних электронов… … Геологическая энциклопедия
Вещество огнезащитное — – огнезащитное вещество (смесь) – вещество (смесь), обеспечивающее огнезащиту. [ГОСТ 12.1.033 81] Рубрика термина: Огнезащита материалов Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги … Энциклопедия терминов, определений и пояснений строительных материалов
ВОДА — (Н2О), жидкость без цвета и запаха, покрывающая более 70% поверхности Земли. Самый распространенный растворитель. Без воды не может быть жизни; она составляет 60 70% человеческого тела. Вода представляет собой соединение водорода и кислорода. Две … Научно-технический энциклопедический словарь
ВЕЩЕСТВО БИОКОСНОЕ — по В. И. Вернадскому (1965), вещество, создаваемое одновременно живыми организмами и косными процессами и являющееся закономерной структурой, состоящей из живого и косного вещества (вода, почва, кора выветривания). Экологический энциклопедический … Экологический словарь
Вещество — – качественная сущность материала, то, из чего состоит физическое тело. [Ушеров Маршак А. В. Бетоноведение: лексикон. М.: РИФ Стройматериалы. 2009. – 112 с.] Вещество – вид материи, обладающий массой покоя. [Блюм Э. Э. Словарь… … Энциклопедия терминов, определений и пояснений строительных материалов
Вещество аварийно химически опасное — – опасное химическое вещество, применяемое в промышленности и сельском хозяйстве, при аварийном выбросе (разливе) которого может произойти заражение окружающей среды в поражающих живой организм концентрациях (токсодозах). [ГОСТ Р 55201… … Энциклопедия терминов, определений и пояснений строительных материалов
normative_ru_de.academic.ru
Удивительное вещество - вода

Разделы: Химия, Конкурс «Презентация к уроку»
Презентация к уроку
Загрузить презентацию (2,5 МБ)
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель:
- Развитие информационной и коммуникативной компетенций.
- Формирование представлений о воде, как об удивительном веществе. Ее аномалиях, нахождении в природе, физических и химических свойствах и значении.
Оборудование и реактивы: компьютер, слайды, стаканчики с водой, лед, железо, мерный цилиндр с водой, надувной мяч в виде глобуса, капельная пипетка, натрий, оксид кальция, оксид фосфора(V), универсальный индикатор, фенолфталеин.
Тип урока: изучение нового материала.
Методы, приемы и средства:
- использование технологии РКМ;
- рассказ учителя с элементами беседы;
- лабораторный опыт исследовательского характера;
- демонстрационные опыты;
Ход урока
Земной шар как мяч, цилиндр с водой.
Слайды
I. Изучение нового материала.
Учитель бросает мяч в класс несколько раз нескольким учащимся. Вопрос: Какой цвет мяча вы поймали? Вопрос: Что мы будем изучать сегодня на уроке? После ответа учащихся объявляется тема урока. Затем показ слайдов (слайд №1, 2)
Учитель: Вода, вещество знакомое каждому человеку с момента рождения, и вы уже многое о ней знаете, но еще больше предстоит узнать. У вас на столах лежит таблица, с которой вы сегодня будете работать. Итак, что вы знаете о воде? (слайд №3, 4, 5)
Что вам известно из уроков биологии о воде? (колыбель, в которой зародилась жизнь на Земле). Во всех процессах, которые происходят в клетках, участвует вода.
У человека количество воды в протоплазме различных тканей варьирует от 20% (в костях) до 85% (в клетках головного мозга). Вода выполняет в протоплазме ряд функций. В ней растворено большинство других содержащихся в протоплазме веществ, водная среда необходима для того, чтобы они могли диффундировать и реагировать между собой. Вода помогает удалению “отходов” обмена веществ, растворяя их. Вода обладает большой способностью поглощать тепло с минимальным изменением собственной температуры. Вода предохраняет протоплазму от внезапных изменений температуры.(сл. №6)
Вода обладает способностью поглощать большое количество тепла при переходе из жидкого состояния в газообразное, давая возможность организму освободиться от избытка тепла путем испарения воды, (слайд №7)
Характерная для воды высокая теплопроводность создает возможность равномерного распределения тепла между тканями тела. Вода служит также незаметным смазочным материалом.
Мы сравнительно редко болеем, в частности, потому что вода обладает тепло-проводимостью, а воды в человеческом организме составляет примерно 65% от массы.
Если бы человек был сделан, скажем из железа, он охлаждался бы и простужался бы от каждого даже небольшого сквозняка или дуновения ветра. А знаете ли вы, в каком органе человека больше всего воды, а в каком меньше?
Стекловидное тело нашего глаза содержит 99% воды, а в эмали зубов содержится лишь 0,2%.
В каких агрегатных состояниях встречается вода на нашей планете?
Не каждое вещество этим может похвастаться, кроме того, у воды есть много аномалий.
Первая аномалия: воде по ее химической структуре положено плавиться и кипеть при низких температурах, которых на Земле не бывает. Не было бы, значит, на Земле ни твердой, ни жидкой воды. А был бы один пар. А она кипит при 100°С.
Вторая аномалия: высокая теплоемкость. У воды она в 10 раз больше, чем у железа. Из-за исключительной способности воды поглощать тепло температура при ее нагревании и охлаждении изменяется незначительно, поэтому морским обитателям никогда не угрожает ни сильный перегрев, ни чрезмерное охлаждение.
Третья аномалия: у воды очень высокая удельная теплота парообразования. Если бы у воды не было этого свойства, многие озера и реки летом быстро бы пересохли до дна, и вся жизнь в них погибла.
Четвертая аномалия: замерзая, вода расширяется на 9% по отношению к прежнему объему. Поэтому лед всегда легче незамерзшей воды и всплывает вверх. Под такой “шубой” даже зимой в Арктике морским животным не очень холодно.
Перечислите физические свойства воды? (лабораторный опыт учащихся), (слайд №8, 9)
А теперь рассмотрим химические свойства воды (демонстрационные опыты). Учащиеся записывают уравнение реакций и определяют их тип. (слайд №10)
Учитель. Казалось бы, что наша планета водой не обиженна, ведь мы знаем, что 2/3 её составляет вода, но большинство водных массивов на Земле соленые. Они не пригодны ни для орошения, ни для питья, ни для промышленности.
Учитель. Представьте себе
Ситуация 1
Вы отправились в кругосветное путешествие и оказались одни на корабле среди бесконечного океана. У вас кончилась питьевая вода, за бортом только соленая. Можно ли из нее сделать пресную?
Ответ: Перегонка воды.
Ситуация 2
Если имеется пресная вода, но очень грязная, что можно сделать?
Ответ: Фильтрование. Отстаивание.
Я прочту вам сказку “Вода”, которую написал Леонардо да Винчи: “Вода весело плескалась в родной морской стихии. Но однажды ей взбрела в голову шальная мысль добраться до самого неба, (слайд №11,12)
Она обратилась за помощью к огню. Своим обжигающим пламенем он обратил воду в мельчайшие капельки теплого пара, которые оказались гораздо легче воздуха. Пар тот час устремился вверх, поднимаясь в самые высокие и холодные слои воздуха. Оказавшись в заоблачной выси, капельки пара окоченели так, что у них зуб на зуб не попадал от холода. Чтобы согреться, они тесно прижались друг другу, став немного тяжелее воздуха, тут же попали на землю в виде обычного дождя. Заболев тщеславием, вода вознеслась к небу, но была изгнана оттуда.
Жаждущая земля поглотила дождь до единой капельки. И воде еще долго пришлось отбывать наказание в почве, прежде чем она, смогла возвратиться в морские просторы.
О каком естественном процессе очистки воды рассказал автор? (слайд - круговорот воды в природе, (слайд №13)).
Применение воды
Промышленность нашей страны ежесекундно потребляет столько воды, сколько несет ее Волга. На получение 1т стали расходуется 150 т воды, бумаги - 250 т, синтетических волокон - 4000т.
Вода используется в сельском хозяйстве Для полива, например, овощных, зеленых и технических культур, а также при производстве сельскохозяйственной продукции.
Многие химические процессы ускоряются в присутствии воды, т.е. вода играет роль катализатора. А, например, при получении кислот, гашении извести, в процессах гидратации, схватывания и затвердевания связывающих материалов (цемент, гипс, известь) вода - активный реагент.
Как это ни странно звучит, но вода играет определенную роль и в искусстве: каскады прудов и фонтаны украшают сады и парки. Во многих странах есть традиция сооружать зимой ледяные скульптуры героев сказок и легенд.
Учитель. Не смотря на то, что воды на Земле много с каждым годом все больше ощущается недостаток запасов пресной, чистой воды. Охрана воды, как и охрана природы вообще, становится глобальной проблемой человечества.
По данным ООН по охране природы и охране среды, скоро на Земле начнутся перебои с питьевой водой. Прогноз на ближайшие 30 лет показывает, что к 2032 году практически нарушится, так как люди нанесут урон 70% территории планеты. Половина населения Земли будет страдать от нехватки питьевой воды. I закон об охране воды был принят еще Петром I, но запасы питьевой воды неуклонно уменьшаются и виновата в этом прежде всего антропогенная деятельность человека.
Ребята, я надеюсь, что вы узнали для себя что-то новое о воде. Я предлагаю заполнить 3-ю и 4-ю колонки таблицы, которую мы начали заполнять в начале урока. И закончить урок, я предлагаю составлением “синквейна” о воде, (слайд №14, 15).
Домашнее задание: параграф34, ответить на вопросы, которые вы записали в 4-ю колонку таблицы.
Литература.
- Великие тайны прошлого. М.: РидерзДрайджест. 2003.
- А. Заломленников. Кинель течёт, а купаемся в фонтане // Приложение к газете “Вести от “Партнёра”. 2007, №6 (статья в газете).
- Д.С. Исаев. Анализ загрязненной воды // Химия в школе 2001, №7 (статья в журнале).
- М. Колтун. Мир химии. М.: Детская литература. 1988.
- Г.Л. Маршанова. Аналитический семинар. “Вода в природе и жизни человека” // Химия в школе. 2006 №2 (статья в журнале).
- Суровцева Р.П. Поурочные разработки с дидактическим материалом к учебнику Л.С. Гузея. “Химия - 8”. М.: Дрофа, 2003.
- Хорьякова Н.Л., Асеева З.Г. Анализ воды из природных источников // Химия в школе. 2001, №7. с 64- 70. (статья в журнале).
xn--i1abbnckbmcl9fb.xn--p1ai
Вода, как химическое вещество
Реферат по химии : «Вода как химическое вещество»
Вода – вещество привычное и необычное. Известный советский ученый академик И.В.Петрянов свою научно – популярную книгу о воде назвал “Самое необыкновенное вещество в мире”. А доктор биологических наук Б.Ф.Сергеев начал свою книгу “Занимательная физиология” с главы о воде – Вещество, которое создало нашу планету.
Ученые правы: нет на Земле вещества более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах.
Почти 60% поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. Из общего количества воды на Земле, равного 1 млрд. 386 млн. кубических километров, 1 млрд. 338 млн. кубических километров приходится на долю солёных вод Мирового океана, и только 35 млн. кубических километров приходится на долю пресных вод. Всего количества океанической воды хватило бы на то, чтобы покрыть ею земной шар слоем более 2,5 километров. На каждого жителя Земли приблизительно приходится 0,33 кубических километров морской воды и 0,008 кубических километров пресной воды. Но трудность в том, что подавляющая часть пресной воды на Земле находится в таком состоянии, которое делает её труднодоступной для человека.
Почти 70% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30% - в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод.
Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Изотопный состав. Существуют девять устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее: 1Н216О – 99,73%, 1Н218О – 0,2%,1Н217О – 0,04%, 1h3Н16О – 0,03%. Остальные пять изотопных разновидностей присутствуют в воде в ничтожно малых количествах.
Строение молекулы. Как известно, свойства химических соединений зависят от того, из каких элементов состоят их молекулы, и изменяются закономерно. Воду можно рассматривать как оксид водорода или как гидрид кислорода. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О – Н 0,957 нм; валентный угол Н – О – Н 104o 27’.
Но поскольку оба водородных атома расположены по одну сторону от кислородного, электрические заряды в ней рассредоточиваются. Молекула воды полярна, что является причиной особого взаимодействия между разными её молекулами. Атомы водорода в молекуле воды, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул.Такая химическая связь называется в о д о р о д н о й. Она обьединяет молекулы воды в своеобразные полимеры пространственного строения. В водяном паре присутствует около 1% димеров воды. Расстояние между атомами кислорода – 0,3 нм. В жидкой и твёрдой фазах каждая молекула воды образует четыре водородные связи: две – как донор протонов и две – как акцептор протонов. Средняя длина этих связей – 0, 28 нм, угол Н – О – Н стремится к 1800 .Четыре водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра.
Структура модификаций льда представляет собой трёхмерную сетку. В модификациях, существующих при низких давлениях, так называемый лёд – I , связи Н – О – Н почти прямолинейны и направлены к вершинам правильного тетраэдра. Но при высоких давлениях обычный лёд можно превратить в так называемые лёд – II, лёд – III так далее – более тяжёлые и плотные кристаллические формы этого вещества. Самые твёрдые, плотные и тугоплавкие пока – лёд – VII и лёд – VIII. Лёд – VII получен под давлением 3 млрд Па, он плавится при температуре + 1900 C . В модификациях – лёд – II - лёд – VI – с вязи Н – О – Н искривлены и углы между ними отличаются от тетраэдрического, что обусловливает увеличение плотности по сравнению с плотностью обычного льда. Только в модификациях лёд – VII и лёд – VIII достигается самая высокая плотность упаковки: в их структуре две правильные сетки, выстроенные из тетраэдров, вставлены одна в другую, при этом сохраняется система прямолинейных водородных связей.
Трёхмерная сетка водородных связей, построенная из тетраэдров, существует и в жидкой воде во всём интервале от температуры плавления до критической температуры, равной + 3,980 С. Увеличение плотности при плавлении, как и в случае плотных модификаций льда, объясняется искривлением водородных связей.
Искривление водородных связей увеличивается с ростом температуры и давления, что ведёт к возрастанию плотности. С другой стороны при нагревании средняя длина водородных связей становится больше, в результате чего плотность уменьщается. Совместное действие двух фактов объясняет наличие максимума плотности воды при температуре + 3, 980 С.
Физические свойства воды аномальны, что объясняется приведёнными выше данными о взаимодействии между молекулами воды.
Вода – единственное вещество на Земле, которое существует в природе во всех трёх агрегатных состояниях – жидком, твёрдом и газообразном.
Плавление льда при атмосферном давлении сопровождается уменьшением объёма на 9%. Плотность жидкой воды при температуре, близкой к нулю, больше, чем у льда. При 00С 1 грамм льда занимает объём 1,0905 кубических сантиметров, а 1 грамм жидкой воды занимает объём 1,0001 кубических сантиметров. И лёд плавает, оттого и не промерзают обычно
насквозь водоёмы, а лишь покрываются ледяным покровом.
Температурный коэффициент объёмного расширения льда и жидкой воды отрицателен при температурах соответственно ниже - 2100 С и + 3,980 С.
Теплоёмкость при плавлении возрастает почти вдвое и в интервале от 00 С до 1000 С почти не зависит от температуры.
Вода имеет незакономерно высокие температуры плавления и кипения в сравнении с другими водородными соединениями элементов главной подгруппы VI группы таблицы Менделеева.
Нужно подвести дополнительную энергию, чтобы расшатать, а затем разрушить водородные связи. И энергия эта очень значительна. Вот почему так велика теплоёмкость воды. Благодаря этой особенности вода формирует климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. Нагреваясь, она поглощает тепло, остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много тепла, и тем самым “выравнивает” климат. Особенно заметно на формирование климата материков влияют морские течения, образующие в каждом океане замкнутые кольца циркуляции. Наиболее яркий пример – влияние Гольфстрима, мощной системы тёплых течений, идущих от полуострова Флорида в Северной Америке до Шпицбергена и Новой Земли. Благодаря Гольфстриму средняя температура января на побережье Северной Норвегии, за Полярным кругом, такая же, как в степной части Крыма, - около 00 С, т. е. повышена на 15 – 200 С. А в Якутии на той же широте,
infourok.ru






















