Формула толуола: что такое толуол и как его получить? Толуол вода
Толуол с водой - Справочник химика 21
Особого внимания заслуживают смеси жидкостей со слабой взаимной растворимостью. Примерами таких смесей могут служить смеси толуола с водой, бензина с водой, бензола с водой, ксилола с водой и др. [c.32]Пример 8.2. Определить температуру кипения смеси толуола с водой, а также состап равновесного пара, если система находится под давлением /5=1,265 бар (950 мм рт. ст.). [c.266]
Другой способ разделения двойной азеотропной смеси состоит в добавлении третьего компонента, который может образовать тройную азеотропную смесь с более низкой температурой кипения, как это, например, имеет место при абсолютировании спирта отгонкой смеси спирта, воды и бензола (стр. 35). Иногда при добавлении третьего компонента образуется новая двойная азеотропная смесь, при отгонке которой можно выделить одну из составных частей первоначальной смеси. Так, если к азеотропной смеси толуола с уксусной кислотой, кипящей при 105,4°, прибавить воду, то при перегонке в первую очередь будет отгоняться азеотропная смесь толуола с водой, кипящая при 84,1°, а затем уксусная кислота, которая не образует с водой постоянно кипящей смеси. Наконец, для выделения одного из компонентов азеотропной смеси можно воспользоваться любым способом, кроме перегонки вымораживанием, химической реакцией, в которой участвует один из компонентов смеси, и,т. п. [c.167]
При использовании обводненной пропионовой кислоты время реакции ацилирования увеличивалось в 2,5—3 раза. В целях сокращения времени реакции ацилирования и потерь дефицитной пропионовой кислоты разработан метод выделения пропионовой кислоты из азеотропа вода — пропионовая кислота с использованием толуола в качестве разделителя [2]. Толуол с водой образует гетерогенный азеотроп вода — толуол состава [c.83]При совместной перегонке толуола с водой [c.54]
Для изучения побочных продуктов авторами был проанализирован непрореагировавший фенол (его отгоняли из реакционной массы в вакууме) и неочищенный дифенилолпропан (сырец). Вследствие того что некоторые примеси содержатся в дифенилолпропане в количестве менее 1% и при этом точность анализа недостаточна, для их концентрирования проводили перекристаллизацию дифенилолпропана-сырца из смеси толуола с водой. Кристаллы дифенилолпропана отфильтровывали, а маточный толуол разгоняли. Полученный кубовый остаток представлял собой смесь побочных продуктов и дифенилолпропана, количество которого соответствует его растворимости в толуоле при комнатной температуре. [c.75]
Эффективность добавок видна из следующего примера. При осуществление синтеза в присутствии хлористого водорода и алкил-меркаптана в качестве промотора по окончании реакции в образующиеся продукты вводили одну из указанных кислот вместе с толуолом, который добавляли для отгонки воды. После вакуумной отгонки азеотропной смеси толуола с водой, а затем — фенола был получен продукт с т. пл. 154 °С и светопропусканием 92—94% (продукт, полученный при тех же условиях, но без стабилизатора, имел светопропускание 80%). После 200 мин выдерживания при 200 °С светопропускание первого образца снизилось до 80—88%, а второго— до 70%. Таким образом, испытанные добавки несколько увеличивают теплостойкость дифенилолпропана, но не предотвращают полностью его разложение. [c.131]
Полученный авторами по этой методике орто-орто-изомер после перекристаллизации из толуола с водой имел т. пл. 119°С хроматограмма показывает в нем примесь только орто-пара-изомера дифенилолпропана. [c.193]
Толуол (температура кипения НО—111 С)—для приготовления смеси толуола с водой, которой отмывают полимер от хлористого натрия и побочных продуктов реакции. [c.277]
Для получения дегидролиналоола к смеси толуола и изобутилового спирта прибавляют гидроксид калия, карбонат калия, нагревают реакционную массу до кипения, отгоняют азеотропную смесь толуола с водой и изобутиловым спиртом для полного обезвоживания. После продувки смеси азотом ее насыщают ацетиленом, охлаждают до 14-18°С и приливают метилгептенон. По окончании процесса прибавлением воды при 30 °С разлагают алкоголят дегидролиналоола, отгоняют толуол, дегидролиналоол подвергают вакуум-ректификации, отбирая фракцию, кипящую при температуре 91-94 °С при давлении 1,1 кПа (8 мм рт. ст.). [c.155]
Иногда при добавлении третьего компонента образуется новая двойная азеотропная смесь. Так, если к азеотропной смеси толуола с уксусной кислотой, кипящей при температуре 105 °С, прибавить воду,. то при перегонке в первую очередь отгоняется азеотропная смесь толуола с водой, кипящая при температуре 84,1 °С, а затем уксусная кислота, которая ие образует с водой азеотропной смеси. [c.287]
Процесс производства эпоксидных смол (рис. 43) состоит из следующих стадий дозировка сырья конденсация промывка олигомера отгонка смеси толуола с водой фильтрация и сушка смолы. [c.279]
Было изучено взаимодействие комплекса Тз 80а, находящегося в толуоле, с водой. С этой целью были приготовлены растворы различной концентрации комплекса в толуоле ранее описанным способом. [c.193]
НОЙ соляной кислоты при 60°С. Смесь 80%-ной тиогликолево кислоты и 36%-НОЙ соляной кислоты в примерном соотношении 1 при перемешивании нагревали до 50 °С в течение 0,5 ч и добавлял ацетон. При этом температура реакционной смеси поднималась Д( 60 °С. Время реакции 1 ч. Выход кислоты 91% от теоретического продукт был идентифицирован по т. пл. (131—133 °С) и ИК-снектру Далее был проведен синтез дифенилолпропана из пропилен-бис тиогликолевой кислоты и фенола в присутствии концентрированно соляной кислоты при 70 °С. Выход дифенилолпропана o тaвляJ 70% от теоретического его т. пл. (после перекристаллизации и смеси толуола с водой) составила 156 С. [c.92]
При перемешивании триоктиламина с водой, взятых в соотношении 1 1 по объему, получается эмульсия В/М и лишь при тройном избытке воды образуется эмульсия М/В [36]. Аналогичный эффект наблюдается при добавлении в систему толуол — вода триоктиламина или дилауриламина. При перемешивании толуола с водой в соотношении 1 1 образуется эмульсия М/В, при добавлении аминов — эмульсия В/М и только при трехкратном избытке воды — эмульсия М/В. [c.136]
Толуол с водой образует азеотропную смесь, кипяшую при температуре 84,Г, содержащую 19,6% воды. Азеотроп вода-пропионовая кислота , кипящий при температуре 99,9°, содержит 82,3% воды. Толуол, отнимая воду от азеотропа вода-пропионовая кислота , сам образует с водой низкокипящий азеотроп и уходит через верх колонны, а кислота остается в кубе. Примерный состав дистиллата (в %) толуол 80, вода 19,4 пропионовая кислота 0,6. Дистиллат после конденсации быстро расслаивается в фазоразделителе, образуя при этом верхний Слой-толуол и нижний слой-вода с небольшим количеством пропионовой кислоты. Состав кубового остатка (в %) пропионовая кислота 99,89 вода и примеси 0,11. [c.162]
chem21.info
что такое толуол и как его получить?
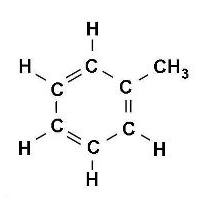
Арены, к которым относится толуол, можно рассматривать как производные родоначальника и первого члена гомологического ряда — бензола. Общая формула соединений, которые относятся к этому классу,— Cnh3n–6. В молекулах ароматических углеводородов содержится бензольное кольцо (цикл, ядро). Формула толуола C7H8 отражает принадлежность вещества к этой большой группе органических соединений. Многим толуол известен под другим названием — метилбензол. Вещество получило широкое распространение в промышленности, используется в качестве органического растворителя, пятновыводителя и для других целей.
Что такое толуол?
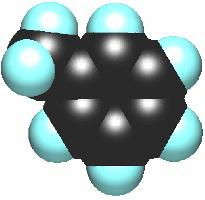 Один из важнейших аренов — толуол — представляет собой метильное производное бензола. Нерастворимая в воде бесцветная жидкость обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей.
Один из важнейших аренов — толуол — представляет собой метильное производное бензола. Нерастворимая в воде бесцветная жидкость обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей.
Химическая формула толуола - C7H8 - может быть записана по-другому: C6H5–Ch4. В этом случае количество атомов остается таким же, но заметно отличие от бензола, которое заключается в радикале — метиле.
Используя другие принципы номенклатуры, соединение называют метилбензолом и фенилметаном. Это тот же толуол, общая формула которого C7H8. Но в первом случае акцент делается на том, что один атом водорода из тех, что связаны с углеродом бензольного кольца, замещен на радикал метил. Для второго названия избран другой подход. Считается, что в метане один водород замещается на радикал фенил. Это частица, в которую превращается бензол, отдавая атом водорода.
Строение молекулы
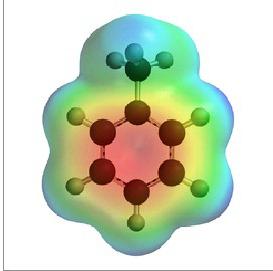 Состав органического вещества, состоящего только из атомов углерода и водорода, отражает формула толуола. Шаростержневые и объемные модели дают представление о строении молекулы соединения, ее отличии от веществ того же гомологического ряда. Есть сходство между толуолом и бензолом, которое заключается в наличии кольца из 6 атомов углерода, находящихся в состоянии sp2-гибридизации. Каждый из них образует три сигма-связи с соседними частицами (двумя атомами углерода и одним водорода). Перпендикулярно кольцу возникает единая электронная система из оставшихся негибридных p-орбиталей (по одной у шести атомов углерода). В результате приобретает значительную прочность и устойчивость весь цикл, а значит, и вещество толуол. Структурная формула соединения включает седьмой углерод из метильной группы, который находится в состоянии sp3-гибридизации. Он связан с тремя атомами водорода, а четвертую связь затрачивает на соединение с одним углеродом в бензольном кольце.
Состав органического вещества, состоящего только из атомов углерода и водорода, отражает формула толуола. Шаростержневые и объемные модели дают представление о строении молекулы соединения, ее отличии от веществ того же гомологического ряда. Есть сходство между толуолом и бензолом, которое заключается в наличии кольца из 6 атомов углерода, находящихся в состоянии sp2-гибридизации. Каждый из них образует три сигма-связи с соседними частицами (двумя атомами углерода и одним водорода). Перпендикулярно кольцу возникает единая электронная система из оставшихся негибридных p-орбиталей (по одной у шести атомов углерода). В результате приобретает значительную прочность и устойчивость весь цикл, а значит, и вещество толуол. Структурная формула соединения включает седьмой углерод из метильной группы, который находится в состоянии sp3-гибридизации. Он связан с тремя атомами водорода, а четвертую связь затрачивает на соединение с одним углеродом в бензольном кольце.
Структурные формулы метилбензола
Электронная плотность между атомами углерода, которые образуют ароматическое ядро, распределяется равномерно. Явление отражается в формуле бензола, толуола и других аренов знаком ароматичности (окружностью в кольце). Отмечается и наличие метильного радикала у одного из атомов углерода в ядре. Связи между всеми частицами показаны черточками. Структурная формула в таком случае отражает состав и основные черты строения молекулы вещества.
Упрощенная формула толуола - шестиугольник с кольцом внутри или черточками, обозначающими двойную связь. Метильная группа может находиться у любого из шести атомов ядра, они равноценны между собой. Недостаток такого способа изображения очевиден. Запись не дает представления о составе вещества и равноценности всех углерод-углеродных связей в кольце.
Получение метилбензола в лаборатории и промышленности
В лаборатории толуол был впервые получен в 1835–1938 годах П. Пельтье и А. Девилем. Первый ученый осуществлял перегонку камеди сосны, а второй использовал толуанский бальзам, извлеченный из южноамериканского дерева Toluifera в Колумбии. Так возникло тривиальное название вещества — толуол. В настоящее время значительное количество метилбензола дает перегонка нефти и каменноугольной смолы с последующей очисткой. В процессе коксования толуол извлекается из коксового газа. При синтезе стирола он выделяется как побочный продукт реакции бензола и этилена. В лаборатории и промышленности получение толуола проводится разными методами.
- Дегидроциклизация ациклических углеводородов. Толуол получают из гептана в присутствии катализатора при температуре 300 C°.
- Алкилирование бензола, которое получило название реакция Фриделя-Крафтса. Проводится в присутствии катализатора AlCl3 или других катализаторов: С6Н5–Н + СН3Cl = С6Н5–СН3 + HCl.
- Взаимодействие с бромбензолом: С6Н5–Br + СН3–Br + 2Na = С6Н5–СН3 + 2NaBr.
- Смешивание цинка и крезола: C6h5Ch4OH + Zn = C6H5Ch4 + ZnO.
- Обработка толуолсульфоновой кислоты.
Физические свойства метилбензола
 Толуол, структурная формула которого содержит бензольное ядро, проявляет физические свойства, типичные для ароматических соединений.
Толуол, структурная формула которого содержит бензольное ядро, проявляет физические свойства, типичные для ароматических соединений.
- Прозрачная бесцветная жидкость издает запах краски.
- Затвердевает метилбензол при низких температурах и начинает плавиться в точке –93 °C.
- Температура кипения толуола составляет 110,63 °C. Плотность вещества — 0,8669 г/мл.
- Растворимость метилбензола в воде при температуре 20°С — 0,47 г/л. Молярная масса вещества M (C7H8) = 92,14 г/моль.
Химические свойства толуола: окисление
Особенности всех аренов определяются химически устойчивым циклом из шести атомов углерода. Формула толуола — это бензольное кольцо, которое формально является ненасыщенным, и радикал метил. Ароматические углеводороды по свойствам близки с алкенами, для которых характерны реакции присоединения. Но атомы водорода в молекулах бензола и его гомологов могут участвовать в реакциях замещения, что сближает арены и алканы. Толуол является более реакционноспособным, чем бензол. Для вещества характерны реакции окисления.
- Горение, которое сопровождается выделением углекислого газа и образованием воды: C7H8 + 9O2 = 7CO2 + 4h3O.
- При взаимодействии толуола с перманганатом калия происходит окисление метильной группы в боковой цепи молекулы вещества до карбоксила. В результате реакции получается бензойная кислота.
Химические реакции ароматического ядра толуола
 Бромирование, которое проводится в присутствии катализаторов. Образуется галогенопроизводное вещество: C7H8 + Br2 = C7H7Br + HBr.
Бромирование, которое проводится в присутствии катализаторов. Образуется галогенопроизводное вещество: C7H8 + Br2 = C7H7Br + HBr.- Нитрование метилбензола осуществляется смесью, состоящей из концентрированных азотной и серной кислот. Нитрогруппа в толуоле может занимать орто- и пара-положение. Реакция идет по механизму электрофильного замещения. При высокой температуре образуется взрывчатое вещество тринитротолуол (тротил).
- Гидрирование водородом на катализаторе приводит к деароматизации и получению метилциклогексана: C7H8 + 3h3 = C7h24.
- Хлорирование при сильном нагревании или под действием УФ-излучения завершается образованием гексахлорциклогексана.
Применение метилбензола
Толуол широко используется в качестве исходного вещества в органическом синтезе. Он является необходимым материалом в производстве многих веществ. Применение толуола:
- получение красителей;
- изготовление пятновыводителей, моющих средств;
- производство взрывчатого вещества тротила;
- использование в качестве растворителя клеев, красок, синтетических отдушек и чистящих средств;
- производство красок для строительных работ;
- выпуск продукции для ногтей;
- производство фармацевтических препаратов;
- повышение октанового числа топлива;
- органический синтез бензойной кислоты, бензальдегида, бензилхлорида, сахарина, бензилового спирта и других веществ;
Толуол выступает в качестве промышленного растворителя в химчистках, используется в процессе дубления кож. Является предшественником ряда нефтепродуктов, фенола, формальдегида, пестицидов и других соединений.

Токсичность толуола
Метилбензол является пожароопасным веществом. Паровоздушная смесь при определенных условиях взрывается. Легко воспламеняется жидкий толуол. Структурная формула дает представление о составе и строении, но не содержит информации о действии вещества на организм человека. Установлено, что толуол является токсичным, обладает канцерогенным действием. Пары метилбензола свободно проникают через кожу, органы дыхания, вызывают изменения в центральной нервной системе, раздражение покровных тканей, дерматит. При вдыхании испарений толуола у человека проявляется заторможенность, тремор, нарушается деятельность вестибулярного аппарата. Работать с толуолом, красками, растворителями нужно в резиновых перчатках, тщательно проветривать помещение либо использовать вытяжку. Метилбензол является слабым наркотическим веществом, вызывает толуольную токсикоманию. Другие формы негативного воздействия вещества:
- раздражение глаз и нарушение цветового зрения;
- длительное воздействие может привести к потере слуха;
- высокая концентрация в крови вызывает поражение печени, некроз почек;
- вдыхание большого количества паров приводит к головокружению, сонливости, головной боли.
Заключение
Толуол в больших количествах производится на нефтехимических заводах или получается в качестве побочного продукта на коксовых предприятиях. Соединение является ценным сырьем для масштабного органического синтеза, используется в фармацевтической промышленности. Входит метилбензол в состав многих видов растворителей, которые применяются в работе с лакокрасочными материалами. Толуол относится в классификации ядовитых соединений к III классу опасности. При работе с веществом концентрация его паров в воздухе не должна превышать значений, которые определены санитарно-гигиеническими нормативами. Нельзя допускать при обращении с толуолом появления открытого огня, искр, это может привести к взрыву. Также существуют экологические проблемы, связанные с выделением толуола в атмосферу:
- при сжигании нефти, разных видов топлива;
- в действующих вулканах;
- в лесных пожарах;
- при использовании растворителей и красок.
Токсические свойства толуола, пожаро- и взрывоопасность требуют острожного обращения с жидким веществом и его парами.
fb.ru
Толуол - это... Что такое Толуол?
Толуо́л (от исп. Tolu, толуанский бальзам) — метилбензол, бесцветная жидкость с характерным запахом, относится к аренам.
Толуол получен впервые П.
Пельтье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил свое название.Общая характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных пределах с углеводородами, многими спиртами и эфирами, не смешивается с водой. Показатель преломления света 1,4969 при 20 °C. Горюч, сгорает коптящим пламенем.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положения относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Концентрационный предел распространения пламени, %об [1,27;6,8]. Температурный предел распространения пламени, °C [6;37]. Температура вспышки 4 °C.
- Взаимодействие с перманганатом калия в кислой среде:
5С6H5Сh4 + 6KMnO4 + 9h3SO4 → 5С6H5СOOH + 6MnSO4 + 3K2SO4 + 14h3O образование бензойной кислоты
Получение и очистка
Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективной экстракцией и последующей ректификацией.Также хорошие выходы достигаются при каталитическом дегидрировании гептана через метилциклогексан. Очищают толуол аналогично бензолу, только в случае применения концентрированной серной кислоты нельзя забывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (менее 30 °C). Толуол также образует с водой азеотропную смесь[1]. [2]
Толуол можно получить из бензола по реакции Фриделя-Крафтса:

Применение
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и др. органических веществ.
Является растворителем для многих полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Опасность и обращение
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам, (САНПИН, меры предосторожности при работе с летучими органическими растворителями) толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, очень токсичен, его длительное воздействие может привести к необратимым поражениям ЦНС, кроветворных органов, и создать предпосылки для возникновения энцефалопатии. Толуол обладает также канцерогенным действием.
Примечания
- ↑ Толуол
- ↑ Гордон А., Форд Р. Спутник химика.//Перевод на русский язык Розенберга Е. Л., Коппель С. И. Москва: Мир, 1976. — 544 с.
Ссылки
dic.academic.ru
Физико-химические свойства толуола, уравнения реакций :: SYL.ru
Толуол – это метилбензол, представляющий собой бесцветную жидкость, относящуюся к классу аренов, которые являются органическими соединениями с ароматической системой в составе.
Ключевой особенностью данного вещества можно считать его специфический запах. Впрочем, это не единственная «отличительная черта» вещества. Свойств и характеристик у толуола много, и обо всех них стоит вкратце рассказать.

Немного истории
Химические свойства толуола начали изучать чуть меньше 200 лет тому назад, когда его и получили впервые. Вещество обнаружил в 1835 году французский фармацевт и химик Пьер Жозеф Пеллетье. Ученый получил толуол при перегонке сосновой смолы.
А спустя три года французский физикохимик Анри Сент-Клер Девиль выделил данное вещество из бальзама, который он привез из колумбийского города Толу. В честь этого напитка, собственно говоря, соединение и получило свое название.
Общие сведения
Что можно сказать о характеристиках и химических свойствах толуола? Вещество представляет собой летучую подвижную жидкость с резким запахом. Оказывает легкое наркотическое действие. Реагирует с неограниченным количеством углеводородов, взаимодействует с простыми и сложными эфирами, со спиртами. С водой не смешивается.
Характеристики следующие:
- Вещество обозначается формулой С7Н8.
- Его молярная масса равна 92,14 г/моль.
- Плотность составляет 0,86694 г/см³.
- Температуры плавления и кипения равны −95 ℃ и 110,6 ℃ соответственно.
- Удельная теплота испарения составляет 364 кДж/кг.
- Критическая температура фазового перехода равна 320 °C.
Еще это вещество отличается горючестью. Сгорает коптящим пламенем.
Основные химические свойства
Толуол – это вещество, которому свойственны реакции электрофильного замещения. Они происходят в так называемом ароматическом кольце, проявляющим анормально высокую стабильность. Эти реакции идут, в основном, в пара- и орто-положениях относительно метильной группы -Ch4.
Относятся к химическим свойствам толуола реакции озонолиза и присоединения (гидрирование). Под воздействием некоторых окислителей метильная группа становится карбоксильной. Чаще всего для этого используется щелочной раствор калийного перманганата или неконцентрированная азотная кислота.
Еще стоит отметить, что толуол способен самовоспламеняться. Для этого необходима температура в 535 °C. Вспышка происходит при 4 °C.

Образование бензойной кислоты
Способность обсуждаемого вещества участвовать в этом процессе также обусловлена его химическими свойствами. Толуол, реагируя с сильными окислителями, образует простейшую одноосновную бензойную карбоновую кислоту, относящуюся к ароматическому ряду. Ее формула – С6Н5СООН.
Кислота имеет вид белых кристаллов, которые хорошо растворяются в диэтиловом эфире, хлороформе и этаноле. Ее получают посредством следующих реакций:
- Толуол и перманганат калия, взаимодействующие в кислой среде. Формула следующая: 5С6Н5СН3 + 6KMnO4 + 9h3SO4 → 5С6Н5СООН + 6MnSO4 + 3K2SO4 + 14Н2О.
- Толуол и перманганат калия, взаимодействующие в нейтральной среде. Формула такая: С6Н5СН3 + 2KMnO4 → С6Н5СООК + 2MnO2 + КОН + Н2О.
- Толуол, взаимодействующий на свету с галогенами, энергичными окислителями. Происходит по формуле: С6Н5СН3 + Х2 → С6Н5СН2Х + НХ.
Полученная вследствие этих реакций бензойная кислота применяется во многих сферах. В основном ее используют для получения реактивов – бензоилхлорида, бензоатных пластификаторов, фенола.
Также ее применяют при консервировании. Добавки Е213, Е212, Е211 И Е210 изготовлены именно на основе бензойной кислоты. Она блокирует ферменты и замедляет обмен веществ, подавляет рост дрожжей, плесени и бактерий.
А еще бензойная кислота используется в медицине для лечения кожных заболеваний, и как отхаркивающее средство.

Получение вещества
Демонстрирующие химические свойства толуола уравнения реакций, представленные выше – это еще не все, что хотелось бы рассмотреть. Важно поговорить и о процессе получения данного вещества.
Толуол является продуктом промышленной переработки бензиновых фракций нефти. Это еще называется каталитическим риформингом. Вещество выделяют селективной экстракцией, после чего проводят ректификацию – разделяют смесь посредством противоточного тепло- и массообмена между жидкостью и паром.
Нередко данный процесс заменяется каталитическим дегидрированием гептана. Это органический алкан с формулой СН3(СН2)5СН3. Дегидрирование происходит через метилциклогексан – циклоалкан с формулой С7Н14. Это моноциклический углеводород, у которого метильной группой замещен один атома водорода.
Очищают толуол так же, как и бензол. Вот только если применяется серная кислота, нужно учесть – это вещество сульфируется легче. Значит, при очищениитолуола надо поддерживать более низкую температуру. Ниже 30 °C, если быть точнее.

Толуол и бензол
Поскольку эти два вещества похожи, стоит выполнить сравнение химических свойств. Бензол и толуол оба вступают в реакции замещения. Однако скорости их протекания отличаются. Поскольку в молекуле толуола метальная группа влияет на ароматическое кольцо, он реагирует быстрее.
Но бензол, в свою очередь, проявляет устойчивость к окислению. Так, например, когда на него воздействует перманганат калия, ничего не происходит. Зато толуол при такой реакции образует бензойную кислоту, о чем уже упоминалось ранее.
В то же время, известно, что предельные углеводороды не реагируют с раствором калиевого перманганата. Так что окисление толуола объясняется влиянием, оказываемым бензольным кольцом на метильную группу. Данное утверждение подтверждается теорией Бутлерова. В соответствии с ней атомы и их группы в молекулах оказывают взаимное влияние.
Реакция Фриделя-Крафтса
Выше было многое сказано о формуле и химических свойствах толуола. Но еще не упоминалось о том, что данное вещество вполне реально получить из бензола, если выполнить реакцию Фриделя-Крафтса. Так называется способ ацилирования и алкилирования ароматических соединений с использованием кислотных катализаторов. К ним относится трифторид бора (BF3), хлорид цинка (ZnCl2), алюминия (AlCl3) и железа (FeCI3).
Вот только в случае с толуолом можно использовать только один катализатор. И это трибромид железа, который представляет сбой сложное бинарное соединение неорганического характера с формулой FeBr3. А реакция выглядит следующим образом: С6Н6 + Ch4Br à FeBr3 С6Н5СН3 + HBr. Так что не только химические свойства бензол и толуол объединяют, но еще и возможность получить одно вещество из другого.

Пожарная опасность
Нельзя не упомянуть и о ней, рассказывая про химические и физические свойства толуола. Ведь это очень огнеопасное вещество.
Оно относится к классу 3,1 легковоспламеняющихся жидкостей. В эту же категорию входит дизельное топливо, газойль, десенсибилизированные взрывчатые соединения.
Нельзя допускать возникновения рядом с толуолом открытого огня, курения, искр. Даже смесь паров этого вещества с воздухом является взрывоопасной. Если выполняются сливно-наливные операции, то соблюдение правил защиты от статического электричества приобретает первостепенную важность.
Производственные помещения, предназначенные для проведения работ, связанных с толуолом, обеспечиваются приточно-вытяжной вентиляцией, а техника – отсосами. Запрещен использование инструментов, которые могут при ударе дать искру. А если происходит возгорание вещества, то тушить его нужно лишь тонкораспыленной водой, воздушно-механической или химической пеной. Разлитый толуол обезвреживают песком.
Опасность для человека
Характеристики и химические свойства толуола определяют его токсичность. Как уже было сказано, его пары оказывают наркотическое воздействие. Оно особенно сильно в повышенных концентрациях. У человека, вдохнувшего пары, появляются сильные галлюцинации. Мало кто знает, но до 1998 года это вещество входило в состав клея «Момент». Именно поэтому он был так популярен среди токсикоманов.
Высокие концентрации данного вещества также отрицательно влияют на нервную систему, слизистые оболочки глаз, кожу. Нарушается функция кроветворения, поскольку толуол – это высокотоксичный яд. Из-за этого может возникнуть такие заболевания, как гипоксия и цианоз.
Существует даже понятие толуольной токсикомании. Она имеет и канцерогенное влияние. Ведь пару, попадая через кожу или органы дыхания в организм человека, поражают нервную систему. Порой, данные процессы обратить невозможно.
Кроме того, пары могут вызвать заторможенность и нарушить работу вестибулярного аппарата. Поэтому люди, работающие с данным веществом, трудятся в хорошо проветриваемых помещениях, обязательно под тягой, и используют специальные резиновые перчатки.

Применение
Завершить тему физико-химических свойств толуола стоит рассмотрением областей, в которых данное вещество активно задействовано.
В основном оно используется в качестве сырья для производства нитротолуолов, бензилхлорида, бензойной кислоты, а также прочих органических веществ.
Также это соединение – эффективный растворитель для многих полимеров (аморфных кристаллических высокомолекулярных веществ). И еще его нередко добавляют в состав товарных растворителей для красок и лаков, некоторых лекарственных медикаментов. Даже в производстве взрывчатых веществ это соединение применимо. С его добавлением изготавливают тринитротолуол и тротилтол.
www.syl.ru
Толуол — WiKi
Общая характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных количествах с углеводородами, многими спиртами, простыми и сложными эфирами, не смешивается с водой. Показатель преломления света 1,4969 при 20 °C. Горюч, сгорает коптящим пламенем.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется бензойная кислота:
- Взаимодействие с перманганатом калия в кислой среде:
- Взаимодействие с перманганатом калия в нейтральной среде
- Взаимодействие с галогенами на свету
Получение и очистка
Применение
Опасность и обращение
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам (САНПИН, меры предосторожности при работе с летучими органическими растворителями), толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, очень токсичен, его длительное воздействие может привести к необратимым поражениям ЦНС, кроветворных органов и создать предпосылки для возникновения энцефалопатии.
Опыты на крысах не выявили рисков увеличения числа опухолей при долговременном воздействии толуола. Однако данные о воздействии на человека в настоящее время отсутствуют, и Агентство по охране окружающей среды США относит толуол к канцерогенам группы D («недостаточно данных для классификации»)[4].
Примечания
Ссылки
ru-wiki.org
2. Толуол.
2.1. Физико-химические свойства веществ
Толуол – бесцветная жидкость со специфическим запахом. Толуол легче воды и в ней не растворяется, однако легко растворяется в органических растворителях – спирте, эфире, ацетоне. Толуол является хорошим растворителем для многих органических веществ. Горит коптящим пламенем ввиду высокого содержания углерода в его молекуле.
Физические свойства толуола представлены в таблице.
Таблица. Физические свойства толуола.
| Название | Формула | t°.пл., °C | t°.кип., °C |
| Толуол (метилбензол) | С6Н5Сh4 | -95,0 | 110,6 |
Химические свойства толуола
I. Реакция окисления.
1. Горение (коптящее пламя):
2C6H5Ch4 + 16O2t → 14CO2 + 8h3O + Q
2. Толуол окисляется перманганатом калия (обесцвечивают марганцовку):
А) в кислой среде до бензойной кислоты
При действии на толуол перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу. Толуол дает бензойную кислоту:
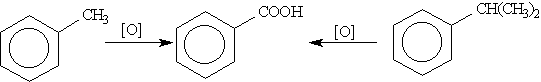
Б) в нейтральной и слабощелочной до солей бензойной кислоты
C6H5-Ch4 + 2KMnO4 → C6H5COOК + KОН + 2MnO2 + h3O
II. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
1. Галогенирование
С6Н5СН3 + Вг2 С6Н5СН2Вг + НВг
C6H5Ch4+Cl2hν →C6H5Ch3Cl+HCl
2. Гидрирование
C6H5Ch4+ 3h3 t,Pt или Ni→C6h21Ch4(метилциклогексан)
III. РЕАКЦИИ ЗАМЕЩЕНИЯ – ионный механизм (легче, чем у алканов)
1. Галогенирование -
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в 4 боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
C6H5-Ch4 + Cl2hν → C6H5-Ch3-Cl + HCl
в присутствии катализатора
C6H5-Ch4+Cl2 AlCl3→ (смесь орта, пара производных) +HCl
2. Нитрование (с азотной кислотой)
C6H5-Ch4+ 3HO-NO2 t, h3SO4→ Сh4-C6h3(NO2)3+ 3h3O
2,4,6-тринитротолуол (тол, тротил)
Применение толуола.
Толуол C6H5–Ch4 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
2.2. Нахождение в природе
Толуол был впервые получен при перегонке сосновой смолы в 1835 г. Пельтье П., позже его выделили из толуанского бальзама (смола из коры дерева Myraxylo, растущего в Центральной Америке). Название это вещество получило по имени города Толу (Колумбия).
2.3. Антропогенные источники поступления толуола в биосферу.
Главные источники – это перегонка угля и ряд нефтехимических процессов, в частности каталитический реформинг, перегонка сырой нефти и алкилирование низших ароматических углеводородов. Полициклические углеводороды присутствуют в дыме, содержащемся в атмосфере городов.
Источником загрязнения атмосферы может являться металлургическая промышленность, автотранспорт.
Содержание толуола в воздухе обычно составляет 3-160 мкг/м3 (0,003-0,16 мг/м3), более высокие концентрации отмечаются в крупных городах. В селитебной зоне концентрация бензола обычно составляет 3-30 мкг/м3 (0,003-0,03 мг/м3) и зависит в основном от интенсивности движения автотранспорта.
Фоновый уровень толуола в атмосфере составляет 0,75 мкг/м3 (0,00075 мг/м3).
Так же основными источниками поступления толуола в окружающую среду является химическое производство взрывчатых веществ, эпоксидных смол, лаков и красок и др
studfiles.net
Толуол свойства, применение, получение
«Арены. Толуол.»
Выполнил
Проверила:
2002 г.
План:
1. Арены.
Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым характером химических связей.
Общая формула класса: Cn h3n-6 .Простейшими представителями класса являются бензол и толуол:
Многоядерные арены: нафталин С10 Н8 , антрацен С14 Н10 и др.Термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией p-электронов в циклической системе.
Критерии ароматичности аренов:
1. Атомы углерода в sp2 -гибридизованном состоянии образуют циклическую систему.
2. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
3. Замкнутая система сопряженных связей содержит4n+2 p-электронов (n – целое число).
2. Толуол – формула, строение.Толуол по своему строению подобен бензолу, отличием является лишь замещение одного атома водорода на группу (Ch4 ).
Рассмотрим строение бензола.
В 1825 году английский исследователь Майкл Фарадей при термическом разложении ворвани выделил пахучее вещество, которое имело молекулярную формулу C6 Н6 . Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
Распространенная структурная формула бензола, предложенная в 1865 году немецким ученым Кекуле, представляет собой цикл с чередующимися двойными и одинарными связями между углеродными атомами: Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными "полуторными " связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2 - гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости.
Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными "полуторными " связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2 - гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости. Четвертая негибридная гантелеобразная p- орбиталь атомов углерода расположена перпендикулярно плоскости направления s- связей. Она состоит из двух одинаковых долей, одна из которых лежит выше, а другая - ниже упомянутой плоскости. Каждая p- орбиталь занята одним электроном. р- Орбиталь одного атома углерода перекрывается с p- орбиталью соседнего атома углерода, что приводит, как и в случае этилена, к спариванию электронов и образованию дополнительной p- связи. Однако в случае бензола перекрывание не ограничивается только двумя орбиталями, как в этилене: р- орбиталь каждого атома углерода одинаково перекрывается с p- орбиталями двух смежных углеродных атомов. В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга). Иными словами, шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:
 С теоретической точки зрения ароматическими соединениями могут называться только такие циклические соединения, которые имеют плоское строение и содержат в замкнутой системе сопряжения (4n+2) p- электронов, где n – целое число. Приведенным критериям ароматичности, известным под названием правила Хюккеля , в полной мере отвечает бензол. Его число шесть p- электронов является числом Хюккеля для n=1, в связи с чем, шесть p- электронов молекулы бензола называют ароматическим секстетом.
С теоретической точки зрения ароматическими соединениями могут называться только такие циклические соединения, которые имеют плоское строение и содержат в замкнутой системе сопряжения (4n+2) p- электронов, где n – целое число. Приведенным критериям ароматичности, известным под названием правила Хюккеля , в полной мере отвечает бензол. Его число шесть p- электронов является числом Хюккеля для n=1, в связи с чем, шесть p- электронов молекулы бензола называют ароматическим секстетом.3. Физические свойства.
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Физические свойства некоторых аренов представлены в таблице.
4. Химические свойства.
Все свойства толуола можно разделить на 2 типа:
А) реакции, затрагивающие бензольное кольцо,
Б) реакции, затрагивающие метильную группу.
 Реакции в ароматическом кольце. Метилбензол вступает во все реакции электрофильного замещения, свойственные для бензола.
Реакции в ароматическом кольце. Метилбензол вступает во все реакции электрофильного замещения, свойственные для бензола. 1) Нитрирование:
1-Метил-2-нитробензол 1-Метил-4-нитробензол
2) Хлорирование толуола может производиться путём пропускания через толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится в темноте). Хлорид алюминия играет при этом роль катализатора. В этом случае образуется 2- и 4-замещённый изомеры:
3) Сульфирование метилбензола концентрированой серной кислотой тоже приводит к образованию смеси 2- и 4-замещённого изомеров:
Механизм всех реакций электрофильного замещения подобен механизму сообветствующих реакций бензола. В этих реакциях 3-замещённые изомеры образуются в незначительных количествах и ими можно пренебречь.
Реакции в боковой цепи. Метильная группа в метилбензоле может вступать в определённые реакции, характерные для алканов, но также и в другие реакции, не характерные для алканов.
 Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения.
Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения. Обратим внимание, что эта реакция представляет собой замещение. Дальнейшее галогенирование приводит к образованию следующих соединений:
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромозамещающенных соединений.
Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:

5. Получение.
Известны следующие способы получения ароматических углеводородов.
 |
mirznanii.com



![{\displaystyle {\mathsf {C_{6}H_{5}CH_{3}+X_{2}{\xrightarrow[{}]{h\nu }}C_{6}H_{5}CH_{2}X+HX}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/074d0a4656779205bc605fe99c9e27efe389a374)



















