Справочник химика 21. Связи воды
Вода, водородные связи - Справочник химика 21
Можно рассмотреть такой пример водородной связи. В обычной воде водородная связь имеет место между атомами водорода одной молекулы и атомами кислорода другой молекулы, что может быть представлено такой структурной формулой [c.29]Катионы связаны с молекулами воды донорно-акцепторной связью донором являются атомы кислорода, имеющие две свободные электронные пары, акцептором — катионы, имеющие свободные электронные ячейки. Чем больше заряд иона и чем меньше его размер,тем значительнее будет катионная доля поляризующего действия К на Н2О. Анионы связаны с молекулами воды водородной связью. Сильное влияние может привести к полному отрыву протона — водородная связь становится ковалентной. Донорная активность А" будет тем значительнее, чем больше я и меньше га . В зависимости от силы поляризующего влияния К"" и А" на молекулы Н2О будут получаться различные результаты. Так, катионы элементов побочных подгрупп и непосредственно следующих за ними элементов подвергаются более интенсивному гидролизу, чем другие ионы одинаковых с ними заряда и радиуса, так как ядра первых менее эффективно экранируются -электро-нами. [c.202]
Катионы связаны с молекулами воды донорно-акцеп-торной связью донором являются атомы кислорода, имеющие две свободные электронные пары, акцептором — катионы, имеющие свободные электронные ячейки. Чем больше заряд иона и чем меньше его ра шер, тем значительнее будет катионная доля поляризующего действия К" на Н2О. Анионы связаны с молекулами воды водородной связью. Сильное влияние может принести к полному отрыву протона— водородная связь становятся ковалентной. До-норная активность А" будет тем значительнее, чем больше п и меньше В зависимости от силы поляризующего [c.208]Ассоциация молекул и структура жидкостей. Молекулы таких жиД Хостей, как НР, вода и спирты, могут при образовании водородных связей выступать как акцепторы и доноры электронного заряда одновременно. В результате этого образуются димеры (НР)2, (НзО) , (СНзОН)2 и т. д. Однако ассоциация на этом не останавливается, образуются тримеры, тетрамеры и т. д., пока тепловое движение не разрушает образовавшеюся кольца и]ш цепочки молекул. Энергия на одну водородную связь в таких цепочках возрастает с числом молекул в димере воды 26,4, в тримере 28,4 кДж/моль, Для фтористого водорода в цепочках (НР)2, (НР)з, (НР)4 и (НР)5 и в кольце (НР)б на одну водородную связь приходится 28,9 32,5, 34,6 36,9 и 39,5 кДж/моль соответственно [к-32]. Когда тепловое движение понижено (в кристалле), через водородные связи создается кристал тическая структура. Известная аномалия плотности воды и льда обусловлена водородными связями в кристаллах льда каждая молекула воды связана с четырьмя соседями водородными связями через две неподеленные пары атома кислорода молекула образует две донорные Н-связи и через два атома Н — две акцепторные. Эти четыре связи направлены к вершинам тетраэдра. Образующаяся гексагональная решетка льда благодаря этому не плотная, а рыхлая, в ней большой объем пустот. При плавлении порядок, существующий в кристалле (дальний порядок), нарушается, часть молекул заполняет пустоты и плотность жидкости оказывается выше плотности кристалла. Но в жидкости частично сохраняется льдообразная структура вокруг каждой молекулы (б.иижний порядок). Эта структура воды определяет многие свойства воды и растворов. Структурированы и спирты, но по-иному, так как молекула спирта образует одну донорную и одну акцепторную связь. Эта структура разрушается тепловым движением значительно легче. Возможно структурирование и смещанных растворителей, как водно-спиртовые смеси и др. Оказывая особое влияние на структуру воды, водородные связи налагают отпечаток на всю термодинамику водных растворов, делая воду уникальным по свойствам растворителем. [c.274]
Поскольку гидратация анионов осуществляется за счет водородной связи, в результате поляризационного взаимодействия между комплексообразователем (анионом) и молекулами воды водородная связь может перейти в ковалентную. При этом может происходить отрыв протона от молекулы воды и присоединение его к аниону [c.239]
Подобные ассоциаты образуют также НР, спирты и вода. Водородные связи определяют возникновение характерной структуры воды (рис. А.44). [c.108]
В этом случае образование Н-связи не определяется дипольным моментом молекулы (или полярностью связи ОН), а только донорно-акцепторными свойствами вещества. Возможность образования молекулой воды водородной связи объясняется ее способностью поляризоваться под влиянием молекулы, с которой эта связь образуется. Перераспределение электронной плотности в молекуле воды эквивалентно появлению диполя, положительный конец которого располагается на протоне, а отрицательный — в центре деформированного электронного облака, создаваемого неподеленной парой электронов атома кислорода. Это как бы эффективный диполь ный момент молекулы воды, который зависит от распределения электронной плотности в водородном мостике [103]. Если облако неподеленной пары электронов имеет ось симметрии, то энергетически выгодной должна быть такая конфигурация ассоциата, при которой линия связи ВА — Н примерно совпадает с направлением этой осн, поскольку в этом случае перекрывание орбит атомов В п Н будет наибольшим. Теория донорно-акцепторного [c.18]
Число водородных связей, наблюдаемых в данной массе воды, в большой степени зависит от температуры. Так, лед заключает наибольшее число водородных мостиков. При плавлении льда рвется около 15% связей, при нагревании воды до 40 — около 50% их. В парах воды водородных связей практически нет. [c.102]
Согласно механизму а, во время атаки воды основание оттягивает протон, поэтому общим результатом будет присоединение ОН . Такое возможно, так как основание еще до атаки связано с молекулой воды водородными связями. Согласно механизму б, поскольку между НВ и кислородом карбонильной группы уже существует водородная связь, при атаке воды происходит [c.326]
Ассоциация молекул спиртов, так же как и воды, происходит благодаря возникновению так называемых водородных связей. Водородная связь — особый вид связи она осуществляется между двумя электроотрицательными атомами (О, Ы, Р) водородом, соединенным с одним из них ковалентной связью (стр. 26). У молекул воды водородные связи образуются между атомами кислорода. [c.106]
При дальнейшем нагревании воды водородные связи разрываются в еще большей степени, однако, освобождаемые молекулы еще входят в сохранившиеся остатки кристаллической структуры льда, поэтому плотность воды увеличивается. Только при температуре выше -t-4 °С начинает преобладать тепловое движение молекул, объем ее начинает возрастать, а плотность уменьшаться. Аномально высокие температуры замерзания и кипения воды также обусловлены водородными связями между ее молекулами. [c.28]
Для растворов водяного пара в газах, образующих с водой водородные связи (диоксид углерода, сероводород), парциальный молярный объем водяного пара в газовой фазе может быть весьма малым уже при давлениях 5—13 МПа (см. гл. IX). [c.98]
При низких температурах жидкая вода имеет аномально высокую энергию взаимодействия молекул друг с другом. Эта энергия взаимодействия обусловлена существованием между молекулами воды водородных связей. Наиболее эффективные водородные связи образуются в условиях, в которых каждая молекула воды окружена четырьмя ближайшими молекулами воды, ориентированными к центральной молекуле приблизительно под равными углами. В жидкой воде при низких температурах описанное расположение молекул воды является преобладающим. Это расположение молекул воды напоминает структуру твердого льда . Из-за малого числа ближайших соседних молекул (четыре) указанная структура далека от "плотной упаковки" и имеет пустоты. [c.161]
Речь идет не просто о полярных газах, а о полярных газах, образующих с водой водородную связь (например, аммиак). [c.161]
В заключение следует отметить, что водородные связи не являются единственным видом сильного межмолекулярного взаимодействия между растворенным веществом и водой. Весьма эффективное взаимодействие происходит между атомом кислорода воды и тг-электронами ароматических неполярных углеводородов (образование тг-комплексов). По этой причине растворимость в воде ароматических углеводородов имеет некоторое сходство с растворимостью веществ, образующих с водой водородные связи. [c.164]
Наряду с частотой валентных ОН-колебаний воды представляет интерес проанализировать положение полосы деформационного ее колебания для изученных кристаллогидратов [27, 181, 183]. Частоты этих полос приведены, в табл. 4. Из таблицы следует, что деформационные частоты чувствительны к изменению прочности образуемых водой водородных связей. При переходе от перхлоратов к фосфатам они испытывают смещение, хотя менее значительное, чем частоты валентных колебаний. Таким образом, для изученных нами кристаллогидратов с увеличением прочности водородных связен воды с анионом происходит смещение частот и валентных и деформационных колебаний молекулы воды. Смещения имеют, однако, противоположные направления. [c.68]
При повышении температуры эндотермичность процесса растворения увеличивается, что может быть связано со смещением аномерного равновесия в сторону увеличения доли а-аномера, который менее, чем Р-аномер, приспособлен к образованию с водой водородных связей. Необходимо также учитывать изменение с температурой способности к гидрофобной гидратации, которая по мере разрушения структуры воды ослабляется. Если структуру воды нарушить иным способом, то это может привести к прямо противоположным последствиям. Так, например, добавление мочевины уменьшает эндотермичность процесса растворения [67], что связано с интенсивным взаимодействием молекул углеводов с мочевиной. [c.85]
Измеренные нами спектры поглощения полностью гидратированного цеолита NaA имеют широкие полосы при 1645 и 3400 см , которые приписаны колебаниям воды 8 (НОН) (ОН). Этой форме сорбированной воды (которая может быть без остатка удалена вакуумной десорбцией уже при температуре нагрева образца облучением) следует приписать структуру, эквивалентную структуре чистой воды (водородные связи). [c.40]
Ионы, а также некоторые неионизированные группы и атомы, в частности атомы кислорода, образуют с молекулами воды водородные связи (см. сноску на стр. 302), в результате чего по-верхностно-активные вещества растворяются в воде. [c.329]
Анионы А"- связываются с молекулами воды водородной связью. Сильное воздействие анионов может привести к полному отрыву протона — водородная связь становится ковалентной — анион входит в состав молекулы кислоты (или аниона видй HS , НСОз и т.п.). Взаимодействие анионов с протонами А"-Тем значительнее, чем больше п и меньше г (А"-). В зависимости от силы поляризующего влияния К"" " и А" на молекулы Н2О будут получаться различные результаты. Так, KaTHOHiJ элементов побочных подгрупп и непосредственно следующих за ними элементов подвергаются более интенсивному гидролизу, чем другие ионы одинаковых с ними заряда и радиуса, так как ядра перБых менее эффективно экранируются -электронами, [c.265]
Бромид-ион образует с молекулами воды водородные связи и тем самым стабилизируется. Образующийся карбкатион также стабилизируется сольватацией растворителем, однако прежде всего этот карбкатион должен быть стабилизирован внутримолекулярными электронными эффектами, т. е. быть третичным или резонансно-стабилизированным. [c.598]
Ряд необычных структур, таких, как НР и димер уксусной кислоты в газовой фазе (рис. 14.11), служат доказательством образования водородных связей. Необычно высокая константа кислотной диссоциации салициловой (орто-оксибензойной) кислоты по сравнению с мета- и яара-нзомерами также свидетельствует об образовании водородной связи. Водородная связь образуется тогда, когда протон поделен между двумя электроотрицательными атомами, такими, как Р, О или Ы, которые находятся на соответствующем расстоянии друг от друга. Протон водородной связи притягивается отрицательным зарядом высокой плотности электроотрицательных атомов. Фтор образует очень сильные водородные связи, кислород — более слабые, а азот — еще более слабые. Необычные свойства воды обусловлены в значительной степени водородными связями, включающими четыре неподе-ленные пары электронов на кислороде (разд. 11.6). Лед имеет тетрагональную структуру, причем каждый атом кислорода связан с четырьмя атомами водорода. В этом случае водородные связи образуются вдоль оси каждой неподеленной пары электронов в жидкой воде их существование ответственно за высокую температуру кипения по сравнению с температурой кипения гидридов других элементов той же подгруппы периодической таблицы (—62° С для НгЗ, —42° С для НгЗе, —4° С для НгТе). При испарении воды водородные связи разрываются, [c.445]
Яснее стала роль водородной связи в специфических молекулярных взаимодействиях, в частности с поверхностными гидроксильными группами чистого кремнезема. Съемка спектра без разогревания образца радиацией (стр. 168) позволила впервые вычислить из спектров изотерму вовлечения во взаимодействие с водой свободных гидроксильных групп поверхности и показать, что все они образуют с молекулами воды водородные связи. Противоречия спектроскопических и термодинамических исследований были устранены усовершенствованием опытов, позволившим применить разные методы в одинаковых условиях. Это открывает возможности получения из спектроскопических данных количественной информации об адсорбционном взаимодействии. Это сделало, в частности, излишним предположение о негидроксильных центрах молекулярной адсорбции воды на гидроксилированной поверхности чистого кремнезема [1, 2]. [c.204]
Растворение друг в друге веществ, ассоциированных посредством водородных связей, может привести либо к распаду последних, либо к образованию новых связей. Так, при растворении спирта в воде водородные связи в воде и спирте могут разрушиться. При этом возможно образование новых связей между молекулами воды и спирта [c.129]
I Согласно современным представлениям, в водных растворах большинство анионов связано с молекулами воды водородными связями [27—29а]. [c.247]
Одно время химики-коллоидники объясняли большинство явлений существованием сольватационных оболочек. Однако с современной точки зрения влияние гидратации не так велико. Даже наиболее сильные гидрофильные группы, а именно ионы, связывают только один или два молекулярных слоя воды, в то время как умеренно гидрофильные группы (такие как —ОН, —СООН, —ХНа) просто соединяются в воде водородными связями. Поэтому гидратированная поверхность (например, целлюлозы) не оказывает значительного действия на расстоянии нескольких ангстрем . [c.83]
Благодаря наличию в воде водородных связей и тетраэдрическому характеру структуры в расположении ее молекул отмечается высокая степень упорядоченности — они объединяются в рои (рис. 1.6). Внутренняя часть роев содержит молекулы воды, сохраняющие четыре водородные связп не нарущенными, т. е. объединенными в тетраэдрический льдоподобный каркас. При такой ажурной льдоподобной структуре в воде возникают многочисленные пустоты, обусловливающие большую ее рыхлость. [c.23]
Анионы А " связываются с молекулами воды водородной связью. Сильное воздействие анионов может привести к полному отрыву протона от молекулы НгО - водородная связь становится ковалентной. В результате образуется кислота или анион типа Н5 , НСОГ и т. п. Взаимодействие анионов К с протонами тем значительнее, чем больше заряд аниона и меньше его радиус. Таким образом, интенсивность взаимодействия вещества с водой определяется силой поляризующего влияния К" и А " на молекулы Н2О. Так, катионы элементов побочных подгрупп и непосредственно следующих за ними элементов подвергаются более интенсивному гидролизу, чем другие ионы одинаковых с ними заряда и радиуса, так как ядра первых менее эффективно экрлнируюгся с/-электронами. [c.283]
ВЛАГОПРОНИЦАЕМОСТЬ полимеров, способность полимерных материалов пропускать водяные пары при наличии перепада давления последних. Зависит от хим. состава и структуры полимера, концентрации воды в нем и т-ры. Коэф. В. (Й ) определяется массой паров воды, прошедшей в единицу времени через единицу площади прн единичных толщине и перепаде давления водяных паров связан с коэф. р-римооти (5) и коэф. диффузии (О) ур-нием W= = 03, Диффузия паров воды в гидрофобных полимерах (полиолефинах, фторопластах, фенопластах и др.) происходит так же, как диффузия инертных газов (см. Газопроницаемость). Гидрофильные полимеры (напр., целлюлоза, поливиниловый спирт, полиамиды) содержат полярные группы, способные образовывать с водой водородные связи. Коэф. диффузии таких полимеров зависят от содержания в них воды. Изменение О с содержанием воды в полимере м.б. оценено с хорошим приближением по формуле [c.391]
Несомненно, что наблюдаемые изменения полосы поглощения воды связаны с влиянием ионов на структуру воды, однако вряд ли будет правильным объяснять эти изменения лищь появлением низкочастотной компоненты, относящейся к более сильно связанной воде, и высокочастотной компоненты, принадлежащей воде, водородные связи которой с окружением ослаблены. Возможно, немалую роль в изменении формы полосы поглощения играет и время пребывания молекулы воды в поле иона. Интерпретация наблюдаемых изменений осложнена и тем, что полоса поглощения первого обертона является составной полосой с неразрещенной структурой, в которую вносят вклад по меньщей мере три компоненты 2г1, 2хз и (VI-Ь + Vз). [c.103]
Полосы же поглощения валентных колебаний воды для всех соединений смещеяы в низкочастотную область по сравнению с хлорофиллом а и й. В связи с существующей зависимостью между прочностью образования молекулой воды водородной связи и амещением частоты ее валентного колеба(Ния следует, что в oдa в указанных веществах образует водородную овязь более сильную, чем в хлорофилле. Проведенная оценка энергии Н-связи воды в анализируемых кристаллических веществах подтвердила это предположение. Результаты расчета сведены в табл. 25. Представленные в таблице значения энергии свидетельствуют о том, что в исследуемых соединениях существуют различные по прочности Н-связи воды. [c.146]
Водородная связь образуется в тех случаях, когда положительно заряженный конец одного из диполей (одной из поляризованных связей) притягивается к отрицательно заряженному концу другого днполя. Способность к образованию водородных связей ярко выражена у молекул воды при этом каждый атом кислорода может образовывать водородные связи с двумя другими молекулами воды. Водородные связи имеют резко выраженный направленный характер наиболее сильной связь бывает в том случае, когда все три атома оказываются на одной прямой. Энтальпия образования водородной связи вдоль прямой, АЯ , может достигать —20 кДж-моль (—5 ккал-моль" ). [c.76]
Грин, Марчелия и Пайлторп [139] методом молекулярной динамики исследовали структуру воды в тонкой прослойке ъ = 31,4 А) между поверхностями, которые моделировали строение поверхности раскола слюды. На каждой из поверхностей располагалось по 16 атомов О, 6 атомов 81 и 2 атома А1 в их кристаллографических позициях. Над ионами А1 находились нротивоионы Ка , что делало поверхность электронейтральной. В прослойку вводилась 81 молекула воды. Водородная связь между молекулами воды моделировалась другим известным потенциалом — Стиллинджер-2 [169]. Для взаимодействия молекул воды с поверхностями слюды использовался потенциал Леннард—Джонса и электростатический потенциал. [c.231]
В последующих работах по исследованию спектров паров воды большее внимание уделялось длинноволновой области спектра [148—150, 160, 287, 295, 341], особенно в применении к парам воды в атмосфере [148, 160, 340]. Неменьшее внимание уделялось вопросам уширения вращательно-колебательных линий за счет соударений молекул и образования ими комплексов. Повышение давления в исследуемом объеме при введении в него посторонних газов с сохранением парциального давления вещества приводит к уширению вращательно-колебательных линий [100, 375]. Линии разных ветвей испытывают различные уширения [100], при зтом уширение идет быстрее, если молекулы постороннего газа образуют с молекулами воды водородную связь [99]. Влияние на вращательные линии воды около 3500 и 600 таких газов, как Не, Аг, Nj, СО2, при давлении 1 атм и температурах 20—80° С, прослежено в работах [25, 303, 375]. [c.119]
Наиболее важным достижением в области улучшения низкотемпературных свойств топлив является разработка Энглиным с сотрудниками [170, 176] присадки (жидкости И ) для предотвращения образования кристаллов льда в реактивных топливах при отрицательных температурах. Эта присадка, представляющая собой ионоэтиловый эфир диэтиленгликоля, при добавке в реактивные топлива, содержащие до 0,014% растворенной воды, не только позволяет предотвратить забивку топливных фильтров при охлаждении до —50°, но и способствует быстрому (3—30 мни.) растворению инея, который может попадать в топливо со стенок топливных баков и резервуаров. Этот метод получил широкое признание не только у нас в стране, но и за рубежом. В США для этих целей в последнее время начали использовать монометиловый эфир диэтилеигликоля с добавкой 0,4% глицерина (PFA55MB), который вводится в топливо в -количестве 0,1—0,15% [92, 180, 181]. Механизм действия присадок, предотвращающих образование кристаллов льда, типа жидкости И заключается, во-первых, в образования с водой водородной связи, обеспечивающей повышение растворимости воды в реактивном топливе, во-вторых, в тех случаях, когда содержание воды в топливе превышает то количество, которое в состоянии удержать присадка, она частично в соответствии с коэффиициентом распределения ее между топливом и водой, переходит в водную фазу, значительно снижая ее температуру кристаллизации. [c.48]
Как было показано в разделе I, минеральные соли влияют на структуру воды (укрепляют или разрушают ее). Ионы СО3 , и sol укрепляют структуру воды и способствуют уменьшению растворимости ряда органических веществ (например, анилина), образующих с водой водородные связи. Вещества с внутримолекулярной водородной связью мало реагируют на изменение структуры воды, поэтому растворимость антраниловой (о-амино-бензойпой) кислоты очень мало изменяется в присутствии солей [c.160]
chem21.info
Н-связь воды, теория водородной связи
СОСТОЯНИЕ ВОДЫ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Способность образовывать водородные связи является, пожалуй, наиболее интересным свойством воды. Эти связи определяют полностью или частично все физические и химические свойства воды, ее структуру, характер и величину взаимодействия. Это утверждение справедливо, однако, не только для воды.
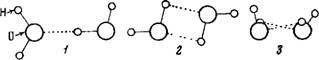
Каждая молекула воды способна образовать четыре водородные связи за счет неподеленных пар электронов атома кислорода [84]. Наличие такой связи создает упорядоченность в расположении молекул в жидкой воде И обусловливает" образование ассоциатов. Простейшие ассоциации воды — димеры. Существуют различные формы димеров: в виде плоского и неплоского кольца, сдвоенного кольца, открытой цепи [72] (рис. 5). Возможно образование ассоциатов и более сложных.
Работы по изучению водородной связи ведутся на протяжении нескольких десятков лет, причем развитию теории водородной связи в значительной степени способствовало изученИе колебательных спектров соединений с Н-связью. Однако природа ее до настоящего времени окончательно не выяснена.
|
Рис. 5. Возможное строение ди меров воды |
|
|
1 — открытый, или цепной димер. циклические димеры 2 — плоское кольцо; 3 — иеплоское кольцо, 4 — «сдвоенное» кольцо
Ранее считалось, что водородная связь обусловлена электростатическим притяжением диполей или остаточных зарядов взаимодействующих групп [84]. Это положение лежит в основе электростатической теории. Согласно последней, атом водорода, обладая только одной устойчивой орбитой, не способен образовать более одной ковалентной связи. В связи с этим предполагалось, что возникновение водородной связи обусловлено ионными силами.
Леннард-Джонс и Попл [85, 86] предложили модель водородной связи молекулы воды с таким расположением зарядов, которое предполагало правильную величину ди - польного момента. Расчет энергии электростатического взаимодействия, проведенный на основе такой модели, дал величину 6 ккал. Это было вполне приемлемое значение для энергии водородной связи, поэтому электростатическая модель была принята и в дальнейшем с успехом использовалась многими исследователями [87—92].
Вместе с тем рассмотренная теория не может описать всех явлений, связанных с образованием водородной связи. Так, увеличение интенсивности полосы ИК-погло - шения в области основных частот при образовании Н-связи во много раз превосходит то, которое может быть объяснено электростатической теорией [93—95].
Кроме того, отсутствует соответствие между энергией связи и дипольным моментом (87, 96, 97].
Так же несостоятельна электростатическая модель в объяснении основного спектроскопического проявления водородной связи — смещения частоты валентных колебАний группы ОН в сторону низких частот [98. 99]
$ последние два десятилетия получила развитие дру - гая модель водородной связи, доНорно-акцепторная, пред; ЛожещшЯ Соколовым (100, 101]} ина основывается на йВантовомеханических расчетах и дает возможность понять многие явления, необъяснимые с точки зрения электростатической теории.
По теории Соколова, при образовании водородной связи в системе А — Н...В происходит перераспределение электронной плотности электроотрицательного атома В. Для того чтобы пара электронов от В переместилась к акцептору электронов — атому Н, необходимо, чтобы последний обладал остаточным положительным зарядом [100, 102]. Необходимо было допущение того, что в процессе образования водородной связи происходит также смещение электронного облака от Н к атому А. Таким образом, атом Н как бы освобождает свою 5-орбиту для приема пары электронов атома В.
В этом случае образование Н-связи не определяется дипольным моментом молекулы (или полярностью связи* ОН), а только донорно-акцепторными свойствами вещества. Возможность образования молекулой воды водородной связи объясняется ее способностью поляризоваться под влиянием молекулы, с которой эта связь образуется. Перераспределение электронной плотности в молекуле воды эквивалентно появлению диполя, положительный конец которого располагается на протоне, а отрицательный — в центре деформированного электронного облака, создаваемого неподеленной парой электронов атома кислорода. Это как бы эффективный диполь^ ный момент молекулы воды, который зависит от распределения электронной плотности в водородном мостике [103]. Если облако неподеленной пары электронов имеет ось симметрии, то энергетически выгодной должна быть такая конфигурация ассоциата, при которой линия связи ВА — Н примерно совпадает с направлением этой осн, ' поскольку в этом случае перекрывание орбит атомов В и Н будет наибольшим. Теория донорно-акцепторного
Взаимодействия получила широкое распространение, так как с ее помощью стало возможным понять и объяснить некоторые закономерности в ИК-спектрах, физико-химические свойства систем с водородной связью. В то же время, основываясь на электростатических представлениях, осуществить это было невозможно.
Как показано в § 3, присутствующие в системе ионы по - разному влияют на структуру воды. В результате упоря - дочивающе-разупорядочивающего действия ионов на структуру воды при введении неэлектролита должны …
Выяснение механизма экстракции сильных кислот — одна из наиболее интересных и наиболее сложных задач теории экстракции. К сожалению, ценное для своего времени представление об оксониевом механизме экстракции таких соединений в …
Изучение взаимодействия воды с органическими и неорганическими соединениями и расчет энергии такого взаимодействия позволили с совершенно новой точки зрения рассмотреть механизм взаимодействия воды с силаноль - ными группами при ее …
msd.com.ua
Энергия связи воды - Справочник химика 21
Коррозионные процессы и эффективность действия ПАВ на поверхности металлов в топливах и маслах в значительной мере связаны с образованием на ней адсорбированной пленки воды. В тех случаях когда энергия связи воды с металлом меньше или равна энергии связи ПАВ с водой, последняя может связываться с активными группами ПАВ за счет водородных связей или сольватации анионной или катионной части молекул, солюбилизироваться внутри или на поверхности молекул ПАВ, связываться коллоидной структурой, либо, наконец, эмульгироваться. Возможен также вариант, когда энергия связи воды с металлом меньше или равна энергии связи ПАВ с металлом. При этом выдвигается на первый план энергия меж-молекулярной связи ПАВ со средой если она невелика, то идет избирательная сорбция ПАВ на наиболее активных участ- [c.207] Ингибиторы адсорбционного типа вытесняют воду с поверхности за счет того, что энергия связи ПАВ и воды больше энергии связи воды с металлом (табл. 48). [c.173]Различают воду, связанную в виде гидроксильных ионов, и воду молекулярных соединений типа кристаллогидратов, последняя связана значительно слабее первой. По величине давления диссоциации гидратов в зависимости от температуры можно рассчитать свободную энергию связи воды и теплоты нарушения связи, приняв за основу зависимость давления насыщенного пара свободной воды от температуры. [c.24]
Широкая полоса в области 3400—3640 смг и для перхлоратов, и для нитратов имеет два слабо разрешенных максимума. Полосы воды в ИК-спектрах перхлоратов смещены в высокочастотную область, и расчет энергии водородной связи молекул воды по формуле [126] дает два значения (табл. 12), одно из которых совпадает с энергией связи вода —вода (в среднем 4,6 ккал связь), а другое меньше его ( 2,0 ккал связь). Перхлораты двухвалентных катионов Мд, 2п, Ре, Са, Со и др. изучены в ра- [c.60]
Сравнивая соотношения (3.1) и (3.3), можно видеть, что потенциал переноса влаги в области гигроскопического состояния определяется энергией связи влаги или изменением свободной энергии =(Э /Зт )jr-Следовательно, зная соотношение между Ср и ф на основе изотерм сорбции и десорбции, можно вычислить значения ц = /(С, Г). На рис. 3.2 представлены совмещенные графики изотерм десорбции и энергии связи воды и ПВХ-С-70. Пользуясь совмещенными графиками, можно непосредственно получить зависимости Е = f( ,T). В частности, для ПВХ-С-70 среднее значение Е составляет 8-10 кДж/кг. [c.89]
Академик П.А. Ребиндер классифицировал формы связи воды с материалом в зависимости от энергии связи. Вода в адсорбционных слоях (физико-химическая связь) отличается от свободной воды как по химическим, так и по термодинамическим свойствам. Диэлектрическая постоянная адсорбированной воды в 40 раз меньше, чем у свободной воды, а температура замерзания на несколько десятков градусов ниже. Предполагают, что при контакте металла с газами, содержащими до 0,05 % П2О, на поверхности металла находится только физико-химически связанная вода. [c.21]
Вариант 3 Ей—( 6+ io+ u) > i6, т. е. энергия связи ингибитора коррозии с металлом в данном ПИНС (за вычетом его энергии связи с растворителем, загустителем и наполнителем) должна быть выше энергии связи воды с металлом. [c.72]
Во-вторых, если образец цементного камня содержит слабо химически связанную воду, свободная энергия связи которой меньше, чем воды, адсорбированной тем же камнем, то никаким равновесным высушиванием нельзя удалить эту адсорбированную воду, не разрушив при этом частично кристаллическую структур у камня. В этом случае при определении сухого веса цементного камня или бетона приходится мириться либо с неполным удалением адсорбированной воды, либо с частичным разрушением кристаллической структуры. При этом для выбора оптимальных условий сушки необходимо знать свободную энергию связи воды с образцом и его компонентами в зависимости от влагосодержания. [c.79]
Общая энергия связи воды и металла Ег (см. рис. 1) зависит от природы металла, а также от количества и качества электролита и определяется из соотношения [c.32]
Таким образом, знание внутренней и свободной энергии связи воды дает полную термодинамическую характеристику слабо химически связанной воды данных кристаллогидратов и позволяет рассчитывать все ее равновесные свойства. [c.79]
Структурные формулы. Термохимические уравнения и расчеты. Энергия связи. Вода. Диаграмма состояния воды. [c.262]
Свободная энергия связывания воды — сильно изменяющаяся величина. Хотя среднее значение свободной энергии связи воды в структуре- больше, чем для адсорбционной воды, замечено также, что удаление адсорбционно связанной воды зачастую происходит позже, чем гидратной. [c.136]
Гидратация высокополимерных соединений отличается от гидратации ионов тем, что в гидратном слое высокополимера вода упорядоченно ориентирована. Энергия связи воды с полимером (белком) постепенно убывает, т. е. сольватные слои располагаются диффузно. В первом молекулярном слое растворитель обладает меньшей упругостью пара и диэлектрической постоянной, большей плотностью и труднее вымораживается. [c.135]
П. А. Ребиндер, основываясь на энергии связи воды с дисперсными минералами, различает следующие формы связи воды [c.223]
Подробный анализ работ в этой области позволил прийти к выводу, что абсорбционный механизм, соответствующий представлениям о молекулярной совместимости полимера (целлюлозы) и низкомолекулярного вешества (воды), является наиболее вероятным. Однако к нему редко обращались, особенно в старых работах, которые были традиционно обусловлены переносом представлений коллоидной химии на полимерные системы. В частности, при объяснении закономерностей, характерных для теплот сорбции, обычно исходят из адсорбционного механизма. Наблюдаемая во всех экспериментах резкая зависимость теплот сорбции от содержания воды в образце целлюлозы объясняется последовательным переходом от монослоев к полислоям сорбированной воды. Соответственно принимается, что по мере образования полислоев энергия связи воды с целлюлозой должна непрерывно уменьшаться. [c.90]
Для преодоления потенциального барьера, вызванного определенной энергией связи воды в гидратных оболочках, требуется некоторая кинетическая энергия. Поскольку крупные частицы обладают большей кинетической энергией при примерно равной скорости движения, сообщаемой им потоком воды, вероятность преодоления потенциального барьера крупными частицами выше, чем мелкими. [c.112]
ГИЮ связи смазочного материала с металлом и энергию связи воды с. металлом). Особен-25 но эффективны слюда и графит (рис. 37). [c.151]
Из данной формулы видно, что при постоянной концентрации вещества адсорбция убывает с ростом потенциала. Другими словами, повышение потенциала металла в системе масло — ПАВ — вода — металл увеличивает энергию связи воды с металлом ( 3) в значительно большей степени, чем энергии связи ПАВ с металлом ( 5) или нефтепродукта с металлом ( 2) в результате вода вытесняет органические ПАВ и масло с поверхности металла. Увеличение смачиваемости металла водой при поляризации током широко используют в процессах обезжиривания и обезмасливания в металлообрабатывающей промышленности. Адсорбция ПАВ на металле, проникновение их в двойной электрический слой связаны со значительным понижением емкости двойного электрического слоя. Адсорбция ПАВ из полярных сред протекает изотермически, в частности по изотерме А. Н. Фрумкина [52] [c.34]
Этот ряд следует считать приближенным, так как используемая для расчета формула не позволяет определять энергию водородной связи с точностью, необходимой для установления ее абсолютного значения. Кроме того, значение энергии связи вода — анион является средним для нескольких солей с различными катионами, неодинаковым содержанием молекул воды и различной кристаллической структурой. Вместе с тем полученные результаты хотя и являются усредненными, однако хороша согласуются с выводами других авторов [7,12, 13] относительно влияния присутствия в воде анионов на упорядочение или разупорядочение структуры воды. [c.274]
Энергия связи воды с металлом определяется целям рядом факторов [303]. Исследования, выполненные с использованием воды, меченной тритием, показали, что в связанном состоянии в пленке оксидов железа содержится Ы0 молекул воды на 1 см (при потенциале ф=1,1 В). Во внешнем слое оксидов находится 9,3-10 5 молекул воды на 1 см т. е. 90% всей связанной воды. Состав внешнего слоя отвечает формуле РегОзХ Х1,5Н20. и лишь небольшое количество воды находится во внутреннем слое оксида (Рез04) [304]. [c.292]
Помимо воды, входящей в состав оксидов, на поверхности металла может присутствовать вода, связанная с ним электронодонорно-акцепторным (ЭДА) взаимодействием, водородной связью или ван-дер-ваальсовыми адсорбционными силами [303]. Тип связи воды с поверхностными атомами металла зависит от природы и металла, и электролита. Так, в кислой или нейтральной среде поверхность железа несет на себе положительный заряд, и можно ожидать электронодонорного взаимодействия воды с этой поверхностью. В щелочной среде или при недостатке НзО+-ионов вблизи электродов предпочтительна ориентация воды в двойном слое атомами водорода к поверхности металла. Следовательно, энергия связи воды с поверхностью металла может изменяться в широком интервале — от химической связи до слабой водородной или ван-дер-ваальсовой. [c.292]
Спектр экстракта уранилнитрата содержит еще одну полосу поглощения при 3500 см , которую следует отнести к молекуле воды, связанной с трибутилфосфатом, с энергией водородной связи 3,5 0,3 ккал1моль, так как указанная величина хорошо совпадает с энергией связи воды, растворенной в трибутилфосфате [140]. Она исчезает, если экстракт осушить молекулярным ситом 4 или 5 А. Аналогичные спектры поглощения имеют кристаллические ди- и тригидраты уранилнитрата (рис. 42), содержащие полосы поглощения при 3140 и 3520 см (9,5 0,3 и 3,4 0,3 ккал1моль ). В спектре поглощения гексагидрата уранилнитрата имеется очень широкая полоса поглощения, в которой нельзя однозначно определить положение отдельных полос. [c.86]
Значения энергии водородной связи молекул воды, полученные расчетным )методом, хотя и являются весьма приближенными, но также дают во3 можность определить место такого взаимодействия. Мы рассчитали, что энергия связи воды с карбонильной группой для ацетона, например, составляет 2,7, метилэтилкетона 2,5 ккал/связь. В случае хлорофилла же получилось значение энергии менее прочной связи молекулы воды 2,6—2,9 ккал/связь, т. е. близкое к значению энергии связи С = О...Н—О—Н. Это. позволяет считать вполне оправданным предположение о том, что вода может быть координирована атомом кислорода циклопентанонного кольца. [c.142]
В дальнейшем мы попытались с помощью ИК-спектров изучить состояние воды в природных водорослях, представителем которых является хлорелла. Для этих целей хлорелла, предварительно отцентрифугированная из водного раствора и высушенная до пастообразной массы, тонким слоем наносилась на подложку из бромистого калия. Затем записывался ее ИК-спектр в области валентных колебаний воды. Поскольку хлорелла очещ> сложный объект исследования, ее спектр также сложен, и полосы разрешены слабо (см. рис. 65, 4). Однако можно сказать, что вода в ней находится в связанном состоянии и энергия наиболее сильной водородной связи составляет около 6,9 ккал1связь, т. е. по своей величине она приближается к значению энергии связи воды с группой Р = 0. Существование такой связи в хлорелле вполне возможно вследствие того, что общее содержание фос-форильных группировок в биологических системах велико (они входят в состав Р, ADP, NADP, NAD), а следовательно, велика и вероятность образования подобного типа связей. Наряду с этим не исключена возможная координация воды другими протоноакцепторными элементами системы, в частности атомом N. Но в результате того, что содержание последних в хлорелле меньше, чем Р=0-групп, связь их с водой в спектре отчетливо не проявляется. [c.148]
Экстракция воды. Экстракция воды играет значительную роль при извлечении вещества по гидратно-сольватному механизму. Некоторые авторы [119—121] полагают, что в системах с участпем нейтральных фосфорорганических соединений образуются различные сольваты, например ТБФ-НаО, ТБФ-2Н20. Однако, как было, показано Розеном [123], в этой системе проявляется значительная положительная неидеальность, а образование соединений, как известно, должно приводить к отрицательной неидеальности. Аналогичный вывод был сделан и Михайловым [161]. О слабом химическом взаимодействии говорит также линейная зависимость концентрации воды в органической фазе от ее активности в водной [122]. Используя физико-химические методы, Николаев с сотр. не обнаружили в органической фазе данной системы каких-либо химических соединений [162], однако в системе Н2О — ТБФО авторы предполагают образование клатратов [163]. Вместе с тем Розен с сотр. [123], исследовав экстракцию воды растворами ТБФ, пришли к заключению, что в органической фазе между ТБФ и водой образуется слабая водородная связь, энергия которой, по мнению авторов, составляет примерно половину энергии связи вода — вода. Проведя термодинамический анализ, авторы заключили, что основной вклад при экстракции воды дает энтропийный фактор. [c.404]
Хорошо известно, что большие количества водяного пара при высоких температурах отравляют алюмосиликатные катализаторы, вызывая резкое сокращение их пoвepxнo tи и увеличение размеров пор [1-—6]. С другой стороны, присутствие малых количеств хемосорбированной воды в ряде случаев определяет каталитическую активность таких катализаторов [7—9]. Поэтому, как ам кажется, является весьма важным изучение каталитической активности обезвоженных и оводненных алюмосиликатных катализаторов параллельно с исследованием адсорбции паров воды на них, а также энергии связи воды с их поверхностью. [c.122]
Вариант 1— з> 1б, т. е. энегргия связи растворителя с металлом больше или равна энергии связи воды с металлом. По данному варианту вытеснение воды возможно полярными растворителями за счет образования с водой водородных или п-связей ароматическими углеводородами, спиртами, простыми и сложными эфирами, кетонами, лактонами и пр. По этому варианту может осуществляться вытеснение только адсорбционной пленки воды с достаточным быстродействием с неустойчивым равновесием, т. е. с вероятной обратной сорбцией воды на поверхности металла. [c.71]
Рассматривая рис. 1, можно отметить следующее. Несмотря на сходство химического состава и кристаллической структуры, энергия связи воды у образцов совершенно различна. Так, для ГСАКВ все молекулы воды, начиная от 10 и до 27, связаны почти одинаково. В противоположность этому, на кривых для ГХАКВ нет областей с постоянной энергией связи. Кривые растут с уменьшением влагосодержания монотонно и только при содержании воды около 13 молекул резко меняют крутизну. Наконец, у ГНАКВ намечаются 2 области с почти постоянной энергией связи и резким переходом между ними при влагосодержании около 10 молекул. Таким образом, энергия связи воды с рассмотренными соединениями различна как по величине, так и по виду зависимости от влагосодержания. [c.78]
Характер связи воды с поверхностью металла зависит не только от природы металла, но и от природы электролита, в частности, от его кислотности или щелочности. Другими словами, энергия связи воды с металлом 1 зависит от стащюнарного потенциала металла в данном электролите по отношению к его нулевой точке [119—121]. Так, в кислой среде (серная кислота) поверхность железа несет на себе положительный заряд [122, 123], поэтому наиболее вероятно электронодонорное взаимодействие воды с поверхностью. металла. В щелочной среде или при недостатке ионов Н3О+ вблизи электродов более возможна ориентация воды в двойном слое, при которой атомы водорода направлены к поверхности металла (см. рис. 28). [c.79]
Химически связанная вода. Различают ионную связь влаги с материалом и воду молекулярных соединений типа кристаллогидратов ( aSO4 пН2О), причем связь последней с материалом значительно слабее. Свободную энергию связи воды и теплоту разрыва связи можно рассчитать, приняв за основу зависимость давления насыщенного пара свободной воды от температуры. [c.23]
chem21.info