Большая Энциклопедия Нефти и Газа. Связь вода
Структура воды и ее водородная связь. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей
Структура воды и ее водородная связь
Еще ни одному веществу в природе, не удавалось возбудить, настолько же глубокий интерес к особенностям своего внутреннего строения, как это произошло с водой. Известна исключительная роль воды в происхождении и развитии всех форм живой природы на Земле, а так же, удивительный и уникальный набор характеристик и свойств, которыми обладает вода.
Проблема строения воды и по сей день остается предметом дискуссий, хотя многое в этом вопросе за последнее время стало яснее. Молекула обычной воды имеет, так называемое, угловое корпускулярное строение: если присмотреться в вершине угла, который в парах равен 104,27° ( а во льду 109°), располагается атом кислорода, на отрезке в 0,96 А от него расположены собственно атомы водорода. Электронные облака молекулы воды - s-водородных атомов и р-кислородного атома - четко перекрываются таким образом, что их основные оси направляются к углам образованного тетраэдра. К оставшимся двум углам этого тетраэдра, направляются оси облаков р-электронов уже кислорода, и, таким образом, получается, что полная электронная структура водной молекулы имеет тетраэдрическую форму. Электронные пары, которые остались не использованными в связи —О— с протонами водорода, обуславливают значительное увеличение электронной плотности в первой из частей молекулы воды, при одновременном избыточном положительном заряде в той части, где расположены протоны; в результате - это состояние молекулы в совокупности с ее угловой формой, вполне логично объясняют наличие у воды дипольного момента, приводящего к существующим силам физико-химического взаимодействия между отдельными молекулами обычной и удивительной воды Н2О: Н—О—Н.
Возникающие между внешними парами образованными электронами кислорода и собственно протонами соседних с ними молекул воды, водородные связи, имеют очень важное значение в структурной организации всего объема воды в ее жидком состоянии. Каждая из молекул Н2О имеет возможность принять участие в формировании четырех подобных связей: двух - за счет притяжения пары протонов из данной молекулы к уже электронным парам кислородного атома двух соседних с ними частиц, а две оставшиеся получаются посредством притяжения протонов от соседних молекул к другим электронным парам атома кислорода настоящей частицы. То есть, молекула воды одновременно является и донором, и акцептором протона.
В парообразном состоянии вода есть образует группы, состоящие из нескольких молекул Н2О — при не очень высоких температурах в парах воды образуются парные — так называемые димерные - частицы обычной воды. В кристаллической структуре воды, находящейся в замороженном твердом состоянии - в форме льда - каждая отдельная молекула воды оказывается окруженной четырьмя другими, таким образом, что в результате получается правильная тетраэдрическая физико-химическая структура, называемая гексагональной сингонией. Протоны, которые образуют водородные связи, расположены между атомами кислорода, а по характеру их движения нельзя понять, к какому именно атому кислорода относится данный протон. А в целом, протон связан почти одинаково прочно с обоими атомами кислорода. Возможно, водородная связь имеет возможность находиться и в состоянии ионизированном, при котором к одной из связанных в структуре молекул приближен протон, а оставшаяся молекула почти потеряла протон НО-... Н+—ОН2. Такое образование характеризуется наличием значительного дипольного момента.
Структура тетраэдра оставляет множество пустого пространства внутри своей структурной решетки. Эти «пустоты» достаточно велики, чтобы вместить в себя молекулу воды. По О. Я. Самойлову, при таянии льда пустоты заполняются жидкой водой, что несомненно приводит к увеличению плотности воды в жидком ее состоянии, по сравнению с ее твердой, кристаллической формой — льдом! Это вполне логически объясняет одну из важнейших особенностей воды.
Водородная связь представляет собой взаимодействие между двумя электроотрицательными атомами двух одинаковых, или двух разных, молекул, посредством одного атома водорода: А−Н ... В (черта - это ковалентная связь, а три точки - водородная связь).
Водородная связь возможна за счет электростатического притяжения атома водорода, несущего положительный заряд δ+, к атому электроотрицательного элемента, несущего отрицательный заряд δ−. Чаще всего водородная связь слабее ковалентной, однако, значительно сильнее обычного физического притяжения молекул друг к другу, наблюдаемого в твердых и жидких средах. От межмолекулярных взаимодействий водородную связь отличает наличие свойств, обозначаемых как направленность и насыщаемость. От этого ее часто относят к одной из разновидностей ковалентной химической связи. Водородную связь можно описать, пользуясь методом молекулярных орбиталей, как трехцентровую двухэлектронную связь.
Кислотные свойства многих веществ определяются наличием водородных связей в их химической природе. Одна из галогеноводородных кислот - фтороводородная кислота, в отличие от них, является слабой потому, что атомы водорода в ней связаны одновременно и сразу же с двумя атомами фтора, что мешает их отщеплению. Большинство карбоновых кислот так же являются слабыми по этой же самой причине.
www.watermap.ru
Вода. Водородная связь
Ни одна из планет Солнечной системы не содержит на своей поверхности такого большого количества воды, как наша Земля. Моря и океаны, средняя глубина которых около 6 км, покрывают 71 % поверхности Земли. Огромное количество воды в виде снега и льда сосредоточено в приполярных районах.
Этот удивительный факт пока не нашел однозначного объяснения. Безусловно, вода играет огромную роль в возникновении и существовании жизни на нашей планете. Во многом это связано со свойствами, которых нет у ее ближайших соседей и аналогов (h3S, h3Se и т.д. – см. таблицу 7-1 в предыдущем параграфе). Прежде всего нужно разобраться, почему вода может находиться в жидком и даже в твердом состоянии (лед) в условиях, в которых похожие соединения водорода с более тяжелыми элементами (серой, селеном и т.д.) газообразны.
Молекула воды имеет следующее электронное строение:

Две электронные пары образуют полярные ковалентные связи между атомами водорода и кислорода, а оставшиеся две электронные пары остаются свободными и называются неподеленными. Молекула воды имеет угловое строение, угол Н–О–Н составляет 104,5 градусов.
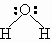
Наличие в молекулах h3O неподеленных электронных пар у атомов кислорода и положительно заряженных атомов водорода приводит к совершенно особому взаимодействию между молекулами, называемому ВОДОРОДНОЙ СВЯЗЬЮ (рис. 7-1). В отличие от всех уже знакомых нам видов химической связи эта связь – межмолекулярная.
Водородная связь (на рисунке она обозначена пунктиром) возникает при взаимодействии обедненного электронами атома водорода одной молекулы воды с неподеленной электронной парой атома кислорода другой молекулы воды.
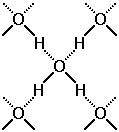
Рис. 7-1. Водородные связи между молекулами воды (обозначены пунктиром).
Водородная связь является частным случаем межмолекулярых связей. Считается, что она обусловлена в основном электростатическими силами. Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с небольшими, но электроотрицательными атомами, например: O, N, F. Важно, чтобы у этих электроотрицательных атомов были неподеленные электронные пары. Поэтому водородные связи характерны для таких веществ, как вода h3O, аммиак Nh4, фтороводород HF. Например, молекулы HF связаны между собой водородными связями, которые на рисунке показаны пунктирными линиями:
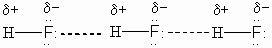
Водородные связи приблизительно в 20 раз менее прочные, чем ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
При температурах выше 0 °С (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру, как показано на рис. 7-1. Поэтому в жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты –
все крупнее. Наконец, образуется лед, который имеет именно такую упорядоченную структуру, которая показана на рисунке.
В кристалле льда между молекулами остаются пустоты. Объем этих пустот больше, чем размер отдельной молекулы Н2
О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности воды. Большинство же других веществ при замерзании увеличивает свою плотность.
Таким образом, водородные связи придают воде еще одно уникальное свойство, без которого вряд ли могла бы существовать разнообразная жизнь в тех районах Земли, где температура зимой понижается ниже 0 °С. Если бы лед тонул в воде, то зимой все водоемы промерзали бы до самого дна. Трудно ожидать, что рыбы согласились бы жить в таких условиях. Человек мог бы растапливать лед, превращая его в воду для своих нужд, но это потребовало бы огромных затрат дополнительной энергии.

** Еще одно красивое проявление водородных связей
– голубой цвет чистой воды в ее толще. Когда одна молекула воды колеблется, она заставляет колебаться и связанные с ней водородной связью другие молекулы. На возбуждение этих колебаний расходуются красные лучи солнечного спектра, как наиболее подходящие по энергии. Таким образом, из солнечного спектра "отфильтровываются" красные лучи –
их энергия поглощается и рассеивается колеблющимися молекулами воды в виде тепла.
В белом солнечном свете различные цвета как бы уравновешивают друг друга. Поэтому солнечный свет кажется глазу "белым"
– лишенным цвета. Если "отфильтровать" лучи одного участка спектра, то начинает проступать другой –
в данном случае голубой участок спектра. Он и окрашивает воду в красивый голубой цвет. Но для этого требуется, чтобы солнечный луч прошел не менее чем через 2-х метровую толщу чистой воды и "потерял" достаточно много красных лучей.
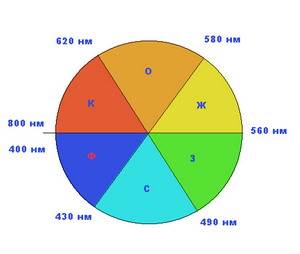
Понять механизм восприятия цвета нашими глазами может помочь "круг цветов", используемый художниками и показанный на рисунке слева. Цвета в нем расположены в следующем порядке (по часовой стрелке): красный, оранжевый, желтый, зеленый, синий, фиолетовый. Цвет, возникающий при поглощении какого-либо цвета из белого, называют дополнительным. В "круге цветов" дополнительными по отношению друг к другу являются, например, красный и зеленый. Или оранжевый и синий, то есть те цвета, которые находятся в секторах напротив друг друга.
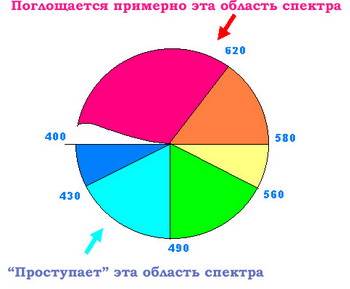
Обычно человеческий глаз воспринимает свет с длиной волны от 800 нм (пурпурно-красный) до 400 нм (темно-фиолетовый)
. "Круг цветов"
достаточно условен, так как строгой границы между цветами нет. Существует множество оттенков и порой трудно определить, где заканчивается, например, желтый цвет и начинается зеленый. Но условно эти границы можно провести примерно так, как показано на следующем рисунке. Поэтому если какое-нибудь вещество (в нашем случае – вода) поглощает из солнечного спектра красные лучи, то поток света, прошедший через это вещество (или отраженный от его поверхности), обогащается дополнительным цветом – голубым. Разумеется, для этого необходимо, чтобы вода была чистой и не содержала веществ, поглощающих лучи из других участков спектра. Очень загрязненная вода поглощает практически весь видимый свет и выглядит черной.
studopedya.ru
Связь - вода - Большая Энциклопедия Нефти и Газа, статья, страница 2
Связь - вода
Cтраница 2
Изучение форм связи воды с глинистыми минералами показало, что целесообразно различать химически, адсорбционно и капиллярно связанную воду, а также свободную воду, механически захваченную дисперсионной структурой. [16]
Классификация форм связи воды на химическую, физико-химическую и механическую имеет общую физическую основу, которая заключается в том, что при взаимодействии с твердым телом структура и свойства воды1 претерпевают качественные изменения; они тем значительнее, чем тоньше пленки воды на поверхности или между поверхностями твердых тел и интенсивнее силы поляризации. [17]
Наиболее полная классификация связи воды с твердыми частицами суспензий предложена акад. Я - Калюжный, различая три вида связи воды - свободную, коллоидно связанную и химически связанную. [18]
Различают три формы связи воды с твердыми частицами в осадке: свободную, коллоидно-связанную и химически связанную. [19]
Рассмотрены различные формы связи воды с дисперсными силикатами и другими гидрофильными материалами. Показано, что при анализе категорий молекулярно связанной воды необходимо учитывать три ее разновидности; сорбционно ( прочно) связанную воду, воду граничных слоев и осмотически связанную воду. Прочно связанная слоистыми силикатами вода энергетически неоднородна. Ее состояние на поверхности описывается моделью локализованной адсорбции. Молекулы граничных слоев воды толщиной 6 - 7 нм в дисперсиях Na - и Li-монтмориллонита участвуют в меньшем количестве водородных связей, чем в жидкой воде. Исходя из этого факта и повышенной вязкости граничных слоев предложена анизотропно-доменная модель их строения. Рассмотрено строение гидратной оболочки вокруг частиц Na - и Li-монтмориллонита. [20]
При изучении характера связи воды в перлите в инфракрасной части спектра установлено понижение светопрозрачности при длине волны 2 73 и 6 1 ж / с, что указывает на наличие в структуре мономерных групп Н, ОН и молекулярной воды при наличии водородных связей. [21]
В зависимости от прочности связи воды в кристаллогидратах их плавление может протекать конгруэнтно или инконгруэнтно. В первом случае не наблюдается дегидратация ионов соли вплоть до достижения температуры плавления и расплав находится в равновесии с исходным кристаллогидратом. Соединения, которые плавятся инконгруэнтно, полностью или частично дегидратируются ниже температуры плавления; в этом случае расплав находится в равновесии с двумя кристаллогидратами различного состава или с кристаллогидратом и безводной солью. [22]
Согласно этой схеме формы связи воды с веществом делятся на три основные группы: химическая, физико-химическая и физико-механическая связь. Очевидно, что под влажностью вещества следует понимать, совокупность физико-химически и физико-механически связанной воды, удаление которой из вещества не приводит к изменению химических свойств материала. [23]
Он различает три формы связи воды с твердыми частицами: свободную, коллоидно-связанную и химически связанную. [24]
По степени подвижности и характеру связи воды с горными породами выделяют несколько ее видов: свободную ( или гравитационную), физически связанную, капиллярную, химически связанную, в твердом состоянии и в состоянии пара. [25]
Превосходным методом для определения механизма связи воды в каком-либо соединении служит получение инфракрасного спектра отражения или поглощения. Для прогрессивной дегидратации гипса до образования ангидрита очень характерно изменение абсорбции в инфракрасном свете. [26]
Исследования показали, что прочность связи воды в гидратах колеблется в широких пределах. Потеря воды гидратами, стабильными при наиболее высоких давлениях водяного пара, по сравнению с потерей воды гидратами, устойчивыми при более низких давлениях, показана кривыми изо-термического разложения на фиг. [27]
В следующем параграфе рассматриваются различные типы связей воды с растворенными веществами. [28]
На рис. 10 приведены различные формы связи воды с почвой. Сверху видна гравитационная вода выпавшего дождя, которая просочилась в почву на некоторую глубину. Затем следует гигроскопическая и рыхлосвязанная вода и почвенный воздух с водяными парами. Далее расположена капиллярная вода, поднявшаяся по капиллярам от уровня грунтовой воды, находящейся ниже. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Связь молекул воды между собой
Молекулы воды связаны между собой посредством водородных связей, расстояние между атомами кислорода и водорода равно 96 пм, а между двумя водородами - 150 пм. В твёрдом состоянии атом кислорода участвует в образовании двух водородных связей с соседними молекулами воды. При этом отдельные молекулы h3O соприкасаются друг с другом разноимёнными полюсами. Таким образом, образуются слои, в которых каждая молекула связана с тремя молекулами своего слоя и одной из соседнего. В результате, кристаллическая структура льда состоит из шестигранных "трубок" соединенных между собой, как пчелиные соты.
Согласно данным компьютерного моделирования, при диаметре трубки в 1,35 нм и давлении в 40000 атмосфер водородные связи искривились, приведя к образованию спирали с двойной стенкой. Внутренняя стенка этой структуры является скрученной в четверо спиралью, а внешняя состоит из четырёх двойных спиралей, похожих на структуру молекулы ДНК.
Последний факт накладывает отпечаток не только на эволюцию наших представлений о воде, но и эволюцию ранней жизни и самой молекулы ДНК. Если предположить, что в эпоху зарождения жизни криолитные глинистые породы имели форму нанотрубок, возникает вопрос - не могла ли вода, сорбированная в них служить структурной основой – матрицей для синтеза ДНК и считывания информации? Возможно, поэтому спиральная структура ДНК повторяет спиральную структуру воды в нанотрубках. Как сообщает журнал New Scientist, теперь нашим зарубежным коллегам предстоит подтвердить существование таких макромолекул воды в реальных экспериментальных условиях с использованием инфракрасной спектроскопии и спектроскопии нейтронного рассеяния.
Такие исследования нанокристаллов льда были проведены в 2007 году Микаелидес из Центра нанотехнологий в Лондоне и Моргенштерн из университета им. Лейбница в Ганновере (рис. 36). Они охлаждали водяной пар над поверхностью металлической пластины, находящейся при температуре 5 градусов Кельвина. Вскоре с помощью сканирующего туннельного микроскопа на пластине удалось наблюдать гексамер (шесть соединенных между собой молекул воды) - мельчайшую снежинку. Это самый маленький из возможных кластеров льда. Ученые наблюдали также кластеры, содержащие семь, восемь и девять молекул.
Рис. 36. Изображение гексамера воды, полученное с помощью сканирующего туннельного микроскопа Размер гексамера в поперечнике - около 1 нм. Фото London Centre for Nanotechnology
Разработка технологии, позволившей получить изображение гексамера воды - само по себе важное научное достижение. Для наблюдения пришлось сократить зондирующий ток до минимума, что и позволило предохранить слабые связи между отдельными молекулами воды от разрушения вследствие процесса наблюдения. Помимо этого, в работе были использованы теоретические подходы квантовой механики. Комплексный подход дал впечатляющие результаты.
В отличие от кристаллического льда, где между всеми молекулами воды энергия связи одинакова, в нанокластерах есть чередование сильных и слабых связей (и соответствующих расстояний) между отдельными молекулами. Получены также важные результаты о способности молекул воды к распределению водородных связей и к их связи с поверхностью металла.
Теоретические анализы Опарина, эксперименты Миллера, Фокса и др. бесспорно доказывают, что в природе могут структурироваться органические молекулы из неорганических. Главным источником энергии в их экспериментах является тепло. В природе это солнечная радиация и энергия магмы. Другой очень существенный вывод – это, что зарождение жизни может произойти в щелочной среде. Во всех случаях наблюдается самоорганизация живого.
В XIX в. Пастьор обратил внимание, что в неживой природе молекулы являются симметричными. А в живой природе наблюдается зеркальная ассиметрия молекул. Белки состоят из левовращающих аминокислот. Данное свойство определяется вращением молекулой плоскости поляризации света. Как объяснить феномен?
Возможно, наличие ассиметрии в органических молекулах проявилось, когда открытая система, предшествувающая биосфере, находилась в крайне неравновесном критическом состоянии.
Произошел скачкообразный эволюционный переход, что является характерной особенностью самоорганизации. Примером такого состояния являются эксперименты, где водные молекулы напоминают ДНК в нанотрубах. Переход из симметричных молекул неживой природы к ассиметричным биомолекулам живой мог произойти на начальном этапе химической эволюции, как самоорганизация материи. Проф. Антонов доказал, что вода тоже является открытой системой и обменивается энергией и веществом с окружающей средой (проф. Антонов, 1992).
Такие экстремальные условия наблюдаются при вулканической деятельности, разрядах в атмосфере молодой Земли. Минеральная вода, взаимодействуюшая с карбонатом кальция, а также морская вода, являются благоприятным спектром для сохранения самоорганизующихся структур. Эффект Кирлиана в лабораторных условиях создает селективный разряд, позволяющий наблюдать излучение света атомами или молекулами. При экспериментах Миллера также создаются неравновесные экстремальные условия с газовым разрядом.
Кирлиановая аура - плазменное свечение электрического разряда наблюдается на поверхности предметов, находящихся в переменном электрическом поле высокой частоты 10-100 кГц, при котором возникает поверхностное натяжение между электродом и исследуемым объектом от 5 до 30 кВ. Эффект Кирлиана наблюдается подобно молниям или статическому разряду на любых биологических, органических объектах, а также на неорганических образцах различного характера.
Для визуализации Кирлиановой ауры на электрод подаётся высокое переменное напряжение с высокой частотой - от 1 до 40 киловольт при 200-15000 Герц. Другим электродом служит сам объект. Оба электрода разделены изолятором и тонким слоем воздуха, молекулы которого подвергаются диссоциации под действием сильного магнитного поля, возникающего между электродом и объектом. В этом слое воздуха, находящемся между объектом и электродом, происходит три процесса.
Первый процесс заключается в ионизации и образовании атомарного азота.
Второй процесс – ионизация молекул воздуха и образования ионного тока – коронного разряда между объектом и электродом. Форма короны свечения, её плотность и т.п. определяются собственным электромагнитным излучением объекта.
Третий процесс - переход электронов с низших на высшие энергетические уровни и обратно. При этом переходе электронов происходит излучение кванта света. Величина перехода электрона зависит от собственного электромагнитного поля исследуемого объекта. Поэтому в различных точках поля, окружающего объект, электроны получают разные импульсы, т.е. перескакивают на разные энергетические уровни, что приводит к испусканию квантов света разной длины и энергии. Последние регистрируются человеческим глазом или цветной фотобумагой в качестве различных цветов, которые в зависимости от объекта могут окрашивать корону свечения в различные цвета. Эти три процесса в своей совокупности дают общую картину кирлиан-эффекта, который позволяет изучать электромагнитное поле объекта. Эффект Кирлиана, таким образом, связан с биоэлектрической аурой живого объекта.
См. ссылку: www.o8ode.ru/article/learn/kirlian.htm
www.o8ode.ru
Связь - вода - Большая Энциклопедия Нефти и Газа, статья, страница 3
Связь - вода
Cтраница 3
Тепловая энергия, необходимая для разрыва связей воды с твердым материалом для ее испарения, может подводиться к высушиваемому материалу тремя способами. При конвективной сушке сушильный агент - топочный газ или нагретый воздух - непосредственно контактирует с материалом, он является и теплоносителем и средой, в которую переходит влага. При контактной ( кондуктивной) сушке теплота передается материалу от горячей твердой поверхности, а при радиационной сушке - за счет лучеиспускания ( радиации) от излучателя. Конечная температура высушиваемого материала зависит от его влажности. [31]
По методу термограмм сушки определены фазы связи воды, поровая структура и степень гидратации шлаковых и шлакоцементных камней. Показано, что шлакоцементный камень с 30 % клинкера дает при затворении поровую структуру, близкую к структуре портланд-цементного камня. [32]
Молекулярная теплота гидратации - мера прочности связи воды в цеолитах. В натролите переход от насыщенного состояния с i.6 молекулами воды к продукту с 14 молекулами воды сопровождается быстрым возрастанием теплоты гидратации, которая затем остается постоянной со значением 25 жал / моль до полной дегидратации. В случае томсонита тепловой эффект отчетливо различен в интервале числа молекул воды от 12 до 8 и от 8 до 4; в случае гидрата с четырьмя молекулами воды теплота гидратации составляет около 30 ккал / моль. Следовательно, плавная кривая натролита указывает на одинаковость связи всех молекул воды, тогда как в томсоните можно выделить различные группы через каждые четыре молекулы воды. [33]
Суммируя данные, относящиеся к природе связи воды в гидрч-силикате кальция, можно считать установленным, что вода имеет цеолитный характер. На кривой нагревания гидратированноге двух кальциевого силиката отчетливо видно, что вода удаляется в широком интервале температур. В дальнейшем показано, что такой характер связи воды в гидратах присущ не только гидратирован-ному двухкальциевому силикату, но и гидратированным двух-стронциевому и двухбариевому силикатам. Следует отметить также, как это и подтверждают наши исследования, что вода в многих гидратированных соединениях, обладающих вяжущими свойствами, имеет цеолитный характер. [34]
Если воспользоваться предложенной П. А. Ребиндером классификацией различных форм связи воды с материалом, то можно установить, при каких условиях метод газоволюметрии позволяет определить влагу, связанную в том или ином виде. [35]
В табл. 4 5 представлены значения энергий связи воды, де-сорбируемой при 300 - 320 К, рассчитанные на основе полученных температурных зависимостей. Чем выше гигроскопичность материала, тем больше энергия связи воды с веществом, что свидетельствует о физико-химическом их взаимодействии. [37]
Для нефтяных коксов характерны две последние формы связи воды с веществом. [38]
В настоящей статье изложены результаты исследования прочности связи воды и катионов с активными центрами и адсорбции анионов из растворов солей и кислот. Последнее, по-видимому, позволило бы ближе подойти к раскрытию роли гидроксильной группы воды, участвующей в обмене с анионом. [39]
Для преодоления потенциального барьера, вызванного определенной энергией связи воды в гидратных оболочках, требуется некоторая кинетическая энергия. Поскольку крупные частицы обладают большей кинетической энергией при примерно равной скорости движения, сообщаемой им потоком воды, вероятность преодоления потенциального барьера крупными частицами выше, чем мелкими. [40]
Полученные спектры поглощения позволяют высказать предположение о характере связи воды с кетонами. [41]
Экстракционный метод может применяться также для исследования характера связи воды. [42]
Таким образом, знание внутренней и свободной энергии связи воды дает полную термодинамическую характеристику слабо химически связанной воды данных кристаллогидратов и позволяет рассчитывать все ее равновесные свойства. [43]
Этот факт тем более важен, что механизм связи воды IB гидросиликатах, как в водных окисях, может быть весьма разнообразен. Мы здесь следуем схеме, тщательно разработанной Буллам1 и Глемзером2, включающей кристаллические гидраты, цеолиты и коллоидные гели. [44]
Оптимальные условия процесса сушки осадков существенно зависят от характера связи воды с твердой фазой в механически обезвоженном осадке. Для идентификации свойств механически обезвоженных осадков определяют в лабораторных условиях кинетику сушки [35] и находят точки перегиба кривых сушки, соответствующих различным формам связи воды в осадке. Одновременно проводят проверку соответствия условий работы узла механического обезвоживания ( дозировки реагентов, перепада давления, влажности кека) параметрам сушки. Меняя состав исходного осадка и приемы оперативной корректировки свойств подсушиваемого продукта ( путем добавки сухого материала - ретура), находят условия сушки, соответствующие требованиям к конечному продукту и минимальным затратам энергии. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Характер - связь - вода
Характер - связь - вода
Cтраница 1
Характер связи воды с поверхностью металла зависит не только от природы металла, но и от природы электролита, в частности, от его кислотности или щелочности. [1]
Характер связи воды в формиате церия ( III) нельзя считать окончательно выясненным. О 2НгО с безводным Gd ( HCOOh [6] может навести на мысль об отсутствии связанной воды в формиате церия. [3]
При изучении характера связи воды в перлите в инфракрасной части спектра установлено понижение светопрозрачности при длине волны 2 73 и 6 1 ж / с, что указывает на наличие в структуре мономерных групп Н, ОН и молекулярной воды при наличии водородных связей. [4]
По степени подвижности и характеру связи воды с горными породами выделяют несколько ее видов: свободную ( или гравитационную), физически связанную, капиллярную, химически связанную, в твердом состоянии и в состоянии пара. [5]
Экстракционный метод может применяться также для исследования характера связи воды. [6]
Полученные спектры поглощения позволяют высказать предположение о характере связи воды с кетонами. [7]
Оптимальные условия процесса сушки осадков существенно зависят от характера связи воды с твердой фазой в механически обезвоженном осадке. Для идентификации свойств механически обезвоженных осадков определяют в лабораторных условиях кинетику сушки [35] и находят точки перегиба кривых сушки, соответствующих различным формам связи воды в осадке. Одновременно проводят проверку соответствия условий работы узла механического обезвоживания ( дозировки реагентов, перепада давления, влажности кека) параметрам сушки. Меняя состав исходного осадка и приемы оперативной корректировки свойств подсушиваемого продукта ( путем добавки сухого материала - ретура), находят условия сушки, соответствующие требованиям к конечному продукту и минимальным затратам энергии. [8]
Вследствие малой рассеивающей способности атомов водорода рентгеновским методом не представляется возможным изучить характер связи воды с минералами. [10]
Идентичный характер изменения наибольшей пластической вязкости и деформационного поведения смесей в какой-то степени является доказательством малого изменения для данного соотношения компонентов характера связи воды с поверхностью глинистых частиц. [11]
Для образцов с емкостью 14 7 и 2 2 % энергия активации оказалась равной 9 2 и 20 2 ккал / моль соответственно, что объясняется зависимостью значений энергии активации от характера связи воды. Большое значение энергии активации для образца с емкостью 2.2 % и отсутствие экзотермического эффекта на кривой его нагревания позволили заключить, что этот адсорбент не является качественным и не обладает цеолитовой структурой. [12]
При откачке псевдобемита в вакууме при комнатной температуре в отличие от бемита часть воды может быть удалена из него без изме-г нения структуры. На различие в характере связи воды в псевдобемите и бемите указывают кривые обезвоживания этих веществ. [13]
Суммируя данные, относящиеся к природе связи воды в гидрч-силикате кальция, можно считать установленным, что вода имеет цеолитный характер. На кривой нагревания гидратированноге двух кальциевого силиката отчетливо видно, что вода удаляется в широком интервале температур. В дальнейшем показано, что такой характер связи воды в гидратах присущ не только гидратирован-ному двухкальциевому силикату, но и гидратированным двух-стронциевому и двухбариевому силикатам. Следует отметить также, как это и подтверждают наши исследования, что вода в многих гидратированных соединениях, обладающих вяжущими свойствами, имеет цеолитный характер. [14]
При разложении хлорида - германия ( П) водой или раствором едкого натра получают желтый осадок, который при кипячении с небольшим количеством раствора едкого натра становится ржаво-красным в результате частичного окисления. Гидроокись Ge ( OH) 2, по-видимому, существует только в растворе. Осадок, который, принимая во внимание неизвестный характер связи воды, обозначают как гидрат окиси германия ( П), снова растворяется в большом избытке раствора едкого натра. Согласно Ганчу ( Hantzsch, 1902), электропроводность этого раствора значительно меньше, чем электропроводность чистого раствора едкого натра той же концентрации, из чего можно заключить, что при действии щелочи образуются соли. При насыщении едкого натра в этом растворе точно эквивалентным количеством соляной кислоты гидроокись германия ( П) не выпадает. Раствор, который наряду с гидроокисью гермапия ( П) содержит только NaCl, проявляет явно кислую реакцию. Из величины pro электропроводности следует, что гидроокись германия является отчетливо выраженной кислотой, хотя и более слабой, чем уксусная. [15]
Страницы: 1 2
www.ngpedia.ru

















