Водород (Hydrogenium – воду рождающий). Рождающий воду
Из огня рождающий… воду. От водорода до …?. Таубе Пётр Рейнгольдович
Из огня рождающий… воду
1. Водород — Hydrogenium (Н)
Вода из огня! Это кажется невероятным, но это факт. И этот факт впервые установил (1781–1782) английский ученый Генри Кэвендиш. Он сжег в закрытом сосуде бесцветный, без вкуса и запаха газ, который в те времена называли «горючим воздухом», и обнаружил, что продуктом горения была вода. Вначале Кэвендиш не поверил полученному результату, но, проделав ряд точных опытов по сжиганию «горючего воздуха», он убедился, что продуктом горения была только вода, «которая не имела ни вкуса, ни запаха и при испарении досуха не оставляла ни малейшего заметного осадка».
Следует отметить, что еще до Кэвендиша выдающийся английский естествоиспытатель Д. Пристли наблюдал появление влаги при горении и взрыве смеси «горючего воздуха», но … не обратил на это должного внимания.
Несмотря на то, что «горючий воздух» был известен еще средневековому немецкому врачу и естествоиспытателю Парацельсу (XVI в.), а знаменитый английский химик, физик и философ Роберт Бойль в 1660 г. сумел не только получить «горючий воздух» из серной кислоты и железа, но и собрать его в сосуд, чего не умели делать до него, простая (элементарная) природа этого газа была установлена только в 1783 г. В этом году французский ученый Антуан Лоран Лавуазье, желая проверить опыты Кэвендиша, провел точные исследования по изучению продукта горения «горючего воздуха». Они подтвердили опыты Кэвендиша — продуктом горения «горючего воздуха» была только вода. Это доказал Лавуазье не только путем сжигания «горючего воздуха», но и разлагая продукты его горения. Правда, поводом к анализу воды послужило отыскание дешевого способа получения водорода, предпринятое Лавуазье по заданию французской Академии наук в связи с начавшимся развитием воздухоплавания.
За способность производить воду «горючий воздух» стали впоследствии называть водородом. Научное название водорода — «хидрогениум» происходит от греческих слов «хидор» — вода и «генао» — рождаю, произвожу. Таким образом, в названии водорода отражено его основное свойство — способность при горении образовывать воду.
Атомы водорода имеют наименьший вес среди всех атомов других химических элементов, и поэтому водород занимает первое место в периодической системе Д. И. Менделеева.
Водород — один из наиболее распространенных элементов природы, он всюду обнаружен во Вселенной — на Солнце, звездах, в туманностях, в мировом пространстве. На Земле основная масса водорода находится в связанном состоянии в виде различных соединений, главным образом на поверхности земли в виде воды. Общее количество водорода в земной коре достигает 1 % от веса земной коры.
В межзвездном пространстве атомы водорода встречаются в несколько сот раз чаще, чем атомы всех остальных элементов, вместе взятых. Водород преобладает над другими элементами в атмосферах звезд и является главной составной частью солнечной атмосферы.
Значение водорода во Вселенной исключительно велико, он играет особую роль, являясь «космическим топливом», дающим энергию звездам, а в их числе и нашему Солнцу.
В недрах Солнца, где температура достигает 20 миллионов градусов и вещество находится под давлением восьми миллиардов атмосфер, атомы водорода теряют электроны и ядра таких атомов (протоны) приобретают скорости, при которых протекают ядерные реакции. Ядерные реакции, происходящие при очень высокой температуре, называются термоядерными. Термоядерная реакция, при которой из четырех ядер водорода образуется ядро нового химического элемента — гелия, и является источником солнечной энергии.
Образование гелия из водорода, как показал немецкий ученый Бете, происходит на Солнце значительно сложнее, но конечный итог реакции дает тот же результат: вместо четырех ядер водорода появляется ядро гелия. Энергия, освобождающаяся при этой реакции, обеспечивает излучение того огромного количества тепла и света, которое дает Солнце в течение уже многих миллиардов лет. Чтобы представить себе количество энергии, излучаемой Солнцем, достаточно сказать, что для выработки такой энергии понадобилось бы 180 000 000 миллиардов электростанций, обладающих мощностью Волжской ГЭС.
Водород в свободном состоянии встречается на земле в вулканических газах; небольшое количество водорода выделяется растениями. В атмосфере, даже в верхних ее слоях, водород содержится в незначительных количествах, не превышающих 0,00005 % по объему.
В чистом виде водород представляет газ в 14,45 раз легче воздуха, не имеющий цвета, запаха и вкуса. Не ядовит. Водород диффундирует и эффундирует быстрее всех других газов и лучше всех их проводит тепло (теплопроводность водорода в 7 раз больше чем у воздуха).
В природе водород встречается в виде трех изотопов: обычный водород, тяжелый и сверхтяжелый водород. Тяжелый водород содержится в обычном водороде в небольших количествах. На 5 тыс. атомов обычного водорода приходится 1 атом тяжелого. От греческого слова «деутерос», что значит второй, тяжелый водород, как второй изотоп водорода, называется дейтерием. По аналогии с протоном ядро этого атома получило название дейтон; часто его называют дейтерон.
Обозначают дейтерий или латинской буквой D, или сохраняют химическое обозначение водорода и, указывая цифрой 2 его массовое число, пишут Н2.
Дейтерий отличается от обычного водорода строением ядра. Ядро дейтерия состоит из протона и нейтрона, поэтому масса атома дейтерия в два раза больше массы атома обычного водорода. Такое резкое расхождение в массах изотопов одного и того же химического элемента является единственным случаем среди известных изотопов различных элементов. Обычный водород, атомы которого являются простейшими (состоят из одного протона и одного электрона), от слова «протос» — простой — называется иногда протием.
Вода, в которой протий заменен дейтерием, называется тяжелой. Она отличается от обычной своими свойствами. Так, тяжелая вода замерзает не при 0°, как обычная, а при +3,8 °C, кипит не при 100 °C, а при 101,4 °C, имеет большую плотность (1,1056), чем обычная; в тяжелой воде невозможна жизнь. В обычной воде всегда содержится примесь тяжелой. Количество ее невелико и составляет 0,02 % от общей массы. Однако собранная со всего земного шара, она могла бы наполнить водоем, равный по величине объему Черного моря.
Тяжелая вода используется при получении атомной энергии в ядерных реакторах в качестве вещества, замедляющего нейтроны.
Получение тяжелой воды в чистом виде — длительный и дорогой процесс, основанный на электролизе (разложении электрическим током) воды, при котором в первую очередь разлагаются молекулы «обыкновенной» воды, тогда как тяжелая накапливается в остатке. В Западной Европе производство тяжелой воды в промышленном масштабе было впервые осуществлено немцами в годы второй мировой войны на территории оккупированной Норвегии, располагавшей дешевой энергией гидроэлектростанций. Тяжелая вода предназначалась для создания нового вида оружия (атомной бомбы), на которое командование фашистских армий возлагало последние надежды. 28 февраля 1943 г. норвежские патриоты совместно с английскими парашютистами взорвали цех тяжелой воды. Начавшиеся вслед за этим налеты на завод английской авиации вынудили фашистское командование перевезти оборудование и накопленный запас воды в Германию. Норвежские бойцы из армии сопротивления 20 февраля 1945 г. взорвали пароход, уничтожив вместе с оборудованием и 16 куб. м тяжелой воды.
Стоимость тяжелой воды все еще высока. По данным зарубежной печати, один кубический метр тяжелой воды стоит не менее 300 тыс. долларов.
Известен и третий «сверхтяжелый» изотоп. Тритий — называют этот изотоп от латинского слова «тритиум» — третий. Он может быть получен искусственным путем в результате ядерных реакций, например, при «стрельбе» нейтронами в атомы легкого металла лития. В ядрах атомов трития имеется два нейтрона и один протон. В природе распространенность трития ничтожно мала. Один атом трития приходится на миллиард миллиардов атомов обычного водорода. Тритий является радиоактивным изотопом водорода. Он излучает бета-частицы и превращается в изотоп гелия с атомным весом 3. Период полураспада трития около 12,5 лет.
Совсем недавно появилось сообщение о новом изотопе, которому еще не дано названия, хотя и установлено, что атомный вес его равен 4. Группа итальянских физиков, изучив несколько тысяч снимков ядерных реакций, обнаружила этого четвертого «брата» в семействе атомов водорода. Насколько трудной была задача обнаружения «сверхтяжелейшего» водорода, говорит время его существования, равное 0,00000000001 доли секунды.
Кроме обычных молекул водорода, состоящих из двух атомов, предполагается возможность получения трехатомной молекулы — гизония. Не исключено, что гизоний столь же недолговечен, как и «сверхтяжелейший» водород.
Практическое применение водорода разнообразно. Являясь наилегчайшим газом, он используется для наполнения оболочек воздушных шаров, метеорологических зондов, стратостатов и других воздухоплавательных аппаратов. История воздухоплавания, начиная с воздушного шара в 18 куб. м, созданного французским физиком Шарлем, до гигантских управляемых дирижаблей германского конструктора Цеппелина, неразрывно связана с водородом. Однако горючесть водорода при легкой его воспламеняемости от случайных и трудно устранимых причин (грозовые разряды, искры при электризации трением и др.) ограничивала возможности его использования в воздухоплавании.
…С ясного и безоблачного неба в самых неожиданных местах на территории США в годы второй мировой войны падали бомбы, раздавались взрывы, пылали пожары. Но об этих таинственных налетах, без сигналов тревоги и вражеских самолетов в воздухе, хранила молчание даже падкая на сенсации американская печать. Лишь несколько лет назад было сообщено, что эти таинственные бомбардировки осуществлялись воздушными шарами, запущенными с японских островов. Таких шаров было запущено более тысячи.
Прозрачные шары из полиэтиленовой пленки, наполненные водородом (до 10 тыс. куб. м) и снабженные оборудованием для шпионских целей, американская разведка пыталась запускать и на нашу территорию в послевоенные годы.
В химической промышленности водород служит исходным материалом для получения различных веществ (аммиака, твердых жиров и т. д.). Высокая температура горения водорода (до 2500 °C) в кислороде используется с помощью специальных горелок для плавления кварца, тугоплавких металлов, разрезания стальных плит и т. д.
Весьма заманчива своей дешевизной идея двигателя внутреннего сгорания, использующего в качестве топлива водород. Такой мотор, потребляя водород и воздух, выбрасывает в качестве продукта сгорания воду.
Специалисты из агрессивного блока НАТО предполагают, что такие водородные шары пригодны для транспортировки атомных бомб и доставки ракет с заводов к пусковым площадкам.
Для получения водорода в качестве топлива нужна только… вода. Запасы воды — основного «сырья» для получения водорода — на земном шаре буквально неисчерпаемы и составляют 2 · 1018 (2 миллиарда миллиардов) тонн. Так же неисчерпаема и энергия текучей воды крупных рек, которая, превращаясь на электростанциях в энергию электричества, может служить для получения водорода из воды разложением ее электрическим током.
Успехи атомной физики и химии открыли путь к возможности использования в практических целях изотопов водорода. К сожалению, эти возможности в первую очередь были использованы для целей военного характера, для создания водородной бомбы.
В водородной бомбе используется энергия термоядерной реакции (между дейтерием и тритием), ведущей к образованию гелия и выделению нейтронов.
Чтобы между изотопами водорода началась реакция, надо нагреть их до сверхвысоких температур порядка не менее 10 млн. градусов. Такая температура возникает при взрыве атомной бомбы, которая играет роль запала в водородной бомбе.
Водородная бомба превосходит по своей силе атомную. Дело в том, что в атомной бомбе количество атомного взрывчатого материала ограничено и не может превышать определенной так называемой критической массы; в водородной бомбе количество взрывчатого вещества (смесь изотопов водорода) не ограничено.
Рассчитывая на монопольное обладание секретом изготовления водородной бомбы, американский империализм пытался запугать миролюбивые народы и сделать их послушными интересам капитализма.
Однако этот расчет поджигателей войны был уничтожен в самой основе. 20 августа 1953 г. было опубликовано правительственное сообщение об успешном испытании водородной бомбы в СССР. Однако в этом сообщении, как и в ряде последующих заявлений, правительство СССР еще раз подтвердило свою готовность пойти на запрещение всех видов атомного и водородного оружия, что и нашло свое отражение в подписанном недавно Московском договоре о запрещении испытаний ядерного оружия в воде, атмосфере и космическом пространстве.
Неисчерпаемая энергия легчайшего элемента должна служить миру и счастью народов.
librolife.ru
20 фактов о водороде. — Все о Водороде и Водородной воде
- Водород занимает первое место в периодической системе химических элементов Менделеева и обозначается символом H.
- Водород — самый маленький и распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов. Таким образом, водород — основная составная часть звёзд и межзвёздного газа.
- В больших количествах водород обнаружен в звездах и планетах типа «газовый гигант». Он играет ключевую роль в протекающих в звездах реакциях синтеза.
- Простое вещество водород — h3 — самый лёгкий газ, он легче воздуха в 14,5 раз.
- При комнатной температуре и нормальном давлении водород в виде газа не имеет вкуса, цвета и запаха.
- Свободный водород h3 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
- А. Л. Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — «вода» и γεννάω — «рождаю») — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова
- В 2007 году японские ученые сделали открытие: молекулярный водород имеет высокий терапевтический потенциал для организма человека.
- Водород оздоравливает организм на клеточном уровне, повышает иммунитет и жизненный тонус организма, оказывает профилактическое и лечебное действие при множестве самых различных заболеваний, включая хронические, омолаживает организм и препятствует преждевременному старению.
- На сегодняшний день о пользе водороде для организма человека написано более чем 600 научных и медицинских статей.
- Наиболее простой и эффективный способ употребления водорода в лечебно-профилактических целях — в виде воды, обогащенной водородом.
- Водородная вода полезна и безопасна для людей любого возраста и не имеет побочных эффектов. Она имеет нейтральный либо слабощелочной pH и высоко отрицательный ОВП, являясь идеальным напитком для употребления человеком.
- Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения, проникая во все клетки и ткани тела человека.
- Водород — самый мощный антиоксидант. В результате ликвидации водородом вредных свободных радикалов в организме человека образуется вода. Другие антиоксиданты, при аналогичной реакции, образуют вредные побочные отходы.
- Водород является одним из двух элементов, из которых состоит вода (h3O). Каждая молекула воды содержит два атома водорода и один атом кислорода.
- Для увеличения концентрации молекулярного водорода в воде используют метод электролиза, т.е. разложение воды на водород и кислород под действием постоянного тока. Такая вода становится лечебной, обладает терапевтическим потенциалом. Уже существуют аппараты, производящие воду, обогащенную водородом, в домашних условиях.
- Под давлением и при сильном холоде (-252,87 градусах по Цельсию) водород переходит в жидкое состояние. Хранимый в этом состоянии водород занимает меньше места, чем в своей «нормальной» газообразной форме. Жидкий водород используется, в том числе, и в качестве ракетного топлива.
- При сверхвысоком давлении водород переходит в твердое состояние и становится металлическим водородом. В этом направлении ведутся научные исследования.
- Водород используется в качестве альтернативного топлива для транспорта. Химическая энергия водорода высвобождается при его сжигании способом, подобным тому, который применяется в традиционных двигателях внутреннего сгорания. На его основе также создаются топливные элементы, в которых задействован процесс образования воды и электричества путем осуществления химической реакции водорода с кислородом.
- Водород зарегистрирован в качестве пищевой добавки E949 (упаковочный газ, класс «Прочие»). Входит в список пищевых добавок, допустимых к применению в пищевой промышленности Российской Федерации в качестве вспомогательного средства для производства пищевой продукции.
Читайте статью «Водород: каков механизм положительного воздействия на организм человека» и заходите на сайт www.h3miraclewater-russia.ru для получения более подробной информации о водородных аппаратах и водородной воде.
Если Вам понравилась статья, подписывайтесь на блог и нажимайте на кнопку «Нравится».
Поделиться ссылкой:
Понравилось это:
Нравится Загрузка...
h2miraclewater.net
Водород
Водоро́д (калька с латинского: лат. Hydrogenium — hydro = «вода», gen = «порождающий»; hydrogenium — «порождающий воду»; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — h3 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
История
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова .
Распространённость
Во Вселенной Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре. Земная кора и живые организмы Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму). Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Получение
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током. Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре: СН4 + 2Н2O = CO2↑ + 4Н2 −165 кДж Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком. Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
Источник: Википедия
Другие заметки по химии
edu.glavsprav.ru
Водород (Hydrogenium – воду рождающий)
Имеет 3 изотопа: протий 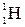 , дейтерий
, дейтерий 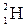 или Д и тритий
или Д и тритий 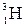 или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения.
или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения.
Свободного водорода на Земле почти нет, в атмосфере его содержание не превышает 5×10-5%. Практически весь водород находится в связанном состоянии в составе многих минералов, углей, нефти, живых и растительных организмов, но самым распространенным его соединением является вода.
Водород – s-элемент, в различных вариантах периодической системы помещают его то в I A, вместе со щелочными металлами, то в VII A вместе с галогенами, а иногда рассматривают отдельно.
Со щелочными металлами он сходен в том, что образует положительный ион Н+ и играет роль восстановителя.
Но с галогенами у него больше сходства: в гидридах активных металлов (Cah3, NaH), содержится ион Н-, подобный ионам Г- (NaCl, CaCl2). Молекулы водорода и галогенов двухатомны (Н2, Cl2, Br2). Для водорода, как и для фтора, хлора, характерны газообразное состояние и неметаллические свойства. Потенциалы ионизации водорода и галогенов близки. Атомы водорода легко замещаются атомами галогенов в органических соединениях. Поэтому вариант ПС, где Н возглавляет VII А группу более правилен.
Особенности водорода – единственный валентный электрон водорода находится непосредственно в зоне действия атомного ядра. Особенностями строения атома водорода обусловлено существование водородной связи.
Получение Н2
В промышленности водород получают из воды и углеводородов. При этом восстановителем водорода при температуре (600-900°С) являются атомы углерода
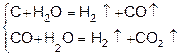 .
.
Конверсия метана с водяным паром:
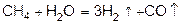 .
.
При более высокой температуре (950-1100°) можно получить разложением метана особо чистый водород и углерод.
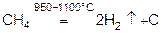
В лаборатории:
1) при действии разбавленного раствора кислоты на активный металл (в аппарате Киппа):
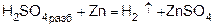
или
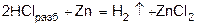
2) щелочные металлы и щелочноземельные вытесняют водород из воды.
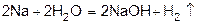
3) действием едких щелочей на металлы
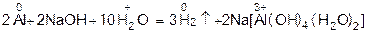
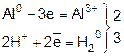
или 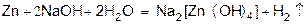
4) разложением гидридов типичных металлов водой
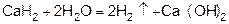
5) электролизом воды (электролиз водных растворов щелочей).
2h3O 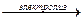 2h3 + O2
2h3 + O2
Физические свойства. В обычных условиях водород – это самый легкий газ без цвета, запаха и вкуса, плохо растворим в воде.
Атомарный водород гораздо активнее молекулярного, для которого нужны дополнительные затраты энергии на расcпаривание электронов.
По электроотрицательности занимает промежуточное положение между неметаллами и металлами. И в реакциях с неметаллами и кислородсодержащими веществами играет роль восстановителя.
Химические свойства Н2
Водород легко соединяется с кислородом, горит на воздухе или в атмосфере чистого кислорода бледно-синим пламенем.
1) 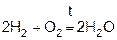
Если состав смеси приближается к стехиометрическому
(2 объема Н2 и 1 объем кислорода), то смесь называется “гремучим газом”, т.к. реакция имеет в этом случае взрывной характер.
Водородно-кислородное пламя, имеющее температуру 2500°-2800°С используют для плавления тугоплавких металлов и автогенной сварки.
2) 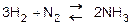 (при температуре 450 – 5000С и повышенном давлении, в присутствии катализатора).
(при температуре 450 – 5000С и повышенном давлении, в присутствии катализатора).
3) 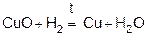 (при нагревании).
(при нагревании).
4) 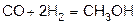 (при повышении температуры и давления, в присутствии катализатора).
(при повышении температуры и давления, в присутствии катализатора).
5) 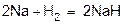 (с очень активными металлами водород взаимодействует непосредственно как окислитель, превращаясь в ион Н- (гидрид-ион).
(с очень активными металлами водород взаимодействует непосредственно как окислитель, превращаясь в ион Н- (гидрид-ион).
3. Вода и ее свойства. Экологическое и биологическое значение Н2О
Три изотопа водорода 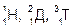 и три стабильных изотопа кислорода 16О, 17О, 18О в различных сочетаниях могут образовывать 18 изотопических разновидностей воды с молекулярными массами от 18 до 24 (Т218О). В тяжелой воде вещества растворяются хуже, растворы меньше проводят электрический ток. Она гигроскопична, жадно поглощает влагу из воздуха. Помещенные в нее без предварительной подготовки живые существа (рыбы, черви и т.п.) погибают, семена в ней не прорастают, микробы не живут. Вода имеет очень большое значение в жизни растений, животных и человека. Согласно с современными представлениями происхождение жизни связано с водной средой. Во всяком живом организме в воде протекают химические процессы, обеспечивающие жизнедеятельность организма.
и три стабильных изотопа кислорода 16О, 17О, 18О в различных сочетаниях могут образовывать 18 изотопических разновидностей воды с молекулярными массами от 18 до 24 (Т218О). В тяжелой воде вещества растворяются хуже, растворы меньше проводят электрический ток. Она гигроскопична, жадно поглощает влагу из воздуха. Помещенные в нее без предварительной подготовки живые существа (рыбы, черви и т.п.) погибают, семена в ней не прорастают, микробы не живут. Вода имеет очень большое значение в жизни растений, животных и человека. Согласно с современными представлениями происхождение жизни связано с водной средой. Во всяком живом организме в воде протекают химические процессы, обеспечивающие жизнедеятельность организма.
Вода обладает аномально большой теплоемкостью равной 4,18 , песок = 0,79, NaCl = 0,88 (Дж/(г×К).
Поэтому это имеет большое значение для жизни. При переходе от лета к зиме, ото дня к ночи она остывает медленно и является регулятором температуры на земном шаре.
Она имеет самую высокую температуру кипения в ряду
Н2О – Н2S – h3Se – h3Te,
Tкипения, °С 100 -60 -41 -2
Если от h3Te к Н2S температура кипения закономерно уменьшается, то при переходе от Н2S к Н2О резко увеличивается. Это объясняется наличием водородной связи между молекулами воды, вследствие кулоновского взаимодействия положительно заряженного атома водорода одной молекулы и электроотрицательным атомом кислорода другой
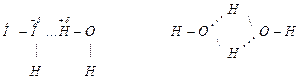
Такое взаимодействие затрудняет отрыв молекул друг от друга, т.е. уменьшает их летучесть, а, следовательно, повышает температуру кипения.
Молекула воды из-за sp3-гибридизации орбиталей атома кислорода имеет угловую конфигурацию, а атомы водорода, соединенные с сильно-электроотрицательным атомом кислорода, определяют ее способность к установлению четырех водородных связей с соседними молекулами.
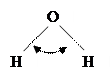
Химические свойства Н2О
Вода – очень активный реагент по следующим причинам:
а) за счет ориентационного взаимодействия с полярными молекулами других веществ;
б) установления водородных связей;
в) проявления донорных свойств со стороны атома кислорода по отношению к частицам – акцепторам электронных пар;
г) электролитической диссоциации при обычных условиях (ионы Н+ гидратируются, образуя ионы Н3О+ ).
1. При температуре выше 1000°С диссоциация водяного пара, но равновесие сдвинуто в сторону воды.
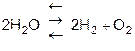 .
.
2. Оксиды металлов и неметаллов соединяются с водой, образуя основания и кислоты (гидрооксиды).
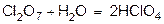
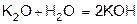
3. Некоторые соли образуют с водой кристаллогидраты. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения, т.е. за счет ион -дипольного взаимодействия.
Например: кристаллогидрат сульфата натрия Na2SO4×10h3O (глауберова соль), Na2CO3×10h3O - кристаллическая сода.
Гидраты, образующиеся в результате донорно-акцепторного взаимодействия (где ионы растворенного вещества выступают обычно в качестве акцепторов, а молекулы растворителя в качестве доноров электронных пар) представляют собой частный случай комплексных соединений.
Аквакомплексы– лигaндами является вода, [Co(h3O)6]Cl2, [Al(h3O)6]Cl3, [Cr(h3O)6]Cl3 и др. Некоторые аквакомлексы в кристаллическом состоянии удерживают кристаллизационную воду [Cu(h3O)4]SO4×h3O – медный купорос.
4. Пероксид водорода. Окислительно - восстановительная двойственность Н2О2
1. Строение молекулы. Структурная формула Н - О – О - Н. Энергия связи О-О (210 кДж/моль) почти в 2 раза меньше энергии связи О-Н (468 кДж/моль). Из-за несимметричного распределения связей Н - О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150°С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение (σ) больше, чем у Н2О.
В молекуле Н2О2 связи между атомами кислорода и водорода полярны (вследствие смещения общих электронных пар к кислороду). В водных растворах – это слабая кислота, хоть и в незначительной степени распадается на ионы:
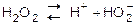 I ст. К1 = 2,6×10-12.
I ст. К1 = 2,6×10-12.
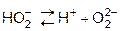 II ст. практически не протекает,
II ст. практически не протекает,
т.к. подавляется диссоциацией Н2О, которая протекает в большей степени, чем Н2О2. Сместить диссоциацию по 2-й ступени можно введением щелочи.
2. С некоторыми основаниями Н2О2 взаимодействует непосредственно образуя соли, что подтверждает его кислотные свойства.
Ba(OH)2 + h3O2 = BaO2 + 2h3O
соль
пероксида водорода
3. В отличие от воды пероксид водорода – непрочное соединение, разлагается даже при комнатной температуре (диспропорционирует на свету)
Н2О2-1 + Н2О2-1 = О20 + 2Н2О-2
Н2О2 = Н2О+ О
Неустойчивость Н2О2 обусловлена непрочностью связи О - О.
Атомы кислорода в молекуле Н2О2 связаны непосредственно друг с другом неполярной ковалентной связью. Связи О - Н полярны. Поэтому молекула Н2О2 также полярна.
Пероксиды относят к классу солей. Как соли они могут вступать в реакцию обмена с кислотами:
ВаО2 + Н2SO4 = BaSO4¯ + h3O2
в отличие от оксидов
SnO2 + 2h3SO4 = Sn(SO4)2 + 2h3O
Этой реакцией пользуются для различия оксидов и пероксидов.
 Н 0.95 А0 = 0,095нм
Н 0.95 А0 = 0,095нм
1,48 А0 = 0,148нм
120°
О О
95°
Н
ЕО-О = 210 кДж/моль ЕО-Н = 468 Дж/моль
Молекула нелинейна, две связи О - Н расположены не симметрично, а в 2-х плоскостях под углом 120°. Поэтому полярность mН2О2 > mН2О.
4. Окислительно-восстановительная двойственность Н2О2
Н2О2 + 2КI = I2 + 2KOH
окислитель восстановитель
Н2О2 + Ag+2O = 2Ag0 + O2 + h3O
восстановитель окислитель
h3O2 + KMnO4 + h3SO4 → O2 + MnSO4 + K2SO4 + h3O
h3O2 + KI + h3SO4 → h3O + I2 + K2SO4
Na2O2 и K2O2 – используют для регенерации кислорода в подводных лодках и в изолирующих противогазах.
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Наличие атомарного кислорода сообщает Н2О2 и Na2O2 сильные окислительные свойства. Na2O2 способен гидролизоваться с образованием h3O2 по реакции
Na2O2 + 2h3O = 2NaOH + h3O2
В связи с этим они находят применение для отбеливания шерсти, шелка, мехов.
Аптечная перекись водорода – 3% водный раствор Н2О2, применяется как дезинфицирующее средство, (30% раствор называется пергидроль).
stydopedia.ru
Технологическая карта урока "Водород, рождающий воду и энергию"
Технологическая карта урока по ФГОС ООО
Учитель - Бадмаева Э.Ж., учитель химии МБОУ «Дыренская средняя общеобразовательная школа» Курумканского района Республики Бурятия
Предмет ХИМИЯ
Класс 8
Тема - Водород, рождающий энергию и воду
Цели урока:
Предметно-дидактическая цель: сформировать у обучающихся представления о водороде как о химическом элементе и простом веществе, о способах получения водорода, о химических свойствах и применении водорода;
Задачи: продолжить развитие у учащихся желания к самостоятельному добыванию знаний на уроке, с помощью побудительного диалога; самостоятельности логического мышления; воспитание коммуникативной культуры.
Планируемые образовательные результаты урока:
1.Личностные: готовность и способность к саморазвитию и самообразованию на основе мотивации к обучению и познанию; умение работать по инструкции с лабораторным оборудованием с соблюдением правил ТБ
Тип урока:
1.По ведущей дидактической цели - текущий
2.По способу организации - комбинированный
3.По ведущему методу обучения – репродуктивный
Методы обучения:
1.Основной - объяснение.
2.Дополнительные - самостоятельная работа учащихся, беседа, эксперимент, частично-поисковый.
Средства обучения: учебник, справочники и энциклопедии, компьютер, экран, проектор, презентация к уроку, лабораторное оборудование, химические реактивы: соляная кислота, металлический цинк.
Технологическая карта урока
Организует деятельность по контролю ранее изученной темы «Типы химических связей»:- проводит тестирование в интерактивном режиме ( ЭОР – mmlab.chemistry 140к) Слайд 1
Выполняют тестирование.
Обсуждают ответы одноклассников.
Слушают заключение учителя
Контролируют свои действия, оценивают себя
Личностные: формирование способности к самооценке на основе критерия успешности учебной деятельности.
Регулятивные: контроль, оценка, коррекция; выделение и осознание того, что усвоено, что еще подлежит усвоению
Коммуникативные: умение работать в группе.
3.Этап мотивации (самоопределения) к учебной деятельности
1.Ребята перед вами стихи Ю.Олеши
«Как слетать с земли до звезд,
Как поймать лису за хвост, Как из камня сделать пар,
Знает доктор наш Гаспар» (Слайд 2).Сегодня мы можем стать настоящими волшебниками, если мы будем активно и хорошо работать, настраиваться на диалог
2.Загадывает загадку (слайд 3)
Вы со мной уже встречались - Я космический скиталец, Элементов прародитель И отважный предводитель. Я любитель кислорода, Вместе с ним даю я воду.
(Слайд 4)
1. На доске тема урока и эпиграф. (Приложение слайд 5) Привлекает внимание обучающихся к эпиграфу. Организует деятельность учащихся на уроке
Я слышу и забываю.
Я вижу и запоминаю.
Я делаю и понимаю.
(Конфуций)
1. Обсуждают слова из детской сказки «Три толстяка»
2. Ученики отгадывают загадку и говорят ответ: «Речь идет о водороде».
Обсуждают эпиграф в начале урока, кто такой Конфуций? (проблемная ситуация)
Личностные: формирование смыслов учебной деятельности на основе развития познавательных интересов, учебных мотивов
Коммуникативные: формирование планирования учебного сотрудничества с учителем и сверстниками
4.Этап целеполагания
Знаю /хочу узнать (слайд 6)
Что мы хотим узнать о водороде? По какому пути мы можем пойти, чтоб узнать о водороде все?
Учитель организует диалог с учащимися (слайд 7)
Совместное заполнение столбцов (что я знаю и что я хочу узнать о водороде)
Учащиеся предполагают, обсуждают, высказывают свои мнения
Коммуникативные: умение работать в группе, умение слушать и вступать в диалог, участвовать в коллективном обсуждении проблем
Познавательные: умение самостоятельно формулировать учебную проблему, познавательную цель, составлять план решения проблем включая логические действия
5.Этап актуализации и пробного учебного действия
Организует работу в группах.
(слайд 8)
Что вы знаете о водороде как о химическом элементе?
Организует работу в группе с инструктивными картами, обращает внимание на ПСХЭ им. Д.И. Менделеева.
Что вы знаете о водороде как о простом веществе? (слайд 9)
Работа в группах выполняется на листах – инструктивных картах.
Ученики заполняют карточку сравнивая химический элемент водород с химическим элементом кислородом, оценивают себя в составе группы, делают выводы
Коммуникативные: умение работать в группе, умение слушать и вступать в диалог, участвовать в коллективном обсуждении проблем
Познавательные: умение анализировать результаты, ориентироваться в своей системе знаний, осознано строить речевое высказывание в устной и письменной форме
Регулятивные: умение сравнивать один элемент с другим, одно вещество с другим, умение оценивать себя,
6.Этап выявления места и причины затруднения
Проблемная ситуация.
Мы узнали физические свойства вещества водорода. А как мы можем еще больше узнать о водороде? Правильно!! Получив его. А как его получим? Из каких веществ получается газообразный водород?
Помни, каждый ученик, Знай, любая кроха: Безопасность — хорошо, А халатность — плохо!
Предлагается выполнить лабораторный практикум с помощью лаборанта – ученика старших классов (Что нужно соблюдать?) (Слайд 10)
Учитель проводит демонстрационный опыт получения в аппарате Киппа
(происхождение названия связано с голландской фирмой)
Газ водород можно собрать методом вытеснения воздуха или воды, так как водород практически нерастворим в ней.
Проверка на чистоту! Наблюдают, делают вывод: если поднести горящую спичку к пробирке будет слышан хлопок.
Познавательные: умение моделировать решение проблемы, построение логических цепей, анализировать, структурировать знания, работать с текстом.
Личностные: умение работать по инструкции с лабораторным оборудованием с соблюдением правил ТБ
7.Этап построения проекта выхода из затруднения
А как нужно действовать, получив его? (Слайды 11-12-13-Химические свойства водорода)
Организует работу в парах, группах наблюдает за деятельностью обучающихся.
Заостряет внимание на реакции
2h3 + O2 = 2h3O (рождает воду и при этом выделяется энергия, где это может использоваться???)
Учащиеся предполагают, моделируют, чтобы решить проблему, оценивают себя, как внесшего вклад в работу группы
Работают в группе, с текстом учебника стр. 98., находят ответ, фиксируют на листах, проговаривают, составляют уравнения химических реакций
На химических свойствах (заполняют графу «Свойства»)
CuO + h3 = Cu + h3O
Cl2 + h3 = 2HCl
2Na + h3 = 2NaH
2h3 + O2 = 2h3O (рождает воду и при этом выделяется энергия)
Может использоваться в качестве топлива (экологически чистого)
Познавательные: умение моделировать решение проблемы, построение логических цепей, анализировать, структурировать знания.
Коммуникативные: умение планировать учебное сотрудничество с учителем и сверстниками
Регулятивные: умение составлять план и последовательность действий
8.Этап реализации построенного проекта
Выполнение заданий (слайд 14).
Каждой группе раздаются карточки с заданиями «Применение водорода»
Водород рождает энергию, поэтому водород - это топливо будущего, существует много примеров создания и применения топливных элементов. Например: подобный агрегат служит источником воды и энергии в космических кораблях, двигателях автомобилей, подводных лодках.
Организует работу в группах. Задает вопросы.
Работают с текстом учебника, справочника химика, энциклопедии. Пробуют моделировать процессы.
Преобразовывают информации, делают вывод.
Отвечают на вопросы учителя:
Производство металлов
Газовая горелка
Получение различных веществ
Познавательные: умение ориентироваться в своей системе знаний: отличать новое от уже известного с помощью учителя, преобразовывать информацию из одного вида в другой, поиск и выделение необходимой информации, умение анализировать свои результаты.
Коммуникативные: умение слушать и понимать речь других, планирование учебного сотрудничества с учителем и сверстниками, умение договариваться и находить общее решение.
9.этап рефлексии учебной деятельности на уроке
Подведение итогов работы на уроке (слайд 15).
Вспомните, какую цель мы поставили в начале урока?
Для этого давайте вернемся к эпиграфу
Как вы считаете, достигли ли мы целей?
Оценивают деятельность всей группы на уроке по 3 критериям Коррекция самооценок, самоанализа, выставление оценок.
Читают эпиграф, делают выводы.
Проводят рефлексию
Водород –химический элемент…
Водород-простое вещество…
Водород может быть получен…
Водород с кислородом образует …
Водород рождает… и …
Водород нужен…
Знаю-хочу узнать-
узнал!!!
Совместная деятельность учителя и учащихся по заполнению столбца «Что узнал о водороде)
Учащиеся обсуждают эпиграф после завершения урока
Личностные: формирование адекватной позитивной, осознанной самооценки, способность к самооценке на основе критерия успешности учебной деятельности.
Познавательные: умение структурировать знания
Регулятивные: планирование, контроль, оценка, коррекция; выделение и осознание того, что усвоено, что еще подлежит усвоению
Коммуникативные: умение работать в группах, умение с достаточной полнотой и точностью выражать свои мысли
Информация о домашнем задании
Формулирует задание, комментируя его при необходимости.
учебник по химии 8 класс Н.Е.Кузнецовой §53
Дополнительное творческое задание: «Химический элемент водород в космосе» или «Использование водорода как топлива»
Записывают домашнее задание в дневник.
Познавательные: переработка изученной информации и ее преобразование, постановка и формулирование проблемы, самостоятельное создание алгоритмов деятельности при решении проблем творческого и поискового характера.
Список использованной литературы:
1. http://school-collection.edu.ru/
2. http://wikischool-ru.livejournal.com/
3.Виртуальная лаборатория. Открытая химия. 8-11 класс. [Электронный носитель]. – М.:
4 « Общая химия» Н.Л.Глинка, изд. «Химия», 1998 г
5.Уроки химии Кирилла и Мефодия. 8-9 класс. [Электронный носитель]. – М.: «Кирилл и Мефодий», 2007
6.Учебник Н.Е.Кузнецовой « Химия - 9», изд. «Дрофа», 2011 г
7.Энциклопедия для детей «Химия», изд. «Аванта», 2013 г
infourok.ru
#химия | 14 фактов о водороде

Водород — самый распространенный во Вселенной химический элемент. Его символом в таблице Менделеева является H, его атомное число — 1. Именно водород — своеобразная «точка отсчета», «химическая единица», и каждому человеку будет интересно узнать об нем немного побольше. Не исключено, что он станет топливом грядущих транспортных средств.

Новозеландский ресурс Science for Kids составил интереснейшую подборку информации о мейнстримнейшем из элементов периодической таблицы.
1. Водород — самый легкий, самый простой и самый распространенный химический элемент во Вселенной. Он составляет примерно 75% от всей массы элементов в ней.
2. В больших количествах водород обнаружен в звездах и планетах типа «газовый гигант». Он играет ключевую роль в протекающих в звездах реакциях синтеза.
3. Водород является одним из двух элементов, из которых состоит вода (h3O). Каждая молекула воды содержит два атома водорода и один атом кислорода.
4. Водород был впервые обнаружен в 1766 году Генри Кавендишем в процессе реакции окисления металла. В 1781 году он обнаружил также, что процесс горения водорода сопровождается образованием воды. Хотя Кавендиш и считается первооткрывателем водорода, ученые и до него выделяли этот элемент, не считая его при этом самостоятельным.
5. Через два года (в 1783 году) водород получил свое имя. Слово «гидроген» происходит из греческого языка и состоит из слов «гидро» (означающего воду) и «генез» (означающего рождение). Гидро- (водо-) ген (род) — порождающий воду.
6. Водород является газом с молекулярной формулой h3. При комнатной температуре и нормальном давлении водород является безвкусным, бесцветным и лишенным запаха газом.
7. Под давлением и при сильном холоде (-252,87 градусах по Цельсию) водород переходит в жидкое состояние. Хранимый в этом состоянии водород занимает меньше места, чем в своей «нормальной» газообразной форме. Жидкий водород используется в том числе и в качестве ракетного топлива.
8. При сверхвысоком давлении водород переходит в твердое состояние и становится металлическим водородом. В этом направлении ведутся научные исследования.
9. Водород используется в качестве альтернативного топлива для транспорта. Химическая энергия водорода высвобождается при его сжигании способом, подобным тому, который применяется в традиционных двигателях внутреннего сгорания. На его основе также создаются топливные элементы, в которых задействован процесс образования воды и электричества путем осуществления химической реакции водорода с кислородом.
10. Инженеры и автопроизводители исследуют возможность применения водорода в качестве массового топлива для автомобилей. Одной из перспектив является помещение в топливный бак водорода в твердом состоянии. На этом пути много трудностей, но и преимущества очевидны: если результат будет достигнут, заправляться придется реже.
11. Молекулярная формула перекиси водорода h3O2. Это вещество часто используется для отбеливания волос и в качестве чистящего средства. В виде медицинского раствора оно используется также для обработки ран.
12. С 1852 года — с тех самых пор, как первый дирижабль на основе водорода был создан Генри Гиффардом — водород использовался в воздухоплавании. Позднее водородные дирижабли называли «цеппелинами» (zeppelins). Их использование было прекращено после крушения дирижабля «Гинденбург» в 1937 году. Авария произошла в результате возгорания.
13. Водород широко применяется в нефтяной и химической отраслях, а также часто используется для различных физических и инженерных задач: например, в сварочном деле и в качестве охлаждающего вещества.
14. Водород потенциально опасен для человека, поскольку может возгораться при соприкосновении с воздухом. Кроме того, этот газ не годится для дыхания.
Разумеется, этим списком фактов знания о водороде не исчерпываются. Возможно вы знаете о самом простом химическом элементе что-то интересное?
hi-news.ru
Водород (Hydrogenium – воду рождающий)
Имеет 3 изотопа: протий 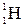 , дейтерий
, дейтерий 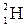 или Д и тритий
или Д и тритий 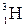 или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения.
или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения.
Свободного водорода на Земле почти нет, в атмосфере его содержание не превышает 5×10-5%. Практически весь водород находится в связанном состоянии в составе многих минералов, углей, нефти, живых и растительных организмов, но самым распространенным его соединением является вода.
Водород – s-элемент, в различных вариантах периодической системы помещают его то в I A, вместе со щелочными металлами, то в VII A вместе с галогенами, а иногда рассматривают отдельно.
Со щелочными металлами он сходен в том, что образует положительный ион Н+ и играет роль восстановителя.
Но с галогенами у него больше сходства: в гидридах активных металлов (Cah3, NaH), содержится ион Н-, подобный ионам Г- (NaCl, CaCl2). Молекулы водорода и галогенов двухатомны (Н2, Cl2, Br2). Для водорода, как и для фтора, хлора, характерны газообразное состояние и неметаллические свойства. Потенциалы ионизации водорода и галогенов близки. Атомы водорода легко замещаются атомами галогенов в органических соединениях. Поэтому некоторые авторы считают, что вариант периодической системы, где Н возглавляет VII А группу, более правилен.
Особенности водорода – единственный валентный электрон водорода находится непосредственно в зоне действия атомного ядра. Особенностями строения атома водорода обусловлено существование водородной связи.
Получение Н2
В промышленности водород получают из воды и углеводородов. При этом восстановителем водорода при температуре (600-900°С) являются атомы углерода
CO + h3O = h3 + CO2
Конверсия метана с водяным паром:
Ch5 + h3O = 3h3 + CO.
При более высокой температуре (950-1100°) можно получить разложением метана особо чистый водород и углерод.
950 – 11000C
Ch5 = 2h3 + C
В лаборатории:
1) при действии разбавленного раствора кислоты на активный металл (в аппарате Киппа):
h3SO4 + Zn = h3↑ + ZnSO4
или
2HCl + Zn = h3↑ + ZnCl2
2) щелочные металлы и щелочноземельные вытесняют водород из воды.
2Na + 2h3O = 2NaOH + h3↑
3) действием едких щелочей на металлы
0 + 0 3
2Al + 2NaOH + 6h3O = 3h3↑+ 2Na[Al(OH)4]
0 3+
Al – 3e = Al
+ -__ 0
2H + 2e = h3
или Zn + 2NaOH + 2h3O = Na2[Zn(OH)4]+h3↑
4) разложением гидридов типичных металлов водой
Cah3 + 2h3O = 2h3↑ + Ca(OH)2
5) электролизом воды (электролиз водных растворов щелочей).
Электролиз
2h3O → 2h3 + O2
Физические свойства. В обычных условиях водород – это самый легкий газ без цвета, запаха и вкуса, плохо растворим в воде.
Атомарный водород гораздо активнее молекулярного, для которого нужны дополнительные затраты энергии на распаривание электронов.
По электроотрицательности занимает промежуточное положение между неметаллами и металлами. И в реакциях с неметаллами и кислородсодержащими веществами играет роль восстановителя.
Химические свойства Н2
Водород легко соединяется с кислородом, горит на воздухе или в атмосфере чистого кислорода бледно-синим пламенем.
t
1) 2h3 + O2 = 2h3O
Если состав смеси приближается к стехиометрическому (2 объема Н2 и 1 объем кислорода), то смесь называется “гремучим газом”, т.к. реакция имеет в этом случае взрывной характер.
Водородно-кислородное пламя, имеющее температуру 2500°-2800°С используют для плавления тугоплавких металлов и автогенной сварки.
2) 3h3 + N2 ↔ 2Nh4 (при температуре 450 – 5000С и повышенном давлении, в присутствии катализатора).
t
3) CuO + h3 = Cu + h3O(при нагревании).
4) CO + 2h3 = Ch4OH (при повышении температуры и давления, в присутствии катализатора).
5) 2Na + h3 = 2NaH (с очень активными металлами водород взаимодействует непосредственно как окислитель, превращаясь в ион Н- (гидрид-ион).
3. Вода и ее свойства. Экологическое и биологическое значение Н2О
Три изотопа водорода 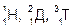 и три стабильных изотопа кислорода 16О, 17О, 18О в различных сочетаниях могут образовывать 18 изотопических разновидностей воды с молекулярными массами от 18 до 24 (Т218О). В тяжелой воде вещества растворяются хуже, растворы меньше проводят электрический ток. Она гигроскопична, жадно поглощает влагу из воздуха. Помещенные в нее без предварительной подготовки живые существа (рыбы, черви и т.п.) погибают, семена в ней не прорастают, микробы не живут. Вода имеет очень большое значение в жизни растений, животных и человека. Согласно с современными представлениями происхождение жизни связано с водной средой. Во всяком живом организме в воде протекают химические процессы, обеспечивающие жизнедеятельность организма.
и три стабильных изотопа кислорода 16О, 17О, 18О в различных сочетаниях могут образовывать 18 изотопических разновидностей воды с молекулярными массами от 18 до 24 (Т218О). В тяжелой воде вещества растворяются хуже, растворы меньше проводят электрический ток. Она гигроскопична, жадно поглощает влагу из воздуха. Помещенные в нее без предварительной подготовки живые существа (рыбы, черви и т.п.) погибают, семена в ней не прорастают, микробы не живут. Вода имеет очень большое значение в жизни растений, животных и человека. Согласно с современными представлениями происхождение жизни связано с водной средой. Во всяком живом организме в воде протекают химические процессы, обеспечивающие жизнедеятельность организма.
Физические свойства. Чистая вода бесцветная, прозрачная жидкость, без запаха и вкуса. Плотность воды при переходе из твердого состояния в жидкое не уменьшается, как у всех других веществ, а возрастает и максимальной плотностью обладает вода при 4°С, а при дальнейшем нагревании плотность ее уменьшается.
Вода обладает аномально большой теплоемкостью равной 4,18 , песок = 0,79, NaCl = 0,88 (Дж/(г×К).
Поэтому это имеет большое значение для жизни. При переходе от лета к зиме, ото дня к ночи она остывает медленно и является регулятором температуры на земном шаре.
Она имеет самую высокую температуру кипения в ряду
Н2О – Н2S – h3Se – h3Te,
Tкипения, °С 100 -60 -41 -2
Если от h3Te к Н2S температура кипения закономерно уменьшается, то при переходе от Н2S к Н2О резко увеличивается. Это объясняется наличием водородной связи между молекулами воды, вследствие кулоновского взаимодействия положительно заряженного атома водорода одной молекулы и электроотрицательным атомом кислорода другой молекулы

Такое взаимодействие затрудняет отрыв молекул друг от друга, т.е. уменьшает их летучесть, а, следовательно, повышает температуру кипения.
Молекула воды из-за sp3-гибридизации орбиталей атома кислорода имеет угловую конфигурацию, а атомы водорода, соединенные с сильно-электроотрицательным атомом кислорода, определяют ее способность к установлению четырех водородных связей с соседними молекулами.
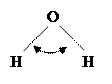
Химические свойства Н2О
Вода – очень активный реагент по следующим причинам:
а) за счет ориентационного взаимодействия с полярными молекулами других веществ;
б) существования межмолекулярных водородных связей;
в) проявления донорных свойств со стороны атома кислорода по отношению к частицам – акцепторам электронных пар;
г) электролитической диссоциации при обычных условиях (ионы Н+ гидратируются, образуя ионы гидроксония Н3О+ ).
1. При температуре выше 3000°С диссоциация водяного пара, но равновесие сдвинуто в сторону воды.
2h3O D 2h3 + O2
2. Оксиды металлов и неметаллов соединяются с водой, образуя основания и кислоты (гидрооксиды).
Cl2O7 + h3O = 2HClO4
K2O + h3O = 2KOH
3. Некоторые соли образуют с водой кристаллогидраты. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения, т.е. за счет ион -дипольного взаимодействия.
Например: кристаллогидрат сульфата натрия Na2SO4×10h3O (глауберова соль), Na2CO3×10h3O - кристаллическая сода.
Гидраты, образующиеся в результате донорно-акцепторного взаимодействия (где ионы растворенного вещества выступают обычно в качестве акцепторов, а молекулы растворителя в качестве доноров электронных пар) представляют собой частный случай комплексных соединений.
Аквакомплексы– лигaндами является вода, [Co(h3O)6]Cl2, [Al(h3O)6]Cl3, [Cr(h3O)6]Cl3 и др. Некоторые аквакомлексы в кристаллическом состоянии удерживают кристаллизационную воду [Cu(h3O)4]SO4×h3O – медный купорос.
4. Пероксид водорода. Окислительно-восстановительная двойственость Н2О2
1. Строение молекулы. Структурная формула Н–О–О–Н. Энергия связи О-О (210 кДж/моль) почти в 2 раза меньше энергии связи О–Н (468 кДж/моль). Из-за несимметричного распределения связей Н–О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150°С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение (σ) больше, чем у Н2О.
В молекуле Н2О2 связи между атомами кислорода и водорода полярны (вследствие смещения общих электронных пар к кислороду). В водных растворах – это слабая кислота, хоть и в незначительной степени распадается на ионы: _
h3O2 «H+ + HO-2 I ступень К1 = 2,6×10-12.
HO-2 « H+ + O2-2 II ступень практически не протекает, т.к. подавляется диссоциацией Н2О, которая протекает в большей степени, чем Н2О2. Сместить диссоциацию по 2-й ступени можно введением щелочи.
2. С некоторыми основаниями Н2О2 взаимодействует, непосредственно образуя соли, что подтверждает его кислотные свойства.
Ba(OH)2 + h3O2 = BaO2 + 2h3O
Соль пероксида водорода
3. В отличие от воды пероксид водорода – непрочное соединение, разлагается даже при комнатной температуре (диспропорционирует на свету)
Н2О2+ Н2О2= О2+ 2Н2О
Н2О2 = Н2О+ О
Неустойчивость Н2О2 обусловлена непрочностью связи О - О.
Атомы кислорода в молекуле Н2О2 связаны непосредственно друг с другом неполярной ковалентной связью. Связи О–Н полярны. Поэтому молекула Н2О2 также полярна.
Пероксиды относят к классу солей. Как соли они могут вступать в реакцию обмена с кислотами:
ВаО2 + Н2SO4 = BaSO4¯ + h3O2
в отличие от оксидов
SnO2 + 2h3SO4 = Sn(SO4)2 + 2h3O
Этой реакцией пользуются для различия оксидов и пероксидов.

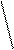 Н 0.95 А0 = 0,095нм
Н 0.95 А0 = 0,095нм
1,48 А0 = 0,148нм
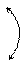
 О О
О О
95°
Н
ЕО-О = 210 кДж/моль ЕО-Н = 468 Дж/моль
Молекула нелинейна, две связи О–Н расположены не симметрично, а в 2-х плоскостях под углом 120°. Поэтому полярность mН2О2 > mН2О.
4. Окислительно-восстановительная двойственность Н2О2
Н2О2 + 2КI = I2 + 2KOH
Окислитель восстановитель
Н2О2 + Ag2O = 2Ag + O2 + h3O
Восстановитель окислитель
5h3O2 + 2KMnO4 + 3h3SO4 → 5O2 + 2MnSO4 + K2SO4 + 8h3O
h3O2 + 2KI + h3SO4 → 2h3O + I2 + K2SO4
Na2O2 и K2O2 – используют для регенерации кислорода в подводных лодках и в изолирующих противогазах.
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Наличие атомарного кислорода сообщает Н2О2 и Na2O2 сильные окислительные свойства. Na2O2 способен гидролизоваться с образованием h3O2 по реакции
Na2O2 + 2h3O = 2NaOH + h3O2
В связи с этим они находят применение для отбеливания шерсти, шелка, мехов.
Аптечная перекись водорода – 3% водный раствор Н2О2, применяется как дезинфицирующее средство, (30% раствор называется пергидроль).
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
zdamsam.ru




















