4.Определение микробного числа воздуха. Омч воды
Определение ОМЧ глубинным методом.
Методика.Водопроводную воду засевают в объеме 1 мл, воду открытых водоемов – в объемах 1,0; 0,1; 0,01 мл. Все пробы вносят в стерильные чашки Петри, после чего их заливают 10-12 мл расплавленным и остуженным до 45-500 С питательным агаром, который тщательно перемешивают с водой. Посевы инкубируют при 370 С в течение 24-48 ч. Воду из открытых водоемов засевают параллельно на две серии чашек, одну из которых инкубируют при 370 С в течение суток, а другую – 2 суток при
200 С. Затем подсчитывают количество выросших на поверхности и в глубине среды колоний и высчитывают ОМЧ.
Определение БГКП
Метод мембранных фильтров
Для определения БГКП этим методом используют фильтровальный аппарат Зейтца, который перед началом исследований протирают тампоном, смоченным в спирте, стерилизуют прокаливанием и устанавливают на колбе Бунзена.
Затем в прибор помещают нитрацеллюлозный или ацетатцеллюлозный мембранный фильтр с диаметром пор не более 0,45 мкм. Такие фильтры предварительно стерилизуют методом кипячения. Выбранный для исследования объем воды пропускают через фильтр, присоединяя аппарат к вакуумному насосу. Если анализируют несколько проб воды, то для каждой из них используют отдельный мембранный фильтр. Перед фильтрованием новой пробы аппарат стерилизуют. После пропускания через них воды фильтры помещают на поверхность среды Эндо в чашки Петри, располагая их на питательной среде фильтрующей стороной вверх. Чашки затем инкубируют в термостате 24 ч при 37ºС . В состав среды Эндо входят лактоза, индикатор и МПА и поэтому БГКП образуют на ней колонии красного цвета с металлическим отливом. Подсчитывают количество таких колоний, готовят из них мазки и окрашивают по Граму, а также проверяют оксидазную активность. Оксидазоотрицательные бактерии, разлагающие лактозу до кислоты и газа, обнаруженные на фильтре, позволяют дать положительный ответ о наличие в воде БГКП. При анализе питьевой воды вычисляют количество БГКП, содержащихся в 100 мл.
Для дифференциации ОКБ (общих колиформных бактерий) и ТКБ (термотолерантных колиформных бактерий) каждую выросшую на фильтре колонию БГКП засевают в две пробирки с лактозной средой. Одну из пробирок предварительно прогревают до 44ºС с тем, чтобы инактивировать ОКБ. Затем эту пробирку инкубируют при этой же температуре в течение 24 ч (для подтверждения наличия ТКБ). Вторую пробирку с посевом ставят в термостат при температуре 37ºС на 48 ч, чтобы убедиться в наличии ОКБ.
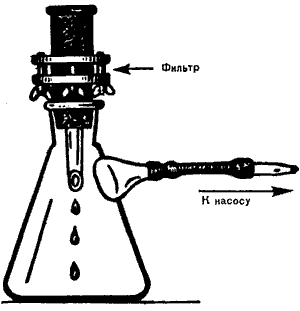
Колба Бунзена
Рис. 4. Фильтр Зейтца и колба Бунзена для фильтрации воды
Бродильный (титрационный) метод
Этот метод известен также под названием: «двухфазный бродильный метод». Для установления содержания колиформных бактерий в воде, исследуемые пробы засевают в глюкозо-пептонную среду (ГПС) для подращивания микроорганизмов. Объемы воды при этом определяются в зависимости от водоисточника и предполагаемой степени его загрязненности.
1 этаписследования. (1 фаза) Исходный объем воды делят на несколько порций, которые засевают в различные объемы питательной среды. Например, посев воды с исходным объемом 300 мл производят следующим образом: два объема по 100 мл засевают в два флакона с 10 мл питательной среды, а 10 объемов по 10 мл той же пробы воды засевают в 10 пробирок, содержащих по 1 мл питательной среды. Посевы инкубируют в термостате при 43ºС в течение 7 -12 ч. Указанная температура подавляет рост сапрофитных микроорганизмов, но не влияет на колиформные бактерии.
На 2 этапе (2 фаза) из флаконов и пробирок, при наличии в них признаков роста (помутнение, газообразование) делают высевы петлей на чашки Петри со средой Эндо, разделенной на 3-4 сектора, и помещают их в термостат при 37ºС на 18-20ч для того, чтобы получить рост изолированных колоний. Емкости с посевами воды в среде ГПС, на которых через 7-12 ч не было признаков роста, оставляют в термостате еще на 24 - 48 ч. Отсутствие роста в них через 48 ч свидетельствует об отсутствии в воде БГКП. При просмотре посевов на среде Эндо обращают внимание на колонии красного, розового, бледно-розового цвета с металлическим блеском. Делают из них мазки, окрашивают по Граму и проверяют оксидазную активность, позволяющую дифференцировать ОКБ от других грамотрицательных бактерий. Наличие грамотрицательных, оксидазоотрицательных палочек свидетельствует о наличие в воде БГКП. Для определения термотолерантных колиформных бактерий по 2-3 лактозоположительные колонии из каждого сектора со среды Эндо засевают в пробирки с любой средой, содержащей лактозу, предварительно нагретой до 44ºС и помещают в термостат на 24 ч при той же температуре. Образование в пробирках кислоты и газа свидетельствует о том, что в исследуемой пробе присутствуют термотолерантные колиформные бактерии (ТКБ). Это позволяет сделать вывод о свежем фекальном загрязнении воды.
К работе № 3
Микрофлора почвы
Состав микрофлоры определяется климатическими, почвенно-географическими условиями и зависит от комплекса факторов – содержания источников питания, влажности, рН, аэрации, структуры почвы, способов обработки, взаимоотношений между микроорганизмами и др.
Основную массу почвенных микроорганизмов составляют сапрофитные и лишь незначительное количество приходится на долю патогенных видов.
Санитарно-микробиологическое состояние почвы оценивается на основании наличия бактерий - показателей фекального загрязнения. Почвы, с преобладанием санитарно-показательных бактерий, расцениваются как санитарно-неблагополучные, загрязненными фекалиями человека или животных. Присутствие в почве бактерий группы кишечной палочки (БГКП или колиформных) и энтерококков (разновидность Streptococcus faecalis) указывает на свежее фекальное загрязнение. Наличие бактерий родов Citrobacter и Enterobacter - на несвежее, a Clostridium perfringens - на давнее фекальное загрязнение. Более точная оценка проводится с помощью определения индекса БГКП - количество бактерий группы кишечной палочки (БГКП), обнаруженных в 1 г почвы, перфрингенс-титра - масса почвы (в граммах), в которой обнаружена 1 особь Clostridium perfringens, общей численности сапрофитных, термофильных и нитрифицирующих бактерий (ОМЧ) в 1 г почвы.
Патогенные микроорганизмы выявляют в объектах внешней среды чаще всего для того, чтобы оценить эпидемиологическую ситуацию и принять необходимые меры для ликвидации источников инфекции. В зонах активного земледелия почву исследуют на содержание в ней спор возбудителей столбняка, чтобы провести своевременно профилактику лиц, работающих в земледелии.
Нормативы: чистая почва: коли-титр - 1 и выше; перфрингенс-титр - 0,001 и выше; ОМЧ- 100-1000.
Загрязненная почва: коли-титр - 0,9 - 0,01; перфрингенс-титр - 0,009-0,0001; ОМЧ-1000-100000.
Сильно загрязненная почва: коли-титр - 0,0009 и ниже; перфрингенс-титр -0,00009 и ниже; ОМЧ - 1000000-4000000.
stydopedia.ru
1. Определение общего количества микроорганизмов в воде
Общее микробное число воды определяют путем культивирования содержащихся в пробах бактерий в плотных питательных средах. В зависимости от предполагаемой загрязненности водоема перед посевом готовят десятикратные разведения исходной пробы в стерильной водопроводной воде. В таблице № 2 приведены рекомендуемые для посева разведения воды в зависимости от степени ее загрязненности (объем каждого разведения для дальнейшего посева в МПА составляет 1 мл).
Таблица 2 - Рекомендуемые для посева разведения воды в зависимости от степени ее загрязненности при определении
Общего микробного числа (объем каждого разведения для посева составляет 1 мл)
| Тип исследуемой воды | Рекомендуемые для посева разведения воды |
| Водопроводная вода и вода артезианских колодцев | 1мл исходной воды без разведения |
| Чистая вода (вода колодцев, родников и др., вода плавательных бассейнов) | 1 и 1:10 |
| Открытые водоемы, не загрязненные сточными водами | 1; 1:10 и 1:100 |
| Чистые водоемы в местах массового купания | 1:10 и 1:100 |
| Открытые водоемы, загрязненные сточными водами | 1:10; 1:100 и 1:1000 |
| Сильно загрязненные хозяйственно-бытовые воды и сточные жидкости | 1:10000; 1:10 0000 и 1:100 000 |
Для получения разведений берут ряд пробирок, содержащих по 9 мл стерильной водопроводной воды. Исследуемую воду в объеме 1 мл вносят в первую пробирку, получают разведение 1:10, затем из этой пробирки переносят 1 мл в следующую и т.д. (см. рис.1). Для приготовления каждого разведения используют новую стерильную пипетку. Из полученных разведений вносят по 1 мл воды в 2 чашки Петри и заливают 15-20 мл расплавленного и охлажденного до 45ºС МПА. Содержимое чашек тщательно перемешивают круговыми движениями, перемещая их по поверхности стола. После застывания агара, чашки помещают в термостат на 24 ч при температуре 37ºС. Колонии бактерий растут, как на поверхности питательной среды (аэробы), так и в ее глубине (анаэробы). Подсчитывают их суммарное количество и вычисляют общее микробное число. Если воду предварительно разводили, то полученную сумму умножают на степень разведения и в итоге получают количество микроорганизмов в 1 мл исходной воды.
Общее микробное число в 1 мл питьевой воды не должно превышать 50.
2. Определение бактерий группы кишечной палочки (бкгб)
Санитарно-показательными микроорганизмами в воде, также как и в почве, являются бактерии группы кишечной палочки (БГКП). Они также называются колиформными (от лат. Escherihia coli - кишечная палочка.) Эта группа объединяет факультативно анаэробных представителей семейства Enterobacteriaceae. Все они имеют палочковидную форму, не образуют спор, грамотрицательные, оксидазоотрицательные, разлагают лактозу до кислоты и газа. Следует обратить внимание на температуру, при которой наиболее активно проявляются сахаролитические свойства колиформных бактерий. Большинство из них сбраживает лактозу через 24-48 ч при температуре 37ºС. Такие бактерии относят к общим колиформным бактериям (ОКБ).
Отличительной особенностью термотолерантных колиформных бактерий (ТКБ) является то, что они разлагают лактозу до кислоты и газа при более высокой температуре - 44ºС в течение более короткого времени – за 24 ч. Обнаружение термотолерантных колиформных бактерий (ТКБ) указывает на свежее фекальное загрязнение воды. Бактерии группы кишечной палочки выявляются различными методами. Наиболее распространенным является метод мембранных фильтров.
studfiles.net
4.Определение микробного числа воздуха
Методы микробиологического исследования воздуха подразделяют на седиментационные и аспирационные. Наиболее простым является седиментационный метод Коха: стерильные чашки Петри с плотной питательной средой открывают в местах отбора проб воздуха и выдерживают в течение определенного времени (5-30 мин), после чего закрывают и термостатируют.
По количеству выросших колоний подсчитывают микробное число воздуха, пользуясь правилом Омелянского, в соответствии с которым считают, что на поверхность питательной среды площадью 100 см2 в течение 5 мин оседает столько микроорганизмов, сколько их содержится в 10 л воздуха. Каждая микробная клетка дает начало одной колонии. Зная количество выросших колоний и время экспозиции, вычисляют количество микробов, содержащихся в 1 м3(1000 л) воздуха.
Для определения микробной загрязненности воздуха расплавляют на водяной бане стерильные среды МПА и СА и разливают каждую в 3 стерильные чашки Петри (всего 6 чашек). Чашки ставят в месте отбора проб и открывают на 5, 10 и 15 мин. Время выдержки отмечают на крышке чашки.
Затем чашки с МПА термостатируют при 37° С 48 ч, а с СА - при 24° С 6-7 суток, перевернув их вверх дном. Подсчет колоний ведут на следующем занятии.
5. Определение микробного числа воды
Микробное число воды - это общее количество микроорганизмов, содержащееся в 1 мл воды. Для санитарно-микробиологического исследования водопроводной воды пробы берут из уличных водоразборов и кранов внутренних водопроводов. Краны обжигают, затем полностью открывают и спускают воду 10 мин., а затем отбирают пробы воды с соблюдением требований асептики, не смачивая пробки, в количестве не менее 0,5 л. Если вода подвергалась хлорированию, то ее собирают в колбы, содержащие 2 мл 1,5%-ого стерильного раствора тиосульфата натрия. При посеве в агаризованную среду 1 мл воды вносят в пустую стерильную чашку Петри, куда затем наливают 10-12 мл расплавленного МПА (45° С) и тщательно перемешивают. После застывания агара посевы инкубируют при 37° С 24 ч. Из одной пробы воды засевают 3 параллельных чашки и не только на МПА, но и на сусло - агар для выявления роста дрожжей и грибов, в этом случае посевы инкубируют 2-З суток при температуре 24° С.
6. Определение микробной загрязненности предметов обихода и рук
Для анализа микробной загрязненности столов, оборудования, полотенец, халатов, рук персонала используют тампонный метод. Для этого готовят ватные тампоны, стерилизуют их, погружают в пробирки с 2 мл стерильной воды или изотонического раствора хлорида натрия, при этом тампон не должен касаться поверхности жидкости, смачивают тампон непосредственно перед взятием проб. Для отбора проб с плоских крупных поверхностей (столы) используют трафареты из проволоки или жести, которые предварительно стерилизуют фламбированием; затем накладывают их на поверхность стола, производят смыв влажным тампоном (салфеткой) с поверхности 100 см2, ограниченной трафаретом; тампон помещают в пробирку, добавляют еще 8 мл жидкости и тщательно прополаскивают тампон (салфетку) с последующим отжимом его.
Общую микробную загрязненность определяют, засевая 1 мл смыва, в глубину расплавленного МПА в чашке Петри, как это описано для определения микробного числа воды. Посевы выращивают сутки при 37° С, подсчитывают количество выросших колоний и определяют общую микробную загрязненность данного объекта. Для выявления дрожжей и грибов делают посев на сусло-агар.
Смывы с рук получают, тщательно протирая ладони, межпальцевые и подногтевые пространства влажным стерильным тампоном на деревянной пилочке. Тампон погружают в ту же пробирку, в которой он смачивался, добавляют еще 8 мл стерильной воды. Смывы с поверхности предметов содержатся в 10 мл стерильной воды (2 мл для увлажнения салфетки, 8 мл доливают к смывам), поэтому исходный смыв уже разведен 1:10. Для приготовления разведения 1:100 1 мл исходного смыва (1:10) помещают в пробирку и доливают к нему 9 мл стерильной водопроводной воды. Берут две стерильные чашки Петри, нумеруют их со стороны дна (№ 1 и 2). В первую чашку вносят 1 мл исходного разведения смыва (1:10), во вторую - 1 мл разведения 1:100. Заливают в каждую чашку 15-30 мл расплавленного и охлажденного до 35° С МПА. После застывания агара посев термостатируют при 37° С сутки. Параллельно ведут посев на 2 чашки со стерильным СА. Этот посев выдерживают при 24° С 4- 5 суток.
В отчете по данной работе указать классификацию и способы стерилизации питательных сред, этапы подготовки микробиологических материалов для количественного учета чашечным методом, схему подготовки разведении и посева, описать конкретную задачу.
Вопросы для самоконтроля
Что называется чистой культурой микроорганизмов?
Каково назначение чистых культур микроорганизмов?
Как выделяют чистые культуры по методу Коха?
Как выделяют чистые культуры по методу Дригальского?
Какие счетные камеры вам известны?
Что из себя представляет счетная камера Горяева?
Из каких этапов складывается процесс изготовления исследуемого препарата для проведения количественного учета с помощью счетных камер?
Каковы размеры бактериальных клеток?
Способы измерения микроорганизмов.
Как определить цену окуляр-микрометра?
studfiles.net