Оксид азота: формула, свойства, применение. N2O5 вода
18. Окисли азота.
С кислородом азот образует ряд оксидов:
Несолеобразующие Солеобразующие
оксиды: оксиды:
N2O- оксид азота (I) N2O3- оксид азота (III)
NO- оксид азота (II)NO2– оксид азота (IV)
N2O4– димер оксида азота (IV)
N2O5 - оксид азота (V)
Все оксида азота, кроме N2O, ядовитые вещества!
Оксид азота (I) N2O – закись азота, «веселящий газ», обладает наркотическим действием. Это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворим в воде, но не взаимодействует с ней. Это эндотермическое соединение. Однако при комнатной температуре химически мало активен. Но при нагревании его реакционная способность сильно возрастает. Он окисляет водород, металлы ,фосфор, серу, уголь, органические и другие вещества, например:
Cu+N2O→N2+CuO
При достаточно высокой температуре разлагается:
2N2O→ 2N2+O2 + 39 ккал
При нагревании N2Oвыше 700 °Cодновременно с реакцией разложения протекает его диспропорционирование:
2N2O→ 2NO+N2
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится как иN2Oк несолеобразующим оксидам. Оксид азота (II) образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
N2+O2→ 2NO
В лаборатории оксид азота (II) чаще всего получают действием разбавленной азотной кислоты на медные стружки:
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4h3O
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
4Nh4+ 5O2→ 4NO+ 6h3O
На воздухе оксид азота (II) мгновенно окисляется:
2NO+O2 → 2NO2
Окисляется NOи галогенами, образуя нитрозилгалогениды:
2NO+ Г2→ 2NOГ
При взаимодействии с восстановителями NOвосстанавливается доN2O,N2,Nh3OH,Nh4в зависимости от восстановительной способности партнера и условий проведения процессов. Водный растворNOнейтрален. Никаких соединений с водой не образует.
Оксид азота (III) N2O3 –существует в твердом состоянии (ниже -100 °C). В жидком и парообразном состояниях в значительной степени диссоциирован за счет диспропорционирования:
N2O3⇄NO+NO2
Получают N2O3охлаждением эквимолярных количествNOиNO2 . А равномерный ток смеси нужного состава получается при взаимодействии 50%-ной азотной кислоты с оксидом мышьяка (III):
2HNO3+As2O3→ 2HAsO3+NO2
Является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:
N2O3+h3O→ 2HNO2
Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствует две кислоты: азотистаяHNO2и азотнаяHNO3. Поэтому взаимодействие с водой происходит по уравнению:
2NO2+h3O→HNO2+HNO3
При взаимодействии NO2с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
4NO2+O2+ 2h3O⇄4HNO3
При растворении NO2 в щелочи, напримерNaOH, образуются две соли (нитрат и нитрит) и вода:
2NO2+ 2NaOH→NaNO2+NaNO3+h3O
В избытке кислорода образуется только нитрат натрия:
4NO2+ 4NaOH+O2→ 4NaNO3+ 2h3O
Он является хорошим окислителем, в нем горят фосфор, сера, уголь и некоторые органические вещества. Выше 150 °Cдиоксид азота начинает разлагаться:
2NO2→ 2NO+O2
Ниже 22 °Cмолекулы оксида азота (IV)NO2 легко соединяются попарно и образуют бесцветную жидкость составаN2O4, которая при охлаждении до -10,2 °Cпревращается в бесцветные кристаллы.
В лаборатории NO2можно получить при взаимодействии меди с концентрированной азотной кислотой:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2h3O
В промышленности NO2получают путем окисленияNOкислородом и далее используют для получения азотной кислоты.
Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворяющиеся в воде с образованием азотной кислоты:
N2O5+h3O→ 2HNO3
Является энергичным окислителем, многие реакции с его участием протекают весьма бурно. Получают оксид азота (V) дегидратацией азотной кислоты с помощьюP2O5 или окислениемNO2озоном:
2HNO3 + P2O5 → 2HPO3 + N2O5 6NO2 + O3 → 3N2O5
studfiles.net
Оксиды азота. Азотная кислота и ее соли
 Сегодня урок химии 19 — Оксиды азота. Азотная кислота и ее соли
Сегодня урок химии 19 — Оксиды азота. Азотная кислота и ее соли
Известны несколько оксидов азота. Несолеобразующие и солеобразующие. Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O — это бесцветный газ, со слабым запахом и сладким вкусом, растворим в воде, но не взаимодействует с ней. При высокой температуре разлагается. В смеси с кислородом N2O используется для наркоза «веселящий газ».
Оксид азота (II) NO – бесцветный газ, без запаха. Относится к несолеобразующим оксидам, в воде мало растворим. Оксид азота(II) NO на воздухе легко окисляется до оксида азота (IV).
Получение.
1. Этот оксид образуется из азота и кислорода при сильных электрических разрядах (во время грозы).
N2+ O2 → 2NO
2. В лаборатории оксид азота (II) получают при взаимодействии меди и разбавленной азотной кислоты:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2 NO↑ + 4h3O
3. Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
4Nh4 + 5O2 → 4NO + 6h3O
Оксид азота(IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах.
Получение.
1. В лаборатории NO2 можно получить при взаимодействии меди с концентрированной азотной кислотой:
Cu + 4HNO3(конц) → Cu (NO3)2 + 2NO2↑ + 2h3O.
2. В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:
N2O3 + h3O → 2HNO2.
Оксид азота (V) N2O5 — бесцветные кристаллы, хорошо растворяющиеся в воде с образованием азотной кислоты:
N2O5 +h3O → 2HNO3.
Азотная кислота и ее соли. Чистая HNO3 бесцветная жидкость, на воздухе «дымит», смешивается с водой. На свету частично разлагается, приобретая бурую окраску.
Получение.
1. В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
Ba (NO3)2 + h3SO4 → BaSO4↓ + 2HNO3.
2. В промышленности получение азотной кислоты идет в три стадии:
1. Окисление аммиака до оксида азота (II):
4Nh4 + 5O2 → 4NO + 6 h3O
2. Окисление оксида азота (II) в оксид азота (IV):
2NO + O2 → 2NO2
3. Растворение оксида азота (IV) в воде с избытком кислорода:
4NO2 + 2h3O + O2 → 4HNO3
Химические свойства. Проявляет все свойства кислот. Азотная кислота одна из наиболее сильных минеральных кислот.
1. В водных растворах она полностью диссоциирована на ионы:
HNO3 → H+ + NO—3
2. Реагирует с оксидами металлов:
MgO + 2HNO3 → Mg(NO3)2 + h3O,
3. Реагирует с основаниями:
Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2h3O,
4. КонцентрированнаяHNO3 при взаимодействии с наиболее активными металлами до Al восстанавливается до N2О. Например:
4Ca + 10HNO3 → 4Ca(NO3)2 + N2O↑+ 5h3O
5. Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
4HNO3 + Ni → Ni(NO3)2 + 2NO2↑ + 2h3O.
6. Аналогично концентрированная HNO3 реагирует с неметаллами. Неметалл при этом окисляется. Например:
5HNO3 +Pо → HP+5O3 + 5NO2↑+ 2h3O.
Cоли азотной кислоты – нитраты при нагревании разлагаются по схеме:
левее Mg: MeNO3 → MeNO2 + O2
Mg – Cu: MeNO3 → MeO + NO2↑ + O2↑
правее Сu MeNO3 → Me + NO2↑ +O2↑
Применение.
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Это был — урок химии 19 — Оксиды азота. Азотная кислота и ее соли
Расскажите об этой статье друзьям:
Friend me:
к нашему сайту.
sovety-tut.ru
Оксид азота (I, II, III, IV, V): свойства, получение, применение
Введение
Если внимательно взглянуть на азот в периодической системе химических элементов Д. И. Менделеева, то можно заметить, что он имеет переменную валентность. Это значит, что азот образует сразу несколько бинарных соединений с кислородом. Некоторые из них были открыты недавно, а некоторые - изучены вдоль и поперек. Существуют малостабильные и устойчивые оксиды азота. Химические свойства каждого из этих веществ совершенно разные, поэтому при их изучении нужно рассматривать как минимум пять оксидов азота. Вот о них и пойдет речь в сегодняшней статье.
Оксид азота (I)
 Формула - N2O. Иногда его могут называть оксонитридом азота, оксидом диазота, закисью азота или веселящим газом.
Формула - N2O. Иногда его могут называть оксонитридом азота, оксидом диазота, закисью азота или веселящим газом.
Свойства
В обычных условиях представлен бесцветным газом, имеющим сладковатый запах. Его могут растворять вода, этанол, эфир и серная кислота. Если газобразный оксид одновалентного азота нагреть до комнатной температуры под давлением 40 атмосфер, то он сгущается до бесцветной жидкости. Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.
Получение
Этот оксид образуется, когда нагревают сухой нитрат аммония. Другой способ его получения - термическое разложение смеси "сульфаминовая + азотная кислота".
Применение
Используется в качестве средства для ингаляционного наркоза, пищевая промышленность знает этот оксид как добавку E942. С его помощью также улучшают технические характеристики двигателей внутреннего сгорания.
Оксид азота (II)
 Формула - NO. Встречается под названиями монооксида азота, окиси азота и нитрозил-радикала
Формула - NO. Встречается под названиями монооксида азота, окиси азота и нитрозил-радикала
Свойства
При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижить, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха
Получение
Его довольно просто получить, для этого нужно нагреть до 1200-1300оС смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольким опытах:
- Реакция меди и 30%-ного раствора азотной кислоты.
- Взаимодействие хлорида железа, нитрита натрия и соляной кислоты.
- Реакция азотистой и иодоводородной кислот.
Применение
Это одно из веществ, из которых получают азотную кислоту.
Оксид азота (III)
 Формула - N2O3. Также его могут называть азотистым ангидридом и сесквиоксидом азота.
Формула - N2O3. Также его могут называть азотистым ангидридом и сесквиоксидом азота.
Свойства
В нормальных условиях является жидкостью, которая имеет синий цвет, а в стандартных - бесцветным газом. Чистый оксид существует только в твердом агрегатном состоянии.
Получение
Образуется при взаимодействии 50%-ной азотной кислоты и твердого оксида трехвалентного мышьяка (его также можно заменить крахмалом).
Применение
С помощью этого вещества в лабораториях получают азотистую кислоту и ее соли.
Оксид азота (IV)
 Формула - NO2. Также его могут называть диоксидом азота или бурым газом.
Формула - NO2. Также его могут называть диоксидом азота или бурым газом.
Свойства
Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность.
Получение
Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца.
Применение
С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.
Оксид азота (V)
 Формула - N2O5. Может встречаться под названиями пентаоксида диазота, нитрата нитроила или азотного ангидрида.
Формула - N2O5. Может встречаться под названиями пентаоксида диазота, нитрата нитроила или азотного ангидрида.
Свойства
Имеет вид бецветных и очень летучих кристаллов. Они могут плавиться при температуре 32,3оС.
Получение
Этот оксид образуется при нескольких реакциях:
- Дегидрация азотной кислоты оксидом пятивалентного фосфора.
- Пропускание сухого хлора над нитратом серебра.
- Взаимодействие озона с оксидом четырехвалентного азота.
Применение
Из-за своей крайней неустойчивости в чистом виде нигде не используется.
Заключение
В химии существует девять оксидов азота, приведенные выше являются только классическими соединениями этого элемента. Остальные четыре - это, как уже было сказано, нестабильные вещества. Однако их все объединяет одно свойство - высокая токсичность. Выбросы оксидов азота в атмосферу приводят к ухудшению состояния здоровья живущих поблизости от промышленных химических предприятий людей. Симптомы отравления каким-либо из этих веществ - токсический отек легких, нарушение работы центральной нервной системы и поражение крови, причина которого - связывание гемоглобина. Поэтому с оксидами азота необходимо осторожно обращаться и в большинстве случаев использовать средства защиты.
fb.ru
формула, свойства, применение :: SYL.ru
Оксидами называют бинарные соединения химических элементов с кислородным атомом, у которого окислительная степень равна 2-. Азот, обладающий меньшим электроотрицательным значением, образует различные комбинации с кислородом. Эти соединения относятся к разным классам веществ. Оксид азота кислород содержит в количестве, которое устанавливает валентность элемента N. Она колеблется от 1 до 5.
Какие бывают оксиды
Существует около десятка азотистых соединений, содержащих O-элемент. Из них пять наиболее часто встречаемых: оксид одновалентного, оксид двухвалентного, оксид трехвалентного, оксид четырехвалентного и оксид пятивалентного азота.
Остальные соединения считаются менее распространенными. К ним относят оксид азота четырехвалентного в форме димера, нестабильные молекулы нитрилазида, нитрозилазида, тринитрамида и нитратный радикал.
Формулы оксидов азота
Ниже приведены обозначения наиболее значимых соединений элемента N.
Это прежде всего оксид азота, формула которого состоит из двух химических знаков - N и O. За ними ставятся индексы, в зависимости от степени окисления атомов.
- Азота одновалентного оксид имеет формулу N2O. В нем атом N заряжен +1.
- Азота двухвалентного оксид имеет формулу NO. В нем атом N заряжен +2.
- Азота трехвалентного оксид имеет формулу N2O3. В нем атом N заряжен +3.
- Четырехвалентный оксид азота, формула которого NO2, имеет заряд атома N +4.
- Пятивалентное кислородное соединение обозначается как N2O5. В нем атом N заряжен +5.
Описание одновалентного оксида азота
Он еще именуется диазотом, закисью и газом веселящим. Последнее название произошло от действия, связанного с опьянением.
Оксид азота с валентностью I в условиях нормальной температуры существует в форме негорючего газа, без цвета, который проявляет приятный сладковатый привкус и запах. Воздух легче данного соединения. Оксид растворяется в водной среде, этаноле, эфирах и кислоте серной.
Вода, щелочные и кислотные растворы не способны с ним вступать в реакцию, он не образует соли. Не подвергается воспламенению, зато способен поддержать процесс горения.
Аммиак оксид азота переводит в азид (N3Nh5).
При соединении с молекулами эфиров, хлорэтана и циклопропана образуется взрывоопасная смесь.
Обычные условия способствуют его инертности. Под действием нагревания вещество восстанавливается.
Описание оксида двухвалентного азота
Его еще называют моноокисью, окисью или нитрозил-радикалом. В условиях нормальной температуры является бесцветным негорючим газом, слаборастворимым в водной среде. Воздухом окисляется, получается NO2. Жидкая и твёрдая его форма становятся голубого цвета.
Оксид азота может быть восстановителем в реакциях взаимодействия с галогенами. Продуктом их присоединения является нитрозилгалогенид, который имеет формулу NOBr.
Диоксид серы и другие сильные восстановители окисляют NO с получением молекул N2.
Описание оксида трехвалентного азота
Они именуется ангидридом азотистым. В нормальном состоянии может быть жидкостью, с синей окраской, а стандартные параметры среды переводят оксид в форму газа, не имеющего цвета. Обладает устойчивостью только при низких температурах.
Молекулы N2O3 диссоциируют во время нагревания с выделением одно- и двухвалентного оксида.
В качестве ангидрида присоединяет воду с получением кислоты азотистой, а со щелочами формирует соли в виде нитритов.
Описание оксида четырехвалентного азота
По-другому его называют диоксидом. Существует в форме буро-красного газа, у которого имеется острый запах, а также может быть желтоватой жидкостью.
Относится к кислотным оксидам, у которых развита хорошо химическая активность.
Его молекулы окисляют неметаллы с образованием кислородсодержащих соединений и свободного азота.
Диоксид взаимодействует с оксидом четырехвалентной и шестивалентной серы. Получается кислота серная. Метод ее синтеза называют нитрозным.
В водной среде можно растворить оксид азота. Азотная кислота является результатом данной реакции. Такой процесс называют диспропорционированием. Промежуточным компонентом считается кислота азотистая, которая быстро распадается.
Если растворить азота четырехвалентного оксид в щелочи, то происходит образование растворов нитратов и нитритов. Можно использовать его жидкую форму для взаимодействия с металлом, тогда получится безводная соль.
Описание оксида пятивалентного азота
Его также называют диазотным пентаоксидом, нитратом нитрония, нитриловым нитратом или азотным ангидридом.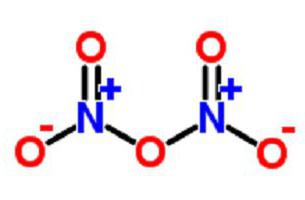
Существует в форме бесцветных кристаллов, которые обладают летучестью и неустойчивостью. Их стабильность наблюдается при низкой температуре. Такую структуру образуют нитрат- и нитрит-ионы.
В газообразном виде вещество имеет форму ангидрида NO2−O−NO2.
Оксид азота пятивалентный обладает свойствами кислотными. Он легко разлагается с выделением кислорода.
Вещество реагирует с водой, в результате получается азотная кислота.
Щелочи растворяют ангидрид с выделением солей нитратов.
Как получают оксиды азота
Закись N2O образуется при острожном нагревании аммония нитрата в сухом виде, однако такой способ может сопровождаться взрывом.
Предпочтительным методом получения оксида одновалентного является воздействие кислотой азотной в концентрированном виде на кислоту сульфаминовую. Главным условием считается нагревание.
Нитрозил, или NO, – это особый оксид азота, получение которого осуществляется при взаимодействии молекул N2 иO2. Важным условием такого процесса является сильное нагревание свыше 1000 °C.
Природный способ получения связан с грозовыми разрядами в атмосферном воздухе. Такой оксид быстро соединяется с кислородными молекулами и формируется диоксид.
Лабораторный метод синтеза NO связан с реакцией металлов и неконцентрированной кислоты азотной. Примером такой реакции может быть взаимодействие меди с HNO3.
Другой способ образования моноокиси азота - реакция хлорида железа двухвалентного с натрия нитритом и кислотой соляной. Результатом процесса являются железа трехвалентного и натрия хлориды, вода и сама окись.
В промышленных масштабах его добывают за счет окисления аммиачных молекул во время нагревания и под высоким давлением. Ускорителем процесса является платина или хрома трехвалентного оксид.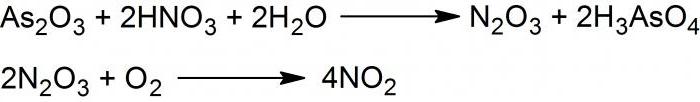
Диоксид, или NO2, получается при взаимодействии мышьяка трехвалентного оксида с 50 % кислотой азотной, которую наносят по каплям на поверхность твердого реагента. Образуется смесь из оксидов двухвалентного и четырехвалентного азота.
Если ее охладить до температуры -30 °С, то синтезируется ангидрид азотистый, или N2O3.
В порошкообразном виде он получается в случае пропускания тока электрического сквозь газообразную его форму.
Если на крахмальный порошок подействовать кислотой азотной с концентрацией 50 %, то выделяется оксид двухвалентного и четырехвалентного азота, газ углекислый и вода. В дальнейшем из полученных первых двух соединений формируется молекула N2O3.
В результате теплового расщепления свинцового нитросоединения выделяется диоксид азота, свободный кислород и оксид свинца.
Ангидрид, или N2O5, образуется благодаря отщеплению молекулы воды от кислоты азотной действием фосфора оксида пятивалентного.
Другой способ его синтеза является пропускание сухого хлора сквозь безводный серебряный нитрат.
Если на диоксид азотный подействовать молекулами озона, то формируется N2O5.
www.syl.ru


















