Большая Энциклопедия Нефти и Газа. Метанол вода
Метанол
| Министерство науки и образования Рф ПСКОВСКИЙ ГОСУДАРСТВЕННЫЙ университет Кафедра техносферная безопасность |
| Первичный токсиколого-гигиенический паспорт на Метанол |
Выполнил студент: Медведев М.А группа:0033-04 ММФ Проверил: Пак Т.С
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат, гидроксид метила) — Ch4OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. Метанол — это первый представитель гомологического ряда одноатомных спиртов.
С воздухом в объёмных концентрациях 6,72—36,5 % образует взрывоопасные смеси (температура вспышки 15,6 °C). Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
Получение
До 1960-х годов метанол синтезировали только на цинкхромовом катализаторе при температуре 300—400 °C и давлении 25—40 МПа (= 250—400 Бар = 254,9—407,9 кгс/см²). Впоследствии распространения получил синтез метанола на медьсодержащих катализаторах (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200—300 °C и давлении 4—15 МПа (= 40—150 Бар = 40,79—153 кгс/см²).
Современный промышленный метод получения — каталитический синтез из оксида углерода(II)(CO) иводорода(2h3) при следующих условиях:
температура — 250 °C,
давление — 7МПа (= 70 атм= 70 Бар = 71,38 кгс/см²),
катализатор— смесь ZnO (оксид цинка) и CuO (оксид меди(II)):
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
Также известны схемы использования с этой целью отходов нефтепереработки, коксующихся углей.
CO2 + 3h3 <--> Ch4OH + h3O + 49.53 кДж/моль
h3O + CO <--> CO2 + h3 + 41.2 кДж/моль
Молекулярная формула — Ch5O или Ch4—OH, а структурная: 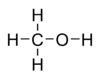 В настоящее время метиловый спирт получают синтетическим способом из монооксида углерода и водорода при температуре 300—400 °C и давления 300—500 атм в присутствии катализатора — смесиоксидов цинка, хрома и др. Сырьем для синтеза метанола служитсинтез-газ(CO + h3), обогащенный водородом: :CO+ 2h3 → Ch4OH[1]
В настоящее время метиловый спирт получают синтетическим способом из монооксида углерода и водорода при температуре 300—400 °C и давления 300—500 атм в присутствии катализатора — смесиоксидов цинка, хрома и др. Сырьем для синтеза метанола служитсинтез-газ(CO + h3), обогащенный водородом: :CO+ 2h3 → Ch4OH[1]

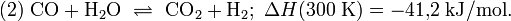
Крупнейшим производителем метанола в России является ОАО «Метафракс» в Губахе.
На конец 2013 года германский концерн "GELSENCHEM Chemical Products GmbH" предлагает метанол 98,5% по цене 520euro за 10 тонн и это цена с доставкой по Германии.
Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости). В органическом синтезе метанол применяют для выпуска формальдегида, формалина, уксусной кислоты и ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства карбамидоформальдегидных и фенолформальдегидных смол. Значительные количества Ch4OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Используется в топливных элементах.
Благодаря высокому октановому числу, что позволяет увеличить степень сжатия до 16[источник не указан 380 дней] и большей на 20 % энергетической мощностью заряда на основе метанола и воздуха, метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:
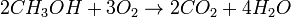
Для получения биодизеля растительное масло переэтерифицируется метанолом при температуре 60 °C и нормальном давлении приблизительно так: 1 т масла + 200 кг метанола + гидроксид калия или натрия.
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли).
Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H+) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку.
Реакции:
На аноде Ch4OH + h3O → CO2 + 6H+ + 6e−
На катоде 1.5O2 + 6H+ + 6e− → 3h3O
Общая для топливного элемента: Ch4OH + 1,5O2 → CO2 + 2h3O
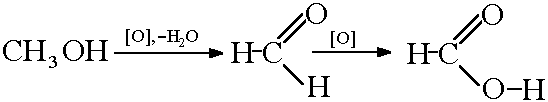
Получение муравьиной кислоты окислением метанола:
Получение диметилового эфира дегидратацией метанола при 300—400 °C и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60 % или цеолитов — селективность процесса близка к 100 %. Диметиловый эфир (C2H6O) — экологически чистое топливо без содержания серы, содержаниеоксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53.
Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол). 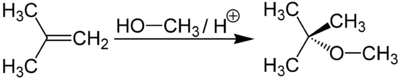
Метил-трет-бутиловый эфир (C5h22O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор). Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15 %, в Польше — 5 %. В России в среднем составе бензинов содержание МТБЭ составляет до 12 % для АИ92 и до 15 % для АИ95, АИ98.
studfiles.net
Температура - кипение - метанол
Температура - кипение - метанол
Cтраница 1
Температуры кипения метанола и воды при Р 40 мм соответственно равны 5 0 и 34 1 С, а при Р 100 мм равны 21 2 и 51 6 С. [1]
Температура кипения метанола в зависимости от давления меняется следующим образом. [2]
Так, при атмосферном давлении температура кипения метанола равна 64 5 С, а воды - 100 С; бензола - 80 2 С, а толуола - 110 6 С. Очевидно, что метанол в первой из смесей и бензол - во второй будут проявлять большее стремление перейти из жидкой фазы в паровую, а вода и толуол - из паровой в жидкую. [3]
Они кипят при температурах выше температуры кипения метанола и ниже температуры кипения воды. Изобутиловое масло содержит 20 - 40 % метанола, 35 - 40 % воды, 30 - 50 % высших спиртов; изобутиронная фракция - до 96 0 % метанола, 1 5 - 3 0 % воды и 2 5 - 4 0 % высших спиртов. Кроме того, они содержат незначительное количество альдегидов, эфиров, кар-бонилов железа и друлих соединений, которые влияют на качество боковых отборов-перманганатное число этих фракций колеблется от уля до 3 - 4 мин. С боковыми фракциями из колонны отводится основное количество этанола, нелетучих азотистых соединений ( N-метилпирролидон и его производные, этаноламины и др.), образующихся на стадии подготовки газового сырья. [4]
Обработка ТХБ метанолом проводилась в колбе с мешалкой и обратным холодильником при температуре кипения метанола в течение двух часов. [5]
В метаноле-ректификате менее 0 02 % составляют вещества, имеющие температуру кипения ниже температуры кипения метанола. [6]
Как видно из таблицы, ряд азеотропных смесей имеет температуру кипения, близкую к температуре кипения метанола, хотя концентрация последнего в отдельных случаях очень низка. Например, азеотропная смесь с метилпропионатом содержит 4 75 % СН3ОН, а кипит при 62 45 С. [8]
В литровую круглодонную четырехгорлую колбу, снабженную мешалкой, обратным холодильником и капельной воронкой, помещают 150 2 г ( 1 63 моля) свежеперегнанного винилизопропенилацетилена, 150 мл метанола, 4 5 мл серной кислоты и 4 5 г сернокислой ртути. Реакционную смесь нагревают до температуры кипения метанола и п течение 8 часов одновременно прикапывают 75 мл воды и небольшими порциями прибавляют 12 0 г сернокислой ртути. Затем прибавляют еще 75 мл воды. Продукт реакции трижды экстрагируют эфиром порциями по 75 мл, эфирный экстракт промывают раствором углекислого калия, иодой и сушат над сернокислым магнием. [9]
Большое число усовершенствований направлено а снижение содержания воды в ректификате. Значительно снизить концентрацию последней можно9 с помощью ввода в колонну дополнительного компонента, который образует азеотропную смесь с водой; температура кипения этой смеси должна быть ниже температуры кипения метанола. Обезвоженный спирт получается также при введении металлического натрия ( или алия) вместе с газообразной двуокисью серы и метабисульфитом калия. В результате происходит осаждение сульфита и обезвоживание метанола. [10]
Метанол-сырец поступает под давлением 5 ати в дистилляционную ( эфирную) колонну 3, где при этом давлении из сырца отгоняется диметиловый эфир. Вместе с метанолом в колонну вводят около 10 % воды ( в виде пара) для отделения олефинов, карбонильных соединений и других примесей, температуры кипения которых близки к температуре кипения метанола. [12]
Метанол-сырец поступает под давлением 5 ати в дистилляционную ( эфирную) колонну 3, где при этом давлении из сырца отгоняется димстиловый эфир. Вместе с метанолом в колонну вводят около 10 % воды ( в виде пара) для отделения олефинов, карбонильных соединений и других примесей, температуры кипения которых близки к температуре кипения метанола. [14]
Себестоимость получения диметилового эфира по приведенной выше технологии ( СН4 - СО Н2 - СН3ОН - СН3ОСН3) получается очень высокой. Поэтому в настоящее время разрабатываются технологии синтезирования СН3ОСН3 непосредственно из синтез-газа, когда в реакторе в присутствии бифункционального катализатора наряду с метанолом образуется диметиловый эфир с последующей его сепарацией. Учитывая значительную разницу в температурах кипения метанола и диметилового эфира ( соответственно плюс 56 С и минус 25 3 С), разделение этих продуктов можно осуществлять либо ректификацией, либо последовательной конденсацией. [15]
Страницы: 1 2
www.ngpedia.ru
Метанол. Применение метанола, физико-химические основы производства.
Метанол (метиловый спирт) является одним из важнейших по значению и масштабам производства органическим продуктом, выпускаемым химической промышленностью. Впервые метанол был найден в древесном спирте в 1661 г., но лишь в 1834 г. был выделен из продуктов сухой перегонки древесины Думасом и Пелиготом. В это же время была установлена его химическая формула. Способы получения метилового спирта могут быть различны: сухая перегонка древесины, термическое разложение формиатов, гидрирование метилформиата, омыление метилхлорида, каталитическое неполное окисление метана, каталитическое гидрирование .окиси и двуокиси углерода.
До промышленного освоения каталитического способа метанол получали в основном сухой перегонкой древесины. «Лесохимический метиловый спирт» загрязнен ацетоном и другими трудноотделимыми примесями. В настоящее время этот метод получения метанола практически не имеет промышленного значения. По причинам технического и главным образом экономического характера промышленное развитие получил метод синтеза метанола из окиси углерода и водорода.
Метанол является сырьем для получения таких продуктов как формальдегид (около 50% от всего выпускаемого метанола), синтетический каучук (~11%), метиламин (~'9%), а также диметилтерефталат, метилметакрилат, пентаэритрит, уротропин. Его используют в производстве фотопленки, аминов, поливинилхлоридных, карбамидных и ионообменных смол, красителей и полупродуктов, в качестве растворителя в лакокрасочной промышленности. В большом количестве метанол потребляют для получения различных химикатов, например хлорофоса, карбофоса, хлористого и бромистого метила и различных ацеталей.
Метиловый спирт, метанол СН3ОН является простейшим представителем предельных одноатомных спиртов. В свободном состоянии в природе встречается редко и в очень небольших количествах (например, в эфирных маслах). Его производные, наоборот, содержатся во многих растительных маслах (сложные эфиры), природных красителях, алкалоидах (простые эфиры) и т. д. При обычных условиях это бесцветная, легколетучая, горючая жидкость,. иногда с запахом, напоминающим запах этилового спирта. На организм человека метанол действует опьяняющим образом и является сильным ядом, вызывающим потерю зрения и, в зависимости от дозы, смерть.
Физические характеристики метанола при нормальных условиях следующие:
Молекулярный вес ............ 32,04
Плотность, г/см3 ............. 0,8100
Вязкость, мПа-с ............. 0,817
Температура кипения, °С ......... 64,7
Температура плавления, °С ........ —97,68
Теплота парообразования, ккал/моль .... 8,94
Теплота сгорания, ккал/моль
жидкого ............... 173,65
газообразного............. 177,40
Плотность и вязкость метанола уменьшаются при повышении температуры таким образом:




 -40 °С -20 °С О °С 20 °С 40 °С 60 °С
-40 °С -20 °С О °С 20 °С 40 °С 60 °С
Плотность, г/см3 ....... 0,8470 0,8290 0,8100 0,7915 0,7740 0,7555.
 Вязкость, мПа.с. ...... 1,750 1,160 0,817 0,597 0,450 0,350
Вязкость, мПа.с. ...... 1,750 1,160 0,817 0,597 0,450 0,350
Метанол при стандартных условиях имеет незначительное давление насыщенных паров. При повышении температуры давление насыщенных паров резко увеличивается".' Так, при увеличении температуры с 10 до 60 °С давление насыщенных паров повышается от 54,1 до 629,8 мм рт. ст., а при 100 °С оно составляет 2640 мм рт. ст. углеводородами. Он хорошо поглощает пары воды, двуокись углерода и некоторые другие вещества.
Следует указать на способность метанола хорошо растворять большинство известных газов и паров. Так, растворимость гелия, неона, аргона, кислорода в метаноле при стандартных условиях выше, чем растворимость их в ацетоне, бензоле, этиловом спирте, циклогексане и т. д. Растворимость всех этих газов при разбавлении метанола водой уменьшается. Высокой растворимостью газов широко пользуются в промышленной практике, применяя метанол и его растворы в качестве поглотителя для извлечения примесей из технологических газов.
Свойства растворов метанола в смеси с другими веществами значительно отличаются от свойств чистого метилового спирта. Интересно рассмотреть изменение свойств системы метанол—вода. Температура кипения водных растворов метанола закономерно увеличивается при повышении концентрации воды и давления . Температура затвердевания растворов по мере увеличения концентрации метанола понижается: -54 °С при содержании 40% СН3ОН и —132°С при 95% СН3ОН.
Плотность водных растворов метанола увеличивается при понижении температуры и почти равномерно уменьшается с увеличением концентрации метанола от плотности воды до плотности ''спирта при измеряемой температуре. Зависимость вязкости от концентрации метанола имеет при всех исследованных температурах максимум при содержании СН3ОН около 40%. В точке максимума вязкость раствора больше вязкости чистого метанола.
Метанол смешивается во всех отношениях со значительным числом органических соединений. Со многими из них он образует азеотропные смеси — растворы, перегоняющиеся без изменения состава и температуры кипения, т. е. без разделения; К настоящему времени известно свыше 100 веществ, в числе которых имеются и соединения, обычно присутствующие в метаноле-сырце. К этим веществам, например, относятся ацетон, метилацетат, метилэтилкетон, метилпропионат и некоторые другие. Необходимо отметить, что азеотропные смеси с содержанием таких соединений, как ме-тилэтилкетон, метилпропионат, пропилформиат, изобутилформиат и ряд других имеют температуру кипения, близкую к температуре кипения чистого метанола (62—64,6 °С).
Метанол сочетает свойства очень слабого основания и еще более слабой кислоты, что обусловлено наличием алкильной и гидроксильной групп. При окислении метанола кислородом в присутствии катализатора образуется формальдегид:
СН3ОН + 0,5СО2 ↔ НСНО + Н2О
На этой реакции основан широко применяемый в промышленности метод получения формальдегида, который используют в производстве пластических масс. При действии щелочей металлов водород гидроксильной группы метанола замещается с образованием алкоголята
2СН3ОН + 2Na ——> 2Ch4ONa + 2Н2
который стоек только в отсутствие воды, так как вода омыляет его до метанола и щелочи:
СН3ОNa + Н2О ® СН3ОН + NaOH
С аммиаком метанол образует метиламины:
СН3ОН + Nh4 ——> Ch4Nh3 + Н2О
СН3ОН + СН3NН2 ——> (Ch4)2Nh3 + Н2О
Ch4OH + (СН3)2Nh3 ——> (СН3)3Nh3 + Н2О
Эти реакции протекают в паровой фазе в присутствии катализаторов при 370—400 °С и повышенных давлениях..
Дегидратацией на катализаторе при повышенных температурах получают диметиловый эфир:
2СН3ОН ——> (СН3)2О + Н2О
При взаимодействии метанола и минеральных кислот образуются сложные эфиры. Этот процесс называется этерификацией, и его широко используют в промышленной практике для получения различных метиловых эфиров — метилхлоридов, метилбромидов, метилнитратов, метилсульфатов и др.:
СН3ОН + h3SO4 ——>- СН3SО3ОН + Н2О
Органические кислоты также реагируют с метанолом с образованием сложных эфиров:
СН3ОН + СН3СООН ——> СН3СООСНз + Н2О
Похожие статьи:
poznayka.org
Абсорбция метанола водой - Справочник химика 21
При втором способе в абсорбере поглощают преимущественно формальдегид тогда колонна 7 служит для абсорбции метанола, который отгоняют от воды и возвращают на реакцию. В обоих случаях формалин из куба абсорбера 6 охлаждают в холодильнике 8 и собирают в сборнике 9. [c.476]Указанный катализатор очень чувствителен к перегреву и действию ядов, поэтому содержание серы в газе не должно итревышать 2 мг/нлГ . Такая Степень очистки газа от серы яри условии, что органическая сера предварительно превращена в сероводород, достигается довольно легко (например, одновременно с абсорбцией СОг водой под давлением 10 ати). Другим очень сильным ядом для данного катализатора является карбонил железа, образующийся даже при температуре ниже 100° при соприкосновении с железом окиси углерода, находящейся под высоким давлением. Поэтому аппаратура для синтеза метанола, через которую проходит газ, сжатый в цилиндрах компрессора, Д0.ТЖНЗ быть изнутри выложена медью (желательно также применение дополнительного фильтра с активным углем). Вместо меди можно использовать кислотоупорную сталь, на которую окись углерода почти не действует. При хорошей очистке газа катализатор работает около 2 месяцев. [c.246]
В ходе разработки математических моделей процессов абсорбции и ректификации для указанного производства с учетом регламентных условий проведения процессов изучены имеющиеся экспериментальные данные о содержании промежуточных соединений в системе формальдегид - метанол -вода и представлена совокупность характерных химических превращений и соединений. Протекание химических реакций между компонентами технологических потоков существенно осложняет математическое описание фазовых равновесий [c.70]Количество раствора, выводимого из цикла охлаждения на ректификацию, определяется балансом воды в этом цикле кубовый остаток после ректификации водно-спиртового раствора направляют на абсорбцию метанола в колонну 14, а метанол возвращают в систему. Описаны и другие варианты технологической схемы очистки [230, 262, 267-270]. [c.276]
Особенно это относится к тому случаю, когда опыты проведены на процессе абсорбции, но применяются для решения вопросов ректификации. В этом случае следует производить проверку результатов работы на горячем стенде . Последний представляет модель колонны с некоторым количеством исследуемых контактных устройств. Минимальное число их —три. Из них исследуется среднее. Конечно, желательно проводить опыты на той системе, которая интересует исследователя. Если же его интересует только общая характеристика контактного устройства, то в качестве объекта исследования берутся бинарные системы с хорошо известными свойствами, например этанол — вода, метанол — вода. [c.187]
Очистительная система состоит из циклонов, скруббера с водяным орошением и фильтров для удаления сажи, скруббера с масляным орошением для удаления высших углеводородов ацетиленового ряда и колонны селективной абсорбции ацетилена водой, работающей под давлением 19 ат. При уменьшении давления из водного раствора выделялся ацетилен чистотой около 90%, который затем очищался с помощью сложной очистительной системы, предусматривающей промывку метанолом при низкой температуре. В результате такой очистки получался конечный продукт с чистотой 97%. Нерастворенные газы из главного водяного абсорбера разделялись на водород, этилен и газ рециркуляции на низкотемпературной установке Линде. [c.175]
Проведено сравнительное исследование процессов абсорбции СОг и ЫНз водой и ректификации в системах дихлорэтан—толуол, метанол—этанол и ацетон—бензол на пленочных трубчатых колоннах. Для расчета кинетики абсорбции СОг водой в колоннах длиной 0,2 0,5 1 м и диаметром 15,5 25,2 49 мм получено уравнение [c.98]
Газы после первых ступеней десорбции рециркулируют в грязный газ. Чистый СОг после третьей ступени десорбции используют для синтеза карбамида. Для предотвращения образования гидратов в газ перед теплообменниками впрыскивают метанол. Смесь метанол — вода из узла охлаждения разделяют в колонне дистилляции (на схеме не показана). Кислый газ из регенератора объединяют с отходящими газами после колонны дистилляции и направляют на переработку для получения серы по методу Клауса. Следы метанола и СОг удаляют из очищенного газа абсорбцией на цеолитах и далее газ подают на промывку жидким азотом. [c.294]
В работе проведено исследование массопередачи на кольцевых пластинчатых тарелках в условиях десорбции кислорода из воды воздухом, абсорбции сернистого газа водой и ректификации смесей метанол — вода и этанол — вода. [c.76]
В связи с применением низких температур при абсорбции ацетилена из газовых смесей важное значение имеет повышение поглотительной способности метанола и о температурах замерзае-мости его абсорбентов и их растворов. Исследовали температуры замерзаемости смешанных абсорбентов метанол — вода, метанол— ацетон, метанол — диметилформамид. Опытные данные показали, что разбавление метанола другими растворителями до определенных концентраций вызывает понижение температуры замерзаемости разбавленного метанола по сравнению с температурой замерзаемости чистого метанола. [c.136]
В процессе с использованием метанола в качестве растворителя желательно извлечь пары метилового спирта из воздуха, покидающего колонну со скоростью 26,3 м /мин, посредством абсорбции в воде. Можно принять, что среднее содержание спирта в воздухе равно 30 % (мол.), а влажность последнего постоянна на протяжении всего процесса и отвечает насыщению по отношению к жидкости, поступающей в аппарат. Абсорбцию необходимо проводить при 39,9 °С в колонне с внутренним диаметром 0,686 м и насадкой из нерегулярно уложенных колец Рашига диаметром 0,0254 м. Степень удаления метанола из воздуха должна составлять 99 %. Давление в верхней части башни поддерживается равным 0,0981 МПа. Преобладающее барометрическое давление является атмосферным. Можно предположить, что абсорбция происходит при постоянных давлении (0,0981 МПа) и температуре (39,9°С) отметим, что эти допущения в реальных условиях, как правило, не наблюдаются. [c.560]
Рассмотренная работа модернизирована [1а] последующими исследованиями колонн больших размеров. Приведены данные и корреляционные зависимости по распределению пузырьков по размерам, по площади межфазной поверхности и по абсорбции кислорода водой, метанолом и водными растворами глицерина и гликоля. Для распределения газа использовались как единичные отверстия, так и пористые пластины. Упомянутая статья, по-видимому, является отличным источником информации при про- [c.663]
Зависимость в верхней части рисунка соответствует области процесса абсорбции метанола из газа концентрация метанола в ВМР на каждой нижерасположенной теоретической тарелке монотонно возрастает. При отсутствии метанола в "отдувочном" газе реализуется процесс десорбции (нижняя часть рис. 19) остаточное содержание метанола в воде после массообмена снижается до [c.36]
Согласно другой разработке, использование которой предполагается в отдаленном будущем, метанол может быть получен из СО2 и Н2. Речь идет о выделении СО2 из воздуха абсорбцией, получении водорода электролизом воды, а энергии из термоядерного синтеза [52]. Для этого, правда, придется разработать специальные катализаторы, которые должны обладать достаточно высокой активностью, чтобы превратить СО2 и Н2 в метанол. [c.232]
Абсорбция метанолом ( ректизол -процесс) — более вигод-ный метод, его можно использовать при температуре до —60 °С, когда резко повышается поглотительная способность метанола. Так, при —60 °С и давлении около 0,4 МПа в 1 г метанола может раствориться до 600 см диоксида углерода. Избирательность метанола по отношению к диоксиду углерода значительно выше, чем воды. Диоксид углерода из раствора выделяют понижением давления м повышением температуры. [c.48]
Кафаров и Зелинский [1611 исследовали абсорбцию NHg ацетона, метанола и этанола водой на решетчатых тарелках с [c.572]
Концентрацию формальдегида в растворе регулируют, либо изменяя количество воды, подаваемой в колонну на стадии абсорбции продуктов реакции, либо разбавляя формалин прямо в хранилище. Для предотвращения образования выпадающего в осадок параформальдегида в формалин вводят стабилизаторы, обычно метанол (см. разд. 3.2). [c.31]
Для физической абсорбции обычно применяют воду, органические растворители — неэлектролиты, не реагирующие с растворимым газом, и их водные растворы. В азотной промышленности к методам физической абсорбции можно отнести водную очистку от СО 2, очистку от двуокиси углерода - метанолом при низких температурах, очистку от СО и СН4 жидким азотом. [c.25]
Шулмен предположил [591, что активная поверхность при абсорбции хорошо растворимых газов пропорциональна динамическому количеству удерживаемой жидкости бд , а при испарении равна смоченной поверхности и пропорциональна общему количеству удерживаемой жидкости б. Для проверки этого предположения в колонне диаметром 300 мм были проведены опыты [1561 по испарению воды и абсорбции метанола водой на насадках из колец размером 12,5—38 мм и седел размером 12,5 и 25 мм, причем определяли значение С в соотношении [c.452]
Е 1 1 i S S. R. М., В i d d U 1 р h М., hem. Eng. S i., 21, 1107 (1966). Измерения турбулентности у поверхности раздела фаз (в условиях понижения и повышения поверхностного натяжения при абсорбции и десорбции ацетона и метанола водой). [c.281]
Шервуд и Пигфорд [3], воспользовавшись данными Теккера и Хоугена, а также усредненными данными по абсорбции хорошо растворимых газов, получили более правдоподобную зависимость (кривая// на рис. 140), чем Вейсман и Бонилла. Данные Теккера и Хоугена использовали также Иосида и Коянаги [139] в сочетании с собственными опытами по абсорбции паров метанола водой и по испарению воды (кривая III на рис. 143). [c.446]
Для синтеза М.-ф. с. обычно используют 30%-ные водные р-ры формальдегида, содержащие ок. 1% метанола. С повышением концентрации формадьдегида увеличивается содержание метанола напр., 40%-ные р-ры содержат его до 10%. Метанол способствует образованию метилированных смол невысокой мол. массы, легко разрушающихся водой после отверждения. Кроме того, с увеличением содержания метанола в формалине возрастает абсорбция паров воды отвержденными смолами (с 2% при использовании безметанольного водного р-ра формальдегида до 6—10% при содержании метанола 8%). Молярное соотношение мочевина/ формальдегид колеблется в пределах 1/1,3—1/1,8. Темп-рный режим существенно зависит от назначения смолы. Проводя поликонденсацию при темп-ре ок. 40 °С, получают связующее для пресс-порошков (см. Аминопласты). Смолы, используемые в произ-ве слоистых пласт.иков, и смолы, модифицированные спиртами (см. ниже), синтезируют при 70—120 °С. [c.155]
Технологический процесс получения формалина состоит из I) приготовления спирто-воздушной смеси 2) окисления метанола в контактном аппарате и 3) абсорбции формальдегида водой. Воздух нагнетается воздуходувкой 1 (рис. 49) в испаритель 2, где барботирует через подогретый до 40 С метанол. Полученная спнрто-воздушная смесь проходит через перегреватель 3 в контактный аппарат 4. Катализаторами служат медь, серебро или окисные катализаторы. Вначале происходит дегидрирование метанола [c.183]
Абсорбция растворами МЭА и ДЭА в метаноле (процесс "Амизол"). Недостатком процесса "Ректизол" является абсорбция при отрицательных температурах, а растворы МЭА в воде имеют слабую концентрацию и соответственно низкую поглотительную способность. На регенерацию их требуется большое количество тепла. Для устранения этих недостатков были разработаны методы очистки растворами алканоламинов в органических растворителях. [c.233]
Дальнейшая переработка реакционных газов состоит в абсорбции формальдегида и метанола водой. В отличие от других альдегидов формальдегид энергично взаимодействует с водой, образуя с ней гидраты, например НСНО-НгО, в то время как метанол поглощается медленнее. Поскольку для стабилизации формальдегида все равно требуется метанол, который содержится в газе как раз в нужном количестве, проводят их совместную абсорбцию таким количеством воды, чтобы с учетом реакционной воды сразу получился 36—37%-ный формалин. Применяемый для этого тарельчатый абсорбер б имеет ряд внутренних или выносных холодильников для снятия тепла, выделяющегося при абсорбции. Реакционные газы проходят с анитарную очистку водой в скруббере 7, а формалин из куба абсорбера 6 дополнительно охлаждается и стекает в сборник 9. [c.569]
На стадии абсорбции апробированы следующие комплексные абсорбенты ДЭА - метанол - вода (ГИАП), ДЭА - -метилпир-ролидон - вода (ЮЖНИИгипрогазК ДЭА - диметилацетамид - вода (ВНИПИгаз). На стадии утилизации газов регенерации цеоли-товой установки апробировано термокаталитическое разложение меркаптанов (НИОгаз, ВНИИгаз). На стадии регенерации отработанных цеолитов испытан термоокислительный процесс (Волго-УралНИПИгаз). [c.140]
При получении метанола на базе природного газа очистка синтез-газа сводится к освобождению его от "углекислоты. Это может быть осуществлено либо водной отмывкой под давлением, либо абсорбцией углекислоты раствором моноэтаноламина. При большом содержании з глекислоты в газе (свыше 10%) обычно применяют водную очистку. Процесс проводят при давлении 25—28 ат в абсорбере, заполненном кольцами Рашига. Отмытый от СОг газ отводится с, верха абсорбера. Вода и растворенные в ней газы направляются на десорбцию, которая осуществляется редуцированием давления до атмосферного в агрегате мотор — насос — турбина. В этом агрегате рекуперируется до 40% энергии, затраченной на подачу воды в аппараты высокого давления. [c.18]
Этот способ основан на применении в качестве хемосорбента раствора МЭА или ДЭА в метаноле. Такой абсорбент поглощает HjS, СО2, меркаптаны, углеводороды и воду. Абсорбция ведется при 35 °С, а регенерация при 80 °С. Это обусловливает низкий расход теплоты на регенерацию по сравнению с водными растворами аминов. Процесс изучен [29] при давлении 3 МПа, при этом достигнута высокая степень очистки h3S (0,3 ррм), OS (0,1 ррм), СО2 (10 ррм). Побочные реакции аминоь с СО2 и OS в метанольном растворе идут в 10 раз медленнее, чем в водном растворе МЭА, и в 100 раз медленнее, чем в водном растворе ДЭА. Коррозия оборудования при этом практически отсутствует. [c.24]
Методы поглощения СО3 посредством физической абсорбции не дают высокой степени извлечения и используют при высоком содержании двуокиси углерода в газовой смеси в качестве поглотителей применяют воду, метанол и ацетон. Вода обладает низкой поглотительной способностью и поэтому употребляется лишь в случае проведения абсорбции под давлением (12—30 бар), преимущественно для очистки азотоводородной смеси в производстве синтетического аммиака (см. схему на стр. 666). Недостатки водного метода—большой расход энергии на перекачку значительных количеств воды и низкий коэффициент массопередачи при поглощении СОз водой. [c.678]
Если дегидродигидродиконифериловый спирт нагревать (с обратным холодильником) с водным диоксаном или метанолом, содержащим 0,5% соляной кислоты, то отщепляется вода от оксиметильной боковой цепи кумаранового кольца. Последнее превращается в кумароновое с образованием новой коньюгирован-ной двойной связи. Возникновение двойной связи обнаруживается увеличением абсорбции и батохромного сдвига при максимуме 310 mji в ультрафиолетовом спектре. [c.713]
Важнейшие преимущества этого нроцесса а) значительное снижение удельного расхода энергии по сравнению с обычными процессами удаления кислых газов (например, абсорбцией водой или растворами этаноламина), б) удовлетворительная полнота удаления всех нежелательных примесей за одну ступень абсорбции и в) получение очищенного газа с весьма низким содержанием водяного пара [36, 37]. Наиболее серьезными недостатками процесса являются а) сложность схемы и б) сравнительно большие потери от испарения растворителя, обусловленные значительным давлением паров метанола даже нри низких температурах. Величину потерь можно определить из графика рис. 14.12 [38]. Кроме того, даже после многоступенчатой очистки газ содержит около 1% двуокпси углерода и поэтому при необходимости получать газы с нпзким содержанием двуокиси углерода требуется [c.368]
Из физически абсорбирующих поглотителей наиболее широко применяется вода. Однако поглотительная емкость воды по отношению к сероводороду и двуокиси углерода сравнительно мала поэтому требуется высокая интенсивность циркуляции и, следовательно, увеличивается расход энергии на перекачку. Важным шагом к усовершенствованию процессов физической абсорбции сероводорода и двуокиси углерода явилась разработка процесса ректизол. Успех этого процесса побудил предпринять хшиски органических поглотителей, по абсорбционной емкости не уступающих метанолу и ацетону (применяемым в процессе ректизол), но менее летучих, что позволило бы проводить абсорбцию, не прибегая к глубокому охлаждению. [c.385]
chem21.info
Метанол водой - Справочник химика 21
В качестве примера па рис. 9 изображены рассчитанные по данным о равновесии коэффициенты активности в бинарных системах, образованных ацетоном, метанолом и водой. Из рассмотрения рис. 9 следует, что в системе ацетон — вода коэффициенты активности компонентов значительно выше, чем в системе метанол — вода. Отсюда вытекает, что прибавление воды к системе метанол ацетон должно, вызывать увеличение относительной летучести последнего. Зависимость степени увеличения коэффициента относительной летучести ацетона и метанола от концентрации воды, рассчитанная по уравнению (121) с помощью коэффициентов активности, также приведена на рнс. 9. [c.46] Ход расчета излагается ниже на примере системы ацетон-метанол—вода. [c.192]На рис. 72 изображены зависимости логарифма отношения коэффициентов активности от концентрации компонента, стоящего в названии системы первым, для систем ацетон—метанол 1ё(У1/Т2) =ф(- 0, ацетон—вода 1 (у1/ з) =Ф1 (- О и метанол-вода 1д(72/уз)=ф2(- 2). [c.192]
Особо надо рассмотреть случай, когда кривые, выражающие зависимость Ф от ле для двух бинарных систем, пересекаются. Этот случай, в частности, имеет место для системы ацетон—метанол—вода (рис. 73), в которой пересекаются кривые. для систем ацетон—метанол (Ф12) и метанол—вода (Фзг)- Очевидно в точке пересечения величина lg(Yl/Yз) p = (Ф12—Фз2)/(1—ЛС2)=0, т. е. кривая, выражающая зависимость (Ф12— [c.195]Из геометрических соображений следует, что пересечение кривых Ф = ф(а ) наиболее вероятно при мало отличающихся по величине функциях Ф12 и Ф32. Но при этом в диапазоне концентраций Х2, на концах которого (Ф12—Фз2)/(1—->С2)=0, значения (ф,2—Фзг)/(1—Х2) мало отличаются от нуля. Так, в системе ацетон—метанол—вода значение (Ф12—Фз2)/(1—при 0экстремальной точке составляет всего —0,012. Поэтому для технологических расчетов можно пренебречь этой величиной и считать, при 0Максимальная относительная погрешность, вызываемая этим допущением, не может превышать 3%. Указанное допущение, по-видимому, может быть сделано во всех аналогичных случаях. При этом значения lg(Yl/Yз) при 0линейной интерполяцией между кривой lg(Yl/Yз) =ф(- ) при д 2 = 0 и осью абсцисс. [c.195]
Проверка адекватности данной модели производилась путем сравнения экспериментальной и рассчитанной по модели зависимости локальной эффективности тюу от состава для смесей пропан-и-бутан, толуол-ксилол, циклогексан-толуол, метанол-вода. Для расчета коэффициентов массоотдачи рд,, р использовались уравнения для определения чисел единиц переноса в паровой и жидкой фазах [c.140]
Зависимость коэффициентов активности компонентов системы метанол —вода от концентрации метанола [109]. [c.84]
В качестве сырья при получении глицерина и гликолей гидрогенолизом углеводов используются главным образом водные растворы (древесные гидролизаты, меласса) в этом случае вопрос о растворителе предопределен и остальные факторы должны подбираться с учетом этого. Когда же сырьем служит сахароза, то в качестве растворителя можно использовать не только воду, но и смесь метанол — вода [16], и другие спиртовые среды. Известно, что медные катализаторы на носителях плохо работают при гидрогенолизе водных растворов углеводов [36], если же использовать в качестве растворителей спирты, то можно применять для гидро-генолиза медно-хромовый катализатор и хромат бария, гидроокись и фторид меди, алюминат меди и другие катализаторы, которые дешевле никелевых [37]. Однако в этом случае возникает необходимость в рекуперации и очистке растворителя, что не требуется для воды. [c.115]Пример 19-2. На ректификацию поступает смесь метанол — вода в количестве Р = 5000 кг/ч, содержащая метанола a , = 40 вес. %. Содержание метанола в дистилляте 98,5 вес.%, в кубовом остатке а =1,5 вес.%. Определить количество дистиллята и остатка. [c.675]
Решение. На рис. 19-12 построена (по данным Приложения X) диаграмма равновесия для смеси метанол — вода при атмосферном давлении. Выражая при помощи уравнения (16-6) составы исходной смеси х дистиллята Хр и остатка в молярных долях, получим [c.677]
Пример 19-5. Определить расход тепла для ректификации смеси метанол — вода в условиях примеров 19-2 и 19-4 и найти тепловую нагрузку дефлегматора, если в колонну смесь вводится при температуре ее кипения, а в дефлегматоре происходит полная конденсация поступающих в него паров. [c.682]
Пример 19-6. Рассчитать насадочную ректификационную колонну непрерывного действия, работающую в режиме подвисания и предназначенную для разделения смеси метанол—вода (см, пример 19-2). [c.694]
Пример 19-7. Рассчитать ректификационную колонну непрерывного действия с ситчатыми тарелками для разделения смеси метанол — вода (см. пример 19-4, стр. 679). [c.695]
Система ацетон — метанол — вода [c.69]Ацетон, Метанол Вода. . [c.69]
Синтез метанола из смеси СО и СО2 значительно упрощает технологическую схему, что повышает технико-зкономические показатели, несмотря на разбавление метанола водой. [c.259]
О — метанол — вода Д — этанол — вода X — пропанол — вода — бутанол — вода. [c.430]
НДА (ТУ 6-00-05808009-248-92) — нитрит дициклогексиламина. Это порошок белого цвета с желтоватым оттенком, растворимый в этаноле, метаноле, воде, ацетоне. Предназначен для долговременной (10—20 лет в зависимости от способа применения и условий хранения изделий) защиты от атмосферной и микробиологической коррозии изделий из стали, алюминия и его сплавов, никеля, хрома, кобальта. Ингибитор применяют в виде порошка, засыпаемого в сублиматор для получения ингибированного воздуха порошка для опудривания или напыления на зашитные поверхности спиртовых растворов ингибированной бумаги с содержанием ингибитора 14— 20 г/см1 [c.376]
Получение термодинамических характеристик химических процессов. Изучение температурных зависимостей спектров ДОВ и КД химических соединений, имеющих различные конформации, может дать ряд термодинамических характеристик равновесного существования различных форм. На рис 25 приведены спектры ДОВ рас-творов ДНК в растворителе метанол вода=7 3 в довольно широком интервале температур. Если теперь построить зависимость величины угла [c.46]
Процесс основан на том, что неароматическая часть образует со смесью метанол — вода илиметил-этилкетон — вода тройную азеотропную смесь, от которой ароматические углеводороды могут быть отделены перегонкой. На рис. 52 дана упрощенная схема выделения чистого толуола из продуктов гидроформинга. Из продуктов гидроформинга выделяется кипящая в узких пределах толуольная фракция, которую подают в колонну вместе с азеотропо-образователем, в данном случае с водным метилэтилкетоном. Азеотропная смесь (метилэтилкетон — вода — неароматическая часть) отгоняется, а получающийся в виде остатка чистый толуол отбирают из низа колонны, и далее очищают серной кислотой и промывают щелочью, водой и повторно перегоняют. [c.108]
Схемы управления сложными системами ректификации со связанными материальными и тепловыми потоками проиллюстрируем на примере двух ректификационных колонн для разделения смеси пропилен — пропан и метанол — вода (рис. У1-35) [28]. Особенности технологических схем этих процессов состоят в том, что питание в обе колонны разделяется П риме,рно поровну и кубовый продукт второй колонны подогревается в дефлегматоре первой колонны, которая работает при большем давлении, чем втррая. Вторая схема отличается от первой установкой дополнительных конденсатора и кипятильника. Составы верхних цродуктов колонн высокого и низкого давлений используются в качестве корректирующего сигнала для. регулирования расходов орошения и дистиллята состав нижнего продукта колонны высокого (а) или низкого (б) давлений используется для коррекции расхода тепла в колонну. [c.342]
Экстракция — извлечение растворенного в одной жидкости вещества или группы веществ другой жидюстью. Примером экстракции может служить промывка га.юконденсата от растворенного в нем метанола водой или промьлша щелочью газоконденсата, содержащего меркаптаны. В этих процессах происходит переход вещества из одной жидкой фазы в другую жидкую фазу. [c.50]
Безопасность процесса повышается добавлением к исходному метанолу воды, что одновременно повышает выход и конверсию процесса окислительного дегидрирования на катализаторе в виде медной сетки или серебра, осажденного на пемзе. Для обеспечения безопасной эксплуатации установки формальдегида узел омисли-тельного дегидрирования метанола, как правило, автоматизируют. [c.324]
Сокони-Вакуум Ойл Метанол ( водой [c.131]
Е 1 1 i S S. R. М., В i d d U 1 р h М., hem. Eng. S i., 21, 1107 (1966). Измерения турбулентности у поверхности раздела фаз (в условиях понижения и повышения поверхностного натяжения при абсорбции и десорбции ацетона и метанола водой). [c.281]
Г. А. Кардашевым, А. Л. Шаталовым и А. В. Салосиным [29] исследованы частичная дистилляция смеси метанол- вода и перегонка азео-тропной смеси вода-пропанол-2 под воздействием ультразвуковых колебаний с частотами 20 кГц и 1 МГц (интенсивностями 2 и 20 Вт/см соответственно) при энергоподводе от электромагнитного поля СВЧ (2375 МГц) и инфракрасном излучении с длинами волн от 15 до 25 мкм. [c.159]
Циклогексан отгоняется из смесей с дихлорэтаном или ди-хлорпропаном в виде азеотропа с метанолом. Этот азеотроп разделяется затем путем экстракции метанола водой [352]. Таким же методом нитрильс, (получаемые путем аминирования олефинов, очищаются от примеси углеводородов [353]. [c.287]
В своем обзоре Фуртер [91 ] анализирует степень влияния солевого эффекта на перегонку с точки зрения возможности использования подобных методов в промышленности, особенно при экстрактивной ректификации. Ряд работ Шуберта с сотр. [92] посвящ,ен исследованию влияния различных хлоридов металлов и других простых солей на изотермическое фазовое равновесие систем пропанол—вода, н-бутанол—вода, а также метанол—вода. [c.323]
Фракщпо метанол — вода выпаривают досуха, переносят количественно в мерную колбу дистиллированной водой и доводят до метки. В делительную воронку емкостью 50 см наливают 10 см указанного раствора и метиленовый голубой. Смесь перемешивают 2 мин. Сливают нижний голубой слой хлороформа и определяют оптическую плотность на спектрофотометре при длине волны 660 нм. По калибровочной кривой находят концентрацию деэмульгатора в нефти. [c.164]
В работах голландских исследователей [16] проведено сравнение процессов гидрогеиолиза сахарозы в оборудовании периодического действия (в автоклавном режиме) и на непрерывно действующей установке. Последняя представляла собой каскад из двух реакторов с полезным объемом 250 см каждый реакторы были снабжены тремя отражательными перегородками и турбинной мешалкой с четырьмя лопастями, делающей 1400 об/мин. Температура в первом реакторе была 225 °С, во втором — 200 °С, давление водорода составляло 20 МПа, объемная скорость сырья 1 ч 1, модуль водорода 2,5. Сахарозу подвергали гидрогенолизу в виде 9%-ного раствора в смеси метанол — вода (75—25 по массе) с добавлением 2% Са(0Н)2 (к углеводу) в присутствии медно-це-риевого катализатора на окиси кремния (95 частей СиО 5 частей СеОгГ 100 частей SiOj). [c.105]
Таким образом, неизвестную величину Л можно определить по значениям Л, измеренным для отдельных бинарных смесей. В примере, рассмотренном в [7], получено удовлетворительное согласование между оценками но этому методу и экспериментальными данными для трехкомпонентной смеси ацетон — метанол — вода. [c.417]
Для первой системы значительные отклонения от идеального поведения объясняются тем, что компоненты этой системы (ацетон, метанол, вода) являются полярными веше-ствами, способными к образованию водородных связей между собой. Вторая система содержит относительно простые неполярные молекулы (азот, аргон, кислород) и, тем не менее, при температуре, соответствующей насыщенному состоянию, в ней также возникли немалые отклонения от идеальности, поскольку вторые вириальные коэффициенты для этих веществ очень велики. [c.29]
Влияние различных активаторов на эффект депарафинизации изучали многие исследователи. Н. И. Черножуков с сотр. [53, 54] при проведении депарафинизации автолового дистиллята туйма-зинской нефти в растворе алкилата добавляли метанол, смесь метанола и этанола, а также м-гептан, а ири использовании в качестве растворителя изопропанола — метанол, воду и этилепгли-коль. Согласно кривым на рис. 10, построенным по результатам исследования, наибольший эффект в отношении температуры застывания дистиллята имеет место при добавлении спиртов (отдельно и в смеси) в количестве 10%. При добавлении же 15% спирта происходит расслоение его с дистиллятом. При добавлении [c.32]
Пример IX. 6. Рассчитать ситчатую тарелку колонны для разделения системы метанол — вода, если известно, что расход пара V = 1.45 м 1сек] расход жидкости об = 2,14. 10 м сек, средняя [c.323]
| Рис. 25. Спектры ДОВ растворов ДНК в ра(Стаорителе метанол вода = 7 3 при различных температурах |  |
chem21.info