Передвижение воды по тканям корня и по растению. Когезия воды
Пять стихий: вода
О необычных, а порой и «волшебных», свойствах воды нам рассказывают в школе, в институте, в электричках и на сайтах, где продают флаконы «живой воды». Кроме шуток, у самой распространенной жидкости на Земле действительно хватает необычных характеристик, чтобы их изучению посвящались тысячи научных работ. В рамках проекта «Пять стихий», который N+1 осуществляет совместно с НИТУ «МИСиС», мы расскажем о том, насколько жидкая стихия поддается укрощению, то есть можно ли с помощью современной физики вывернуть все необычные свойства воды наизнанку, как это сделать, а главное — зачем.
О главном
Принципиальный вопрос: откуда у вещества с такой простой формулой (h3O, как все помнят) берется такой набор необычных, местами парадоксальных свойств. Оказывается, что из этой самой формулы и берется. Молекулы воды устроены просто, но очень хитро: в них атом кислорода находится в середине воображаемого тетраэдра, а две неподеленных электронных пары и два атома водорода размещены в его вершинах. Такая конструкция позволяет представить весь объем воды как массив упорядоченных тетраэдров, причем атомы водорода оказываются удобно зажаты между «собственным» кислородом и кислородом соседа. Такая дополнительная связь между соседними молекулами называется водородной, и хотя она на порядок слабее внутримолекулярной ковалентной связи, в масштабах всего вещества она является дополнительным связывающим фактором. Кстати, когда мы сказали «массив упорядоченных тетраэдров», любители теорий о «структуре» и «памяти» воды рановато обрадовались: это упорядочивание действительно есть, но благодаря тепловому движению сетка водородных связей все время разрушается и создается заново, таким образом «помнить» вода ничего не может, но ей и не надо.
Из наличия водородных связей вытекает, пожалуй, самая главная характеристика воды — огромная энергия когезии молекул, которая удерживает их вместе и отвечает за то, что вода остается жидкой при комнатной температуре. У ближайших соседей — сероводорода (h3S), аммиака (Nh4), галогеноводородов (HF, HCl и пр.) — водородные связи тоже могут образоваться, но все эти вещества при комнатной температуре — газы, что еще раз подтверждает необычный статус воды. Но это еще далеко не все. Мы выбрали пять характерных явлений, связанных с водой, которые и предлагаем рассмотреть по порядку.
Когезия: теплоемкость
Давайте вспомним, как на молекулярном уровне определяется агрегатное состояние вещества: если энергия теплового движения совсем мала, атомы будут выстраиваться в наиболее выгодное пространственное положение, как правило — очень симметричное. Такое состояние мы называем «твердым». Если температуру (а вместе с ней и тепловую энергию) системы повысить, атомы и молекулы смогут вырваться из кристаллической решетки, но им все еще не будет хватать прыти, чтобы разлететься далеко друг от друга — в этом случае вещество будет жидким. Когда тепловой энергии окажется достаточно, чтобы пересилить все межмолекулярные взаимодействия, молекулы разлетятся подальше друг от друга, а вещество превратится в газ.
Как видно из нашей простой картинки, именно межмолекулярные взаимодействия определяют то, как много энергии готова впитать жидкость прежде, чем испариться. Этот параметр называется теплоемкостью и для воды он действительно велик: чтобы нагреть килограмм воды на один градус, требуется 4200 джоулей — в четыре раза выше, чем для материалов вроде дерева, камня и стекла, и в 10 раз выше, чем теплоемкость металлов.
Как «победить» столь высокую теплоемкость воды? Значительных успехов здесь добиться не удалось, однако метод предельно ясен: раз во всем виноваты упорядоченные водородные связи, надо их устранить. Для этого достаточно заставить молекулы воды структурироваться как-то по-другому, например, тянуться атомами кислорода к какому-то заряженному объекту. С этой ролью неплохо справляются белки: в достаточно концентрированных растворах они облепляются молекулами воды, которые больше не могут образовывать водородные связи. Теплоемкость в таком случае снижается почти в два раза и становится такой же, как у льда. Кстати, о льде.

Когезия: кристаллизация
Как мы уже знаем, молекулы воды любят упорядочиваться, однако за счет теплового движения их структура оказывается несколько разупорядоченной. Охлаждение способно внести порядок. «Если температуру понизить, водородные связи заставят молекулы воды практически замереть в наиболее удачном положении. Необычным фактом является то, что это для этого положения характерно сравнительно большое количество пустот между молекулами, поэтому лед занимает на 9 процентов больший объем, чем та же масса жидкой воды», — поясняет природу этого процесса профессор Юрий Николаевич Уткин, доктор химических наук, ведущий эксперт Центра энергоэффективности НИТУ «МИСиС». С одной стороны, такое свойство положительно сказывается на экосистеме: более легкий лед плавает на поверхности, а водоемы не промерзают до дна. С другой стороны, образование льда ставит под угрозу жизнь многих биологических систем, так как увеличившаяся в объеме вода может необратимо повредить клетки, которые уже не смогут восстановиться после разморозки. Из-за этого продукты из морозилки уже не настолько хороши, как в свежем виде — кристаллы льда вредят внутренней структуре тканей.
Пагубное влияние льда, к счастью, оказалось несложно победить. Причем на этой почве преуспели и природные системы, и синтетические. Первые научились создавать специальные структуры, чаще всего белковые, которые называют «антифризами». Эти крупные молекулы хитро связываются с зародышами кристаллов льда, препятствуя их дальнейшему росту. Таким образом вместо крупных кристаллов с большим объемом в системе образуется кашица из мелких кристалликов льда, которая практически не повреждает клетку. Живые организмы, использующие белковые антифризы, выживают при температурах до −30 градусов Цельсия, а жуки Upis Ceramboides и вовсе выдерживают морозы до −60 градусов благодаря небелковым антифризам.
В промышленности же с замерзанием воды борются проще — добавляя в систему так называемые криопротекторы, образующие водородные связи с водой и препятствующие ее замерзанию. К этим веществам относятся глицерин, этанол, полиэтиленгликоль и другие. Эти же агенты используют и при исследовании биологических препаратов, которые требуется заморозить, но сохранить при этом в максимально близком к «живому» состоянию виде. Недавно оказалось, что и красители могут служить в качестве криопротекторов. Например, хорошо известный сафранин О по своим свойствам схож с белковыми антифризами, хотя и имеет значительно меньший размер молекул.
Когезия: вязкость
Продолжая наблюдать за необычными свойствами, следующими из сильной когезии молекул воды, надо упомянуть и вязкость. Этот параметр, свойственный любым жидкостям и газам, отвечает за то, насколько сильно слои одного и того же вещества «трутся» друг о друга. Если точнее, вязкость определяет интенсивность обмена импульсом между молекулами. Сильно вязкие системы — мед, или кетчуп, например — текут медленно и неохотно, тогда как вещества с малой вязкостью — бензин или ацетон — растекаются быстро и при меньшем внешнем воздействии.
Значительная вязкость воды является главным виновником того, что под водой практически невозможно серьезно разогнаться, а для прокачки жидкости по трубам требуются мощные насосы. Самое обидное, что бороться с вязкостью путем устранения водородных связей не получается: когда молекулы воды упорядочиваются, их вязкость становится еще больше за счет тех же сил, что вызывают это упорядочение. Однако проблему вязкого сопротивления удалось вполне успешно атаковать не со стороны самой воды, а со стороны тела, движущегося сквозь нее. Для этого вспомним об адгезии и взаимодействии воды с другими телами.

Адгезия: прилипание
Если когезия — это притяжение молекул воды друг к другу, то адгезия — это их притяжение к сторонним телам, например, стенкам сосудов. Тут важно вспомнить, что вода ко всему прочему является полярной жидкостью, то есть каждая ее молекула представляет собой диполь — частицу, у которой один конец заряжен чуть более положительно, а другой — чуть более отрицательно. Благодаря такой структуре вода в целом остается электронейтральной, но ее молекулы способны взаимодействовать, например, со стенками сосуда. Объясняется это тем, что большинство поверхностей, погруженных в полярную жидкость, оказывается хоть немного, но заряженной.
Адгезия молекул воды к стенкам влечет за собой много последствий, одно из которых известно под названием «гидродинамическое условие прилипания». Оно выражается в том, что при течении воды вдоль большинства поверхностей ближайший к стенке слой «прилипает», поэтому скорость в нем нулевая. За счет вязкости этот слой сильно тормозит следующий и так далее. В итоге максимальная скорость будет наблюдаться в центре трубы или канала. Казалось бы, ничего страшного в этом нет, и это правда, пока речь идет о крупных трубах — водопроводных, например. Если же собрать устройство с каналами толщиной в несколько микрон, то в них вязкое сопротивление окажется настолько велико, что обычные насосы уже не смогут прокачать воду через тонкие трубки. Такая проблема существует в микрофлюидике — разделе науки о миниатюрных устройствах для управления жидкостями, пузырьками и каплями на микромасштабах. Специальные микрофлюидные приборы чем-то похожи на электронные чипы, только в них вместо проводов для электричества проложено множество каналов для жидкости. Такая «лаборатория-на-чипе» позволяет производить десяток биологических анализов в устройстве размером с наручные часы.
Очевидно, что миниатюризация в рамках микрофлюидики не предполагает наличие огромного насоса для прокачки жидкости, поэтому с вязким сопротивлением воды приходиться справляться. На данный момент существует два основных способа, как это сделать: во-первых, можно устранить прилипание воды на стенке, что существенно увеличит скорость течения. Для этого используют поверхность, которая слабо взаимодействует с молекулами воды, то есть гидрофобный материал. Однако первые же эксперименты показали, что обычная химическая гидрофобность дает лишь очень слабый эффект в снижение вязкого сопротивления. Следующим шагом стало изобретение супергидрофобных поверхностей, обладающих необычным рельефом и способностью удерживать в нем пузырьки воздуха. Поскольку на границе «жидкость-газ» прилипание отсутствует, вода очень быстро скользит вдоль таких поверхностей. Эффект особенно заметен в случае микроканалов, однако попытки сделать более крупное устройство с супергидрофобными стенками (подводную лодку, например) пока не увенчались особыми успехами.
Вторым способом устранения вязкого сопротивление является отказ от традиционных насосов для прокачки жидкости за счет перепада давления. Вместо этого можно заставить воду течь под действием электрического поля, правда, для этого необходимо добавить в систему электролит (например соль), а стенки — зарядить. Такое течение называется электроосмотическим и характеризуется тем, что профиль скорости жидкости оказывает плоским, без максимума в центре канала. Это очень удобно, если в системе есть требование к равномерной прокачке жидкости по микроканалу.

Адгезия: поверхностное натяжение
Раз мы вспомнили об адгезии воды и гидрофобных поверхностях, нельзя не упомянуть о смачивании и капиллярности. Эти свойства определяют, как ведет себя поверхность жидкости, а также ее капли и пленки на твердых телах, внутри капилляров, пор и так далее. Вода и здесь продолжает держать марку в качестве «самой-самой»: благодаря огромной энергии когезии велико и поверхностное натяжение, которое, например, отвечает за форму дождевых капель и позволяет водомеркам бегать по воде как по твердому основанию. Само натяжение возникает из-за того, что каждой молекуле воды выгоднее находиться в объеме, в окружении соседей, поэтому все молекулы одинаково стремятся покинуть поверхность, то есть максимально сократить ее площадь. Поэтому мы не видим капель в форме кубика: шар всегда имеет меньшую площадь при том же объеме.
Если добавить к поверхностному натяжению взаимодействие с твердыми телами, мы окунемся в богатый мир смачивания: здесь и идеально круглые капли на листке лотоса, и поднятие воды по тонким капиллярам, и пропитка пористых тел (мочалки, например). А еще интереснее посмотреть, как всеми этими эффектами можно управлять, так как поверхностное натяжение оказалось одним из самых «податливых» свойств воды. Самый известный бытовой пример — добавить к воде поверхностно-активное вещество, например мыло. В этом случае поверхность жидкости окажется стабилизирована, а натяжение значительно снизится. Попробуйте выдуть пузырь из чистой воды — не тут-то было, а из мыльной — пожалуйста: большая площадь поверхности уже не помеха. Можно провести другой эксперимент: посыпать воду молотым перцем и кинуть в нее кубик льда. За счет разницы температур возникнет перепад поверхностного натяжения, и перчинки поплывут в сторону кубика.
Снова вернемся к гидрофобным и супергидрофобным поверхностям: поскольку вода их очень не любит, она стремится максимально сократить площадь контакта с ними. Если каплю воды посадить на такую поверхность, мы увидим почти идеальный шар, который едва касается поверхности. Такие шарики очень легко заставить кататься, поэтому супергидрофобными поверхностями в основном интересуются для создания водоотталкивающих и антиобледенительных покрытий. Природа тоже давно их использует: лист лотоса, ножка водомерки, кожа акулы — вот лишь некоторые примеры. Гидрофобные поверхности оказались удачным решением и старых бытовых проблем: протекающего носика заварочного чайника, например. Если его снаружи покрыть гидрофобным материалом, заварка всегда будет литься только в чашку.
Встречаются и совсем необычные эффекты управления поверхностным натяжением и смачиванием, например капли Ляйденфроста. Они образуются, если воду накапать на очень сильно нагретую поверхность: в этом случае между каплей воды и твердым телом возникает прослойка пара, поэтому капля свободно летает над поверхностью. Кстати, аналогичный эффект очень вредит промышленным водонагревателям: если их мощность слишком велика, на поверхности нагревателя образуется прослойка пара, которая блокирует теплообмен и приводит к перегреву устройства. В качестве других примеров необычных капиллярных явлений можно назвать эффекты, возникающие в отсутствие гравитации (например на орбите). Именно ими объясняются огромные капли воды, которые нам показывают в видеорепортажах про жизнь космонавтов: без силы тяжести поверхностное натяжение остается единственным фактором, определяющим форму капли, поэтому независимо от объема жидкость стремится стать шариком. На Земле же максимальный размер идеально круглых капель — несколько миллиметров. Если размер больше, гравитация придаст капле форму лужи.
Мы вспомнили лишь некоторые из свойств воды, с которыми мы сталкиваемся в повседневной и научной жизни. Существуют и многие другие особенности и эффекты — сольватация, диэлектрическая проницаемость, осмотическое давление — которые остались за кадром. Вода была и остается одним из самых популярных объектов для изучение в современной физической химии и материаловедении и чуть ли не главным залогом существования живых организмов, и каждый из названных эффектов играет в этом свою роль.

Тарас Молотилин
nplus1.ru
Адгезия. Когезия. Смачивание и растекание жидкости
Понятие когезии и адгезии. Смачивание и растекание. Работа адгезии и когезии. Уравнение Дюпре. Краевой угол смачивания. Закон Юнга. Гидрофобные и гидрофильные поверхности
В гетерогенных системах различают межмолекулярное взаимодействие внутри фаз и между ними.
Когезия - притяжение атомов и молекул внутри отдельной фазы. Она определяет существование вещества в конденсированном состоянии и может быть обусловлена межмолекулярными и межатомными силами. Понятие адгезии, смачивания и растекания относятся к межфазным взаимодействиям.
Адгезия обеспечивает между двумя телами соединение определенной прочности благодаря физическим и химическим межмолекулярными силами. Рассмотрим характеристики когезионного процесса. Работа когезии определяется затратой энергии на обратимый процесс разрыва тела по сечению равной единице площади: Wk=2, где Wk- работа когезии; - поверхностное натяжение
Так как при разрыве образуется поверхность в две параллельные площади, то в уравнении появляется коэффициент 2. Когезия отражает межмолекулярное взаимодействие внутри гомогенной фазы, то ее можно охарактеризовать такими параметрами как энергия кристаллической решетки, внутреннее давление, летучесть, температура кипения, адгезия результат стремления системы к уменьшению поверхностной энергии. Работа адгезии характеризуется работой обратимого разрыва адгезионной связи, отнесенной к единице площади. Она измеряется в тех же единицах, что и поверхностное натяжение. Полная работа адгезии, приходящаяся на всю площадь контакта тел: Ws=WaS
Таким образом, адгезия - работа по разрыву адсорбционных сил с образованием новой поверхности в 1м2.

Чтобы получить соотношение между работой адгезии и поверхностным натяжением взаимодействующих компонентов, представим себе две конденсированные фазы 2 и 3, имеющие поверхность на границе с воздухом 1, равную единице площади (рис. 2.4.1.1).
Будем считать, что фазы взаимно нерастворимы. При совмещении этих поверхностей, т.е. при нанесении одного вещества на другое происходит явление адгезии, т.к. система стала двухфазной, то появляется межфазное натяжение 23. В результате первоначальная энергия Гиббса системы снижается на величину, равную работе адгезии:
 G + Wa=0, Wa= -
G + Wa=0, Wa= -  G.
G.
Изменение энергии Гиббса системы в процессе адгезии:
Gнач.= 31 + 21;
Gкон = 23;
 ;
;
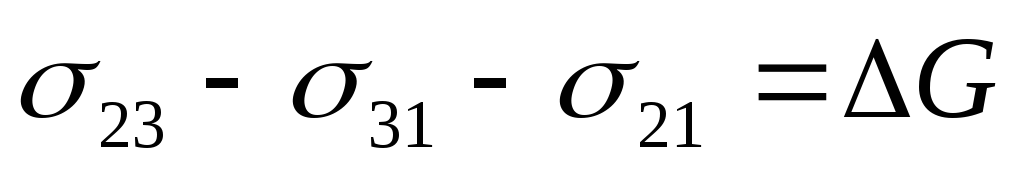 .
.
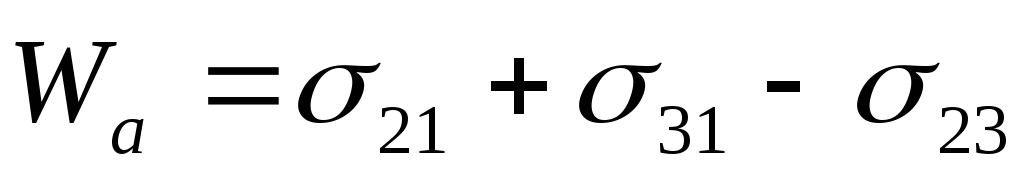 - уравнение Дюпре.
- уравнение Дюпре.
Оно отражает закон сохранения энергии при адгезии. Из него следует, что работа адгезии тем больше, чем больше поверхностные натяжения исходных компонентов и чем меньше конечное межфазное натяжение.
Межфазное натяжение станет равно 0, когда исчезнет межфазная поверхность, что происходит при полном растворении фаз

Учитывая, что Wk=2, и умножая правую часть на дробь 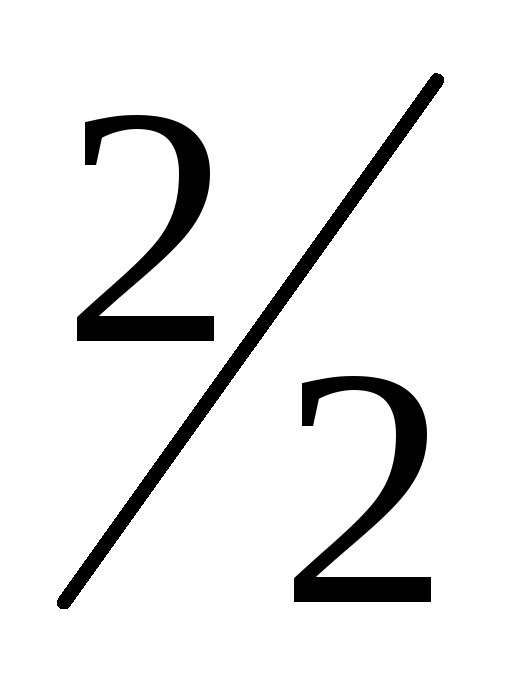 , получим:
, получим:
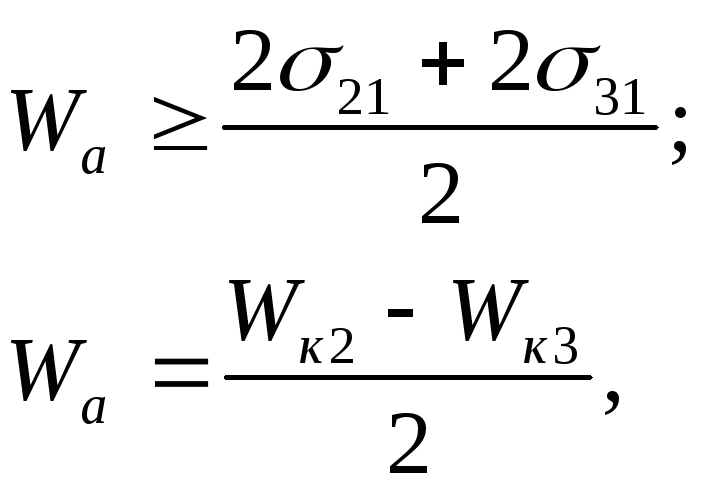
где Wk2, Wk3- работа когезии фаз 2 и 3.
Таким образом, условие растворения состоит в том, что работа адгезии между взаимодействующими телами должна быть равна или больше среднего значения суммы работ когезии. От работы когезии надо отличать адгезионную прочность Wп.
Wп– работа, затраченная на разрушение адгезионного соединения. Эта величина отличается тем, что в нее входит как работа разрыва межмолекулярных связей Wa, так и работа, затраченная на деформацию компонентов адгезионного соединения Wдеф:
Wп = Wa + Wдеф.
Чем прочнее адгезионное соединение, тем большей деформации будут подвергаться компоненты системы в процессе его разрушения. Работа деформации может превышать обратимую работу адгезии в несколько раз.
Смачивание - поверхностное явление, заключающееся во взаимодействии жидкого с твердым или другим жидким телом при наличии одновременного контакта трех несмешивающихся фаз, одна из которых обычно является газом.
Степень смачиваемости характеризуется безразмерной величиной косинуса краевого угла смачивания или просто краевого угла. При наличии капли жидкости на поверхности жидкой или твердой фазы наблюдаются два процесса при условии, что фазы взаимно нерастворимы.
Жидкость остается на поверхности другой фазы в виде капли.
Капля растекается по поверхности.
На рис. 2.4.1.2 показана капля на поверхности твердого тела в условиях равновесия.
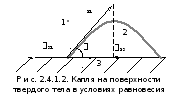
Поверхностная энергия твердого тела, стремясь к уменьшению, растягивает каплю по поверхности и равна 31. Межфазная энергия на границе твердое тело - жидкость стремится сжать каплю, т.е. поверхностная энергия уменьшается за счет уменьшения площади поверхности. Растеканию препятствуют когезионные силы, действующие внутри капли. Действие когезионных сил направлено от границы между жидкой, твердой и газообразной фазами по касательной к сферической поверхности капли и равно 21. Угол (тетта), образованный касательной к межфазным поверхностям, ограничивающим смачивающую жидкость, имеет вершину на границе раздела трех фаз и называется краевым углом смачиваемости. При равновесии устанавливается следующее соотношение
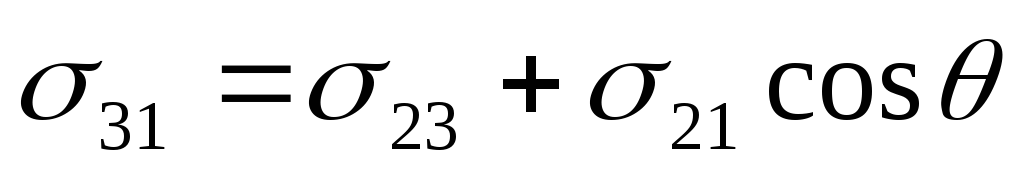 - закон Юнга.
- закон Юнга.
Отсюда вытекает количественная характеристика смачивания как косинус краевого угла смачивания 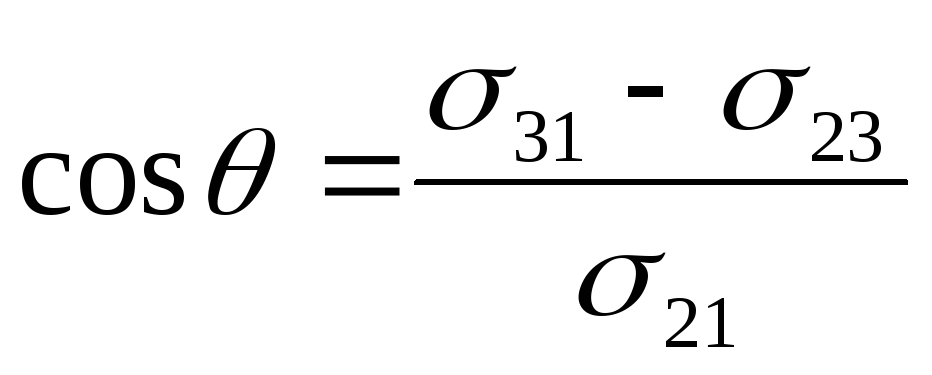 . Чем меньше краевой угол смачивания и, соответственно, чем большеcos , тем лучше смачивание.
. Чем меньше краевой угол смачивания и, соответственно, чем большеcos , тем лучше смачивание.
Если cos > 0, то поверхность хорошо смачивается этой жидкостью, если cos < 0, то жидкость плохо смачивает это тело (кварц – вода – воздух: угол = 0; «тефлон – вода – воздух»: угол = 1080). С точки зрения смачиваемости различают гидрофильные и гидрофобные поверхности.
Если 0< угол <90, то поверхность гидрофильная, если краевой угол смачиваемости >90, то поверхность гидрофобная. Удобная для расчета величины работы адгезии формула получается в результате сочетания формулы Дюпре и закона Юнга:
 ;
;
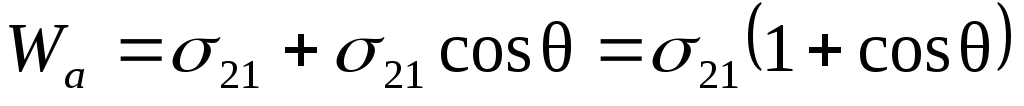 ;
;
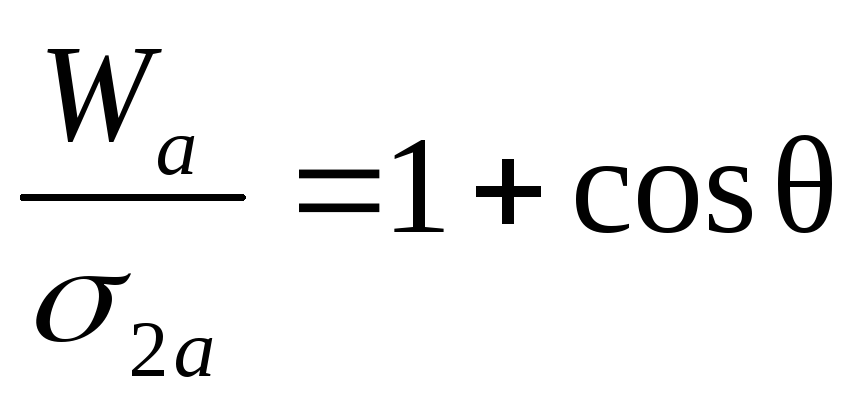 - уравнение Дюпре-Юнга.
- уравнение Дюпре-Юнга.
Из этого уравнения видна разница между явлениями адгезии и смачиваемости. Разделив обе части на 2, получим
 .
.
Так как смачивание количественно характеризуется cos , то в соответствии с уравнением оно определяется отношением работы адгезии к работе когезии для смачивающей жидкости. Различие между адгезией и смачиванием в том, что смачивание имеет место при наличии контакта трех фаз. Из последнего уравнения можно сделать следующие выводы:
1. При = 0 cos = 1, Wa=Wk.
2. При = 900 cos = 0, Wa=Wk/2.
3. При =1800 cos = -1, Wa=0.
Последнее соотношение не реализуется.
studfiles.net
когезия молекул воды - Справочник химика 21
Прн растекании пленки на достаточно большой поверхности образуется м о и о м о л е к у л я р н ы й слой, поскольку с ростом площади пленки свободная поверхностная энергия системы непрерывно уменьшается. Образующийся монослой является плотным, так как боковая когезия между молекулами в пленке (Ц7с) стягивает его и препятствует разбеганию молекул. Если покрыть поверхность воды мелкой пылью (иапример, частицами талька), а затем нанести каплю масла , то пленка, растекаясь, сдвигает частицы на периферию. Таким путем, измеряя площадь пятна, можно найти 5 пленки. Известно также число молей (молекул) вещества в пленке я , поскольку вещество нерастворимо и нелетуче, а следовательно, целиком находится в пленке. [c.90] Выделение гетерофазных примесей из воды может быть осуществлено с использованием явления избирательного смачивания, лежащего в основе процесса флотации. Сущность этого процесса заключается в действ ии молекулярных сил, способствующих слипанию взвешенных веществ с пузырьками тонкодиспергированного в воде воздуха, и образовании на поверхности воды пенного слоя, насыщенного извлекаемым веществом. Элементарный акт пенной флотации состоит в том, что при сближении в воде газового пузырька с гидрофобной поверхностью частицы, адгезия которой к воде менее когезии молекул воды, разделяющий их тонкий слой становится неустойчивым и разрывается при достижении некоторого критического значения. Прилипание пузырька к поверхности сопровождается образованием краевого угла смачивания. Вследствие кратковременности соприкосновения пузырька и частицы при их столкновении (0,001— [c.145]Явление мицеллообразования характеризуется рядом особенностей. Подобно адсорбции мицеллообразование протекает самопроизвольно, т. е. с уменьшением энергии Гиббса системы. Действительно, силы когезии между полярными молекулами воды значительно выше, чем силы взаимодействия между углеводородными цепями и водой. Поэтому любые процессы, связанные с переходом углеводородных радикалов из воды в близкую по полярности фазу, энергетически выгод-ны В очень разбавленных (ниже ККМ) растворах стремление системы к убыли свободной энергии удовлетворяется за счет перехода молекул ПАВ в поверхностный слой и выталкивания углеводородных радикалов из воды в неполярную фазу. При полном насыщении адсорбционного слоя такая возможность исчерпывается. С дальнейшим повышением концентрации ПАВ минимизация энергии Гиббса может быть реализована лишь за счет структурных изменений в объеме раствора, т. е. путем образования мицелл. При этом гидрофоб- [c.38]
Примем для простоты площадь сечения каждого цилиндра 1 м . Разрезав столб воды перпендикулярно оси цилиндра, получим 2 м поверхности раздела вода—воздух. Затраченная работа будет израсходована на преодоление сил сцепления между молекулами воды. Работу, затрачиваемую на преодоление сил сцепления между молекулами однородной жидкости и приводящую к возникновению двух новых поверхностей раздела фаз жидкость — газ с площадью каждой из них 1 м , называют работой когезии. Работа когезии для воды и масла равна соответственно [c.38]
У целлюлозы в твердом состоянии возникают регулярная система Н-связей и вследствие этого кристаллическая решетка, образуются микрофибриллы, фибриллы, ламеллы и клеточная стенка в целом. Из-за высокой энергии когезии, обусловленной Н-связями и превышающей прочность ковалентных связей в макромолекулах, у целлюлозы невозможно плавление и при нагревании происходит деструкция. Высокая энергия когезии затрудняет подбор растворителей. Выделенную из древесины целлюлозу растворяют лишь немногие растворители, которые способны преодолевать энергию ее межмолекулярного взаимодействия. Образование Н-связей между цепями целлюлозы и молекулами воды имеет важное значение при поглощении целлюлозой и древесиной гигроскопической влаги (см. 10.2). Высокая энергия Н-связей, особенно в кристаллических участках, понижает химическую реакционную способность целлюлозы, оказывая решающее влияние на скорость диффузии реагентов в целлюлозное волокно. Механические свойства технической целлюлозы и бумажного листа определяются межволоконными связями, возникающими в частности в результате образования Н-связей между макромолекулами целлюлозы на поверхностях фибрилл и волокон. [c.235]
Образование мицелл НПАВ в водных растворах определяется, в основном, силами когезии углеводородных цепей молекул и сродством гидрофильных групп к молекулам воды в случае ионных ПАВ — когезией гидрофобных групп и балансом электрических сил ионизированных групп молекулы. В водных растворах молекулы ПАВ находятся в строго ориентированном состоянии таким образом, что гидрофобные части молекул располагаются центрально друг к другу, а гидрофильные — по отношению к полярному растворителю. В этом случае возникают возможности к образованию ассоциированных соединений. Как правило, мицеллы ПАВ и других ВВ имеют большие коллоидные размеры (40-500 А°), состоят из большого числа молекул (до 200) и обладают большой объемной емкостью, т.е. имеют пустоты. Кроме того, относительно небольшие промежуточные пространства могут возникать при набухании в воде плохо растворимых макромолекул ВВ. В эти пустоты мицелл или промежуточные пространства скоплений макромолекул под влиянием сил межмолекулярного притяжения могут проникать относительно небольшие молекулы ЛВ, образуя соединения, которые очень часто стабилизируются дополнительными побочными валентными силами. Количество включаемого ЛВ зависит от размеров полого пространства мицеллы и молекулы действующего вещества. [c.393]
Мицеллообразование, подобно адсорбции, протекает самопроизвольно, так как уменьшает свободную энергию системы. Действительно, силы когезии между полярными молекулами воды значительно выше, чем силы взаимодействия между углеводородными цепями и водой. Поэтому любой процесс, связанный с переходом углеводородных радикалов молекул ПАВ в близкую по полярности фазу, энергетически выгоден. В очень разбавленных растворах [c.109]
Как говорилось, ПАВ характеризуются двойственностью свойств, связанной с асимметрией структуры их молекул, причем влияние этих противоположных асимметрично локализованных в молекуле свойств может проявиться как раздельно, так и одновременно [2]. Так, ПАВ обладают большой способностью к адсорбции, сопровождающейся ориентацией на поверхности водного раствора в результате уменьшения свободной энергии системы. Адсорбция углеводородных цепей на поверхности раздела вода — воздух вызывается большими силами когезии между молекулами воды, на поверхности же раздела углеводород — воздух адсорбция ПАВ отрицательна, за исключением случая фторуглеродных соединений, которые обладают меньшими межмолекулярными силами взаимодействия, чем углеводороды. С этими же свойствами связана способность ПАВ понижать поверхностное и межфазное натяжение растворов и вызывать эффективное эмульгирование, смачивание, диспергирование и пенообразование [2]. [c.13]
Примыкающие друг к другу цепи тесно связаны межмолекулярными водородными связями. Действительно, плотность нативного маннана обычно превышает плотность нативной целлюлозы. Вследствие такой высокой когезии маннан I нерастворим в воде и не гидратирован. Заместители в главной цепи полисахарида повышают растворимость в воде, так как такие объемистые группы нарушают правильную систему водородных связей между соседними молекулами и таким образом увеличивают доступность гидроксильных групп полисахарида для молекул воды. [c.266]
Если считать, что цепи в плёнках нормальны к поверхности, то меньшая плотность упаковки должна обусловливаться влиянием молекул воды, которое, естественно, должно сводиться к увеличению площади, занимаемой цепью в плёнке. Молекулы воды находятся в непрерывном движении вдоль поверхности, что должно создавать некоторую разрывающую силу, противодействующую тангенциальной когезии между цепями. К тому же вполне вероятно, что некоторое количество молекул воды зажато между молекулами плёнки, что также может повысить величину площади, приходящуюся на молекулу Плёнки по сравнению с площадью в сухих кристаллах. [c.75]
Поверхностное натяжение представляет собой лишь математическое понятие, эквивалентное поверхностной энергии. Конечные результаты взаимодействия частицы с водой зависят-не только от свободной поверхностной энергии частицы, но и от энергии взаимодействия молекул воды между собой. Взаимное притяжение молекул одного и того же вещества, называемое когезией, характеризуется работой когезии. Взаимное притяжение молекул двух фаз дисперсной системы на поверхности раздела называется адгезией. Притяжение, оказываемое одной фазой на другую через поверхность их раздела, требует энергии на разделение этих фаз, характеризуемой работой адгезии. [c.79]
Чем меньше работа когезии жидкости озж, а, следовательно, и поверхностное натяжение последней и, чем больше работа адгезии жидкости к твердому телу От-ж, тем лучше жидкость смачивает поверхность твердого тела и наоборот. Поэтому в процессе пропитки следует использовать жидкости с низким поверхностным натяжением. Степень смачиваемости различных тел водой зависит от полярности молекул твердого тела. Такие полярные вещества, как карбонаты, силикаты, сульфаты являются гидрофильными. [c.132]
Способность материала смачиваться водой зависит от соотношения сил взаимодействия молекул воды с материалом (адгезия) и сил взаимодействия молекул воды между собой (когезия). Если силы взаимодействия молекул воды с материалом больше сил взаимодействия молекул воды друг с другом, то вода будет хорошо смачивать такой материал. В этом случае степень смачивания будет существенно зависеть от микрогеометрии поверхности материала (ее дефектности) и наличия открытой пористости в материале. Если на поверхности материала имеются дефекты структуры, соизмеримые с диаметром молекулы воды (0,29 нм), то молекулы воды могут внедриться в объем материала и при наличии такой же по размеру пористости (дефектности) в объеме материала будут диффундировать по механизму активированной диффузии, аналогично диффузии газов. Силикатные стекла способны вполне свободно поглощать пары воды, так как размер дефектов в них находится в пределах от 0,7 до 1,7 нм. [c.26]
БОЛЬШОЕ ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ И КОГЕЗИЯ. Когезия — это сцепление молекул физического тела друг с другом под действием сил притяжения. На поверхности жидкости существует поверхностное натяжение — результат действующих между молекулами сил когезии, направленных внутрь. Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь ее поверхности бьша минимальной (в идеале — форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды. Значительная когезия, характерная для молекул воды, играет важную роль в живых клетках, а также при движении воды по сосудам ксилемы в растениях (гл. 13). Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения оно позволяет им удерживаться на воде или скользить по ее поверхности. [c.111]
Если помимо сил сцепления между отдельными частицами водяного пара (когезия) появляются более высокие силы сцепления молекул воды с твердой поверхностью (силы адгезии), то увеличивается возможность конденсации молекул водяного пара именно на поверхности такого твердого тела. Адсорбционная конденсация, т. е. образование тончайшего слоя молекул Н2О, связанных с поверхностью металла силами адсорбции, предшествует процессу капельной конденсации и может происходить при относительной влажности ниже 100%. В зависимости от состояния металлической поверхности, ири влажности немного ниже [c.174]
Прочное сцепление (когезия) между молекулами воды и прилипание (адгезия) их к гидрофильным стенкам клеток ксилемы предотвращает образование полостей (кавитацию) в находящемся в ксилеме растворе почти в любых условиях. Однако при сильном дефиците воды в отдельных трубках [c.138]
Величина сил когезии зависит от природы (полярности) жидкости. При уменьшении полярности молекул растворителя и соответствующем уменьшении сил сцепления между ними понижается выигрыш энергии, который связан с переносом углеводородного радикала из объема раствора на поверхность раздела фаз, т. е. уменьшается величина ЛШ. Поэтому с переходом от воды неводным растворителям средней полярности наблюдается понижение поверхностной активности ПАВ, а также коэффициента р. Так, для форма-мида р=1,8 и АШ=1,4 кДж/моль, для нитробензола р==1,3 и Д У=0,44 кДж/моль, в связи с чем поверхностная активность одного и того же ПАВ в этих средах оказывается сильно пониженной по сравнению с водой. Из сказанного следует, что величину р можно рассматривать как одну из характеристик молекулярных свойств растворителей. [c.23]
Таким образом, условием хорошего смачивания жидкостью твердого тела является слабое взаимодействие между ее молекулами (слабая когезия). Жидкости с малым поверхностным натяжением обычно хорошо смачивают поверхности. Например, углеводороды, поверхностное натяжение которых невелико и составляет около 20—30 мДж/м , смачивают практически любую поверхность. Вода, поверхностное натяжение которой при 20 °С составляет 72 мДж/м , смачивает лишь гетерополярные вещества (стекло, алюмосиликаты, некоторые минералы, ионные кристаллы). Ртуть (поверхностное натяжение 472 мДж/м ) практически не смачивает твердые тела. Принято называть лиофильными поверхности, хорошо смачиваемые жидкостью ( os 0 > 0), в частности гидрофильными — поверхности, сма- [c.198]
Рассмотрим подробнее, что из себя представляют адгезия и когезия. Если имеется система, состоящая из молекул однородной жидкости (например, вода), то для создания новых поверхностей раздела (например, вода — воздух) потребуется затрата работы. Эта работа, затраченная на преодоление сил сцепления [c.283]
В свое время высказывалось мнение, что если бы в таких условиях в водных столбах возникало натяжение, то в них наблюдалась бы кавитация — образование полводяными парами и потому блокирующих переме-щеиие воды снизу вверх. Убедительно показано, однако что в чистой стеклянной трубке, заполненной водой, не содержащей никаких растворенных газов, кавитации не происходит даже при натяжении в несколько сотен бар препятствует кавитации когезия — сцепление молекул воды под действием сил притяжения. В сосудах ксилемы молекулы воды связаны не только друг с другом, за счет сил когезии (сцепления), но также и со> стенками сосудов (очень гидрофильными)—за счет адгезии (прилипания) эти силы тоже препятствуют кавитации в сосудах ксилемы при обычно наблюдающемся натяжении. [c.194]
Вода — жидкость со сравнительно высокой работой когезии в силу полярности ее молекул (й кЛ НО мДж/м ) — хорошо смачивает оксиды и растекается на некоторых силикатах, но не смачивает парафин и фторорганические полимеры. [c.97]
Расчеты показали, что при сравнительно небольшой ориентации молекул в склеивающей прослойке поляризация достигает значений, которые соизмеримы с электрической составляющей сил адгезии. Даже небольшая ориентация единичных диполей создает заметный эффект поляризации, обеспечивающий высокую когезионную прочность клея, так что порядок величин электрических составляющих сил адгезии и когезии одинаков. Для воды характерный радиус ориентированного взаимодействия молекул соответствует 10 межмолекулярным расстояниям. [c.40]
Адгезия в значительной степени определяется природой функциональных групп молекул контактирующих веществ. Например, близкие значения работы адгезии к воде имеют соединения с одинаковыми функциональными группами (в двухфазных системах жидкость — жидкость) изовалериановая (94,6 мДж/м ) и гептиловая (94,8 мДж/м ) кислоты, бензол, толуол (66,6 мДж/м ). Это свидетельствует об ориентировании молекул в поверхностном слое при адгезии. На границе раздела фаз в сторону воды обращены гидрофильные группы указанных соединений, и они почти полностью обеспечивают адгезию к воде. Разность между работой адгезии к воде и работой когезии контактирующей с ней жидкости может служить мерой полярности и гидрофильности последней. Например, для неполярных гексана и толуола эта разность соответственно равна [c.86]
Водные дисперсии. Гидрофильная группа в растворе гидратируется поляризованными молекулами воды. Гидрофобная группа вытесняется из раствора силами когезии молекул воды. Согласно Мак-Бэну , Хартли и другим авторам 20-129 образование коллоида начинается уже при концентрации моющего вещества примерно 0,3—0,5 г/л. При достаточном разбавлении в растворе находятся только диссоциированные ионы, как это схематически показано на рис. 4 [c.31]
Ксилемные сосуды заполняет сплошной столб воды по мере того как вода вьгходит из сосудов, в этом столбе создается натяжение оно передается вниз по стеблю до самого корня благодаря сцеплению (когезии) молекул воды. Эти молекулы стремятся прилипнуть друг к другу, потому что они полярны и притягиваются друг к другу электричесвсими силами, а затем удерживаются вместе водородными связями (разд. [c.123]
Кроме того, они притягиваются к стенкам ксилемных сосудов, т. е. происходит их адгезия (прилипание) к ним. Сильная когезия молекул воды означает, что ее столб трудно разорвать — у него высокий предел прочности при растяжении. Растягиваюшее напряжение в клетках ксилемы приводит к генерированию силы, способной сдвигать весь водяной столб вверх по механизму объемного потока. Снизу вода поступает в ксилему из соседних клеток корня. При этом очень важно, что стенки ксилемных элементов жесткие и не спадаются при падении давления внутри, как это бывает, когда сосешь коктейль через мягкую соломинку. Жесткость стенок обеспечивается лигнином. Доказательством того, что жидкость внутри ксилемных сосудов сильно напряжена (растянута), служат суточные колебания диаметра древесных стволов, измеряемые инструментом под названием дендрограф. Минимальный диаметр отмечен днем, когда интенсивность транспирации наивысшая. Натяжение столба воды в ксилемном сосуде немного втягивает внутрь его стенки (из-за адгезии), и сочетание этих микроскопических сжатий дает фиксируемую прибором обш ую усадку ствола. [c.123]
Таким образом, молекулы типичных ПАВ, сочетая в себе одновременно полярные и неполярные свойства, являются д и ф и л ь и ы м и, т. е. проявляют сродство к воде (гид-рофильность) и к маслам (олеофильность, или липофиль-ность). Другими словами, в молекулах типичных ПАВ сочетаются две противоположные тенденции. Нерастворимый в воде углеводородный радикал стремится выйти в близкую по полярности фазу, выталкивается из воды. Этому способствует интенсивное взаимное притяжение полярных молекул воды друг к другу (силы когезии воды). Эти силы значительно больше, чем силы взаимодействия между углеводородными радикалами и молекулами воды. Полярная же группа определяет обратную тенденцию — растворимость ПАВ в воде. [c.6]
Мономолекулярная природа поверхностных пленок. Поверхностное давление [1—4]. Нерастворимое и нелетучее вещество, помещенное в небольшом количестве на поверхность жидкости с большим поверхностным натяжением (например воды), может оставаться в виде нерастекающейся капли, либо растекаться по поверхности. Необходимое и достаточное условие растекания вещества — более сильное притяжение его молекул к растворителю (воде), чем друг к другу. Иными словами, работа адгезии между веш,еством и жидкостью в этом случае превышает работу когезии самого вещества. Если это условие соблюдено, то молекулы растекающегося вещества стремятся прийти в непосредственное соприкосновение с жидкостью, обычно называемой подкладкой . Если позволяет площадь подкладки, растекающаяся жидкость образует мономолекулярный слой. Особое состояние вещества в этих пленках представляет большой интерес. [c.51]
Агрегация алканов в водном растворе обусловлена главным образом тем, что она вызывает минимальное нарушение струк-турообразования молекул воды. Главной причиной низкой растворимости неполярных соединений в воде является наличие внутренней когезии в этом растворителе. Это означает, что именно вода заставляет углеводороды образовывать ассоциаты, а не взаимное их притяжение. Не следует, однако, думать, что диполи полярных углеводородов не оказывают никакого дейст- [c.316]
Адсорбционные плёнки между двумя несмешивающимися жидкостями . При обработке данных Гаркинса и Кинга Шофилд и Райдил не обнаружили признаков заметной боковой когезии между молекулами масляной кислоты, адсорбированными на поверхности раздела вода—бензол. Единственная поправка к уравнению идеального газового состояния этих плёнок относилась к пространству, занимаемому молекулами. На границе вода—воздух та же кислота обнаруживает некоторую боковую когезию. С другой стороны Г аркинс и МакЛофлин считают, что молекулы уксусной кислоты плотнее упакованы между водой и бензолом, чем между водой и воздухом но это не значит, что боковая когезия в первом случае должна быть обязательно выше, так как на адсорбцию может влиять притяжение метильных групп уксусной кислоты к бензолу, благодаря которому при данном поверхностном авлении на поверхность выводится больше молекул. Данные по этому вопросу пока слишком скудны. Из соображений, аналогичных приведённым в 32 гл. II, напрашивается заключение, что боковая когезия между несмешивающимися жидкостями должна быть меньше, чем на границе вода—воздух, но разница должна быть меньше для кислот с более короткими цепями, так как их молекулы лежат на поверхности раздела вода — воздух плашмя и, таким образом, обладают большей свободой передвижения вместе с молекулами воды, чем молекулы с более длинными цепями, образующие плотный частокол. [c.184]
Если взять вещество с дифильными молекулами, например октиловый спирт, то для него работа когезии равна 55 эрг1см , т. е. мало отличается от бензола. Поэтому октиловый спирт, подобно бензолу, не растворяется в воде. Однако октиловый спирт, растекаясь по поверхности воды на границе раздела, ориентируется в сторону воды полярными гидроксильными группами. Поэтому, чтобы отделить молекулы октилового спирта от воды, необходимо затратить значительно большую энергию (92 эрг1см ), чем для отделения бензола. Различие можно объяснить сильным взаимодействием с водой гидроксильных групп спирта, Таким образом, величина когезий и величина адгезии дают возможность определить асимметрию силового поля молекул. Она определяется разностью между энергией адгезии по отношению к воде и энергией когезии данного вещества, определяемой неполярными группами. [c.33]
Энергия связи хемосорбированной фазы с ювенильным металлом значительно вьиие энергии связи с ним адсорбированной фазы. При хемосорбции отсутствует процесс миграции молекул ПАВ по поверхности и наблюдается эффект последействия. Маслорастворимые ингибиторы хемосорбционного действия вытесняют воду в связи с тем, что энергия связи ПАВ и металла больше или равна свяэи металла и воды. При разрьше пленки воды происходит адсорбция ПАВ на металле. Процессы хемосорбции развиваются во времени. Применительно к пластическим смазкам и ингибированным тонкопленочным покрытиям закономерности адгезии и когезии обусловлены кинетикой испарения летучих растворителей и явлениями, связанными с формированием защитной пленки. [c.173]
В последние годы все больше внимания уделяется пленкам на поверхностях раздела типа жидкость — жидкость (чаще всего типа вода—жидкость). Некоторые работы в этой интересной области были рассмотрены в предыдущих разделах, посвященных белковым и полимерным пленкам. Хатчинсон [201] описывает ряд опытов на пленках кислот с неразветвленными цепями и спиртов на поверхностях раздела вода — бензол, вода — циклогексан и вода — СнНзо. Во всех случаях спирты (гексиловый, октиловый, децнловый и додециловый) давали более конденсированные пленки, чем кислоты (масляная, капроновая, канриловая и лауриловая), с экстраполированной площадью молекулы в плотном монослое 20 А . Правило Траубе (разд. 1П-7Г) к этим системам не применимо, что указывает а непараллельную ориентацию молекул на поверхности раздела. Данные по адсорбции спиртов на поверхности раздела вода — октан описываются уравнением (П-67) или (П-133), при этом, однако, с увеличением длины цепи площадь молекулы в плотном монослое возрастает, поэтому можно предположить, что ориентация не является строго вертикальной [202]. Как правило, при данном поверхностном давлении площадь пленок спиртов и кислот на исследованных поверхностях раздела больще, чем на границе вода — воздух. (Этого, собственно, можно было ожидать, поскольку неполярный растворитель стремится уменьшить когезию между углеводородными цепями.) Однако давление, при котором происходит переход газообразной пленки в конденсированную фазу, более низкое, возможно потому, что значительная боковая адгезия между полярными группами при высоком сжатии с избытком компенсирует уменьшение когезии между углеводородными хвостами. Исследования заряженных монослоев на поверхностях раздела масло— вода вкратце обсуждаются в следующем разделе. [c.144]
Сорастворители с эфирной группой (диоксан и диметил-лизосорбит) и соединения, содержащие кислород с двойной связью (диметилсульфоксид, диметилацетамид, диметилформамид) обеспечивают более высокую растворимость в системах сорастворитель — вода. Это может быть обусловлено их относительно высокой щелочностью, понижением когезии между молекулами сорастворителя и их способностью к разрушению трехмерной структуры водьт. Повышение растворимости таких веществ как бензокаин, фенитоин и диазепам особенно ярко выражено в смесях диметилсульфоксид — вода. [c.650]
Если допустить, что формула (3.6.2) остается справедливой при минимально возможном расстоянии между телами, равном размеру молекул д, то при к = д эта формула должна дать энергию когезии и адгезии ] для тел одинаковой и разной природы соответственно. Так как они известны из опыта, то это позволяет вычислить константу взаимодействия тел одинаковой и различной природы. Следует, однако, ) итывать, что формула (3.6.1) обоснована для дисперсионной составляющей сил Ван-дер-Ваальса, поэтому в расчет следует принимать только часть энергии адгезии (когезии), пропорциональную доле Ь дисперсионных сил в общем их балансе. Для воды Ь 0,2, = 0,145 Дж/м" при 293 К и точное значение константы Ван-дер-Ваальса — Гамакера А= 5,13 10 " Дж. Из соотношения А / = ЬШ , эффективное расстояние д между двумя частями адгезионно разъединяемого столба воды будет примерно 2,3 10 ° м. Эта величина несколько меньше, чем средняя величина расстояния (К / = 3 10 °м, вычисленная из молярного объема воды У . Учетывая приближенный характер вычислений, для расчетов оценочного характера будет использована формула с1= У / Л0() При взаимодействии веществ разной природы это расстояние является средним арифметическим межмолекулярных расстояний каждого вещества, [c.619]
Механизм образования межфазных адсорбционных слоев глобулярных белков обсуждался и ранее в ряде работ. Так, Александер и Чогел [127] считают, что в нроцессе адсорбции, протекающей на границе раздела фаз, вначале образуется монослой из белка с гидрофобными участками молекул, обращенными к маслу, и гидрофильными,— к воде. Следующие молекулы, которые подходят к поверхности раздела благодаря давлению адсорбционного слоя, имеют тенденцию вытеснять с поверхности менее поверхностно-активные сегменты молекул, связанные в монослое силами когезии, вследствие чего сегменты молекул адсорбционного слоя образуют свободные петли или складки. Это приводит к тому, что увеличивается число полярных областей молекул белка на границе раздела фаз. Поверхность слоя, обращенного к воде, становится более гидрофильной, что должно приводить к образованию толстых структурированных слоев. [c.202]
В табл. П-2 приведены работы когезии и адгезии для ряда жидкостей. Эти данные показывают, что для самых разнообразных органических жидкостей работа когезии почти одинакова. Следовательно, можно предполагать, что поверхности этих жидкостей сходны по своей природе и образованы преимущественно углеводородными группировками. Такие же низкие значения характерны для работы адгезии чистых углеводородов к воде. Три последних наиболее высоких значе, ния аУдв относятся к поверхности раздела между водой и полярно-неполярным веществом. Отсюда следует вполне обоснованный вывод, что на таких поверхностях раздела полярные концы органических молекул ориентированы к воде. [c.58]
Структурные эффекты растворителя приходится учитывать, поскольку взаимодействия между молекулами растворителя включаются в термодинамические функции процесса сольватации. Эти эффекты твердо установлены только для воды, этиленгликоля и глицерина, в которых существует трехмерная сетка водородных связей, определяемая наличием по крайней мере двух Н-донорных и двух Н-акцеп-торных центров в молекуле [267], Однако для формамида подобные эффекты не обнаружены. Здесь не рассматривается вопрос о том, каким образом структурирован растворитель (ср. [35]) последнее обстоятельство влияет на термодинамику раствора через возрастание плозности энергии когезии (см. ниже). Речь идет об уникальной способности структуры этих строго определенных растворителей упорядочиваться в присутствии неполярных растворенных веществ, тогда как введение заряда в частицы растворенного вещества компенсирует это упорядочивание. Информацию о структуре растворителя можно получить путем измерения времен переориентации его молекул [267, 433]. [c.223]
В полярных апротонных растворителях некоторое упорядочивание расположения ближайших соседей обусловлено диполь-дипольны-ми взаимодействиями, однако обычно время диэлектрической релаксации в 10 — 100 раз меньше, чем в спиртах с молекулами примерно тех же размеров, а энтальпия активации ЛЯ (т ) мала (1 — 2ккал/моль) [677]. Поэтому в них не обнаруживаются структурные эффекты такого типа, как в воде. Апротонные растворители с большими дипольными моментами и с молекулами малого объема характеризуются высокой плотностью энергии когезии, и некоторые их свойства сильно зависят от температуры. Так, считают, что диметилсульфоксид и 1М,М-ди-метилформамид - сильно ассоциированные жидкости, в которых могут существовать цепочечные структуры [650, 730]. Однако время диэлектрической релаксации последнего такое же, как у трихлорэти-лена или циклогексанона, а энтальпия активации ДЯ (TD) равна всего лишь 2,7 ккал/моль [62], так что образование этих ассоциатов нельзя сопоставлять с ассоциацией, обусловленной водородными связями. [c.237]
Публикаций, посвященных систематическому исследованию этого вопроса применительно к пластмассам, очень мало. Бауэрс, Клинтон и Зисман исследовали трение найлона и трение стали по найлону в присутствии 16 специально подобранных смазочных жидкостей, что позволило им выяснить влияние различных полярных концевых групп и длины углеводородной цепи молекул смазки на этот процесс. Поверхностное натяжение всех использованных для смазки жидкостей было меньше критического поверхностного натяжения смачивания найлона, поэтому каждая жидкость хорошо растекалась на его поверхности. Среди этих жидкостей были нормальные алканы, спирты, кислоты и амины, вода, этиленгликоль, глицерин, несколько фторированных соединений и силиконы. Показано, что механизмы действия граничной смазки на пластмассах и металлах аналогичны. Наиболее эффективны те смазочные вещества, которые образуют особо прочно удерживаемые на поверхности пленки с высокой межмолекулярной когезией составляющих их молекул. Снижение трения между поверхностями найлона затруднено тем, что адсорбционно-активные участки (амидные группы) на его поверхности слишком далеко отстоят друг от друга и образование достаточно плотной смазочной пленки невозможно. При комбинации сталь —найлон действие смазки более эффективно, так как на поверхности стали может образовываться более плотная пленка. [c.320]
chem21.info
Что такое когезия? | New-Best.com Самый простой поиск ответов на наилучшие вопросы
Когезия (от лат. cohaesus - связанный, сцепленный), сцепление молекул (атомов, ионов) физического тела под действием сил притяжения. Это силы межмолекулярного взаимодействия, водородной связи и (либо) хим связи. Они определяют совокупа физических и физико-химических параметров вещества: агрегатное состояние, летучесть, растворимость, механические характеристики и т.д.
Интенсивность межмолекулярного и межатомного взаимодействия (а, как следует, силы когезии) резко убывает с расстоянием. Более сильна когезия в жестких телах и жидкостях, т.е. в конденсированных фазах, где расстояние меж молекулами (атомами, ионами) малы - порядка нескольких атомов.
В газах средние расстояния меж молекулами значительны по сопоставлению с их размерами, и потому когезия в их малозначительна.
Работой когезии именуют свободную энергию разделения тела на части и удаления их на такое расстояние, когда нарушается целостность тела. Работу когезии Wc определяют как работу обратимого изотермического разрушения тела: Wc=2γ, где γ - удельная поверхностная энергия (для жестких тел) либо поверхностное натяжение (для жидкостей).
Соотношение Wc и работы адгезии Wa, характеризующей сцепление разнородных тел (адгезия), служит для определения возможности жидкостей смачивать твердые тела: при WaWc растекание воды по поверхности твердого тела. Обширно употребляется также понятие плотности энергии когезии Eс, которую отождествляют с внутренней энергией испарения (либо сублимации) Uисп, отнесенной к молярному объему вещества Vт: Fc=Uисп/Vm. По значениям Ес есть возможность высчитать параметр растворимости Гильдебранда: Ec=σ2 (растворимость).
Для низкомолекулярных соединений энергию когезии рассматривают как излишек возможной энергии воды над возможной энергией пара, численно равный внутренней энергии испарения Е при давлении р и температуре Т:
E=-ΔUисп=р(Vг-Vж)-ΔHисп, (1)
где ΔHисп - энтальпия испарения, индексы «г» и «ж» означают газообразное и жидкое состояния вещества соответственно.
При Vг>>Vж и при критериях, когда пар ведет себя как безупречный газ, справедливо соотношение:
E=RT-ΔHисп, (2)
где R - газовая неизменная.
Значения Е и Ес определяют экспериментально по данным калориметрии; употребляют также эмпирическое соотношение Гильдебранда: ΔHисп=0,02Т2ксп+27,3Ткип-2950. Приближенные расчеты Ес основаны на предположении об аддитивности вкладов в плотность энергии когезии энергий хим связей, соединяющих атомы (инкрементов) ΔЕi: когезия низкомолекулярных веществ связана с их агрегатным состоянием Ec=∑iΔEi, и служит для оценки параметров (термодинамических, механических и др.).
Когезионные свойства низкомолекулярных жидкостей и жестких тел чувствительны к их хим природе. Так, введение в молекулы углеводородов атомов галогенов приводит к повышению Ес от 8-25 до 10-44 кДж/моль, азота - до 14-42 кДж/моль, серы - до 12-52 кДж/моль.
При внедрении гидроксильных, карбонильных и карбоксильных групп Ес возрастает соответственно до 20-60, 11-30 и 22-35 кДж/моль. При всем этом подобно меняются характеристики веществ (температуры кипения, плавления и сублимации, вязкость, диэлектрическая проницаемость, поверхностное натяжение и др.).
Для высокомолекулярных соединений понятие ΔHисп лишено физического смысла и соотношение (2) не применимо.
На практике обычно параметр растворимости полимера σВМС принимают равным параметру растворимости низкомолекулярной воды, которая является для полимера наилучшим растворителем из всех имеющихся (о растворимости полимера судят по объемному набуханию либо характеристической вязкости раствора).
В случаях, в том случае известна структурная формула циклического составного (либо мономерного) звена макромолекулы, есть возможность высчитать Ес, используя способ инкрементов. Понятно около 10 наборов значений ΔEi позволяющих обеспечить не плохое совпадение с экспериментальными данными (расхождение не превосходит 5-10%). Точность расчета возрастает, в том случае учитывать свободный объем полимера. Таковой подход справедлив и для энергии когезии Еsc частей макромолекул. Отысканные когезионные свойства употребляют для корреляции с механической прочностью, температурами плавления и стеклования, чертами растворимости, набухания, смачиваемости, сопоставимости и др. параметров полимерных материалов, принципиальных при их переработке и практического использовании.
Экспериментальные данные подтверждают связь когезионньгх черт полимеров с их хим природой и строением. Так, в ряду полиолефины, полиамиды, полиакрилаты, полиарилаты, полигетероарилены Ес возрастает от 9-25 до 40-100, 16-130, 100-160 и 90-200 кДж/моль соответственно, Еsc меняется от 15-500 до 200-700, 90-2100, 250-10000 и 550-15000 кДж/моль. Для полипептидов, отличающихся большой молекулярной массой и постоянным строением молекул, Ес добивается 350, а Еsc - 50000-70000 кДж/моль.
Предстоящее углубление представлений о когезии подразумевает рассмотрение отдельных частей плотности энергии когезии (параметра растворимости), обусловленных разными межмолекулярными взаимодействиями. Обычно выделяют составляющие, связанные с диполь-дипольным (полярным) взаимодействием (σр), дисперсионным взаимодействием (σd) и водородной связью (σН). Общее (суммарное) значение параметра растворимости σ∑ определяется соотношением: σ2∑=σ2p+σ2d+σ2H.
Для воды значение σ∑ определяется в главном наличием водородной связи и диполь-дипольным взаимодействием (σН=34,2, σр=31,3, σd=12,3 МДж0,5/м1,5).
Для углеводородных жидкостей с полярными галогени азотсодержащими молекулами σр соответственно в 2 и 5-10 раз больше, чем для незамещенных углеводородов.
Для технического углерода σd=21,1, σр=12,3, σН=11,2 МДж0,5/м1,5.
Для полимеров отдельные составляющие σ∑ выделить сложнее; по-видимому, из-за огромных размеров макромолекул нивелируются различия в межмолекулярных взаимодействиях многофункциональных групп.
Первоисточники:
Дополнительно на New-Best.com:
Источник материала Интернет-сайт www.genon.ru
new-best.com
Процессы адгезии и когезии
Адгезия. Когезия. Смачивание и растекание жидкости
Понятие когезии и адгезии. Смачивание и растекание. Работа адгезии и когезии. Уравнение Дюпре. Краевой угол смачивания. Закон Юнга. Гидрофобные и гидрофильные поверхности
В гетерогенных системах различают межмолекулярное взаимодействие внутри фаз и между ними.
Когезия - притяжение атомов и молекул внутри отдельной фазы . Она определяет существование вещества в конденсированном состоянии и может быть обусловлена межмолекулярными и межатомными силами. Понятие адгезии , смачивания и растекания относятся к межфазным взаимодействиям.
Адгезия обеспечивает между двумя телами соединение определенной прочности благодаря физическим и химическим межмолекулярными силами. Рассмотрим характеристики когезионного процесса. Работа когезии определяется затратой энергии на обратимый процесс разрыва тела по сечению равной единице площади: Wk =2 × s , где Wk - работа когезии; s- поверхностное натяжение
Так как при разрыве образуется поверхность в две параллельные площади, то в уравнении появляется коэффициент 2. Когезия отражает межмолекулярное взаимодействие внутри гомогенной фазы, то ее можно охарактеризовать такими параметрами как энергия кристаллической решетки, внутреннее давление, летучесть, температура кипения, адгезия результат стремления системы к уменьшению поверхностной энергии. Работа адгезии характеризуется работой обратимого разрыва адгезионной связи, отнесенной к единице площади. Она измеряется в тех же единицах, что и поверхностное натяжение. Полная работа адгезии, приходящаяся на всю площадь контакта тел: Ws = Wa S
Таким образом, адгезия - работа по разрыву адсорбционных сил с образованием новой поверхности в 1м2 .

Чтобы получить соотношение между работой адгезии и поверхностным натяжением взаимодействующих компонентов, представим себе две конденсированные фазы 2 и 3, имеющие поверхность на границе с воздухом 1, равную единице площади (рис. 2.4.1.1).
Будем считать, что фазы взаимно нерастворимы. При совмещении этих поверхностей, т.е. при нанесении одного вещества на другое происходит явление адгезии, т.к. система стала двухфазной, то появляется межфазное натяжение s23 . В результате первоначальная энергия Гиббса системы снижается на величину, равную работе адгезии:
 G + Wa =0, Wa = -
G + Wa =0, Wa = -  G .
G .
Изменение энергии Гиббса системы в процессе адгезии:
G нач. = s 31 + s 21 ;
Gкон = s23 ;
 ;
;  .
.  - уравнение Дюпре.
- уравнение Дюпре. Оно отражает закон сохранения энергии при адгезии. Из него следует, что работа адгезии тем больше, чем больше поверхностные натяжения исходных компонентов и чем меньше конечное межфазное натяжение.
Межфазное натяжение станет равно 0, когда исчезнет межфазная поверхность, что происходит при полном растворении фаз

Учитывая, что Wk =2 s , и умножая правую часть на дробь
 , получим:
, получим: 
где Wk 2, Wk 3 - работа когезии фаз 2 и 3.
Таким образом, условие растворения состоит в том, что работа адгезии между взаимодействующими телами должна быть равна или больше среднего значения суммы работ когезии. От работы когезии надо отличать адгезионную прочность W п .
W п – работа, затраченная на разрушение адгезионного соединения . Эта величина отличается тем, что в нее входит как работа разрыва межмолекулярных связей Wa , так и работа, затраченная на деформацию компонентов адгезионного соединения W деф :
W п = Wa + W деф .
Чем прочнее адгезионное соединение, тем большей деформации будут подвергаться компоненты системы в процессе его разрушения. Работа деформации может превышать обратимую работу адгезии в несколько раз.
Смачивание - поверхностное явление, заключающееся во взаимодействии жидкого с твердым или другим жидким телом при наличии одновременного контакта трех несмешивающихся фаз, одна из которых обычно является газом.
Степень смачиваемости характеризуется безразмерной величиной косинуса краевого угла смачивания или просто краевого угла. При наличии капли жидкости на поверхности жидкой или твердой фазы наблюдаются два процесса при условии, что фазы взаимно нерастворимы.
1. Жидкость остается на поверхности другой фазы в виде капли.
2. Капля растекается по поверхности.
На рис. 2.4.1.2 показана капля на поверхности твердого тела в условиях равновесия.

Поверхностная энергия твердого тела, стремясь к уменьшению, растягивает каплю по поверхности и равна s31 . Межфазная энергия на границе твердое тело - жидкость стремится сжать каплю, т.е. поверхностная энергия уменьшается за счет уменьшения площади поверхности. Растеканию препятствуют когезионные силы, действующие внутри капли. Действие когезионных сил направлено от границы между жидкой, твердой и газообразной фазами по касательной к сферической поверхности капли и равно s21 . Угол q (тетта), образованный касательной к межфазным поверхностям, ограничивающим смачивающую жидкость, имеет вершину на границе раздела трех фаз и называется краевым углом смачиваемости . При равновесии устанавливается следующее соотношение
 - закон Юнга .
- закон Юнга . Отсюда вытекает количественная характеристика смачивания как косинус краевого угла смачивания
 . Чем меньше краевой угол смачивания и, соответственно, чем больше cos q, тем лучше смачивание.
. Чем меньше краевой угол смачивания и, соответственно, чем больше cos q, тем лучше смачивание. Если cos q > 0, то поверхность хорошо смачивается этой жидкостью, если cos q < 0, то жидкость плохо смачивает это тело (кварц – вода – воздух: угол q = 0; «тефлон – вода – воздух»: угол q = 1080 ). С точки зрения смачиваемости различают гидрофильные и гидрофобные поверхности.
Если 0< угол q<90, то поверхность гидрофильная, если краевой угол смачиваемости q>90, то поверхность гидрофобная. Удобная для расчета величины работы адгезии формула получается в результате сочетания формулы Дюпре и закона Юнга:
 ;
;
 ;
;
 - уравнение Дюпре-Юнга.
- уравнение Дюпре-Юнга.
Из этого уравнения видна разница между явлениями адгезии и смачиваемости. Разделив обе части на 2, получим
 .
.
Так как смачивание количественно характеризуется cos q, то в соответствии с уравнением оно определяется отношением работы адгезии к работе когезии для смачивающей жидкости. Различие между адгезией и смачиванием в том, что смачивание имеет место при наличии контакта трех фаз. Из последнего уравнения можно сделать следующие выводы:
1. При q = 0 cos Q = 1, Wa = Wk .
2. При q = 900 cos q = 0, Wa = Wk /2 .
3. При q =1800 cos q = -1, Wa =0 .
Последнее соотношение не реализуется.
Коэффициент растекания по Гаркинсу. Условие растекания и смачивания. Эффект Марангони. Правило Антонова
Рассмотрим условие растекания жидкости 2 по поверхности 3. Это условие можно получить из закона Юнга, приняв, что процесс проходит при q < 0. Тогда s31 ³ s23 + s21 .
При этом условии равновесие становится невозможным и происходит растекание. Из уравнения следует, что уменьшение межфазного натяжения s23 и уменьшение поверхностного натяжения жидкости s21 способствует растеканию. Если разность s31 и s23 заменить выражением из уравнения Дюпре, что получим условие растекания в виде

Таким образом, растекание происходит в том случае, если работа адгезии превышает работу когезии растекания жидкости. Разницу между левой и правой частями неравенства называют коэффициентом растекания f или коэффициентом растекания по Гаркинсу F
 ;
;  .
. При положительном значении коэффициента растекания жидкость растекается, при отрицательном - не растекается. Растекание жидкости с меньшим поверхностным натяжением по жидкости с бớльшим поверхностным натяжением называют эффектом Марангони. Под ним понимают движение в поверхностных слоях, вызванное градиентом поверхностного натяжения. Обычно неоднородность по поверхностному натяжению обусловлена неодинаковостью состава и температуры в разных точках межфазной поверхности. Течение происходит из области малых натяжений в сторону бớльших натяжений вследствие самопроизвольного уменьшения энергии Гиббса поверхности. Если предположить, что течение следует закону Ньютона, то напряжение сдвига давления записывается таким образом:
mirznanii.com
Передвижение воды по тканям корня и по растению
Передвижение воды по тканям корня
Вода поглощается корневым волоском как пассивно (по законам осмоса), так и активно. Проникнув в корневой волосок, далее вода поступает в эндодерму. Переход воды по клеткам паренхимы корня до эндодермы осуществляется также по законам осмоса.
По Д.П. Сабинину переход воды внутри клетки и из клетки в клетку обуславливается разностью осмотического давления. В клетке всегда поддерживается такое состояние, когда в одной части протопласта А непрерывно проходят реакции синтеза, образования веществ, вследствие чего увеличивается концентрация веществ, а, следовательно, и осмотическое давление, в другой же части протопласта В происходит постоянное превращение осмотически активных веществ в осмотически неактивные (например глюкозы в крахмал), вследствие чего осмотическое давление в этой части клетки уменьшается. Возникающий ток воды и обуславливает возникновение гидростатической силы и передачу воды внутри клетки и от клетки к клетке.

Передвижение воды по тканям коря и по растению
Большая часть биоколлоидов клетки принадлежит к гидрофильным соединениям, способным к обратимым изменениям степени своей оводненности. Поглощая воду, коллоидная мицелла набухает, при отдаче же ею воды происходит отбухание. При этом в клетке развиваются весьма значительные силы, достигающие иногда сотен атмосфер.
Сила, которую нужно приложить к коллоидной системе, чтобы предотвратить поглощение ею воды, называется давлением набухания. Этому свойству биоколлоидов принадлежит важная роль в процессах поглощения протоплазмой воды, в передаче воды в вакуоль и в выделении воды клеткой.
При прорастании семян, например, обусловленном только явлением набухания, поглощение воды идет с силой до 105 килопаскаль.
Эндодерма - самый внутренний слой первичной коры, облекающий центральный цилиндр, часть эндодермы представлена тонкостенными клетками, называющимися пропускными. Именно через эти клетки вода под давлением проникает из клеток коры корня в центральный сосудистый цилиндр (ксилему).
Корневое давление зависит:
- от условий влажности почвы (чем больше гидромодуль почвы, т.е. количество воды на единицу площади, тем интенсивнее идет поглощение воды растением),
- от температуры почвы (ниже 12оС и выше 30оС поглощение воды замедляется),
- от аэрации почвы (так как при нарушении аэрации ухудшается процесс дыхания, т.е. получения энергии клеткой, а, значит, и поглощения и передачи воды).
Передвижение воды по растению
При передвижении по клеткам паренхимы корня вода обогащается минеральными веществами и в таком составе попадает в клетки ксилемы, скелетной основой которой являются сосуды и трахеиды. Сосуды, у которых нет протоплазмы, обладают высокой сосущей силой, пропорциональной осмотическому давлению содержащегося в них раствора.
Находящаяся в сосудах и трахеидах вода имеет форму тончайших нитей, которые своими верхними концами как бы подвешены к испаряющим клеткам листьев, а нижними концами упираются в паренхимные клетки корня. Для того, чтобы вода передвигалась вверх, необходимо, чтобы испаряющие клетки обладали достаточной величиной сосущей силы. В отсутствие этого условия возникает ток воды в сосудах в обратном направлении.
За счет того, что в атмосфере почти всегда содержится воды меньше, чем в растении, определяется явление отрицательного водного потенциала и, следовательно, сосущей силы атмосферы. Сосущая сила в испаряющих клетках достигает 2-4 тысяч килопаскаль.
Удерживание воды в сосудах ксилемы в виде нитей обуславливается силами когезии и адгезии.
Когезия - это прочное сцепление молекул воды между собой.
Адгезия - это прилипание молекул воды к гидрофильным стенкам клеток ксилемы.
При передвижении воды в клетках ксилемы возникает электрический заряд вдоль поверхностей раздела клеток (по мембранам). Электроосмос определяется наличием проницаемых мембран с системой пор разной величины и постоянной диффузии электролитов, которыми и является передвигаемая по ксилеме пасока (вода и растворенные в ней минеральные вещества).
Состав пасоки сильно варьирует в зависимости от вида растения и фазы его вегетации и фазы органогенеза. Пасока однолетнего травянистого растения и многолетнего древесного растения безусловно сильно отличаются друг от друга, так же как и пасока у одного и того же растения весной, летом и осенью. У ряда древесных растений человек использует весеннюю пасоку в своем питании (березовый сок, кленовый сок). Пасока, выделяющаяся при гуттации, имеет в своем составе очень мало минеральных веществ и сахаров, поскольку происходит их естественная фильтрация при прохождении пасоки через эпитему (ткань, выстилающую воздушную полость гидатоды).
biofile.ru





















