Умягчение воды катионированием. Катионирование воды
Умягчение воды катионированием
Умягчение воды катионированием – один из методов умягчения (обессоливание) воды.
Катионирование – процесс обработки воды методом ионного обмена, в результате которого происходит обмен катионов. В зависимости от вида ионов (Н+ или Na+), находящихся в объеме катионита, различают два вида катионирования: Н-катионирования и Na-катионирование.
Натрий-катионитовый метод применяют для умягчения воды с содержанием взвешенных веществ в воде не более 8 мг/л и цветностью воды не более 30 град. Жескость воды снижается при одноступенчатом натрийкатионированием до значений 0,05-0,1 мг-экв/л, при двухступенчатом – до 0,01 мг-экв/л. Регенирация Na-катионита достигается фильтрованием через него со скоростью 3-4 м/ч; 5-8% раствора NaCI.
Достоинства NaCI (поваренная соль) регенерационного раствора:
- дешевизна
- доступность
- продукты регенерации (хорошо растворимые СаCI2 и MgCI2) легко утилизируются.
Водород-катионитовый метод применяют для глубокого умягчения воды. Этот метод основан на фильтрации обрабатываемой воды через слой катионита, содержащего в качестве обменных ионов катиониты водорода.
При Н-катионировании воды значительно снижается рН фильтрата за счет кислот, образующихся в ходя процесса. Углекислый газ, выделяющийся при реакциях умягчения, можно удалить дегазацией. Регенерация Н-катионита в этом случае призводится 4-6% раствором кислоты (HCI, Н2SO4).
Катиониты
Иониты, в зернах при ионообменном процессе происходит обмен катионов, называют катионитами.
Энергия вхождения различных катионов в катионит по величине их динамической активности может быть охарактеризована для одинаковых условий следующим рядом: Na+<Mg2+<Ca2+<AI3+.
Каждый катионит обладает определенной обменной емкостью выражающейся количеством катионов, которые катионит может обменять в течение фильтроцикла. Обменную емкость катионита измеряют в грамм-эквивалентных задержанных катионов на 1 м3 катионита, находящегося в набухшем (рабочем) состоянии после пребывания в воде, т.е. в таком состоянии, в котором катионит находится в фильтре. Различают полную и рабочую обменную емкость катионита.
Полной обменной емкостью называют то количество катионов, которое может задержать 1 м3 катионита, находящегося в рабочем состоянии, до того момента, когда жесткость фильтра сравнивается с жесткостью исходной воды.
Рабочей обменной емкостью катионита называют то количество катионов, которое задерживает 1 м3 катионита до момента «проскока» в фильтрат катионов. Рабочая обменная емкость катионита зависит от вида извлекаемых из воды катионов, соотношения солей в умягчаемой воде, значения рН, высоты слоя катионита, скорости фильтрования, режима эксплуатации катионитовых фильтров, удельного расхода регенерирующего реагента и от других фильтров.
Обменную емкость, отнесенную ко всему объему катионита, загруженного в фильтр, называют емкостью поглощения.
Обессоливание воды ионным обменом
Для очистки сточных вод от анионов сильных кислот применяют технологическую схему одноступенчатого Н-катионирования и ОН-анионирования с использованием сильнокислотного катионита и слабоосновного анионита.
Для более глубокой очистки сточных вод, в том числе от солей, применяют одно- или двухступенчатое Н-катионирование на сильнокислотном катионите с последующим двухступенчатым ОН-анионированием на слабо-, а затем на сильноосновном анионите.
При содержании в сточной воде большого количества диоксида углерода и его солей происходит быстрое истощение емкости сильноосновного анионита. Для уменьшения истощения сточную воду после катионитового фильтра дегазируют в специальных дегазаторах с насадкой из колец Рашига или других аппаратах. При необходимости обеспечивать значение рН=6,7 и очистки сточной воды от анионов слабых кислот вместо анионитовых фильтров второй ступени используют фильтр смешенного действия, загружаемый смесью сильнокислотного катионита и сильноосновного анионита.
Метод обессоливания воды ионным обменом основан на последовательном фильтровании воды через Н-катионитовый, а затем ОН-НСО3-, или СО3-анионитовый фильтр. В Н-катионитовом фильтре содержащиеся в воде катионы, главным образом Са2+,Mg2+, Na+, обмениваются на водород-катионы .
В ОН-анионитовых фильтрах, которые проходит вода после Н-катионитовых, анионы образовавшихся кислот обмениваются на ионы ОН-.
Образующийся в процессе разложения гидрокарбонатов СО2 удаляется в дегазаторе.
Требования к воде, подаваемой на Н-ОН фильтры:
- взвешенные вещества – не более 8 мг/л
- общее солесодержание – до 3 г/л
- сульфаты и хлориды – до 5 мг/л
- цветность – не более 30 градусов
- окисляемость перманганатная – до 7 мг О2/л
- железо общее – не более 0,5 мг/л
- нефтепродукты – отсутствие
- свободный активный хлор – не более 1 мг/л.
Если исходная вода не отвечает данным требованиям, то необходимо провести предварительную подготовку воды.
В соответствии с необходимой глубиной обессоливания воды проектируют одно-, двух- и трехступенчатые установки, но во всех случаях для удаления из воды ионов металлов применяют сильнокислотные Н-катиониты с большой обменной способностью.
studfiles.net
КАТИОНИРОВАНИЕ ВОДЫ - это... Что такое КАТИОНИРОВАНИЕ ВОДЫ?
КАТИОНИРОВАНИЕ ВОДЫ умягчение воды, т.е. снижение ее жесткости до требуемой величины путем фильтрации через материал, называемый катионитом. Накипеобразующие катионы кальция и магния, содержащиеся в воде, обмениваются на необразующие накипи катионы натрия или водорода, содержащиеся в катионе. У катионитов, подвергнутых регенерации раствором поваренной соли, обменным катионом является катионит натрия (Nа-катионит), а у катионитов, прошедших регенерацию раствором серной или соляной кислоты - катион водорода (Н-катионит). В последнем случае из воды удаляются ионы натрия. На катионитовой водоподготовительной установке можно достичь глубокого умягчения (остаточная жесткость 0,03°-0,05°) и снижения щелочности воды.Словарь по гидрогеологии и инженерной геологии. — М.: Гостоптехиздат. Составитель: А. А. Маккавеев, редактор О. К. Ланге. 1961.
- КАРСТОВЫЙ КОЛОДЕЦ
- КАТИОННЫЙ ОБМЕН
Смотреть что такое "КАТИОНИРОВАНИЕ ВОДЫ" в других словарях:
КАТИОНИРОВАНИЕ ВОДЫ — смягчение воды, т.е. снижение ее жесткости до требуемой величины путем фильтрации через материал, называемый катионитом. Накипеобразующие катионы Са и Mg, содер. в воде, обмениваются на необразующие накипи катионы Na или Н, содер. в катионите.… … Геологическая энциклопедия
катионирование воды — vandens katijonavimas statusas T sritis chemija apibrėžtis Vandens minkštinimas katijonitais. atitikmenys: angl. cation exchange softening rus. катионирование воды … Chemijos terminų aiškinamasis žodynas
частичное катионирование воды — Умягчение воды, при котором часть воды пропускается через натрий катионитовые аппараты, а другая часть подается в котел в необработанном виде … Политехнический терминологический толковый словарь
катионирование — катионирование; отрасл. пермутирование Ионирование, имеющее целью замену катионов, находящихся в воде, на катионы, содержащиеся в катионите умягчение воды методом ионного обмена; катионирование; отрасл. пермутирование Умягчение воды путем… … Политехнический терминологический толковый словарь
натриевое катионирование — натриевое катионирование; Na катионирование; отрасл. пермутирование Катионирование воды с применением Na катионитов, при котором катионы, находящиеся в воде, замещаются ионами натрия … Политехнический терминологический толковый словарь
Na-катионирование — натриевое катионирование; Na катионирование; отрасл. пермутирование Катионирование воды с применением Na катионитов, при котором катионы, находящиеся в воде, замещаются ионами натрия … Политехнический терминологический толковый словарь
ступенчато-противоточное Н-катионирование — 3.103 ступенчато противоточное Н катионирование : Н катионирование воды последовательно через предвключенный и основной Н катионитные фильтры и подача регенерационного раствора в противоположном направлении. Источник … Словарь-справочник терминов нормативно-технической документации
Н-К-катионирование — Катионирование, заключающееся в пропуске части воды через Н каионит и другой части через К катионит (т. е. через катионит, заряженный ионами калия) с последующей нейтрализацией Н катионированной воды путем смешения ее с К катионированной водой … Политехнический терминологический толковый словарь
к-катионирование — Катионирование путем пропуска воды через калий катионит, т. е. через катионит, заряженный ионами калия … Политехнический терминологический толковый словарь
н-катионирование — Катионирование путем пропуска воды через Н катионит, т. е. катионит, заряженный ионами водорода … Политехнический терминологический толковый словарь
gidrogeology.academic.ru
Умягчение воды катионированием
Умягчение воды катионированием
Кинетика работы катионитового фильтра
Сущность ионного обмена заключается в способности ионе обменных материалов или ионитов поглощать из воды (раствора электролита) положительные или отрицательные ионы в обмен на эквивалентное количество ионов ионита. Процесс водообработки методом ионного обмена, в результате которого происходит обмен катионов, называют катионированием. Катиониты в воде разбухают, увеличиваясь в объеме. Отношение объемов одинаковых масс катионитов в набухшем и воздушно- сухом состоянии называют коэффициентом набухания. Он выражается отношением насыпных плотностей воздушно-сухого и набухшего ионитов.
Ионный состав и степень разбухания частиц ионообменной смолы являются результатом равновесия движущих сил в системе частица—вода. Наряду с небольшой долей энергии, освобождающейся вследствие гидратации функциональных групп, движущие силы возникают в основном из-за разности концентраций между внутренней набухшей частью зерна и окружающей его водой. Вода набухания в частице смолы с мобильными противоионами функциональных групп имеет концентрацию 1,5 ...6 г-экв/л. Следуя за перепадом концентрации, противоионы функциональных групп пытаются покинуть частицу смолы и протолкнуть в нее молекулы воды. Это влечет за собой смещение потенциала Доннана на граничной поверхности частицы. Миграция противоионов и набухание смолы прекращаются по достижении условий минимального запаса энергии. Внутри частицы аккумулируются те многоатомные противоионы с небольшим радиусом, которые вступают с функциональными группами в ассоциации с малым запасом энергии. Эта селективность, являющаяся основой процесса, понижается с увеличением концентрации среды и уменьшением степени «сшивания» ионообменника.
Энергия вхождения различных катионов в катионит по величине их динамической активности может быть охарактеризована для одинаковых условий следующим рядом: Na+<Nh5+<K+<Mg2+<Ca2+<Al3+<Fe3+, т. е. чем больше заряд катионов, тем больше их энергия вхождения в катионит. Для катионов одинаковой валентности энергия вхождения в катионит зависит от их гидратации; что касается энергии вхождения иона водорода в катионит, то она в 17 раз больше, чем у натрия, и в 4 раза больше, чем у кальция.
Основополагающим фактором кинетики процесса является скорость ионообмена между ионами воды и омываемой частицей смолы. Непосредственно на наружной поверхности омываемой частицы образуется неподвижная водяная пленка, толщина которой зависит от скорости потока умягчаемой воды и размеров зерна смолы. Ион Са2+ или Mg2+, который стремится попасть внутрь частицы смолы, в функциональную группу, должен диффундировать из воды через пленку, пройти через граничную поверхность частицы и внутри смолы в растворе набухания устремиться к ассоциации с функциональной группой.
У чистых смол, диффузионные пути которых не загрязнены и не заблокированы, диффузия ионов через пленку является важнейшим этапом процесса. С увеличением скорости потока уменьшается толщина водяной пленки, что облегчает прохождение через нее ионов. Повышение температуры умягчаемой воды влечет уменьшение ее вязкости, что способствует увеличению скорости диффузии и улучшению кинетики ионообмена. Другим важным фактором является отношение объема частицы к ее поверхности. С уменьшением диаметра частицы на каждую функциональную группу приходится большая поверхность обмена.
Скорость обмена катионов зависит от их диффузии к поверхности раздела катионит — вода и определяется структурой катионита. При компактной структуре катионита обмен происходит быстро и в основном на наружных поверхностях — экстрамицеллярный обмен. Однако, при этом не полностью используется сорбционная емкость катионита. При пористой структуре катионита, когда размеры капиллярных каналов больше диаметра гидратированных ионов, обмен происходит на внутренних поверхностях — интермицеллярный обмен. Скорость его меньше, а обменная способность катионита больше. Скорости реакции обмена ионов в катионитах и достижения полного равновесия весьма велики. По данным В. А. Клячко, даже в пористых катионитах реакция обмена Са2+, Mg2+, Na+ на ионы водорода достигает 90 ... 98% в течение долей минуты, а равновесие устанавливается за 5 ... 6 мин. Поэтому допустимы большие скорости фильтрования умягчаемой воды через катиониты.
Каждый катионит обладает определенной обменной емкостью (способностью) выражающейся количеством катионов, которые катионит может обменять в течение фильтроцикла. Обменную емкость катионита измеряют в грамм-эквивалентных задержанных катионов на 1 м3 катионита, находящегося в набухшем (рабочем) состоянии после пребывания в воде, т. е. в таком состоянии, в котором катионит находится в фильтре. Различают полную и рабочую обменную емкость катионита (рис. 20.11). Полной обменной емкостью называют то количество катионов кальция и магния, которое может задержать 1 м3 катионита, находящегося в рабочем состоянии, до того момента, когда жесткость фильтрата сравнивается с жесткостью исходной воды. Рабочей обменной емкостью катионита называют то количество катионов Са2^- и Mg2+, которое задерживает 1 м3 катионита до момента «проскока» в фильтрат катионов солей жесткости. Обменную емкость, отнесенную ко всему объему катионита, загруженного в фильтр, называют емкостью поглощения.

При пропуске воды сверху вниз через слой катионита происходит ее умягчение, заканчивающееся на некоторой глубине. Слой катионита, умягчающий воду, называют работающим слоем или зоной умягчения. При дальнейшем фильтровании воды верхние слои катионита истощаются и теряют обменную способность. В ионный обмен вступают нижние слои катионита и зона умягчения постепенно опускается. Через некоторое время наблюдаются три зоны: работающего, истощенного и свежего катионита. Жесткость фильтрата будет постоянной до момента совмещения нижней границы зоны умягчения с нижним слоем катионита.

Рис. 20.11. Кинетика работы катионитового фильтра (а) и графики для определения удельного расхода поваренной соли на регенерацию в зависимости от требуемой жесткости фильтрата Жф и жесткости исходной воды (б), мг-экв/л.
А и А+Б — рабочая и полная обменная способность катионита; 1 — 5,0; 2 — 7,0; 3 — 10; 4 — 15,0; 5 — 20,0 мг-экв/л
В момент совмещения начинается «проскок» катионов Са2+ и Mg2+ и увеличение остаточной жесткости, пока она не станет равной жесткости исходной воды, что свидетельствует о полном истощении катионита. Пренебрегая жесткостью умягченной воды, рабочую обменную емкость фильтра Ер, г-экв/м3, можно выразить уравнениями:
 (20.14)
(20.14) Объем загруженного в фильтр катионита в набухшем состоянии
VK=ahK. (20.15)
Преобразовав это выражение, получим формулу для определения рабочей обменной емкости катионита, г-экв/м3,
 (20.16)
(20.16) где Жи — жесткость исходной воды, г-экв/м3; Q— количество' умягченной воды, м3; а — площадь катионитового фильтра, м2; hк — высота слоя катионита, м.
Обозначив скорость фильтрования воды в катионитовом фильтре υK, количество умягченной воды можно найти по формуле
 (20.17)
(20.17) откуда длительность работы катионитового фильтра (межрегенерационный период) находим по формуле
 (20.18)
(20.18) По исчерпанию рабочей обменной способности катионита его подвергают регенерации, т. е. восстановлению обменной емкости истощенного ионообменника путем пропуска раствора кислоты или поваренной соли.
Катиониты и их свойства
вода умягчение катионирование
Катиониты по составу разделяют на минеральные и органические, которые, в свою очередь, делят на естественного и искусственного происхождения (табл. 20.2).
Минеральные катиониты естественного происхождения ха-: растеризуются малой обменной способностью и недостаточной химической стойкостью, что привело к замене их искусственными катионитами. Минеральные катиониты искусственного происхождения приготовляют смешением раствора сульфата алюминия с растворами соды и жидкого стекла.
В технологии подготовки воды широко применяют органические катиониты искусственного происхождения. Они содержат функциональные химически активные группы, водород которых способен замещаться другими катионами: четвертичные амины
Таблица 20.2
Катионнты
Nh4OH, сульфогруппу HSO3-, одновалентную фенольную группу ОН-, фосфорную группу НРО3-, карбоксильную группу СООН-. Группа HSO3- обладает сильнокислотными, а группы СООН- и ОН- слабокислотными свойствами. В зависимости от содержащейся функциональной группы катиониты делят на сильнокислотные и слабокислотные. Сильнокислотные катиониты обменивают катионы в щелочной, нейтральной и кислой средах, слабокислотные — только в щелочной среде.
Катионит может содержать несколько функциональных групп. Катиониты с однотипными функциональными группами называют монофункциональными, а имеющие несколько функциональных групп — полуфункциональными. Если подвижные ионы функциональных групп имеют положительные заряды, ионит обладает катионообменными, а если отрицательные — анионо-обменными свойствами.
mirznanii.com
Натрий-катионирование
Этот процесс применяется для умягчения воды и имеет самостоятельное значение при подготовке добавочной воды для котлов низкого давления и подпиточной воды для тепловых сетей, если исходная вода имеет малую щелочность.
Обработка воды путем натрий-катионирования заключается в фильтровании ее через слой катионита, содержащего в качестве обменных ионов катионы натрия. При этом катионит поглощает из воды ионы Са2+ и Mg2+, обусловливающие ее жесткость, а в воду переходит из катионита эквивалентное количество ионов Na+. Протекающие реакции могут быть записаны следующим образом:
2NaR + Ca(HCO3)2 CaR2 + 2NaHCO3;
2NaR + Mg(HCО3)2 MgR2 + 2 NaHCO3;
2NaR + CaCl2 CaR2 + 2NaCl;
2NaR + MgSO4 MgR2 + Na2SO4,
где СаR2, MgR2, NaR - солевые формы катионита;
R - комплекс матрицы и функциональной группы без обменного
иона; его принято считать одновалентным.
При Na – катионировании:
- жесткость воды снижается,
- анионный состав не изменяется,
- щелочность остается постоянной.
- Суммарная концентрация катионов, участвующих в этом процессе, также остается постоянной. Однако массовая концентрация катионов в растворе несколько увеличивается, поскольку эквивалентная масса двух ионов натрия выше эквивалентных масс ионов кальция и магния, поэтому солесодержание воды несколько возрастает.
Недостаток процесса: карбонатная жесткость в процессе ионного обмена переходит в бикарбонат натрия и обусловливает высокую натриевую щелочность котловой воды, так как в котле NaHCO3 превращается в соду и едкий натр. К достоинствам относятся простота метода и дешевизна реагентов.
Регенерация истощенного Na - катионита достигается фильтрованием через него раствора поваренной соли NaCl концентрацией 6-10%. Протекающие реакции можно записать в следующей форме:
СаR2 + 2NaCl 2NaR + CaCl2;
MgR2 + 2NaCl 2NaR + MgCl2.
Поваренная соль применяется для регенерации вследствие ее доступности. Получающиеся при этом хлориды кальция и магния хорошо растворимы и легко удаляются с регенерационным раствором и отмывочной водой.
Процесс умягчения воды удобно представить графически:
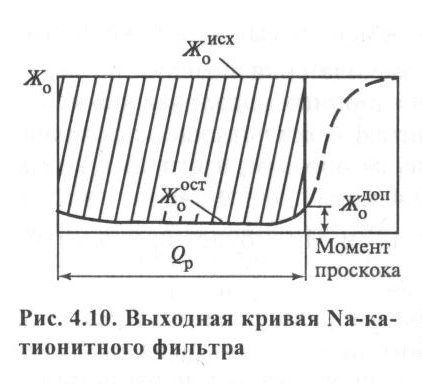
Линия ГД (Жо)соответствует величине исходной жесткости воды. Процесс умягчения, начавшись в момент контакта воды со слоем катионита, заканчивается на некоторой глубине в плоскости аобо. Слой, в котором начинается и заканчивается умягчение воды, наз. работающим слоем или зоной умягчения.
В процессе работы верхние слои зоны умягчения истощаются. На смену им вступают в работу свежие слои катионита, расположение ниже. Таким образом, зона умягчения постепенно опускается вниз. В слое катионита постепенно образуется три зоны: истощенного катионита, умягчения, свежего катионита. При включении фильтра в работу жесткость воды будет минимальной (точка А). Величина ее остается постоянной до момента совмещения нижних границ зоны умягчения а2б2 и слоя катионита а3б3. В момент совмещения границ (точка Б графика) появляется проскок катионов жесткости, поэтому в фильтрате жесткость начинает увеличиваться, пока в точке Д не станет равной жесткости исходной воды. Это означает полное истощение катионита. Для целей умягчения фильтр выводится из работы и останавливается на регенерацию в момент начала проскока жесткости в точке Б.
Площадь АБВГ наз. рабочей обменной емкостью фильтра.
Площадь БВД – остаточная обменная емкость или неиспользованная обменная емкость. Она минимальна в том случае, когда плоскости а1б1 и а2б2 горизонтальны. В действительности зона умягчения ограничивается искривленными поверхностями, при которых проскок катионов жесткости начинается раньше вследствие гидравлического перекоса. На графике этому моменту соответствует точка Б'. В результате величина использованной емкости поглощения будет меньше (площадь А Б' В' Г), а неиспользованная емкость больше.
При проведении процессов умягчения и регенерации следует учитывать действие так называемых противоионов. Противоион – это тот, который вытесняется из ионита, то есть в умягчаемой воде ион Na+, а в регенерационном растворе - ионы Са2+, Mg2+. Повышение концентрации в фильтрате иона, содержащегося в катионите (продукта реакции), согласно закону действующих масс, тормозит реакции умягчения воды или регенерации катионита. Поэтому чем выше минерализация исходной воды, тем больше концентрация ионов натрия в умягченной воде и, следовательно, выше противоионный эффект, что приводит к увеличению остаточной жесткости фильтрата. Концентрация противоиона определяется не только начальным содержанием иона Na+ в исходной воде, но и тем количеством Na+, которое будет вытеснено из катионита в процессе обмена на ионы жесткости. Этот эффект необходимо учитывать при высокой жесткости исходной воды 20...30 мг-экв/кг.
Аналогичное действие оказывают противоионы в регенерационном растворе. При пропускании через фильтр раствора NaCl в нем возрастает концентрация вытесняемых из катионита катионов Ca2+ и Mg2+ и он обедняется ионами Na+. Увеличение концентрации противоионов (Ca2+ и Mg2+) в регенерационном растворе подавляет диссоциацию истощенного катионита и ослабляет процесс ионного обмена, то есть тормозит регенерацию ионита. В результате, по мере продвижения регенерационного раствора в нижние слои, некоторое количество катионов Ca2+ и Mg2+ остается невытесненным, поэтому регенерация катионита протекает менее полно.
Меры борьбы с противоионным эффектом при регенерации:
1. Увеличить расход соли, что сильно ухудшает экономичность процесса.
2. Противоточное катионирование (фильтрование производится снизу вверх, а регенерация – сверху вниз), при котором устраняется неблагоприятное расположение в слое ионов, так как умягченная вода перед выходом из фильтра будет соприкасаться с наиболее хорошо отрегенерированными слоями катионита, благодаря чему обеспечивается более глубокое умягчение воды. Метод противоточного катионирования позволяет значительно снизить расход реагентов на регенерацию катионита, приближаясь к стехиометрическим соотношениям.
3. Применение двухступенчатого катионирования. В этом случае в фильтрах первой ступени вода умягчается до остаточной жесткости 0,05...0,2 мг-экв/кг, а во второй ступени до 0,03...0,01 мг-экв/кг. Наличие фильтров второй ступени создает своего рода барьер, препятствующий “проскоку” удаляемых катионов при случайных отклонениях в работе фильтров первой ступени (несвоевременное отключение на регенерацию, нарушение гидравлического режима, приводящее к гидравлическому перекосу и увеличенному проскоку удаляемых катионов в фильтрат). При наличии барьерных фильтров второй ступени упрощается эксплуатация установки, так как фильтры первой ступени могут отключаться на регенерацию не по проскоку ионов Са2+ и Мg2+, требующему тщательного контроля жесткости воды после этих фильтров, а по количеству воды, пропущенной через них. Небольшое повышение жесткости воды после первой ступени будет снято фильтрами второй ступени.
Эффект от применения двухступенчатого и противоточного Na-ка-тионирования в отношении уменьшения удельного расхода соли на регенерацию и снижения остаточной жесткости фильтрата практически одинаков. В зависимости от качества исходной воды и схемы ее обработки можно применять то или другое или оба эти мероприятия.
studfiles.net
Умягчение воды водород-натрий-катионированием
Умягчение воды водород-натрий-катионированием
Задачей водород-натрий-катионирования, аналогично натрий-катионированию, является умягчение воды. Главным отличием от предыдущего метода заключается в том, что в качестве обменных катионов выступают не только катионы Na+, но и катионы H+.
Происходящий процесс на водород-катионитовом фильтре представлен следующими реакциями:2Н [K] + Ca(HCO3)2 → Ca[K]2 + 2h3O + CO2,2Н [K] + Mg(HCO3)2 → Mg[K]2 + 2h3O + CO2,2H [K] + CaCl2 → Ca[K]2 + 2HCl,2Na [K] + MgCl2 → Mg[K]2 + 2HCl,2Na [K] + CaSO4 → Ca[K]2 + h3SO4,2Na [K] + MgSO4 → Mg[K]2 + h3SO4,2Na [K] + CaSiO3 → Ca[K]2 + h3SiO3,2Na [K] + MgSiO3 → Mg[K]2 + h3SiO3,2Na [K] + Na2SO4 → 2Na[K] + h3SO4,2H [K] + NaCl → Na[K] + HCl,где [K] – не растворимая матрица катионита.
Как видно из реакций, вода, проходя сквозь водород-катионитовый фильтр, приобретает кислую среду, при этом выделяется углекислота. После удаления оксида углерода (IV) в дегазаторе, на выходе получают воду с концентрацией минеральных кислот, эквивалентной концентрации хлоридов и сульфатов в исходной воде и низкой карбонатной щелочностью. В случае фильтрования воды через натрий-катионитовый фильтр щелочность воды не меняется. Смешивая фильтраты после H- и Na-катионитовых фильтров можно получать воду с различной щелочностью.
Водород-натрий-катионирование возможно реализовывать по нескольким схемам, выбор которых определяется качеством, предъявляемым к воде.
Рассмотрим их.
Параллельное H – Na-катионирование.
Применяется в водоподготовке с качеством исходной воды со средней и малой минерализацией и с содержанием:Cl- + SO42- Na+
Вода параллельно фильтруется через H-катионитовый и Na-катионитовый фильтры, после чего фильтраты смешиваются. Смешение кислого и щелочного потоков происходит в такой пропорции, что бы на выходе щелочность воды не превышала 0,4 мг-экв/л.
Для более глубокого умягчения воды с жесткостью на выходе менее 0,01 мг-экв/л, воду после дегазатора доумягчают на барьерном Na-катионитовом фильтре.
- Результатом обработки воды по данной схеме будет снижение:
- общей жесткости до 0,1 мг-экв/л;
- общей щелочности до 0,4 мг-экв/л;
- общего солесодержания;
- общей жесткости до 0,01 мг-экв/л с условием применения барьерного Na-катионитного фильтра.
Вывод на регенерацию фильтров производят по началу проскока катионов жесткости (порядка 0,5 мг-экв/л).
Последовательное H – Na-катионирование.
Применяется в водоподготовке с высокой жесткостью и повышенной минерализацией исходной воды.

Вода разделяется на два потока, один из которых проходит через H-катионитовый фильтр, после потоки смешиваются и направляются в дегазатор. В дегазаторе удаляется оксид углерода (IV). Затем вода направляется на Na-катионитовый фильтр и, в случае глубокого умягчения воды, далее на барьерный Na-катионитовый фильтр.
- Результатом обработки воды по данной схеме будет снижение:
- общей жесткости до 0,01 мг-экв/л;
- общей щелочности до 0,7 мг-экв/л;
- общего солесодержания.
Регенерация H-катионитового фильтра начинается по превышению общей жесткости после смешения потоков перед Na-катионитовыми фильтрами, которая составляет от 0,8 до 1,0 мг-экв/л, что позволяет экономить кислоту на регенерациях.
Последовательное H – Na-катионирование с «голодной» регенерацией Н-катионитового фильтра.
Применяется в водоподготовке для воды, принадлежащей к гидрокарбонатному классу (где преобладающим анионом является HCO3- ) и с солесодержанием до 3 мг/л.
Отличительной особенностью данной схемы является то, что регенерация Н-катионитного фильтра осуществляется меньшим количеством кислоты, чем при обычной регенерации. Для того, что бы процесс регенерации водород-катионитного фильтра прошел успешно, т.е. что бы все катионы жесткости были заменены на ионы водорода и удалены, необходимо затратить кислоты в 2-2,5 раза больше теоретического. В случае «голодной» регенерации расход кислоты берется равным удельному теоретическому расходу, т.е. 1 г-экв/г-экв. Для h3SO4 − 49 г/г-экв, для HCl – 36.
Такая регенерация обеспечивает перевод в Н-форму лишь верхние слои катионита, нижние же слои остаются неотрегенерированными и содержат катионы Ca (II), Mg (II) и Na (I).
В процессе фильтрации в верхних слоях катионита идут все вышеприведенные реакции, т.е. образование минеральных кислот с выделением CO2. В нижних слоях ионообмен описывается следующими реакциями:Ca/Mg[K]2 + 2HCl → 2H[K] + Ca/MgCl2,Ca/Mg[K]2 + h3SO4 → 2H[K] + Ca/MgSO4,Na[K] + HCl → H[K] + NaCl.
Находящаяся в равновесной концентрации с CO2 угольная кислота в реакцию ионообмена может вступать только тогда, когда прореагировали все сильные кислоты. Этот процесс происходит не до-конца и в самых нижних слоях катионита:Ca/Mg[K]2 + 2h3CO3 → 2H[K] + Ca/Mg(HCO3)2.
- Процесс восстановления карбонатной жесткости завершится не успевает и на выходе фильтрат имеет:
- малую карбонатную жесткость, численно равную щелочности,
- углекислоту, чья концентрация увеличена на величину снижения щелочности,
- пониженное общее солесодержание в результате удаления карбонатной жесткости.
Влияние Na+ на эффект очистки воды.
- В силу того, что ионы натрия принимают активное участие в ионообменных процессах, то его концентрация в исходной воде оказывает непосредственное влияние на качество очистки:
- при малых концентрациях общая жесткость воды на выходе из H-катионитного фильтра примерно равна некарбонатной жесткости исходной воды и на протяжении всего фильтроцикла изменяется незначительно, как и общая щелочность, равная 0,3−0,5 мг-экв/л.
- При высоких концентрациях катионов натрия в начале и конце фильтроцикла жесткость воды падает, в середине растет некарбонатная жесткость. Щелочность воды снижается вначале рабочего цикла фильтра, затем растет и в среднем составляет 0,7−0,8 мг-экв/л.

Вода поступает на H-катионитовые фильтры «голодной регенерации», т.е. регенерируемые стехиометрическим количеством кислоты, где происходит понижение карбонатной жесткости. Далее вода поступает на дегазатор для удаления оксида углерода (IV) и затем проходит одну ли две ступени Na-катионитовых фильтров, на которых устраняется некарбонатная жесткость.
В случае непостоянного качества исходной воды и невозможности строгого соблюдения технологического режима эксплуатации установок с фильтрами, работающими по схеме «голодной регенерации», что грозит возможным проскоком кислого фильтрата и колебаний щелочности, после H-водородных фильтров ставят ступень с буферными не подлежащими регенерации фильтрами.
Высота слоя катионита в таких фильтрах берется от 2 м, скорость прохождения потока – до 40 м/ч. Взрыхляющая промывка осуществляется умягченной водой, подвод кислоты для регенерации не предусмотрен.
Такая схема позволяет избежать кислых стоков и получить на выходе глубоко умягчённую воду с общей щелочностью менее 0,7 мг-экв/л.
Расчет фильтров для ВПУ.
-
Расход воды на Н- и Na-катионитовые фильтры.
QNa = Qп - QН,QН = Qп*(Щ - Щу/А1 + Щ), гдеQп − производительность ВПУ, м3/ч; QNa − производительность Na-катионитовых фильтров, м3/ч; QH − производительность H-катионитовых фильтров, м3/ч; Щу − требуемая щёлочность на выходе из установки, мг-экв/л; Щ – щелочность воды до обработки (исходной воды), мг-экв/л.
-
Объем катионита в Н- и Na-катионитовых фильтрах.
VН = 24* QН*(Ж о - СNa)/n*eН,VNa = 24* QNa*Ж о/n*eNa, гдеVН − объем катионита в H-катионитовых фильтрах, м3;VNa − объем катионита в Na-катионитовых фильтрах, м3;СNa − концентрация в исходной воде ионов натрия, мг/л;n – количество регенераций каждого фильтра за сутки, 1…3; eNa и eН − рабочие обменные емкости Na- и H-катионита, мг-экв/л. eН = aН*Eп - 0,5*qу*Ск, где aН − коэффициент эффективности, зависит от стехиометрического количества кислоты, затрачиваемого на регенерацию;Eп − паспортная емкость катионита, мг-экв/л;qу − удельный расход воды на отмывку катионита, принимается равным 4…5 м 3/ м 3 катионита в фильтре;Ск − содержание в исходной воде всех катионов, выраженное в г-экв/л;
-
Общая площадь всех катионитовых фильтров.
АН=VH/hк, м2;АNa=VNa/hк, м2;где hк − высота слоя катионита в фильтре, 2 – 2,5 м.
-
Количество фильтров.
Количество фильтров на установке ВПУ должно быть не менее двух – одна линия всегда в работе.
Статью подготовил: Руководитель ПТО OOO "CАТ" Макаров Василий А. 8-905-282-32-19
satspb.net
Водород-катионирование.
При Н-катионировании обменными ионами являются катионы водорода. В процессе фильтрования из воды поглощаются все содержащиеся в ней катионы согласно ряду селективности, то есть Са2+, Mg2+, Na+ и другие, а в воду переходит эквивалентное количество Н+ ионов. Кроме того, происходит разрушение ионами водорода бикарбонатной щелочности воды с образованием свободной углекислоты. Протекают следующие реакции:
2HR + Ca(HCO3)2 CaR2 + 2h3O + 2CO2;
2HR + Mg(HCO3)2 MgR2 + 2h3O + 2CO2;
2HR + CaCl2 CaR2 + 2HCl;
2HR + MgSO4 MgR2 + h3SO4;
HR + NaCl NaR + HCl;
2HR + Na2SO4 2NaR + h3SO4.
В результате этих реакций общая жесткость снижается до 0,01 мг-экв/кг, а карбонатная жесткость [Са(НСО3)2 и Mg(НСО3)2] полностью удаляется, вследствие чего происходит устранение щелочности воды и снижение солесодержания. В процессе Н-катионирования все катионы заменяются катионами водорода Н+, а присутствующие в исходной воде соли: сульфаты, хлориды и нитраты кальция, натрия и другие, преобразуются в свободные кислоты: серную, соляную, азотную, кремниевую… Общая кислотность фильтрата равна сумме содержащихся в воде анионов минеральных кислот SO42–, Cl–, NO3– и др. Н-катионированная вода является кислой, непригодной для питания паровых котлов, поэтому этот метод всегда сочетают с Na- катионированием или анионированием, что дает возможность нейтрализовать кислотность и снизить щелочность обработанной воды.
Вследствие селективности удержания ионов катионитом, весь слой условно можно разбить на зоны по поглощаемым катионам. Ближе к нижней границе слоя располагается зона поглощения ионов Na+, над ней - смешанная зона поглощения Mg2+ и Na+, а еще выше - зона поглощения Са2+, Mg2+. Суммарная высота этих зон определяет величину рабочей зоны катионита. Над ней располагается слой истощенного катионита, а под ней - свежего.
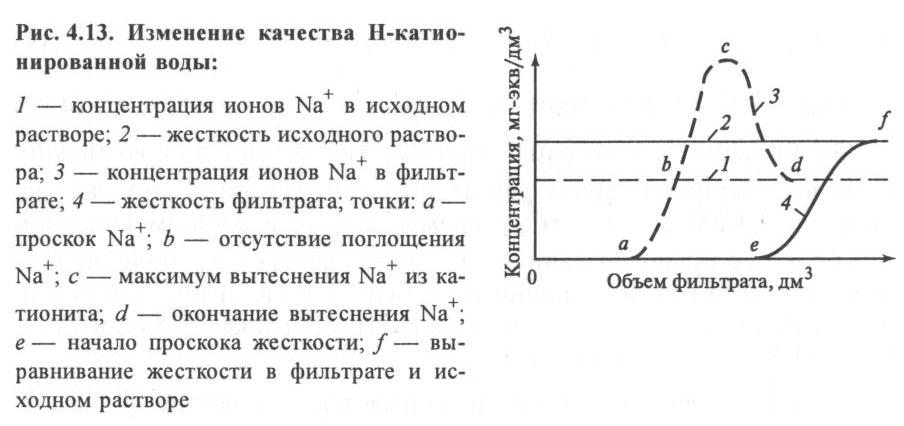
При работе Н-катионитного фильтра наблюдаются два периода. В первом происходит полное поглощение всех катионов до момента достижения зоной поглощения ионов Na+ нижней границы слоя катионита (работа до проскока Na+). В этот период кислотность фильтрата остается постоянной. Второй период начинается с проскока ионов Na+ в воду. С этого момента содержание Na+ в обработанной воде начинает возрастать, так как этот ион не может полностью улавливаться катионитом, пока не достигнет концентрации Na+ как в исходной воде. К этому моменту Н-катионит совсем прекращает поглощать Na+ из обрабатываемой воды и происходит только улавливание ионов Са2+ и Mg2+. Эти ионы Са2+ и Mg2+. наряду с обменом на ионы Н+ начинают вытеснять ранее поглощенные ионы Na+ из катионита, поэтому содержание Na+ в фильтрате становится больше его концентрации в исходной воде. Происходят одновременно процессы водород- и натрий-катионирования с постепенным переходом в Na-катионирование, так как ионы Н+ в катионите уже полностью заменены на ионы Na+, Са2+, Mg2+(точка О). Содержание натрия в фильтрате снижается по мере истощения катионита и возвращается к его концентрации в исходной воде по мере приближения проскока ионов жесткости Мg2+ (точка Р). Во втором периоде снижается кислотность фильтрата и начинает возрастать щелочность. При переходе в режим Na-катионирования щелочность восстанавливается полностью.
При умягчении воды Н-катионитные фильтры отключаются на регенерацию по проскоку ионов жесткости Са2+ и Mg2+ в фильтрат, а при химическом обессоливании - по проскоку катионов Na+, то есть при снижении кислотности фильтрата.
Эффект умягчения воды при Н-катионировании обычно столь же полный, как и при Na-катионировании. Он зависит от качества регенерации ионита, его природы и состава исходной воды. Регенерация производится 1...1,5 % раствором серной кислоты, как более дешевой и удобной по сравнению с соляной. Последняя также может применяться для регенерации (например, для вод с высоким содержанием Na+). Реакции регенерации описываются следующими уравнениями:
СаR2 + h3SO4 2HR + CaSO4;
MgR2 + h3SO4 2HR + MgSO4;
2NaR + h3SO4 2HR + Na2SO4.
При регенерации катионита соляной кислотой продуктами регенерации являются хлориды кальция, магния, натрия, хорошо растворимые в воде. При использовании серной кислоты один из продуктов регенерации сульфат кальция (СаSO4) обладает ограниченной растворимостью и способен «загипсовывать» катионит. Это обстоятельство заставляет ограничивать крепость регенерационного раствора до 1...1,5 % или осуществлять ступенчатую регенерацию: сначала 1% раствором Н2SO4, а затем, когда основная масса Са2+ и Mg2+ вытеснена и опасности гипсования уже нет, более крепким 5...6 % раствором кислоты для более полного вытеснения поглощенных катионитом ионов. Скорость пропуска регенерационного раствора выбирают также исходя из условий предотвращения кристаллизации гипса, а не диффузии при обмене ионов, как при Na-катионировании. Для сокращения времени контакта раствора кислоты с катионитом скорость фильтрования принимают 10...15 м/ч. По этой же причине, а также во избежание усиления коррозии оборудования, не допускается повышение температуры обрабатываемой воды и регенерационного раствора.
Кислотность Н-катионированной воды, то есть концентрация в ней противоиона Н+, определяется разностью между суммой всех анионов и щелочностью воды и зависит от суммарной концентрации хлоридов и сульфатов. Противоионный эффект заметно проявляется в Н-катионированной воде, которая содержит значительное количество ионов SO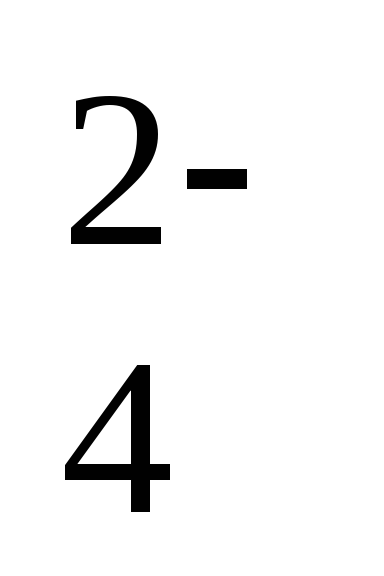 и Cl-. Чем больше некарбонатная жесткость, тем ниже рН фильтрата, тем сильнее противоионный эффект. В этом случае сильно подавляется диссоциация особенно слабокислотного катионита и уменьшается рабочая обменная емкость Н-катионита. Обменная емкость и эффект умягчения воды зависят лишь от концентрации нейтральных солей, так как бикарбонаты кальция, магния и натрия не повышают концентрацию противоиона в фильтрате. Чем больше противоионный эффект, тем больший требуется удельный расход кислоты на регенерацию для достижения заданной остаточной жесткости фильтрата. Существенно снижается расход реагента при применении противоточной регенерации или двухступенчатого Н-катионирования.
и Cl-. Чем больше некарбонатная жесткость, тем ниже рН фильтрата, тем сильнее противоионный эффект. В этом случае сильно подавляется диссоциация особенно слабокислотного катионита и уменьшается рабочая обменная емкость Н-катионита. Обменная емкость и эффект умягчения воды зависят лишь от концентрации нейтральных солей, так как бикарбонаты кальция, магния и натрия не повышают концентрацию противоиона в фильтрате. Чем больше противоионный эффект, тем больший требуется удельный расход кислоты на регенерацию для достижения заданной остаточной жесткости фильтрата. Существенно снижается расход реагента при применении противоточной регенерации или двухступенчатого Н-катионирования.
Иногда применяется «голодная регенерация» Н-катионитных фильтров. В этом случае при катионировании происходит не глубокое умягчение исходной воды, а разрушение её карбонатной щелочности без образования кислого фильтрата. Это достигается тем, что фильтры регенерируются таким количеством кислоты, которого недостаточно для вытеснения всех катионов, ранее поглощенных из воды. Это приводит к расположению в верхних частях фильтрующего слоя обменного иона Н+ водорода (отрегенерированный слой), а в нижних слоях- обменных катионов кальция и магния. В слоях, находящихся в Н+-форме протекают реакции обмена улавливаемых из воды ионов на ионы водорода, который переходит в воду с образованием сильных кислот и угольной кислоты. В ниже расположенных слоях ионы водорода сильных кислот обмениваются на ионы кальция, магния, натрия. Слабая угольная кислота, диссоциация которой подавлена в присутствии сильных кислот, значительную часть слоя проходит «транзитом» и обменивает некоторое количество ионов водорода уже в нижних слоях, обусловливая появление щелочности. С течением времени количество обменных ионов Н+ уменьшается и одновременно происходит их перемещение из вышележащих слоев в нижележащие. К моменту окончания рабочего цикла все количество введенных при регенерации ионов +
Н
оказывается израсходованным на разрушение щелочности исходной воды. В момент повышения щелочности фильтр выводится на регенерацию. Прошедшая через такой слой вода не содержит сильных кислот и имеет незначительную щелочность (Щ=0,2-0,3 мг-экв/кг).Режим «голодной регенерации» отличается от других режимов регенерации с недостатком кислоты тем, что на протяжении всего рабочего цикла обеспечивается нулевая кислотность фильтрата и минимальная щелочность. Любые другие модификации регенерации с недостатком кислоты не обеспечивают этого требования.
Такой режим применяется в схемах подготовки подпиточной воды для тепловых сетей.
studfiles.net
Натрий-катионирование - Ватера
Сущность метода
Кроме того, продукты регенерации – CaCl2, MgCl2 – хорошо растворимы в воде, в отличие,
например, от СаСО3 (регенерация карбонатом натрия (Na2CO3) или CaSO4 (регенерация сульфатом натрия (Na2SO4)).
Реакции обмена ионами (R – комплекс катионита, упрощенно называемый анионитной частью
катионита):
2NaR + Ca(HCO3)2 ↔ CaR2 + 2NaHCO3; (1)
2NaR + Mg(HCO3)2 ↔ MgR2 + 2NaHCO3; (2)
2NaR + CaCl2 ↔ CaR2 + 2NaCl; (3)
2NaR + MgSO4 ↔ MgR2 + Na2SO4; (4)
2NaR + CaSiO3 ↔ CaR2 + Na2SiO3, (5)
Уравнения реакций с солями MgCl2, CaSO4 и MgSiO3 аналогичны уравнениям (3), (4), (5) соответственно.
Замена ионов кальция и магния ионом натрия гарантирует отсутствие накипеобразований на греющих поверхностях котлов и теплообменников.
По мере пропускания воды через слой катионита количество ионов натрия, способных к обмену, уменьшается, а количество ионов кальция и магния, задержанных на смоле, возрастает, то есть катионит «истощается». Тогда его следует регенерировать – пропустить через слой катионита раствор хлорида натрия, и обменная способность катионита восстанавливается.
Процессы ионного обмена обратимы. Поэтому если в воде ионов натрия становится все больше и больше по сравнению с количеством ионов кальция и магния, то процесс поглощения ионов Ca2+ и Mg2+ замедляется, то есть все больше сдвигается в левую сторону реакций (1) – (5) и может быть изображен так:
CaR2 + 2Na+ ↔ 2NaR + Ca2+; (6)
MgR2 + 2Na+ ↔ 2NaR + Mg2+. (8)
Ионы Na+ , Ca2+ и Mg2+ названы противоионами. Это свойство катионитов имеет два следствия.
Первое. При увеличении минерализации обрабатываемой воды (увеличение идет, в основном, за счет увеличения содержания в воде натрия и в гораздо меньшей степени – калия) получение глубокоумягченной воды традиционным натрий-катионированием – даже двухступенчатым – становится все более проблематичным. Числовое выражение этого явления приведено в табл. 1.
Второе. Обеспечивается возможность регенерации катионита 5 – 10%-ным раствором хлорида натрия. Концентрация иона натрия в растворе при этом заведомо и намного больше концентрации ионов кальция и магния в катионите.
Особенности натрий-катионирования и регенерации катионита
В то же время улучшать эффективность регенерации путем увеличения концентрации регенерирующего раствора можно до определенного предела, диктуемого экономическими соображениями, которые вынуждают ограничиваться некоторым расходом раствора, то есть уменьшать объем раствора при увеличении концентрации натрий хлорида.
Это, в свою очередь, уменьшает эффективность регенерации, так как вытесненные из катионита ионы Ca2+ и Mg2+ распределяются в меньшем объеме регенерационного раствора, концентрация их увеличивается, и в качестве противоионов они в таких условиях более действенны.
Одновременно уменьшение объема раствора регенеранта снижает полноту регенерации, так как уменьшение количества этого раствора снижает его обмен в пространстве между зернами катионита – желательна трехкратная смена жидкости в этом пространстве.
Для компенсации описанного недостатка рекомендуется двухступенчатая регенерация: сначала разбавленным (2–3%-ным), затем более концентрированным (10–12%-ным) раствором хлорида натрия. Аналог такого способа регенерации – двух-ступенчатое натрий-катионирование. В фильтре второй ступени противоионов Ca2+ и Mg2+ очень мало, и они хорошо вытесняются концентрированным раствором NaCl.
Скорость фильтрования регенерационного раствора при ограниченном его расходе всегда меньше скорости фильтрования умягчаемой воды. Для того чтобы диффузия ионов Na+ внутрь зерна катионита и ионов Ca2+ и Mg2+ из зерна в раствор осуществлялась в достаточной мере, нужно время – не менее 15 мин. Этим и определяется максимальная скорость фильтрования регенерационного раствора через слой катионита – 4 – 6 м/ч (условно принимается, что фильтр пустой).
Температура, как и в большинстве химических процессов, интенсифицирует диффузию ионов, и поэтому там, где возможно, производится нагревание умягчаемой воды и регенерационного раствора хотя бы до 35 – 40°С.
Значение водородного показателя (рН) умягчаемой воды существенно влияет на обменную емкость катионита в натриевой форме. Чем ниже рН (чем больше в воде ионов Н+ ), тем больше ионов H+ участвуют в обмене с ионами Na+:
NaR + H+ ↔ HR + Na+ (9)
Ионы водорода обладают несколько большим, чем ионы натрия , сродством к катиониту, поэтому поглощенные катионитом ионы H+ плохо вытесняются ионами Na+ , то есть «законные» места ионов Na+ заняты ионами H+ . Значит, обменная емкость катионита по ионам Ca2+ и Mg2+ снижается. Как правило, при натрий-катионировании значение рН должно быть не менее 6,5 и не более 10,0 (во избежание разрушения катионита).
Допустимое качество исходной воды
Для уменьшения загрязнения катионита качество исходной воды перед катионитным фильтром должно быть в пределах норм, не более:
- содержание взвешенных примесей – 8 мг/л;
- цветность – 30 градусов платино-кобальтовой шкалы;
- содержание железа – 0,3 мг/л;
- окисляемость перманганатная – 5 мгО2/л.
Жесткость воды после натрий-катионирования
С помощью параллельноточного натрий-катионирования общую жесткость исходной воды можно уменьшить до пределов, указанных в табл. 1.
Таблица 1
|
Наименование |
Минерализация исходной воды, мг/л |
||||
|
Жесткость общая воды после натрий-катионитных фильтров: |
≤200 |
200-500 |
500-800 |
800-1200 |
>1200 |
|
I ступени, мкмоль/л |
10 |
20 |
30 |
50 |
>50 |
|
II ступени, мкмоль/л |
2-4 |
5 |
10 |
20-30 |
>30 |
Для достижения нормативных значений жесткости обработанной воды при значениях минерализации исходной воды больше указанных могут быть предусмотрены способы (отдельно или в сочетании друг с другом): противоточное фильтрование, трехступенчатое натрий-катионирование, нагрев обрабатываемой воды и регенерационного раствора реагента до температуры, допускаемой конструкцией фильтра и фильтрующим материалом, магнитная обработка воды перед натрий-катионированием, применение катионитов большой обменной емкости.
Расход хлорида натрия для регенерации катионита.
Расход хлорида натрия для регенерации катионита фильтра I ступени определяется по формуле:
Рс = f к · Нк · ЕрабNa · Qc / 1000, кг/рег., (10)
где f к – площадь фильтрования фильтра, м2 ; Нк – высота слоя катионита в фильтре, м; ЕрабNa – рабочая обменная емкость катионита, моль/м3 ; Qc – удельный расход хлорида натрия на 1 моль обменной емкости катионита, г/моль, принимается по паспортным данным производителя катионита, обычно (в зависимости от жесткости исходной воды): 100–300 г/моль – для фильтров I ступени, 300–400 – для фильтров II ступени, 90–130 – для противоточных фильтров.
www.watera.ru


















