Формула гидроксида. Гидроксид вода
Формула гидроксида в химии
Определение и формула гидроксида
Основная классификация гидроксидов основывается на их природе. Различают основные, амфотерные и кислотные гидроксиды.
Основные гидроксиды (основания, щелочи)
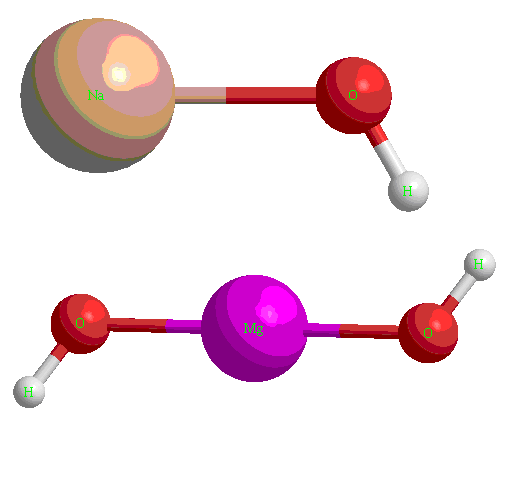
К ним относятся соединения металлов общей формулы 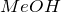 или
или 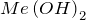 , а также раствор аммиака в воде (гидроксид аммония
, а также раствор аммиака в воде (гидроксид аммония 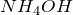 ). В данных веществах металл принимает степень окисления или
). В данных веществах металл принимает степень окисления или 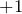 или
или 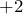 .
.
Примеры: 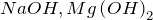
Щелочами называют гидроксиды щелочных и щелочно-земельных металлов, которые в воде они диссоциируют нацело, т.е. являются сильными электролитами.
Они проявляют типичные основные свойства реагируя с кислотными оксидами, кислотами, амфотерными соединениями (при сплавлении fus. и в растворе sol.), растворимыми солями:
![Rendered by QuickLaTeX.com \[ 2CsOH + CO_2 = Cs_2CO_3 + H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cc0221b3349a01516e6072897687d0a6_l3.png)
![Rendered by QuickLaTeX.com \[ 2NaOH + H_2SO_4 = Na_2SO_4 + 2H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-847d8c70200605d974adee04d43eed5b_l3.png)
![Rendered by QuickLaTeX.com \[ 2KOH + ZnO \overset{fus.}{\rightarrow} K_2ZnO_2 + H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7c34fa40be3753078af4663cd3363442_l3.png)
![Rendered by QuickLaTeX.com \[ 2KOH + ZnO + H_2O \overset{sol.}{\rightarrow} K_2[Zn(OH)_4] \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d29fad1c231b9fa1e9afd347301d857a_l3.png)
![Rendered by QuickLaTeX.com \[ 3NaOH + FeCl_3 = Fe(OH)_3 + 3NaCl \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0cab876fca1dc6d93094e89351ce85e7_l3.png)
Остальные основные гидроксиды обладают практически такими же химическими свойствами, но они как правило нерастворимы в воде и не взаимодействуют с амфотерными соединениями.
Амфотерные гидроксиды
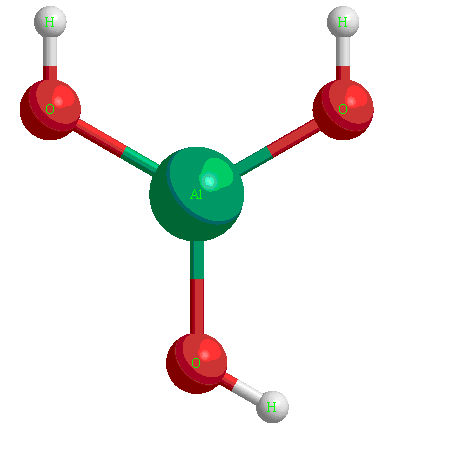
Это гидроксиды металлов со степенью окисления 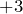 ,
, 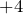 . Есть исключения (например,
. Есть исключения (например, 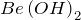 ), в которых металл проявляет степень окисления
), в которых металл проявляет степень окисления 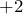 .
.
Примеры: 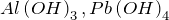 .
.
В зависимости от условий амфотерные вещества могут проявлять или основные или кислотные свойства.
Они представляют собой твёрдые вещества, которые не растворяются в воде, и так правило являются слабыми электролитами.
При воздействии температуры происходит разложение соединения с образованием амфотерного оксида, например:
![Rendered by QuickLaTeX.com \[ Fe\left(OH\right)_2\overset{t}{\rightarrow}FeO+H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a38c6f8198772c7d3e873894f4b9012a_l3.png)
При взаимодействии с кислотами образуются соли:
![Rendered by QuickLaTeX.com \[ 2Al\left(OH\right)_3+6HCl\rightarrow 2AlCl_3+3H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a1ffbafbe1c0a23a28b315731a4810d8_l3.png)
Пример реакции с сильным основанием в зависимости от условий проведения реакции рассмотрен выше.
Кислотные гидроксиды (кислородсодержащие кислоты)
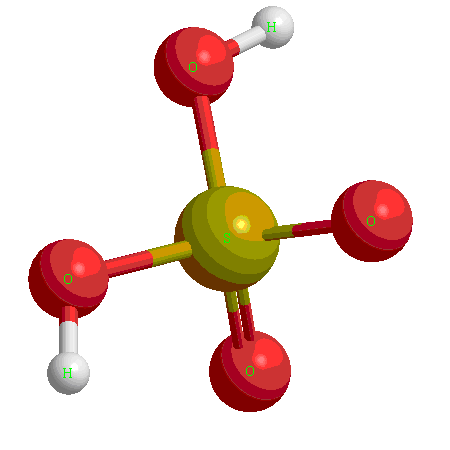
Это как правило гидроксиды неметаллов, имеющих степень окисления  ,
,  либо гидроксиды металлов в высших степенях окисления.
либо гидроксиды металлов в высших степенях окисления.
Примеры: 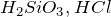
Большая часть неорганических кислот при обычных условиях находятся в жидком состоянии, некоторые – в твёрдом состоянии (ортофосфорная), а некоторые нельзя выделить в виде индивидуальных соединений.
Кислоты реагируют с основаниями, основными оксидами и металлами с образованием солей:
![Rendered by QuickLaTeX.com \[ H_2SO_4+2RbOH\rightarrow Rb_2SO_4+2H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-be2a894cf0391f6b06b76294bdee630a_l3.png)
![Rendered by QuickLaTeX.com \[ 2HCl+MgO\rightarrow MgCl_2+H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1bef462ecaa1ffef1961a47c2266bfa3_l3.png)
![Rendered by QuickLaTeX.com \[ 6HCl+2Al\rightarrow 2AlCl_3+3H_2\uparrow \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a4472def4cc52b90164c2c239262567c_l3.png)
Примеры решения задач
ru.solverbook.com
Химические свойства оснований — урок. Химия, 8–9 класс.
Химические свойства гидроксида металла во многом зависят от того, к какой группе он принадлежит — к щелочам или к нерастворимым основаниям.
Общие химические свойства щелочей
1. Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы.
A) Например, при диссоциации гидроксида натрия образуются положительно заряженные ионы натрия и отрицательно заряженные гидроксид-ионы:
NaOH→Na++OH−.
Б) Процесс диссоциации гидроксида кальция отображается следующим уравнением:
Ca(OH)2→Ca2++2OH−.
2. Растворы щелочей изменяют окраску индикаторов.
Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой щёлочи. При этом протекает химическая реакция с образованием нового продукта, признаком протекания которой является изменение окраски вещества.
Изменение окраски индикаторов в растворах щелочей
Индикатор | Изменение окраски индикатора |
| Лакмус | Фиолетовый лакмус становится синим  |
| Фенолфталеин | Беcцветный фенолфталеин становится малиновым  |
Универсальный индикатор | Универсальный индикатор становится синим  |
Видеофрагмент:
Действие щелочей на индикаторы |
3. Щёлочи взаимодействуют с кислотами, образуя соль и воду.
Реакции обмена между щелочами и кислотами называют реакциями нейтрализации.
А) Например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия и вода: NaOH+HCl→NaCl+h3O.
Видеофрагмент:
Взаимодействие гидроксида натрия с соляной кислотой |
Б) Если нейтрализовать гидроксид кальция азотной кислотой, образуются нитрат кальция и вода:
Ca(OH)2+2HNO3→Ca(NO3)2+2h3O.
4. Щёлочи взаимодействуют с кислотными оксидами, образуя соль и воду.
А) Например, при взаимодействии гидроксида кальция с оксидом углерода(\(IV\)) т. е. углекислым газом, образуются карбонат кальция и вода:
Ca(OH)2+CO2→CaCO3↓+h3O.
Обрати внимание!
При помощи этой химической реакции можно доказать присутствие оксида углерода(\(IV\)): при пропускании углекислого газа через известковую воду (насыщенный раствор гидроксида кальция) раствор мутнеет, поскольку выпадает осадок белого цвета — образуется нерастворимый карбонат кальция.
Б) При взаимодействии гидроксида натрия с оксидом фосфора(\(V\)) образуются фосфат натрия и вода:
6NaOH+P2O5→2Na3PO4+3h3O.
5. Щёлочи могут взаимодействовать с растворимыми в воде солями.
Обрати внимание!
Реакция обмена между основанием и солью возможна в том случае, если оба исходных вещества растворимы, а в результате образуется хотя бы одно нерастворимое вещество (выпадает осадок).
А) Например, при взаимодействии гидроксида натрия с сульфатом меди(\(II\)) образуются сульфат натрия и гидроксид меди(\(II\)):
2NaOH+CuSO4→Na2SO4+Cu(OH)2↓.
Б) При взаимодействии гидроксида кальция с карбонатом натрия образуются карбонат кальция и гидроксид натрия:
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH.
6. Малорастворимые щёлочи при нагревании разлагаются на оксид металла и воду.
Например, если нагреть гидроксид кальция, образуются оксид кальция и водяной пар:
Ca(OH)2⟶t°CaO+h3O↑.
Общие химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с кислотами, образуя соль и воду.
А) Например, при взаимодействии гидроксида меди(\(II\)) с серной кислотой образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+h3SO4→CuSO4+2h3O.
Б) При взаимодействии гидроксида железа(\(III\)) с соляной (хлороводородной) кислотой образуются хлорид железа(\(III\)) и вода:
Fe(OH)3+3HCl→FeCl3+3h3O.
Видеофрагмент:
Взаимодействие гидроксида железа(\(III\)) с соляной кислотой |
2. Некоторые нерастворимые основания могут взаимодействовать с некоторыми кислотными оксидами, образуя соль и воду.
Например, при взаимодействии гидроксида меди(\(II\)) с оксидом серы(\(VI\)) образуются сульфат меди(\(II\)) и вода:
Cu(OH)2+SO3⟶t°CuSO4+h3O.
3. Нерастворимые основания при нагревании разлагаются на оксид металла и воду.
А) Например, при нагревании гидроксида меди(\(II\)) образуются оксид меди(\(II\)) и вода:
Cu(OH)2⟶t°CuO+h3O.
Видеофрагмент:
Разложение гидроксида меди(\(II\)) |
Б) Гидроксид железа(\(III\)) при нагревании разлагается на оксид железа(\(III\)) и воду:
2Fe(OH)3⟶t°Fe2O3+3h3O.
www.yaklass.ru
Гидроксид натрия — WiKi
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH, а также гидроксид одновалентного таллия TlOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH−), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в следующие реакции:
с кислотами, амфотерными оксидами и гидроксидамиNaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}} NaOH+h3S→NaHS+h3O{\displaystyle {\mathsf {NaOH+H_{2}S\rightarrow NaHS+H_{2}O}}} (кислая соль, при отношении 1:1)2NaOH+h3S→Na2S+2h3O{\displaystyle {\mathsf {2NaOH+H_{2}S\rightarrow Na_{2}S+2H_{2}O}}} (в избытке NaOH)Общая реакция в ионном виде:
OH−+H+→h3O{\displaystyle {\mathsf {OH^{-}+H^{+}\rightarrow H_{2}O}}}- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
c неметаллами:например, с фосфором — с образованием гипофосфита натрия:
4P+3NaOH+3h3O→Ph4↑+3Nah3PO2{\displaystyle {\mathsf {4P+3NaOH+3H_{2}O\rightarrow PH_{3}\uparrow +3NaH_{2}PO_{2}}}}с серой:
3S+6NaOH→2Na2S+Na2SO3+3h3O{\displaystyle {\mathsf {3S+6NaOH\rightarrow 2Na_{2}S+Na_{2}SO_{3}+3H_{2}O}}} с галогенами 2NaOH+Cl2→NaClO+NaCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaClO+NaCl+H_{2}O}}} (дисмутация хлора при комнатной температуре)6NaOH+3Cl2→NaClO3+5NaCl+3h3O{\displaystyle {\mathsf {6NaOH+3Cl_{2}\rightarrow NaClO_{3}+5NaCl+3H_{2}O}}} (дисмутация хлора при нагревании раствора)с металламиГидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксоалюмината натрия и водорода:
2Al+2NaOH+6h3O→2Na[Al(OH)4]+3h3{\displaystyle {\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na[Al(OH)_{4}]+3H_{2}}}}Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых (в том числе боевых) условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
с эфирами, амидами и алкилгалогенидами (гидролиз):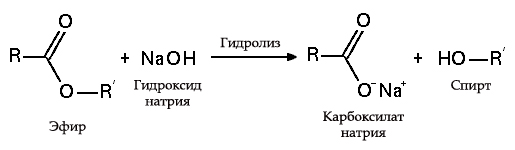 Гидролиз эфиров
Гидролиз эфиров с жирами (омыление) такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века.
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла в зависимости от состава жира.
с многоатомными спиртами — с образованием алкоголятов:HOCh3Ch3OH+2NaOH→NaOCh3Ch3ONa+2h3O{\displaystyle {\mathsf {HOCH_{2}CH_{2}OH+2NaOH\rightarrow NaOCH_{2}CH_{2}ONa+2H_{2}O}}}Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся пиролитический, известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнён примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Пиролитический метод
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия при температуре 1000 °C (например, в муфельной печи):
Na2CO3→1000∘CNa2O+CO2{\displaystyle {\mathsf {Na_{2}CO_{3}\,{\xrightarrow[{1000^{\circ }C}]{}}\,Na_{2}O+CO_{2}}}}В качестве сырья может быть использован и гидрокарбонат натрия, разлагающийся при 200 °C на карбонат натрия, углекислый газ и воду.
2NaHCO3→200∘CNa2CO3+CO2+h3O→1000∘CNa2O+2CO2+h3O{\displaystyle {\mathsf {2NaHCO_{3}\,{\xrightarrow[{200^{\circ }C}]{}}\,Na_{2}CO_{3}+CO_{2}+H_{2}O{\xrightarrow[{1000^{\circ }C}]{}}\,Na_{2}O+2CO_{2}+H_{2}O}}}Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
Na2O+h3O→2NaOH{\displaystyle {\mathsf {Na_{2}O+H_{2}O\,\rightarrow \,2NaOH}}}Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с гашеной известью при температуре около 80 °С. Этот процесс называется каустификацией и проходит по реакции:
Na2CO3+Ca(OH)2→2NaOH+CaCO3{\displaystyle {\mathsf {Na_{2}CO_{3}+Ca(OH)_{2}\rightarrow 2NaOH+CaCO_{3}}}}В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он кристаллизуется.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Na2CO3+Fe2O3→2NaFeO2+CO2{\displaystyle {\mathsf {Na_{2}CO_{3}+Fe_{2}O_{3}\rightarrow 2NaFeO_{2}+CO_{2}}}} 2NaFeO2+2h3O→2NaOH+Fe2O3⋅h3O{\displaystyle {\mathsf {2NaFeO_{2}+2H_{2}O\rightarrow 2NaOH+Fe_{2}O_{3}\cdot H_{2}O}}}Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200 °С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xh3О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твёрдый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
2NaCl+2h3O→h3↑+Cl2↑+2NaOH{\displaystyle {\mathsf {2NaCl+2H_{2}O\rightarrow H_{2}\uparrow +Cl_{2}\uparrow +2NaOH}}}Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| 99 | 96 | 98,5 |
| 3 150 | 3 260 | 2 520 |
| 50 | 12 | 35 |
| 99,2 | 98 | 99,3 |
| 99,9 | 99,9 | 99,9 |
| 0,1 | 1—2 | 0,3 |
| 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом.
Диафрагменный метод
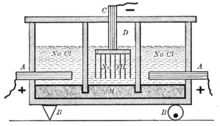 Схема старинного диафрагменного электролизера для получения хлора и щёлоков: А — анод, В — изоляторы, С — катод, D — пространство заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагма
Схема старинного диафрагменного электролизера для получения хлора и щёлоков: А — анод, В — изоляторы, С — катод, D — пространство заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагма Наиболее простым из электрохимических методов в плане организации процесса и конструкционных материалов для электролизера является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подаётся в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую иногда добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизера. Именно благодаря противоточному потоку, направленному из анодного пространства в катодное через пористую диафрагму, становится возможным раздельное получение щёлоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH- ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO-), который затем может окисляться на аноде до хлорат-иона ClO3-. Образование хлорат-иона серьёзно снижает выход по току хлора и является основным побочным процессом в этом методе получения гидроксида натрия. Также вредит и выделение кислорода, которое, к тому же, ведёт к разрушению анодов и, если они из углеродных материалов, попаданию в хлор примесей фосгена.
Анод: 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}} — основной процесс 2h3O→O2+4H++4e−{\displaystyle {\mathsf {2H_{2}O\rightarrow O_{2}+4H^{+}+4e^{-}}}} 6ClO3−+3h3O→2ClO3−+4Cl−+1,5O2↑+6H++6e−{\displaystyle {\mathsf {6ClO_{3}^{-}+3H_{2}O\rightarrow 2ClO_{3}^{-}+4Cl^{-}+1,5O_{2}\uparrow +6H^{+}+6e^{-}}}} Катод: 2h3O+2e−→h3↑+2OH−{\displaystyle {\mathsf {2H_{2}O+2e^{-}\rightarrow H_{2}\uparrow +2OH^{-}}}} — основной процесс ClO−+h3O+2e−→Cl−+2OH−{\displaystyle {\mathsf {ClO^{-}+H_{2}O+2e^{-}\rightarrow Cl^{-}+2OH^{-}}}} ClO3−+3h3O+6e−→Cl−+6OH−{\displaystyle {\mathsf {ClO_{3}^{-}+3H_{2}O+6e^{-}\rightarrow Cl^{-}+6OH^{-}}}}В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их, в основном, заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок, поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из анодного пространства вытекает поток обеднённого анолита, содержащего также примеси гипохлорит- и хлорат-ионов и хлор, а из катодного — щёлока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щёлочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щёлочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка объясняется высокой стоимостью полимерных катионообменных мембран и их уязвимостью к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
Схема мембранного электролизера.Ртутный метод с жидким катодом
В ряду электрохимических методов получения щёлоков самым эффективным способом является электролиз с ртутным катодом. Щёлоки, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (для некоторых производств это критично). Например, в производстве искусственных волокон можно применять только высокочистый каустик), а по сравнению с мембранным методом организация процесса при получении щёлочи ртутным методом гораздо проще.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}} — основной процесс 2h3O→O2+4H++4e−{\displaystyle {\mathsf {2H_{2}O\rightarrow O_{2}+4H^{+}+4e^{-}}}} 6ClO3−+3h3O→2ClO3−+4Cl−+1,5O2+6H++6e−{\displaystyle {\mathsf {6ClO_{3}^{-}+3H_{2}O\rightarrow 2ClO_{3}^{-}+4Cl^{-}+1,5O_{2}+6H^{+}+6e^{-}}}}Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизёра, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
Na++e−→HgNaHg{\displaystyle {\mathsf {Na^{+}+e^{-}{\xrightarrow[{}]{Hg}}NaHg}}}Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
2NaHg+2h3O→−Hg2NaOH+h3{\displaystyle {\mathsf {2NaHg+2H_{2}O{\xrightarrow[{-Hg}]{}}2NaOH+H_{2}}}}Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щелочи с твёрдым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизёр диафрагменного или мембранного типа.
ru-wiki.org
Гидроксиды, гидроокиси - Знаешь как
Страницы Список страниц 7 8 9 10 11 · · · 45
§ 24. Гидроокиси (гидроксиды). Состав и свойства
Как уже говорилось, гидроокислами, или основаниями, называются электролиты, диссоциирующие в водных растворах с образованием в качестве катионов ионов металла, а в качестве анионов — только ионов гидроксила.Например:NaOH = Na+ + ОН—
Са(ОН)2 = Са2+ + 2ОН—В табл. 4 и 5 приводится классификация оснований по числу гидроксильных групп и по растворимости в воде.
| Классификация оснований по числу гидрооксильных групп. Таблица 4 | ||
| Однокислотные | Двухкислотные | Многокислотные |
| NaOHКОНAgOH | Ca(OH)2Cu(OH)2Ва(ОН)2 | Al(OH)3 Fe(OH)3 |
| Классификация оснований по растворимости в воде. Таблица 5 | |
| Растворимые | Нерастворимые |
| NaOH, Са(ОН)2, КОН, Ва(ОН)2 и другие основания, образованные металлами главных подгрупп I и II групп, кроме Ве(ОН)2 | Cu(OH)2, Fe(OH)3, Fe(OH)2 и др. |
Растворимые основания являются сильными электролитами и носят название сильных оснований. Гидроокиси металлов главной подгруппы I группы являются наиболее сильными и в некоторых случаях носят название едких щелочей, например едкий натр NaOH, едкое кали КОН. Изредка встречается название едкий барит Ва(ОН)2, несмотря на то что барий — металл II группы. Обычно основания носят общие названия гидроокисей, или гидрок-сидов, например гидроокись кальция (гидроксид кальция), гидроокись лития (гидроксид лития). Если металл может иметь в соединениях разную валентность, то она проставляется рядом в скобках римской цифрой, например гидроокись меди (II), гидроокись железа (III) и т. д.
■ 90. Пользуясь периодической системой, напишите формулы следующих оснований и укажите, к какой группе по числу гидроксил-ионов и по растворимости они относятся: а) гидроокись лития; б) гидроокись стронция; в) гидроокись галлия; г) гидроокись алюминия; д) гидроокись калия; е) гидроокись меди (II), ж) гидроокись железа (III). (См. Ответ)
Основания являются твердыми веществами. Щелочи — это кристаллические вещества белого цвета, химически весьма стойкие, поэтому в хорошо закупоренном виде они могут длительное время храниться в лаборатории.Едкие щелочи при попадании на кожу могут причинить сильные ожоги, поэтому кристаллические щелочи следует брать не руками, а только щипцами или пинцетом. При попадании на кожу раствора щелочи необходимо прежде всего смыть раствор до исчезновения ощущения мылкости большим количеством воды, а затем нейтрализовать раствором борной кислоты.
• Запишите меры первой помощи при ожогах щелочами в тетрадь и хорошо запомните.
Нерастворимые основания являются твердыми веществами, различно окрашенными. При хранении нерастворимые основания довольно быстро разлагаются, поэтому в лаборатории их не хранят, а, как правило, используют свежеприготовленные. Химические свойства щелочей более разнообразны, чем нерастворимых оснований. Для сравнения проведем между ними параллель.
| Растворимые основания 1. Растворимые основания действуют на индикаторы. «Индикатор» в переводе значит «указатель» «определитель». С помощью вещества-индикатора определяют, какое вещество имеется в избытке в данном растворе, — кислота или щелочь. Изменение цвета индикатора дает ответ на этот вопрос. Мы здесь будем говорить о трех индикаторах — лакмусе, который в нейтральной среде (вода) имеет фиолетовую окраску, о фенолфталеине (в нейтральной среде бесцветен), о метиловом оранжевом (в нейтральной среде желтый). В щелочах лакмус синеет, фенолфталеин становится малиновым, а метиловый оранжевый остается желтым (см. приложение III, п. 8 «Изменение окраски индикаторов»).Однозначное действие на индикаторы всех растворимых оснований объясняется наличием в их растворах большой концентрации гидроксил-иона ОН-. Такие растворы обычно называют щелочными. 2. Растворимые основания (условимся в дальнейшем именовать их щелочами) могут вступать во взаимодействие с кислотными окислами. Примером является реакция известковой воды при пропускании через нее двуокиси углерода: Са(ОН)2 + СО2 = CaCО3 + Н2О Са2+ + 2ОН— + СО2 = СаСО3 + Н2О Это свойство рассматривалось нами при изучении химических свойств кислотных окислов. | Нерастворимые основания
1. Нерастворимые основания на индикаторы не действуют, так как в растворе практически не диссоциируют и не создают избытка гидроксил-ионов. 2. Нерастворимые основания реагируют с кислотными окислами лишь крайне медленно и с трудом. |
| 3. Все основания могут вступать в реакцию с кислотами. При этом образуются соль и вода. Реакция между основаниями и кислотами, в процессе которой образуются нейтральная соль и вода, называется реакцией нейтрализации: | |
| NaOH + HNO3 = NaNО3 +h3О Na+ + ОН— + H+ + NO3— = Na+ + NO3— + h3O H+ + OH— = h3О Поскольку щелочи и кислоты являются веществами главным образом бесцветными, а в процессе реакции образуются также бесцветные вещества, то реакцию между ними следует проводить в присутствии индикатора, который поможет обнаружить наличие реакции. На этой реакции в количественном анализе основан метод нейтрализации.4. Щелочи могут реагировать с растворимыми солями. При этом образуются новая соль и нерастворимое основание: FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl Fe3+ + 3Cl— + 3Na+ + ЗОН— = Fe(OH)3 + 3Na+ + 3Cl—Fe3+ + 3ОН— = Fe(OH)3 Удобнее для реакции со щелочью брать соль, в состав которой входит металл, образующий нерастворимое основание. В противном случае реакция будет обратимой. Можно подобрать и такую реакцию, в которой в осадок выпадает соль, например: Са(ОН)2 + Na2CO3 = CaCO3 + 2NaOH Са2+ + 2OН— + 2Na+ + CO23— = CaCO3 + 2Na+ + 2OH— Ca2+ + CO23— = CaCO3 (см. приложение III. п. 7 «Растворимость кислот, оснований и солей»). | Cu(OH)2 + 2HCl = CuCl2 + 2h3O Cu(OH)2 + 2Н+ + 2Cl—= Сu2+ +2Сl— + 2h3O Сu(OН)2 + 2Н+ = Сu2+ + 2Н2O 4. Нерастворимые основания под действием кислот растворяются. Это является достаточно ярким показателем наличия реакции. 4. Нерастворимые основания с солями не реагируют. |
| 5. Многие основания, особенно нерастворимые, могут разлагаться на основной окисел и воду: | |
| Нерастворимые основания постепенно разлагаются даже при обычных условиях, а растворимые — только при сильном прокаливании. Что касается едких щелочей NaOH, КОН и др., то они практически совсем не подвержены разложению. | |
■ 91. С какими из перечисленных веществ будет реагировать едкое кали: а) хлорид цинка, б) окись кальция, в) окись серы (VI), г) кремниевая кислота, д) карбонат магния, е) карбонат натрия; ж) нитрат меди (II). Подтвердите свой вывод уравнениями реакций в молекулярной и ионных формах. (См. Ответ) 92. Рассчитайте, сколько гидроокиси кальция вступит в реакцию с 280 г азотной кислоты, если она содержит 10% примесей. (Это новый тип химических задач, в которых исходное вещество содержит примеси.) 93. Какой объем двуокиси углерода израсходуется на реакцию с 10 г едкого натра, содержащего 20% примесей? 94. Сколько соли получится при реакции 570 г гидроокиси бария с серной кислотой, если гидроокись бария содержит 10% примесей? (См. Ответ)
| Получение оснований | |
| Растворимых 1. При непосредственном взаимодействии металла (Na, К) с водой 2Na + 2h3O = 2NaOH + h3 2Na + 2h3O = 2Na+ + 2OH—+ h3 2. При взаимодействии основного окисла с водой: СаО + h3О = Са(ОН)2 3. Чаше всего щелочи получают в технике из солей (например, таких, как NaCl, KCI) разложением их растворов электрическим то- ком. | Нерастворимых Нерастворимые ос нования первыми тремя способами получены быть не могут. |
| 4. Как растворимые, так и нерастворимые основания могут быть получены из растворимых солей соответствующих металлов действием едких щелочей: | |
| K2SO4 + Ba(OH)2 = 2KOH + BaSO4 2K+ + SO24— + Ba2+ + 2OH— = BaSO4 + 2K+ +2OH— Ba2+ + SO24— = BaSO4 | CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 Cu2+ + SO24— + 2Na+ + 2OH— = Cu(OH)2 + 2Na+ + SO24— Cu2+ + 2OH— = Cu(OH)2 Это единственный способ получения нерастворимых оснований. |
■ 95. Предложите все возможные способы получения гидроокиси кальция. (См. Ответ) 96. Каким образом можно получить гидроокись кальция, исходя из карбоната кальция? 97. Имеются медь, кислород, соляная кислота, вода, металлический натрий. Каким образом, пользуясь только этими веществами, можно получить гидроокись меди? 98. В четырех колбах находятся растворы: в одной — азотной кислоты, в другой — гидроокиси натрия, в третьей — гидроокиси бария, в четвертой — вода. Как определить, в какой колбе какой раствор? Какие реактивы для этого требуются? 99. Сколько окиси кальция потребуется для получения 37 г гидроокиси, если окись содержит 20% примесей? (См. Ответ)
§ 25. Кислоты
Кислотами называются электролиты, диссоциирующие в водных растворах с образованием в качестве катионов только ионов водорода, а в качестве анионов — кислотного остатка.Например, диссоциация азотной кислоты выражается следующим равенством:HNО3 ⇄ Н+ + NO3—В табл. 6 и 7 приведена классификация кислот по составу и основности. 1Названия кислот зависят от названия центрального атома, образующего кислоту, например: h3SО4— серная кислота, HNО3—азотная кислота.
| Классификация кислот по составу. Таблица 6 | |||
| Кислородные кислоты | Бескислородные кислоты | ||
| h3SО4 HNO3 h3CO3 h4PО4 h3SO3 h3SiO3 | Серная Азотная Угольная Фосфорная Сернистая Кремниевая | Соляная Сероводородная Бромистоводородная Иодистоводородная Плавиковая | |
| Классификация кислот по основности Таблица 7 | ||
| Одноосновные кислоты | Двухосновные кислоты | Многоосновные кислоты |
Если элемент образует две или несколько кислот, то названия отличаются друг от друга окончаниями: h3SО4— серная кислота (сера в высшей положительной степени окисления), h3SО3 — сернистая кислота (сера в низшей положительной степени окисления).Среди кислот лишь кислородные кислоты имеют соответствующие им ангидриды. Например, серной кислоте h3SО4 соответствует серный ангидрид SО3, фосфорной кислоте Н3РО4 —фосфорный ангидрид Р2О5 и т. д.Если кислота бескислородная, то к названию элемента добавляется окончание «водородный»: h3S — сероводородная кислота, НВr — бромистоводородная кислота и т. д.Бескислородные кислоты представляют собой летучие водородные соединения элементов главных подгрупп VI— VII группы, растворенные в воде. Ангидридов они, естественно, не имеют. Они также не могут быть выделены в безводном состоянии.
Диссоциация одкоосновных кислот отличается от диссоциации двухосновных и многоосновных кислот.Двухосновные и многоосновные кислоты диссоциируют ступенчато, например диссоциация серной кислоты протекает практически по следующей схеме

■ 100. Напишите, пользуясь периодической системой, формулы следующих кислот: а) мышьяковой, б) фтористоводородной, в) селеновой, г) хромовой, д) марганцевой, е) бромистоводородной, ж) сероводородной, з) ванадиевой. (См. Ответ)
К каким группам кислот по составу и по основности они относятся? Напишите уравнения диссоциации этих кислот. Для кислородных кислот найдите ангидриды.По степени диссоциации кислоты разделяют на сильные, средние и слабые (табл. 8).
| Классификация кислот по степени диссоциации Таблица 7 | ||
| Сильные кислоты | Средние кислоты | Слабые кислоты |
По физическим свойствам большая часть минеральных кислот представляет собой жидкости. Имеется и твердая кислота — фосфорная. Это кристаллическое вещество. Все кислоты по удельному весу тяжелее воды. Затвердевают они при температурах ниже нуля и смешиваются с водой в любых соотношениях. Некоторые летучие кислоты имеют запах (HCl, HNO3). Известны кислоты бесцветные и окрашенные (хромовая кислота Н2СrO4 — желтого цвета; марганцевая кислота НМnO4 — малиновая). Кислородные и бескислородные кислоты обладают общими химическими свойствами.1. Кислоты действуют на индикаторы. Лакмус в кислотах становится розовым, фенолфталеин остается бесцветным, а метиловый оранжевый становится красным (см. приложение III, п. 7 «Изменение окраски индикаторов»).
Одинаковое действие кислот на индикаторы объясняется повышенной концентрацией ионов водорода в растворе в связи с диссоциацией кислот.2. Кислоты вступают в реакцию с металлами:Zn + 2НСl= ZnCl2 + h3↑
Zn + 2H+ + 2Cl— = Zn2+ + 2Cl—+ h3
Zn + 2H+ = Zn2+ + h3Реакция с выделением водорода происходит лишь в том случае, если кислота сильная (кроме азотной) и если вступающий в реакцию металл активнее водорода и поэтому может вытеснять его из кислот.Для того чтобы определить, достаточно ли активен металл, пользуются электрохимическим рядом напряжений металлов. Впервые этот ряд экспериментальным путем был составлен и изучен русским ученым Н. Н. Бекетрвым (см. приложение III, п. 6 «Электрохимический ряд напряжений металлов»).Металлы в этом ряду расположены в порядке убывания их активности. Это связано с энергией, необходимой для отрыва валентных электронов. Чем активнее металл, тем легче он отдает электроны, тем меньшая энергия для этого требуется. Все металлы, стоящие в этом ряду левее водорода, активнее его и могут восстанавливать его из кислот. Все металлы, стоящие правее водорода, имеют малую активность и водород из кислот не восстанавливают.3. Кислоты могут вступать в реакцию с основными окислами, что уже рассматривалось в разделе «Основные окислы»:Fe2O3 + 3h3SO4 = Fe2(SO4)3 + 3h3O
Fe2O3 + 6Н+ + 3SO24— = 2Fe3+ + 3SO24— + 3h3
Fe2O3 + 6H+ = 2Fe3+ 3h3O4, Кислоты реагируют с любыми основаниями (реакция нейтрализации):Са(ОН)2+ 2НСl = СаСl2+ 2Н2О
Са2+ + 2OН— + 2Н+ + 2Сl— = Са2+ + 2Сl— + 2Н2ОH+ + OH— = h3O
5. Кислоты вступают в реакцию с солями в том случае, если при этом образуется нерастворимый в кислотах осадок или если реагирующая кислота сильнее, чем кислота, образовавшая соль. Первому условию удовлетворяет реакцияAgNО3 + НСl = AgCl↓ + HNO3
Ag+ + NO3— + H+ + Cl— = AgCl + H+ + NO3—Ag+ + Cl—= AgClа второму реакция
CaCO3 + 2HCl = СаСl2 + h3CO3
CaCO3 + 2H+ + 2Cl— = Ca2+ + 2Cl— + CO2 + h3O
CaCO3 + 2H+ = Ca2+ + CO2 + h3O
| Получение кислот | |
| Бескислородных | |
| 1. Соединением соответствующего ангидрида с водой: SO3 + Н2О = h3SO4. | 1. Путем прямого синтеза из элементов: Н2 + Сl2 = 2НСl. |
| 2. Вытеснением менее стойкой кислоты из ее соли более стойкой кислотой: | |
| Na2SiO3 + h3SO4 =Na2SO4 + h3SiO3 2Na++ SiO23—+ 2H++ SO24— = 2Na+ + SO24—+h3SiO3 2H+ + SiO23—=h3SiO3 | 2NaCl + h3SO4 = Na2SO4 + 2HCl сухой конец. |
■ 101. С какими из перечисленных ниже веществ может вступать в реакцию разбавленная серная кислота: а) железо; б) сульфат кальция; в) карбонат натрия; г) гидроокись цинка; д) медь; е) нитрат магния; ж) окись алюминия; з) окись углерода (IV)? В тех случаях, когда реакция возможна, напишите ее уравнение в молекулярной и ионных формах. 102. Каким способом, имея окись кремния (IV), едкий натр, воду и серную кислоту, можно получить кремниевую кислоту? Все уравнения записывать в молекулярной, полной ионной и сокращенной ионной формах в тех случаях, если это реакция между электролитами в растворах. (См. Ответ)
103. Осуществите ряд превращений.

Все уравнения реакций между электролитами в растворе записывайте в молекулярной, полной ионной и сокращенной ионной формах. 104. Сколько едкого натра будет израсходовано на реакцию с 200 г 3% раствора соляной кислоты? (Иногда исходное вещество может быть дано в виде раствора молярной или нормальной концентрации. Ход решения от этого не меняется.) 105. Сколько гидроокиси бария потребуется для полного осаждения сульфат-иона из 200мл 0,1 н. серной кислоты? (См. Ответ)
9
8 10
10
znaesh-kak.com

 NaOH+h3S→NaHS+h3O{\displaystyle {\mathsf {NaOH+H_{2}S\rightarrow NaHS+H_{2}O}}}
NaOH+h3S→NaHS+h3O{\displaystyle {\mathsf {NaOH+H_{2}S\rightarrow NaHS+H_{2}O}}} (кислая соль, при отношении 1:1)2NaOH+h3S→Na2S+2h3O{\displaystyle {\mathsf {2NaOH+H_{2}S\rightarrow Na_{2}S+2H_{2}O}}}
(кислая соль, при отношении 1:1)2NaOH+h3S→Na2S+2h3O{\displaystyle {\mathsf {2NaOH+H_{2}S\rightarrow Na_{2}S+2H_{2}O}}} (в избытке NaOH)
(в избытке NaOH)
![{\mathsf {2NaOH+ZnO{\xrightarrow[{}]{^{o}t}}Na_{2}ZnO_{2}+H_{2}O}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/36faf5d0d4a5f8319d7173d164c982ff596dc813) — при сплавлении2NaOH+ZnO+h3O→Na2[Zn(OH)4]{\displaystyle {\mathsf {2NaOH+ZnO+H_{2}O\rightarrow Na_{2}[Zn(OH)_{4}]}}}
— при сплавлении2NaOH+ZnO+h3O→Na2[Zn(OH)4]{\displaystyle {\mathsf {2NaOH+ZnO+H_{2}O\rightarrow Na_{2}[Zn(OH)_{4}]}}}![{\displaystyle {\mathsf {2NaOH+ZnO+H_{2}O\rightarrow Na_{2}[Zn(OH)_{4}]}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/998901176ff5d911bf45c0726b6fb15579713e10) — в растворес амфотерными гидроксидами NaOH+Al(OH)3→otNaAlO2+2h3O{\displaystyle {\mathsf {NaOH+Al(OH)_{3}{\xrightarrow[{}]{^{o}t}}NaAlO_{2}+2H_{2}O}}}
— в растворес амфотерными гидроксидами NaOH+Al(OH)3→otNaAlO2+2h3O{\displaystyle {\mathsf {NaOH+Al(OH)_{3}{\xrightarrow[{}]{^{o}t}}NaAlO_{2}+2H_{2}O}}}![{\mathsf {NaOH+Al(OH)_{3}{\xrightarrow[{}]{^{o}t}}NaAlO_{2}+2H_{2}O}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/5f4a78fc801aff5757402f0574704b2116ca659d) — при сплавлении3NaOH+Al(OH)3→Na3[Al(OH)6]{\displaystyle {\mathsf {3NaOH+Al(OH)_{3}\rightarrow Na_{3}[Al(OH)_{6}]}}}
— при сплавлении3NaOH+Al(OH)3→Na3[Al(OH)6]{\displaystyle {\mathsf {3NaOH+Al(OH)_{3}\rightarrow Na_{3}[Al(OH)_{6}]}}}![{\mathsf {3NaOH+Al(OH)_{3}\rightarrow Na_{3}[Al(OH)_{6}]}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/f712e037a7471c3dcfe1bdee33b39d5f730b2756) — в растворес солями в растворе:2NaOH+CuSO4→Cu(OH)2↓+Na2SO4{\displaystyle {\mathsf {2NaOH+CuSO_{4}\rightarrow Cu(OH)_{2}\downarrow +Na_{2}SO_{4}}}}
— в растворес солями в растворе:2NaOH+CuSO4→Cu(OH)2↓+Na2SO4{\displaystyle {\mathsf {2NaOH+CuSO_{4}\rightarrow Cu(OH)_{2}\downarrow +Na_{2}SO_{4}}}}

 с галогенами 2NaOH+Cl2→NaClO+NaCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaClO+NaCl+H_{2}O}}}
с галогенами 2NaOH+Cl2→NaClO+NaCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaClO+NaCl+H_{2}O}}} (дисмутация хлора при комнатной температуре)6NaOH+3Cl2→NaClO3+5NaCl+3h3O{\displaystyle {\mathsf {6NaOH+3Cl_{2}\rightarrow NaClO_{3}+5NaCl+3H_{2}O}}}
(дисмутация хлора при комнатной температуре)6NaOH+3Cl2→NaClO3+5NaCl+3h3O{\displaystyle {\mathsf {6NaOH+3Cl_{2}\rightarrow NaClO_{3}+5NaCl+3H_{2}O}}} (дисмутация хлора при нагревании раствора)с металлами
(дисмутация хлора при нагревании раствора)с металлами![{\mathsf {2Al+2NaOH+6H_{2}O\rightarrow 2Na[Al(OH)_{4}]+3H_{2}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/71e2855c0c45c0720f7eb91db10329d15184cfd0)

![{\mathsf {Na_{2}CO_{3}\,{\xrightarrow[{1000^{\circ }C}]{}}\,Na_{2}O+CO_{2}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/fa1292b2c7a59f8512b863111c0482a6fbdb8168)
![{\displaystyle {\mathsf {2NaHCO_{3}\,{\xrightarrow[{200^{\circ }C}]{}}\,Na_{2}CO_{3}+CO_{2}+H_{2}O{\xrightarrow[{1000^{\circ }C}]{}}\,Na_{2}O+2CO_{2}+H_{2}O}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/3e6e642209570dcf3611650745eb82854280549c)


 2NaFeO2+2h3O→2NaOH+Fe2O3⋅h3O{\displaystyle {\mathsf {2NaFeO_{2}+2H_{2}O\rightarrow 2NaOH+Fe_{2}O_{3}\cdot H_{2}O}}}
2NaFeO2+2h3O→2NaOH+Fe2O3⋅h3O{\displaystyle {\mathsf {2NaFeO_{2}+2H_{2}O\rightarrow 2NaOH+Fe_{2}O_{3}\cdot H_{2}O}}}

 — основной процесс 2h3O→O2+4H++4e−{\displaystyle {\mathsf {2H_{2}O\rightarrow O_{2}+4H^{+}+4e^{-}}}}
— основной процесс 2h3O→O2+4H++4e−{\displaystyle {\mathsf {2H_{2}O\rightarrow O_{2}+4H^{+}+4e^{-}}}} 6ClO3−+3h3O→2ClO3−+4Cl−+1,5O2↑+6H++6e−{\displaystyle {\mathsf {6ClO_{3}^{-}+3H_{2}O\rightarrow 2ClO_{3}^{-}+4Cl^{-}+1,5O_{2}\uparrow +6H^{+}+6e^{-}}}}
6ClO3−+3h3O→2ClO3−+4Cl−+1,5O2↑+6H++6e−{\displaystyle {\mathsf {6ClO_{3}^{-}+3H_{2}O\rightarrow 2ClO_{3}^{-}+4Cl^{-}+1,5O_{2}\uparrow +6H^{+}+6e^{-}}}} Катод: 2h3O+2e−→h3↑+2OH−{\displaystyle {\mathsf {2H_{2}O+2e^{-}\rightarrow H_{2}\uparrow +2OH^{-}}}}
Катод: 2h3O+2e−→h3↑+2OH−{\displaystyle {\mathsf {2H_{2}O+2e^{-}\rightarrow H_{2}\uparrow +2OH^{-}}}} — основной процесс ClO−+h3O+2e−→Cl−+2OH−{\displaystyle {\mathsf {ClO^{-}+H_{2}O+2e^{-}\rightarrow Cl^{-}+2OH^{-}}}}
— основной процесс ClO−+h3O+2e−→Cl−+2OH−{\displaystyle {\mathsf {ClO^{-}+H_{2}O+2e^{-}\rightarrow Cl^{-}+2OH^{-}}}} ClO3−+3h3O+6e−→Cl−+6OH−{\displaystyle {\mathsf {ClO_{3}^{-}+3H_{2}O+6e^{-}\rightarrow Cl^{-}+6OH^{-}}}}
ClO3−+3h3O+6e−→Cl−+6OH−{\displaystyle {\mathsf {ClO_{3}^{-}+3H_{2}O+6e^{-}\rightarrow Cl^{-}+6OH^{-}}}}

![{\mathsf {Na^{+}+e^{-}{\xrightarrow[{}]{Hg}}NaHg}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/7d4cdfebd949eaf6330c204730df488a248356b0)
![{\mathsf {2NaHg+2H_{2}O{\xrightarrow[{-Hg}]{}}2NaOH+H_{2}}}](/800/600/https/wikimedia.org/api/rest_v1/media/math/render/svg/b046395d52e14eb5498af5dd14ba7568e1951fbb)

















